ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 4, с. 457-473
ОБЗОРНАЯ СТАТЬЯ
УДК [547’13-126:544.478.34]::(577.11 + 576.3)
МЕТОДЫ ИНКАПСУЛИРОВАНИЯ
БИОМАКРОМОЛЕКУЛ И ЖИВЫХ КЛЕТОК.
ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ
МЕТАЛЛОРГАНИЧЕСКИХ КАРКАСНЫХ ПОЛИМЕРОВ
© 2021 г. А. В. Соколов, Л. В. Лимарева, П. В. Ильясов*,
О. В. Грибкова, А. С. Сустретов
Институт экспериментальной медицины и биотехнологий
ФГБОУ ВО «Самарский государственный медицинский университет» Минздрава России
Россия, 443099 Самара, ул. Чапаевская, 89
*e-mail: p.v.ilyasov@samsmu.ru
Поступила в редакцию 25.12.2020 г.
После доработки 29.12.2020 г.
Принята к публикации 31.12.2020 г.
Обзор посвящен сравнению различных методов инкапсулирования и биоминерализации макромолекул
и живых клеток. Кратко перечислены основные достоинства и недостатки наиболее распространенных
носителей, матриц и материалов, используемых для иммобилизации белков, ферментов, нуклеиновых
кислот, живых клеток. Приведены примеры средств доставки для многофункционального инкапсулиро-
вания веществ белковой природы. Особое внимание уделено перспективам практического применения
металлорганических каркасных полимеров в медицине и биотехнологии.
Ключевые слова: полимерные наночастицы, неорганические наночастицы, металлорганические кар-
касные полимеры, иммобилизация, инкапсулирование, биоминерализация
DOI: 10.31857/S0514749221040017
ВВЕДЕНИЕ
ских компонентов. Наиболее распространенные
среди них - гелевые материалы, мицеллярные,
Иммобилизация биомакромолекул и клеток -
везикулярные и мембранные системы, органиче-
ключевой подход к созданию новых биоматериа-
ские и неорганические полимерные структуры, а
лов, катализаторов, лекарственных средств и кон-
также металлорганические каркасные полимеры
струированию биопроцессов. Существует множе-
(МОКП) (рис. 1). Каждый из носителей имеет свои
ство типов иммобилизации, наиболее перспектив-
структурные и функциональные особенности,
ными из которых при использовании в биомедицин-
преимущества и недостатки, их выбор в каждом
ских целях выступают инкапсулирование и био-
конкретном случае основывается на целях иссле-
минерализация, поскольку они обеспечивают защи-
дования, особенностях носителя, иммобилизуемо-
ту от факторов окружающей среды, стабилизацию и
го компонента и предпочтениях исследователя.
контролируемое высвобождение содержимого.
ИНКАПСУЛИРОВАНИЕ БЕЛКОВ
На данный момент разработано большое коли-
чество носителей, матриц и материалов для ин-
В настоящее время масштабное применение
капсулирования и биоминерализации биологиче-
в медицине, пищевой промышленности, биотех-
457
458
СОКОЛОВ и др.
нологии получили биологически активные веще-
форме и заряду частиц, особенно при необходимо-
ства и лекарственные средства белковой приро-
сти обеспечения контролируемого высвобождения
ды - гормоны, антиоксиданты, ферменты, инги-
инкапсулированного вещества. В частности, такое
биторы ферментов, вакцины, противоопухолевые
ограничение применения неорганических носите-
препараты и др. Вместе с тем, их использование
лей, как небольшой размер пор, приводит к воз-
сопряжено с рядом ограничений, основные из ко-
можности захвата молекул только определенной
торых - высокая чувствительность белков и ле-
величины [21, 22]. Кроме того, в ряде случаев име-
карственных препаратов к денатурации, агрега-
ет место плохая воспроизводимость микросфер, а
ции или гидролизу в желудочно-кишечном тракте
также дезактивация белка во время приготовления,
(ЖКТ) человека; нежелательные взаимодействия
хранения и высвобождения из созданных частиц.
компонентов лекарственного средства друг с дру-
Во избежание проявлений токсичности и нежела-
гом или с другими лекарственными препаратами;
тельного взаимодействия компонентов полученно-
плохое всасывание белка в ЖКТ; гидрофобность;
го препарата необходимо тщательно подбирать ин-
нестабильность и деградация при хранении; ток-
гредиенты инкапсулирующих систем. Основные
сичность; иммуногенность чужеродных белковых
ограничения успешного применения липосом на
компонентов [1-5]. Один из подходов к преодоле-
практике - потенциальные цитотоксические эф-
нию этих ограничений - инкапсулирование белков
фекты липосом, токсичность заряженных липосом
с использованием носителей, обладающих соот-
[23, 24], их негерметичность, вероятность присут-
ветствующими свойствами [1, 6-11]. Так, в каче-
ствия органических растворителей (этанол, эфир)
стве коллоидных систем доставки, пригодных для
в следовых количествах в конечном препарате
инкапсулирования белков, используют межфаз-
[25], недостаточная воспроизводимость от партии
ные системы, например, микроэмульсии, эмуль-
к партии, низкая сорбируемость полезной нагруз-
сии, мицеллы, твердые липидные наночастицы,
ки [26], отсутствие эффективных методов стери-
липосомы, полимерсомы, золь-гели и гидрогели
лизации [27-29], проблемы стабильности [30-32]
(рис. 1) [3, 12, 13]. Активно применяют неорга-
и масштабирования. Другие недостатки исполь-
нические мезопористые частицы (наночастицы
зования межфазных везикулярных систем, в том
диоксида кремния, гидроксиапатит, фосфаты каль-
числе липосом, а также твердых липидных ча-
ция и др.) и частицы на полимерной основе, в том
стиц - их высокая стоимость, трудоемкость полу-
числе белковой природы [14-19]. Так, инсулин
чения, подверженность деградации при хранении,
инкапсулировали [20] в нано- и микрочастицы с
необходимость контроля состояния агрегации кол-
помощью хитозанов и пектина, что позволило от-
лоидных частиц. До настоящего времени не решены
казаться от инъекций гормона и разработать пре-
проблемы, связанные с ограничениями объема ле-
параты для перорального применения. Достаточно
карственной нагрузки мицеллярных систем и ста-
широко в этих целях используют липосомальные
бильностью рецептур в их составе [2, 5, 10, 26, 33].
формы лекарственных средств и антигенов, что
Решением вышеуказанных проблем во мно-
позволяет преодолевать проблемы биосовмести-
гих случаях служит использование в качестве ин-
мости, осуществлять адресную доставку содер-
капсулирующей матрицы МОКП, отличающихся
жимого, его защиту от нежелательных иммунных
ригидностью структуры, фиксирующей белок, что
факторов. Липосомы применяют для конструиро-
препятствует его денатурации или разрушению.
вания вакцин, обеспечивая индукцию антител и
Продемонстрировано [34], что инсулин, инкапсу-
Т-клеточных реакций на ассоциированные субъе-
лированный в мезопористый МОКП на основе
диницы антигенов [8].
циркония NU-1000, остается стабильным к дей-
ствию желудочного сока и не разрушается пепси-
Вместе с тем существуют определенные не-
ном, но распадается в фосфатном буфере, имити-
достатки описанных технологий инкапсулиро-
рующем физиологические условия в тканях, что
вания биологически активных веществ белковой
позволяет контролировать его высвобождение.
природы, которые необходимо учитывать при их
практической реализации. Ряд из них связан с не-
Композиционный материал выдерживает на-
обходимостью стандартизации матриц по размеру,
грев выше 50°С, обеспечивая интактность струк-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
МЕТОДЫ ИНКАПСУ
ЛИРОВАНИЯ БИОМАКРОМОЛЕКУЛ И ЖИВЫХ КЛЕТОК
459
Липосомы
Полимерсомы
Мицеллы
Биомолекулы
Клетки
Органические
Неорганические
гидрогели и матрицы
носители
Металлорганические
каркасные полимеры
Рис. 1. Носители и матрицы для инкапсулирования и биоминерализации биологических компонентов
туры инсулина. Полученные результаты могут
МОКП для доставки в клеточные структуры одно-
быть использованы для разработки альтернативы
го или нескольких белков. Получаемые гибридные
материалы обеспечивают интактность белковых
инсулиновым помпам, а также новых лекарствен-
молекул в течение нескольких месяцев хранения.
ных форм доставки инсулина.
Представлен [35] метод биомиметической мине-
Для разработки новых подходов к лечению но-
рализации белка, сохраняющий активность белка
вообразований были созданы биомиметические
и защищающий содержимое МОКП от фермент-
методы инкапсулирования белков в наночастицы
но-опосредованной деградации. Более того, про-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
460
СОКОЛОВ и др.
демонстрировано, что спроектированная платфор-
ванной l-аспарагиназы. Инкапсулирование повы-
ма позволяет легко инкапсулировать несколько
шала протеолитическую стабильность фермента и
белков в одиночные наночастицы для их совмест-
ослабляла его распознавание антителами, что сни-
ной доставки.
жало потенциальную частоту введения препарата
Инкапсулирование гемоглобина в МОКП ZIF-
и риск индукции иммунного ответа [40].
8, имеющий цеолитоподобную структуру, значи-
Предложен способ инкапсулирования белков
тельно увеличивает стабильность при сохранении
на основе последовательного многослойного по-
способности инкапсулированного гемоглобина
крытия полимерами кристаллов белка на примере
переносить кислород in vivo с эффективностью
каталазы. Продемонстрирована методическая про-
80-90% относительно нативного гемоглобина.
стота данного подхода и устойчивость полученно-
В экспериментах на мышах показано, что полу-
го покрытия к действию протеаз [44].
ченный композит не иммуногенен, его поверх-
Включение в липосомы ацетилхолинэстеразы
ностный заряд близок нулю, что предотвращает
и ряда других ферментов позволяет стабилизиро-
адсорбцию белков на поверхности. Наночастицы
вать и защитить их от действия протеаз [45]. Было
композитного материала примерно в 3 раза мед-
рассмотрено [37] получение и применение липо-
леннее поглощаются макрофагами и не приводят к
сом для инкапсулирования различных фермен-
изменению активности ферментов крови. Период
тов в пищевой промышленности. Современные
полувыведения составляет 14 ч, причем цитоток-
технологии позволяют объединить одновременно
сичность композита ниже, чем отдельно взятого
на одном носителе несколько биологически ак-
МОКП. При этом композит разрушается при рН
тивных веществ в мультиферментные комплексы.
5.0 в клеточных лизосомах, что снижает риск на-
Так, описаны [47] полимерсомы с иерархической
копления наночастиц in vivo. Испытания показали,
иммобилизацией 3 ферментов (глюкозооксидазы,
что введение препарата значительно повышает
липазы и пероксидазы хрена) в качестве наноре-
выживаемость мышей после индукции геморраги-
акторов.
ческого шока [36].
Ограничения и проблемы применения инкапсу-
Важная роль в области медицинской, пище-
лирования ферментов определяются структурой
вой промышленности и биотехнологии отводит-
носителей и, соответственно, модификация струк-
ся биокатализаторам, в том числе ферментам [37,
туры носителя зачастую позволяет преодолеть эти
38]. Для биотехнологического применения особое
ограничения. Например, для усиления способно-
значение имеет повышение стабильности и эффек-
сти полимерсомы удерживать и защищать свой
тивности ферментов, а также возможность их мно-
груз сшивают ее мембраны с помощью специаль-
гократного использования при биокатализе, био-
ных соединений и гидрофобных первичных ами-
трансформации, получении различных продуктов
нов [41, 48]. Для повышения стабильности липо-
и др. Этих целей можно достичьза счет различных
сом в их слои вводят различные липиды и белки
носителей: дендримеров и дендрисом, мицелл, ли-
посом, полимерных везикул (полимерсом), эмуль-
[45]. Кроме этого, общая проблема для инкапсу-
лирования ферментов в полимерные капсулы -
сий, неорганических мезопористых наночастиц
нежелательная десорбция биологически актив-
диоксида кремния, гидроксиапатита и др. [21, 22,
39-41], а также МОКП [42]. Инкапсулирование
ных веществ в процессе хранения и доставки [49].
ферментов, как один из вариантов иммобилиза-
Альтернативный метод стабилизации ферментов
ции, позволяет защищать их от действия агрессив-
при сохранении их каталитических свойств - их
инкапсулирование в МОКП (рис. 2, а).
ных сред, сохранять каталитическую активность,
доставлять в организм в терапевтических целях,
Показано [50], что МОКП MIL-100(Fe) можно
снижать риск аллергической реакции, объединять
использовать для инкапсулирования панкреатиче-
биологически активные вещества в мультифер-
ской липазы в качестве многоразового катализато-
ментные комплексы - нанореакторы [40, 43-47].
ра. При этом катализатор сохраняет свою актив-
В частности, было продемонстрировано эффек-
ность в течение 8 циклов применения, нечувстви-
тивное противоопухолевое действие инкапсулиро-
телен к изменению кислотности среды в диапазо-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
МЕТОДЫ ИНКАПСУ
ЛИРОВАНИЯ БИОМАКРОМОЛЕКУЛ И ЖИВЫХ КЛЕТОК
461
(a)
(b)
(c)
Рис. 2. Инкапсулирование в кристалл МОКП: (a) молекулы фермента, (b) плазмидной ДНК, (c) целой клетки
не рН 3.0-9.0 и сохраняет свою каталитическую
качестве генетических векторов обычно исполь-
активность при 70°С. Также была продемонстри-
зуют вирусные, плазмидные и другие конструкты
рована высокая ёмкость полукристаллического
на основе нуклеотидных последовательностей.
MIL-100(Fe) в отношении липазы и лактазы и по-
Такие векторы могут быть специфичными и/или
казано, что в ходе технологического процесса те-
неспецифичными к клеткам-мишеням опреде-
ряется не более 10% молекул фермента [51].
ленного типа, способны встраиваться в геном,
обеспечивать конститутивную или индуцибель-
Успешно применены цеолитоподобные ими-
ную экспрессию трансгена, подменяющего или
дазолатные каркасные полимеры (ZIF), отличаю-
компенсирующего дефектные или нежелательные
щиеся от других МОКП возможностью синтеза в
гены хозяина, нести или не нести репликативные
физиологических условиях, для инкапсулирова-
механизмы в зависимости от своего назначения.
ния нестабильных ферментов, например, перок-
В последнее время растет интерес к технологиям
сидазы, уреазы, алкогольдегидрогеназы и глю-
РНК-интерференции, а также методам редактиро-
козооксидазы
[52-54]. Получаемые структуры
вания генома на основе систем CRISPR/Cas и их
«ZIF-фермент» отличаются высокой резистент-
аналогов, открывающим широкие перспективы
ностью по отношению к денатурирующим рас-
для генной терапии. Общий недостаток подобных
творителям, например, ДМСО, ДМФА, спиртам
структур - их иммуногенность, а также ряд огра-
[55]. Интересен пример образования композита
ничений при адресной доставке и трансформации
«фермент-МОКП» [56], в котором используется
клеток-мишеней in vivo, связанных, в частности,
органический каркасный полимер, образованный
с необходимостью защиты векторов от иммунной
водородными связями (так называемый hydrogen-
системы и нуклеаз. Одним из методов преодоле-
bonded organic framework, HOF), не имеющий ци-
ния этих ограничений выступает инкапсулирова-
тотоксических свойств и обладающий большими
ние трансгенов в носители различной природы в
апертурами пор. Однако в процессе дизайна ин-
составе векторов или без них; в последнем случае
капсулированных ферментов подобной структуры
функции вектора, т.е. доставку трансгена в клетку
необходимо учитывать, что в ряде случаев и сам
и обеспечение его функционирования в ней, вы-
МОКП на основе переходных металлов может ока-
полняет носитель (рис. 2, b).
зывать каталитическое действие [57, 58].
Для инкапсулирования нуклеиновых кислот
ИНКАПСУЛИРОВАНИЕ НУКЛЕИНОВЫХ
практически не используются полимерные матри-
КИСЛОТ
цы и мицеллярные структуры ввиду сложностей с
Конструирование векторов - важнейшая ста-
трансформацией подобных векторов. В последнее
дия в процессах генной инженерии и терапии. В
время появились публикации, посвященные при-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
462
СОКОЛОВ и др.
менению МОКП в качестве абиогенного аналога
включающих, помимо возможности снижения
генетических векторов вследствие возможности
расхода биоматериала, его защиты от агрессивных
их эндоцитоза. Благодаря наличию развитой си-
условий среды, контролируемого высвобождения,
стемы водородных связей в структуре нуклеи-
многократного использования иммобилизованных
новых кислот и сопоставимых диаметров пор в
агентов, также формирование пространственных
МОКП, процесс инкапсулирования может проте-
структур, имитирующих ткани организма, био-
кать как в виде биоминерализации, так и в виде
пленки и т.д. Применение ряда гелей и полимеров
обратимых процессов адсорбции нуклеиновых
позволяет оптимизировать состояние клеток и тем
кислот в порах МОКП [53, 59]. В последнем слу-
самым способствовать их стабильности или моду-
чае процессами контролируемого высвобождения
лировать их активность [64]. Все это обеспечивает
и поглощения нуклеиновых кислот можно управ-
эффективность использования иммобилизован-
лять посредством изменения свойств носителя без
ных биокомпонентов при культивировании клеток
его разрушения, что позволяет реализовать управ-
[65], производстве биотоплива [66], биотрансфор-
ляемую платформу для генетических манипуля-
мации различных соединений и других биотехно-
ций. Такой подход был продемонстрирован [60] на
логических процессах, связанных с биокатализом,
примере МОКП изоретикулярного ряда на основе
в частности, при ремедиации окружающей среды
никеля Ni-IRMOF-74, где была подобрана точно
[67], при терапевтическом применении, например,
контролируемая апертура пор для обратимого вза-
для заживления ран [68, 69], а также в биоанали-
имодействия с одноцепочечной ДНК и выполне-
тических целях, в том числе в составе рецепторов
на успешная трансфекция первичных иммунных
биосенсоров.
клеток мыши (CD4+ T-клеток, с эффективностью
Перспективным подходом выступает возмож-
92%) и иммунных клеток человека (клеток THP-1,
ность формирования структур, аналогичных био-
с эффективностью 30%). Другой МОКП, а именно
логическим мембранам, органам и тканям [70], с
ZIF-8, был использован в качестве трансфекцион-
целью их использования в качестве имплантатов
ного носителя для клеток-предшественников из
или в тканевой инженерии [71-73]. Выбор мето-
островков Лангерганса [61]. Была показана малая
да и носителя осуществляют, исходя из критериев
токсичность и простота использования подобного
стабильности биоматериала и его активности, в
носителя. Использованы [62] нанокомпозиты на
том числе с учетом диффузионных свойств носи-
основе циркониевого МОКП NU-1000 с малой ин-
теля. В подавляющем большинстве случаев иммо-
терферирующей РНК для нокдауна гена на приме-
билизацию клеток выполняют методом адсорбции
ре линии клеток HEK293.
либо включения в гелевые и полимерные матри-
Помимо интерферирующих нуклеиновых кис-
цы. Ковалентное связывание бифункциональ-
лот и других олигонуклеотидов, удалось [63] ин-
ными агентами используют относительно редко
капсулировать в МОКП ZIF-8 плазмидную ДНК,
ввиду токсичности этого метода для клеток [74,
кодирующую продукцию флуоресцентного белка
75]. В качестве носителя для адсорбции исполь-
plGFP, и успешно провести трансфекцию культуры
зуют различные мембраны [76-82], фильтроваль-
клеток РС-3 полученным материалом. Отмечено,
ную бумагу [83, 84], углеродные материалы [85]
что вследствие медленного высвобождения и экс-
и т.п. Одно из главных преимуществ адсорбции -
прессии чужеродной ДНК, а также наличия ста-
техническая простота метода. Кроме того, адсор-
билизирующих свойств МОКП цитотоксичность
бция - «мягкий» метод иммобилизации, при кото-
этого способа трансфекции значительно ниже, чем
ром повреждающее воздействие на клетки обычно
аналогов.
минимально [86]. Стабильность показаний при
использовании сорбированных клеток и фермен-
ИНКАПСУЛИРОВАНИЕ КЛЕТОК
тов обычно достаточно велика. В ряде публикаций
И МИКРООРГАНИЗМОВ
отмечена работа ферментов и клеток без потери
Инкапсулирование и биоминерализация кле-
активности в течение нескольких недель и даже
ток широко используются в различных областях
месяцев [80, 87, 88]. Все перечисленные факторы
биотехнологии и обеспечивают ряд преимуществ,
делают адсорбцию одним из наиболее предпочти-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
МЕТОДЫ ИНКАПСУ
ЛИРОВАНИЯ БИОМАКРОМОЛЕКУЛ И ЖИВЫХ КЛЕТОК
463
тельных методических приемов. Иммобилизация
в ряде случаев приводящие к кажущемуся сниже-
клеток в составе структур МОКП также может
нию скорости биокатализа и активности биоком-
производиться посредством адсорбции, ковалент-
понентов.
ного связывания клеток на поверхности МОКП,
Применение МОКП в качестве инкапсулирую-
включения их в поры носителя, соосаждения и
щих матриц приводит к образованию кристалли-
синтеза in situ [89].
ческих внеклеточных структур, схожих со струк-
Включение в гель используется в биотехно-
турами, возникающими при минерализации не-
логии приблизительно так же часто, как и адсор-
органическими солями. Однако в данном случае
бция, и практически незаменимо в случае слабо-
внеклеточная структура обладает упорядоченным
го удерживания микроорганизмов на носителе.
строением пор и селективной проницаемостью по
Преимущество включения в гелевые или поли-
отношению к ионам и низкомолекулярным соеди-
мерные матрицы в общем случае - более высокая,
нениям, что оказывает специфическое влияние на
по сравнению с адсорбцией, стабильность кле-
жизненный цикл и работу клеток (рис. 2, c).
ток [90]. Кроме того, известно, что в ряде случа-
В качестве тестовых объектов [138] использо-
ев полисахаридные гели (в частности, агаровый)
снижают токсическое воздействие ароматических
вали Saccharomyces cerevisiae и Micrococcus luteus,
соединений на клетки [91], что выступает важ-
биоминерализация которых МОКП ZIF-8 показа-
ным критерием для применения. Широко исполь-
ла практически 90% выживаемость в присутствии
зуются агаровый [92], кальций-альгинатный [74,
литиказы и под влиянием антибиотиков, что де-
93-95], каррагинановый [96], желатиновый и кол-
монстрирует гомогенность покрытия в отношении
лагеновый гели [97-99] и поливиниловый спирт
как биомакромолекул, так и относительно низ-
(ПВС) [100-102]. Хотя полимеризация этих носи-
комолекулярных соединений. Кроме этого, было
телей происходит в стрессовых условиях (высокая
показано, что биоминерализация приводит к ги-
температура либо ионная сила среды, либо УФ-
бернации клеток, которой можно управлять, вводя
облучение), они обеспечивают высокую стабиль-
соединение, лизирующее экзоцитоскелет (напри-
ность и воспроизводимость работы биоматериала.
мер, ЭДТА). При иммобилизации на поверхности
Достаточно часто используется полиакриламид-
цитоэкзоскелета нехарактерного для S. сerevisiae
ный гель [103], несмотря на его токсичность. В
фермента β-галактозидазы, способной расщеплять
числе носителей также следует упомянуть кри-
лактозу на естественные нутриенты, наблюдает-
огели на основе ПВС [104, 105] и фотосшитые
ся их усваивание через поры МОКП ZIF-8 и, как
полимеры типа ENT/ENTP (полимерная смесь на
следствие, выживаемость и адаптация к олиготро-
основе полиэтилен- или полипропиленгликоля,
фным условиям [139].
гидроксиэтилакрилата и изофорон-диизоцианата,
При помощи биоминерализации мономоле-
полимеризующаяся в ближнем диапазоне УФ-
кулярным слоем МОКП на основе циркония и
излучения) или модифицированного ПВС [106],
1,3,5-трис(4-карбоксифенил)бензола анаэробной
гранулы и пленки на основе поливинилхлорида
бактерии Moorella thermoacetica удалось значи-
[107], гидрогели хитозана [108-110], поликарба-
тельно повысить ее выживаемость в аэробных ус-
моилсульфоната [111, 112] и полиуретана [113,
ловиях. В данном случае цитопротекция обеспечи-
114], пептидные полимеры [115], биотин-авидино-
вые линкеры [116-118], золь-гелевые матрицы на
валась не только изоляцией клетки от окружающей
основе оксида алюминия [119] или композитных
среды, но и каталитическим действием МОКП,
полимеров [120-123], а также электрополимеризу-
разрушающим активные формы кислорода за счет
ющиеся пленки полианилина [124-127] и других
ненасыщенных координационных положений цир-
соединений [128, 129], и наноструктурные мате-
кониевых оксокластеров. Интересным фактом ока-
риалы (включая углеродные нанотрубки и нано-
залась способность бактерий, покрытых МОКП, к
частицы металлов) [130-137]. Общий недостаток
размножению, что обеспечивалось эластичностью
включения в гели и полимеры - диффузионные
цитопротекторного слоя, не препятствующего де-
ограничения, накладываемые природой носителя,
лению [140].
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
464
СОКОЛОВ и др.
Биоминерализация клеточных структур может
лей на основе микроячеистых структур, содержа-
нести функции, обратные защитным. Так, с помо-
щих клетки микроорганизмов [152]. Такие матри-
щью композиционных материалов, включающих
цы востребованы в области клеточной биологии,
порфиринсодержащие МОКП, генерирующие
иммунологии и разработки лекарственных препа-
синглетный кислород, осуществляли эффектив-
ратов. Кроме органических структур, для инкапсу-
ную фотодинамическую абляцию бактериальных
лирования разнородных молекул могут исполь-
биопленок [141], что может найти применение как
зоваться МОКП. Например, одновременная им-
в медицинских, так и в биотехнологических при-
мобилизация никель-палладиевых наночастиц и
кладных аспектах.
глюкозооксидазы в ZIF-8 приводит к образованию
самоорганизующихся кристаллических структур,
Помимо клеточных структур, биоминерали-
обладающих ферментативными свойствами. На их
зации можно подвергать фрагменты клеток и ви-
основе были разработаны сенсоры глюкозы [153].
русных частиц, используемые в качестве вакцин,
При замене никель-палладиевых наночастиц на-
что повышает их стабильность и регулирует им-
ночастицами Fe3O4 композит становится магнито-
мунологическую реактивность за счет посте-
восприимчивым [154], что может быть использо-
пенного высвобождения антигенов
[142-144].
вано для создания управляемых биокатализаторов.
Бактериальные клеточные мембраны можно при-
менять в качестве каркаса для МОКП в целях соз-
Описаны дизайн и синтез МОКП в качестве
дания микрокапсул с селективным высвобожде-
носителей одновременно нескольких ферментов
нием содержимого [145]. В ряде случаев МОКП
для биомедицинского применения [155]. Показано
может нести отдельную защитную функцию, на-
[156], что цирконийсодержащий МОКП UiO-66
пример, аналогичную белкам-антифризам, пре-
может одновременно абсорбировать глюкозоокси-
дотвращающим рост кристаллов льда, что может
дазу и пероксидазу. Получаемый биокатализатор
быть использовано для криоконсервирования эри-
обладает более высокой активностью по сравне-
троцитов [36].
нию с несорбированными ферментами, однако
из-за равновесного характера адсорбции носи-
МНОГОФУНКЦИОНАЛЬНОЕ
ИНКАПСУЛИРОВАНИЕ
тель теряет ферменты в течение нескольких дней.
Использование ферментов, включенных в поры
Разработка высокоэффективных лекарствен-
МОКП для реализации мультиферментных каскад-
ных средств для осуществления полимодальной
ных реакций, было продемонстрировано [157] на
терапии онкологических и инфекционных забо-
примере конверсии углекислого газа в формиат-
леваний требует одновременной доставки или
анион посредством технологии на основе слоистой
последовательного высвобождения биомолекул.
структуры, состоящей из МОКП MIL-101(Cr) и
Для решения подобных задач применяется автома-
HKUST-1 с иммобилизованными карбоангидра-
тизированное формирование сложных структур с
зой, формиат- и глутаматдегидрогеназой. Данная
высоким пространственным разрешением, содер-
работа - важное свидетельство возможности раз-
жащих иммобилизованные клетки и ферменты.
работки биомиметических методов удаления пар-
Так, использована [146] струйная печать для соз-
никовых газов.
дания матриц высокой плотности с включенными
клетками бактерий. Аналогичный подход связан
Наличие каталитически активных металлоцен-
также с применением струйной печати [147]. При
тров в структуре МОКП, образующихся из-за ло-
этом клетки, конъюгированные с одноцепочечной
кальных дефектов и нарушений кристаллической
ДНК, иммобилизовали на поверхности, модифи-
решетки вкупе с эффектом молекулярного распоз-
цированной комплементарной ДНК. Этот подход
навания, обусловленным строго упорядоченной
использовался ранее в отношении ферментов,
формой и интерьером пор, а также высокой пло-
ДНК и антител [148-151], однако его применение
щадью поверхности, в ряде случаев приводит к по-
в сочетании с целыми клетками встречается редко.
явлению каталитической активности носителя, по-
Кроме того, описано использование сканирующей
добной активности нативных ферментов [158]. На
зондовой литографии для формирования носите-
данный момент охарактеризованы структуры, об-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
МЕТОДЫ ИНКАПСУ
ЛИРОВАНИЯ БИОМАКРОМОЛЕКУЛ И ЖИВЫХ КЛЕТОК
465
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
466
СОКОЛОВ и др.
ладающие каталазной [159], пероксидазной [160,
ческих условиях, либо обладают малой емкостью.
161], лакказной
[162] активностью. Подобные
В этом отношении применение МОКП в качестве
МОКП со временем могут быть использованы в
инкапсулирующих агентов позволяет удовлетво-
качестве аналогов ферментных меток для разра-
рить большинство из вышеуказанных требований.
ботки тест-систем для иммуноферментного и им-
Это связано с тем, что МОКП характеризуются
мунохроматографического анализа.
высокой емкостью, устойчивостью к высушива-
нию, денатурирующим средствам, а также воз-
Возможность
инкапсулирования
ДНК-
можностью придания контролируемых свойств,
ферментов совместно с низкомолекулярными со-
гибкостью создания и широким разнообразием по-
единениями продемонстрирована [163] на при-
тенциально реализуемых топологий. Наличие упо-
мере синтеза наночастиц МОКП ZIF-8, включа-
рядоченной системы пор в МОКП, проницаемых
ющих молекулы ДНК и фотосенсибилизатора.
для определённых молекул, термической стабиль-
Обнаружено, что получаемый наноматериал, не
ности и возможности селективной деградации но-
подвергаясь деградации, эффективно проникает
сителя, основанной на различии физиологических
через мембрану опухолевых клеток у самок бе-
условий во внутри- и внеклеточном пространстве,
стимусных мышей BALB/c - носителей опухолей
позволяет реализовать новые биотехнологиче-
MCF-7 и позволяет реализовать одновременно
ские процессы и создавать медицинские компо-
фотодинамическую и генную противоопухолевую
зиционные материалы с заданными свойствами.
терапию.
Таким образом, использование МОКП в качестве
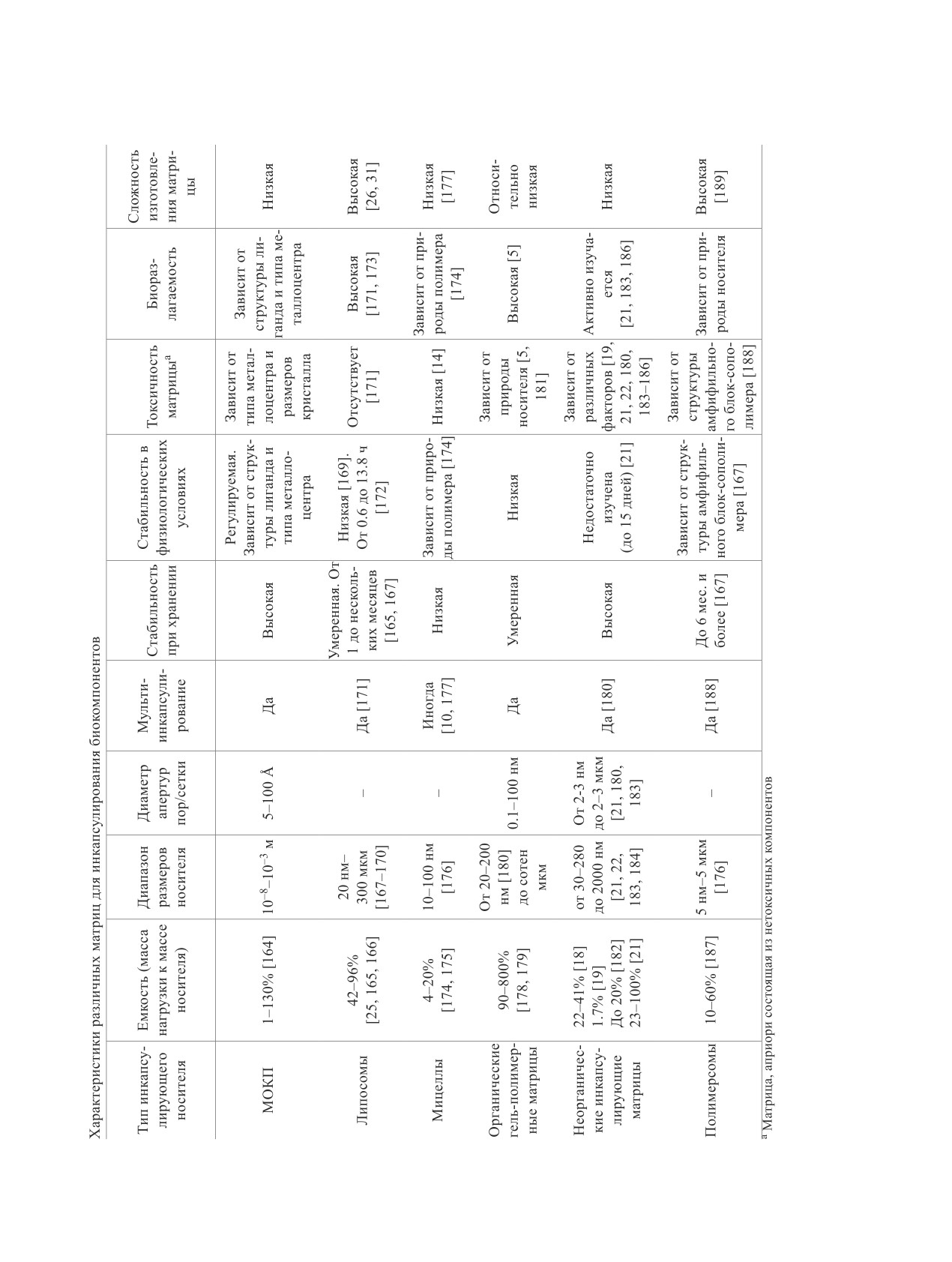
Краткие характеристики, преимущества и не-
носителей и минерализаторов для биомакромоле-
достатки различных носителей для инкапсулиро-
кул и живых клеток - динамично развивающееся
вания биокомпонентов представлены в таблице.
направление, имеющее безусловные перспективы
Все вышеперечисленные аспекты обуславли-
практического применения, включая доставку ле-
вают перспективность инкапсулирования и био-
карственных средств, разработку биокатализато-
минерализации для разработки биоматериалов с
ров для биотехнологических целей, формирование
контролируемыми и управляемыми параметрами.
клеточных структур для регенерации тканей. На
Такие материалы могут найти самое широкое при-
данный момент применение МОКП ограничива-
менение в различных областях биотехнологии и
ется небольшим разнообразием биосовместимых
медицины.
органических лигандов и токсичностью металло-
центров, нехваткой информации о потенциальном
ВЫВОДЫ
использовании ранее не применяемых металлов и
Инкаспулирование - один из наиболее распро-
лигандов. Однако значительный рост числа иссле-
страненных методов стабилизации биомакромо-
дований, посвященных изучению свойств МОКП,
лекул и живых клеток. Ввиду широкой области
и небольшой промежуток времени от начала их
применения и перечня медицинских и биотехно-
открытия даёт основания полагать, что в течение
логических задач для инкапсулирования использу-
короткого времени будут разработаны новые те-
ют практически весь спектр биосовместимых или
рапевтические средства и методы, лекарственные
нетоксичных материалов, образующих структури-
формы, высокоэффективные биокатализаторы.
рованные объекты. Общее требование к инкапсу-
КОНФЛИКТ ИНТЕРЕСОВ
лирующим агентам - стабильность содержимо-
го к воздействию внешней среды, неизменность
Авторы заявляют об отсутствии конфликта ин-
структуры и состава во времени, высокая нагру-
тересов.
зочная способность, биоразлагаемость. Однако в
СПИСОК ЛИТЕРАТУРЫ
большинстве случаев одновременное обеспечение
перечисленных свойств затруднено, поскольку
1. Ye C., Chi H. Materials Sci. Eng: C. 2018, 83, 233-
органические коллоидные структуры термодина-
246. doi 10.1016/j.msec.2017.10.003
мически нестабильны, а неорганические матрицы
2. Perry S.L., McClements D.J. Molecules. 2020, 25,
либо трудно поддаются разложению в физиологи-
1161. doi 10.3390/molecules25051161
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
МЕТОДЫ ИНКАПСУ
ЛИРОВАНИЯ БИОМАКРОМОЛЕКУЛ И ЖИВЫХ КЛЕТОК
467
3.
Pérez-Luna V.H., González-Reynoso O. Gels. 2018, 4,
22.
Engineering of Nanobiomaterials. Applications of
61. doi 10.3390/gels4030061
Nanobiomaterials. Ed. A. Grumezescu. Amsterdam,
Boston, Heidelberg, London, New York, Oxford, Paris,
4.
Henriksen P.A. Heart. 2018, 104, 971. doi 10.1136/
San Diego, San Francisco, Singapore, Sydney, Tokyo:
heartjnl-2017-312103
Elsevier Inc. 2016, 2, 564.
5.
Sikder S., Gote V., Alshamrani M., Sicotte J., Pal D.
23.
Smistad G., Jacobsen J., Sande S.A. Int. J. Pharm.
Expert Opin. Drug Deliv. 2019, 16, 1113-1131. doi
2007, 330, 14-22. doi 10.1016/j.ijpharm.2006.08.044
10.1080/17425247.2019.1662785
24.
Dokka S., Toledo D., Shi X., Castranova V.,
6.
McClements D.J. Adv. Colloid Interface Sci. 2018, 253,
Rojanasakul Y. Pharm. Res. 2000, 17, 521-525. doi
1-22. doi 10.1016/j.cis.2018.02.002
10.1023/A:1007504613351
7.
Richard-Carpentier G., DiNardo C.D. Hematology.
25.
Dos Santos N., Cox K.A., McKenzie C.A., van Baar-
2019,
2019,
548-556.
doi
10.1182/
da F., Gallagher R.C., Karlsson G., Edwards K.,
hematology.2019000059
Mayer L.D., Allen C., Bally M.B. Biochim.
8.
Watson D.S., Endsley A.N., Huang L. Vaccine. 2012,
Biophys. Acta.
2004,
1661,
47-60. doi
10.1016/
30, 2256-2272. doi 10.1016/j.vaccine.2012.01.070
j.bbamem.2003.11.016
9.
Schwendener R.A. Ther. Adv. Vaccines Immunother.
26.
Pattni B.S., Chupin V.V., Torchilin V.P. Chem. Rev.
2014, 2, 159-182. doi 10.1177/2051013614541440
2015,
115,
10938-10966. doi
10.1021/acs.
10.
Zhang Y., Huang Y., Li S. AAPS PharmSciTech. 2014,
chemrev.5b00046
15, 862-871. doi 10.1208/s12249-014-0113-z
27.
Toh M.-R., Chiu G.N.C. Asian J. Pharm. Sci. 2013,
11.
Gupta S., Kaushal A., Kumar A., Kumar D. Int.
8, 88-95. doi 10.1016/j.ajps.2013.07.011
J. Biol. Macromol. 2017, 105, 905-911. doi 10.1016/
28.
Shadyro O.I., Yurkova I.L., Kisel M.A. Int. J. Radiat.
j.ijbiomac.2017.07.126
Biol.
2002,
78,
211-217. doi
10.1080/
12.
Xiaolin W., Nada Ben A., Gisela S.A., Maria V.T.,
09553000110104065
Christophe H., Martin F.D., Thibaud C. Curr. Topics
29.
Mohammed A.R., Bramwell V.W., Coombes A.G.A.,
Med. Chem. 2015, 15, 223-244. doi 10.2174/15680266
Perrie Y. Methods. 2006, 40, 30-38. doi 10.1016/
14666141229112734
j.ymeth.2006.05.025
13.
Venditti I. J. King Saud Univer. Sci. 2019, 31, 398-
30.
Stark B., Pabst G., Prassl R. Eur. J. Pharm. Sci. 2010,
411. doi 10.1016/j.jksus.2017.10.004
41, 546-555. doi 10.1016/j.ejps.2010.08.010
14.
Akash M.S., Rehman K., Chen S. Pharm. Dev. Technol.
31.
Edwards K.A., Baeumner A.J. Talanta. 2006, 68,
2016, 21, 367-378. doi 10.3109/10837450.2014.999785
1432-1441. doi 10.1016/j.talanta.2005.08.031
15.
Liu H., Cui Y., Li P., Zhou Y., Chen Y., Tang Y.,
32.
Glavas-Dodov M., Fredro-Kumbaradzi E., Goracino-
Lu T. Anal. Chim. Acta. 2013, 776, 24-30. doi
va K., Simonoska M., Calis S., Trajkovic-Jolevs-
10.1016/j.aca.2013.03.040
ka S., Hincal A.A. Int. J. Pharm. 2005, 291, 79-86. doi
16.
Tarhini M., Greige-Gerges H., Elaissari A. Int.
10.1016/j.ijpharm.2004.07.045
J. Pharm.
2017,
522,
172-197. doi
10.1016/
33.
Ma G. J. Control. Rel. 2014, 193, 324-340. doi
j.ijpharm.2017.01.067
10.1016/j.jconrel.2014.09.003
17.
Truffi M., Fiandra L., Sorrentino L., Monieri M.,
34.
Chen Y., Li P., Modica J.A., Drout R.J., Farha O.K.
Corsi F., Mazzucchelli S. Pharmacol. Res. 2016, 107,
J. Am. Chem. Soc. 2018, 140, 5678-5681. doi 10.1021/
57-65. doi 10.1016/j.phrs.2016.03.002
jacs.8b02089
18.
Andersson J., Rosenholm J., Areva S., Lindén M. Chem.
35.
Chen T.-T., Yi J.-T., Zhao Y.-Y., Chu X. J. Am. Chem.
Mater. 2004, 16, 4160-4167. doi 10.1021/cm0401490
Soc. 2018, 140, 9912-9920. doi 10.1021/jacs.8b04457
19.
Meng H., Xue M., Xia T., Zhao Y.-L., Tamanoi F.,
36.
Peng S., Liu J., Qin Y., Wang H., Cao B., Lu L., Yu X.
Stoddart J.F., Zink J.I., Nel A.E. J. Am. Chem. Soc.
ACS Appl. Mater. Interfaces. 2019, 11, 35604-35612.
2010, 132, 12690-12697. doi 10.1021/ja104501a
doi 10.1021/acsami.9b15037
20.
Maciel V.B.V., Yoshida C.M.P., Pereira S.M.S.S.,
37.
Mohammadi A., Jafari S.M., Mahoonak A.S., Ghorba-
Goycoolea F.M., Franco T.T. Molecules. 2017, 22,
ni M. Food Bioprocess Technol. 2020. doi 10.1007/
1707. doi 10.3390/molecules22101707
s11947-020-02513-x
21.
Popat A., Hartono S.B., Stahr F., Liu J., Qiao S.Z.,
38.
Kumar H., Kuča K., Bhatia S.K., Saini K., Kaushal A.,
Qing Max Lu G. Nanoscale. 2011, 3, 2801-2818. doi
Verma R., Bhalla T.C., Kumar D. Sensors. 2020, 20,
10.1039/c1nr10224a
1966. doi 10.3390/s20071966
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
468
СОКОЛОВ и др.
39.
Aisida S.O., Akpa P.A., Ahmad I., Zhao T.-k.,
55.
Wu X., Yang C., Ge J. Bioresources Bioproces. 2017, 4,
Maaza M., Ezema F.I. Eur. Polymer J. 2020, 122,
24. doi 10.1186/s40643-017-0154-8
109371. doi 10.1016/j.eurpolymj.2019.109371
56.
Liang W., Carraro F., Solomon M.B., Bell S.G.,
40.
Blackman L.D., Varlas S., Arno M.C., Houston Z.H.,
Amenitsch H., Sumby C.J., White N.G., Falcaro P.,
Fletcher N.L., Thurecht K.J., Hasan M., Gibson M.I.,
Doonan C.J. J. Am. Chem. Soc. 2019, 141, 14298-
O’Reilly R.K. ACS Central Sci. 2018, 4, 718-723. doi
14305. doi 10.1021/jacs.9b06589
10.1021/acscentsci.8b00168
57.
Федин В.П., Артемьев А.В. ЖОрХ. 2019, 55, 901-
41.
Varlas S., Foster J.C., Georgiou P.G., Keogh R.,
922. [Artem’ev A.V., Fedin V.P. Russ. J Org. Chem.
Husband J.T., Williams D.S., O’Reilly R.K. Nanoscale.
2019, 55, 800-817.] doi 10.1134/S1070428019060101
2019, 11, 12643-12654. doi 10.1039/C9NR02507C
58.
Ганина О.Г., Бондаренко Г.Н., Исаева В.И., Кус-
42.
Cui J., Ren S., Sun B., Jia S. Coordin. Chem. Rev. 2018,
тов Л.М., Белецкая И.П. ЖОрХ. 2019, 55, 1813-
370, 22-41. doi 10.1016/j.ccr.2018.05.004
1821. [Ganina O.G., Bondarenko G.N., Isaeva V.I.,
43.
Yoshimoto M., Enzyme Stabilization and Immobi-
Kustov L.M., Beletskaya I.P. Russ. J. Org. Chem. 2019,
lization: Methods and Protocols. Ed. S.D. Minteer.
55, 1813-1820.] doi 10.1134/S1070428019120017
N.-Y.: Springer 2017, 9-18. doi 10.1007/978-1-4939-
59.
Hidalgo T., Alonso-Nocelo M., Bouzo B.L., Reimon-
6499-4_2
dez-Troitiño S., Abuin-Redondo C., de la Fuente M.,
44.
Caruso F., Trau D., Möhwald H., Renneberg R.
Horcajada P. Nanoscale. 2020, 12, 4839-4845. doi
Langmuir.
2000,
16,
1485-1488. doi
10.1021/
10.1039/C9NR08127E
la991161n
60.
Peng S., Bie B., Sun Y., Liu M., Cong H., Zhou W.,
45.
Chaize B., Colletier J.-P., Winterhalter M., Fournier D.
Xia Y., Tang H., Deng H., Zhou X. Nature Commun.
Artific. Cells, Blood Substit., Biotechnol. 2004, 32, 67-
2018, 9, 1293. doi 10.1038/s41467-018-03650-w
75. doi 10.1081/BIO-120028669
61.
Poddar A., Joglekar M., Hardikar A., Shukla R.
46.
Sakr O.S., Borchard G. Biomacromolecules. 2013, 14,
Progenitor Cells. 2019, 2029, 81-91. doi 10.1007/978-
2117-2135. doi 10.1021/bm400198p
1-4939-9631-5_7
47.
van Dongen S.F.M., Nallani M., Cornelissen J.J.L.M.,
62.
Teplensky M.H., Fantham M., Poudel C., Hockings C.,
Nolte R.J.M., van Hest J.C.M. Chem. Eur. J. 2009, 15,
Lu M., Guna A., Aragones-Anglada M., Mogha-
1107-1114. doi 10.1002/chem.200802114
dam P.Z., Li P., Farha O.K., Bernaldo de Quirós
48.
Le Meins J.F., Sandre O., Lecommandoux S. Eur. Phys.
Fernández S., Richards F.M., Jodrell D.I., Kamins-
J. E. 2011, 34, 14. doi 10.1140/epje/i2011-11014-y
ki Schierle G., Kaminski C.F., Fairen-Jimenez D.
49.
Zyuzin M.V., Ramos-Cabrer P., Carregal-Romero S.,
Chem.
2019,
5,
2926-2941. doi
10.1016/
Immobilization of Enzymes and Cells: Methods and
j.chempr.2019.08.015
Protocols. Eds. J.M. Guisan, J.M. Bolivar, F. López-
63.
Poddar A., Conesa J.J., Liang K., Dhakal S., Reineck
Gallego, J. Rocha-Martín. N.-Y.: Springer. 2020, 227-
P., Bryant G., Pereiro E., Ricco R., Amenitsch H., Doo-
241. doi 10.1007/978-1-0716-0215-7_15
nan C., Mulet X., Doherty C.M., Falcaro P., Shukla R.
50.
Nobakht N., Faramarzi M.A., Shafiee A., Khoobi M.,
Small. 2019, 15, 1902268. doi 10.1002/smll.201902268
Rafiee E. Int. J. Biol. Macromol. 2018, 113, 8-19. doi
64.
Zhang R., Teramura Y., Fukazawa K., Ishihara K.
10.1016/j.ijbiomac.2018.02.023
Macromol. Biosci.
2020, e2000114. doi
10.1002/
51.
Gascón V., Jiménez M.B., Blanco R.M., Sanchez-
mabi.202000114
Sanchez M. Catalysis Today. 2018, 304, 119-126. doi
65.
Lambert C.R., Nijsure D., Huynh V., Wylie R.G.
10.1016/j.cattod.2017.10.022
Biomed. Mater. 2018, 13, 045002. doi 10.1088/1748-
52.
Tadepalli S., Yim J., Cao S., Wang Z., Naik R.R.,
605X/aab45d
Singamaneni S. Small. 2018, 14, 1702382. doi 10.1002/
66.
Zhong L., Feng Y., Wang G., Wang Z., Bilal M., Lv H.,
smll.201702382
Jia S., Cui J. Int. J. Biol. Macromol. 2020, 152, 207-
53.
Liang K., Ricco R., Doherty C.M., Styles M.J.,
222. doi 10.1016/j.ijbiomac.2020.02.258
Bell S., Kirby N., Mudie S., Haylock D., Hill A.J.,
Doonan C.J., Falcaro P. Nature Commun. 2015, 6,
67.
Zhuang L.L., Li M., Hao Ngo H. Bioresour Technol.
7240. doi 10.1038/ncomms8240
2020, 308, 123320. doi 10.1016/j.biortech.2020.123320
54.
Knedel T.-O., Ricklefs E., Schlüsener C., Urlacher V.B.,
68.
Zhou Y., Chen R., Yang H., Bao C., Fan J., Wang C.,
Janiak C. ChemistryOpen. 2019, 8, 1337-1344. doi
Lin Q., Zhu L. J. Mater. Chem. B. 2020, 8, 727-735.
10.1002/open.201900146
doi 10.1039/c9tb02411e
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
МЕТОДЫ ИНКАПСУ
ЛИРОВАНИЯ БИОМАКРОМОЛЕКУЛ И ЖИВЫХ КЛЕТОК
469
69.
Jafari S., Maleki-Dizaji N., Barar J., Barzegar-Jalali M.,
90.
Racek J. Appl. Microbiol. Biotechnol. 1991, 34, 473-
Rameshrad M., Adibkia K. Eur. J. Pharm. Sci. 2016,
477.
91, 225-235. doi 10.1016/j.ejps.2016.05.014
91.
Федоров А.Ю., Волченко Е.В., Сингирцев И.Н.,
70.
Zhu Z., Chen Z., Luo X., Liang W., Li S., He J.,
Корженевич В.И., Шуб Г.М. Приклад. биохим.
Zhang W., Hao T., Yang Z. Chemosphere. 2020, 240,
микробиол. 1999, 35, 165-172.
124882. doi 10.1016/j.chemosphere.2019.124882
92.
Garcia J.L., Nunez C.J., Gonzalez E.G., Osuna J.,
71.
Yu L., Xia K., Gong C., Chen J., Li W., Zhao Y.,
Soberon X., Galindo E. Appl. Biochem. Biotechnol.
Guo W., Dai H. Int. J. Biol. Macromol. 2020, 160, 101-
1998, 73, 243-256. doi 10.1007/BF02785659
111. doi 10.1016/j.ijbiomac.2020.05.161
93.
Gonchar M.V., Maidan M.M., Moroz O.M., Wood-
72.
Zhang W., Wang X.C., Li X.Y., Zhang L.L., Jiang F.
ward J.R., Sibirny A.A. Biosens. Bioelectron. 1998,
Carbohydr. Polym. 2020, 236, 116043. doi 10.1016/
13, 945-952. doi 10.1016/s0956-5663(98)00034-7
j.carbpol.2020.116043
94.
Schmidt A., Standfuss-Gabisch C., Bilitewski U.
73.
Yilmaz E.N., Zeugolis D.I. Front. Bioeng. Biotechnol.
Biosens. Bioelectron.
1996,
11,
1139-1145. doi
2020, 8, 77. doi 10.3389/fbioe.2020.00077
10.1016/0956-5663(96)82336-0
74.
Gur S.D., Idil N., Aksoz N. Appl. Biochem. Biotechnol.
95.
Jung S.W., Byun J.H., Oh S.H., Kim T.H., Park J.S.,
2018, 184, 538-552. doi 10.1007/s12010-017-2566-5
Rho G.J., Lee J.H. Carbohydr. Polym. 2018, 180,
75.
Wei C., Zhou Y., Zhuang W., Li G., Jiang M., Zhang H.
216-225. doi 10.1016/j.carbpol.2017.10.029
J. Biosci. Bioeng. 2018, 125, 377-384. doi 10.1016/
96.
Held M., Schuhmann W., Jahreis K., Schmidt H.L.
j.jbiosc.2017.09.011
Biosens.Bioelectron. 2002,17,1089-1094.doi10.1016/
76.
Heim S., Schnieder I., Binz D., Vogel A., Bilitewski U.
s0956-5663(02)00103-3
Biosens. Bioelectron. 1999, 14, 187-193.
97.
Svitel J., Curilla O., Tkac J. Biotechnol. Appl.
77.
Dubey R.S., Upadhyay S.N. Biosens. Bioelectron.
Biochem. 1998, 27, 153-158.
2001, 16, 995-1000.
98.
Karube I., Mitsuda S., Suzuki S. Eur. J. Appl.
78.
Galindo E., Bautista D., Garcia J.L., Quintero R.
Microbiol. Biotechn. 1979, 7, 343-350.
Enzyme Microb. Technol. 1990, 12, 642-646. doi
10.1016/0141-0229(90)90001-7
99.
Timur S., Seta L.D., Pazarlioglu N., Pilloton R., Te-
lefoncu A. Process Biochem. 2004, 39, 1325-1329.
79.
Hoshi M., Sasamoto Y., Nonaka M., Toyama K.,
Watanabe E. Biosens. Bioelectron. 1991, 6, 15-20.
100.
Horsburgh A.M., Mardlin D.P., Turner N.L., Henk-
ler R., Strachan N., Glover L.A., Paton G.I., Kill-
80.
Karube I., Suzuki S., Okada T., Hikuma M. Biochimie.
ham K. Biosens. Bioelectron. 2002, 17, 495-501.
1980, 62, 567-573. doi 10.1016/s0300-9084(80)80102-
7
101.
Riedel K., Beyersdorf-Radeck B., Neumann B.,
81.
Kim M.N., Kwon H.S. Biosens. Bioelectron. 1999, 14,
Schaller F. Appl. Microbiol. Biotechnol. 1995, 43,
1-7.
7-9.
82.
Mulchandani P., Lei Y., Chen W., Wang J., Mulchanda-
102.
Anderson D.E.J., Truong K.P., Hagen M.W.,
ni A. Anal. Chim. Acta. 2002, 470, 79-86.
Yim E.K.F., Hinds M.T. Acta Biomater. 2019, 86,
83.
Renneberg R., Riedel K., Liebs P., Scheller F. Anal.
291-299. doi 10.1016/j.actbio.2019.01.008
Lett. 1984, 17, 349-358.
103.
Wollenberger U., Scheller F., Atrat P. Anal. Lett. 1980,
84.
Riedel K., Scheller F. Analyst. 1987, 112, 341-342.
13, 1201-1210.
85.
Katrlik J., Brandsteter R., Svorc J., Rosenberg M.,
104.
Philp J.C., Balmand S., Hajto E., Bailey M.J.,
Miertus S. Anal. Chim. Acta. 1997, 356, 217-224.
Wiles S., Whiteley A.S., Lilley A.K., Hajto J., Dun-
bar S.A. Anal. Chim. Acta. 2003, 487, 61-74.
86.
Riedel K., Renneberg R., Wollenberger U., Kaiser G.,
Scheller F.W. J. Chem. Tech. Biotechnol. 1989, 44,
105.
Simonian A.L., Rainina E.I., Lozinsky V.I., Bada-
85-106.
lian I.E., Khachatrian G.E., Tatikian S., Makhlis T.A.,
87.
Rechnitz G.A., Kobos R.K., Riechel S.J., Gebauer C.R.
Varfolomeyev S.D. Appl. Biochem. Biotechnol. 1992,
Anal. Chim. Acta. 1977, 94, 357-365.
36, 199-210. doi 10.1007/BF02921779
88.
Matsunaga T., Toshihiko S., Tomoda R. Enzyme
106.
Fukui S., Tanaka A. Adv. Biochem. Eng. Biotechnol.
Microb. Technol. 1984, 6, 335-358.
1984, 29, 2-33.
89.
Bilal M., Adeel M., Rasheed T., Iqbal H.M.N. J. Mater.
107.
Grinyte R., Barroso J., Moller M., Saa L., Pavlov V.
Res. Technol.
2019,
8,
2359-2371. doi
10.1016/
ACS Appl. Mater. Interfaces. 2016, 8, 29252-29260.
j.jmrt.2018.12.001
doi 10.1021/acsami.6b08362
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
470
СОКОЛОВ и др.
108.
Odaci D., Timur S., Telefoncu A. Sensors
124.
Jha S.K., Kanungo M., Nath A., D’Souza S.F. Biosens.
Actuators B: Chem. 2008, 134, 89-94. doi 10.1016/
Bioelectron. 2009, 24, 2637-2642. doi 10.1016/
j.snb.2008.04.013
j.bios.2009.01.024
109.
Yao Y., Yang L., Feng L.F., Yue Z.W., Zhao N.H.,
125.
Strehlitz B., Bohland C. Fourth Workshop
Li Z., He Z.X. Stem Cell Res. Ther. 2020, 11, 136. doi
on Biosensors and Biological Techniques in
10.1186/s13287-020-01637-3
Environmental Analysis. Spain, Menorca. 1999, O16
110.
Shahzadi L., Yar M., Jamal A., Siddiqi S.A.,
126.
Quijada C., Leite-Rosa L., Berenguer R., Bou-
Chaudhry A.A., Zahid S., Tariq M., Rehman I.U.,
Belda E. Materials (Basel). 2019, 12, 2516. doi
MacNeil S. J. Biomater. Appl. 2016, 31, 582-593. doi
10.3390/ma12162516
10.1177/0885328216650125
127.
Shaikh M.O., Srikanth B., Zhu P.Y., Chuang C.H.
111.
Chan C., Lehmann M., Tag K., Lung M., Kunze G.,
Sensors (Basel).
2019,
19,
3990. doi
10.3390/
Riedel K., Gruendig B., Renneberg R. Biosens.
s19183990
Bioelectron. 1999, 14, 131-138. doi 10.1016/s0956-
128.
El-Maiss J., Cuccarese M., Maerten C., Lupattelli P.,
5663(98)00110-9
Chiummiento L., Funicello M., Schaaf P., Jierry L.,
112.
Gaberlein S., Spener F., Zaborosch C. Appl. Microbiol.
Boulmedais F. ACS Appl. Mater. Interfaces. 2018, 10,
Biotechnol.
2000,
54,
652-658. doi
10.1007/
18574-18584. doi 10.1021/acsami.8b04764
s002530000437
129.
Trzaskowska P.A., Kuzminska A., Butruk-Raszeja B.,
113.
Konig A., Riedel K., Metzger J.W. Biosens.
Rybak E., Ciach T. Colloids Surf. B Biointerfaces. 2018,
Bioelectron. 1998, 13, 869-874.
167, 499-508. doi 10.1016/j.colsurfb.2018.04.052
114.
Konig A., Zaborosch C., Muscat A., Vorlop K.-D.,
130.
Deng L., Guo S., Zhou M., Liu L., Liu C., Dong S.
Spener F. Appl. Microbiol. Biotechnol. 1996, 45,
Biosens. Bioelectron. 2010, 25, 2189-2193.
844-850.
131.
Gorityala B.K., Ma J., Wang X., Chen P., Liu X.W.
115.
Faust H.J., Sommerfeld S.D., Rathod S., Ritten-
Chem. Soc. Rev. 2010, 39, 2925-2934. doi 10.1039/
bach A., Ray Banerjee S., Tsui B.M.W., Pom-
b919525b
per M., Amzel M.L., Singh A., Elisseeff J.H.
132.
Hiep H.M., Endo T., Kim D.K., Tamiya E.
Biomaterials.
2018,
183,
93-101. doi
10.1016/
Nanomaterials Synthesis, Interfacing, and Integrating
j.biomaterials.2018.08.045
in Devices, Circuits, and Systems II. Boston, MA.
116.
Smirnova D.V., Rubtsova M.Y., Grigorenko V.G.,
2007, 67680I.
Ugarova N.N. Photochem. Photobiol. 2017, 93, 541-
133.
Hnaien M., Lagarde F., Bausells J., Errachid A.,
547. doi 10.1111/php.12666
Jaffrezic-Renault N. Anal. Bioanal. Chem. 2010,
117.
Tham D.K.L., Moukhles H. J. Vis. Exp. 2017, 55974.
1083-1092. doi 10.1007/s00216-010-4336-x
doi 10.3791/55974
134.
Huang Y., Palkar P.V., Li L.J., Zhang H., Chen P.
118.
Ikonomova S.P., Le M.T., Kalla N., Karlsson A.J.
Biosens. Bioelectron.
2010,
25,
1834-1837. doi
Biotechnol. Appl. Biochem. 2018, 65, 580-585. doi
10.1016/j.bios.2009.12.011
10.1002/bab.1645
135.
Zhu Y.C., Li Z., Liu X.N., Fan G.C., Han D.M.,
119.
Chen D., Cao Y., Liu B., Kong J. Anal. Bioanal.
Zhang P.K., Zhao W.W., Xu J.J., Chen H.Y. Biosens.
Chem. 2002, 372, 737-739.
Bioelectron.
2020,
148,
111836. doi
10.1016/
120.
Jia J., Tang M., Chen X., Qi L., Dong S. Biosens.
j.bios.2019.111836
Bioelectron. 2003, 18, 1023-1029.
136.
Yoon J., Shin M., Lee T., Choi J.W. Materials (Basel).
2020, 13, 299. doi 10.3390/ma13020299
121.
Tetteh G., Khan A.S., Delaine-Smith R.M., Reil-
ly G.C., Rehman I.U. J. Mech. Behav. Biomed. Mater.
137.
Wang H., Jiang Y., Zhang Y., Zhang Z., Yang X.,
2014, 39, 95-110. doi 10.1016/j.jmbbm.2014.06.019
Ali M.A., Fox E.M., Gobius K.S., Man C. J. Dairy
122.
Kaiser P., Reich S., Leykam D., Willert-Porada M.,
Sci. 2018, 101, 10775-10791. doi 10.3168/jds.2018-
15258
Greiner A., Freitag R. Macromol. Biosci. 2017, 17,
1600442. doi 10.1002/mabi.201600442
138.
Liang K., Richardson J.J., Cui J., Caruso F., Doo-
nan C.J., Falcaro P. Adv. Mater. 2016, 28, 7910-7914.
123.
Magyari K., Nagy-Simon T., Vulpoi A., Popescu R.A.,
doi 10.1002/adma.201602335
Licarete E., Stefan R., Hernadi K., Papuc I., Baia L.
Mater. Sci. Eng. C Mater. Biol. Appl. 2017, 76, 752-
139.
Liang K., Richardson J.J., Doonan C.J., Mulet X.,
759. doi 10.1016/j.msec.2017.03.138
Ju Y., Cui J., Caruso F., Falcaro P. Angewandte
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
МЕТОДЫ ИНКАПСУ
ЛИРОВАНИЯ БИОМАКРОМОЛЕКУЛ И ЖИВЫХ КЛЕТОК
471
Chem., Int. Ed. 2017, 56, 8510-8515. doi 10.1002/
154.
Ricco R., Wied P., Nidetzky B., Amenitsch H.,
anie.201704120
Falcaro P. Chem, Commun. 2020, 56, 5775-5778. doi
10.1039/C9CC09358C
140.
Ji Z., Zhang H., Liu H., Yaghi O.M., Yang P. Proceed.
Nat. Acad. Sci. 2018, 115, 10582. doi 10.1073/
155.
Lian X. Doctor of Philosophy. 2018.
pnas.1808829115
156.
Ahmad R., Shanahan J., Rizaldo S., Kissel D.S.,
141.
Deng Q., Sun P., Zhang L., Liu Z., Wang H., Ren J.,
Stone K.L. Catalysts. 2020, 10, 499. doi 10.3390/
Qu X. Adv. Funct. Mater. 2019, 29, 1903018. doi
catal10050499
10.1002/adfm.201903018
157.
Li Y., Wen L., Tan T., Lv Y. Front. Bioeng. Biotechnol.
2019, 7, 394. doi 10.3389/fbioe.2019.00394
142.
Luzuriaga M.A., Welch R.P., Dharmarwardana M.,
Benjamin C.E., Li S., Shahrivarkevishahi A., Popal S.,
158.
Nath I., Chakraborty J., Verpoort F. Chem. Soc. Rev.
Tuong L.H., Creswell C.T., Gassensmith J.J. ACS
2016, 45, 4127-4170. doi 10.1039/C6CS00047A
Appl. Mater. Interfaces. 2019, 11, 9740-9746. doi
159.
Wang J., Li W., Zheng Y.-Q. Analyst. 2019, 144,
10.1021/acsami.8b20504
6041-6047. doi 10.1039/C9AN00813F
143.
Zhang Y., Wang F., Ju E., Liu Z., Chen Z., Ren J.,
160.
Yang H., Yang R., Zhang P., Qin Y., Chen T., Ye F.
Qu X. Adv. Funct. Mater. 2016, 26, 6454-6461. doi
Microchim. Acta. 2017, 184, 4629-4635. doi 10.1007/
10.1002/adfm.201600650
s00604-017-2509-4
144.
Zhong X., Zhang Y., Tan L., Zheng T., Hou Y.,
161.
He J., Zhang Y., Zhang X., Huang Y. Scientific Reports.
Hong X., Du G., Chen X., Zhang Y., Sun X.
2018, 8, 5159. doi 10.1038/s41598-018-23557-2
J. Control. Rel. 2019, 300, 81-92. doi 10.1016/
162.
Liang H., Lin F., Zhang Z., Liu B., Jiang S., Yuan Q.,
j.jconrel.2019.02.035
Liu J. ACS Appl. Mater. Interfaces. 2017, 9, 1352-
145.
Li W., Zhang Y., Xu Z., Meng Q., Fan Z., Ye S.,
1360. doi 10.1021/acsami.6b15124
Zhang G. Angewandte Chem., Int. Ed. 2016, 55, 955-
163.
Wang H., Chen Y., Wang H., Liu X., Zhou X.,
959. doi 10.1002/anie.201508795
Wang F. Angewandte Chem., Int. Ed. 2019, 58, 7380-
146.
Cho M.O., Yoon S., Kim J.K. 1st Global Congress
7384. doi 10.1002/anie.201902714
on NanoEngineering for Medicine and Biology:
164.
Hamedi A., Caldera F., Trotta F., Borhani Zaran-
Advancing Health Care through NanoEngineering
di M., Rubin Pedrazzo A., Cecone C., Review M.
and Computing, NEMB 2010. Houston, TX. 2010,
Acta Sci. Pharm. Sci.
2019,
3,
107-109. doi
335-336.
10.13140/RG.2.2.24033.97125
147.
Sakurai K., Teramura Y., Iwata H. Biomate-
165.
Kan P., Tsao C.W., Wang A.J., Su W.C.,
rials.
2011,
32,
3596-3602. doi
10.1016/
Liang H.F. J. Drug Deliv. 2011, 2011, 629234. doi
j.biomaterials.2011.01.066
10.1155/2011/629234
148.
Cho H., Parameswaran M., Yu H.-Z. Sensors
166.
Katsai O., Ruban O. Int. J. Appl. Pharm. 2019, 11,
Actuators B: Chem.
2007,
123,
749-756. doi
418-425. doi 10.22159/ijap.2019v11i4.32080
10.1016/j.snb.2006.10.022
167.
Rideau E., Dimova R., Schwille P., Wurm F.R.,
149.
Cook C.C., Wang T., Derby B. Chem. Commun.
Landfester K. Chem. Soc. Rev. 2018, 47, 8572-8610.
(Camb).
2010,
46,
5452-5454. doi
10.1039/
doi 10.1039/c8cs00162f
c0cc00567c
168.
Заборова О.В. Дис. …канд. хим. наук. Москва.
150.
Kwok C.Y. International Conference on Knowledge-
2014.
Based Intelligent Electronic Systems, Proceedings,
169.
Sharma A., Sharma U.S. Int. J. Pharm. 1997, 154,
KES. 1998, 3, 442-446.
123-140. doi 10.1016/S0378-5173(97)00135-X
151.
Lin L., He W. Digital Fabrication 2006. Denver, CO.
170.
Bioceramics and Biocomposites. From Research to
2006, 98.
Clinical Practice. Ed. I. Antoniac. Hoboken: John
152.
Choi I., Yang Y.I., Kim Y.-J., Kim Y., Hahn J.-S.,
Wiley & Sons, Inc. 2019, 385.
Choi K., Yi J. Langmuir. 2008, 24, 2597-2602. doi
171.
Mishra M.K., Singh T.K., Tiwari P. Adv. J. Pharm.
10.1021/la701679a
Life Sci. Res. 2016, 4, 41-52.
153.
Wang Q., Zhang X., Huang L., Zhang Z., Dong S.
172.
Blume G., Cevc G. Biochim. Biophys. Acta
Angewandte Chem, Int, Edition. 2017, 56, 16082-
Biomembr. 1993, 1146, 157-168. doi 10.1016/0005-
16085. doi 10.1002/anie.201710418
2736(93)90351-Y
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
472
СОКОЛОВ и др.
173. Antimisiaris S.G., Kallinteri P., Fatouros D.G.,
182. Muñoz B., Rámila A., Pérez-Pariente J., Díaz I.,
Pharm. Sci. Encyclopedia.
2010,
1-91. doi
Vallet-Regí M. Chem. Mater. 2003, 15, 500-503. doi
10.1002/9780470571224.pse352
10.1021/cm021217q
174. Kim S., Shi Y., Kim J.Y., Park K., Cheng J.X.
183. Fundamental Biomaterials. Ceramics. Eds. S. Tho-
Expert Opin. Drug Del.
2010,
7,
49-62. doi
mas, P. Balakrishnan, M.S. Sreekala. Duxford:
10.1517/17425240903380446
Woodhead Publishing, Elsevier Ltd. 2018, 498.
175. Yang R., Zhang S., Kong D., Gao X., Zhao Y.,
184. Lu F., Wu S.H., Hung Y., Mou C.Y. Small. 2009, 5,
Wang Z. Pharm. Res. 2012, 29, 3512-3525. doi
1408-1413. doi 10.1002/smll.200900005
10.1007/s11095-012-0848-8
185. Chung T.-H., Wu S.-H., Yao M., Lu C.-W., Lin Y.-S.,
176. Letchford K., Burt H. Eur. J. Pharm. Biopharm. 2007,
Hung Y., Mou C.-Y., Chen Y.-C., Huang D.-M.
65, 259-269. doi 10.1016/j.ejpb.2006.11.009
Biomaterials. 2007, 28, 2959-2966. doi 10.1016/
177. Heffernan M.J., Murthy N. Ann. Biomed. Eng. 2009,
j.biomaterials.2007.03.006
37, 1993-2002. doi 10.1007/s10439-009-9734-x
178. Mao A.S., Shin J.W., Utech S., Wang H., Uzun O.,
186. Slowing I.I., Vivero-Escoto J.L., Wu C.W., Lin V.S.
Li W., Cooper M., Hu Y., Zhang L., Weitz D.A.,
Adv. Drug Deliv. Rev. 2008, 60, 1278-1288. doi
Mooney D.J. Nat. Mater. 2017, 16, 236-243. doi
10.1016/j.addr.2008.03.012
10.1038/nmat4781
187. Lin F.-Y., Cheng C.-Y., Chuang Y.-H., Tung S.-H.
179. Chen Y., Zheng X., Qian H., Mao Z., Ding D.,
Polymer.
2018,
134,
117-124. doi
10.1016/
Jiang X. ACS Appl. Mater. Interfaces. 2010, 2, 3532-
j.polymer.2017.11.060
3538. doi 10.1021/am100709d
188. Das S., Sharma D.K., Chakrabarty S., Chowdhury A.,
180. Li Z., Barnes J.C., Bosoy A., Stoddart J.F., Zink J.I.
Sen Gupta S. Langmuir. 2015, 31, 3402-3412. doi
Chem. Soc. Rev. 2012, 41, 2590-2605. doi 10.1039/
10.1021/la503993e
c1cs15246g
189. Dionzou M., Morere A., Roux C., Lonetti B., Mar-
181. Biopolymer Nanostructures for Food Encapsulation
Purposes. Ed. S.M. Jafari. London: Academic Press,
ty J.D., Mingotaud C., Joseph P., Goudouneche D.,
Elsevier Inc. 2019, 1, 668. doi 10.1016/C2017-0-
Payre B., Leonetti M., Mingotaud A.F. Soft Matter.
03166-X
2016, 12, 2166-2176. doi 10.1039/c5sm01863c
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
МЕТОДЫ ИНКАПСУ
ЛИРОВАНИЯ БИОМАКРОМОЛЕКУЛ И ЖИВЫХ КЛЕТОК
473
Methods of Encasulation of Biomacromolecules and Living
Cells. Prospects for Use of Metal-Organic Framework Polymers
А. V. Sokolov, L. V. Limareva, P. V. Iliasov*, О. V. Gribkova, and А. S. Sustretov
Institute of Experimental Medicine and Biotechnologies, Samara State Medical University
ul. Chapaevskaya, 89, Samara, 443079 Russia
*e-mail: p.v.ilyasov@samsmu.ru
Received December 25, 2020; revised December 29, 2020; accepted December 31, 2020
The present review describes methods of encapsulation and biomineralization of macromolecules and living
cells. It summarizes primary benefits and disadvantages of the most common carriers, matrixes and materials
used to immobilize proteins, nucleic acids or cells, and exemplifies vehicles for multi-functional encapsulation
of polypeptide compounds. A particular attention is paid to the prospects for the use of metal-organic framework
polymers in medicine and biotechnology.
Keywords: polymer nanoparticles, inorganic nanoparticles, metal-organic framework polymers, immobilization,
encapsulation, biomineralization
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021