ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 4, с. 474-484
ДИСКУССИЯ
УДК 547.12
О МЕХАНИЗМЕ ДИМЕРИЗАЦИИ СТАБИЛЬНЫХ
ОРГАНИЧЕСКИХ РАДИКАЛОВ
© 2021 г. О. Б. Томилин*, О. В. Бояркина**, Б. С. Танасейчук
ФГБОУ ВО «Национальный исследовательский Мордовский государственный университет им. Н.П. Огарева»,
430005, Россия, Саранск, ул. Большевистская, 68
e-mail: *tomilinob@mail.ru, **boyarkinaov@mail.ru
Поступила в редакцию 14.01.2021 г.
После доработки 23.01.2021 г.
Принята к публикации 24.01.2021 г.
При несимметричной димеризации трифенилметильного и диариламинильного радикалов динамика
изменения распределения плотности неспаренного электрона от координаты реакции соответствует одно-
электронному переносу от атома - формального носителя неспаренного электрона к бензольному кольцу.
Закономерности образования продуктов димеризации обуславливаются кулоновским взаимодействием
эффективных зарядов на атомах реагирующей системы. В полярных средах коэффициент прозрачности
потенциального барьера одноэлектронного переноса уменьшается, что определяет отсутствие несим-
метричной димеризации радикалов.
Ключевые слова: стабильные органические радикалы, несимметричная димеризация,одноэлектронный
перенос, кулоновское взаимодействие, координата реакции
DOI: 10.31857/S0514749220120029
ВВЕДЕНИЕ
чиняется термодинамическому контролю. Причем
изменение полярности растворителя может вызы-
Литература, посвященная закономерностям ди-
вать распад симметричных димеров и образование
меризации свободных органических радикалов,
несимметричных димеров, как это показано на при-
обширна [1-3]. Можно выделить общепринятые
мере тетрафенилгидразина [4, 5]. Предполагается,
положения, опирающиеся на экспериментальные
что движущая причина такого вида димеризации -
данные. Симметричная димеризация, предпола-
электростатическое взаимодействие эффективных
гающая взаимодействие атомов - формальных
зарядов разноименно заряженных атомов.
носителей неспаренного электрона, протекает в
высокополярных средах. Ее протекание реализу-
Краткий обзор общепринятых положений о за-
ется в условиях, не обеспечивающих сколь-нибудь
кономерностях димеризации свободных стабиль-
длительное существование радикалов, и поэтому
ных органических радикалов позволят сделать
подчиняется кинетическому контролю. Указанное
некоторые общие заключения. Имеющиеся экс-
протекание димеризации, по общепринятому мне-
периментальные данные однозначно указывают
нию, обуславливается взаимодействием атомов с
на принципиальную роль природы растворителя.
наибольшей плотностью неспаренного электрона,
Однако, пока остается вне рассмотрения вопрос:
образующих между собой σ-связь.
на какие характеристики электронного строения
Несимметричная димеризация протекает в
взаимодействующих радикалов влияет раствори-
апротонных малополярных растворителях и под-
тель. Взаимодействие атомов с наибольшей плот-
474
О МЕХАНИЗМЕ ДИМЕРИЗАЦИИ СТАБИЛЬНЫХ ОРГАНИЧЕСКИХ РАДИКАЛОВ
475
ностью неспаренного электрона с образованием
описывающего совокупность имеющихся экс-
симметричных димеров противоречит существу-
периментальных данных, пока далека от своего
ющему фундаментальному физическому взаимо-
окончательного решения.
действию - кулоновскому взаимодействию. Это
МОДЕЛЬ И МЕТОД ИССЛЕДОВАНИЯ
означает, что механизм взаимодействия двух ста-
В настоящей работе, аналогично подходу, ис-
бильных органических радикалов с образованием
пользованному в [7], предпринято исследование
симметричных димеров пока еще не имеет убеди-
изменения характеристик электронного строения
тельной теоретической интерпретации.
взаимодействующих радикалов в зависимости
При рассмотрении кулоновского взаимодей-
от изменения реакционных координат. Для этого
ствия атомов свободных радикалов следует учи-
проводился расчет электронного строения реаги-
тывать ближайшее окружение - «реакционную
рующей системы при пошаговом изменении коор-
область» реагирующих атомов, так как в радика-
динаты реакции с последующей оптимизацией все
лах наблюдается чередование знака эффективных
остальных геометрических параметров. На схе-
зарядов на атомах при сопоставимых расстояниях
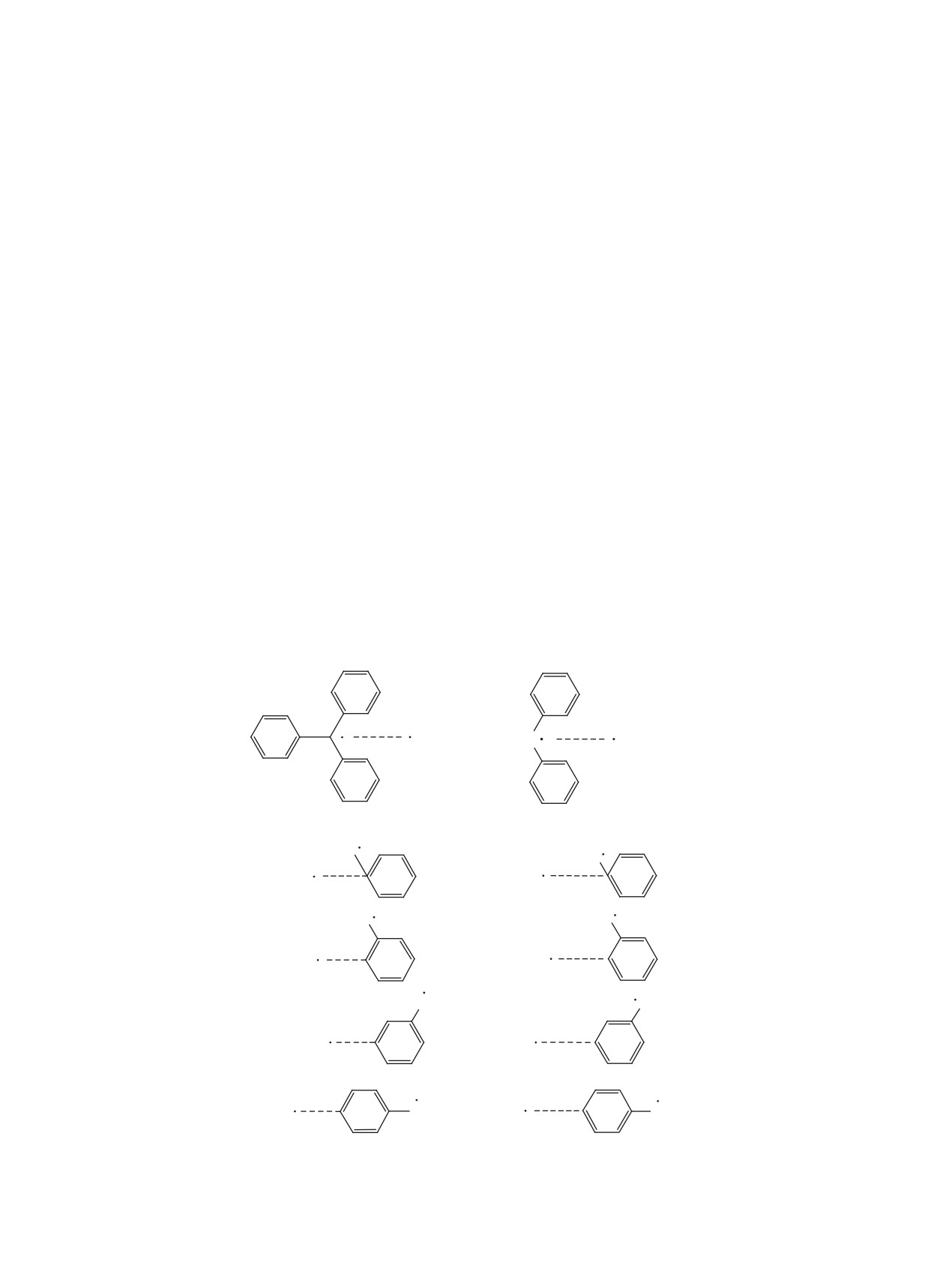
ме 1 представлены рассмотренные реагирующие
в «реакционной области».
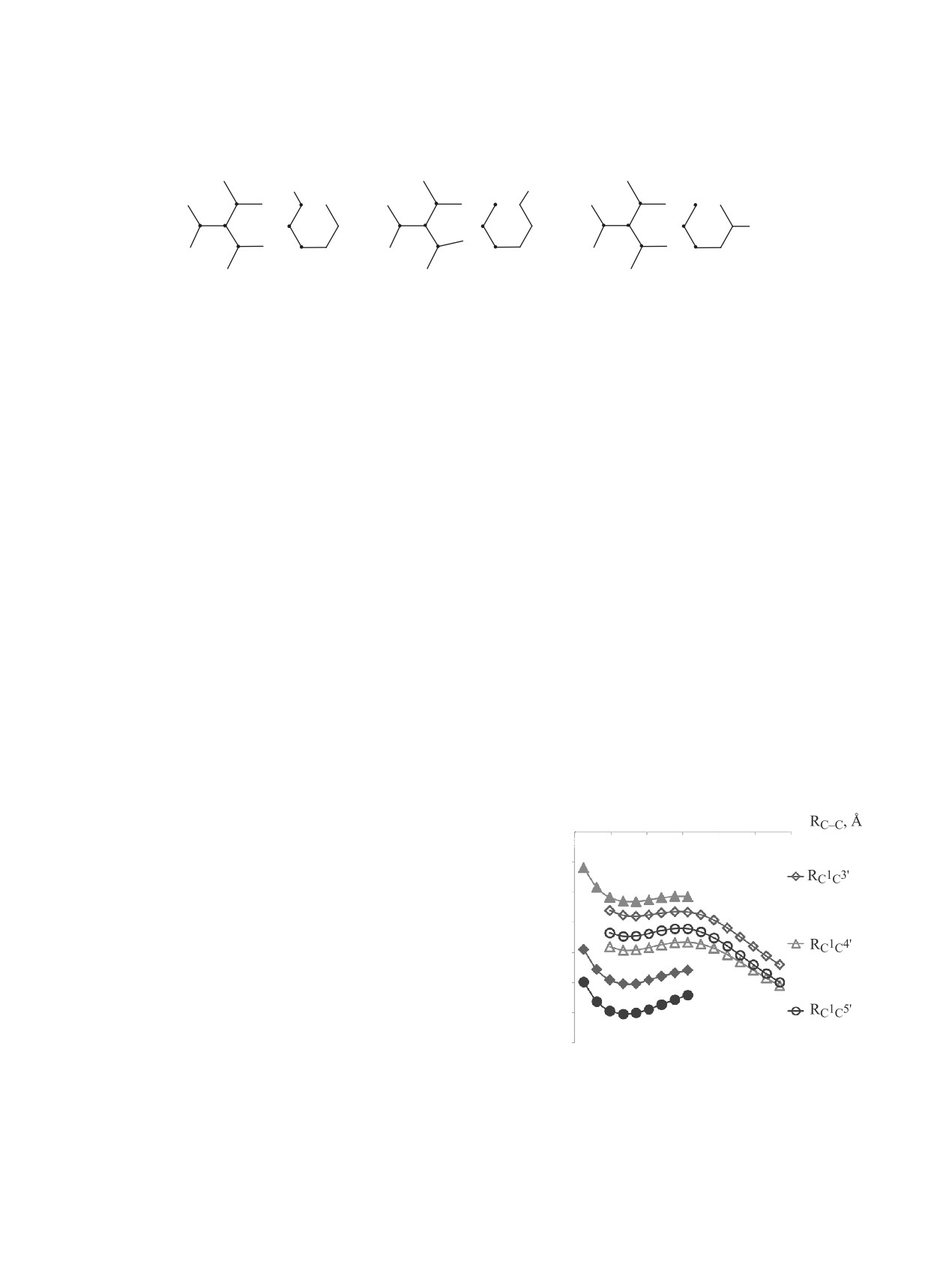
системы при димеризации трифенилметильного 1
и диариламинильного 2 радикалов.
На протекание димеризации стабильных орга-
нических радикалов значительное влияние на ряду
Пунктирными линиями показаны координа-
с кулоновским взаимодействием оказывают имею-
ты реакции R путей взаимодействия радикалов.
щиеся стерические факторы [6].
Величина R изменялась в интервале 3.00-1.40 Å с
шагом 0.07 Å.
Резюмируя вышеизложенное, можно отметить,
что проблема построения механизма димеризации
Такая модель исследования, основанная на при-
свободных органических радикалов, адекватно
ближении изолированной молекулы, близка по фи-
Схема 1
4
5
4
5
3
6
3
6
2
7
2
7
1
1
CPh3
N
NPh2
1
2
Ph2C
PhN
Ph
C
Ph2N
3
Ph2C
PhN
Ph3C
Ph2N
CPh2
NPh
Ph3C
Ph2N
Ph3C
CPh2
Ph2N
NPh
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
476
ТОМИЛИН и др.
Схема 2
Ph
Ph
Ph3C
C
Ph3C
CH
H
Ph
Ph
3
4
зическому смыслу к взаимодействию радикалов в
стемы и определялась ее полная энергия Etot. Так
неполярных растворителях. Поэтому ее результа-
как реагирующая система - бирадикал, то опти-
ты будут соотнесены с соответствующими экспе-
мизация проводилась для триплетного состояния
риментальными данными.
М = 3.
Расчеты электронной структуры реагирующих
Рассмотрение механизмов димеризации ста-
систем проводились методом функционала плот-
бильных органических радикалов будем прово-
ности DFT с использованием гибридного функ-
дить, исходя из того, что все химические взаимо-
ционала UB3LYP [8] в базисе 6-31G [9] в пакете
действия обуславливаются фундаментальным фи-
прикладных программ Orca[10].
зическим взаимодействием - кулоновским взаимо-
действием эффективных зарядов атомов реагиру-
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
ющей системы. Величины эффективных зарядов
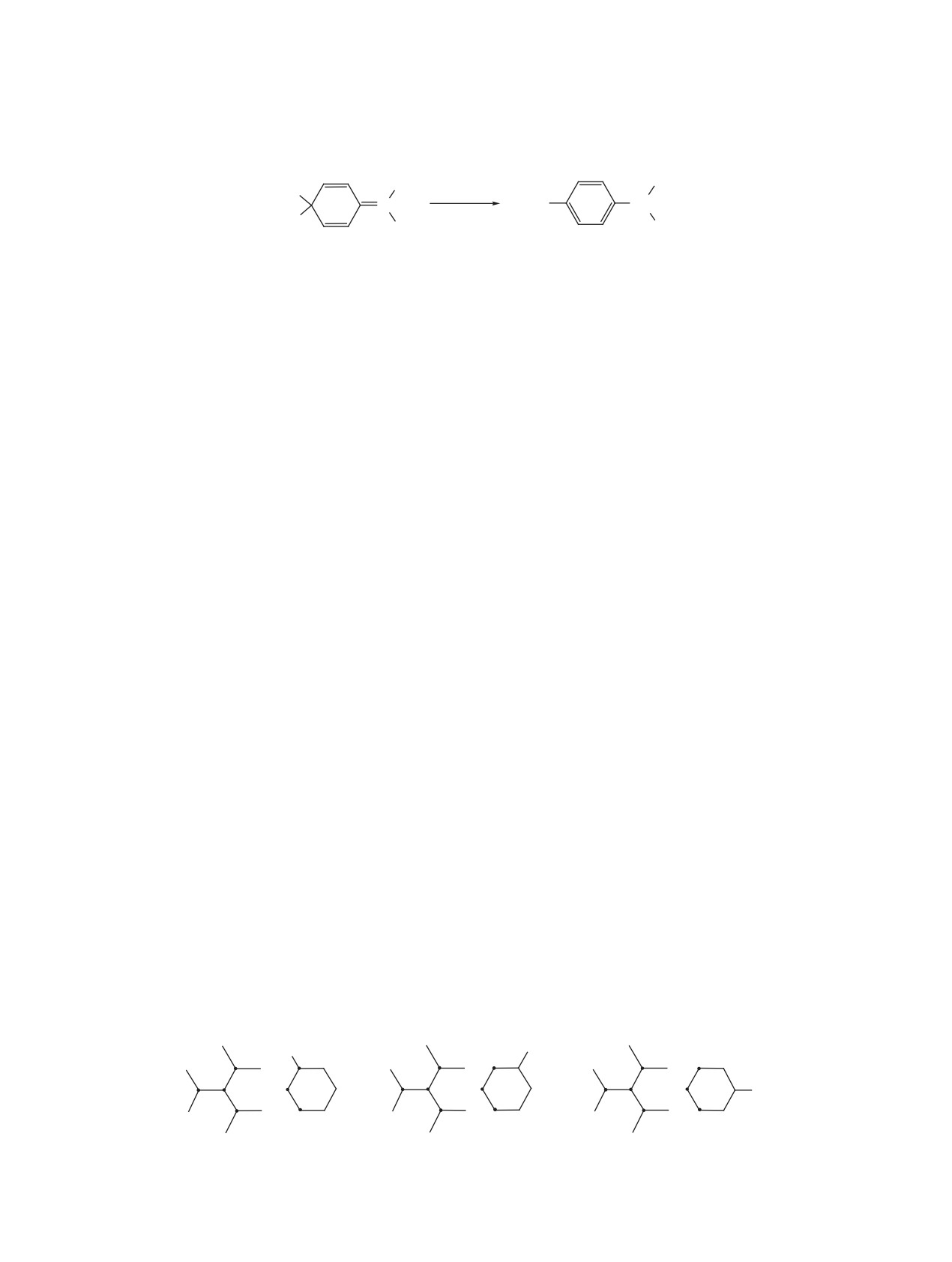
Для радикала 1 характерно образование несим-
на атомах радикала 1, которые могут участвовать
метричного димера 3, имеющего метиленхино-
во взаимодействии при димеризации, имеют от-
идную структуру и перегруппировывающегося в
рицательные значения. Электронейтральность ра-
углеводород Ульмана-Борсума 4 [11] (схема 2).
дикала 1 обеспечивается положительными эффек-
Можно предположить, что симметричный ди-
тивными зарядами на атомах водорода. Однако,
эффективные заряды на атомах, образующих С-С
мер радикала 1 - гексафенилэтан, вероятно, может
быть получен восстановлением триарилкарбинола
связь при димеризации, предполагают кулонов-
двуххлористым ванадием в сильнокислой среде
ское отталкивание одноименных зарядов. Это
[12]. Однако, стерические факторы, по-видимо-
означает, что взаимодействие атомов объемных
му, препятствуют симметричной димеризации
структурных фрагментов радикала 1 предполага-
образующихся радикалов. Поэтому значительная
ет учет дополнительных кулоновских взаимодей-
часть трифенилметильных радикалов выпадает из
ствий атомов, окружающих выбранный реакци-
раствора в твердом виде. При растворении обра-
онный центр. На схеме 3 показано распределение
зующегося продукта раствор приобретает интен-
эффективных зарядов на атомах qi (а.е.з.) в реакци-
сивную желтую окраску, которая постепенно ос-
онной области при значении координаты реакции
лабевает в связи с образованием несимметричного
RC1C3' = RC1C4' = RC1C5' = 3.0 Å.
димера.
Совокупный учет кулоновских взаимодействий
Рассмотрим, следуя схеме 1, четыре возмож-
реагирующих атомов и атомов, окружающих реак-
ных взаимодействия атомов углерода при диме-
ционный центр, осуществляется в вычислении ве-
ризации радикала 1: RC1C1', RC1C2', RC1C3', RC1C4',
личины Etot реагирующей системы в зависимости
RC1C5'. В каждой точке координаты реакции прово-
от расположения атомов относительно друг друга
дилась оптимизация геометрии реагирующей си-
(рис. 1).
Схема 3
Ph2C
CPh2
+0.02
-0.15
-0.15
+0.01
+0.02
+0.05
+0.03
-0.01
–0.13
+0.01
-0.02
-0.12
+0.02
-0.02
–0.11
CPh2
+0.01
+0.06
+0.01
–0.15
-0.13
-0.14
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
О МЕХАНИЗМЕ ДИМЕРИЗАЦИИ СТАБИЛЬНЫХ ОРГАНИЧЕСКИХ РАДИКАЛОВ
477
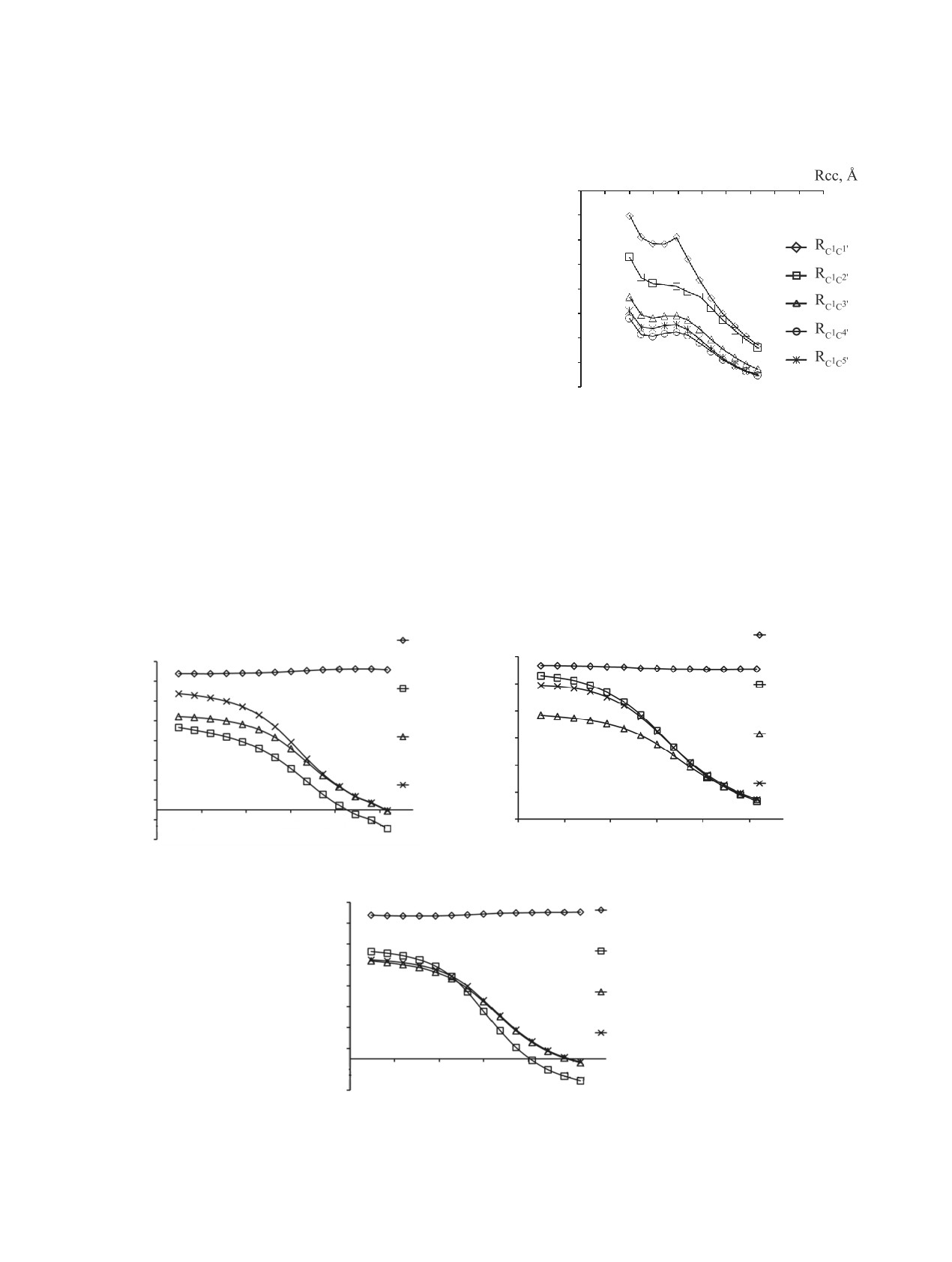
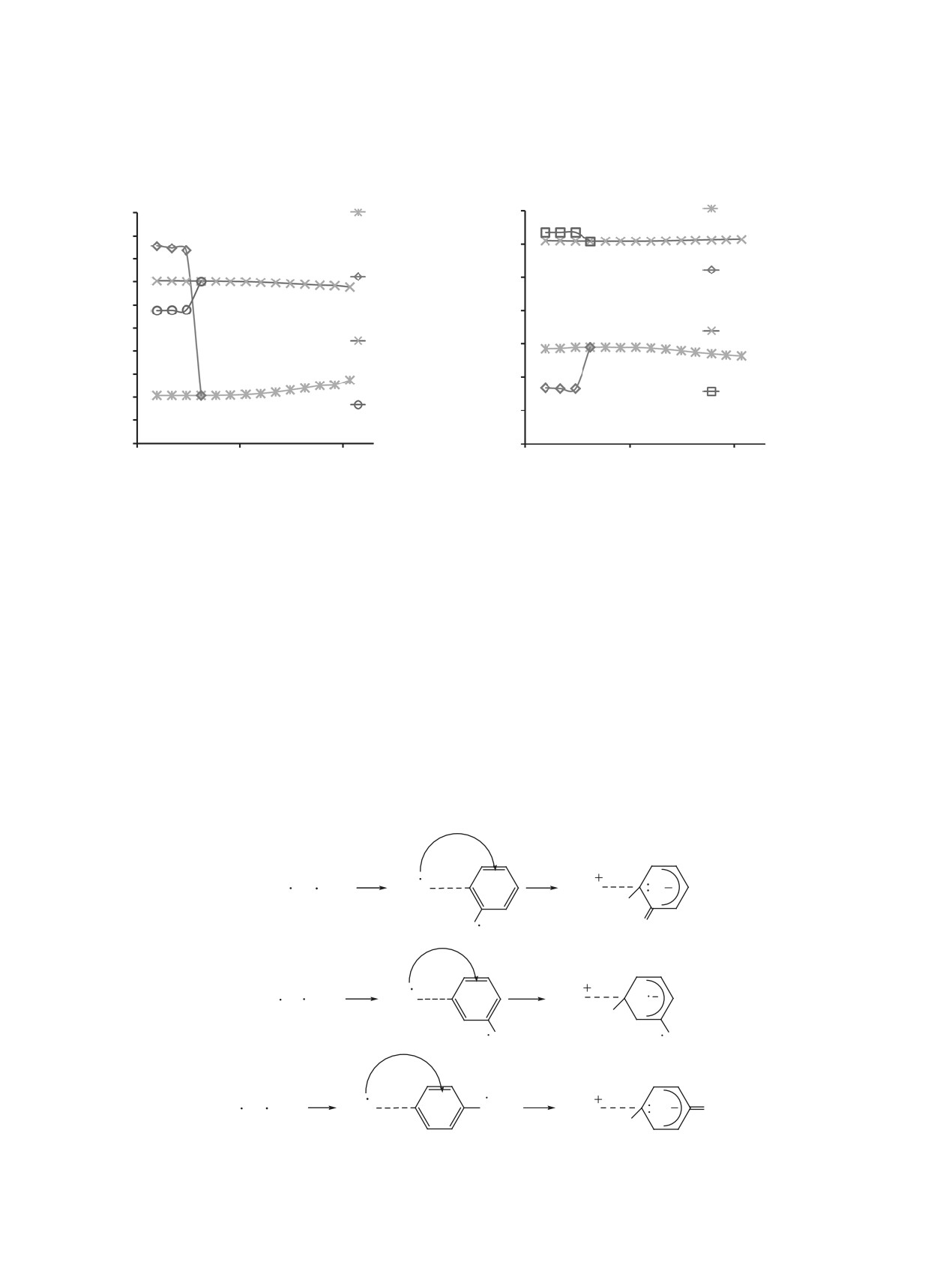
На рис. 1 показано, что величина Etot увеличи-
Etot, a.e.
вается с уменьшением расстояния RC1C1' и RC1C2',
0.8 1.1 1.4 1.7
2 2.3 2.6 2.9 3.2 3.5
–1464.56
что свидетельствует о невозможности такого вза-
имодействия в рамках принятых предположений.
-1464.59
Зависимости величин Etot от координат RC1C3',
-1464.62
RC1C4', RC1C5' в рассматриваемом интервале рас-
-1464.65
стояний имеют экстремум, что указывает на обра-
-1464.68
зование переходного состояния в области ~2.00 Å.
-1464.71
Для установления структуры образующегося
-1464.74
переходного состояния рассмотрим изменение
-1464.77
плотности неспаренного электрона pi на атомах
-1464.80
реагирующей системы, зависимости которой от
Рис. 1. Зависимости полной энергии Еtot реагирующей
RC1C3', RC1C4', RC1C5’ представлены на рис. 2, а-c.
системы от координаты реакции RCC при димеризации
При уменьшении RC1С3', RC1С4' и RC1С5' от 2.50
радикала 1
до 1.50 Å происходит уменьшение суммарной
одноэлектронного переноса, который реализуется
плотности неспаренного электрона до нуля на
в интервале расстояний 2.50-1.50 Å реагирующих
одной половине образующегося димера и увели-
чение суммарной плотности неспаренного элек-
атомов. Состоявшееся качественное изменение
трона на другой (атомы С1'-C7'). Представленные
электронной структуры реагирующей системы в
результаты можно интерпретировать, как процесс
переходном состоянии создает условия для реком-
(a)
(b)
pi, a.e.
pi, a.e.
pC1
pC1
0.75
0.75
0.65
pC3
pC2
0.65
0.55
0.55
0.45
pC4
pC5
0.35
0.45
0.25
0.35
0.15
pC6
pC7
0.25
0.05
-0.05
0.15
1.65
1.85
2.05
2.25
RC1
3', Å
C
-0.15
1.45
1.65
1.85
2.05
2.25
2.45
RC1
4', Å
C
(c)
pi, a.e.
0.75
pC1'
0.65
0.55
pC2'
0.45
0.35
pC4'
0.25
0.15
pC6'
0.05
-0.05
1.65
1.85
2.05
2.25
R
C
1C5', Å
–0.15
Рис. 2. Зависимости величин спиновой плотности pi атомов от координаты реакции: (а) - RC1С3'; (b) - RC1С4'; (с) - RC1С5'
при димеризации радикала 1
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
478
ТОМИЛИН и др.
(a)
(b)
N(C1'-C2'), a.e., R(C1'-C2'), Å
N(C1'-C2'), a.e., R(C1'-C2'), Å
1.8
N(C1'-C2') M = 3
1.55
N(C1'-C2') M = 3
1.7
1.45
1.6
N(C1'-C2') M = 1
1.5
N(C1'-C2') M = 1
1.35
1.4
1.25
1.3
R(C1'-C2') M = 3
R(C1'-C2') M = 3
1.15
1.2
1.1
1.05
R(C1'-C2') M = 1
1
R(C1'-C2') M = 1
0.95
0.9
0.8
0.85
1.45
1.95
2.45
RC1C3', Å
1.45
1.95
2.45
RC1C4', Å
Рис. 3. Зависимости порядка связи N(C1'-C2') и длины связи R(C1'-C2') для М = 3 и М = 1 от координаты реакции: (а) -
RC1С3'; (b) - RC1С4' при димеризации радикала 1
бинации неспаренных электронов с образованием
1.7 Å рассчитывались для триплетного состояния
синглетного электронного состояния реагирую-
(М = 3) и в интервале 1.7-1.4 Å для синглетного со-
щей системы, что должно найти отражение в элек-
стояния (М = 1). Зависимости величин N(C1'-C2')
тронных и структурных характеристиках.
и R(C1'-C2') по координате RC1С5' аналогичны за-
висимостям по координате RC1С3'.
Важнейший результат одноэлектронного пе-
реноса - образование двойной связи С1'-С2' при
Таким образом, структура переходного состоя-
ния при димеризации радикала 1 с учетом перено-
димеризации радикала 1 по координатам RC1С3'
са электрона может быть представлена на схеме 4.
и RC1С5', в отличие от RC1С4'. Об этом свидетель-
ствуют зависимости порядка связи N(C1'-C2') и
Образующиеся переходные состояния в этом
длины связи R(C1'-C2') от изменения координаты
случае имеют иное распределение эффективных
реакции RC1С3' и RC1С4', представленные на рис. 3.
зарядов на атомах в реакционной области. На схе-
Указанные характеристики в интервале RCС = 2.5-
ме 5 приведено распределение величин qi (а.е.з.)
Схема 4
–
e
Ph3C
+
CPh3
Ph3C
Ph3C
H
Ph2C
Ph2C
–
Ph3C
+
CPh3
Ph3C
Ph3C
H
CPh2
CPh2
e-
Ph3C
+
CPh3
Ph3C
CPh2
Ph3C
CPh2
H
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
О МЕХАНИЗМЕ ДИМЕРИЗАЦИИ СТАБИЛЬНЫХ ОРГАНИЧЕСКИХ РАДИКАЛОВ
479
Схема 5
+0.07
-0.09
-0.12
Ph2C
CPh2
(+0.08)
(-0.06)
(-0.10)
+0.11
+0.06
+0.10
-0.24
-0.23
–0.20
+0.11
-0.14
+0.09
–0.16
+0.06
–0.16
CPh
(-0.30)
(-0.30)
(-0.26)
2
+0.09
+0.11
+0.09
–0.12
-0.12
-0.12
(-0.11)
(-0.10)
(-0.09)
на атомах реакционной области для М = 1 при
15] с образованием несимметричных неустойчи-
значении координаты реакции RСC =1.7 Å, в скоб-
вых димеров 5 и 6, выступающих промежуточны-
ках - при значении 1.4 Å.
ми продуктами в реакциях синтезап- и о-семидио-
нов и их полимеров [4, 16, 17] (схема 6).
Кулоновское взаимодействие атомов реакцион-
ной области в процессе димеризации после пере-
Аналогичное поведение проявляют радика-
носа электрона (RСC = 1.4 Å) похоже на взаимо-
лы, димеры которых представлены ниже [18-20]
действие в начальной стадии (RСC = 1.7 Å), однако
(схема 7).
величины эффективных зарядов становятся ины-
Как и в случае радикала 1, величины эффек-
ми в бензольном кольце, которое взаимодействует
тивных зарядов на реагирующих атомах радикала
с третичным атомом углерода.
2 так же имеют отрицательные знаки, причем за-
Для учета совокупного кулоновского взаимо-
ряд на атоме азота имеет существенную величину
действия также были вычислены зависимости
(qN = -0.5 а.е.з.). Таким образом, эффективные за-
полной энергии энергия Еtot реагирующей систе-
ряды на атомах, образующих связь C-N при диме-
мы в синглетном состоянии от координаты реак-
ризации, предполагают отталкивание одноимен-
ции RCС, которое изменяется в интервале 2.0-
ных зарядов. Расширение реакционной области,
1.4 Å с шагом 0.07 Å (рис. 4). Кроме того, на пред-
представленной на схеме 8 (RNC = 3.0 Å), также
ставленные зависимости наложены зависимости
не предполагает димеризации благодаря кулонов-
величин Еtot, найденные для М = 3 в интервале
скому взаимодействию между реагирующими ато-
RCС = 2.5-1.5 Å.
мами.
Как следует из рис. 4, образование промежу-
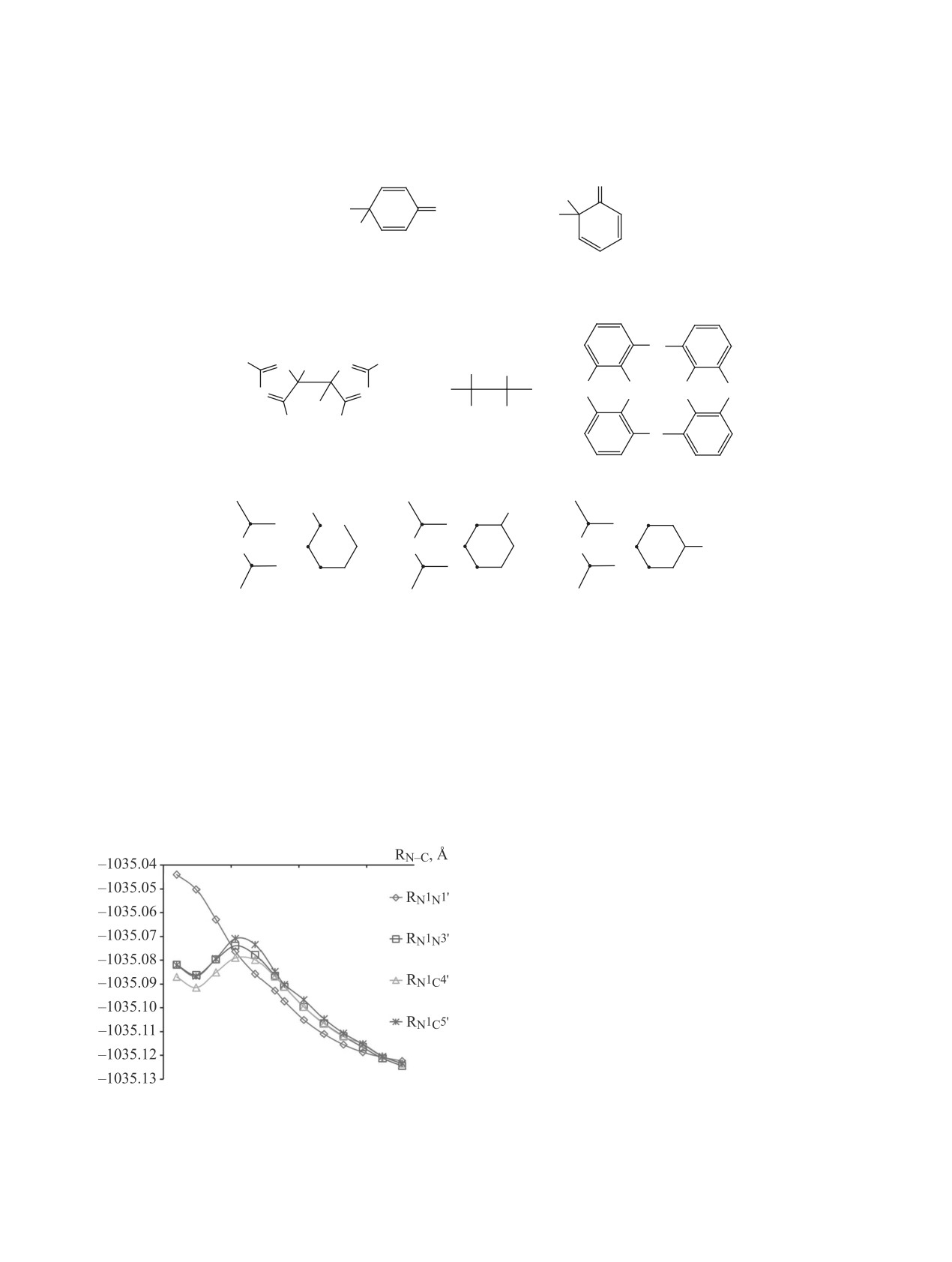
На рис. 5 представлены зависимости Еtot от RNN
точного соединения и его димера энергетически
и RNC для взаимодействий N1-N1', N1-C3', N1-C4',
более выгодно при несимметричной димеризации
в пара-положение бензольного кольца радикала 1.
Etot, a.e.
Это результат полностью соответствует экспери-
1.35
1.55
1.75
1.95
2.15 2.35 2.55
ментальным данным [11].
–1464.68
Представленный выше подход исследования
динамики изменения электронных характеристик
-1464.70
в процессе реакции димеризации органических
-1464.72
радикальных систем позволяет удовлетворительно
-1464.74
качественно интерпретировать механизм димери-
зации на основе только фундаментального физи-
-1464.76
ческого взаимодействия - кулоновского взаимо-
-1464.78
действия эффективных зарядов атомов молекулы.
-1464.80
Симметричный димер радикала 2 - тетрафе-
нилгидразин получают окислением дифениламина
Рис. 4. Зависимости полной энергии Еtot реагирую-
щей системы от координаты реакции RСС в интервале
KMnO4 в ацетоне [13]. В то же время тетрафенил-
2.5-1.5 Å для М=3(светлые знаки) и в интервале 2.0-
гидразин способен к диссоциации при нагревании
1.4 Å для М = 1 (затемненные знаки) при димеризации
в апротонных малополярных растворителях [14,
радикала 1
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
480
ТОМИЛИН и др.
Схема 6
NPh
H
NPh
NPh
2
NPh2
H
5
6
Схема 7
Ph
N
Ph N
Ph
CN
CN
Ph
Ph
CH CH
N
N
Ph
CN CN
Ph Ph
Схема 8
PhN
NPh
+0.13
-0.11
-0.16
+0.16
+0.15
+0.15
N
-0.52
-0.12
N-0.49
-0.14
N-0.49
-0.11
NPh
+0.17
+0.16
+0.15
-0.16
-0.13
-0.16
N1-C5' при димеризации радикала 2 в триплетном
1.8-1.9 Å, что свидетельствует об образовании пе-
состоянии (М = 3). Координаты реакции RNN и
реходного состояния с существенным изменением
RNC изменялись в интервале 3.00-1.40 Å с шагом
электронного состояния реагирующей системы.
0.07 Å.
Для установления структуры переходного со-
Как следует из рис. 5, происходит увеличение
стояния рассмотрим изменение плотности не-
величины Еtot с уменьшением расстояния R, что
спаренного электрона рi на атомах реагирующих
соответствует реализуемым кулоновским взаимо-
систем в зависимости от RN1C3', RN1C4', RN1C5'
действиям атомов реакционной области, представ-
(рис. 6).
ленным на схеме 8. Однако, зависимости Еtot от
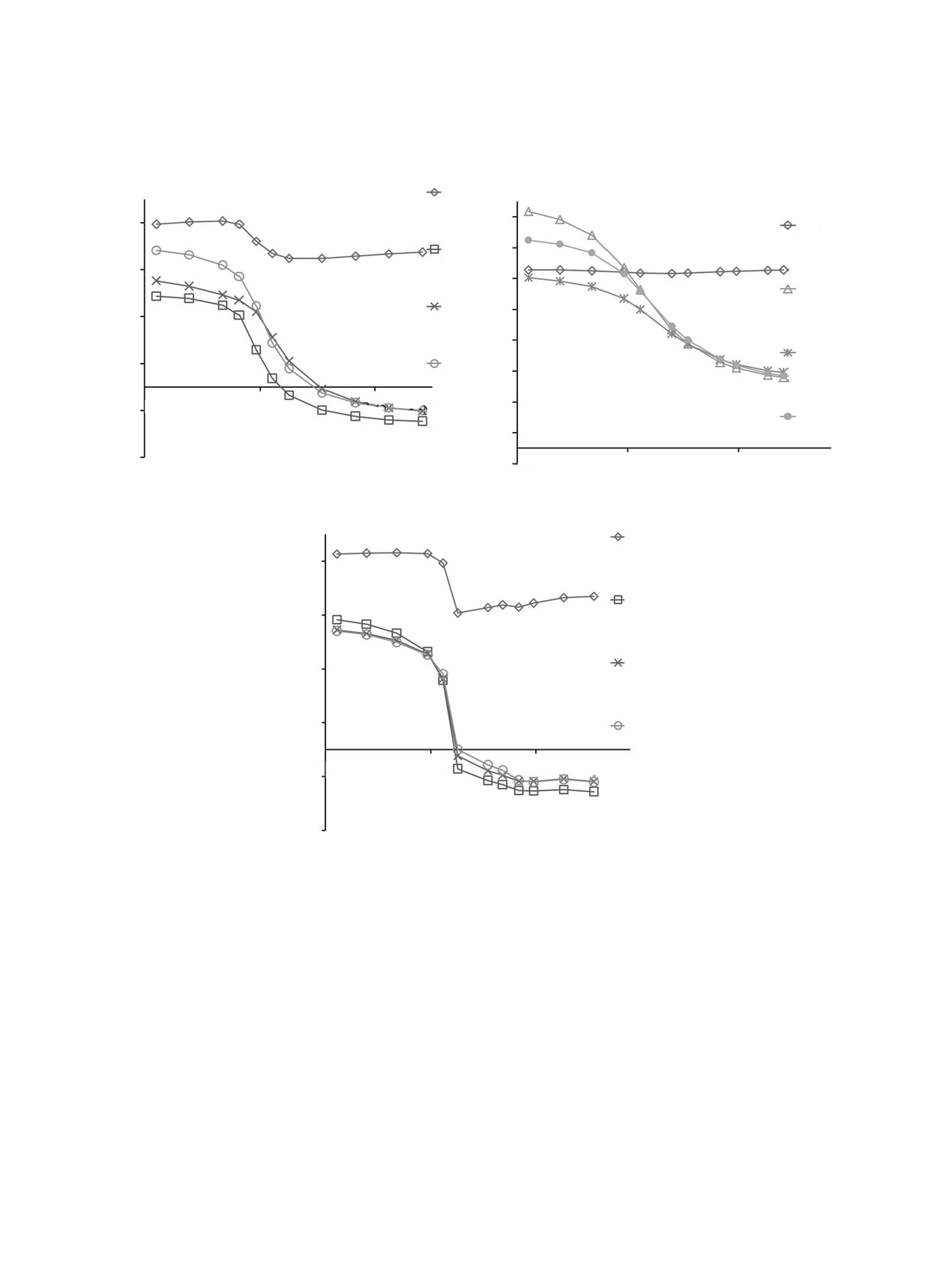
При уменьшении величины RNС до 1.5 Å про-
RN1C3', RN1C4', RN1C5' имеют экстремумы в области
исходит уменьшение до нуля плотности неспарен-
Etot, a.e.
ного электрона, локализованной на атомах первой
1.8
2.3
2.8
половины димера независимо от направления ди-
меризации. В то же время наблюдается увеличе-
ние плотности неспаренного электрона на атомах
второй половины димера. Более существенное
увеличение плотности неспаренного электрона
происходит на атомах С2', C4', C6' при димеризации
по связям N1-С3' и N1-С5', на атомах C3', C5', C7'
при димеризации по связи N1-С4'.
Представленные выше результаты можно ин-
терпретировать как одноэлектронный перенос от
одного взаимодействующего радикала к другому,
Рис. 5. Зависимости полной энергии Еtot реагирующей
который реализуется в интервале изменения вели-
системы от координат реакции RNN и RNC при димери-
зации радикала 2
чины RNС, равной 2.00-1.50 Å. Изменение элек-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
О МЕХАНИЗМЕ ДИМЕРИЗАЦИИ СТАБИЛЬНЫХ ОРГАНИЧЕСКИХ РАДИКАЛОВ
481
(a)
(b)
pi, a.e.
pi, a.e.
pN1'
0.75
0.7
pN1'
pC2'
0.65
0.5
0.55
pC3'
pC4'
0.45
0.3
0.35
pC5'
0.1
pC6'
0.25
1.85
2.35
RN1-C3', Å
0.15
-0.1
pC7'
0.05
–0.3
-0.05
1.85
2.35
RN1-C4', Å
(c)
pi, a.e.
pN1'
0.7
pC2'
0.5
pC4'
0.3
0.1
pC6'
1.85
2.35
RN1-C5', Å
–0.1
–0.3
Рис. 6. Зависимости величин плотности неспаренного электрона атомов рi от координаты реакции: (а) - RN1C3'; (b) - RN1C4';
(с) - RN1C5' при димеризации радикала 2
тронного состояния промежуточного соединения
3.0-1.7 Å для триплетного состояния (М = 3) и в
создает условия для рекомбинации неспаренных
интервале 1.7-1.4 Å для синглетного состояния
электронов с образованием синглетного электрон-
(М = 1) (рис. 7).Зависимости величин N(N1'-C2') и
ного состояния (М = 1) реагирующей системы,
R(N1'-C2') по координате RN1С5' аналогичнызави-
приводящей к изменению электронных и струк-
симостям по координате RN1С3. Как видно из по-
турных характеристик в промежуточном соедине-
лученных результатов, одноэлектронный перенос
нии.
приводит к образованию двойной связи N1'-C2'
при димеризации радикала 2 по координате реак-
Для исследования изменения электронных и
ции RN1C3' и RN1C5'.
структурных характеристик в промежуточном
состоянии вычислим зависимости порядка связи
Таким образом, структура переходного состоя-
N(N1'-C2') и длины связи R(N1'-C2') от изменения
ния при димеризации радикала 2 с учетом перено-
координаты реакции RN1C3' и RN1C4' в интервале
са электрона может быть представлена на схеме 9.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
482
ТОМИЛИН и др.
(a)
(b)
N(C
1'-C2'), a.e., R(C1'-C2'), Å
N(C1'-C2'), a.e., R(C1'-C2'
), Å
1.7
1.55
N(N1'-C2') M = 3
N(N1'-C2') M = 3
1.6
1.50
1.45
1.5
N(N1'-C2') M = 1
N(N1'-C2') M = 1
1.40
1.4
1.35
1.3
1.30
R(N1'-C2') M = 3
R(N1'-C2') M = 3
1.2
1.25
1.1
1.20
R(N1'-C2') M = 1
R(N1'-C2') M = 1
1.0
1.15
0.9
1.10
1.3
1.8
2.3
2.8
RN1C3', Å
1.3
1.8
2.3
2.8
RN1C4', Å
Рис. 7. Зависимости порядка связи N(N1'-C2') и длины связи R(N1'-C2') для М = 3 и М = 1 от координаты реакции: (а) -
RN1C3'; (b) - RN1C4' при димеризации радикала 2
Естественно, что образующиеся переходные
щей системы при значении координаты реакции
состояния имеют иное распределение эффектив-
RNC = 2.0 Å, в скобках - при значении 1.4 Å.
ных зарядов в реакционной области. На схеме 10
Сравнивая данные, представленные на схемах
представлено распределение величин qi (а.е.з) на
8 и 10, можно видеть, что распределение эффек-
атомах реакционной области взаимодействующих
тивных зарядов на атомах реакционной области
радикалов для синглетного состояния реагирую-
изменилось в результате состоявшегося одноэлек-
Схема 9
–
e
Ph2N
+
NPh2
Ph2N
Ph2N
H
PhN
PhN
–
e
Ph2N
+
NPh2
Ph2N
Ph2N
H
NPh
NPh
e-
Ph2N
+
NPh2
Ph2N
NPh
Ph2N
NPh
H
Схема 10
+0.15
-0.11
PhN
NPh
+0.14
(+0.17)
(-0.01)
+0.24
-0.12
+0.20
(+0.19)
(+0.32)
–0.54
-0.73
-0.01
–0.57
N
-0.07
N
N
-0.09
NPh
(-0.70)
(-0.77)
(-0.08)
(-0.73)
+0.24
+0.16
+0.33
(+0.33)
-0.11
-0.13
(+0.22)
–0.12
(-0.08)
(-0.10)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
О МЕХАНИЗМЕ ДИМЕРИЗАЦИИ СТАБИЛЬНЫХ ОРГАНИЧЕСКИХ РАДИКАЛОВ
483
тронного переноса. Эти изменения создают более
Etot, a.e.
1.8
2.3
благоприятное распределение эффективных заря-
дов для кулоновского взаимодействия в реакцион-
ной области при димеризации по связям N1-С3' и
N1-С5'.
Для учета совокупного кулоновского взаимо-
действия были вычислены зависимости полной
энергии Еtot реагирующей системы в синглетном
состоянии от координаты реакции RNC, которая из-
меняется в интервале 2.00-1.40 Å с шагом 0.07 Å
(рис. 8). Кроме того, на зависимости Еtot от RNC
наложены зависимости Еtot, найденные для три-
Рис. 8. Зависимости полной энергии Еtot реагирую-
плетного состояния реагирующей системы в ин-
щей системы от координаты реакции RNC в интерва-
тервале RNC = 2.5-1.5 Å.
ле 2.5-1.5 Å для М = 3 (светлые знаки) и в интервале
2.00-1.40 Å для М = 1 (затемненные знаки) при диме-
Как следует из рис. 8, значения Etot при обра-
ризации радикала 2
зовании промежуточных состояний и их димеров
при несимметричной димеризации в п- и о-поло-
полученные результаты показали, что распреде-
жения бензольного кольца радикала 2 - сопостави-
ление эффективных зарядов на атомах радикалов
мые величины. Полученные результаты соответ-
чувствительно к внешним воздействиям. Можно
ствуют экспериментальным данным [16-18].
предположить, что в высокополярных средах про-
исходит существенное изменение распределения
ВЫВОДЫ
эффективных зарядов на атомах реакционной об-
Несимметричная димеризация стабильных
ласти, которое обеспечивает реализацию кулонов-
органических радикалов обеспечивается куло-
ского взаимодействия, приводящего к образова-
новским взаимодействием эффективных зарядов
нию симметричных димеров.
атомов, которое усиливается переносом элек-
КОНФЛИКТ ИНТЕРЕСОВ
трона от атома-донора одного радикала к ато-
му-акцептору другого радикала. Существование
Авторы заявляют об отсутствии конфликта ин-
одноэлектронного переноса, как необходимого
тересов.
естественного процесса при несимметричной ди-
СПИСОК ЛИТЕРАТУРЫ
меризации, позволяет понять роль природы рас-
творителя при взаимодействии радикалов между
1. Худяков И.В., Левин П.П., Кузьмин В.А. Усп. хим.
собой.
1980, 49, 1990-2031. [Khudyakov I.V., Levin P.P.,
Kuz’min V.A. Russ. Chem. Rev. 1980, 49, 982-1002.]
Одноэлектронный перенос представляет со-
doi 10.1070/RC1980v049n10ABEH002523
бой квантовый эффект преодоления дуальной ча-
2. Танасейчук Б.С. ЖОрХ.
2004,
40,
629-632.
стицей потенциального барьера. Существенное
[Tanaseichuk B.S. Russ. J. Org. Chem. 2004, 40, 603-
изменение полярности растворителя также суще-
606.] doi 10.1023/B:RUJO.0000036094.21048.63
ственно изменяет характеристики потенциально-
3. Розанцев Э.Г., Шолле В.Д. Органическая химия
го барьера, коэффициент прозрачности которого
свободных радикалов. М.: Химия, 1979.
весьма мал в высокополярных средах. Поэтому в
4. Welzel P., Dietz C., Echardt G. Chem. Ber. 1975, 108,
полярных средах несимметричная димеризация
3550-3565. doi 10.1002/cber.19751081117
радикалов отсутствует из-за маловероятного про-
5. Musso H. Chem. Ber. 1959, 92, 2881-2886. doi
текания одноэлектронного переноса.
10.1002/cber.19590921134
Естественно, что при симметричной димери-
6. Томилин О.Б., Танасейчук Б.С., Бояркина О.В.
зации одноэлектронный перенос не происходит,
ЖОрХ. 2016, 52, 1584-1593. [Tomilin O.B., Tanasei-
так как невозможно выделить на координате ре-
chuk B.S., Boyarkina O.V. Russ. J. Org. Chem. 2016,
акции атом-донор и атом-акцептор. В то же время
52, 1576-1586.] doi 10.1134/S1070428016110051
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
484
ТОМИЛИН и др.
7. Томилин О.Б., Бояркина О.В., Танасейчук Б.С.
14. Cain C.K., Wisclogle F.Y. J. Am. Chem. Soc. 1940, 62,
ЖОрХ. 2020, 56, 1813-1823. [Tomilin O.B., Boyarki-
1163-1169. doi 10.1021/ja01862a050
na O.V., Tanaseichuk B.S. Russ. J. Org. Chem. 2020,
15. Танасейчук Б.С., Живечкова Л.А., Ермишов А.Ю.
56, 2049-2056.] doi 10.1134/S1070428020120015
ЖОрХ. 1972, 8, 758-760.
8. Stephens P.J., Devlin F.J., Chablowski C.F., Frisch M.J.
16. Welzel P., Günter L., Eckhardt G. Chem. Ber. 1974,
J. Phys. Chem. 1994, 98, 11623-11627. doi 10.1021/
j100096a001
107, 3624-3639. doi 10.1002/cber.19741071116
9. Hehre W.J., Ditchfield R., Pople J.A. J. Chem. Phys.
17. Wieland Н. Lieb. Ann. 1911, 381, 200-216. doi
1972, 56, 2257-2261. doi 10.1063/1.1677527
10.1002/jlac.19113810203
10. Neese F. Wiley Interdiscip. Rev. Comput. Mol. Sci.
18. White D.M., Sonnenberg J. J. Am. Chem. Soc. 1966,
2012, 2, 73-78. doi 10.1002/wcms.81
88, 3825-3829. doi 10.1021/ja00968a027
11. Takeuchi H., Nagai T., Tokura N. Bull. Chem. Soc. Jap.
19. Hartzler H.D. J. Org. Chem. 1966, 31, 2654-2658. doi
1971, 44, 753-756. doi 10.1246/bcsj.44.753
10.1021/jo01346a047
12. Conant J B., Small L.F., Taulor B.S. J. Am. Chem. Soc.
1925, 47, 1959-1974. doi 10.1021/ja01684a026
20. Lankamp H., Nauta W.Th., MacLean C. Tetrahedron
13. Гаттерман Л., Виланд Г. Практические работы по
Lett.
1968,
9,
249-254. doi
10.1016/S0040-
органической химии. М.: ГХН, 1948.
4039(00)75598-5
About the Mechanism of Dimerization
of Stable Organic Radicals
O. B. Tomilin*, O. V. Boyarkina**, and B. S. Tanaseichuk
Mordovian State University, ul. Bolshevistskaya, 68, Saransk, 430005 Russia
e-mail: *tomilinob@mail.ru; **boyarkinaov@mail.ru
Received January 14, 2021; revised January 23, 2021; accepted January 24, 2021
In the case of asymmetric dimerization of triphenylmethyl and diarylaminyl radicals, the dynamics of the change
in the density distribution of an unpaired electron versus the reaction coordinate corresponds to one-electron
transfer from an atom that is a formal carrier of an unpaired electron to the benzene ring. The regularities of
the formation of dimerization products are determined by the Coulomb interaction of effective charges on the
atoms of the reacting system. In polar media, the transparency coeffcient of the potential barrier to one-electron
transfer decreases, which determines the absence of asymmetric dimerization of radicals.
Keywords: stable organic radicals, asymmetric dimerization, one-electron transfer, Coulomb interaction, re-
action coordinate
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021