ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 4, с. 497-506
УДК 547.717
ОСОБЕННОСТИ НУКЛЕОФИЛЬНОГО РАСКРЫТИЯ
ОКСИРАНОВОГО ЦИКЛА АНИОНАМИ
ТЕТРААЛКИЛАММОНИЕВЫХ СОЛЕЙ
В ПРИСУТСТВИИ ПРОТОНОДОНОРОВ
© 2021 г. С. Г. Бахтинa,*, Е. Н. Шведb, М. А. Синельниковаa, Ю. Н. Беспалькоc
a ГОУ ВПО «Донецкий национальный университет», Украина, 283001 Донецк, ул. Университетская, 24
b Донецкий национальный университет им. Васыля Стуса,
Украина, 21021 Винница, ул. 600-Летия, 21
c Katholieke Universiteit Leuven (KU Leuven), Oude Markt 13, Leuven, 3000 Belgium
*e-mail: s.bahtin@donnu.ru
Поступила в редакцию 14.01.2021 г.
После доработки 26.01.2021 г.
Принята к публикации 27.01.2021 г.
Кинетическими и спектральными (УФ) методами исследованы особенности свойств солей тетраал-
киламмония в реакции нуклеофильного раскрытия оксиранового цикла в системе «эпихлоргидрин
(ЭХГ) - протонодонор - [(C2H5)4]NX» (протонодонор: бензойная кислота, 4-нитрофенол; Х: бензоат,
нитрат). Установлен порядок реакции: по тетраалкиламмониевым солям - первый, по бензойной кисло-
те - нулевой, по 4-нитрофенолу - меньше нуля. На основании мониторинга накопления образующегося в
системе «ЭХГ - 4-нитрофенол - [(C2H5)4N]X» 4-нитрофенолят-аниона при варьировании концентрации
как исходной тетраалкиламмониевой соли, так и самого протонодонора - 4-нитрофенола - детализирован
механизм нуклеофильного раскрытия оксиранового цикла. Установлено, что имеет место необратимое
расходование аниона исходной тетраалкиламмониевой соли за счет его атаки на оксирановый цикл при
участии протонодонорного реагента, приводящее к генерированию 4-нитрофенолята тетраэтиламмо-
ния, который катализирует последующее образование продукта реакции. Увеличение концентрации
4-нитрофенола снижает скорость образования как 4-нитрофенолят-аниона, так и реакции в целом, что
соответствует механизму катализа, когда осуществляется нуклеофильная атака анионом соли на элек-
трофильно неактивированный протонодонором оксирановый цикл.
Ключевые слова: оксиран, тетраалкиламмониевая соль, катализ нуклеофилами, протонодонорный
реагент, механизм катализа
DOI: 10.31857/S0514749221040042
ВВЕДЕНИЕ
ние заслуживает эпихлоргидрин [ЭХГ, 2-(хлор-
метил)оксиран]. Его реакции с различными реа-
Раскрытие оксиранового цикла протонодонор-
гентами НА (спиртами, фенолами, карбоновыми
ными реагентами НА (схема 1) принадлежит к
кислотами, аминами) приводят к образованию
числу фундаментальных органических реакций,
ациклических продуктов оксиалкилирования, все
получивших широкое применение в процессах
производства материалов для покрытий [1, 2], кле-
3 атома углерода которых содержат функциональ-
ев, герметиков, эпоксидных смол [3], композитных
ную группу (схема 1), что позволяет активно их
матриц [4], красителей [5], растворителей [6], ле-
использовать в тонком органическом синтезе для
карственных препаратов, биологически активных
получения разнообразных полифункциональных
соединений [7]. Среди оксиранов особое внима-
соединений.
497
498
БАХТИН и др.
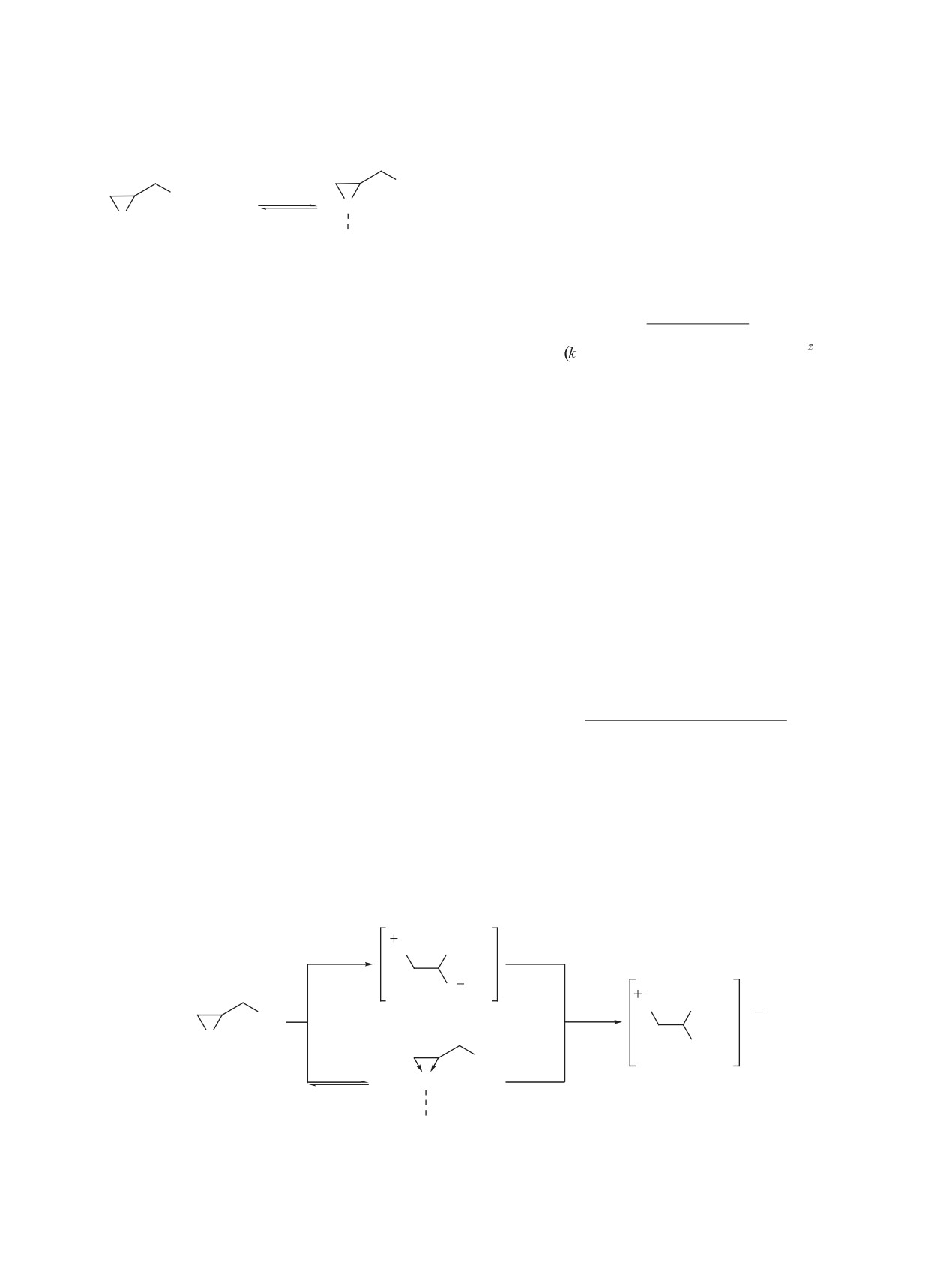
Схема 1
cat
Cl
A
Cl
Cl
+
HA
+ HO
O
OH
A
А - анион любого протонодонорного реагента НА
Скорость некаталитических реакций оксиал-
ным образованием тетраалкиламмониевой соли
килирования реагентов HA обычно относительно
(схема 3) [22-25, 27].
низка [8]. Успехи синтетической химии оксиранов
Интермедиаты, полученные в обоих случаях,
во многом обусловлены применением специаль-
когда В действует как основание или как нукле-
ных катализаторов. В частности, реакция, пред-
офил, содержат в своем составе реакционноспо-
ставленная схемой 1, катализируется различными
собный нуклеофил A-, что приводит далее к об-
классами органических и неорганических осно-
разованию конечных продуктов раскрытия цикла
ваний (B): третичными аминами жирного [9] и
ЭХГ под действием HА (схема 1). Результаты на-
жирноароматического [10] рядов, гетероцикли-
ших предыдущих работ, проведенных с помощью
ческими аминами [11], соединениями типа MPh3
комплекса кинетических методов исследования
(M = P [12], Sb [13]), солями щелочных и щелоч-
реакционных систем «эпихлоргидрин - карбоно-
ноземельных металлов [14], четвертичными ам-
вая кислота - третичный амин», свидетельствуют
мониевыми солями [15]. Одни из наиболее эффек-
о том, что в реакции раскрытия цикла ЭХГ ре-
тивных катализаторов, обеспечивающих высокую
агентами HA в присутствии органических осно-
региоселективность раскрытия эпоксидного цикла
ваний R3Y (Y = N, P) каталитическая активность
[16, 17] - третичные амины и тетраалкиламмоние-
последних определяется в большей степени их ну-
вые соли, которые в ходе реакции способны гене-
клеофильностью, а не основностью [26, 27]. Более
рировать из протонодонора реакционноспособные
того, установлено постепенное необратимое рас-
нуклеофильные частицы A-.
ходование R3Y [28, 29], которое может соответ-
ствовать только его участию в реакции кватерни-
Для объяснения каталитического действия ос-
зации эпихлоргидрином (схема 3) с образованием
нований B в литературе предложено несколько
[R3YCH2CH(OH)CH2Cl]+A-, обеспечивающей ге-
механизмов реакции, принципиальное различие
нерирование A-.
которых заключается в роли, приписываемой B:
основание (общеосновный механизм [18-21]) или
Вместе с тем реакция кватернизации (схема 3)
нуклеофил (нуклеофильный механизм [22-25], ме-
не может считаться элементарной, так как в таком
ханизм переноса аниона нуклеофильного реагента
виде она - тримолекуляра и должна иметь кинети-
ионной парой [26, 27]). Когда B проявляет свой-
ческий порядок реакции по реагенту НА первый,
ства основания, то первоначально происходит его
что не соответствует экспериментальным данным
взаимодействие с протонодонорным кислотным
[30]. Это ограничение потребовало выяснения
реагентом HA и образуется интермедиат, суще-
природы электрофильной компоненты - свободно-
ствующий как комплекс с водородной связью или
го или активированного протонодонором оксирана
ионная пара (схема 2) [18-21].
(схема 4).
В случае, когда В проявляет свойства нуклео-
Наличие данного равновесия делает возмож-
фила, предполагается первоначальное его взаимо-
ным существование двух путей раскрытия окси-
действие с субстратом (оксираном) с промежуточ-
ранового цикла под действием присутствующих в
Схема 2
Схема 3
+δ
-δ
+
B
+ HA
B HA
[BH]
Cl
B
X
+
+
HA
В (base) - любое основание Льюиса
O
OH
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
ОСОБЕННОСТИ НУКЛЕОФИЛЬНОГО Р
АСКРЫТИЯ ОКСИРАНОВОГО ЦИКЛА
499
Схема 4
на основании экспериментальных данных, по-
лученных по кинетической методике I (расходо-
Cl
Cl
вание карбоновой кислоты, см. эксперименталь-
+
HA
O
ную часть). Так, уравнение скорости суммарной
O
HA
реакции бензойной кислоты с ЭХГ при катализе
[(C2H5)4N]C6H5COO или [(C2H5)4N]NO3 описыва-
ется выражением:
системе нуклеофилов (схема 5), которые различа-
ются последовательностью стадий протонирова-
d[C
H
COOH]
6
5
r
=
−
=
ния оксирана и атаки нуклеофилом.
dt
x
y
+k [cat]
)[ЭХГ]
[C H
COOH
]
,
(1)
На примере системы «эпихлоргидрин - карбо-
non cat
6
5
новая кислота - третичный амин» ранее нами было
где knon и kcat - константы скорости некаталитиче-
показано, что R3N (B) атакует только электрофиль-
ской и каталитической реакции, соответственно;
но активированный оксирановый цикл (путь II,
kobs = knon + kcat[cat]x - наблюдаемая константа ско-
схема 5). Для дальнейшей детализации механизма
рости.
реакции необходимо изучение свойств анионов те-
траалкиламмониевых солей (cat = [R4N]X, B = X-),
Кинетические кривые расходования бензойной
которые или изначально вводятся в систему в роли
кислоты ([C6H5COOH], моль/л), полученные при
катализаторов, или образуются из третичных ами-
различных начальных концентрациях солей - ли-
нов (cat = R3N) по реакции из схемы 3. Объектом
нейны в координатах [C6H5COOH] - t (рис. 1). Это
настоящего исследования выбрана реакционная
указывает на нулевой порядок реакции по карбо-
новой кислоте (z = 0).
система «эпихлоргидрин - протонодонорный ре-
агент HA - [(C2H5)4N]X», где протонодонор - бен-
С учетом найденного нулевого порядка реак-
зойная кислота или 4-нитрофенол, X- - бензоат
ции по C6H5COОН и избытка оксирана (псевдо-
или нитрат-анионы. Исследования проводили при
порядок по ЭХГ, y = 1) наблюдаемые константы
помощи кинетических методов, потенциометри-
скорости рассчитывали по уравнению:
ческого кислотно-основного титрования прото-
[C
6
H
5
COOH]
0
−[C
6
H
5
COOH]
нодонорного реагента, УФ-спектроскопического
,
k
obs
=
(2)
[ЭХГ]
t
мониторинга свойств аниона А-.
0
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
где [C6H5COOH]0 и [ЭХГ]0 - начальная концен-
трация кислоты и оксирана (12.5 моль/л), соответ-
Первоначальный этап исследования - установ-
ственно; t - время реакции, с.
ление кинетических закономерностей суммарной
реакции раскрытия цикла ЭХГ бензойной кисло-
Сопоставление наблюдаемых констант скоро-
той в присутствии тетраалкиламмониевых солей
сти реакции ЭХГ с бензойной кислотой и началь-
Схема 5
путь I
B
CH2Cl
B
HA
O
B
CH2Cl
+
Cl
δ1+
δ
A
2
O
OH
+
Cl
+
δ'1+
δ'2
δ'1+
>δ1
HA
B
O
+
+
δ'2
>δ2
путь II
HA
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
500
БАХТИН и др.
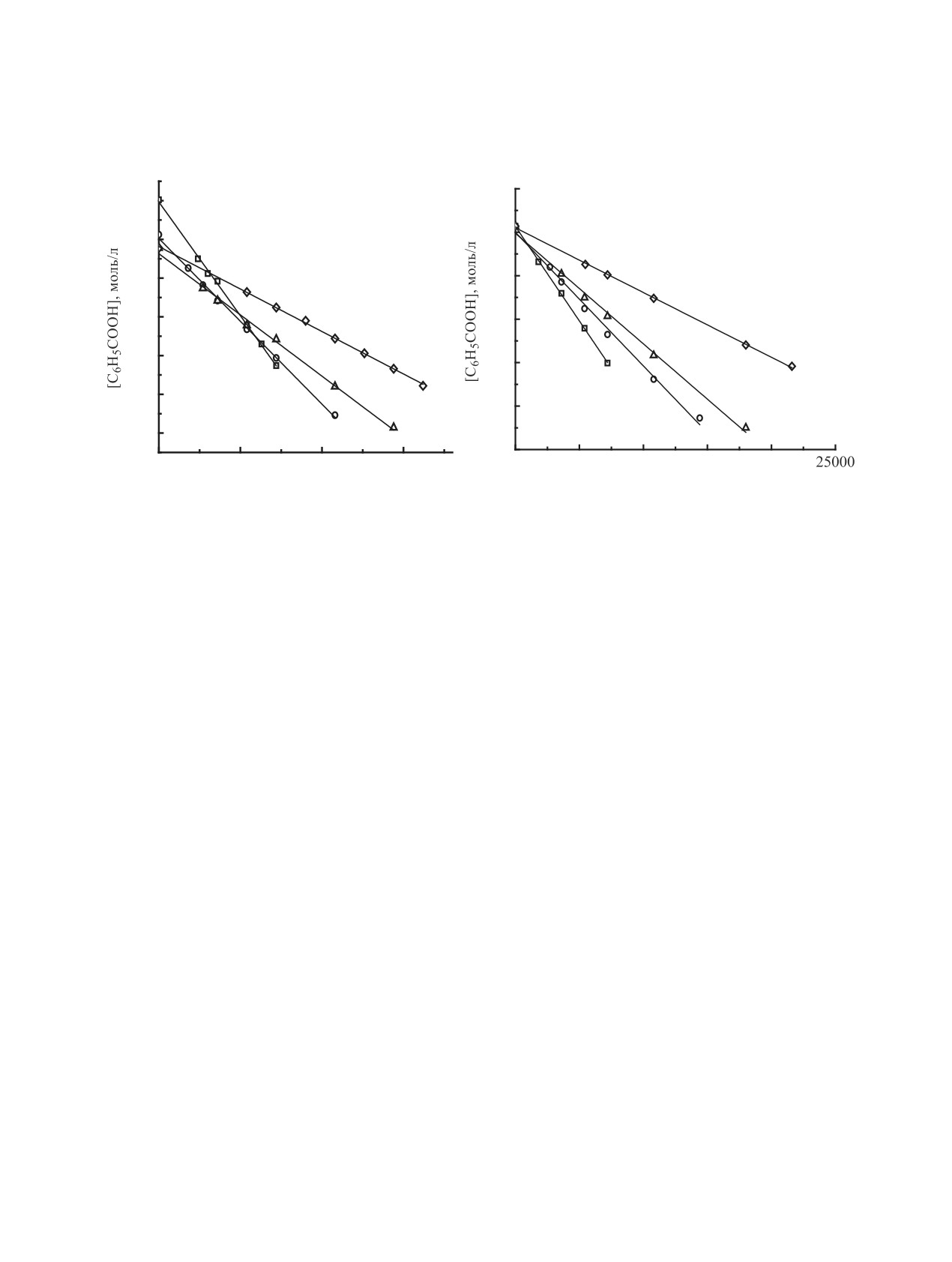
(a)
(b)
0.30
0.35
0.25
0.30
0.25
0.20
0.20
0.15
0.15
4
4
0.10
1
1
0.10
3
0.05
3
2
2
0.05
0.00
0
5000
10000
15000
0
5000
10000
15000
20000
t, с
t, с
Рис. 1. Кинетические кривые расходования бензойной кислоты в реакции с ЭХГ при 60°C при катализе бензоатом (a) и
нитратом (b) тетраэтиламмония; [cat], моль/л: 1 - 0.00500, 2 - 0.00375, 3 - 0.00250, 4 - 0.00125
ных концентраций катализатора показывает на-
раздо более высокой концентрации протонодонора
личие прямой зависимости как в случае бензоата
C6H5COOH, затруднительно.
(уравнение 3), так и нитрата (уравнение 4) тетра-
В то же время реализация схемы 3, когда В
этиламмония, что указывает на первый порядок
действует как нуклеофил, предполагает генериро-
реакции по соли:
вание аниона протонодонорного реагента за счет
kobs = (3.5±0.5)×10-7 + (4.2±0.2) ×10-4 [cat]
первоначального раскрытия цикла оксирана ани-
оном тетраалкиламмониевой соли (ЭХГ, по сути,
(r = 0.998),
(3)
выступает «посредником»). В связи с этим для
kobs = (3±1)×10-7 + (3.0±0.3) ×10-4 [cat]
раздельного определения поведения аниона соли
и реагента НА нами была исследована система
(r = 0.988).
(4)
«ЭХГ-ArOH-[(C2H5)4N]X», в которой в качестве
Из уравнений 3 и 4 видно, что knon << kcat. Таким
протонодонорного реагента выступает замещен-
образом, исследуемые соли - эффективные ката-
ный фенол (4-нитрофенол). В соответствии со
лизаторы раскрытия оксиранового цикла карбоно-
схемой 3 атака аниона Х- тетраалкиламмониевой
вой кислотой. Каталитическая константа скорости
соли на оксирановый цикл при участии ArOH при-
реакции, катализируемой бензоатом тетраэтилам-
водит к трансформации последнего в соответству-
мония (kcat = 4.2×10-4 л/моль с), несколько выше,
ющий анион ArO-. Образование фенолят-аниона
чем в случае соответствующего нитрата (kcat =
из фенола можно зафиксировать с помощью УФ-
3.0×10-4 л/моль с).
спектроскопии, так как при переходе ArOH в ArO-
происходят батохромный и гиперхромный сдвиги
Вместе с тем кинетическая методика I, как
за счет усиления сопряжения аниона O- с бензоль-
было отмечено выше, не предоставляет непосред-
ным ядром [31].
ственную информацию о свойствах самого ката-
лизатора - аниона соли - на начальной стадии ре-
Действительно, как показали результаты экспе-
акции, поскольку основана на измерении текущей
римента (рис. 2, для бензоата тетраэтиламмония),
концентрации кислотного реагента. Кроме того,
при добавлении растворов солей
[(C2H5)4N]X
определение концентрации именно C6H5COO-
в ЭХГ к раствору 4-нитрофенола в ЭХГ появляет-
(истинный катализатор), присутствующего в си-
ся новая полоса в длинноволновой области УФ-
стеме в каталитических количествах, на фоне го-
спектра (λ = 420 нм), что объясняется образова-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
ОСОБЕННОСТИ НУКЛЕОФИЛЬНОГО Р
АСКРЫТИЯ ОКСИРАНОВОГО ЦИКЛА
501
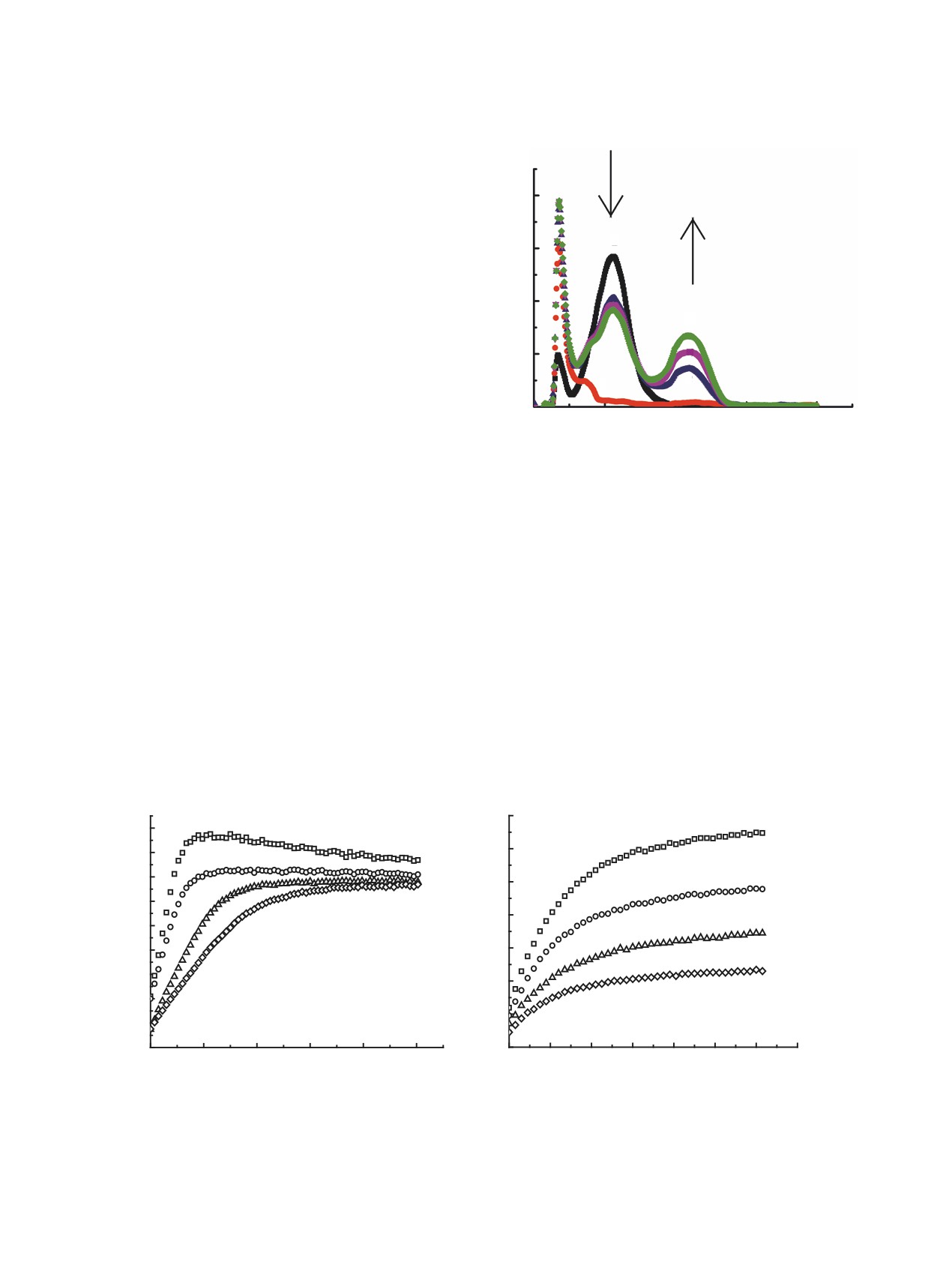
нием 4-нитрофенолят-аниона за счет атаки окси-
A
рана бензоатом или нитратом при участии ArOH
(схема 3). Интенсивность этого поглощения посте-
0.8
пенно возрастает по ходу реакции. Кроме того, на-
блюдается непрерывное уменьшение интенсивно-
2
0.6
сти полосы поглощения исходного 4-нитрофенола
(λ = 312 нм).
0.4
Альтернативное генерирование ArO- по схеме
5
2 следует исключить, поскольку кислотно-основ-
ные взаимодействия по Бренстеду принадлежат к
0.2
4
быстрым процессам (реакция протекает практи-
1
3
чески мгновенно) и кислотность 4-нитрофенола
(pKa = 7.15 [32]) существенно меньше, чем бен-
0.0
200
300
400
500
600
зойной (pKa = 4.20 [32]) или азотной (pKa = -1.64
λ, нм
[33]) кислот, поэтому бензоат- или нитрат-анион
Рис.
2. УФ-спектры бензоата тетраэтиламмония
не сможет вызвать существенное депротонирова-
5.17×10-5 моль/л (1), 4-нитрофенола 4.60×10-5 моль/л
ние 4-нитрофенола.
(2) и реакционной системы в ЭХГ (3-5) при 25°С
Для мониторинга накопления образующегося в
кривых в начальный момент времени) как в случае
системе «ЭХГ-4-O2NC6H4OH-[(C2H5)4N]X» 4-ни-
бензоата, так и в случае нитрата тетраэтиламмо-
трофенолят-аниона были проведены кинетиче-
ния (рис. 4).
ские измерения при варьировании концентрации
как исходной тетраалкиламмониевой соли, так и
Порядок реакции по соли, определенный ме-
самого протонодонора - 4-нитрофенола (методика
тодом Вант-Гоффа (наклон прямых в координатах
кинетических измерений II).
lg r0 - lg {[(C2H5)4N]X}0, оказался близок к еди-
Как следует из рис. 3, понижение начальной
нице: в случае бензоата тетраэтиламмония равен
концентрации соли
({[(C2H5)4N]X}0) приводит
(1.24±0.06), в случае нитрата тетраэтиламмония
к уменьшению начальной скорости накопления
составляет (1.1±0.2). Это вполне согласуется со
4-нитрофенолят-аниона (r0, тангенс угла наклона
схемой 3, поскольку скорость такого процесса
(a)
(b)
A
A
1
0.9
1
2.0
1.8
0.8
2
2
1.6
0.7
1.4
3
0.6
1.2
3
1.0
0.5
4
0.8
4
0.4
0.6
0.3
0.4
0.2
0.2
0
200
400
600
800
1000
0
100
200
300
400
500
600
700
t, с
t, с
Рис. 3. Кинетические кривые накопления 4-нитрофенолята в реакции анионов тетраалкиламмониевых солей с ЭХГ
(12.5 моль/л) в присутствии 4-нитрофенола (0.109 моль/л) при различных начальных концентрациях солей (25°C);
(a) - бензоат, (b) - нитрат; {[(C2H5)4N]X}0, моль/л: 1 - 0.0250, 2 - 0.0200, 3 - 0.0143, 4 - 0.0100
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
502
БАХТИН и др.
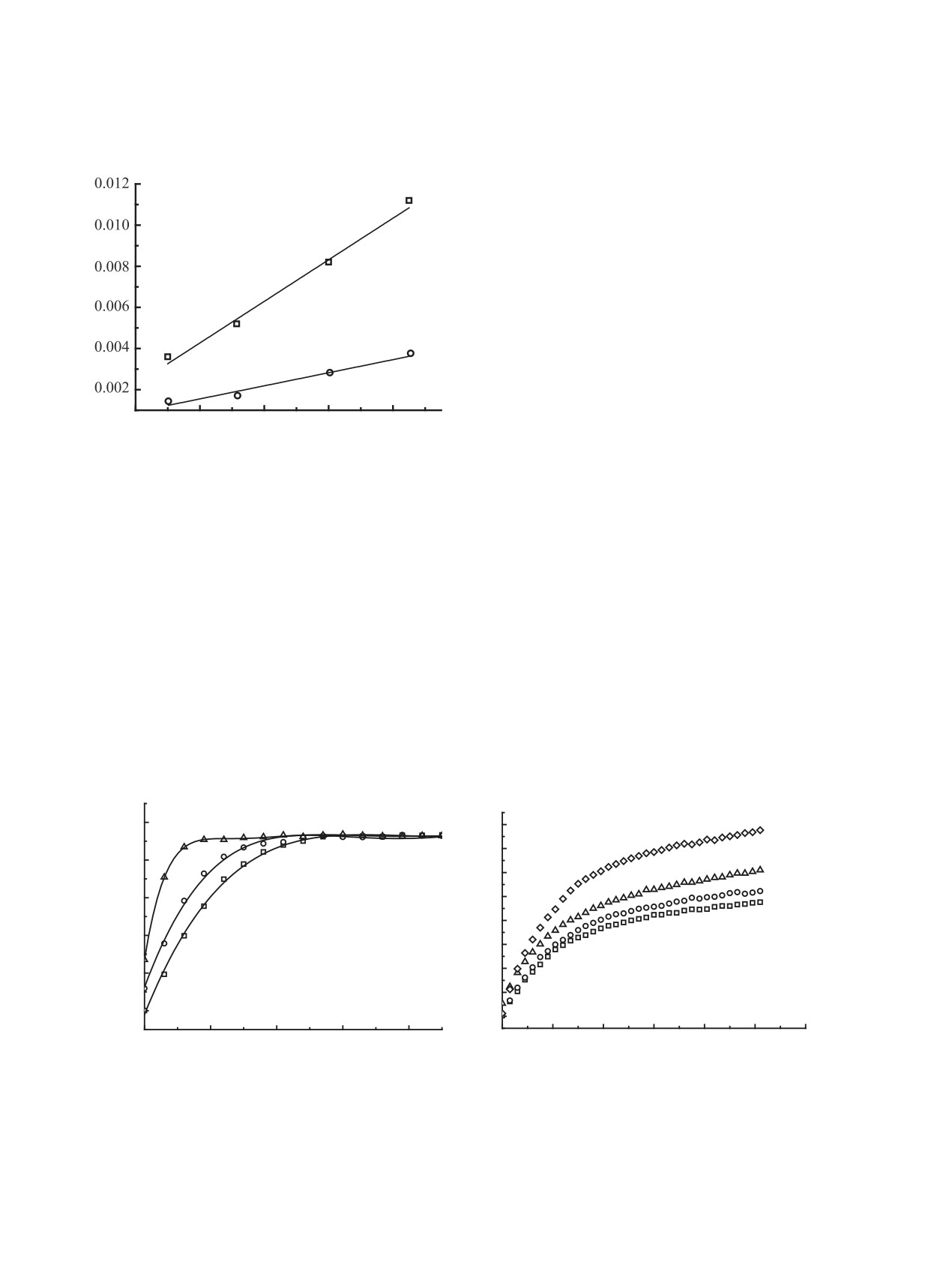
анион соли, было изучено влияние концентрации
r0, у.е.
протонодонора на скорость реакции. Так, если
бензоат- или нитрат-анион атакует активирован-
1
ный протонодонором эпихлоргидрин (электро-
фильно активированный), то должен наблюдаться
первый порядок реакции по фенолу [30] и кине-
тические зависимости в координатах «интенсив-
ность поглощения - время» и «начальная скорость
реакции - концентрация фенола» должны быть
2
аналогичными кривым, представленным на рис.
3 и 4, соответственно. Если же реализуется атака
на свободный эпихлоргидрин, то скорость нако-
пления 4-нитрофенолята не должна зависеть от
0.008
0.012
0.016
0.020
0.024
начальной концентрации фенола, участвующего в
, моль/л
[(C2H5)NX]0
быстром протонировании уже после скорость-ли-
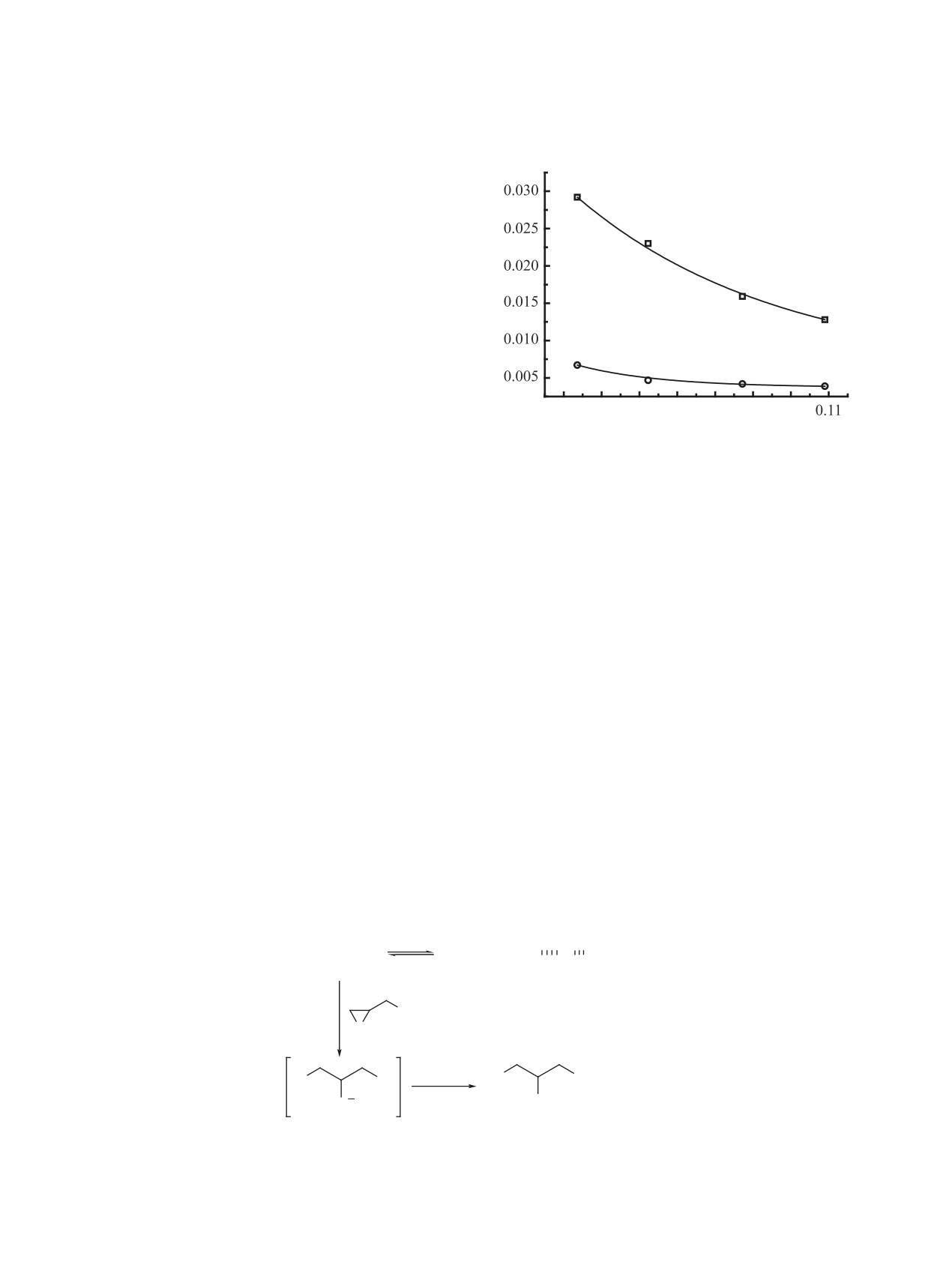
Рис. 4. Зависимость начальной скорости накопления
митирующей стадии (порядок по фенолу нулевой).
4-нитрофенолята от начальной концентрации тетра-
этиламмониевой соли в реакции с ЭХГ (12.5 моль/л) в
Результаты экспериментальных кинетических
присутствии 4-нитрофенола (0.109 моль/л) при 25°C;
исследований оказались неожиданными (рис. 5):
1 - бензоат, 2 - нитрат
при понижении исходной концентрации фенола
должна линейно зависеть от концентрации нукле-
начальная скорость образования фенолята возрас-
офила - аниона соли, атакующего оксирановый
тает (рис. 6).
цикл.
Порядок реакции по фенолу оказался отри-
Согласно схеме
5, раскрытие оксиранового
цательным для реакции ЭХГ как с бензоатом
цикла под действием нуклеофила возможно по
[-(0.92±0.07)], так и с нитратом [-(0.6±0.1)] тетра-
двум путям. Для ответа на вопрос, какой из этих
этиламмония. Полученные данные показывают,
путей наиболее предпочтительный, то есть, с ка-
что в системе «ЭХГ-4-O2NC6H4OH-[(C2H5)4N]X»,
ким из электрофилов (свободным оксираном -
когда исходный нуклеофил - анион соли, прото-
путь І или протонированным - путь ІІ) реагирует
нодонорный реагент ингибирует первоначальное
(a)
(b)
A
A
1.6
1.1
4
3
1.0
1.4
3
2
0.9
2
1.2
0.8
1
1
0.7
1.0
0.6
0.5
0.8
0.4
0.6
0.3
0
50
100
150
200
0
100
200
300
400
500
600
t, с
t, с
Рис. 5. Кинетические кривые накопления 4-нитрофенолята в реакции анионов тетраалкиламмониевых солей (0.025 моль/л)
с ЭХГ (12.5 моль/л) в присутствии 4-нитрофенола, полученные при различных начальных концентрациях 4-нитрофенола
при 25°C; (a) - бензоат ([ArOH]0, моль/л: 1 - 0.109, 2 - 0.087, 3 - 0.044), (b) - нитрат ([ArOH]0, моль/л: 1 - 0.109, 2 - 0.087,
3 - 0.062, 4 - 0.044)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
ОСОБЕННОСТИ НУКЛЕОФИЛЬНОГО Р
АСКРЫТИЯ ОКСИРАНОВОГО ЦИКЛА
503
раскрытие оксиранового цикла. При этом абсо-
r0, у.е.
лютное значение порядка по фенолу в случае ни-
трата меньше, что согласуется с более низкой ос-
1
новностью нитрат-аниона, чем бензоата, поэтому
чувствительность к концентрации протонодонора
и вклад такого связывания ниже.
Механизм нуклеофильного раскрытия оксира-
нового цикла с учетом полученных данных можно
продемонстрировать схемой 6, когда реализуется
путь І (схема 5) с последовательным образовани-
2
ем двух солей. Первая соль C (алкоголят), перво-
начально образующаяся при взаимодействии бен-
зоата или нитрата тетраэтиламмония с молекулой
0.04
0.05
0.06
0.07
0.08
0.09
0.10
свободного эпихлоргидрина, быстро реагирует с
[ArOH]0, моль/л
протонодонорным реагентом, приводя к образова-
Рис. 6. Зависимость начальной скорости накопления
нию продукта реакции - хлоргидринового эфира
4-нитрофенолята от начальной концентрации 4-ни-
трофенола в реакции анионов тетраэтиламмониевых
и фенолята тетраэтиламмония D, участвующего
солей (0.025 моль/л) с ЭХГ (12.5 моль/л) при 25°C;
в последующих циклах раскрытия оксиранового
1 - бензоат, 2 - нитрат
цикла в присутствии протонодонора.
УФ-спектры получены на спектрофотометре
Обнаруженные закономерности нуклеофиль-
СФ-2000 (Россия).
ной реакционной способности анионов тетраал-
киламмониевых солей противоположны тем, кото-
Промышленно выпускаемый эпихлоргидрин
рые мы наблюдали ранее для систем, в которых в
сушили в течение 1 сут над гранулами гидрокси-
роли исходных катализаторов выступали третич-
да натрия, а затем перегоняли при атмосферном
ные амины [28, 29], атаковавшие только активиро-
давлении, собирая фракцию с т.кип. 115-116°C; nD
ванный протонодонором оксиран. Можно предпо-
1.438 (115.5°C; nD 1.438 [31]). Бензойную кислоту
ложить, что в случае солей роль электрофильного
очищали возгонкой при температуре 100°C; т.пл.
активатора в определенной степени выполняет
121-122°С (122.4°С [31]). Очистку 4-нитрофено-
противоион - катион тетраалкиламмония, который
ла проводили перекристаллизацией его фенолята
стабилизирует алкоголят, образующийся в ходе
(обработка NaOH) из водного раствора соляной
нуклеофильного раскрытия свободного оксирана
кислоты (10%); т.пл. 113-115°С (т.пл. 115°С [31]).
[33].
Бензоат тетраэтиламмония. Смешивали во-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
дные растворы бензойной кислоты и гидроксида
Спектры ЯМР 1Н регистрировали на спек-
натрия (в мольном соотношении 1:1). Затем до-
трометре Bruker Avance II 400 МГц (Германия).
бавляли эквимолярное количество нитрата сере-
Схема 6
+ -
+
-δ
-δ
ArOH
+
[(C2H5)4N]
X
[(C2H5)4N]
X H O Ar
Cl
O
+
ArOH
X
Cl
+
-
X
Cl
[(C2H5)4N]
+
[(C2H5)4N]
ArO
O
OH
C
D
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
504
БАХТИН и др.
бра (водный раствор). Выпавший осадок бензоата
образом приготовленные растворы 4-нитрофенола
серебра отфильтровывали, а затем переносили в
(2 мл) и [(C2H5)4N]X (1 мл) в ЭХГ быстро смеши-
стакан с дистиллированной водой и к суспензии
вали и помещали в кварцевую кювету (l = 1 см)
добавляли по каплям раствор бромида тетраэти-
спектрофотометра. Для регистрации УФ-спектра
ламмония (эквимолярное количество) при интен-
измеряли оптическую плотность реакционной
сивном перемешивании. Выпавший осадок бро-
смеси непосредственно в кювете при 25°С относи-
мида серебра удаляли фильтрованием. Фильтрат
тельно раствора сравнения - чистого ЭХГ.
упаривали на водяной бане и полученный остаток
ВЫВОДЫ
кипятили с бензолом в колбе с насадкой Дина-
Старка в течение 4 ч для удаления остатков воды.
Исследована кинетика и механизм оксиалки-
Выпавшие кристаллы отфильтровывали и сушили
лирования протонодонорных нуклеофильных ре-
агентов (бензойной кислоты и 4-нитрофенола)
в вакууме. Выход соли количественный. Спектр
ЯМР 1Н (CDCl3), δ, м.д.: 1.20 т (12H, 4CH3, J
эпихлоргидрином в присутствии бензоата и нитра-
8.0 Гц), 3.30 к (8H, 4CH2, J 8.0 Гц), 7.25-7.75 м
та тетраэтиламмония. При изучении нуклеофиль-
но-электрофильных и кислотно-основных взаи-
(5Н, C6H5).
модействий в системах «оксиран-протонодонор-
Нитрат тетраэтиламмония. Синтезировали
тетраалкиламмониевая соль» установлено, что в
аналогично бензоату тетраэтиламмония, добавляя
начале реакции анион соли расходуется в стадии
бромид тетраэтиламмония к водному раствору ни-
по SN2 механизму с раскрытием цикла свободно-
трата серебра.
го оксирана, образуя соответствующий алкоголят.
Методика кинетических измерений I.
Дальнейшее протонирование этого алкоголята
Мониторинг концентрации карбоновой кислоты
протонодонорным реагентом приводит к транс-
проводили при помощи потенциометрического
формации последнего в реакционноспособный
кислотно-основного титрования. В один из 2 от-
анион, который затем атакует оксирановый цикл,
ростков кинетической колбы вносили раствор бен-
приводя к конечным продуктам реакции.
зойной кислоты (0.2 моль/л) в 2 мл ЭХГ, а в дру-
КОНФЛИКТ ИНТЕРЕСОВ
гой - раствор катализатора [(C2H5)4N]X соответ-
Авторы заявляют об отсутствии конфликта ин-
ствующей концентрации в 1 мл ЭХГ. Колбу поме-
тересов.
щали в термостат при 60°C. После термостати-
рования (10 мин) растворы быстро смешивали и
СПИСОК ЛИТЕРАТУРЫ
колбу снова помещали в термостат. За начальный
1. Blank W.J., He Z.A., Picci M. J. Coat. Technol. 2002,
момент времени реакции принимали время сме-
74, 33-41. doi 10.1007/BF02720158
шивания растворов. Через необходимый промежу-
2. Yan Z., Deng J., Chen Y., Luo G. Ind. Eng. Chem. Res.
ток времени реакцию останавливали добавлением
2020, 59, 19168-19176. doi 10.1021/acs.iecr.0c02906
10 мл охлажденной до 0-5°С смеси изопропилово-
3. Pascault J.P., Williams R.J.J. Epoxy Polymers: New
го спирта и воды (1:1 по объему) при быстром пе-
Materials and Innovations. Weinheim: John Wiley &
ремешивании (метод разбавления и охлаждения).
Sons, 2009.
Содержимое колбы количественно переносили
4. Arslan M., Sanyal R., Sanyal A. Polym. Chem. 2020,
дистиллированной водой в ячейку для титрования.
11, 615-629. doi 10.1039/C9PY01679A
Текущую концентрацию протонодонорного реа-
5. Zhou H., Steinhilber D., Schlaad H., Sisson A.L.,
гента определяли методом потенциометрического
Haag R. React. Funct. Polym. 2011, 71, 356-361. doi
кислотно-основного титрования 0.1 моль/л рас-
10.1016/j.reactfunctpolym.2010.11.018
твором NaOH на универсальном иономере ЭВ-74
6. Subramanian S., Park J., Byun J., Jung Y., Yavuz C.T.
(ΔрН = ±0.05) при 25°С с использованием стеклян-
ACS Appl. Mater. Interfaces. 2018, 10, 9478-9484. doi
ного (ЭСЛ-43-07) и вспомогательного (ЭВ1-1М3)
10.1021/acsami.8b00485
электродов.
7. Singh G.S., Mollet K., D’Hooghe M., Kimpe N. Chem.
Методика кинетических измерений II (монито-
Rev. 2012, 113, 1441-1498. doi 10.1021/cr3003455
ринг накопления фенолят-аниона). Аналогичным
8. Усачев В.В. Дис. … канд. хим. наук. Донецк. 2008.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
ОСОБЕННОСТИ НУКЛЕОФИЛЬНОГО Р
АСКРЫТИЯ ОКСИРАНОВОГО ЦИКЛА
505
9.
Kucharski M., Chmiel-Szukiewicz E. J. Appl.
23.
Maitre C., Ganachaud F., Ferreira O., Lutz J.F., Pain-
Polym. Sci.
2000,
78,
2081-2088. doi
10.1002/
toux Y., Hemery P. Macromolecules. 2000, 33, 7730-
1097-4628(20001213)78:12<2081::AID-APP40>
7736. doi 10.1021/ma0007132
3.0.CO;2-Q
24.
Bobbink F.D, Vasilyev D., Hulla M., Chamam S.,
10.
Швед Е.Н., Усачов В.В., Козорезова Е.И. Укр.
Menoud F., Laurenczy G., Dyson P.J. ACS Catal. 2018,
хим. ж. 2007, 73, 113-117.
8, 2589-2594. doi 10.1021/acscatal.7b04389
11.
Швед Е.Н., Петренко Е.Н., Пожидаев М.А. ЖОрХ.
25.
Tsutsumi Y., Yamakawa K., Yoshida M., Ema T.,
2001, 37, 1804-1806. [Shved E.N., Petrenko E.N.,
Sakai T. Org. Lett. 2010, 12, 5728-5731. doi 10.1021/
Pozhidaev M.A. Russ. J. Org. Chem. 2001, 37, 1723-
ol102539x
1725.] doi 10.1023/A:1013922017887
26.
Бахтин С.Г., Швед Е.Н., Беспалько Ю.Н. Кине-
12.
Rafizadeh M., Ghasemi H., Haddadi-Asl V. Chin.
тика и катализ. 2016, 57, 49-53. [Bakhtin S.G.,
J. Polym. Sci.
2006,
24,
599-608. doi
10.1142/
Shved E.N., Bespal’ko Y.N. Kinet. Catal. 2016. 57,
S0256767906001709
47-51.] doi 10.1134/S002315841601002X
13.
Schneider C., Brauner J. Eur. J. Org.
27.
Bakhtin S., Bespal’ko Y., Shved E. React. Kinet. Mech.
Chem.
2001,
23,
4445-4450. doi
10.1002/
Catal. 2016, 119, 139-148. doi 10.1007/s11144-016-
1099-0690(200112)2001:23<4445::AID-EJOC4445>
1051-4
3.0.CO;2-U
28.
Bakhtin S., Shved E., Bespal’ko Y. J. Phys. Org. Chem.
14.
Bukowska A., Guskov A.K., Makarov M.K., Rokas-
2017, 30, e3717. doi 10.1002/poc.3717
zewski E., Svets V.F. J. Chem. Techn. Biotechnol. 1995,
29.
Bakhtin S., Shved E., Bespalko Y., Tyurina T.,
63, 374-378. doi 10.1002/jctb.280630411
Palchykov V. J. Phys. Org. Chem. 2020, 33, e4071. doi
15.
Usachev V.V., Shved E.N. Mendeleev Commun.
10.1002/poc.4071
2002,
12,
113-114.
doi
10.1070/
30.
Bakhtin S., Shved E., Bespal’ko Y., Stepanova Y. Prog.
MC2002v012n03ABEH001586
React. Kinet. Mec. 2018, 43, 121-135. doi 10.3184/
16.
Синельникова М.А., Швед Е.Н. ЖОрХ. 2014, 50,
146867818X15161889114501
343-348.
[Sinel’nikova M.A., Shved E.N. Russ.
31.
Иоффе Б.В., Костиков Р.Р., Разин В.В. Физические
J. Org. Chem. 2014, 50, 332-336.] doi 10.1134/
методы определения строения органических соеди-
S107042801403004X
нений. М.: Высшая школа, 1984.
17.
Xia X.Y., Sun W., He W., Feng Y., Zhan L., Luo Y.
32.
Shields G.C., Seybold P.G. Computational Approaches
Russ. J. Org. Chem. 2020, 56, 877-883. doi 10.1134/
for the Prediction of pKa Values. Boca Raton: CRC
S107042802005022X.
Press, 2013.
18.
Tanaka Y., Okada A., Suzuki M. Can. J. Chem. 1970,
33.
Зинченко А.В., Изотова С.Г., Румянцев А.В. Новый
48, 3258-3264. doi 10.1139/v70-547
справочник химика и технолога. Химическое равно-
19.
Сорокин М.Ф., Гершанова Э.Л. Кинетика и ката-
весие. Свойства растворов. СПб.: Профессионал,
лиз. 1967, 8, 512-519.
2004.
20.
Lubczak J., Lubczak R., Naróg D. Open J. Phys. Chem.
34.
Yutilova K., Bespal’ko Y., Shved E. Croat. Chem. Acta.
2018, 8, 67-79. doi 10.4236/ojpc.2018.83005
2019, 92, 357-367. doi 10.5562/cca3505
21.
Швец В.Ф., Тюкова О.А. ЖОрХ. 1971, 7, 1847-1850.
35.
Amarego W.L.F., Chai C. Purification of Laboratory
22.
Сорокин М.Ф., Шодэ Л.Г. ЖОрХ. 1968, 4, 666-669.
Chemicals. Oxford: Butterworth-Heinemann, 2005.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021
506
БАХТИН и др.
Peculiarities of Nucleophilic Opening of the Oxirane Ring
by Tetraalkylammonium Salts Anions in the Presence
of Proton Donors
S. G. Bakhtina, *, E. N. Shvedb, M. A. Sinelnikovaa, and Y. N. Bespalkoc
a Donetsk national university, ul. Universitetskaya, 24, Donetsk, 283001 Ukraine
b Donetsk national university named after Vasyl Stus, ul. 600-Letiya, 21, Vinnytsia, 21021 Ukraine
c Katholieke Universiteit Leuven (KU Leuven), Oude Markt 13, Leuven, 3000 Belgium
*e-mail: s.bahtin@donnu.ru
Received January 14, 2021; revised January 26, 2021; accepted January 27, 2021
The behavior of tetraalkylammonium salts in the reaction of nucleophilic opening of the oxirane ring in the
system “epichlorohydrin (ECH) - proton donor - [(C2H5)4]NX” (proton donor: benzoic acid, 4-nitrophenol;
X: benzoate, nitrate) was studied by kinetic and spectral (UV) methods. The reaction orders were evaluat-
ed: the first order for tetraalkylammonium salts, zero one for benzoic acid, and less than zero reaction order
for 4-nitrophenol. Basing on the monitoring of the accumulation of 4-nitrophenolate anion formed in the
“ECH - 4-nitrophenol - [(C2H5)4N]X” system upon varying concentrations of both the initial tetraalkylammo-
nium salt and the proton donor - 4-nitrophenol - the mechanism of nucleophilic opening of the oxirane ring was
detailed. It was found that there is an irreversible consumption of the anion of the initial tetraalkylammonium salt
due to its attack on the oxirane ring with the participation of a proton donor reagent, leading to the generation
of tetraethylammonium 4-nitrophenolate, that catalyzes the subsequent formation of the reaction product. An
increase in the concentration of 4-nitrophenol reduces the rate of both the formation of 4-nitrophenolate anion
and the total reaction, which corresponds to the mechanism of catalysis, when a nucleophilic attack by the salt
anion on the oxirane ring electrophilically not activated by the proton donor is carried out.
Keywords: oxirane, tetraalkylammonium salt, catalysis by nucleophiles, proton donor reagent, mechanism of
catalysis
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 4 2021