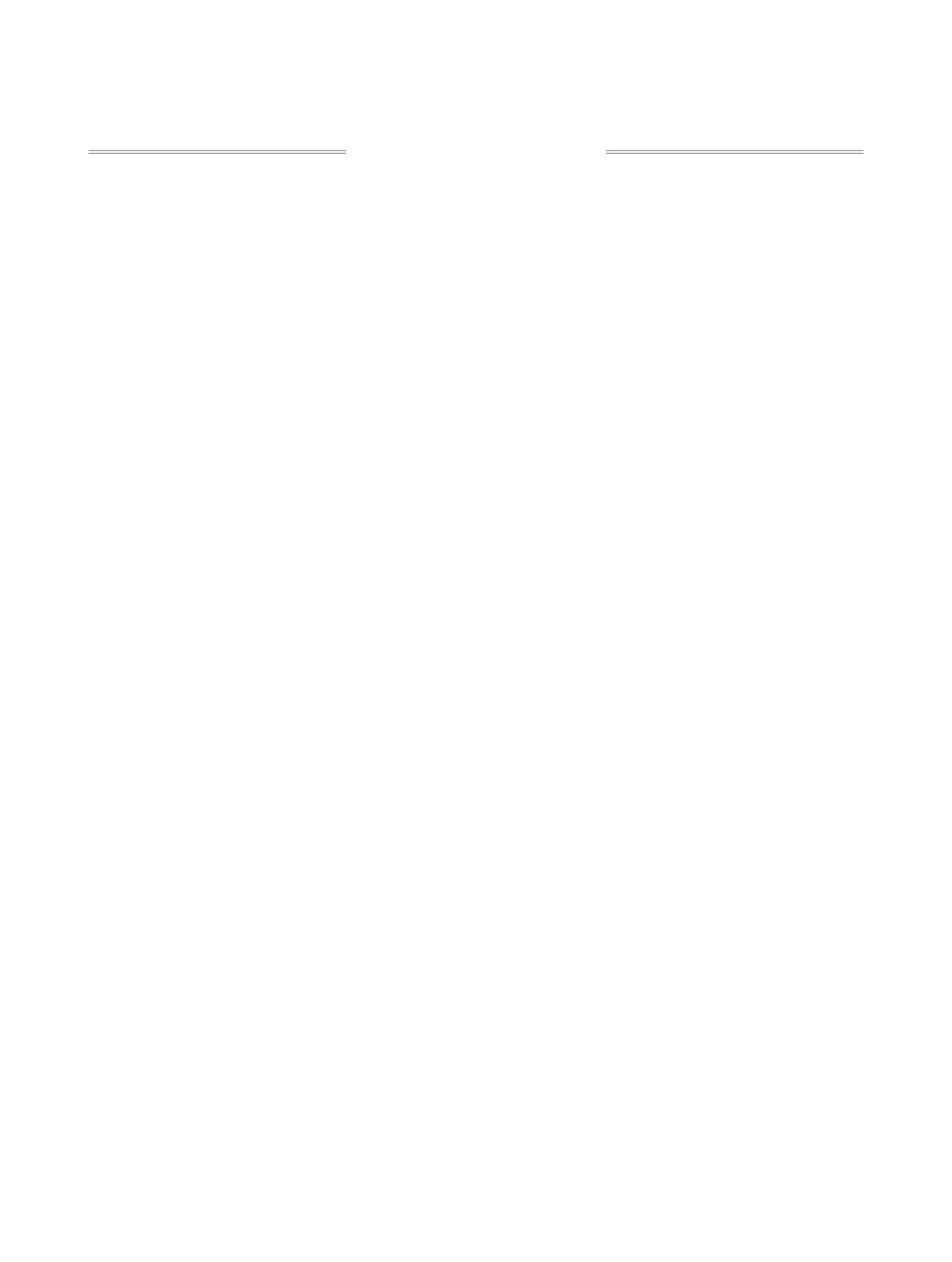
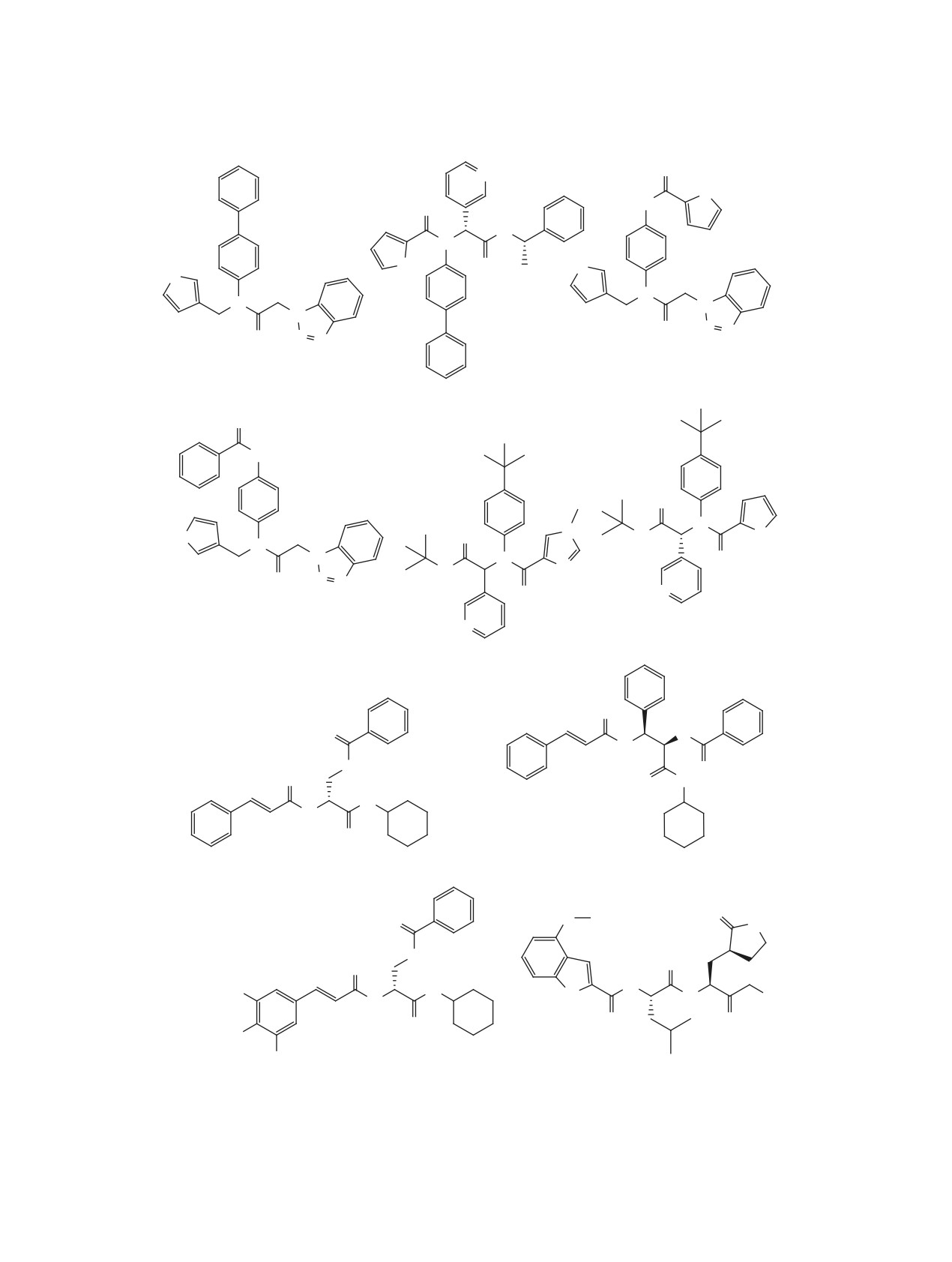
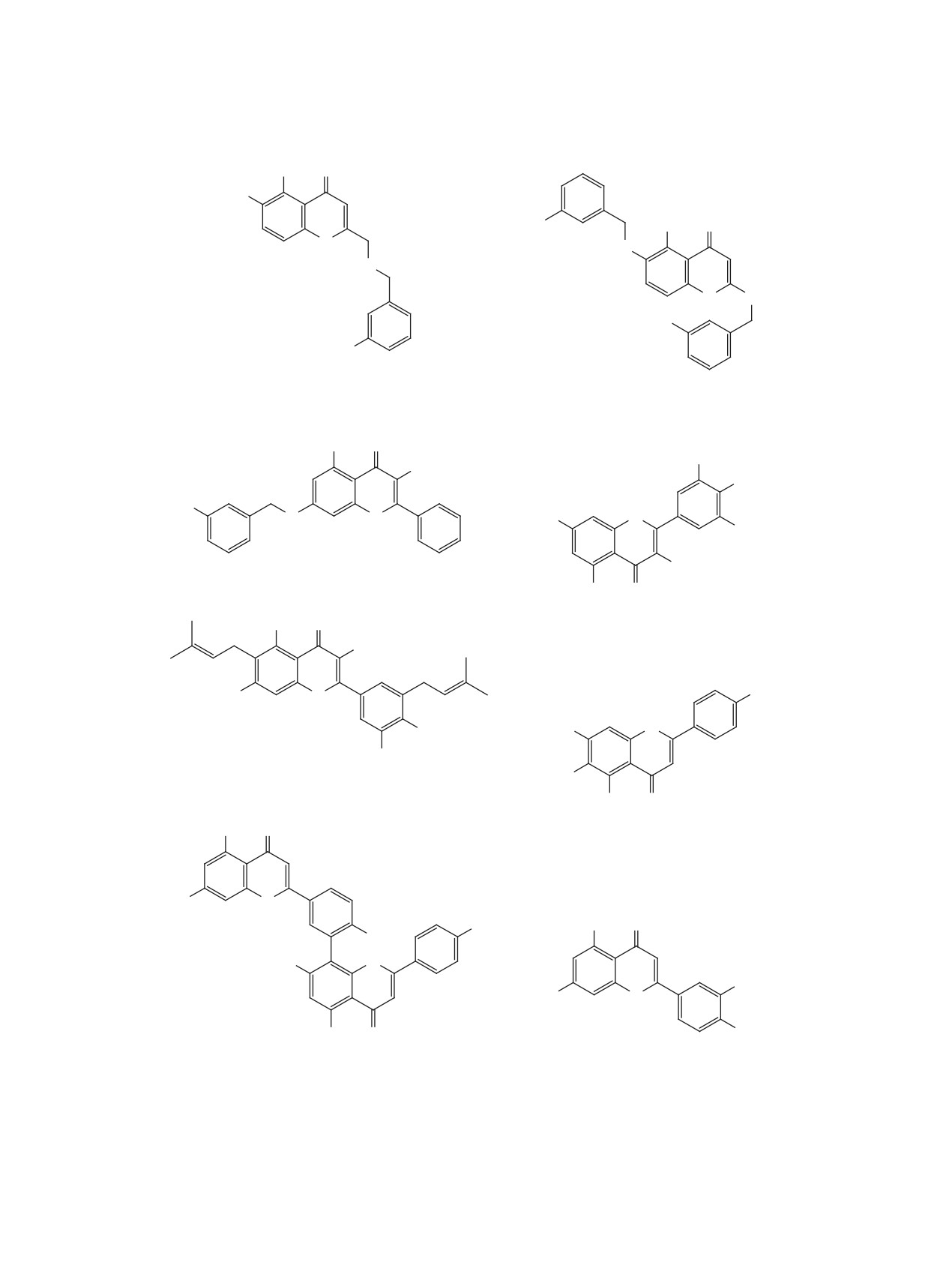
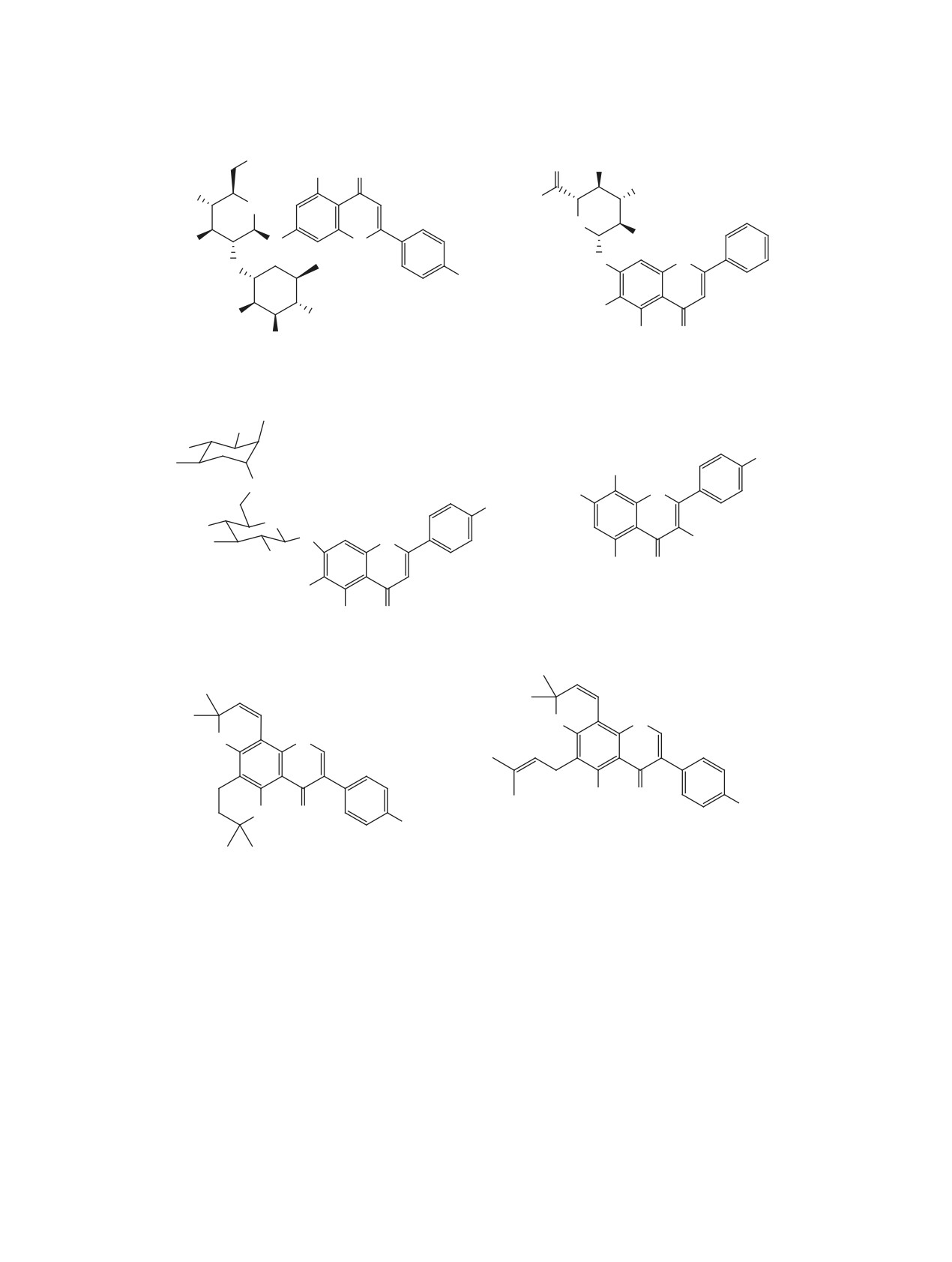
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 5, с. 661-699
ОБЗОРНАЯ СТАТЬЯ
УДК 547.3, 615.281
К 70-летнему юбилею академика РАН В.Н. Чарушина
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ
РЕПРОДУКЦИИ SARS-COV-2
© 2021 г. В. А. Ширяев*, Ю. Н. Климочкин
ФГБОУ ВО «Самарский государственный технический университет»,
Россия, 443100 Самара, ул. Молодогвардейская, 244
*e-mail: shiryaev.va@samgtu.ru
Поступила в редакцию 05.03.2021 г.
После доработки 15.03.2021 г.
Принята к публикации 18.03.2021 г.
Пандемия COVID-19 заставила ученых всего мира направить свои усилия на поиск химиотерапевтиче-
ских препаратов направленного действия, способных эффективно бороться с коронавирусами. В обзоре
приведена попытка систематизации низкомолекулярных соединений, в том числе известных фармацев-
тических препаратов и природных веществ, обладающих высокой противовирусной активностью по
отношению к коронавирусам, не с позиций действия на их мишени, а по принадлежности к тому или
иному структурному типу.
Ключевые слова: коронавирус, противовирусные средства, COVID-19, SARS-CoV-2
DOI: 10.31857/S0514749221050025
Активное изучение коронавирусов было начато
группы населения, среди которых их применение
только в 2002 г. после вспышки тяжелого острого
невозможно, во многих странах сформировалось
респираторного синдрома (ТОРС, SARS) в 2002 г.
стойкое неприятие вакцинации, из-за ограничен-
в Китае. Следующий толчок к дальнейшему разви-
ного времени иммунной защиты подразумевает-
тию данное направление исследований получило в
ся повторное введение вакцины приблизительно
2012 г. после вспышки ближневосточного респи-
через год, что в результате может привести к рез-
кому снижению доли привитого населения, а для
раторного синдрома (БВРС, MERS) в Саудовской
Аравии. Появление высокопатогенного штамма
новых мРНК-вакцин этот вопрос вообще остается
открытым. На момент написания обзора в Израиле
вируса SARS-CoV2 в конце 2019 г. в Китае и его
было привито 60%, а в ОАЭ почти 50% населения,
распространение, приведшее к текущей пандемии,
однако уровень заболеваемости все еще остается
явилось интеллектуальным вызовом для мирового
достаточно высоким. Следует учитывать постоян-
научного сообщества, диктующим необходимость
ное появление мутантных штаммов коронавиру-
коллаборации исследователей из разных дисци-
сов, в том числе с более высокой патогенностью,
плин для разрешения возникшего системного кри-
против которых применение вакцин может ока-
зиса как в здравоохранении, так и в обществе в
заться неэффективным [1]. Все эти аспекты сви-
целом.
детельствуют о безусловной необходимости созда-
Несмотря на успехи в создании вакцин, их
ния эффективного химиотерапевтического ответа,
использование не является залогом полного бло-
обеспечивающего борьбу с вызываемыми коро-
кирования пандемии. Существуют социальные
навирусами инфекциями применением линейки
661
662
ШИРЯЕВ, КЛИМОЧКИН
препаратов, обладающих собственно вирусспеци-
мишенью, а по типу молекулярной структуры
фическим действием. Проблема стимулирует воз-
(хемотипу) ингибитора вирусной репродукции.
никновение инноваций и отчасти является движу-
Последовательность изложения основана на ча-
щей силой развития как медицинской химии, так и
стоте встречаемости структурных типов в лите-
современного органического синтеза.
ратуре без разделения на синтетические, полу-
синтетические и природные соединения, причем
Для химического сообщества неотложность
в рассмотрение принимались только наиболее
проблематики заставила методами in silico изучить
активные индивидуальные соединения каждого
афинность существующих библиотек соединений
хемотипа. Учитывая, что на момент написания об-
к известным мишеням SARS-CoV2 [2-7] и сроч-
зора была изучена антивирусная активность почти
но рассмотреть возможность перепрофилирова-
2500 соединений в отношении коронавирусов, то
ния существующих лекарственных средств [3, 4,
представленная выборка наиболее активных сое-
8-17]. Ввиду резко выросшего глобального спроса
динений достаточно репрезентативна.
остро встает необходимость новых методов синте-
за, масштабирования и рентабельных технологи-
Первая группа соединений, имеющих значи-
тельное противовирусное действие - пептидоми-
ческих решений производства фармацевтических
субстанций антивирусных препаратов [18-20]. Но
метики 1-23 [30-48] (рис. 1 и 2). Единственной
доказанной мишенью пептидомиметиков явля-
главные усилия химиков-органиков должны быть
ется вирусная химотрипсин-подобная протеаза
направлены на создание новых молекул, главным
3CLpro/Mpro. Среди представителей данного
образом новых структурных типов молекул, обе-
типа ингибиторов репродукции коронавирусов
спечивающих потенциал будущей антивирусной
встречаются как уже применяемые в клинической
терапии.
практике препараты, такие как боцепревир 21 [36,
Геном коронавируса достаточно большой,
42] и лопинавир 23 [48] и, так и новые соедине-
свидетельствующий о множестве возможных то-
ния. Соединения данной группы можно условно
чек вмешательства в репродуктивный цикл [21].
разделить на производные арил (гетарил)амино-
Большинство существующих лабораторных мо-
уксусной кислоты 1 [30], 3 [32], 6 [33], 10 [36] и
делей оценки противовирусной активности все
бензотриазолилуксусной кислоты 2 [31], 4 [32], 5
еще подразумевают работу с нативным вирусом
[32], производные серина и изосерина 7-9 [34, 35]
[22, 23], что не раскрывает детали конкретного
(рис. 1) и соединения, содержащие несколько ами-
механизма антивирусного действия, и создаваемое
нокислотных звеньев 11-23 [36-48] (рис. 2), среди
интеллектуальным потенциалом химиков-органи-
которых часто встречаются фрагменты лейцина 11
ков структурное многообразие активных молекул
[36, 37, 38], 12 [39], 14 [41], 15 [36, 42], 19 [45],
является стимулом и инструментом выявления
20 [42], 22 [47]. Общим для соединений группы
новых мишеней для подавления вирусной репро-
пептидомиметиков является наличие липофиль-
дукции.
ных заместителей как в аминокислотных остатках,
так и на периферии (чаще всего трет-алкильных,
Актуальность проблематики вызвала появле-
ароматических или гетероароматических), что
ние значительного количества обзорных статей
свидетельствует в пользу важности связывания с
[12, 14, 24-29], посвященных описанию существу-
гидрофобными участками мишени.
ющих вирусных мишеней SARS-CoV-2 и органи-
ческих молекул, взаимодействующих с сайтами
Уровень противовирусной активности (IC50)
связывания вирусных протеинов.
пептидомиметиков находится в широком диапазо-
не (0.051-74 мкмоль), наиболее активные - произ-
В настоящем обзоре приведена попытка анали-
водные бензотриазолилуксусной кислоты 2 [31], 4
за лавины публикаций, которые трудно полностью
[32], 5 [32] и полизамещенный треонилфенилала-
охватить, и классификации низкомолекулярных
нин 17 [44].
соединений, проявляющих доказанную in vitro
или in vivo активность в отношении коронавиру-
Пептидомиметики показали высокий потенци-
сов, не с позиций взаимодействия с той или иной
ал для борьбы с SARS-CoV-2, поскольку протеаза
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
663
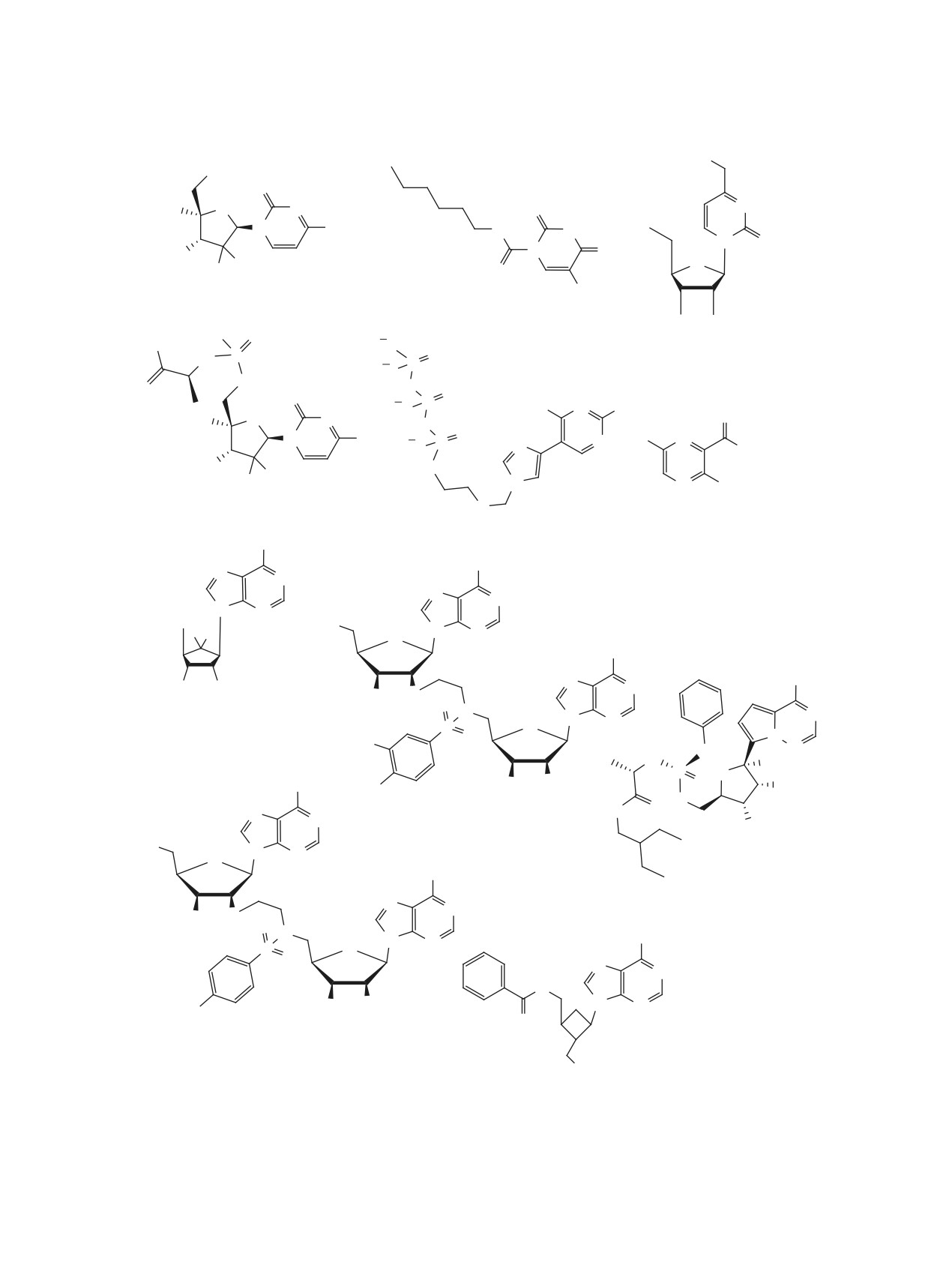
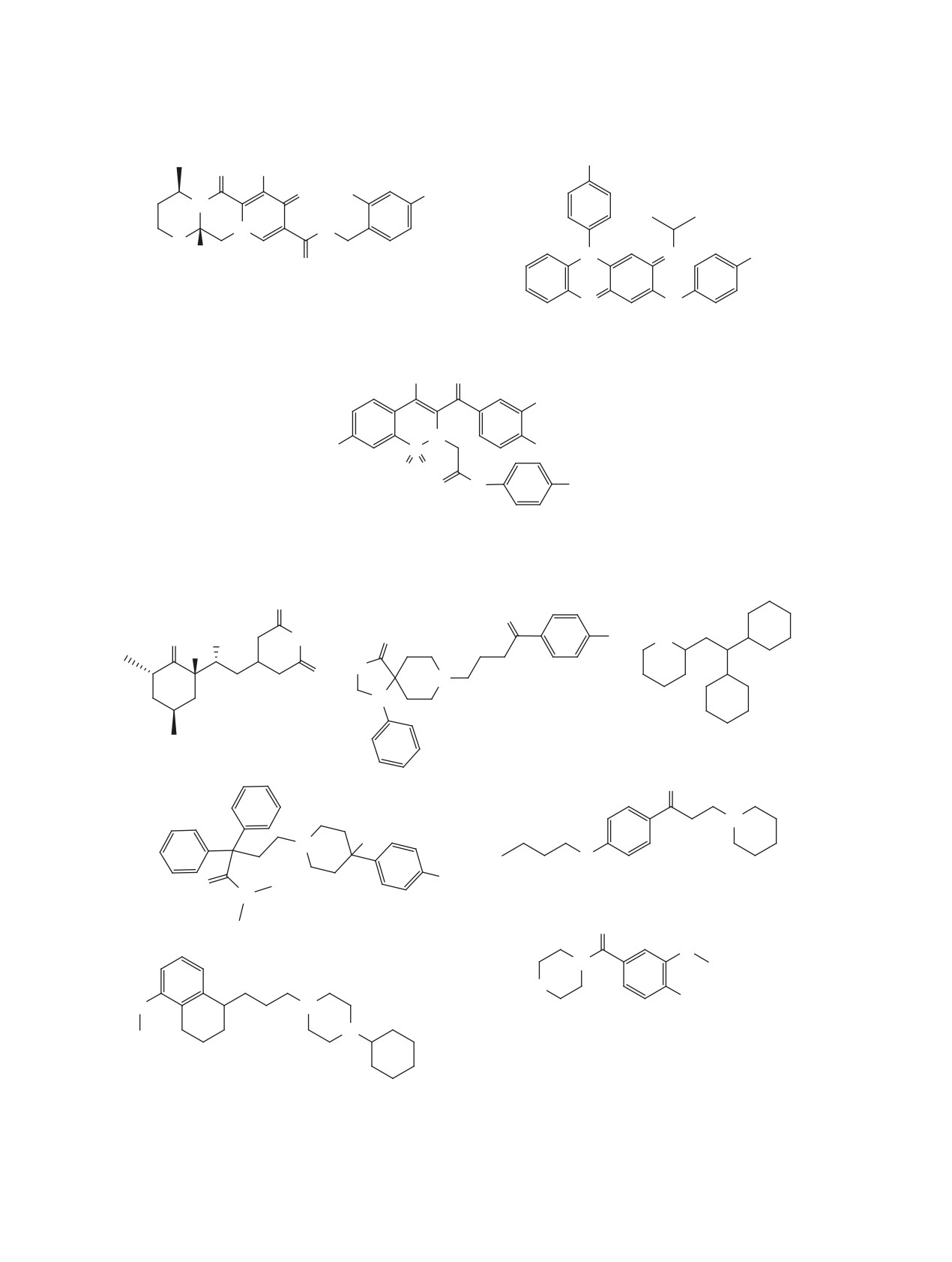
O
N
S
HN
O
H
N
N
O
O
S
S
N
N
N
N
O N N
O N N
3 [32]
1 [30]
HKU4-CoV 3CLpro IC50 = 0.33 uM
SARS-CoV 3CLpro IC50 = 0.051 uM
2 [31]
= 0.31 uM
SARS-CoV-2 Mpro IC50
O
SARS-CoV Mpro IC50 = 0.27 uM
NH
O
N
N
O
S
O
N
N
H
N
N
O
N
N
O N
H
N
O
N
4 [32]
HKU4-CoV 3CLpro IC50 = 0.41 uM
6 [33]
N
SARS-CoV 3CLpro IC50 = 1.5 uM
5 [32]
HKU4-CoV 3CLpro IC50 = 1.3 uM
O
O
O
N
H
O
O
O
O NH
H
N
N
H
O
7 [34]
8 [35]
SARS-CoV 3Clpro IC50 = 30 uM
SARS-CoV 3CLpro IC50 = 43 uM
O
O
O
NH
O
O
O
H
H
N
MeO
N
N
N
OH
N
H
H
H
O
O
O
MeO
OMe
10 [36]
9 [34]
SARS-CoV-2 3CLpro IC50 = 0.0057 uM
SARS-CoV 3CLpro IC50 = 65 uM
Рис. 1. Структуры пептидомиметиков 1-10
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
664
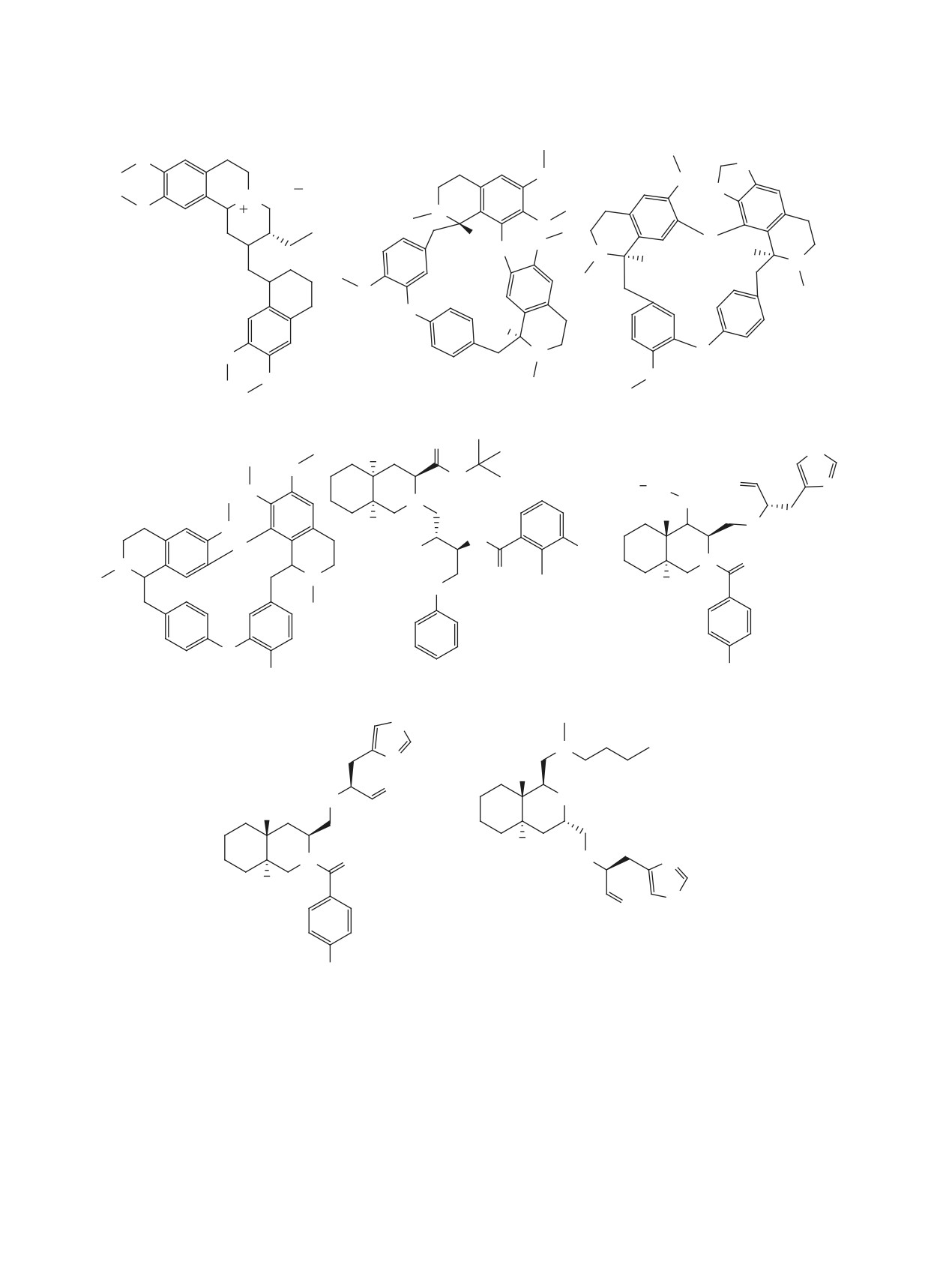
ШИРЯЕВ, КЛИМОЧКИН
O
O
NH
O
O
H
O
N
OH
N
N
N
N
H
H
O
SO3Na
O
N N
S
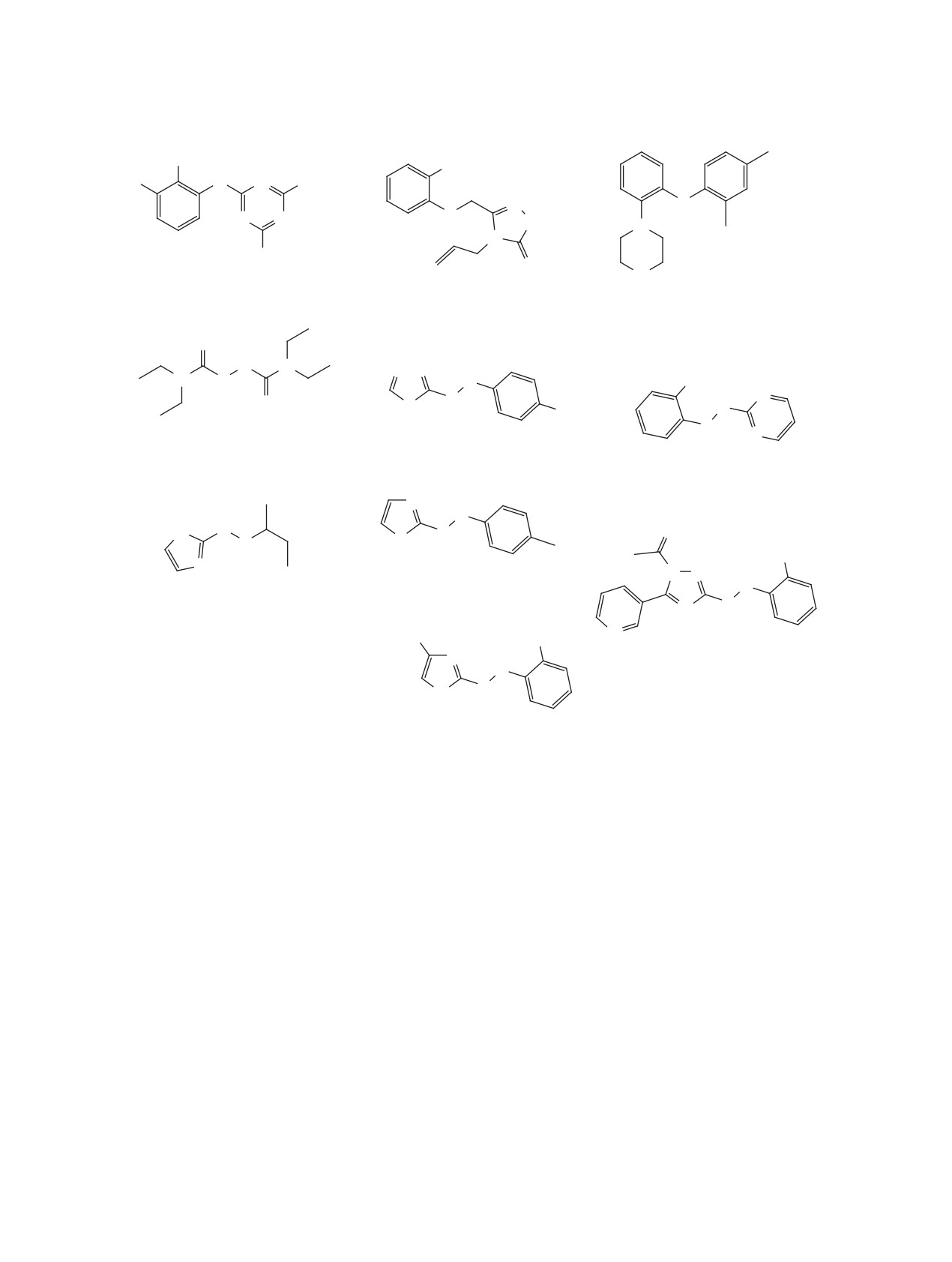
12 [39]
11 [36, 37, 38]
SARS-CoV 3CLpro IC50 = 0.5 uM
SARS-CoV-2 3CLpro IC50 = 0.15 uM
O
NH
O
O
O
HN
O
O
H
N
O
N
NH
O N
N
O
NH
O
H
H
O
O
O
O
13 [40]
MERS-CoV-3Clpro IC50 = 2.1 uM
14 [41]
SARS-CoV 3CLpro Ki = 0.053 uM
H
N
O
O
N
O
H
H
N
N
O N
H
O
O
O
O
O
N
O
N
N
NH
H
H
15 [36, 42]
O
O
SARS-CoV-2 Mpro IC50 = 0.453 uM
H
N
16 [43]
O
SARS-CoV-2 Mpro IC50 = 0.68 uM
O
O
S
H
N
N
N
O
O
H
H
H
O
O
N
N
N
H
H
O
O
17 [44]
SARS-CoV Mpro IC50 = 0.71 uM
18 [36, 42]
repl. EC50 = 2.1 uM
SARS-CoV-2 Mpro IC50 = 0.97 uM
Рис. 2. Структуры пептидомиметиков 11-23
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
665
O
O
O
O
H
O
O
N
N
H
N
N
N
N
H
H
H
N
N
O
O
H
H
O
O
O
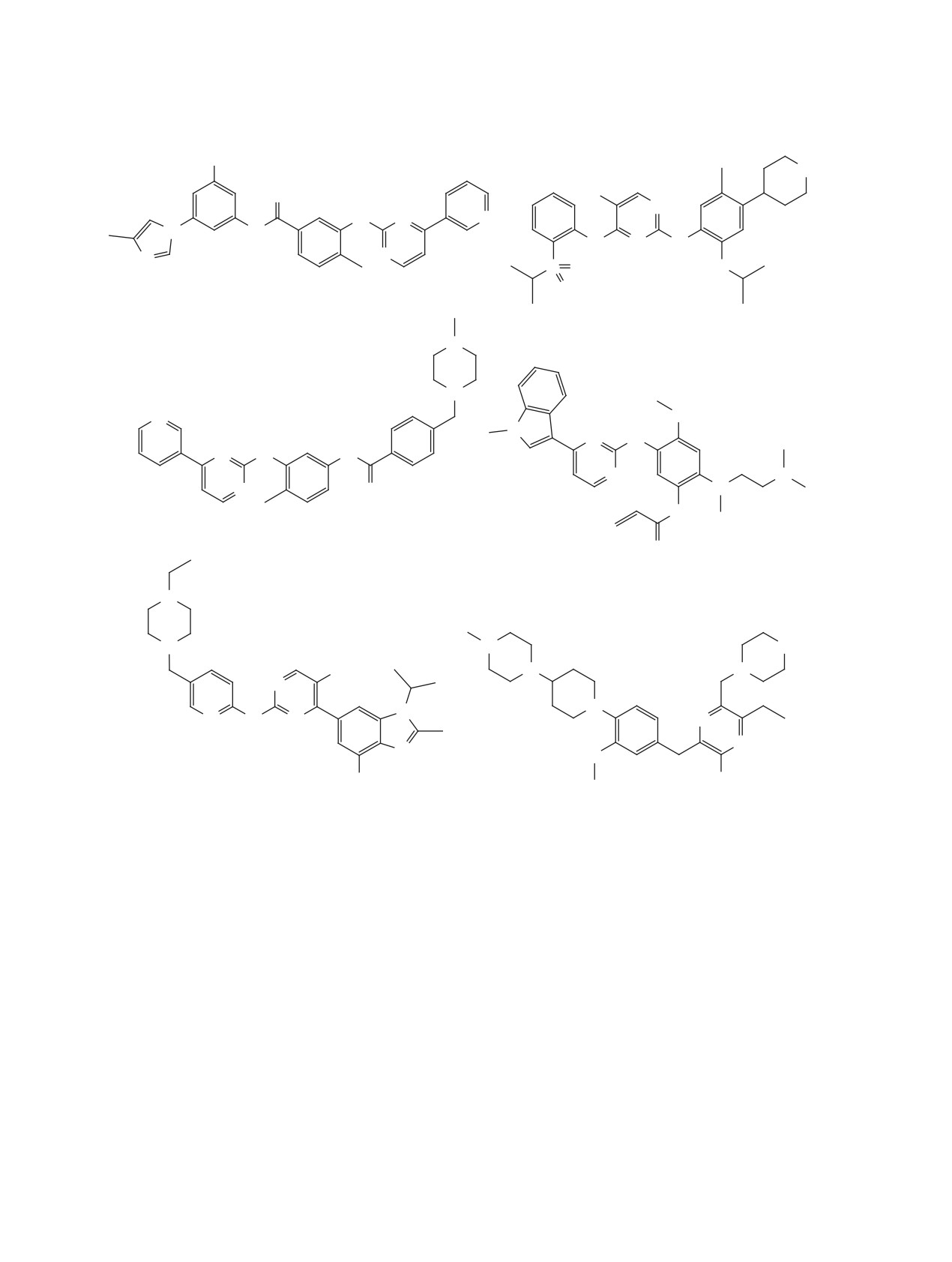
20 [42]
SARS-CoV-2 Mpro IC50= 1.46 uM
19 [45]
SARS-CoV-2 repl. EC50 = 1.28 uM
H
O
NH2
N
O
O
O
O
O
O NH
H
N
O
O N
N
NH
H
H
H
H
N
O
O
N
N
O
22 [47]
21 боцепревир [46]
SARS-CoV 3CLpro IC50 = 6.8 uM
SARS-CoV-2 Mpro IC50 = 5.40 uM
H
N
N
O
OH
N
O
O
H
O
N
H
23 лопинавир [48]
SARS-CoV-2 repl. EC50 = 26.63 uM
Рис. 2. (продолжение)
3CLpro/Mpro коронавирусов необходима для ре-
к мишени. Для соединений данного класса харак-
пликации коронавирусов, и ее активный сайт вы-
терно заметное преобладание в структуре акцеп-
соко консервативен. Так, например, значения IC50
торов водородных связей над донорами.
дифенильного производного 6 [33] примерно оди-
Следующей по распространенности среди из-
наковы как в отношении протеазы SARS-CoV, так
вестных соединений с антикоронавирусной ак-
и SARS-CoV-2. Однако, для успешного использо-
тивностью является группа полифенолов, в том
вания пептидомиметиков следует решить ряд про-
блем, связанных с их биодоступностью и метабо-
числе флавоноидов и халконоидов, а также заме-
лической стабильностью, избирательностью в от-
щенных хромонов и полициклических хинонов.
ношении целевой протеазы и способами доставки
Большинство из соединений этих структурных
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
666
ШИРЯЕВ, КЛИМОЧКИН
типов ингибируют действие вирусных протеаз
аналогом одновременно пиримидиновых и пури-
3CLpro и Mpro, однако также встречаются инги-
новых нуклеозидов.
биторы протеазы Plpro, NTP-геликазы и вирус-
Неожиданным является наличие достаточно
ного ионного канала Е. Среди этих соединений
высокой противовирусной активности у сульфи-
представлены хромоны 24 [49], 25 [53], произво-
дов 65-67 [78-82] и дисульфидов 68-74 [83-84],
дные флавона и изофлавона 26-37 [50-52, 54-57]
содержащих ароматические и азотистые гетеро-
(рис. 3), катехина 38 [58], флаванона 39 [58], фла-
ароматические заместители (рис. 7). В этой группе
вана 40 [52], кумарина 41 [59], нафтохиноны ши-
выделяется дисульфирам 68 [83], не содержащий
конин 42 [60] и плюмбагин 43 [61] и антрахинон
циклических фрагментов, однако обладающий за-
44 [62]. Также достаточно высокой активностью
метной активностью в отношении вируса MERS-
обладают траншиноны 45 [63], 46 [63] (рис. 4),
CoV.
халконоиды 47-49 [64-66], производные бензофе-
нона 50 [61], 51 [62] и дибензодиоксина 52 [67] и
Среди рассмотренного массива активных в
53 [67] (рис. 5).
отношении коронавирусов соединений заметное
место занимают представители шестичленных
Активность полифенолов лежит в пределах
азотсодержащих гетероциклов. К ним относятся
1-50 мкМ, однако для большинства из них она
достаточно широко известные ингибиторы про-
установлена при помощи биохимических тестов в
теинкиназ («тинибы») 75-80 [57, 85, 86], среди
отношении протеаз 3CLpro/Mpro и PLpro, а также
которых следует отметить нилотиниб 75 [85] с
геликазы и N-метилтрансферазы. Собственно ви-
IC50 < 0.01 мкМ (рис. 8).
русингибирующее действие установлено только
для соединений 36 [57] и 37 [57] и находится на
Из гетероциклических соединений, облада-
микромолярном уровне. В целом соединения, не
ющих антикоронавирусной активностью, часто
содержащие углеводного остатка, обладают боль-
встречаются производные хинолина 81-91 [57, 86-
шей активностью, изофлаваноиды более активны,
95], к которым относятся известные противомаля-
чем производные флавона, а лучшие значения IC50
рийные средства, в том числе гидроксихлолрохин
отмечены у хинонов 42 [60] и 45 [63].
82 [87, 88, 89], который какое-то время использо-
вался в клинической практике для лечения боль-
Достаточно активными в отношении коронави-
ных COVID-19 (рис. 9).
русов, действующими в том числе in vitro, являются
модифицированные аналоги нуклеозидов, причем
Антивирусной активностью различного уров-
среди них встречаются как производные пирими-
ня обладают производные пирана 92 [96], 93 [62],
дина 54-58 [60, 68-71], так и производные пурина
пиридина 94-101 [21, 57, 85, 90, 91, 97, 98], изо-
60 [73], 61 [74], 63 [74], 64 [77] (рис. 6). Основной
хинолина 102 [99], тиазолопиридина 103 [100], ок-
мишенью ингибиторов этого хемотипа являет-
сазолопиридина 104 [101] (рис. 10), пиримидина
ся вирусная N-метилтрансфераза nsp14. Только
105-110 [90, 102-105], бензопиримидина 111-113
кармофур 55 [60, 69] проявляет выраженную ак-
[93, 106, 107], имидазолопиримидина 114 [96], 115
тивность (IC50 0.2 мкМ) в отношении протеазы
[109], пиразолопиримидина 116 [96], пиразина 117
3CLpro/Mpro SARS-CoV-2. В целом пиримидино-
[110], бензпиразина 118 [90], 119 [85], бензотиази-
вые производные обладают большей активностью
на 120 [111] (рис. 11) и насыщенных гетероцикли-
по сравнению с пуриновыми. В этой группе особ-
ческих соединений 121-127 [21, 57, 61, 85, 90, 99]
няком стоит производное пирроло[2,1-f][1,2,4]-
(рис. 12), среди которых заслуживают внимание
триазина 62 [75, 76] (ремдисивир), по сути являю-
популярные фармпрепараты гипотензивного дей-
щееся пролекарством. Ремдисивир 62 доказал эф-
ствия амлодипин 99 [85] и папаверин 102 [99]. Для
фективность в клинических испытаниях и активно
большинства соединений этой группы активность
используется в текущей медицинской практике.
определялась на клеточных моделях, поэтому не
Сюда же следует отнести и широко применяемый
ясно, на какую из мишеней коронавирусов дей-
при лечении COVID-19 фавипиравир 59 [72], ко-
ствуют данные вещества. Однако соединения 93
торый также является пролекарством и является
[62], 95-98 [91, 97, 98], 103 [100], 104 [101], 106
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
667
OH O
HO
Cl
OH O
O
O
HN
O
O
I
NC
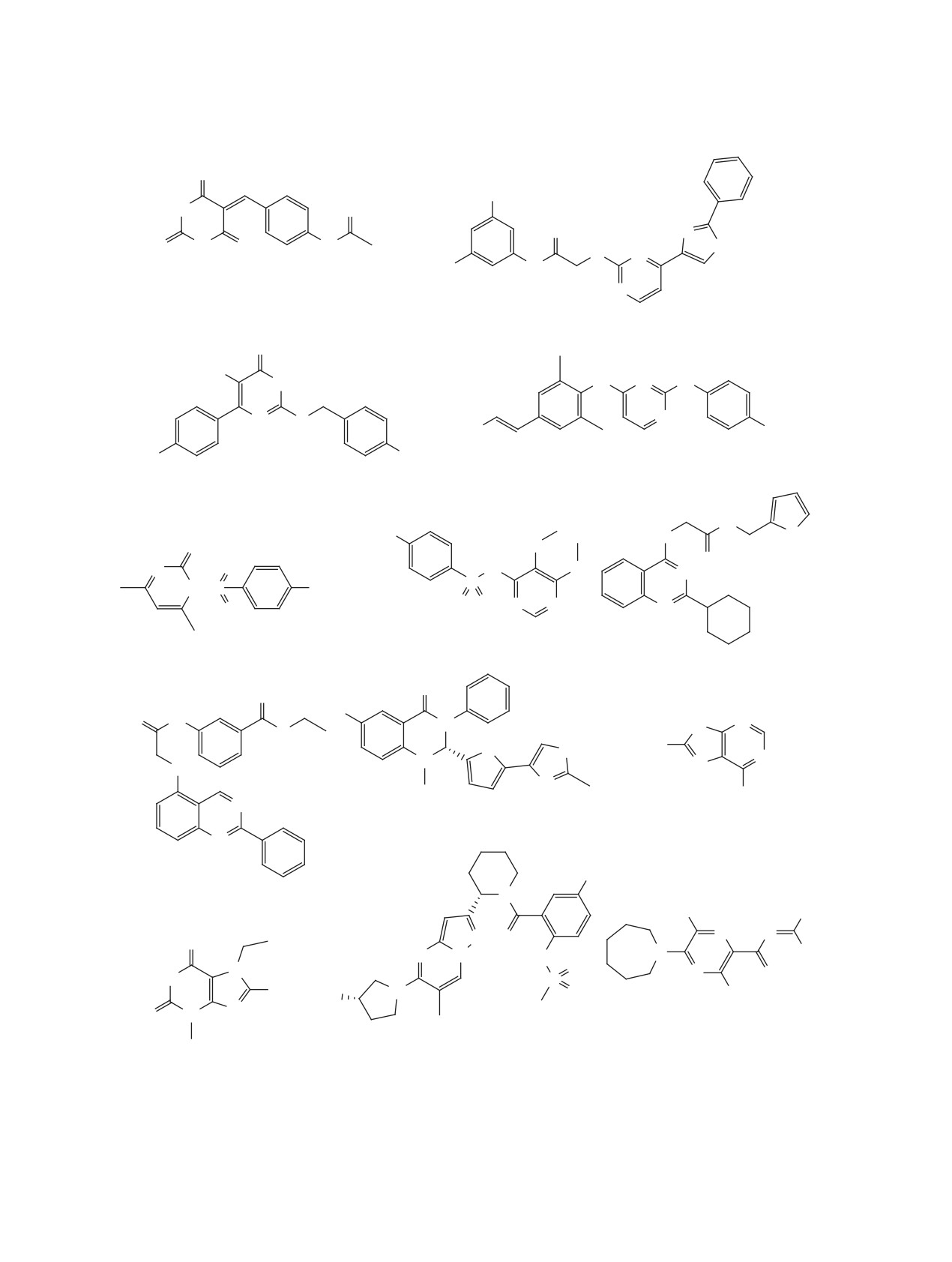
24 [49]
25 [53]
SARS-CoV NTPase/helicase EC50 = 2.7 uM
SARS-CoV NTPase IC50 = 4 uM
helicase IC50 = 11uM
OH O
OH
OH
OH
NC
O
O
HO
O
OH
26 [50]
OH
SARS-CoV helicase IC50 = 2.7 uM
OH O
27 мирицетин [51]
OH
O
SARS-CoV nsp13 IC50 = 2.71 uM
OH
OH
HO
O
HO
O
OH
OH
28 [52]
HO
SARS-CoV PLpro IC50 = 3.7 uM
OH
O
29 скутеллареин [51]
OH O
SARS-CoV nsp13 IC50 = 0.86 uM
HO
O
OH
OH O
OH
HO
O
OH
HO
O
OH
O
OH
31 лутеолин [54]
30 [54]
SARS-CoV 3CLpro IC50 = 20.2 uM
SARS-CoV 3CLpro IC50 = 8.3 uM
Рис. 3. Структуры полифенольных соединений 24-37
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
668
ШИРЯЕВ, КЛИМОЧКИН
OH
O
OH
OH O
OH
HO
HO
O
O
OH
HO
O
O
O
O
O
OH
HO
HO
OH
OH
O
OH
33 баикалин [56]
32 роифолин [55]
SARS-CoV-2 3CLpro IC50 = 34.71 uM
SARS-CoV 3CLpro IC50 = 27.45 uM
OH
OH
HO
OH
HO
OH
O
HO
O
OCH3
O
HO
O
HO
O
OH
OH
OH
O
H3CO
35 гербацетин [56]
OH
O
SARS-CoV-2 3CLpro IC50 = 53.90 uM
34 пектолинарин [56]
SARS-CoV-2 3CLpro IC50 = 51.64 uM
O
O
O
O
OH
O
OH
O
O
OH
37 [57]
SARS-CoV-2 repl. IC50 = 3.87 uM
36 [57]
SARS-CoV-2 repl. IC50 = 3.22 uM
Рис. 3. (продолжение)
[103], 107 [104], 109 [105], 111 [93], 112 [106], 114
57, 99] и ингибитора ВИЧ-протеаз - нелфинави-
[96] и 127 [61] ингибируют работу основной про-
ра 132 [112]. В основном, активность соединений
теазы 3CLpro/Mpro.
определялась исследователями на клеточных мо-
делях, однако для соединений 133-135 [113-115]
Среди производных тетра- 128-131 [48, 57,
мишенью является химотрипсин-подобная проте-
99] и декагидроизохинолина 132-134 [112-115] и
аза 3CLpro/Mpro.
октагидробензопирана 135 [113, 114] встречается
достаточно много соединений, ингибирующих ре-
Поскольку пятичленные гетероциклические
пликацию коронавирусов (рис. 13). Заслуживает
системы являются одними из наиболее часто
внимания заметная активность в отношении SARS-
встречающихся среди известных лекарственных
CoV-2 изохинолиновых алкалоидов 128-131 [48,
препаратов [116], неудивительно, что из соедине-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
669
OCH3
OH
OCH3
OH
O
O
HO
O
HO
OH
OH O
OH
O
39 [58]
38 [58]
SARS-CoV PLpro IC50 = 9.2 uM
SARS-CoV PLpro IC50 = 5.0 uM
OH
HO
O O
OH
HO
O
O
OH
40 [52]
41 [59]
SARS-CoV 3CLpro IC50 = 30.2 uM
SARS-CoV PLpro IC50 = 4.2 uM
MERS-CoV 3CLpro 34.7 uM
SARS-CoV PLpro 35.8 uM
O
MERS-CoV PLpro 48.8 uM
OH O OH
OH O
OH
OH
O
OH
43 плюмбагин [61]
O
SARS-CoV-2 Mpro IC50 = 17.1 uM
OH
O
44 [62]
42 шиконин [60]
SARS-CoV-2 E - 60% инг. при 10 ммоль
SARS-CoV-2 Mpro IC50= 1.5 uM
Orf7b - 75% инг. при 10 ммоль
O
O
O
O
O
O
45 [63]
46 [63]
SARS-CoV PLpro IC50 = 0.8 uM
SARS-CoV 3CLpro IC50 = 14.4 uM
PLpro IC50 = 4.9 uM
Рис. 4. Структуры полифенольных соединений 38-46
ний, активных по отношению к коронавирусам,
85, 90, 91, 100, 118-124] (рис. 14), два 149-160 [57,
этот структурный тип является одним из наиболее
85, 86, 89, 90, 100, 125, 127-129] (рис. 15) и три
представительных. В этой группе представлены
161-165 [60, 86, 94, 130, 131] (рис. 16) гетероато-
гетероциклы, содержащие один 136-148 [57, 61,
ма, в том числе бициклические конденсированные.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
670
ШИРЯЕВ, КЛИМОЧКИН
HO
OMe
OOH
HO
OH
O OH
O OH
47 [64]
SARS-CoV IC50 = 11.4 uM (3CLpro)
48 [65]
1.2 uM (PLpro)
MERS-CoV 3CLpro IC50 = 38.85 uM
O
OH
O
HO
OH
HO
O
HO
OH
HO
49 [66]
50 [61]
SARS-CoV 3CLpro IC50 = 36.2 uM
SARS-CoV-2 Mpro IC50 = 10.6 uM
OH
OH
O
HO
OH
O
OH
HO
O
O
OH
51 [62]
SARS-CoV-2 Mpro IC50 = 10.6 uM
O
O
OH
HO
OH
OH
OH
OH
O
OH
O
O
OH
O
OH
HO
O
HO
O
OH
53 [67]
OH
SARS-CoV 3CLpro IC50 = 8.8 uM
52 [67]
SARS-CoV 3CLpro IC50 = 2.7 uM
Рис. 5. Структуры полифенольных соединений 47-53
Вирусингибирующим действием обладают пор-
го ингибитора ЦОГ-2 целекоксиб 149 [85] (IC50
фирины 139-140 [61, 119], производные индола, в
0.04 мкМ) и противоязвенного препарата оме-
том числе 141 [120] с IC50 0.03 мкМ, и рекомен-
празол 158 [90]. Наивысшей активностью в этой
дованный для лечения больных COVID-19 уме-
группе обладают ралоксифен 148 [85] (0.02 мкМ)
феновир («Арбидол») 145 [90, 123, 124]. Отметим
(рис. 14) и димерное производное бензимидазола
заметную антивирусную активность селективно-
157 [128] (0.003 мкМ!) (рис. 15).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
671
HO
OH
O
F
O
N
O
N
HO
N
NH2
NH
NH
N
O
HO
N
O
F
O
F
O
54 [68]
F
55 кармофур [60, 69]
SARS-CoV-2 repl. EC50 = 0.096 uM
SARS-CoV-2 Mpro IC50 = 0.2 uM
OH OH
PhOO
BnO
56 [70]
O
HN
P
O
P
SARS-CoV-2 repl. EC50 = 0.3 uM
O
O
O
O
O
O
P
O
MeO
N
NH2
O
F
O
N
O
O
N
NH2
F
N
P
N
N
O
NH2
HO
O
F
F
N
N OH
57 [68]
O
59 фавипиравир [72]
SARS-CoV-2 repl. EC50 = 0.73 uM
SARS-CoV-2 repl. EC50 = 61.88 uM
58 [71]
NH2
NH2
N
N
N
N
N N
HO
HO F F
N
N
O
NH2
N
NH2
HO OH
N
HO OO
60 [73]
N
N
N
N
S
O
MERS-CoV repl. EC50 = 0.2 uM
O
N
O2N
H
N
SARS-CoV repl. EC50 = 0.5 uM
O
N
CN
P
O
NH2
HO OH
O
OH
Cl
O
N
61 [74]
O O
N
OH
SARS-CoV nsp14 IC50 = 0.6 uM
HO
N
N
O
NH2
62 ремдесивир [75, 76]
N
N
SARS-CoV-2 repl. EC50 = 0.77 uM
HO OO
N
Cl
N
N
S
O
O
N
N
O
HO OH
N
N
Cl
O
63 [74]
SARS-CoV nsp14 IC50 = 1.5 uM
OH
64 [77]
SARS-CoV repl IC50 = 14.5 uM
Рис. 6. Структуры аналогов нуклеозидов 54-64
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
672
ШИРЯЕВ, КЛИМОЧКИН
CN
NO
2
I
S
N OCH3
N
S
S
N N
NH
N
N
OCH3
S
65 [78]
N
H
SARS-CoV MPro IC50 = 3.30 uM
66 [79, 80, 81]
SARS-CoV nsp13 IC50 = 5.9 uM
67 вортиоксетин [82]
SARS-CoV-2 repl. IC50 = 8.03 uM
S
S
N
N N
N S
S
NO2
N
S
O S
S
Cl
S
68 дисульфирам [83]
N
69 [84]
MERS-CoV 3CLpro IC50 = 14.6 uM
SARS-CoV Mpro IC50 = 0.516 uM
SARS-CoV 3CLpro IC50 = 24.1 uM
70 [85]
SARS-CoV Mpro IC50 = 0.883 uM
N
S
H
N
S
S
O
S
S
N
O2
N
72 [84]
N
N
S
71 [60]
SARS-CoV Mpro IC50 = 1.250 uM
S
SARS-CoV-2 Mpro IC50 = 0.9 uM
N
H3COOC
O2N
N
N
S
73 [84]
S
SARS-CoV Mpro IC50 = 1.762
N
H
74 [84]
SARS-CoV Mpro IC50 = 2.075 uM
Рис. 7. Структуры сульфидов и дисульфидов 65-74
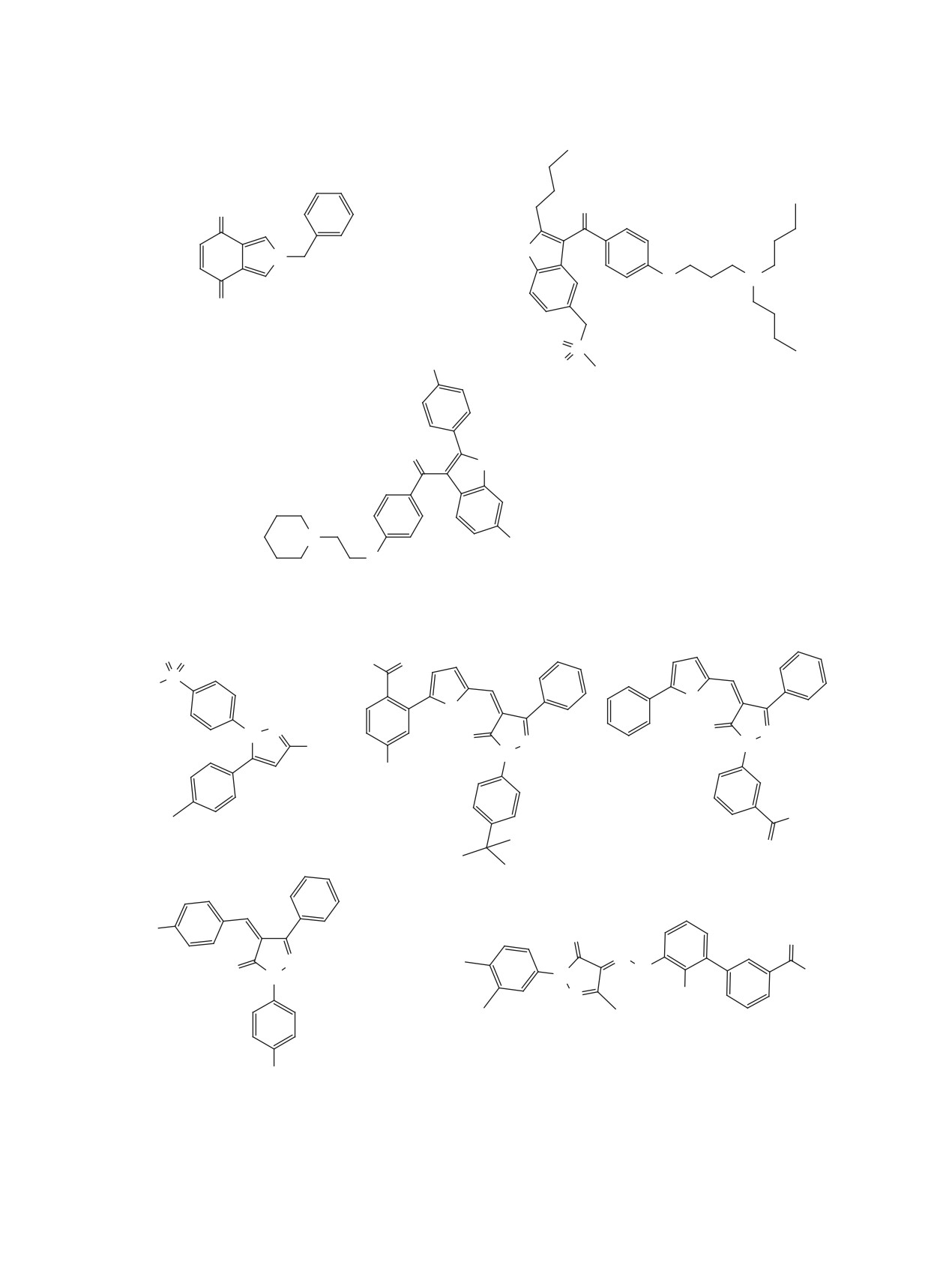
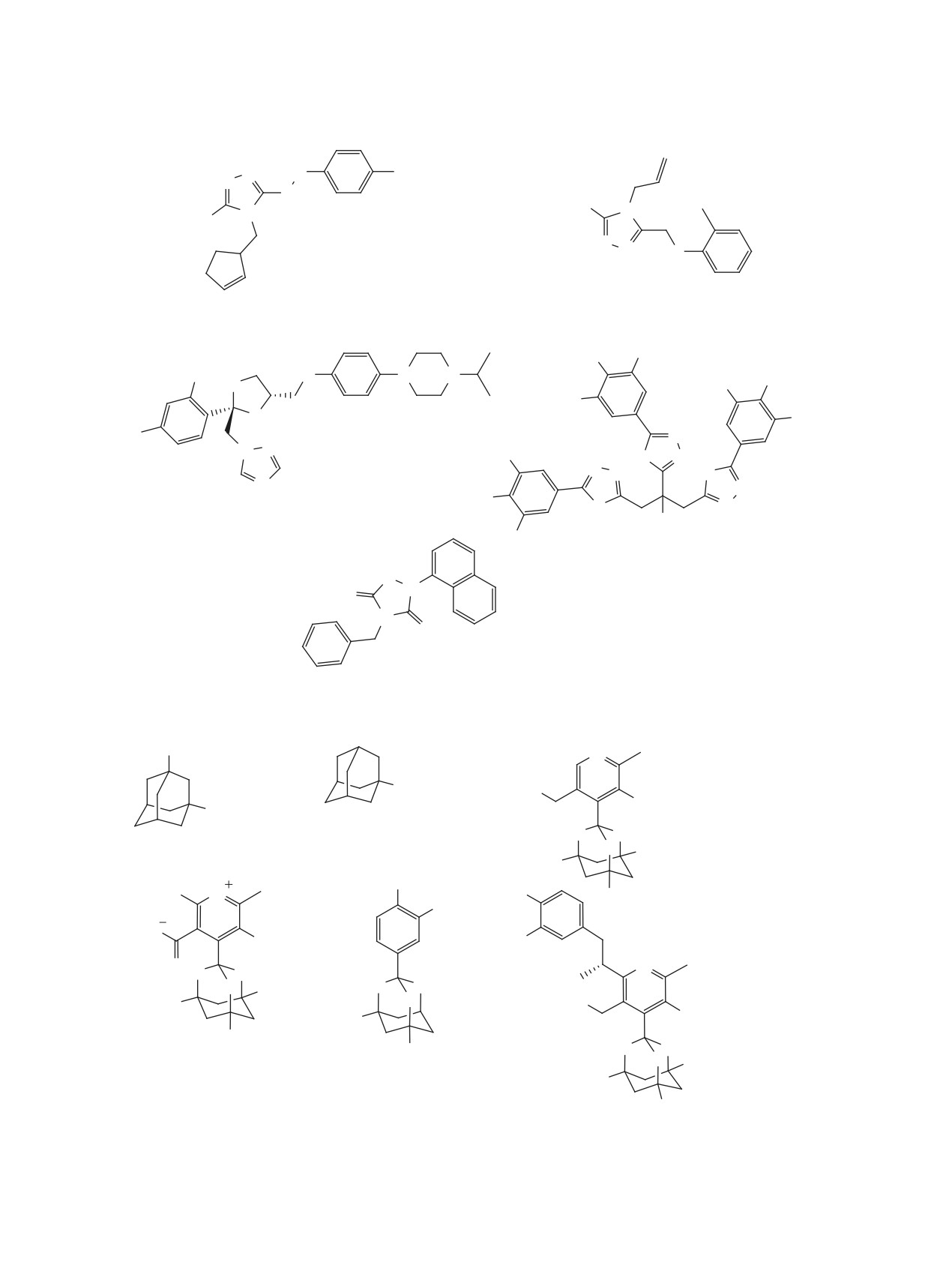
Соединения каркасной структуры 166 [134],
гибирующая активность метиленового синего 178
167 [62], антивирусная активность которых в от-
[137] (IC50 0.22 мкМ).
ношении ионных каналов М2 вируса гриппа [132,
Препараты, активные фармацевтические ингре-
133] хорошо известна, оказались активными и в
диенты которых содержат в своей структуре ди- и
отношении SARS-CoV-2 (рис. 17). Обнаружено,
трианнелированные семичленные гетероциклы:
что амантадин 166 и 3-фторамантадин 167 спо-
азепин 179 [90], ди- и тетрагидроазепины 180-182
собны связываться с ионным каналом E. Однако,
[48, 85, 86] и дигидрооксепин 183 [82] подавляют
производные бананина 168-171 [135, 136], име-
репликацию SARS-CoV-2 в микромолярном диа-
ющие триоксаадамантановый каркас, ингиби-
пазоне (рис. 19).
руют другую мишень коронавирусов - геликазу
nsp13.
Ряд лекарственных препаратов, на основе со-
единений дифенилметильный фармакофор 184-
Нейролептики фенотиазинового ряда 172-177
189 [46, 57, 85, 86], проявляют выраженную актив-
[57, 86, 137] ингибируют репликацию корона-
ность в отношении коронавирусов (рис. 20).
вирусов в микромолярном диапазоне (рис. 18).
Российскими учеными в условиях фотодинами-
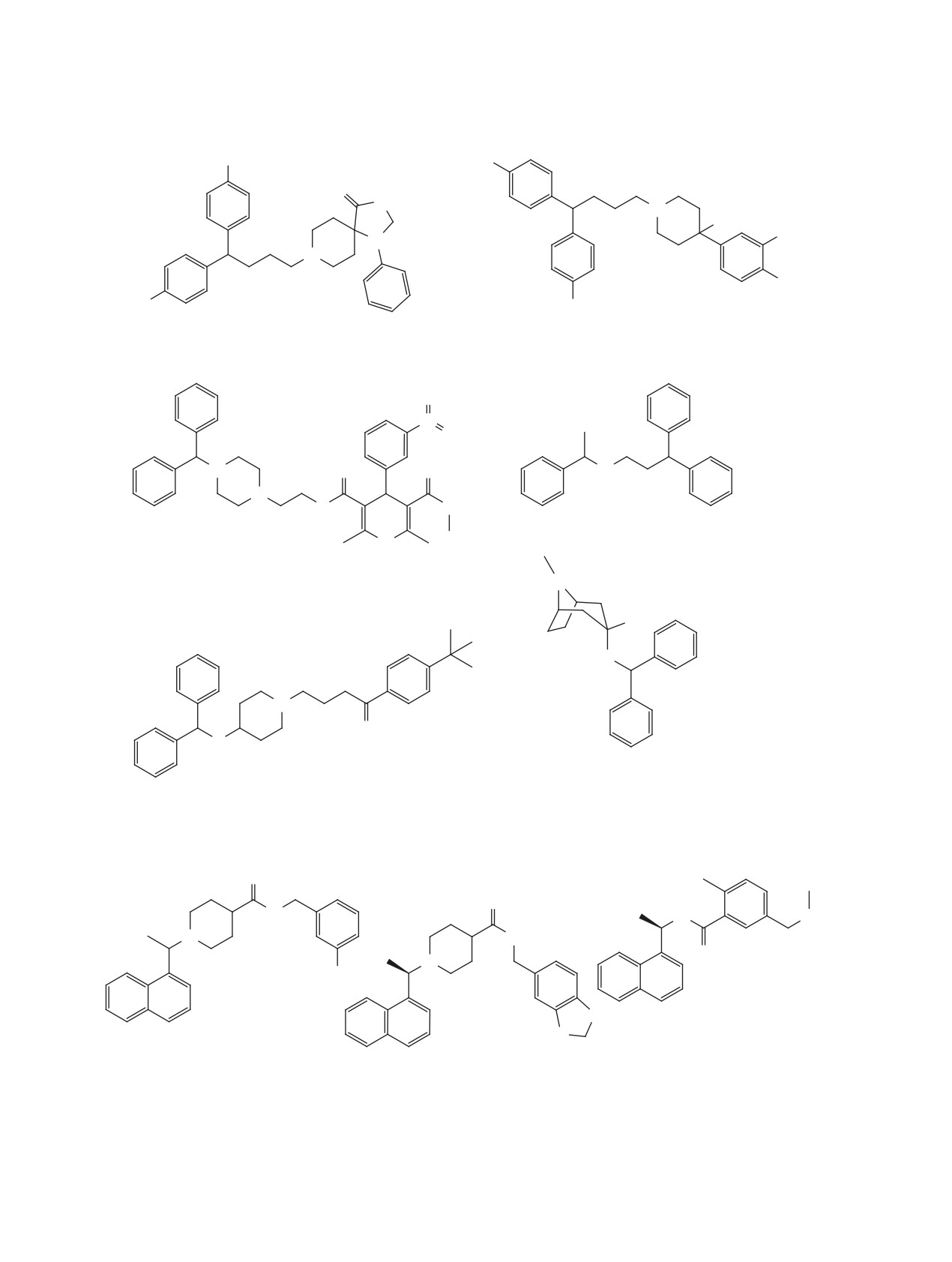
Достаточно подробно изучен ряд соединений,
ческой активации обнаружена высокая вирусин-
содержащих
1-(нафт-1-ил)этильный фрагмент
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
673
CF3
NH
O
Cl
H
N
N
N
N
N
N
H
N
N N
N
H
H
N
S
O
O
O
75 нилотиниб (AMN-107) [85]
SARS-CoV-2 repl. IC50 < 0.01 uM
76 церитиниб [57]
SARS-CoV-2 repl. IC50 = 2.86 uM
N
N
N
O
H
N
H
H
N
N
N
N
N
N
N
N
O
N
NH
77 иматиниб [86]
SARS-CoV-2 repl. IC50 = 3.24 uM
O
78 осиметриниб [57]
SARS-CoV-2 repl. IC50 = 3.26 uM
N
N
N
O
F
N
N
N
N
N
N N
N
N
H
N
N
O
F
CONH2
79 абемациклиб [57]
80 гилтеритиниб [57]
SARS-CoV-2 repl. IC50 = 6.62
SARS-CoV-2 repl. IC50 = 6.76 uM
Рис. 8. Структуры ингибиторов протеинкиназ («тинибов») 75-80
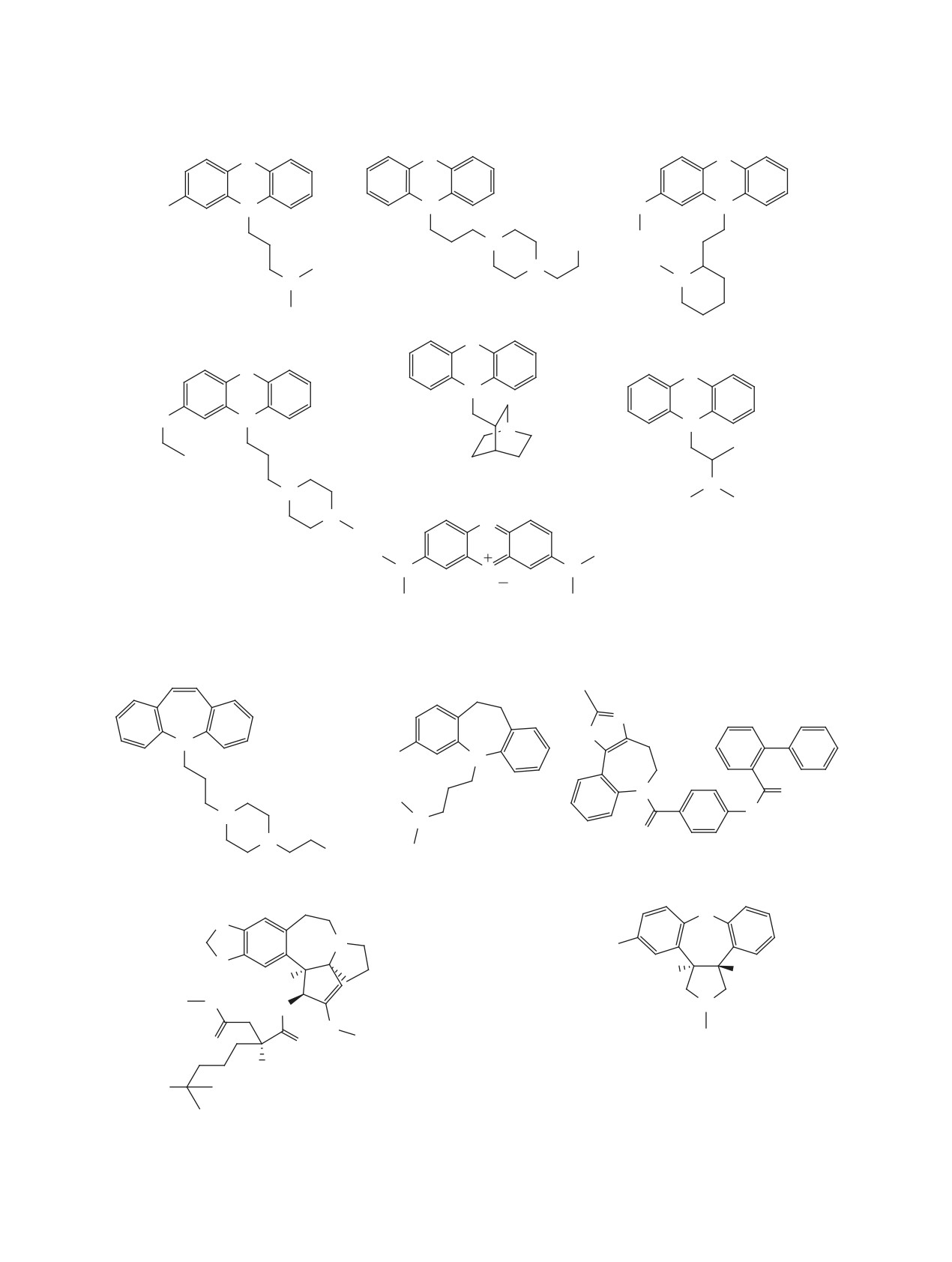
190-196 [138-142] (рис. 21). Они показывают вы-
репродукцию SARS-CoV-2 in vitro (рис. 22). Такие
сокую активность in vitro как в отношении папа-
соединения, как нафамостат 206 [99, 144], голу-
ин-подобной протеазы PLpro SARS-CoV и SARS-
бой Эванса 207 [61], камостат 208 [99] и гексахло-
CoV-2, так и вызывают угнетение репликации ви-
рофен 209 [57], обладают высокой активностью,
русных частиц на клеточных моделях в микро и
находящейся в субмикромолярном диапазоне
субмикромолярном диапазонах.
(рис. 23).
Значительное количество соединений арома-
Некоторые ртутьорганические соединения 217
тической природы 197-216 [57, 61, 85, 86, 90, 99,
[61, 148] и 218 [61], органические сульфиды и
143-147], в том числе некоторые антагонисты
комплексы цинка 219-222 [148], висмута
223
эстрогена 197-201 [57, 86], к которым принадле-
[149, 150], а также бронопол 224 [148] эффектив-
жит тамоксифен 200 [86], и противогельминтные
но ингибируют химотрипсин-подобную протеазу
препараты 202-204 [57-85] способны подавлять
3CLpro/Mpro SARS-CoV и SARS-CoV-2 (рис. 24).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
674
ШИРЯЕВ, КЛИМОЧКИН
Cl
N
Cl
N
Cl
N
HN
HN
HO
HN
N
N
N
OH
83 амодиахин [86]
81 хлорохин [87, 88, 89]
82 гидроксихлорохин [87, 88, 89]
SARS-CoV-2 repl. IC50 = 2.59 uM
SARS-CoV-2 repl. EC50 = 5.47 um SARS-CoV-2 repl. EC50 = 0.72 uM
CF3
HO
N
N
CF3
MeO
N
Cl
O
H
N
HO
N
HO
86 [91]
85 хинидин [90]
SARS-CoV-2 3CLpro IC50 = 13.8 uM
SARS-CoV-2 repl. EC50 = 5.11 uM
84 мефлохин [86]
SARS-CoV-2 repl. IC50 = 7.11 uM
O
OH
N
NH
O
O
N
O
O
N
N
H
S
O
N
H
N
H
O
O
O
N
NH
87 ивакафтор [57]
S
O O
N
SARS-CoV-2 repl. IC50 = 6.57 uM
H
89 [93]
SARS-CoV 3CLpro IC50 = 17.2 uM
88 симепревир [92]
SARS-CoV-2 Mpro IC50 = 9.6 uM
N
Cl
OH
N
OH
N
OH
O
S
COO-Na+
OH
Cl
N
90 [94]
OH
SARS-CoV-2 repl. EC50 = 1.01 uM
91 монтелукаст [95]
MERS-CoV S IC50 = 3 uM
Рис. 9. Структуры производных хинолина 81-91
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
675
CN
O
CF3
O
O
O
O
N
93 [62]
OH
SARS-CoV-2 E - 80% инг. при 10 ммоль
HO
O
3a - 20% инг. при 10 ммоль
HO
O
S
N
Orf7b - 50% инг. при 10 ммоль
N
O
H
94 зотатифин [21]
92 типранавир [96]
SARS-CoV-2 repl. IC90 = 0.037 uM
SARS-CoV-2-Nluc repl. IC50 = 8.65 uM
F
O
O
Cl
HN
O
O
O
N
H
O
O
O
N
O2N
O
N
97 [98]
96 [91]
SARS-CoV 3CLpro IC50 = 7.9 uM
95 [97]
FCoV 3CLpro IC50 = 3.56 uM
SARS-CoV 3CLpro IC50 = 0.06 uM
SARS-CoV 3CLpro IC50 = 7.00 uM
SARS-CoV-2 3CLpro IC50 = 12.72 uM
H
N
NH2
O
N
Cl
Br
O
N
MeOOC
COOEt
O
N
Cl
H2N
N
NH2
98 [98]
SARS-CoV 3CLpro IC50 = 13 uM
100 феназопиридин [57]
SARS-CoV-2 repl. IC50 = 28.0
O
99 амлодипин [85]
O
SARS-CoV-2 repl. IC50 = 10.28 uM
S
N
N
O
O
O
N
S
F
N
N S
O
O
NH
O
O
101 вонопразан [90]
103 [100]
SARS-CoV-2 repl. EC50 = 35.38 uM
O
SARS-CoV 3CLpro IC50 = 7.2 uM
102 папаверин [99]
O
SARS-CoV-2 repl. IC50 = 1.1 uM
HN
O
O
N N
Cl
104 [101]
SARS-CoV Mpro EC50 = 6 uM
Рис. 10. Структуры шестичленных гетероциклических соединений 92-104
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
676
ШИРЯЕВ, КЛИМОЧКИН
O
Cl
HN
O
O
N
S
N
O
N
S
H
H
S
N
Cl
N
H
105 [102]
N
SARS-CoV ATPase IC50 = 1.19 uM
106 [103]
helicase IC50 = 32.9 uM
SARS-CoV 3CLpro IC50 = 3 uM
O
NC
H
H
NH
N
N
N
N S
N
NC
CN
108 рилпивирин [96]
Cl
NO2
SARS-CoV-2-Nluc repl. IC50 = 7.8 uM
107 [104]
3CLpro SARS-CoV IC50 = 6.1 uM
H
N
H2N
S
O
O
O
H
O
N
O
O
N
N
S
N S
NH2
O
O O N N
N
110 сульфадоксин [90]
109 [105]
SARS-CoV-2 repl. EC50 = 35.37 um
111 [93]
MERS-CoV 3CLpro IC50 = 20.0 uM
SARS-CoV 3CLpro IC50 = 18.2 uM
O
O
H
F
H
O
N
N
N
N
O
F3C
S
S
N
N
S
N
N
NH2
N
113 [107]
114 [96]
N
SARS-CoV-2 repl IC50 = 0.08 uM SARS-CoV 3CLpro IC50 = 13.9 uM
Cl
112 [106]
N
SARS-CoV 3CLpro IC50 = 5.8 uM
Cl
NH
2
N N
N O
O
N N
N
NH2
HN
N
O
N
O
HN
S
SH
N
O
H2N
NH2
O
N N
117 гексаметиленамилорид [110]
116 пресатовир [96]
HCoV-229E repl. EC50 = 1.34 uM
115 [109]
SARS-CoV-2-Nluc repl. IC50 = 2.53 uM
SARS-CoV ATPase IC50 = 8.66 uM
helicase IC50 = 41.6 uM
Рис. 11. Структуры шестичленных гетероциклических соединений 105-120
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
677
Cl
O OH
O
F
F
N
H
N
N
O
H
N
N
Cl
O
118 долутегравир [90]
N
N
SARS-CoV-2 repl. EC50 = 22.04 uM
H
119 клофазимин [85]
SARS-CoV-2 repl. IC50 = 0.01 uM
OH
O
Cl
N
F
S
F
O O
O N
CF3
H
120 [111]
SARS-CoV-2 repl. IC50 = 0.88 uM
Рис. 11. (продолжение)
O
O
H
O
OH
NH
O
F
N
H
HN
O
N
N
123 перексилин [57]
121 циклогексимид [99]
= 6.38 uM
SARS-CoV-2 repl. IC50
SARS-CoV-2 repl. IC50 = 0.58 uM
122 спиперон [90]
O
SARS-CoV-2 repl. EC50 = 2.49 uM
N
OH
N
O
Cl
O
125 диклонин [90]
N
SARS-CoV-2 repl. EC50 = 10.00 uM
S
124 лоперамид [57]
SARS-CoV-2 repl. IC50 = 9.27
O
N
O
OH
O
N
127 ванитиолид [61]
N
SARS-CoV-2 Mpro IC50 = 4.6 uM
126 PB-28 [21, 85]
SARS-CoV-2 repl. IC90 = 0.278 uM
Рис. 12. Структуры шестичленных гетероциклических соединений 121-127
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
678
ШИРЯЕВ, КЛИМОЧКИН
O
O
O
O
O
NH
Cl
O
N
O
H
O
O
O
N
H
H
N
O
O
H
N
O
O
O
O
129 тетрандрин [57]
130 цефарансин [57]
128 эметин [48, 99]
SARS-CoV-2 repl. IC50 = 3.00 uM
SARS-CoV-2 repl. IC50 = 4.47 uM
SARS-CoV-2 repl. EC50 = 0.46 uM
O
H
H
N
O
N
Ac Thr Gly
O
N
O
H
N
NH
H
O
H
H
NH
N
O
HO
OH
N O
N
N
O
S
H
O
Br
OH
132 нелфинавир [112]
133 [113, 114]
SARS-CoV-2 repl. EC50 = 1.3 uM
131 бербамин [57]
SARS-CoV 3CLpro IC50 = 20.0 uM
SARS-CoV-2 repl. IC50 = 7.87 uM
NH
N
N
H
O
HN
O
H
H
N
O
HN
N
H
O NH
135 [113, 114]
SARS-CoV 3CLpro IC50 = 95 uM
F
134 [115]
SARS-CoV-2 3CLpro IC50 = 57 uM
Рис. 13. Структуры гидрированных аналогов изохинолина 128-135
Среди природных и полусинтетических тетра-
CoV-2 (рис. 25). Сотрудниками ФГБУ НИИ гриппа
и пентациклических тритерпеноидов были най-
МЗ РФ и Уфимского НЦ РАН изучалась активность
дены вещества 225-234 [57, 90, 151-155] способ-
производных глицирретовой и глицирризиновой
ные подавлять репликацию коронавирусов SARS-
кислот в отношении SARS-CoV. Наилучшую ак-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
679
CN
H
CN
N
O
O
SO2NH2
CN
CN
O
136 [117]
SARS-CoV ATPase IC50 = 2.09 uM
137 [91]
helicase IC50 = 13.2 uM
SARS-CoV-2 3CLpro IC50 = 16.14 uM
O2N
O
H
N
N
HN
N
N
O
O
Bi NO
3
N
N
138 [118]
SARS-CoV 3CLpro IC50 = 38.6 uM
139 [119]
NH
N
SARS-CoV helicase EC50 = 3 uM
Cl
O O
O
N HN
O
N
H2N
O
N
N
H
HOOC
COOH
141 [120]
140 гематопорфирин [61]
SARS-CoV 3CLpro IC50 = 0.03 uM
142 [121]
SARS-CoV-2 Mpro IC50 = 3.9 uM
EC50 = 6.9 uM
SARS-CoV 3CLpro IC50 = 0.37 uM
O
O
O
OH
S
N
O
N
H
O
N
143 [122]
N
O
N
SARS-CoV 3CLpro IC50 = 1.18 uM
OH
O
S
N
Br
OH
145 умифеновир [90, 123, 124]
144 базедоксифен [57]
SARS-CoV-2 repl. EC50 = 10.7 uM
SARS-CoV-2 repl. IC50 = 3.44 uM
Рис. 14. Структуры производных пятичленных гетероциклических соединений 136-148
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
680
ШИРЯЕВ, КЛИМОЧКИН
O
O
O
N
O
N
O
146 [100]
O
S
SARS-CoV 3CLpro IC50 = 7.0 uM
HO
O
147 дронедарон [57, 85]
SARS-CoV-2 repl. IC50 = 3.92 uM
O
S
N
OH
O
148 ралоксифен [85]
SARS-CoV-2 repl. IC50 = 0.02 uM
Рис. 14. (продолжение)
O
O
HO O
S
H
2N
O
O
O
N N
N
O
CF3
N
N
N
Cl
OH
149 целекоксиб [85]
SARS-CoV-2 repl. IC50 = 0.04 uM
O
151 [125]
150 [125]
MERS-CoV 3CLpro IC50 = 5.8 uM
SARS-CoV 3CLpro IC50 = 5.8 uM
HOOC
O
O
N
N
O
N
N
N
OH
H
N
OH
153 элтромбопаг [86, 127]
SARS-CoV-2 repl. IC50 = 8.27 uM
S-ACE2 комплекс
F
152 [89]
SARS-CoV 3CLpro IC50 = 6.8 uM
Рис. 15. Структуры производных пятичленных гетероциклических соединений 149-157
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
681
N
O
O O
O2N
S
N
H
N
O
N
N
O
155 нитразоксанид [89]
O
N
= 2.12 uM
SARS-CoV-2 repl. IC50
O
O
NH
N
HN
N
O
N
N
O
N
N
154 [100]
SARS-CoV 3CLpro IC50 = 3.3 uM
H2N
O
O
O
S
O
H2N
N
Cl
N
N
H
O
O
O
157 [128]
Cl
HCoV-229E repl EC50 = 0.003 uM
COOH
156 лусутромбопаг [57]
SARS-CoV-2 repl. IC50 = 3.78 uM
Cl
O
N
O
O
S
N
N
N
O
H
Se
N
N
N
160 эбселен [129]
158 омепразол [90]
SARS-CoV PLpro IC50 = 8.45 uM
SARS-CoV-2 repl. EC50 = 17.06 uM
159 клемизол [90]
SARS-CoV-2 PLpro IC50 = 2.26 uM
SARS-CoV-2 repl. EC50 = 23.94 uM
Рис. 15. (продолжение)
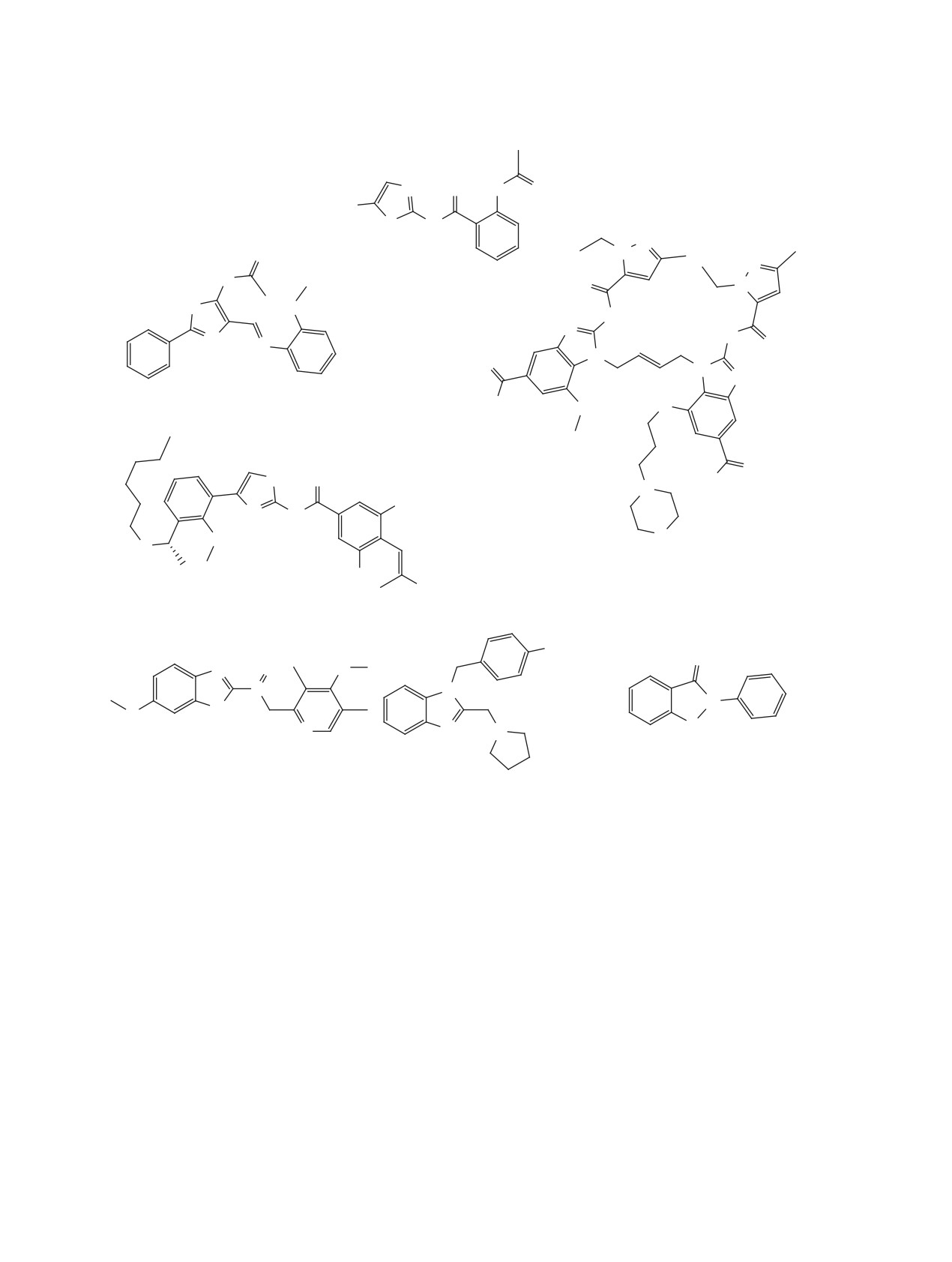
тивность показало соединение 231 (IC50 5 мкМ).
ивермектинов, среди которых наибольшей актив-
Вирусные мишени данного класса соединений
ностью обладает ивермектин B1a 243 [158] (IC50
удалось выяснить только для производного бету-
2 мкМ) (рис. 26).
лоновой кислоты 227 (эндорибонуклеаза nsp15)
ВЫВОДЫ
и для глицирризиновой кислоты 233 («шиповой»
Накопленный объем данных по противовирус-
белок S).
ной активности низкомолекулярных соединений
Ряд природных и полусинтетических антибио-
в отношении коронавирусов в основном пред-
тиков 235-240 [57, 85, 90, 156, 157] показали до-
ставлен с точки зрения мишени (главным образом
статочно высокую эффективность против корона-
3CLpro/Mpro и PLpro протеаз), на которые дей-
вирусов in vitro. Также активными в лабораторных
ствуют вещества. Такой подход несомненно очень
моделях оказались противогрибковый препарат
удобен, в особенности учитывая недавнее полу-
анидулафунгин 241 [57], иммунодепрессант ци-
чение экспериментальных трехмерных структур
клоспорин 242 [158] и ряд противопаразитарных
белков-мишеней коронавирусов и их комплексов
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
682
ШИРЯЕВ, КЛИМОЧКИН
HN
I
N N
NH
HS
N
N
HS
N N
S
162 [131]
161 [130]
SARS-CoV helicase IC50 = 5.6 uM
MERS-CoV ATPase IC50 = 0.47 uM
helicase IC50 = 2.5 uM
OH
HO
Cl
O
N N
OH
O
HO
HO
O
OH
Cl
N
N N
HO
O
N
N
N
O
N
N
HO
163 терконазол [86]
O
N
OH
SARS-CoV-2 repl. IC50 = 11.92 uM
HO
164 [94]
SARS-CoV-2 repl. EC50 = 0.31 uM
S
N
O
N
O
165 тидеглусиб [60]
SARS-CoV-2 Mpro IC50 = 2.1 uM
Рис. 16. Структуры производных пятичленных гетероциклических соединений 161-165
NH2
N
NH2
HO
OH
F
168 бананин [135, 136]
167 [62]
O
O
SARS-CoV nsp13
166 [134] SARS-CoV-2 E инг. 77% инг. при 10 ммоль
O
OH
IC50 = 3.0 uM
SARS-CoV-2 E
Orf10 65% инг. при 10 ммоль
HO
H
OH
I
N
HO
OH
OCH
3
171 эубананин [135, 136]
O
SARS-CoV nsp13
OH
H3CO
IC50 = 5.4 uM
O
N
O
O
O
O
O
OH
HO
O OH
HO
HO
OH
OH
O
O
OH
169 иодобананин [135, 136]
O
OH
170 ванилинбананин [135, 136]
SARS-CoV nsp13 IC50 = 7.0 uM
HO
SARS-CoV nsp13 IC50 = 2.7 uM
OH
Рис. 17. Структуры каркасных соединений 166-171
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
683
S
S
S
Cl
N
N
S
N
N
OH
N
N
N
173 флуфеназин [86]
= 6.36 uM
SARS-CoV-2 repl. IC50
172 хлорпромазин [86]
174 тиоридазин [57]
SARS-CoV-2 repl. IC50 = 3.14 uM
S
SARS-CoV-2 repl. IC50 = 6.69 uM
S
S
N
S
N
N
N
176 мехитазин [57]
N
N
SARS-CoV-2 repl. IC50 = 7.28 uM
177 прометазин [86]
N
N
= 9.21 uM
SARS-CoV-2 repl. IC50
175 тиэтилперазин [86]
SARS-CoV-2 repl. IC50 = 7.09 uM
N
S
N
Cl
178 метиленовый синий [137]
SARS-CoV-2 repl. IC50 = 0.22 uM
Рис. 18. Структуры нейролептиков фенотиазинового ряда 172-177 и метиленового синего 178
N
HN
N
Cl
N
N
O
N
NH
N
O
N
OH
180 кломипрамин [86]
181 кониваптан [85]
179 опипрамол [90]
= 10.34
SARS-CoV-2 repl. IC50 = 5.63 uM SARS-CoV-2 repl. IC50
SARS-CoV-2 repl. EC50 = 5.05 uM
O
O
N
Cl
182 омацетоксин
O
(гомохаррингтонин) [48]
H
H
H
SARS-CoV-2 repl.
O
N
O
EC50 = 2.55 uM
O
O
O
183 азенапин [82]
SARS-CoV-2 repl. IC50 = 16.70 uM
OH
HO
Рис. 19. Структуры ди- и трианнелированных семичленных гетероциклов 179-183
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
684
ШИРЯЕВ, КЛИМОЧКИН
F
F
O
NH
N
OH
CF3
N
N
Cl
F
F
184 флуспирилен [86]
185 пенфлуридол [57]
SARS-CoV-2 repl. IC50 = 3.16 uM
SARS-CoV-2 repl. IC50 = 5.01 uM
O
N
O
N
O
O
N
H
N
O
O
187 фендилин [85]
SARS-CoV-2 repl. IC50 = 10.23 uM
N
H
186 манидипин [46]
N
SARS-CoV-2 Mpro IC50 = 4.81 uM
H
O
N
O
O
189 бензтропин [86]
SARS-CoV-2 repl. IC50 = 13.8 uM
188 эбастин [57]
SARS-CoV-2 repl. IC50 = 6.92 uM
Рис. 20. Структуры соединений 184-189, содержащих дифенилметильный фармакофор
O
O
H
N
N
NH
H
N
NH
O
N
F
O
192 [140]
O
190 [138]
SARS-CoV PLpro IC50 = 1.3 uM
SARS-CoV PLpro IC50 = 0.15 uM
191 [139]
repl. EC50 = 2.5 uM
SARS-CoV PLpro IC50 = 0.32 uM
repl. EC50 = 9.1 uM
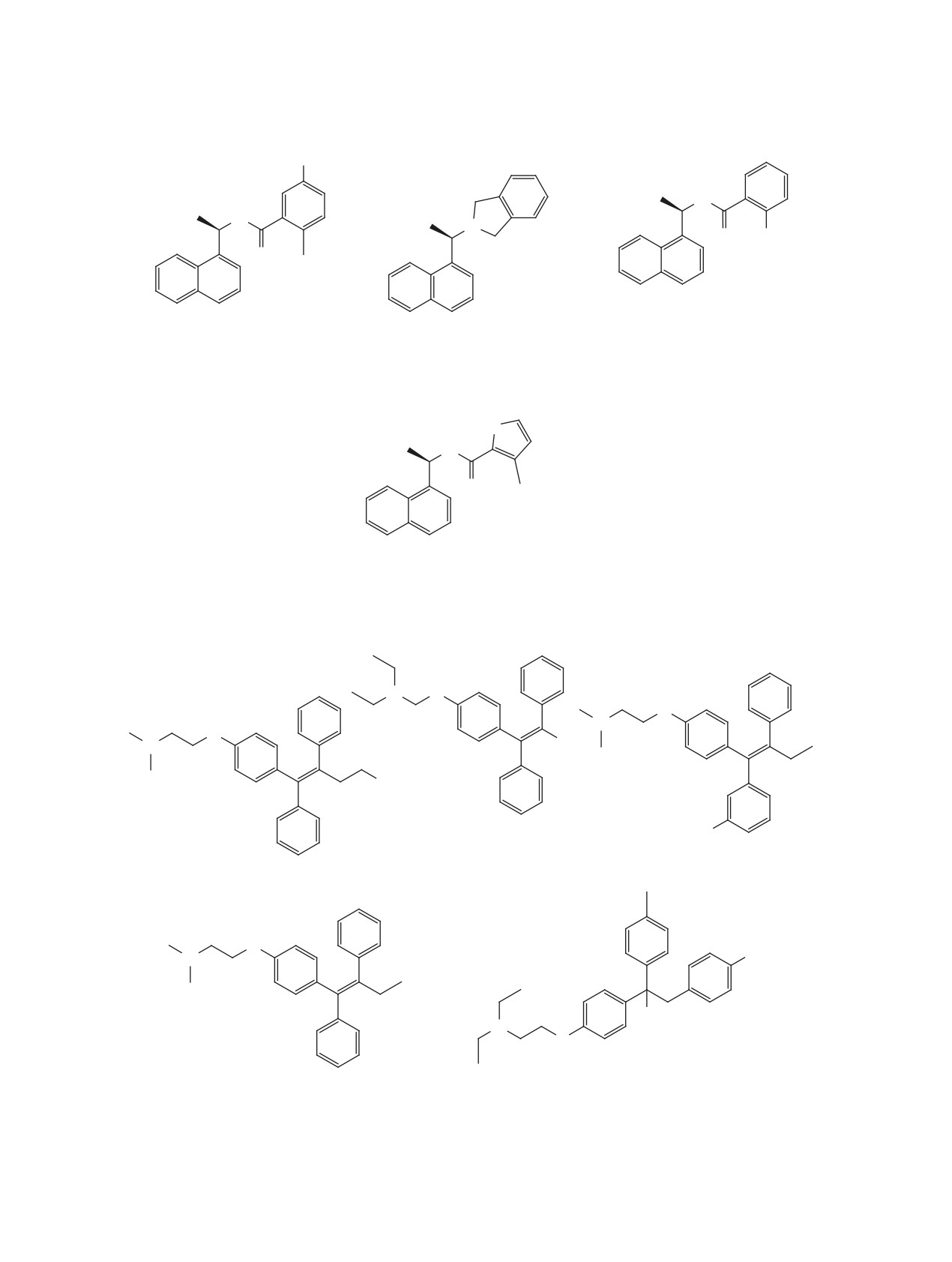
Рис. 21. Структуры соединений 190-196, содержащих 1-(нафт-1-ил)этильный фрагмент
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
685
NH2
H
N
H
N
N
O Cl
O
195 [142]
193 [141]
SARS-CoV PLpro IC50 = 6.5 um
194 [142]
SARS-CoV-2 PLpro IC50 = 2.2 uM
SARS-CoV-2 PLpro IC50 = 15 uM
SARS-CoV PLpro IC50 = 2.9 um
SARS-CoV-2 repl. EC50 = 1.77 uM
SARS-CoV-2 PLpro IC50 = 7.6 uM
SARS-CoV-2 repl. EC50 = 7.85 uM
S
H
N
O
196 [142]
SARS-CoV PLpro IC50 = 14 um
SARS-CoV-2 PLpro IC50 = 42 uM
SARS-CoV-2 repl. EC50 = 4.74 uM
Рис. 21. (продолжение)
N
O
O
N
O
Cl
N
Cl
198 кломифен [57]
HO
SARS-CoV-2 repl. IC50 = 5.36
199 дролоксифен [57]
197 торемифен [86]
SARS-CoV-2 repl. IC50 = 6.60 uM
SARS-CoV-2 repl. IC50 = 4.77 uM
O
N
Cl
OH
N
O
201 трипаранол [86]
200 тамоксифен [86]
SARS-CoV-2 repl. IC50 = 4.68 uM
SARS-CoV-2 repl. IC50 = 34.12 uM
Рис. 22. Структуры соединений ароматической природы 197-204
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
686
ШИРЯЕВ, КЛИМОЧКИН
Cl
NO2
Cl
O
O
Br
Cl
OH
O
N
N
H
H
Cl
Cl
N
Cl
OH
OH
H
OH
202 никлозамид [57]
204 [85]
Cl
SARS-CoV-2 repl. 0.28 uM
SARS-CoV-2 repl. IC50 = 8.86 uM
Cl
203 оксиклозанид [57]
SARS-CoV-2 repl. IC50 = 3.71 uM
Рис. 22. (продолжение)
B(OH)2
H2N
N
O
NH2
H
N
O2N
O
NH2
O
O
NO2
N
NH
H
206 нафамостат [99, 144]
205 [143]
SARS-CoV-2 repl. IC50 = 0.04 uM
SARS-CoV 3CLpro Ki = 0.04 uM
B(OH)2
SO3Na
N
NaO3S
N
NH2
OH
OH NH
2
N
SO3Na
N
207 голубой Эванса [61]
SARS-CoV-2 Mpro IC50 = 0.2 uM
O
SO3Na
O
Cl
Cl
O
N
Cl Cl
O
NH
O
Cl
Cl
H2N N
H
208 камостат [99]
OH
OH
SARS-CoV-2 repl. IC50 = 0.64 uM
209 гексахлорофен [57]
O
SARS-CoV-2 repl. IC50 = 0.90 uM
H
O
N
NH2
S
H
N
NH
O
211 [146]
SARS-CoV repl. EC50 < 2 uM
210 [145]
HCoV-OC34 repl. EC50 < 2.5 uM
SARS-CoV 3CLpro IC50= 1.06 uM
Рис. 23. Структуры соединений ароматической природы 204-215
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
687
O
O
O
O
Cl
Cl
N
N
Cl
Cl
O
212 тилорон [57]
213 [61]
SARS-CoV-2 repl. IC50 = 4.09 uM
SARS-CoV-2 Mpro IC50 = 4.1 uM
H
H
O O
N
OH
H
H
COOH
O
N
Cl
O
O
Cl
216 окспренолол [90]
214 сертралин [85]
SARS-CoV-2 repl. EC50 = 20.22 uM
SARS-CoV-2 repl. IC50 = 9.34 uM
215 [147]
SARS-CoV helicase EC50 = 13.6 uM
Рис. 23. (продолжение)
O O
Na
O
O
OH
Hg
S
Hg
O
O
O
NH
Zn
217 [61, 148]
HN
O
O
SARS-CoV 3CLpro Ki = 0.7 uM
218 тиомерсал [61]
SARS-CoV-2 Mpro IC50 = 0.4 uM
SARS-CoV-2 Mpro IC50 = 0.6 uM
HO
O
S
S
219 [148]
Zn
N
SARS-3CLpro Ki = 0.05 uM
S
N
Zn S
N
S
O
O
220 [148]
S
O
Zn O
SARS-3CLpro Ki = 1.4 uM
221 [148]
O
O
SARS-3CLpro Ki = 1 uM
222 [148]
N
NH
SARS-3CLpro Ki = 0.32 uM
S
NO2
O
N
H
O
NO2
HO
O HO O
Br
Bi3+
O
OH
224 бронопол [148]
O
O
SARS-CoV-2 Mpro IC50 = 4.4 uM
223 ранитидин висмут циртрат [149, 150]
SARS-CoV helicase IC50 = 0.3 uM
EC50 = 5.9 uM
Рис. 24. Структуры солей и комплексов металлов 217-223 и бронопола 224
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
688
ШИРЯЕВ, КЛИМОЧКИН
O O
O
O
HO
HO
OH
HO
H
HO
O
OH
OH
H
OH
H
H
HO
O
O
HO
O
OH
H
OH
OH
O
O
O
O
H
H
H
225 уабаин [57]
OH
SARS-CoV-2 repl. IC50 < 0.097 uM
226 дигитоксин [57]
SARS-CoV-2 repl. IC50 = 0.23
O
H
O
H
COOH
N
N
H
H
N
H
H
OH
O
O
O
HO
HO
227 [151]
HCoV-229E nsp15 EC50 = 0.6 uM
OH OH
229 [152]
228 просцилларидин [57]
SARS-CoV 3CLpro IC50 = 2.6 uM
SARS-CoV-2 repl. IC50 = 2.04 uM
O
COOH
O
HN
O
O
NH
H
O
O
O
HO
O
O
O
O
H
HO
H
NH
H
HN
H
H
O
O
H
O
O
O
230 циклесонид [57]
OH
O
SARS-CoV-2 repl. IC50 = 4.33 uM
HO
HO
231 [153]
SARS-CoV repl. IC50 = 5 uM
Рис. 25. Структуры тритерпеноидов 225-234
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
689
COOH
O
H
H
O
HOOC
H
H
O
HO
O
H
HOOC
O
O
232 эксеместан [90]
HO
O
H
SARS-CoV-2 repl. EC50 = 7.51 uM
HO
OH
O
COOH
233 глицирризиновая кислота [153, 154, 155]
SARS-CoV-2 S/ACE IC50 = 22 uM
HO
HO
234 алпростадил [90]
SARS-CoV-2 repl. EC50 = 5.39 uM
Рис. 25. (продолжение)
OH
H
N
OH
OH
HO
O
O O
Cl
HO
O
O
O
HO
O
Cl
O
O NH
H
H
O
N
N
235 тейкопланин [156]
N
N
NH
H
O
H
SARS-CoV-2 3CLpro
HN
O
O
O
IC50 = 1.61 uM
HO
O
NH2
HO
O
OH
HO
O
HO
HO
O
HO
OH OH
HO
OH
H
H
236 X-206 [157]
O
O
O
O
O
H H
H OH H
OH
SARS-CoV-2 repl.
OH
IC50
= 8.2 uM
HO
O
O
OH
Рис. 26. Структуры антибиотиков 235-240, анидулафунгина 241, циклоспорина 242 и ивермектина B1a 243
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
690
ШИРЯЕВ, КЛИМОЧКИН
O
O OH O
O
237 салиномицин [57]
COOH
SARS-CoV-2 repl. IC50 = 0.24 uM
O
O
OH
N
HO
HO
OH
HO
N
HO
O
O
O
238 азитромицин [90]
SARS-CoV-2 repl. EC50 = 2.12 uM
O
O
OCH3
OH
O
H
O
N
O
O
H
OHOH
O
O
H
OH
O
O
N
H3CO
HO
H
O
OH
H
O
O
O
O O
O
O
OH
O
OH
239 спирамицин [90]
OH
SARS-CoV-2 repl. EC50 = 7.95 uM
240 монензин [85]
OH
SARS-CoV-2 repl. IC50 = 0.60 uM
OH
H
N
HO
HN
OH
O
O
O
N
HO
O
O
OH
HO
NH
OH
O
OH
HN
O
O
241 анидулафунгин [57]
SARS-CoV-2 repl. IC50 = 4.64 uM
Рис. 26. (продолжение)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
691
O
HO
O
O
O
O
O
H
O O
[158]
243 ивермектин B1a
O O
SARS-CoV-2 repl.
OH
IC50 = 2 uM
O
H
HO
O
H
O N
N
N
O
O
N
HN
O
O
242 циклоспорин [57]
SARS-CoV-2 repl.
HN
N
IC50 = 5.82 uM
OH
O
O
HN
O
N
N
N
O
O
Рис. 26. (продолжение)
с лигандами [38, 69, 134, 141, 159, 160, 161], что
Приведенный анализ литературных данных
позволяет достаточно легко проводить компью-
не претендует на полный охват всех соединений,
терное моделирование взаимодействий виртуаль-
протестированных на наличие активности в отно-
ных структур с мишенями. Однако при этом часто
шении вирусов SARS-CoV, MERS-CoV или SARS-
химик-синтетик попадает «ловушку» белка-ми-
CoV-2 (около 2500), но дает достаточное представ-
шени - ведет поиск соединений с активностью в
ление о хемотипах наиболее активных соедине-
отношении определенных белков, не рассматривая
ний, которые удалось найти. Несмотря на то, что
возможности вмешательства в другие стадии ре-
уже обнаружено достаточно большое количество
продуктивного цикла вируса. При этом для иссле-
типов активных молекул, многие молекулы-«лиде-
дования активности используются тесты, которые
ры» все еще ждут своего открытия.
дают информацию только о непосредственном
В прошлом сообщество химиков-органиков в
взаимодействии лиганд - мишень, но оказываются
общем успешно участвовало в отражении угроз,
бесполезными для оценки влияния соединения на
биохимические процессы инфицированной клет-
создаваемых здоровью человеческой популяции
ки. Напротив, обладание данными об особенно-
инфекционными заболеваниями. Создание суль-
стях химического строении активных соединений
фаниламидных препаратов, полусинтетических
безотносительно к их «точкам приложения» дает
и синтетических антибиотиков, противомалярий-
общее направление поиска новых потенциальных
ных и противотуберкулезных средств, модифици-
лекарственных кандидатов.
рованных нуклеозидов антивирусного действия,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
692
ШИРЯЕВ, КЛИМОЧКИН
спектра антиретровирусных препаратов, ингиби-
3.
Naveja J.J., Madariaga-Mazón A., Flores-Murrieta F.,
торов вирусных протеаз отражает только часть
Granados-Montiel J., Maradiaga-Ceceña M., Ala-
niz V.D., Maldonado-Rodriguez M., García-Morales J.,
вклада специалистов в области органического
Senosiain-Peláez J.P., Martinez-Mayorga K. Drug
синтеза в решение критических проблем мирово-
Disc. Today.
2021,
26,
229-239. doi
10.1016/
го здравоохранения. На этом пути понадобились
j.drudis.2020.10.018
как разработка новых синтетических методов (на-
4.
Ojha P.K., Kar S., Krishna J.G., Roy K., Leszczynsk J.
пример, использование дициклогексилкарбодии-
Mol. Divers. 2021, 25, 625-659. doi 10.1007/s11030-
мида или защитных групп [162]), так и создание
020-10134-x
моделей взаимодействия исследователей фунда-
5.
Chowdhury K.H., Chowdhury M.R., Mahmud S.,
ментальной науки со специалистами медицинской
Tareq A.M., Hanif N.B., Banu N., Reza A.S.M.A.,
промышленности. Новые вызовы должны приве-
Emran T.B., Simal-Gandara J. Biol. 2021, 10, 2. doi
сти к переосмыслению взаимоотношений между
10.3390/biology10010002
химиками-синтетиками, специалистами в области
6.
Caruso F.P., Scala G., Cerulo L., Ceccarelli M. Brief.
медицинской химии, исследователями биомеди-
Bioinform.
2020,
22,
701-713. doi
10.1093/bib/
цинской сферы и органиками, работающими в
bbaa328
фарминдустрии.
7.
Santibanez-Moran M.G., Lopez-Lopez E., Prieto-
Martınez F.D., Sanchez-Cruz N., Medina-Franco J.L.
Авторы надеются, что в свете нерешенных
RSC Adv. 2020, 10, 25089. doi 10.1039/d0ra04922k
проблем совокупный гений этих людей позволит
8.
Ahamad S., Branch S., Harrelson S., Hussain M.K.,
человечеству обрести уверенность в успешном
Saquib M., Khan S. Eur. J. Med. Chem. 2021, 209,
преодолении текущего кризиса глобального здра-
112862. doi 10.1016/j.ejmech.2020.112862
воохранения путем создания в ближайшем време-
9.
de Almeida S.M.V., Soares J.C.S., dos Santos K.L.,
ни целой линейки новых эффективных препаратов
Alves J.E.F., Ribeiro A.G., Jacob I.T.T., da Silva
для борьбы с инфекциями, вызываемыми корона-
Ferreira C.J., dos Santos J.C., de Oliveira J.F., de
вирусами.
Carvalho Junior L.B., de Lima M.C.A. Bioorg.
Med. Chem.
2020,
28,
115757. doi
10.1016/
ФОНДОВАЯ ПОДДЕРЖКА
j.bmc.2020.115757
Обзор выполнен при финансовой поддержке
10.
Butterworth R.F. J. Pharmaceut. Pharmacol. 2020, 8,
Российского научного фонда (проект № 20-73-
4. doi 10.13188/2327-204x.1000035
00254) и Минобрнауки РФ в рамках проектной ча-
11.
Choudhry N., Zhao X., Xu D., Zanin M., Chen W.,
Yang Z., Chen J. J. Med. Chem. 2020, 63, 13205-13227.
сти государственного задания № 0778-2020-0005.
doi 10.1021/acs.jmedchem.0c00626
КОНФЛИКТ ИНТЕРЕСОВ
12.
Hosseini-Zare M.S., Thilagavathi R., Selvam C. RSC
Adv. 2020, 10, 28287. doi 10.1039/d0ra04395h
Авторы заявляют об отсутствии конфликта ин-
13.
Li D., Hu J., Li D., Yang W., Yin S.-F., Qiu R. Top. Curr.
тересов.
Chem. 2021, 379, 4. doi 10.1007/s41061-020-00318-2
СПИСОК ЛИТЕРАТУРЫ
14.
Chakraborty C., Bhattacharya M., Mallick B., Shar-
1. Planas D., Bruel T., Grzelak L., Guivel-Benhassine F.,
ma A.R., Lee S.-S., Agoramoorthy G. Exp. Rev. Clin.
Staropoli I, Porrot F., Planchais C., Buchrieser J.,
Pharmacol. 2021. doi 10.1080/17512433.2021.1874348
Rajah M.M., Bishop E., Albert M, Donati F., Behil-
15.
Савосина, П.И., Дружиловский Д.С., Поройков В.В.
lil S., Enouf V., Maquart M., Gonzalez M., De Sèze J.,
Хим. Фарм. ж. 2020, 54, 7-14. [Savosina P.I.,
Péré H., Veyer D., Sève A., Simon-Lorière E., Fafi-
Druzhilovskii D.S., Poroikov V.V. Pharm. Chem. J.
Kremer S., Stefic K., Mouquet H., Hocqueloux L., van
2021, 54, 989-996.] doi 10.1007/s11094-021-02308-0
der Werf S., Prazuck T., Schwartz O. bioRxiv. 2021. doi
16.
Андреев С.М., Шершакова Н.Н., Кожихова К.В.,
10.1101/2021.02.12.430472
Шатилов А.А., Тимофеева А.В., Турецкий Е.А.,
2. Silva L.R., da Silva Santos-Júnior P.F., de Andrade
Кудлай Д.А., Хаитов М.Р. Росс. Аллерг. ж. 2020, 17,
Brandão J., Anderson L., Bassi E.J., de Araújo-
18-32. doi 10.36691/RJA1362
Júnior J.X., Cardoso S.H., da Silva-Júnior E.F.
17.
Sharma D., Sharma N., Sharma P., Subramaniam G.
Bioorg. Med. Chem. 2020, 28, 115745. doi 10.1016/
J. Edu. Health Promot. 2021, 10, 31. doi 10.4103/
j.bmc.2020.115745
jehp.jehp_457_20
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
693
18.
Hardy M.A., Wright B.A., Bachman J.L., Boit T.B.,
Baez-Santos Y.M., Tomar S., Mielech A.M., Ba-
Haley H.M.S., Knapp R.R., Lusi R.F., Okada T.,
ker S.C., Lindsley C.W., Hodder P., Mesecar A.,
Tona V., Garg N.K., Sarpong R. ACS Cent. Sci. 2020,
Stauffer S.R. J. Med. Chem. 2013, 56, 534-546. doi
6, 1017-1030. doi 10.1021/acscentsci.0c00637
10.1021/jm301580n
19.
Liang C., Tian L., Liu Y., Hui N., Qiao G., Li H., Shi Z.,
34.
Konno H., Wakabayashi M., Takanuma D., Saito Y.,
Tang Y., Zhang D., Xie X., Zhao X. Eur. J. Med. Chem.
Akaji K. Bioorg. Med. Chem. 2016, 24, 1241-1254. doi
2020, 201, 112527. doi 10.1016/j.ejmech.2020.112527
10.1016/j.bmc.2016.01.052
20.
Bujuq N.A. Synthesis. 2020, 52, 3735-3750. doi
35.
Konno H., Onuma T., Nitanai I., Wakabayashi M.,
10.1055/s-0040-1707386
Yano S., Teruya K., Akaji K. Bioorg. Med. Chem. Lett.
2017, 27, 2746-2751. doi 10.1016/j.bmcl.2017.04.056
21.
Gordon D.E., Jang G.M., Bouhaddou M. Nature. 2020,
583, 459-468. doi 10.1038/s41586-020-2286-9
36.
Liu C., Boland S., Scholle M.D., Bardiot D., Mar-
chand A., Chaltin P., Blatt L.M., Beigelman L., Sy-
22.
Luo H., Zhao M., Tan D. Chin. Med. 2020, 15, 115. doi
mons J.A., Raboisson P., Gurard-Levin Z.A., Van-
10.1186/s13020-020-00393-z
dyck K., Deval J. Antivir. Res. 2021, 187, 105020. doi
23.
Liu J., Li K., Cheng L., Shao J., Yang S., Zhang W.,
10.1016/j.antiviral.2021.105020
Zhou G., de Vries A.A.F., Yu Z. Int. J. Infect. Dis. 2021,
37.
Hung H.-C., Ke Y.-Y., Huang S.Y., Huang P.-N.,
103, 300-304. doi 10.1016/j.ijid.2020.12.033
Kung Y.-A., Chang T.-Y., Yen K.-J., Peng T.-T.,
24.
Faheem B.K.K., Sekhar K.V.G.C., Kunjiappan S.,
Chang S.-E., Huang C.-T., Tsai Y.-R., Wu S.-H.,
Jamalis J., Balaña-Fouce R., Tekwani B.L., Sankara-
Lee S.-J., Lin J.-H., Liu B.-S., Sung W.-C., Shih S.-R.,
narayanan M. Bioorg. Chem. 2020, 104, 104269. doi
Chen C.-T., Hsu J.T.-A. Antimicrob. Agents Chemother.
10.1016/j.bioorg.2020.104269
2020, 64, e00872-e00820. doi 10.1128/AAC.00872-20
25.
Amin S.A., Jha T. Eur. J. Med. Chem. 2020, 201,
38.
Fu L., Ye F., Feng Y., Yu F., Wang O., Wu Y., Zhao C.,
112559. doi 10.1016/j.ejmech.2020.112559
Sun H., Huang B., Niu P., Song H., Shi Y., Li X.,
26.
Das G., Ghosh S., Garg S., Ghosh S., Jana A.,
Tan W., Qi J., Gao G.F. Nat. Commun. 2020, 11, 4417.
Samat R., Mukherjee N., Roy R., Ghosh S. RSC Adv.
doi 10.1038/s41467-020-18233-x
2020, 10, 28243. doi 10.1039/d0ra05434h
39.
St. John S.E., Mesecar A.D. Амер. заявка US 9 975
27.
Keum Y.-S., Jeong Y.-J. Biochem. Pharmacol. 2012,
885 B2.
84, 1351-1358. doi 10.1016/j.bcp.2012.08.012.
40.
Kankanamalage A.C.G., Kim Y., Damalanka V.C.,
28.
Spratt A.N., Gallazzi F., Quinn T.P., Lorson C.L.,
Rathnayake A.D., Fehr A.R., Mehzabeen N., Battai-
Sönnerborg A., Singh K. Exp. Opin. Ther. Pat. 2021.
le K.P., Lovell S., Lushington G.H., Perlman S.,
doi 10.1080/13543776.2021.1884224
Chang K.-Y., Groutas W.C. Eur. J. Med. Chem. 2018,
29.
Пандемия COVID-19. Химия и экономика. Инфор-
150, 334-346. doi 10.1016/j.ejmech.2018.03.004
мационно-аналитический сборник: специальный
41.
Yang S., Chen S.-J., Hsu M.-F., Wu J.-D., Tseng C.-T.K.,
выпуск. Ред. М.Ф. Мизинцева. М.: Издательство
Liu Y.-F., Chen H.-C., Kuo C.-W., Wu C.-S.,
ВИНИТИ РАН, 2020.
Chang L.-W., Chen W.-C., Liao S.-Y., Chang T.-
30.
Turlington M., Chun A., Tomar S., Eggler A., Grum-
Y., Hung H.-H., Shr H.-J., Liu C.-Y., Huang Y.-A.,
Tokars V., Jacobs J., Daniels J.S., Dawson E., Saldan-
Chang L.-Y., Hsu J.-C., Peters C.J., Wang A.H.-J.,
ha A., Chase P., Baez-Santos Y.M., Lindsley C.W.,
Hsu M.-C. Med. Chem. 2006, 49, 4971-4980. doi
Hodder P., Mesecar A.D., Stauffer S.R. Bioorg. Med.
10.1021/jm0603926
Chem. Lett.
2013,
23,
6172-6177. doi
10.1016/
42.
Sacco M.D., Ma C., Lagarias P., Gao A., Town-
j.bmcl.2013.08.112
send J.A., Meng X., Dube P., Zhang X., Hu Y., Kitamu-
31.
Kitamura N., Sacco M.D., Ma C., Hu Y., Town-
ra N., Hurst B., Tarbet B., Marty M.T., Kolocouris A.,
send J.A., Meng X., Zhang F., Zhang X., Kukuljac A.,
Xiang Y., Chen Y., Wang J. Sci. Adv. 2020, 6, eabe0751.
Marty M.T., Schultz D., Cherry S., Xiang Y., Chen Y.,
doi 10.1126/sciadv.abe0751
Wang J. biorXiv. 2020. doi 10.1101/2020.12.19.423537
43.
Zhang L., Lin D., Sun X., Curth U., Drosten C.,
32.
St. John S.E., Tomar S., Stauffer S.R., Mesecar A.D.
Sauerhering L., Becker S., Rox K., Hilgenfeld R.
Bioorg. Med. Chem. 2015, 23, 6036-6048. doi 10.1016/
Science. 2020, 368, 409-412. doi 10.1126/science.
j.bmc.2015.06.039
abb3405
33.
Jacobs J., Grum-Tokars V., Zhou Y., Turlington M.,
44.
Zhang L., Lin D., Kusov Y., Nian Y., Ma Q., Wang J.,
Saldanha S.A., Chase P., Eggler A., Dawson E.S.,
von Brunn A., Leyssen P., Lanko K., Neyts J.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
694
ШИРЯЕВ, КЛИМОЧКИН
de Wilde A., Snijder E.J., Liu H., Hilgenfeld R.
57.
Jeon S., Ko M., Lee J., Choi I., Byun S.Y., Park S.,
J. Med. Chem. 2020, 63, 4562-4578. doi 10.1021/
Shum D., Kim S. Antimicrob. Agents Chemother. 2020,
acs.jmedchem.9b01828
64, e00819-e00820. doi 10.1128/AAC.00819-20
45.
Wang J., Liang B., Chen Y., Chan J.F.-W., Yuan S.,
58.
Cho J.K., Curtis-Long M.J., Lee K.H., Kim D.W.,
Ye H., Nie L., Zhou J., Wu Y., Wu M., Huang L.S.,
Ryu H.W., Yuk H.J., Park K.H. Bioorg. Med. Chem.
An J., Warshel A., Yuen K.-Y., Ciechanover A.,
2013, 21, 3051-3057. doi 10.1016/j.bmc.2013.03.027
Huang Z., Xu Y. Eur. J. Med. Chem. 2021, 113267.
59.
Kim D.W., Seo K.H., Curtis-Long M.J., Oh K.Y.,
doi 10.1016/j.ejmech.2021.113267
Oh J.W., Cho J.K., Lee K.H., Park K.H. J. Enzyme
Inhib. Med. Chem. 2016, 29, 59-63. doi 10.3109/
46.
Ghahremanpour M.M., Tirado-Rives J., Deshmukh M.,
14756366.2012.753591
Ippolito J.A., Zhang C.-H., de Vaca I.C., Liosi M.-E.,
Anderson K.S., Jorgensen W.L. ACS Med.
60.
Ma C., Hu Y., Townsend J.A., Lagarias P.I., Marty M.T.,
Chem. Lett.
2020,
11,
2526-2533. doi
10.1021/
Kolocouris A., Wang J. ACS Pharmacol. Transl. Sci.
2020, 3, 1265-1277. doi 10.1021/acsptsci.0c00130
acsmedchemlett.0c00521
61.
Coelho C., Gallo G., Campos C.B., Hardy L., Würte-
47.
Botyanszki J., Catalano J.G., Chong P.Y., Dickson H.,
le M. Plos ONE. 2020, 15, e0240079. doi 10.1371/
Jin Q., Leivers A., Maynard A., Liao X., Miller J.,
journal.pone.0240079
Shotwell J.B., Tai V.W.-F., Thalji R. Междунар. заяв-
62.
Jeppesen M.G., Toft-Bertelsen T.L., Kledal T.N.,
ка WO 2018/042343 A2.
Rosenkilde M.M. Res. Square. 2020. doi 10.21203/
48.
Choy K.-T., Wong A.Y.-L., Kaewpreedee P., Sia S.F.,
rs.3.rs-121743/v1
Chen D., Hui K.P.Y., Chu D.K.W, Chan M.C.W.,
63.
Park J.-Y., Kim J.H., Kim Y.M., Jeong H.J., Kim D.W.,
Cheung P.P.-H., Huang X., Peiris M., Yen H.-L.
Park K.H., Kwon H.-J., Park S.-J., Lee W.S.,
Antivir. Res.
2020,
178,
104786. doi
10.1016/
Ryu Y.B. Bioorg. Med. Chem. 2012, 20, 5928-5935.
j.antiviral.2020.104786
doi 10.1016/j.bmc.2012.07.038
49.
Lee C., Lee J.M., Lee N.-R., Kim D.-R., Jeong Y.-L.,
64.
Park J.-Y., Ko J.-A., Kim D.W., Kim Y.M., Kwon H.-J.,
Chong Y. Bioorg. Med. Chem. Lett. 2009, 19, 4538-
Jeong H.J., Kim C.Y., Park K.H., Lee W.S., Ryu Y.B.
4541. doi 10.1016/j.bmcl.2009.07.009
J. Enzyme. Inhib. Med. Chem. 2016, 31, 23-30. doi
50.
Chung Y.H., Jeong Y.J., Lee C.W. Южн. Корейск. за-
10.3109/14756366.2014.1003215
явка KR20110006083A.
65.
Jo S., Kim H., Kim S., Shin D.H., Kim M.-S. Chem.
51.
Yu M.-S., Lee J., Lee J.M., Kim Y., Chin Y.-W.,
Biol. Drug Des. 2019, 94, 2023-2030. doi 10.1111/
Jee J.-G., Keum Y.-S., Jeong Y.-J. Bioorg. Med.
cbdd.13604
Chem. Lett.
2012,
22,
4049-4054. doi
10.1016/
66.
Park J.-Y., Jeong H.J., Kim J.H., Kim Y.M., Park S.-J.,
j.bmcl.2012.04.081
Kim D., Park K.H., Lee W.S., Ryu Y.B. Biol. Pharm.
Bull. 2012, 35, 2036-2042. doi 10.1248/bpb.b12-00623
52.
Park J.-Y., Yuk H.J., Ryu H.W., Lim S.H., Kim K.S.,
Park K.H., Ryu Y.B., Lee W.S. J. Enzyme Inhib.
67.
Park J.-Y., Kim J.H., Kwon J.M., Kwon H.-J.,
Med. Chem.
2017,
32,
504-512. doi
10.1080/
Jeong H.J., Kim Y.M., Kim D., Lee W.S., Ryu Y.B.
14756366.2016.1265519
Bioorg. Med. Chem.
2013,
21,
3730-3737. doi
10.1016/j.bmc.2013.04.026
53.
Kim M.K., Yu M.-S., Park H.R., Kim K.B., Lee C.,
68.
Zheng Z., Groaz E., Snoeck R., De Jonghe S., Herde-
Cho S.Y., Kang J., Yoon H., Kim D.-E., Choo H.,
wijn P., Andrei G. ACS Med. Chem. Lett. 2021, 12, 88-
Jeong Y.-J., Chong Y. Eur. J. Med. Chem. 2011, 46,
92. doi 10.1021/acsmedchemlett.0c00485
5698-5704. doi 10.1016/j.ejmech.2011.09.005
69.
Jin Z., Zhao Y., Sun Y., Zhang B., Wang H., Wu Y.,
54.
Ryu Y.B., Jeong H.J., Kim J.H., Kim Y.M., Park J.-Y.,
Zhu Y., Zhu C., Hu T., Du X., Duan Y., Yu J.,
Kim D., Naguyen T.T.H., Park S.-J., Chang J.S.,
Yang X., Yang X., Yang K., Liu X., Guddat L.W.,
Park K.H., Rho M.-C., Lee W.S. Bioorg. Med. Chem.
Xiao G., Zhang L., Yang H., Rao Z. Nat. Struct. Mol.
2010, 18, 7940-7947. doi 10.1016/j.bmc.2010.09.035
Biol. 2020, 27, 529-532. doi 10.1038/s41594-020-
55.
Jo S., Kim S., Shin D.H., Kim M.-S. J. Enzyme
0440-6
Inhib. Med. Chem. 2020, 35, 145-151. doi 10.1080/
70.
Zandi K., Amblard F., Musall K., Downs-Bowen J.,
14756366.2019.1690480
Kleinbard R., Oo A., Cao D., Liang B., Russell O.O.,
56.
Jo S., Kim S., Kim D.Y., Kim M.-S., Shin D.H.
McBrayer T., Bassit L., Kim B., Schinazi R.F.
J. Enzyme Inhib. Med. Chem. 2020, 35, 1539-1544.
Antimicrob. Agents Chemother. 2021, 65, e01652-
doi 10.1080/14756366.2020.1801672
e01620. doi 10.1128/AAC.01652-20
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
695
71.
Radtke K.L. Междунар. заявка WO 2019/027501 A1,
84.
Wang L., Bao B.-B., Song G.-Q., Chen C., Zhang X.-M.,
2019.
Lu W., Wang Z., Cai Y., Li S., Fu S., Song F.-H.,
Yang H., Wang J.-G. Eur. J. Med. Chem. 2017, 137,
72.
Cai Q., Yang M., Liu D., Chen J., Shu D., Xia J.,
450-461. doi 10.1016/j.ejmech.2017.05.045
Liao X., Gu Y., Cai Q., Yang Y., Shen C., Li X.,
Peng L., Huang D., Zhang J., Zhang S., Wang F., Liu J.,
85.
Xiao X., Wang C., Chang D., Wang Y., Dong X.,
Chen L., Chen S., Wang Z., Zhang Z., Cao R.,
Jiao T., Zhao Z., Ren L., Dela Cruz C.S., Sharma L.,
Zhong W., Liu Y., Liu L. Engineering (Beijing). 2020,
Lei X., Wang J. Front. Immunol. 2020, 11, 586572. doi
6, 1192-1198. doi 10.1016/j.eng.2020.03.007
10.3389/fimmu.2020.586572
73.
Yoon J., Kim G., Jarhad D.B., Kim H.-R., Shin Y.-S.,
86.
Weston S., Coleman C.M., Haupt R., Logue J.,
Qu S., Sahu P.K., Kim H.O., Lee H.W., Wang S.B.,
Matthews K., Li Y., Reyes H.M., Weiss S.R., Frie-
Kong Y.J., Chang T.-S., Ogando N.S., Kovacikova K.,
man M.B. J. Virol. 2020, 94, e01218-e01220. doi
Snijder E.J., Posthuma C.C., van Hemert M.J.,
10.1128/JVI.01218-20
Jeong L.S. J. Med. Chem. 2019, 62, 6346-6362. doi
87.
Vincent M.J., Bergeron E., Benjannet S. Erickson B.R.,
10.1021/acs.jmedchem.9b00781
Rollin P.E., Ksiazek T.G., Seidah N.G., Nichol S.T.
74.
Ahmed-Belkacem R., Sutto-Ortiz P., Guiraud M.
Virol. J. 2005, 2, 69. doi 10.1186/1743-422X-2-69
Canard B., Vasseur J.-J., Decroly E. Debart F. Eur.
88.
Yao X., Ye F., Zhang M., Cui C., Huang B., Niu P.,
J. Med. Chem. 2020, 201, 112557. doi 10.1016/
Liu X., Zhao L., Dong E., Song C. Clin. Infect. Dis.
j.ejmech.2020.112557
2020, 71, 732-739. doi 10.1093/cid/ciaa237
75.
Wang Z., Yang L. New J. Chem. 2020, 44, 12417-
89.
Wang M., Cao R., Zhang L., Yang X., Liu J., Xu M.,
12429. doi 10.1039/d0nj02656e
Shi Z., Hu Z., Zhong W., Xiao G. Cell. Res. 2020, 30,
76.
Agostini M.L., Andres E.L., Sims A.C., Graham R.L.,
269-271. doi 10.1038/s41422-020-0282-0
Sheahan T.P., Lu X., Smith E.C., Case J.B., Feng J.Y.,
90.
Touret F., Gilles M., Barral K. Nougairède A., van
Jordan R., Ray A.S., Cihlar T., Siegel D., Mack-
Helden J., Decroly E., de Lamballerie X., Coutard B.
man R.L., Clarke M.O., Baric R.S., Denison M.R. mBio.
Sci. Rep. 2020, 10, 13093. doi 10.1038/s41598-020-
2018, 9, e00221-e00218. doi 10.1128/mBio.00221-18
70143-6
77.
Ikejiri M., Saijo M., Morikawa S., Fukushi S., Mizuta-
91.
Theerawatanasirikul S., Kuo C.J., Phecharat N., Choo-
ni T., Kurane I., Maruyama M. Bioorg. Med. Chem. Lett.
tip J., Lekcharoensuk C., Lekcharoensuk P. Antivir. Res.
2007, 17, 2470-2473. doi 10.1016/j.bmcl.2007.02.026
2020, 182, 104927. doi 10.1016/j.antiviral.2020.104927
78.
Wu R.-J., Zhou K.-X., Yang H., Song G.-Q., Li Y.-H.,
92.
Lo H.S., Hui K.P.Y., Lai H.-M., Khan K.S., Kaur S.,
Fu J.-X., Zhang X., Yu S.-J., Wang L.-Z., Xiong L.-X.,
Huang J., Li Z., Chan A.K.N., Cheung H.H.-Y.,
Niu C.-W., Song F.-H., Yang H., Wang J.-G. Eur.
Ng K.-C., Ho J.C.W., Chen Y.W., Ma B.,
J. Med. Chem. 2019, 167, 472-484. doi 10.1016/
Cheung P.M.-H., Shin D., Wang K., Lee M.-H.,
j.ejmech.2019.02.002
Selisko B., Eydoux C., Guillemot J.-C., Canard B.,
79.
Adedeji A.O., Singh K., Kassim A., Coleman C.M.,
Wu K.-P., Liang P.-H., Dikic I., Zuo Z., Chan F.K.L.,
Elliott R., Weiss S.R., Frieman M.B., Sarafianos S.G.
Hui D.S.C., Mok V.C.T., Wong K.-B., Ko H.,
Antimicrob. Agents Chemother. 2014, 58, 4894-4898.
Aik W.S., Chan M.C.W., Ng W.-L. BioRxiv. 2020. doi
doi 10.1128/AAC.02994-14
10.1101/2020.05.26.116020
80.
Sarafianos S.G., Adedeji A.O., Singh K. Амер. заявка
93.
Mukherjee P., Desai P., Ross L., White E.L., Ave-
US 20140005241 A1.
ry M.A. Bioorg. Med. Chem. 2008, 16, 4138-4149.
81.
Adedeji A.O., Singh K., Calcaterra N.E., DeDiego M.L.,
doi 10.1016/j.bmc.2008.01.011
Enjuanes L., Weiss S., Sarafianos S.G. Antimicrob.
94.
Rabie A.M. New J. Chem. 2021, 45, 761. doi 10.1039/
Agents Chemother. 2012, 56, 4718-4728. doi 10.1128/
d0nj03708g
aac.00957-12
95.
Gan H.J., Harikishore A., Lee J., Jeon S., Rajan S.,
82.
Xiong H.-L., Cao J.-L., Shen C.-G., Ma J., Qiao X.-Y.,
Chen M.W., Neo J.L., Kim S., Yoon H.S. Antivir. Res.
Shi T.-S., Yang Y., Ge S.-X., Zhang J., Zhang T.-Y.,
2021, 185, 104996. doi 10.1016/j.antiviral.2020.104996
Yuan Q., Xia N.-S. bioRxiv. 2020. doi 10.1101/
96.
Xie X., Muruato A.E., Zhang X., Lokugamage K.G.,
2020.06.05.135996
Fontes-Garfias C.R., Zou J., Liu J., Ren P., Balakrish-
83.
Lin M.H., Moses D.C., Hsieh C.H., Cheng S.-C.,
nan M., Cihlar T., Tseng C.-T.K., Makino S., Menache-
Chen Y.-H., Sun C.-Y., Chou C.-Y. Antivir. Res. 2018,
ry V.D., Bilello J.P., Shi P.-Y. Nat. Commun. 2020, 11,
150, 155-163. doi 10.1016/j.antiviral.2017.12.015
5214. doi 10.1038/s41467-020-19055-7
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
696
ШИРЯЕВ, КЛИМОЧКИН
97.
Niu C., Yin J., Zhang J., Vederas J.C., James M.N.G.
112.
Yamamoto N., Matsuyama S., Hoshino T., Yamamo-
Bioorg. Med. Chem. 2008, 16, 293-302. doi 10.1016/
to N. bioRxiv. 2020. doi 10.1101/2020.04.06.026476
j.bmc.2007.09.034
113.
Ohnishi K, Hattori Y., Kobayashi K., Akaji K.
98.
Zhang J., Huitema C., Niu C., Yin J., James M.N.G.,
Bioorg. Med. Chem. 2019, 27, 425-435. doi 10.1016/
Eltis L.D., Vederas J.C. Bioorg. Chem. 2008, 36, 229-
j.bmc.2018.12.019
240. doi 10.1016/j.bioorg.2008.01.001
114.
Yoshizawa S., Hattori Y., Kobayashi K., Akaji K.
99.
Ellinger D., Bojkova D., Zaliani A., Cinatl J., Claus-
Bioorg. Med. Chem. 2020, 28, 115273. doi 10.1016/
sen C., Westhaus S., Reinshagen J., Kuzikov M.,
j.bmc.2019.115273
Wolf M., Geisslinger G., Gribbon P., Ciesek S. Res.
115.
Shimamoto Y., Hattori Y., Kobayashi K., Teruya K.,
Square. 2020. doi 10.21203/rs.3.rs-23951/v1
Sanjoh A., Nakagawa A., Yamashita E., Akaji E.
100.
Kuo C.-J., Liu H.-G., Lo Y.-K., Seong C.M.,
Bioorg. Med. Chem. 2015, 23, 876-890. doi 10.1016/
Lee K.-I., Jung Y.-S., Liang P.-H. FEBS Lett. 2009,
j.bmc.2014.12.028
583, 549-555. doi 10.1016/j.febslet.2008.12.059
116.
Taylor R.D., MacCoss M., Lawson A.D.G. J. Med.
101.
Kao R.Y., Tsui W.H.W., Lee T.S.W., Tanner J.A.,
Chem. 2014, 57, 5845-5859. doi 10.1021/jm4017625
Watt R.M., Huang J.-D., Hu L., Chen G., Chen Z.,
117.
Lee J.-M., Cho J.-B., Ahn H.-C., Jung W., Jeong Y.-J.
Zhang L., He T., Chan K.-H., Tse H., To A.P.C.,
J. Microbiol. Biotechnol. 2017, 27, 2070-2073. doi
Ng L.W.Y., Wong B.C.W., Tsoi H.-W., Yang D.,
10.4014/jmb.1707.07073
Ho D.D., Yuen K.-Y. Chem. Biol. 2004, 11, 1293-
118.
Nguyen T.T.H., Ryu H.-J., Lee S.-H., Hwang S., Bre-
1299. doi 10.1016/j.chembiol.2004.07.013
ton V., Rhee J.H., Kim D. Bioorg. Med. Chem. Lett.
102.
Lee J.-M., Cho J.-B., Ahn H.-C., Jeong Y.-J. Bull.
2011, 21, 3088-3091. doi 10.1016/j.bmcl.2011.03.034
Korean Chem. Soc.
2016,
37,
2066-2068. doi
119.
Yang N., Tanner .A., Wang Z., Huang J.-D.,
10.1002/bkcs.11002
Zheng B.-J., Zhua N., Sun H. Chem. Commun. 2007,
103.
Tsai K.-C., Chen S.-Y., Liang P.-H., Lu I.-L.,
4413-4415. doi 10.1039/B709515E
Mahindroo N., Hsieh H.-P., Chao Y.-S., Liu L.,
120.
Ghosh A.K., Gong G., Grum-Tokars V., Mul-
Liu D., Lien W., Lin T.-H., Wu S.-Y. J. Med. Chem.
hearn D.C., Baker S.C., Coughlin M., Prabhakar B.S.,
2006, 49, 3485-3495. doi 10.1021/jm050852f
Sleeman K., Johnson M.E., Mesecar A.D. Bioorg.
104.
Ramajayam R., Tan K.-P., Liu H.-G., Liang P.-H.
Med. Chem. Lett. 2008, 18, 5684-5688. doi 10.1016/
Bioorg. Med. Chem. Lett. 2010, 20, 3569-3572. doi
j.bmcl.2008.08.082
10.1016/j.bmcl.2010.04.118
121.
Zhou L., Liu Y., Zhang W., Wei P., Huang C., Pei J.,
105.
Lee H., Ren J., Pesavento R.P., Ojeda I., Rice A.J.,
Yuan Y., Lai L. J. Med. Chem. 2006, 49, 3440-3443.
Lv H., Kwon Y., Johnson M.E. Bioorg. Med. Chem.
doi 10.1021/jm0602357
2019, 27, 1981-1989. doi 10.1016/j.bmc.2019.03.050
122.
Liu W., Zhu H.-M., Niu G.-J., Shi E.-Z., Chen J.,
106.
Mukherjee P., Shah F., Desai P., Avery M. J. Chem. Inf.
Sun B., Chen W.-Q., Zhou H.-G., Yang C. Bioorg.
Model. 2011, 51, 1376-1392. doi 10.1021/ci1004916
Med. Chem.
2014,
22,
292-302. doi
10.1016/
107.
Holwerda M., Vkovski P., Wider M., Thiel V.,
j.bmc.2013.11.028
Dijkman R. Microorganisms. 2020, 8, 1872. doi
123.
Wang X., Cao R., Zhang H. Liu J., Xu M., Hu H.,
10.3390/microorganisms8121872
Li Y., Zhao L., Li W., Sun X., Yang X., Shi Z.,
108.
Lee H., Mittal A., Patel K., Gatuz J.L., Truong L.,
Deng F., Hu Z., Zhong W., Wang M. Cell. Discov.
Torres J., Mulhearn D.C., Johnson M.E. Bioorg.
2020, 6, 28. doi 10.1038/s41421-020-0169-8
Med. Chem.
2014,
22,
167-177. doi
10.1016/
124.
Хамитов Р.А, Логинова С.Я., Щукина В.Н., Бори-
j.bmc.2013.11.041
севич С.В., Максимов В.А., Шустер А.М. Вопр.
109.
Cho J.B., Lee J.M., Ahn H.C., Jeong Y.J. J. Microbiol.
вирусол. 2008, 53, 9-13.
Biotechnol.
2015,
25,
2007-2010. doi
10.4014/
125.
Kumar V., Tan K.P., Wang Y.M., Lin S.W.,
jmb.1507.07078
Liang P.H. Bioorg. Med. Chem. 2016, 24, 3035-3042.
doi 10.1016/j.bmc.2016.05.013
110.
Wilson L., Gage P., Ewart G. Virology. 2006, 353,
294. doi 10.1016/j.virol.2006.05.028
126.
Ramajayam R., Tan K.-P., Liu H.-G., Liang P.-H.
111.
Shin Y.S., Lee J.Y., Noh S., Kwak Y., Jeon S.,
Bioorg. Med. Chem.
2010,
18,
7849-7854. doi
10.1016/j.bmc.2010.09.050
Kwon S., Jin Y., Jang M.S., Kim S., Song J.H.,
Kim H.R., Park C.M. Bioorg. Med. Chem. Lett. 2021,
127.
Feng S., Luan X., Wang Y., Wang H., Zhang Z.,
31, 127667. doi 10.1016/j.bmcl.2020.127667
Wang Y., Tian Z., Liu M., Xiao Y., Zhao Y., Zhou R.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
697
Zhang S. Infect. Gen. Evol. 2020, 85, 104419. doi
141.
Gao X., Qin B., Chen P., Zhu K., Hou P., Wojdy-
10.1016/j.meegid.2020.104419
la J.A., Wang M., Cui S. Acta Pharm. Sin. B. 2021, 11,
237-245. doi 10.1016/j.apsb.2020.08.014
128.
Zhu O., Zhang Y., Wang L., Yao X., Wu D., Cheng J.,
Pan X., Liu H., Yan Z., Gao L. Antivir. Res. 2021, 187,
142.
Welker A., Kersten C., Müller C., Madhugiri R.,
105015. doi 10.1016/j.antiviral.2021.105015
Zimmer C., Müller P., Zimmermann R., Hammer-
schmidt S., Maus H., Ziebuhr J., Sotriffer C., Schir-
129.
Węglarz-Tomczak E., Tomczak J.M., Talma M.,
meister T. ChemMedChem. 2021, 16, 340-354. doi
Brul S. bioRxiv. 2020. doi 10.1101/2020.05.17.100768
10.1002/cmdc.202000548
130.
Zaher N.H., Mostafa M.I., Altaher A.Y. Acta Pharm.
143.
Bacha U., Barrila J., Velazquez-Campoy A., Lea-
2020, 70, 145-159. doi 10.2478/acph-2020-0024
vitt S.A., Freire E. Biochemistry. 2004, 43, 4906-
131.
Sarafanios S.G., Adedeji A.O. Междунар. заявка
4912. doi 10.1021/bi0361766
WO 2013 188887 A1.
144.
Hoffmann M., Schroeder S., Kleine-Weber H., Mül-
132.
Konstantinidi A., Chountoulesi M., Naziris N., Sarto-
ler M.A., Drosten C., Pöhlmann S. Antimicrob. Agents
ri B., Amenitsch H., Mali G., Čendak T., Plakantona-
Chemother. 2020, 64, e00754-e00720. doi 10.1128/
ki M., Triantafyllakou I., Tselios T., Demetzos C.,
AAC.00754-20
Busath D.D., Mavromoustakos T., Kolocouris A.
145.
Yang O., Chen L., He X., Gao Z., Shen X., Bai D.
Biochim. Biophys. Acta Biomembr.
2019,
1862,
Chem. Pharm. Bull.
2008,
56,
1400-1405. doi
183156. doi 10.1016/j.bbamem.2019.183156
10.1248/cpb.56.1400
133.
Eleftheratos S., Spearpoint P., Ortore G., Kolocou-
146.
Gage P.W., Ewart G.D., Wilson L.E., Best W.,
ris A., Martinelli A., Martin S., Hay A. Bioorg. Med.
Premkumar A. Амер. заявка US 20150313909.
Chem. Lett. 2010, 20, 4182-4187. doi 10.1016/
147.
Lee C., Lee J.M., Lee N.-R., Jin B.-S., Jang K.J.,
j.bmcl.2010.05.049
Kim D.-E., Jeong Y.-J., Chong Y. Bioorg. Med.
134.
Mandala V.S., McKay M.J., Shcherbakov A.A.
Chem. Lett. 2009, 19, 1636-1638. doi 10.1016/
Dregni A.J., Kolocouris A., Hong M. Nat. Struct. Mol.
j.bmcl.2009.02.010
Biol. 2020, 27, 1202-1208. doi 10.1038/s41594-020-
148.
Lee C.-C., Kuo C.-J., Hsu M.-F., Liang P.-H.,
00536-8
Fang J.-M., Shie J.-J., Wang A.H.-J. FEBS Lett. 2007,
135.
Kesel A.J. Anti-Infect. Agents Med. Chem. 2006, 5,
581, 5454-5458. doi 10.1016/j.febslet.2007.10.048
161. doi 10.2174/187152106776359039
149.
Yang N., Tanner J., Zheng B.-J., Watt R., He M.-L.,
136.
Tanner J.A., Zheng B.J., Zhou J., Watt R.M.,
Lu L.-Y., Jiang J.-Q., Shum K.-T., Lin Y.-P.,
Jiang J.Q., Wong K.L., Lin Y.P., Lu L.Y., He M.L.,
Wong K.-L., Lin M., Kung H.-F., Sun H.,
Kung H.F., Kesel A.J., Huang J.D. Chem. Biol. 2005,
Huang J.-D. Angew. Chem. Int. Ed. 2007, 46, 6464-
12, 303-311. doi 10.1016/j.chembiol.2005.01.006
6468. doi 10.1002/anie.200701021
137.
Svyatchenko V.A., Nikonov S.D., Mayorov A.P.,
150.
Shu T., Huang M., Wu D. Ren Y., Zhang X., Han Y.,
Gelfond M.L., Loktev V.B. Photodiagn.
Mu J., Wang R., Qiu Y., Zhang D.-Y., Zhou X. Virol.
Photodyn. Ther. 2021, 33, 102112. doi 10.1016/
Sin. 2020, 35, 321-329. doi 10.1007/s12250-020-
j.pdpdt.2020.102112
00242-1
138.
Báez-Santos Y.M., Barraza S.J., Wilson M.W.,
151.
Krasniqi B., Stevaert A., Loy B.V., Nguyen T., Tho-
Agius M.P., Mielech A.M., Davis N.M., Baker S.C.,
mas J., Vandeput J., Jochmans D., Thiel V., Dijk-
Larsen S.D., Mesecar A.D. J. Med. Chem. 2014, 57,
man R., Dehaen W., Voet A., Naesens L. bioRxiv.
2393-2412. doi 10.1021/jm401712t
2020. doi 10.1101/2020.12.10.418996
139.
Ghosh A.K., Takayama J., Rao K.V., Ratia K.,
152.
Ryu Y.B., Park S.-J., Kim Y.M., Lee J.-Y., Seo W.D.,
Chaudhuri R., Mulhearn D.C., Lee H., Nichols D.B.,
Chang J.S., Park K.H., Rho M.-C., Lee W.-S. Bioorg.
Baliji S., Baker S.C., Johnson M.E., Mesecar A.D.
Med. Chem. Lett. 2010, 20, 1873-1876. doi 10.1016/
J. Med. Chem. 2010, 53, 4968-4979. doi 10.1021/
j.bmcl.2010.01.152
jm1004489
153.
Hoever G., Baltina L., Michaelis M., Kondraten-
140.
Ghosh A.K., Takayama J., Aubin Y., Ratia K.,
ko R., Baltina L., Tolstikov G.A., Doerr H.W.,
Cinatl J. J. Med. Chem. 2005, 48, 1256-1259. doi
Chaudhuri R., Baez Y., Sleeman K., Coughlin M.,
Nichols D.B., Mulhearn D.C., Prabhakar B.S.,
10.1021/jm0493008
Baker S.C., Johnson M.E., Mesecar A.D. J. Med.
154.
Yu S., Zhu Y., Xu J., Yao G., Zhang P., Wang M.,
Chem. 2009, 52, 5228-5240. doi 10.1021/jm900611t
Zhao Y., Lin G., Chen H., Chen L., Zhang J.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
698
ШИРЯЕВ, КЛИМОЧКИН
Phytomedicine.
2020,
153364. doi
10.1016/
Wang L., Yang K., Liu F., Jiang R., Yang X., You T.,
j.phymed.2020.153364
Liu X., Yang X., Bai F., Liu H., Liu X., Guddat L.W.,
155. Зарубаев В.В., Аникин В.Б., Смирнов В.С. Инф.
Xu W., Xiao G., Qin C., Shi Z., Jiang H., Rao Z.,
Иммун. 2016, 6, 199-206. doi 10.15789/2220-7619-
Yang H. Nature. 2020, 582, 289-293. doi 10.1038/
2016-3-199-206
s41586-020-2223-y
156. Tripathi P.K., Upadhyay S., Singh M., Raghavend-
160. Lockbaum G.J., Reyes A.C., Lee J.M., Tilvawala R.,
har S., Bhardwaj M., Sharma P., Patel A.K. Int. J.
Nalivaika E.A., Ali A., Kurt Yilmaz N., Thomp-
Biol. Macromol. 2020, 164, 2622-2631. doi 10.1016/
j.ijbiomac.2020.08.166
son P.R., Schiffer C.A. Viruses. 2021, 13, 174. doi
157. Svenningsen E.B., Thyrsted J., Blay-Cadanet J.,
0.3390/v13020174
Liu H., Lin S., Moyano-Villameriel J., Olagnier D.,
161. Yin W., Mao C., Luan X., Shen D.D., Shen Q., Su H.,
Idorn M., Paludan S.R., Holm C.K., Poulsen T.B.
Wang X., Zhou F., Zhao W., Gao M., Chang S.,
Antivir. Res.
2021,
185,
104988. doi
10.1016/
Xie Y.C., Tian G., Jiang H.W., Tao S.C., Shen J.,
j.antiviral.2020.104988
Jiang Y., Jiang H., Xu Y., Zhang S., Zhang Y.,
158. Caly L., Druce J.D., Catton M.G., Jans D.A., Wags-
Xu H.E. Science. 2020, 368, 1499-1504. doi 10.1126/
taff K.M. Antivir Res. 2020, 178, 104787. doi
science.abc1560
10.1016/j.antiviral.2020.104787
159. Jin Z., Du X., Xu Y., Deng Y., Liu M., Zhao Y.,
162. Sheehan J.C., Henery-Logan K.R. J. Am. Chem. Soc.
Zhang B., Li X., Zhang L., Peng C., Duan Y., Yu J.,
1957, 79, 1262-1263. doi 10.1021/ja01562a063
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
ОСНОВНЫЕ ХЕМОТИПЫ ИНГИБИТОРОВ РЕПРОДУКЦИИ SARS-COV-2
699
The Main Chemotypes
of SARS-CoV-2 Reproduction Inhibitors
V. A. Shiryaev* and Y. N. Klimochkin
Samara State Technical University, ul. Molodogvardeyskaya, 244, Samara, 443100 Russia
*e-mail: shiryaev.va@samgtu.ru
Received March 5, 2021; revised March 15, 2021; accepted March 18, 2021
The COVID-19 pandemic has forced scientists around the world to focus their efforts on finding targeted
chemotherapy drugs that can effectively fight coronaviruses. The review presents an attempt to systematize
low-molecular-weight compounds, including well-known pharmaceuticals and natural substances, that have
high antiviral activity against coronaviruses, not from the standpoint of action on their targets, but according to
their belonging to a particular structural type.
Keywords: coronavirus, antiviral drugs, COVID-19, SARS-CoV-2
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021