ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 5, с. 700-717
УДК 547.82, 547.99
К 70-летнему юбилею академика РАН В.Н. Чарушина
АРИЛИРОВАНИЕ АДАМАНТАНАМИНОВ: XI.1
СРАВНЕНИЕ ЭФФЕКТИВНОСТИ КАТАЛИЗА
КОМПЛЕКСАМИ ПАЛЛАДИЯ И МЕДИ В РЕАКЦИЯХ
АДАМАНТАНАМИНОВ С ФТОРСОДЕРЖАЩИМИ
ПРОИЗВОДНЫМИ 2-БРОМПИРИДИНА
© 2021 г. М. С. Ляховичa, А. В. Мурашкинаa, С. П. Панченкоa, А. Д. Аверинa, b, *,
А. С. Абельa, О. А. Малошицкаяa, Е. Н. Савельевc, Б. С. Орлинсонc,
И. А. Новаковc, И. П. Белецкаяa, b
a ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»,
химический факультет, 119991, Россия, Москва, Ленинские горы 1/3
*e-mail: alexaveron@yandex.ru
b ФГБУН «Институт физической химии и электрохимии им. А.Н. Фрумкина РАН»,
119071, Россия, Москва, Ленинский просп. 31/4
c ФГБОУ ВО «Волгоградский государственный технический университет» ВолГТУ,
400005, Россия, Волгоград, просп. Ленина 28
Поступила в редакцию 15.04.2021 г.
После доработки 17.04.2021 г.
Принята к публикации 17.04.2021 г.
Проведено сравнение эффективности катализа комплексами нульвалентного палладия и одновалентной
меди в реакциях адамантансодержащих аминов с рядом фтор- и трифторметилзамещенных 2-бромпири-
динов с использованием ранее оптимизированных каталитических систем. Показано, что при отсутствии
пространственных препятствий в исходных соединениях результаты катализа комплексами Cu(I) сопо-
ставимы с таковыми в случае катализа комплексами Pd(0), а в ряде случаев выходы целевых продуктов
N-гетероарилирования оказываются выше, что связано с образованием побочных продуктов N,N-диге-
тероарилирования в условиях палладиевого катализа. С другой стороны, в случае 2-бромпиридинов,
содержащих в орто-положении фтор или трифторметильную группу, следует применять исключительно
катализ комплексами палладия.
Ключевые слова: адамантан, амины, пиридин, аминирование, гомогенный катализ, комплексы палладия
и меди
DOI: 10.31857/S0514749221050037
ВВЕДЕНИЕ
меститель [2]. Спектр действия данных соедине-
ний чрезвычайно широк, среди фторсодержащих
Важность фторсодержащих органических со-
лекарств много противовоспалительных и проти-
единений для фармакологии трудно переоценить:
вораковых препаратов, антибиотиков, они могут
не менее 20% медицинских препаратов содержит
обладать антипсихотической, анксиолитической и
в своем составе фтор или трифторметильный за-
нейротропной активностью [3-5]. В связи с этим
постоянно совершенствуются методы синтеза
1 Сообщение X см. [1].
фторсодержащих производных [6, 7], среди кото-
700
АРИЛИРОВАНИЕ АДАМАНТАНАМИНОВ: XI.
701
рых значительный интерес представляют фтор- и
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
трифторметилзамещенные пиридины с аминоал-
Ранее нами установлено, что в большинстве
кильными заместителями [8, 9]. Молекулы, со-
случаев оптимальная каталитическая система на
держащие в своей структуре адамантановый и
основе палладия в гетероарилировании адаман-
пиридиновый фрагмент, также представляют ин-
тансодержащих аминов 2-бромпиридином и его
терес с точки зрения биологической активности.
производными - Pd(dba)2/DavePhos (dba - дибен-
2-Аминоадамантанзамещенное производное пир-
зилиденацетон, DavePhos - 2-дициклогексилфос-
ролопиридина Peficitinib используется в качестве
фино-2'-диметиламинобифенил), в некоторых слу-
средства для лечения ревматоидного артрита [10].
чаях сходные результаты можно получить при ис-
Комплекс адамантансодержащих пиридиновых
пользовании вместо DavePhos родственных бифе-
хелаторов с Cu(II) проявляют противоопухолевую
нильных фосфиновых лигандов - JohnPhos (2-ди-
активность [11]. 1-(Адамантан-1-ил)-2-(пиридин-
трет-бутилфосфинобифенил) или Cy-JohnPhos
3-ил)этан-1-он оксимы обладают противогрибко-
(2-дициклогексилфосфинобифенил) [25]. С другой
выми свойствами по отношению к S. Sclerotiorum и
стороны, только одна каталитическая система на
R. solani [12]. Адамантансодержащие производные
основе меди оказалась эффективной для тех же це-
2-аминопиридина способны ингибировать 11β-ги-
лей - CuI-2-изобутирилциклогексанон. Опираясь
дроксистероид дегидрогеназу тип 1 (11β-HSD1)
на эти данные, мы исследовали каталитическое
[13-15], конъюгаты адамантана и 3-аминопириди-
гетероарилирование ряда адамантансодержащих
на вызывают выработку антител к никотину [16].
аминов 1-5, отличающихся взаимным располо-
жением адамантанового каркаса и аминогруппы,
В настоящее время наблюдается широкое вне-
дрение в практику органического синтеза реакций,
с 2-бром-3-фтор- и 2-бром-5-фторпиридинами, а
также с 2-бромпиридинами, содержащими три-
катализируемых комплексами меди [17-21], что
позволяет не только удешевить процессы путем
фторметильные группы в положениях 3, 4, 5 и 6 пи-
ридинового цикла. Первоначально было провере-
замены дорогостоящих катализаторов на осно-
но, что 2-бромпиридин действительно эффектив-
ве благородных металлов, но и осуществить ряд
но взаимодействует с данными аминами в присут-
новых превращений. В связи с этим представля-
ствии каталитической системы Pd(dba)2-DavePhos
ется актуальным проведение систематического
(схема 1). Реакции проводили с использованием
сравнения возможностей катализа комплекса-
1-2 мол % катализатора при мольном соотноше-
ми палладия и меди для образования связи угле-
нии амин-2-бромпиридин
1.25:1 для подавле-
род-азот. В рамках работ по изучению палладий- и
ния побочного процесса N,N-дигетероарилирова-
медь-катализируемого гетероарилирования ада-
ния.
мантансодержащих аминов [1, 22-24] нами опти-
мизированы каталитические системы для Pd(0)- и
Обнаружено, что во всех случаях, кроме реак-
Cu(I)-катализируемого аминирования галогенпи-
ции с амином 1, выходы целевых продуктов мо-
ридинов указанными аминами. В настоящей рабо-
ногетероарилирования 7-10 оказались высокими,
те поставлена задача изучить образование 2-ами-
причем в трех случаях (соединения 8-10) они пре-
нозамещенных фтор- и трифторметилпиридинов
высили 90%. Такой результат оказался возможным
в реакциях соответствующих 2-бромпиридинов с
за счет подавления образования соответствующих
рядом адамантансодержащих аминов и сравнить
N,N-дипиридилпроизводных. В случае амина 1
эффективность использования каталитических си-
выход соединения 6 был умеренным (49%), а ди-
стем на основе нульвалентного палладия и однова-
пиридинильного производного 6а получилось за-
лентной меди. Методологически вначале изучены
метно больше, чем в других случаях (21%). При
реакции, катализируемые нульвалентным палла-
введении в реакцию наиболее пространственно за-
дием, показаны возможности данного подхода, а
трудненного амина 4 использовали 2 мол % ката-
на следующем этапе исследованы возможности
лизатора, при этом выход соединения 9 был близок
использования в тех же превращениях катализато-
к количественному. Можно сделать вывод о том,
ра с одновалентной медью.
что за счет стерического фактора в определенной
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
702
ЛЯХОВИЧ и др.
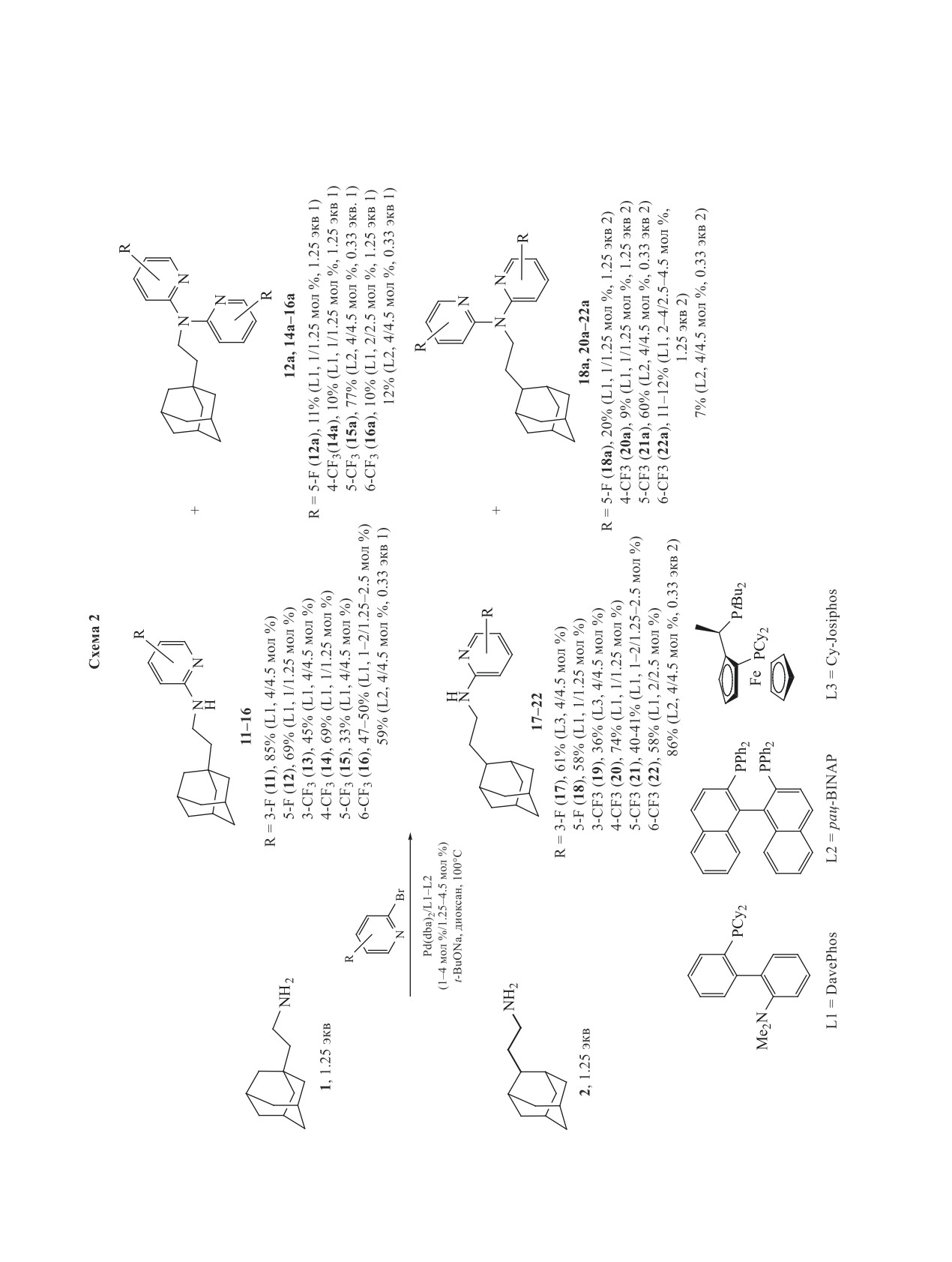
Схема 1
X NH2
N Br
X N
N
X N N
+
H
Pd(dba)2-DavePhos
(1-2 мол %/1.25-2.5 мол %)
N
t-BuONa, диоксан, 100°C
1-5
6-10
6a, 21%
1.25 экв
7a, 14%
6, X = 1-CH2CH2 (49%, 1/1.25 мол %)
7, X = 2-CH2CH2 (86%, 1/1.25 мол %)
8, X = 2-CH2 (96%, 1/1.25 мол %)
9, X = 1-CH2CH(CH3) (97%, 2/2.5 мол %)
10, X = 2-CH(CH3)CH2 (93%/ 1/1.25 мол %)
NMe2
DavePhos =
Cy2P
NH2
NH2
NH2
X NH2
1
2
3
=
H3C
H3C
NH2
NH2
4
5
степени увеличивается селективность протекания
фторпиридином в присутствии 4 мол % данной си-
моногетероарилироования.
стемы привело к 85% выходу целевого продукта
11, при этом в реакции с более пространственно
В реакциях Pd(0)-катализируемого гетероари-
затрудненным
2-бром-3-(трифторметил)пириди-
лирования с рядом фтор- и трифторметилзаме-
ном выход продукта гетероарилирования 13 упал
щенных 2-бромпиридинов в первую очередь были
до 45%, хотя было использовано 4 мол % ката-
детально исследованы пространственно наименее
лизатора. Образования побочных продуктов N,N-
затрудненные амины 1 и 2 (схема 2).
дигетероарилирования в данных случаях не на-
Данные амины были введены в реакции с
блюдалось из-за стерических факторов, обуслов-
2-бром-3-фтор- и
2-бром-5-фторпиридинами, а
ленных наличием орто-заместителей. Напротив, в
также с изомерными 2-бром(трифторметил)пири-
реакциях амина 1 с пространственно незатруднен-
динами, содержащими трифторметильную груп-
ными 2-бром-5-фторпиридином и 2-бром-4-(три-
пу в положениях 3, 4, 5, 6. В качестве основной
фторметил)пиридином даже при использовании
каталитической системы использовали Pd(dba)2-
1 мол % катализатора образовалось практически
DavePhos. Взаимодействие амина 1 с 2-бром-3-
одинаковое количество целевых продуктов 12 и 14
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
АРИЛИРОВАНИЕ АДАМАНТАНАМИНОВ: XI.
703
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
704
ЛЯХОВИЧ и др.
(по 69%) и соответствующих побочных продуктов
58 и 74%. Оказалось, что при высокой конверсии
диарилирования 12а и 14а (10-11%). Иначе проте-
амина в продукты арилирования, наблюдаемой в
кает реакция с изомерным 2-бром-5-(трифторме-
обоих случаях, в реакции с 2-бром-5-фторпири-
тил)пиридином: в присутствии 1 мол % Pd(dba)2-
дином образовалось несколько больше продукта
DavePhos выход целевого соединения 15 был не-
диарилирования 18а (20%) по сравнению с соеди-
велик (33%), при этом образовалось заметное ко-
нением 20а (9%).
личество диарилированного продукта 15а (17%).
Отмеченные выше проблемы при введении в
Попытка проведения реакции при увеличении того
реакцию изомерных трифторметил-замещенных
же катализатора до 4 мол % привела к падению вы-
2-бромпиридинов характерны и для реакций с ами-
хода целевого соединения до 14%, а выход побоч-
ном 2. Так, в случае 2-бром-5-(трифторметил)пи-
ного продукта диарилирования возрос до 28%. Не
ридина как 1, так и 2 мол % катализатора дают воз-
помогло и использования альтернативного донор-
можность получить целевое соединение 21 лишь
ного дифосфинового лиганда на основе ферроцена
с умеренным выходом порядка 40%, в то время
Cy-Josiphos (выход 15 составил 24%). Проведение
как использование 4 мол % катализатора снижа-
реакции с 3 экв пиридина в присутствии каталити-
ет выход обоих продуктов, 21 и 21а, до 32 и 11%,
ческой системы с лигандом рац-BINAP (4 мол %
соответственно. Получение продукта диарилиро-
катализатора) дало возможность провести процесс
вания 21а с неплохим выходом 60% возможно в
более селективно и получить соединение 15а в ка-
случае применения лиганда BINAP и трехкратного
честве основного с 77% выходом.
избытка данного бромпиридина. Интересно, что в
Реакция амина 1 с 2-бром-6-(трифторметил)-
реакциях с изомерным 2-бром-6-(трифторметил)-
пиридином продемонстрировала, что выход це-
пиридином выход целевого соединения 22 в целом
левого соединения 16 примерно одинаков при
оказался выше и составил 58% при использовании
использовании 1 или 2 мол % катализатора (47 и
2 мол % катализатора, однако, наибольший выход
50%, соответственно), только во втором случае
(86%) достигнут в реакции, в которой ожидалось
увеличивается количество продукта диарилирова-
образование преимущественно дипиридинилпро-
ния 16а с 8 до 18%, в то время как при 4 мол %
изводного при использовании 3 экв бромпириди-
Pd(dba)2-DavePhos заметно уменьшается выход
на. Такое поведение
2-бром-6-(трифторметил)-
обоих продуктов 16 и 16а (33 и 8%, соответствен-
пиридина, наблюдаемое в реакциях с адамантан-
но). Это, возможно, связано с более активным про-
содержащими аминами 1 и 2, пока что не находит
теканием других побочных процессов, отличных
разумного объяснения.
от N-гетероарилирования амина. Интересно, что
В целях сравнения эффективности катализа
при проведении реакции с избытком пиридина и в
комплексами нульвалентного палладия и одно-
присутствии лиганда BINAP при 4 мл % катализа-
валентной меди были проведены реакции ами-
тора, тем не менее, с хорошим выходом образуется
на 2 с 2-бром-5-фторпиридином и изомерными
монопиридинилпроизводное 16 в качестве основ-
2-бром(трифторметил)пиридинами (схема 3). В
ного (59%), а выход дипиридинильного производ-
качестве каталитической системы использовали
ного составляет всего 12%.
CuI-2-изобутирилциклогексанон (20:40 мол %),
В двух реакциях изомерного амина 2 с про-
ранее хорошо зарекомендовавшую себя в ре-
странственно затрудненными пиридинами был
акциях с адамантансодержащими аминами.
опробован Cy-Josiphos, но его эффективность ока-
Взаимодействие проводили в ДМФА при 140°С
залась хуже, выходы соответствующих продук-
в присутствии основания карбоната цезия. Было
тов 17 и 19 составили 61 и 36%, соответственно.
обнаружено, что во всех случаях выходы целевых
Применение 1 мол % оптимальной каталитиче-
продуктов 18, 20-22 превышают таковые при ис-
ской системы Pd(dba)2-DavePhos позволило син-
пользовании палладиевого катализа, причем для
тезировать продукты моноарилирования 18 и 20
соединений 18 и 21 - значительно (58 и 84%, 41 и
в реакции амина 2 с 2-бром-5-фторпиридином и
81%, соответственно). Это может быть объяснено
2-бром-4-(трифторметил)пиридином с выходами
отсутствием протекания ряда побочных процессов
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
АРИЛИРОВАНИЕ АДАМАНТАНАМИНОВ: XI.
705
Схема 3
R
H
NH2
N N
N Br
R
CuI/2-изобутирилциклогексанон (20/40 мол %)
Cs2CO3, ДМФА, 140°C
2
18, 20-22
R = 5-F (18), 84%
4-CF3 (20), 79%
5-CF3 (21), 81%
6-CF3 (22), 89%
в присутствии комплекса меди, в первую очередь,
стерически затрудненного амина 4 закономерно
N,N-диарилирования и, вероятно, иных катали-
привело к общему понижению выходов продуктов
тических реакций, отличных от аминирования, в
реакций 29-32 до 53-67%. В нескольких случаях
которых могут участвовать активные 2-бромпири-
проведено сравнение эффективности двух катали-
дины.
тических методов. Так, при взаимодействии амина
3 с 2-бром-4-(трифторметил)пиридином исполь-
Более пространственно затрудненные ами-
ны 3-5 исследованы в реакциях с изомерными
зование Pd(dba)2-DavePhos (2:2.5 мол %) позво-
2-бромфторпиридинами и 2-бром(трифторметил)-
лило увеличить выход продукта 25 с 64 до 81%,
пиридинами в условиях палладиевого и медного
увеличение выхода в условиях палладиевого ката-
катализа (cхема 3). Реакции с более стерически
лиза с 56 до 75% наблюдалось и для соединения
затрудненным 2-бром-3-фторпиридином проводи-
30. С другой стороны, катализ комплексами Cu(I)
ли только в присутствии каталитической системы
и Pd(0) в реакции амина 4 с 2-бром-5-(трифтор-
Pd(dba)2-DavePhos (4:4.5 мол %), поскольку реак-
метил)пиридином привел практически к одина-
ционная способность галогенаренов, содержащих
ково умеренным выходам соединения 31 порядка
в орто-положении атом фтора, в условиях катали-
50%. Сравнение результатов, полученных в дан-
за одновалентной медью сильно снижена. Выходы
ной серии экспериментов, с таковыми, получен-
соответствующих продуктов 23, 28 и 33 составили
ными при использовании палладиевого катализа,
76, 47 и 63%, что в целом несколько ниже, чем в
позволяет оценить общую закономерность: при
реакциях менее пространственно затрудненных
гетероарилировании адамантанаминов произ-
аминов 1 и 2 с данным производным пиридина.
водными 2-бромпиридина катализ комплексами
Взаимодействие с изомерным 2-бром-5-фторпири-
нульвалентного палладия предпочтителен при
дином проводили в условиях катализа комплексом
введении в реакцию более пространственно за-
меди, при этом выходы продуктов гетероарили-
трудненных 2-бром-3-фторпиридинов и в особен-
рования 24, 29 и 34 составили 65-75%. В случае
ности 2-бром-3-(трифторметил)пиридина, а также
реакции амина 4 с данным бромпиридином пока-
изомерного 2-бром-4-(трифторметил)пиридина, в
зано, что использование в качестве растворителя
случае других изомеров - 5- и 6-(трифторметил)-
ДМСО вместо ДМФА позволяет снизить темпе-
производных - лучшие результаты достигаются
ратуру реакции до 110°С при определенном росте
в условиях катализа одновалентной медью, а вы-
выхода продукта 29 до 75%.
ходы продуктов гетероарилирования с 2-бром-5-
Можно отметить и другие закономерности ис-
фторпиридином сравнимы для обоих типов ката-
следованных реакций. Амин 3 обеспечил наилуч-
литических систем.
шее образование продуктов гетероарилирования,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
при этом в реакции с 2-бром-6-(трифторметил)-
пиридин достигнуто рекордное значение выхода
Спектры ЯМР 1Н и 13С регистрировали на
97% для соединения 27, использование наиболее
приборе Bruker Avance-400 (рабочие частоты 400,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
706
ЛЯХОВИЧ и др.
Схема 4
R
NH2
N
N
H
3
R
23-27
H3C
N Br
H3C
R
NH2
N
N
H
Метод а
Pd(dba)2/DavePhos
4
28-32
t-BuONa, диоксан, 100°C
1.25 экв амина
H3C
CH3
H
NH2
N N
или
R
Метод б
CuI/2-изобутирилциклогексанон (20/40 мол %)
Cs2CO3, ДМФА, 140°C
33-37
5
1.25 экв производного 2-бромпиридина
R = 3-F (23), 76% (а, 4/4.5 мол %)
R = 3-F (28), 47% (а, 4/4.5 мол %)
5-F (24), 75% (б)
5-F (29), 67% (б)
4-CF3 (25), 81% (а, 2/2.5 мол %)
4-CF3 (30), 75% (а, 2/2.5 мол %)
64% (б)
56% (б)
5-CF3 (26), 69% (б)
5-CF3 (31) 51% (а, 2/2.5 мол %)
6-CF3 (27), 97% (б)
53% (б)
6-CF3 (32), 67% (б)
R = 3-F (33), 63% (а, 4/4.5 мол %)
5-F (34), 65% (б)
4-CF3 (35), 52% (б)
5-CF3 (36), 71% (б)
6-CF3 (37), 69% (б)
100.6 МГц соответственно). В качестве внутрен-
лоночной хроматографии использовали силика-
него стандарта использовали сигнал хлороформа
гель марки «Merck» (40/60). Коммерчески до-
(δH 7.25, δС 77.00 м.д.), спектры регистрировали
ступные
2-бромпиридин,
2-бром-3-фторпири-
в CDCl3. Спектры 19F регистрировали на прибо-
дин, 2-бром-5-фторпиридин, 2-бром-3-(трифтор-
ре Agilent-400MR (рабочая частота 376.4 МГц,
метил)пиридин,
2-бром-4-(трифторметил)пири-
химические сдвиги приведены относительно
дин,
2-бром-5-(трифторметил)пиридин,
2-бром-
стандарта CCl3F), спектры регистрировали в
6-(трифторметил)пиридин, трет-бутилат натрия,
CDCl3. Масс-спектры MALDI-TOF положитель-
карбонат цезия, иодид меди (I), фосфиновые ли-
ных ионов получали на приборе Bruker Daltonics
ганды, 2-изобутирилциклогексанон вводили в ре-
Autoflex II с использованием 1,8,9-тригидрокси-
акции без дополнительной очистки. Амины 1-5
антрацена в качестве матрицы и полиэтиленгли-
получали по методам, описанным в работах [25-
колей ПЭГ-200, ПЭГ-300 и ПЭГ-400 в качестве
29], Pd(dba)2 получали по описанной методике
внутренних стандартов. Для препаративной ко-
[30]. Диоксан абсолютировали перегонкой над на-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
АРИЛИРОВАНИЕ АДАМАНТАНАМИНОВ: XI.
707
трием, ДМФА перегоняли над гидридом кальция.
Спектральные данные соединений 6, 6а, 7, 8, 10
Синтезы целевых соединений проводили в сосу-
описаны в статье [31], соединения 9 - в сообщении
дах Шленка с использованием прибора для парал-
[25].
лельного синтеза Radleys Carousel 12 Plus.
N-[2-(Адамантан-2-ил)этил]-N-(пиридин-2-
N-пиридинилпроизводные адамантанами-
ил)пиридин-2-амин (7а). Получен в качество вто-
нов 6-33. а. В сосуд Шленка, входящего в состав
рого продукта при синтезе соединения 7 по общей
прибора для параллельного синтеза, предваритель-
методике а взаимодействием амина 2 (112 мг) с
но заполненный аргоном, снабженный магнитной
2-бромпиридином (79 мг) в присутствии Pd(dba)2
мешалкой, помещают Pd(dba)2 (1-4 мол %) и ли-
(3.3 мг), DavePhos (2.5 мг). Выход 14%. Спектр
ганд DavePhos (1.25-4.5 мол %), затем добавляют
ЯМР 1Н, δ, м.д.: 1.51-1.54 м [2Н, H(Ad)], 1.70-1.79
0.2 ммоль соответствующего арилгалогенида и
м [15Н, H(Ad), AdCH2], 4.15-4.18 м (2Н, CH2N),
2 мл абс. диоксана и перемешивают в течение
6.82 д.д [2H, H4(Py), 3JНН 7.0, 3JНH 5.1 Гц], 7.08 д
1-2 мин. Далее в токе аргона помещают в реактор
[2H, H6(Py), 3JНН 8.5 Гц], 7.50 д.д.д [2H, H5(Py),
0.25 ммоль соответствующего амина и 0.3 ммоль
3JНН 8.5, 3JНH 7.0, 4JНH 1.9 Гц], 8.32 д.д [2H, H3(Py),
(32 мг) трет-бутилата натрия. Реакционную смесь
3JНН 5.1, 4JНH 1.9 Гц]. Масс-спектр (MALDI-TOF),
перемешивают при нагревании при температуре
m/z: 334.206 [M + H]+. C22H28N3. M + H 334.228.
110°С в течение 8 ч. По завершении реакций ре-
N-[2-(Адамантан-1-ил)этил]-3-фторпири-
акционную смесь отбирают из реактора, отделяя
дин-2-амин (11). Получен по общей методике а
от неорганического осадка, осадок промывают
взаимодействием амина 1 (45 мг) с 2-бром-3-фтор-
дихлорметаном (5 мл), объединенные органиче-
пиридином (35 мг) в присутствии Pd(dba)2 (4.6 мг),
ские фазы упаривают в вакууме, остаток растворя-
DavePhos (3.5 мг). Бежевое кристаллическое веще-
ют в дихлорметане (5 мл), экстрагируют водой (5
ство, т.пл. 115-117°С. Выход 85%. Спектр ЯМР 1Н,
мл), органический слой сушат над молекулярными
δ, м.д.: 1.40-1.44 м (2Н, AdCH2), 1.56-1.58 м [6Н,
ситами 4Å и тщательно упаривают в вакууме (1 мм
CH2 (Ad)], 1.61-1.72 м [6H, CH2 (Ad)], 1.95 уш.с
рт.ст.).
[3Н, CH2 (Ad)], 3.41-3.47 м (2Н, CH2N), 4.38 уш.с
б. В сосуд Шленка, входящего в состав прибора
(1Н, NН), 6.46 д.д.д [1H, H5(Py), 3JНН 7.8, 3JНН 5.1,
для параллельного синтеза, предварительно запол-
4JНF 3.7 Гц], 7.08 д.д.д [1H, H4(Py), 3JНF 7.8, 3JНН
ненный аргоном, снабженный магнитной мешал-
7.8, 4JНH 1.3 Гц], 7.89 д [1H, H6(Py), 3JНН 5.1 Гц].
кой, помещают иодид меди (I) (20 мол %, 19 мг)
Спектр ЯМР 13С, δ, м.д.: 28.6 [3C, CH2(Ad)], 32.0
и лиганд 2-изобутирилциклогексанон (40 мол %,
[C(Ad)], 36.0 (AdCH2), 37.0 [3C, CH2(Ad)], 42.5
33 мкл), добавляют 0.625 ммоль соответствую-
[3C, CH2(Ad)], 44.2 (CH2N), 111.3 [C5(Py)], 119.6
щего арилгалогенида и 1 мл ДМФА, 0.5 ммоль
д [C4(Py), 2JCF 16.1 Гц], 142.7 д
[C6(Py), 4JCF
соответствующего амина, 0.63 ммоль (212 мг)
5.9 Гц], 147.1 д [C3(Py), 1JCF 252.1 Гц], 148.8 д
карбоната цезия. Реакционную смесь нагрева-
[C1(Py), 2JCF 11.8 Гц]. Масс-спектр (MALDI-TOF),
ют при перемешивании при температуре 140°С в
m/z: 275.1895 [M + H]+. C17H24FN2. M + H 275.1924.
течение 24 ч. По завершении реакций реакцион-
ную смесь отбирают из реактора, отделяя от не-
N-[2-(Адамантан-1-ил)этил]-5-фторпири-
органического осадка, осадок промывают дихлор-
дин-2-амин (12). Получен по общей методике а
метаном (5-10 мл), объединенные органические
взаимодействием амина 1 (45 мг) с 2-бром-5-фтор-
фракции упаривают в вакууме, остаток раство-
пиридином (35 мг) в присутствии Pd(dba)2 (1.2 мг),
ряют в дихлорметане (5 мл), экстрагируют водой
DavePhos (1.0 мг). Выход 69%. Спектр ЯМР 1Н, δ,
(5 мл), органический слой сушат над молекуляр-
м.д.: 1.36-1.40 м (2Н, AdCH2), 1.56-1.58 м [6Н, CH2
ными ситами 4Å и тщательно упаривают в ва-
(Ad)], 1.61-1.72 м [6H, CH2 (Ad)], 1.95 уш.с [3Н,
кууме (1 мм рт.ст.). Дополнительная очистка осу-
CH2 (Ad)], 3.18-3.23 м [2Н, CH2N], 4.53 уш.с (1Н,
ществляется с помощью хроматографирования
NН), 6.34 д.д [1H, H3(Py), 3JНН 9.1, 4JНF 3.4 Гц],
на силикагеле последовательностью элюентов
7.22 д.д.д [1H, H4(Py), 3JНН 9.1, 3JНF 8.0, 4JНH
петролейный эфир - CH2Cl2 1:1, CH2Cl2, CH2Cl2 -
3.0 Гц], 7.92 д [1H, H6(Py), 4JНН 3.0 Гц]. Спектр
MeOH 200:1-100:1.
ЯМР 13С, δ, м.д.: 28.5 [3C, CH(Ad)], 31.9 [C(Ad)],
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
708
ЛЯХОВИЧ и др.
36.1 (AdCH2),
37.0
[3C, CH2(Ad)],
37.7
[3C,
м (2Н, CH2N), 5.08 уш.с (1Н, NН), 6.56 уш.с [1H,
CH2(Ad)], 42.5 [3C, CH2(Ad)], 43.8 [CH2N], 106.9 д
H3(Py)], 6.73 д [1H, H5(Py), 3JНН 5.3 Гц], 8.17 д [1H,
[C3(Py), 3JCF 3.0 Гц], 125.9 д [C4(Py), 2JCF 20.8 Гц],
H6(Py), 3JНН 5.3 Гц]. Спектр ЯМР 13С, δ, м.д.: 28.5
133.6 д [C6(Py), 2JCF 25.6 Гц], 152.9 д [C5(Py), 1JCF
[3C, CH(Ad)], 31.9 [C(Ad)], 37.0 [3C, CH2(Ad)],
249.0 Гц], 155.4 [C1(Py)]. Спектр ЯМР 19F, δ, м.д.:
37.3 (AdCH2), 42.4 [3C, CH2(Ad)], 43.4 (CH2N),
-143.90 д.д (3JНF 8.0, 4JНF 3.4 Гц). Масс-спектр
103.0 [C5(Py)], 107.5 [C3(Py)], 122.6 к (CF3, 1JCF
(MALDI-TOF), m/z: 275.1950 [M + H]+. C17H24FN2.
273.2 Гц), 140.7 к [C4(Py), 2JCF 33.0 Гц], 147.1
M + H 275.1924.
[C6(Py)], 158.0 [C2(Py)]. Спектр ЯМР 19F, δ, м.д.:
-66.77. Масс-спектр (MALDI-TOF), m/z: 325.202
N-[2-(Адамантан-1-ил)этил]-5-фтор-N-(5-
[M + H]+. C18H24F3N2. M + H 325.189.
фторпиридин-2-ил)пиридин-2-амин (12а). По-
лучен в качестве второго продукта в синтезе со-
N-[2-(Адамантан-1-ил)этил]-4-(трифторме-
единения 12 по общей методике а. Выход 11%.
тил)-N-[4-(трифторметил)пиридин-2-ил]пири-
Спектр ЯМР 1Н, δ, м.д.: 1.40-1.44 м (2Н, AdCH2),
дин-2-амин (14а). Получен в качестве второго про-
1.51-1.53 м [6Н, CH2 (Ad)], 1.62-1.72 м [6H, CH2
дукта в синтезе соединения 14 по общей методике
(Ad)], 1.95 уш.с [3Н, CH (Ad)], 4.09-4.13 м (2Н,
а. Выход 10%. Спектр ЯМР 1Н, δ, м.д.: 1.44-1.48 м
CH2N), 7.01 д.д [2H, H3(Py), 3JНН 9.0, 4JНF 3.7 Гц],
(2Н, AdCH2), 1.58-1.60 м [6Н, CH2 (Ad)], 1.62-1.73
7.27 д.д.д [2H, H4(Py), 3JНН 9.0, 3JНF 7.6, 4JНH
м [6H, CH2 (Ad)], 1.97 уш.с [3Н, CH(Ad)], 4.24-4.28
3.0 Гц], 8.15 д [2H, H6(Py), 4JНН 3.0 Гц].
м (2Н, CH2N), 7.08 д [2H, H5(Py), 3JНН 5.2 Гц], 7.38
уш.с [2H, H3(Py)], 8.47 д [2H, H6(Py), 3JНН 5.2 Гц].
N-[2-(Адамантан-1-ил)этил]-3-(трифторме-
Спектр ЯМР 13С, δ, м.д.: 28.5 [3C, CH(Ad)], 32.0
тил)пиридин-2-амин (13). Получен по общей
[C(Ad)], 37.1 [3C, CH(Ad)], 41.4 (AdCH2), 42.1 [3C,
методике а взаимодействием амина 1 (45 мг) с
CH2(Ad)], 43.9 (CH2N), 110.2 [2C, C5(Py)], 112.6
2-бром-3-(трифторметил)пиридином
(46 мг) в
[2C, C3(Py)], 120.3 к (2C, CF3, 1JCF 273.8 Гц), 139.5
присутствии Pd(dba)2 (4.6 мг), DavePhos (3.5 мг).
к [2C, C4(Py), 2JCF 33.4 Гц], 149.3 [2C, C6(Py)],
Бежевое кристаллическое вещество, т.пл. 104-
157.0
[2C, C2(Py)]. Масс-спектр (MALDI-TOF),
105°С. Выход 45%. Спектр ЯМР 1Н, δ, м.д.: 1.41-
m/z: 470.217 [M + H]+. C24H26F6N3. M + H 470.203.
1.45 м (2Н, AdCH2), 1.58 уш.с [6Н, CH2 (Ad)], 1.63-
1.73 м [6H, CH2(Ad)], 1.96 уш.с [3Н, CH2(Ad)],
N-[2-(Адамантан-1-ил)этил]-5-(трифторме-
3.51-3.56 м (2Н, CH2N), 4.80 уш.с (1Н, NН), 6.63
тил)пиридин-2-амин (15). Получен по общей
д.д [1H, H5(Py), 3JНН 7.3, 3JНН 4.8 Гц], 7.68 д [1H,
методике а взаимодействием амина 1 (45 мг) с
H4(Py), 3JНH 7.3 Гц], 8.29 д
[1H, H6(Py), 3JНН
2-бром-5-(фторметил)пиридином (46 мг) в присут-
4.8 Гц]. Спектр ЯМР 13С, δ, м.д.: 28.6 [3C, CH2(Ad)],
ствии Pd(dba)2 (1.2 мг), DavePhos (1.0 мг). Бежевое
32.1 [C(Ad)], 37.0 [3C, CH2(Ad)], 37.2 к (AdCH2,
кристаллическое вещество, т.пл. 98-100°С. Выход
JCF 4.6 Гц), 42.5 [3C, CH2(Ad)], 43.8 (CH2N), 110.9
33%. Спектр ЯМР 1Н, δ, м.д.: 1.38-1.42 м (2Н,
[C5(Py)], 124.0 к (CF3, 1JCF 271.5 Гц), 135.8 уш.c
AdCH2), 1.55 уш.с [6Н, CH2 (Ad)], 1.62-1.73 м
[C4(Py)], 150.3 уш.c [C6(Py)], 153.8 уш.c [C2(Py)].
[6H, CH2 (Ad)], 1.96 уш.с [3Н, CH(Ad)], 3.26-3.32
Сигнал C3(Py) однозначно не отнесен. Спектр
м (2Н, CH2N), 5.00 уш.с (1Н, NH), 6.39 д [1H,
ЯМР 19F, δ, м.д.: -64.01. Масс-спектр (MALDI-
H3(Py), 3JНН 8.8 Гц], 7.58 д.д [1H, H4(Py), 3JНН 8.3,
TOF), m/z: 325.1863 [M + H]+. C18H24F3N2. M + H
4JНH 2.1 Гц], 8.29 уш.с [1H, H6(Py)]. Спектр ЯМР
325.1892.
13С, δ, м.д.: 28.5 [3C, CH(Ad)], 32.0 [C(Ad)], 37.0
[3C, CH2(Ad)], 37.1 (AdCH2), 42.4 [3C, CH2(Ad)],
N-[2-(Адамантан-1-ил)этил]-4-(трифторме-
43.6 (CH2N), 105.9 [C3(Py)], 115.1 к [C5(Py), 2JCF
тил)пиридин-2-амин (14). Получен по общей
33.7 Гц], 124.3 к (CF3, 1JCF 270.6 Гц), 134.8 [C4(Py)],
методике а взаимодействием амина 1 (45 мг) с
145.1
[C6(Py)],
159.9
[C2(Py)]. Масс-спектр
2-бром-4-(трифторметил)пиридином
(46 мг) в
(MALDI-TOF), m/z: 325.193 [M + H]+. C18H24F3N2.
присутствии Pd(dba)2 (1.2 мг), DavePhos (1.0 мг).
M + H 325.189.
Выход 69%. Спектр ЯМР 1Н, δ, м.д.: 1.40-1.44 м
(2Н, AdCH2), 1.56 уш.с [6Н, CH2(Ad)], 1.63-1.74 м
N-[2-(Адамантан-1-ил)этил]-5-(трифторме-
[6H, CH2(Ad)], 1.97 уш.с [3Н, CH2(Ad)], 3.26-3.31
тил)-N-[5-(трифторметил)пиридин-2-ил]пири-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
АРИЛИРОВАНИЕ АДАМАНТАНАМИНОВ: XI.
709
дин-2-амин (15а). Получен по общей методике а
7.5 Гц], 7.42 д [2H, H5(Py), 3JНН 8.5 Гц], 7.69 т [2H,
взаимодействием амина 1 (45 мг) с 2-бром-5-(фтор-
H4(Py), 3JННнабл 8.0 Гц]. Спектр ЯМР 13С, δ, м.д.:
метил)пиридином (173 мг) в присутствии Pd(dba)2
28.6 [3C, CH(Ad)], 32.0 [C(Ad)], 37.1 [3C, CH2(Ad)],
(4.9 мг), BINAP (5.9 мг). Выход 77%. Спектр ЯМР
41.1 (AdCH2), 42.0 [3C, CH2(Ad)], 43.7 (CH2N),
1Н, δ, м.д.: 1.44-1.49 м (2Н, AdCH2), 1.59-1.61 м
113.0 [2C, C3(Py)], 116.8 [2C, C5(Py)], 121.3 к (2C,
[6Н, CH2(Ad)], 1.65-1.75 м [6H, CH2(Ad)], 1.98
CF3, 1JCF 274.0 Гц), 138.2 [2C, C4(Py)], 146.4 к (2C,
уш.с [3Н, CH(Ad)], 4.27-4.31 м (2Н, CH2N), 7.27
C6(Py), 2JCF 34.8 Гц], 156.1 [2C, C2(Py)]. Спектр
д [2H, H3(Py), 3JНН 8.8 Гц], 7.76 д.д [2H, H4(Py),
ЯМР 19F, δ, м.д.: -61.81. Масс-спектр (MALDI-
3JНН 8.8, 4JНН 2.4 Гц], 8.59 д.к [2H, H6(Py), 4JНН
TOF), m/z: 470.212 [M + H]+. C24H26F6N3. M + H
2.4, 4JНF 0.9 Гц]. Спектр ЯМР 13С, δ, м.д.: 28.6 [3C,
470.203.
CH(Ad)], 32.1 [C(Ad)], 37.1 [3C, CH2(Ad)], 41.3
N-[2-(Адамантан-2-ил)этил]-3-фторпири-
(AdCH2), 42.2 [3C, CH2(Ad)], 44.0 (CH2N), 113.9
дин-2-амин (17). Получен по общей методике а
[2C, C3(Py)], 119.9 к [2C, C4(Py), 2JCF 33.3 Гц],
взаимодействием амина 2 (45 мг) с 2-бром-3-фтор-
123.8 к (2C, CF3, 1JCF 270.6 Гц), 134.4 [2C, C4(Py)],
пиридином (35 мг) в присутствии Pd(dba)2 (4.6 мг),
145.7 [2C, C6(Py)], 158.7 [2C, C2(Py)]. Масс-спектр
Сy-JosiPhos (4.9 мг). Выход 61%. Спектр ЯМР 1Н,
(MALDI-TOF), m/z: 470.194 [M + H]+. C24H26F6N3.
δ, м.д.: 1.52 д [2H, H(Ad), JНН 12.0 Гц], 1.68-1.91
M + H 470.203.
м [15Н, Н(Ad), AdCH2], 3.42-3.47 м (2Н, CH2N),
N-[2-(Адамантан-1-ил)этил]-6-(трифторме-
4.54 уш.с (1Н, NH), 6.46 д.д.д [1H, H4(Py), 3JНН 7.8,
тил)пиридин-2-амин (16). Получен по общей
3JНН 5.1, 4JНF 3.5 Гц), 7.08 д.д.д [1H, H5(Py), 3JНF
методике а взаимодействием амина 1 (45 мг) с
11.4, 3JНН 7.8, 4JНH 1.4 Гц], 7.87 д [1H, H6(Py), 3JНН
2-бром-6-(трифторметил)пиридином
(173 мг) в
5.1 Гц]. Спектр ЯМР 13С, δ, м.д.: 28.0 [CH(Ad)], 28.2
присутствии Pd(dba)2 (4.9 мг), BINAP (5.9 мг).
[CH(Ad)], 31.6 [2C, CH2(Ad)], 31.8 [2C, CH(Ad)],
Выход 59%. Спектр ЯМР 1Н, δ, м.д.: 1.38-1.42 м
32.7 [CH2(Ad)], 38.3 [CH2(Ad)], 39.1 [2C, CH2(Ad)],
(2Н, AdCH2), 1.55-1.57 м [6Н, CH2 (Ad)], 1.62-1.74
39.6 (AdCH2), 42.0 (CH2N), 111.3 [C5(Py)], 119.6 д
м [6H, CH2(Ad)], 1.97 уш.с [3Н, CH(Ad)], 3.24-
[C4(Py), 2JCF 16.0 Гц], 142.7 д [C6(Py), 4JCF 5.9 Гц],
3.29 м (2Н, CH2N), 4.70 уш.с (1Н, NH), 6.53 д [1H,
147.1 д [C3(Py), 1JCF 251.2 Гц], 148.8 д [C2(Py), 2JCF
H3(Py), 3JНН 8.6 Гц], 6.90 д [1H, H5(Py), 3JНН 7.3 Гц],
11.8 Гц]. Масс-спектр (MALDI-TOF), m/z: 275.207
7.54 т [1H, H4(Py), 3JННнабл 7.9 Гц]. Спектр ЯМР
[M + H]+. C17H24FN2. M + H 275.192.
13С, δ, м.д.: 28.6 [3C, CH(Ad)], 31.9 [C(Ad)], 36.6
N-[2-(Адамантан-2-ил)этил]-5-фторпири-
(AdCH2), 37.0 [3C, CH2(Ad)], 42.5 [3C, CH2(Ad)],
дин-2-амин (18). Получен по общей методике
43.7 (CH2N), 108.6 [C3(Py)], 109.5 [C5(Py)], 121.4 к
а взаимодействием амина 2 (45 мг) с 2-бром-5-
(CF3, 1JCF 274.8 Гц), 138.3 [C4(Py)], 146.3 к [C6(Py),
фторпиридином (35 мг) в присутствии Pd(dba)2
2JCF 33.7 Гц], 158.6 [C2(Py)]. Спектр ЯМР 19F, δ,
(4.6 мг), DavePhos (3.5 мг). Светло-желтое кри-
м.д.:
-61.27. Масс-спектр (MALDI-TOF), m/z:
сталлическое вещество, т.пл. 64-66°С. Выход 58%.
325.195 [M + H]+. C18H24F3N2. M + H 325.189.
По методике б получали взаимодействием амина 2
N-[2-(Адамантан-1-ил)этил]-6-(трифторме-
(90 мг) с 2-бром-5-фторпиридином (110 мг) в при-
тил)-N-[6-(трифторметил)пиридин-2-ил]пири-
сутствии CuI (19 мг), 2-изобутирилциклогексанона
дин-2-амин (16а). Получено в качестве второго
(34 мг). Выход 84%. Спектр ЯМР 1Н, δ, м.д.: 1.52 д
продукта при синтезе соединения 16 по общей
[2H, H(Ad), JНН 12.0 Гц], 1.66-1.88 м [15Н, Н(Ad),
методике а взаимодействием амина 1 (45 мг) с
AdCH2], 3.16-3.21 м (2Н, CH2N), 4.46 уш.с (1Н,
2-бром-6-(трифторметил)пиридином
(46 мг) в
NH), 6.31 д.д [1H, H3(Py), 3JНН 9.0, 4JНF 2.5 Гц],
присутствии Pd(dba)2 (2.3 мг), DavePhos (2.0 мг).
7.12-7.20 м [1H, H4(Py)], 7.92 уш.с [1H, H6(Py)].
Светло-желтое кристаллическое вещество, т.пл.
Спектр ЯМР 13С, δ, м.д.:
27.9
[CH(Ad)],
28.1
69-71°С. Выход 18%. Спектр ЯМР 1Н, δ, м.д.: 1.46-
[CH(Ad)], 31.6 [2C, CH2(Ad)], 31.8 [2C, CH(Ad)],
1.50 м (2Н, AdCH2), 1.59-1.61 м [6Н, CH2 (Ad)],
32.3 [CH2(Ad)], 38.2 [CH2(Ad)], 39.0 [2C, CH2(Ad)],
1.64-1.74 м [6H, CH2(Ad)], 1.97 уш.с [3Н, CH(Ad)],
41.2 (AdCH2), 41.9 (CH2N), 106.5 [C3(Py)], 125.1
4.28-4.32 м (2Н, CH2N), 7.24 д [2H, H3(Py), 3JНН
д [C4(Py), 2JCF 20.6 Гц], 134.5 д
[C6(Py),
2JCF
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
710
ЛЯХОВИЧ и др.
24.7 Гц], 153.1 д [C5(Py), 1JCF 240.7 Гц], 155.7
фторметил)пиридином (141 мг) в присутствии CuI
[C2(Py)]. Масс-спектр (MALDI-TOF), m/z: 275.1948
(19 мг),
2-изобутирилциклогексанона
(34 мг).
[M + H]+. C17H24FN2. M + H 275.1924.
Выход 79%. Спектр ЯМР 1Н, δ, м.д.: 1.55 д [2H,
H(Ad), JНН 12.4 Гц], 1.73 уш.с [4Н, Н(Ad)], 1.74-
N-[2-(Адамантан-2-ил)этил]-5-фтор-N-(5-
1.80 м [3Н, Н(Ad)], 1.80-1.89 м [8Н, Н(Ad), AdCH2],
фторпиридин-2-ил)пиридин-2-амин (18a). По-
3.26-3.31 м (2Н, CH2N), 5.10 уш.с (1Н, NH), 6.56
лучен в качестве второго продукта при синтезе
уш.с [1H, H3(Py)], 7.73 д [1H, H5(Py), 3JНН 5.3 Гц],
соединения 18 по общей методике а. Выход 20%.
8.18 д [1H, H6(Py), 3JНН 5.3 Гц]. Спектр ЯМР 13С,
Спектр ЯМР 1Н, δ, м.д.: 1.52 д [2H, H(Ad), JНН
δ, м.д.: 27.9 [CH(Ad)], 28.1 [CH(Ad)], 31.6 [2C,
12.0 Гц], 1.64-1.89 м [15Н, Н(Ad), AdCH2], 4.03-
CH2(Ad)], 31.8 [2C, CH(Ad)], 32.1 [CH2(Ad)], 38.2
4.07 м (2Н, CH2N), 7.00 д.д [2H, H3(Py), 3JНН = 4JНF
[CH2(Ad)], 39.0 [2C, CH2(Ad)], 40.9 (AdCH2), 41.8
2.8 Гц], 7.22-7.29 м [2H, H4(Py)], 8.14 уш.с [2H,
(CH2N), 103.1 [C3(Py)], 107.5 [C4(Py)], 122.6 к (CF3,
H6(Py)]. Спектр ЯМР 13С, δ, м.д.: 27.8 [CH(Ad)],
1JCF 274.0 Гц), 140.9 к [C4(Py), 2JCF 33.4 Гц], 148.6
28.0 [CH(Ad)], 30.7 [CH2(Ad)], 31.5 [2C, CH2(Ad)],
д [C6(Py)], 158.0 [C2(Py)]. Спектр ЯМР 19F, δ, м.д.:
31.8
[2C, CH(Ad)],
38.1
[CH2(Ad)],
38.7
[2C,
-65.50. Масс-спектр (MALDI-TOF), m/z: 325.1914
CH2(Ad)], 42.1 (AdCH2), 47.8 (CH2N), 114.9 [2C,
[M + H]+. C18H24F3N2. M + H 325.1892.
C3(Py)], 124.6 д [2C, C4(Py), 2JCF 20.3 Гц], 135.1
д [2C, C6(Py), 2JCF 24.5 Гц], 153.7 [2C, C2(Py)],
N-[2-(Адамантан-2-ил)этил]-4-(трифторме-
154.9 д [2C, C5(Py), 1JCF 251.2 Гц]. Масс-спектр
тил)-N-[4-(трифторметил)пиридин-2-ил]пи-
(MALDI-TOF), m/z: 370.216 [M + H]+. C22H26F2N3.
ридин-2-амин (20а). Получен в качестве второго
M + H 370.209.
продукта при синтезе соединения 20. Выход 9%.
Спектр ЯМР 1Н, δ, м.д.: 1.54 д [2H, H(Ad), JНН
N-[2-(Адамантан-2-ил)этил]-3-(трифторме-
12.0 Гц], 1.71-1.90 м [15Н, Н(Ad), AdCH2], 4.19-
тил)пиридин-2-амин (19). Получен по общей
методике а взаимодействием амина 2 (45 мг) с
4.23 м (2Н, CH2N), 7.09 д [2H, H5(Py), 3JНН 5.1 Гц],
7.38 уш.с [2H, H3(Py)], 8.48 д [2H, H6(Py), 3JНН
2-бром-3-(трифторметил)пиридином
(46 мг) в
5.1 Гц].
присутствии Pd(dba)2 (4.6 мг), Сy-JosiPhos (4.9 мг).
Выход 36%. Спектр ЯМР 1Н, δ, м.д.: 1.52 д [2H,
N-[2-(Адамантан-2-ил)этил]-5-(трифторме-
H(Ad), JНН 12.4 Гц], 1.65-1.89 м [15Н, Н(Ad),
тил)пиридин-2-амин (21). Получен по общей
AdCH2], 3.43-3.48 м (2Н, CH2N), 4.81 уш.с (1Н,
методике а взаимодействием амина 2 (45 мг) с
NH), 6.56 д.д [1H, H5(Py), 3JНН 7.6, 3JНН 5.3 Гц],
2-бром-5-(трифторметил)пиридином
(46 мг) в
7.60 д
[1H, H4(Py), 3JНН 7.6 Гц], 8.24 д [1H,
присутствии Pd(dba)2 (1.2 мг), DavePhos (1.0 мг).
H6(Py), 3JНН 5.3 Гц]. Спектр ЯМР 13С, δ, м.д.: 28.0
Выход 41%. По методике б получали взаимодей-
[CH(Ad)], 28.1 [CH(Ad)], 31.6 [2C, CH2(Ad)], 31.8
ствием амина 2 (90 мг) с 2-бром-5-(трифторметил)-
[2C, CH(Ad)], 32.3 [CH2(Ad)], 38.3 [CH2(Ad)], 39.1
пиридином (141 мг) в присутствии CuI (19 мг),
[2C, CH2(Ad)], 40.1 (AdCH2), 42.1 (CH2N), 108.3 к
2-изобутирилциклогексанона
(34 мг). Выход
[C3(Py), 2JCF 30.4 Гц], 110.8 [C5(Py)], 124.4 к (CF3,
81%. Спектр ЯМР 1Н, δ, м.д.: 1.55 д [2H, H(Ad),
1JCF 271.5 Гц), 134.8 к [C4(Py), 3JCF 5.3 Гц], 151.6
J
12.1 Гц], 1.72 уш.с [4Н, Н(Ad)], 1.74-1.79 м
НН
[C6(Py)],
154.7
[C2(Py)]. Масс-спектр (MALDI-
[3Н, Н(Ad)], 1.80-1.90 м [8Н, Н(Ad), AdCH2],
TOF), m/z: 305.1867 [M - F]+. C18H24F2N2. M - F
3.27-3.32 м (2Н, CH2N), 5.13 уш.с (1Н, NH), 6.41
305.1829.
уш.с [1H, H3(Py)], 7.59 д.д [1H, H4(Py), 3JНН 8.9,
N-[2-(Адамантан-2-ил)этил]-4-(трифторме-
4JНН 2.3 Гц], 8.30 уш.с [1H, Н6(Py)]. Спектр ЯМР
тил)пиридин-2-амин (20). Получен по общей
13С, δ, м.д.: 27.9 [CH(Ad)], 28.1 [CH(Ad)], 31.6
методике а взаимодействием амина 2 (45 мг) с
[2C, CH2(Ad)], 31.8 [2C, CH(Ad)], 32.2 [CH2(Ad)],
2-бром-4-(трифторметил)пиридином
(46 мг) в
38.2 [CH2(Ad)], 39.0 [2C, CH2(Ad)], 40.6 (AdCH2),
присутствии Pd(dba)2 (1.2 мг), DavePhos (1.0 мг).
41.9 (CH2N), 105.7 [C3(Py)], 115.2 к [C5(Py), 2JCF
Светло-желтое кристаллическое вещество, т.пл.
32.9 Гц],
124.4 к (CF3, 1JCF 269.8 Гц),
134.7
76-79°С. Выход 74%. По методике б получали
[C4(Py)], 145.6 к
[C6(Py), 3JCF 4.2 Гц],
160.2
взаимодействием амина 2 (90 мг) с 2-бром-4-(три-
[C2(Py)]. Спектр ЯМР 19F, δ, м.д.: -61.28. Масс-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
АРИЛИРОВАНИЕ АДАМАНТАНАМИНОВ: XI.
711
спектр (MALDI-TOF), m/z:
325.198
[M + H]+.
продукта при синтезе соединения 22 по общей
C18H24F3N2
. M + H 325.189.
методике а взаимодействием амина 2 (45 мг) с
2-бром-6-(трифторметил)пиридином (46 мг) в при-
N-[2-(Адамантан-2-ил)этил]-5-(трифторме-
сутствии Pd(dba)2 (4.6 мг), DavePhos (3.5 мг). Выход
тил)-N-[5-(трифторметил)пиридин-2-ил]пири-
12%. Спектр ЯМР 1Н, δ, м.д.: 1.52 д [2H, H(Ad), JНН
дин-2-амин (21а). Получен по общей методике а
12.6 Гц], 1.67-1.92 м [15Н, Н(Ad), AdCH2], 4.23-
взаимодействием амина 2 (45 мг) с 2-бром-5-(триф-
4.27 м (2Н, CH2N), 7.24 д [2H, H3(Py), 3JНН 7.5 Гц],
торметил)пиридином (172.5 мг) в присутствии
7.41 д [2H, H5(Py), 3JНН 8.5 Гц], 7.69 т [2H, H4(Py),
Pd(dba)2 (4.9 мг), BINAP (5.9 мг). Выход 60%.
3JННнабл 8.0 Гц]. Спектр ЯМР 13С, δ, м.д.: 27.9
Спектр ЯМР 1Н, δ, м.д.: 1.52 д [2H, H(Ad), JНН
[CH(Ad)], 28.2 [CH(Ad)], 31.6 [3C, CH2(Ad)], 31.8
13.8 Гц], 1.61-1.90 м [15Н, Н(Ad), AdCH2], 4.21-
[CH2(Ad)], 32.3 [CH2(Ad)], 38.3 [CH2(Ad)], 39.1
4.25 м (2Н, CH2N), 7.29 д [2H, H3(Py), 3JНН 8.8 Гц],
[2C, CH2(Ad)], 42.2 (AdCH2), 47.3 (CH2N), 113.4
7.76 д.д [2H, H4(Py), 3JНН 8.8, 4JНН 2.5 Гц], 8.50
[2C, C3(Py)], 116.9 [2C, C5(Py)], 121.1 к (СF3, 1JCF
уш.с [2H, Н6(Py)]. Спектр ЯМР 13С, δ, м.д.: 28.0
274.2 Гц), 138.2 [2C, C4(Py)], 146.4 к [2C, C6(Py),
[CH(Ad)], 28.1 [CH(Ad)], 30.6 [CH2(Ad)], 31.6 [2C,
2JCF 34.8 Гц], 156.3 [2C, C2(Py)]. Спектр ЯМР 19F,
CH2(Ad)], 31.8 [2C, CH(Ad)], 38.2 [CH2(Ad)], 39.0
δ, м.д.: -68.57. Масс-спектр (MALDI-TOF), m/z:
[2C, CH2(Ad)], 42.2 (AdCH2), 47.6 (CH2N), 113.8
470.188 [M + H]+. C24H26F6N3. M + H 470.203.
[2C, C3(Py)], 120.0 к [2C, C5(Py), 2JCF 33.0 Гц],
121.7 к [2C, СF3, 1JCF271.1 Гц), 134.3 д [2C, C4(Py)],
N-[(Адамантан-2-ил)метил]-3-фторпири-
145.6 [2C, C6(Py)], 158.7 [2C, C2(Py)]. Спектр ЯМР
дин-2-амин (23). Получен по общей методике
19F, δ, м.д.: -68.49. Масс-спектр (MALDI-TOF),
а взаимодействием амина 3 (41 мг) с 2-бром-3-
. M + H 470.203
m/z: 470.214 [M + H]+. C24H26F6N3
фторпиридином (35 мг) в присутствии Pd(dba)2
(4.6 мг), DavePhos (3.5 мг). Выход 76%. Спектр
N-[2-(Адамантан-2-ил)этил]-6-(трифторме-
ЯМР 1Н, δ, м.д.: 1.56 д [2H, H(Ad), JНН 12.9 Гц],
тил)пиридин-2-амин (22). Получен по общей
1.73 уш.с [4Н, Н(Ad)], 1.81-1.96 м [9Н, Н(Ad)],
методике а взаимодействием амина 2 (45 мг) с
3.58 д.д (2Н, CH2N, 3JНН 7.5, 3JНН 5.6 Гц), 4.51 уш.с
2-бром-6-(трифторметил)пиридином
(172.5 мг)
в присутствии Pd(dba)2 (4.9 мг), BINAP (5.9 мг).
(1Н, NH), 6.45 д.д.д [1H, H5(Py), 3JНН 7.8, 3JНН 5.1,
4JНF 3.5 Гц], 7.08 д.д.д [1H, H4(Py), 3JНF 11.5, 3JНН
Выход 86%. По методике б получали взаимодей-
ствием амина 2 (90 мг) с 2-бром-6-(трифторметил)
7.8, 4JНН 1.5 Гц], 7.87 д.д.д [1H, H6(Py), 3JНН 5.1,
пиридином (141 мг) в присутствии CuI (19 мг),
4JНН 1.4, 5JНF 1.0 Гц]. Спектр ЯМР 13С, δ, м.д.: 27.9
2-изобутирилциклогексанона (34 мг). Выход 89%.
[CH(Ad)], 28.3 [CH(Ad)], 30.2 [2C, CH(Ad)], 31.7
Спектр ЯМР 1Н, δ, м.д.: 1.54 д [2H, H(Ad), JНН
[2C, CH2(Ad)], 38.2 [CH2(Ad)], 38.9 [2C, CH2(Ad)],
12.3 Гц], 1.72 уш.с [4Н, Н(Ad)], 1.74-1.78 м [3Н,
44.3 (CH2N), 44.5 [CH2(Ad)], 111.2 [C5(Py)], 119.6
Н(Ad)], 1.79-1.89 м [8Н, Н(Ad), AdCH2], 3.25-
д [C4(Py), 2JCF 15.2 Гц], 142.7 д
[C6(Py), 4JCF
3.29 м (2Н, CH2N), 4.87 уш.с (1Н, NH), 6.52 д
6.8 Гц], 147.1 д [C3(Py), 1JCF 252.1 Гц], 149.9 д
[1H, H3(Py), 3JНН 8.5 Гц], 6.90 д [1H, H5(Py), 3JНН
[C2(Py), 2JCF 11.0 Гц]. Масс-спектр (MALDI-TOF),
7.3 Гц], 7.53 т [1H, H4(Py), 3JННнабл 7.9 Гц]. Спектр
m/z: 261.1793 [M + H]+. C16H22FN2. M + H 261.1767.
ЯМР 13С, δ, м.д.: 28.0 [CH(Ad)], 28.1 [CH(Ad)], 31.6
N-[(Адамантан-2-ил)метил]-5-фторпири-
(Ad)],
[2C, CH2(Ad)], 31.8 [2C, CH(Ad)], 32.3 [CH2
дин-2-амин (24). Получен по общей методике б
),
38.3 [CH2(Ad)], 39.1 [2C, CH2(Ad)], 40.6 (AdCH2
взаимодействием амина 3 (83 мг) с 2-бром-5-ф-
(Py)], 121.4 к
41.8 (CH2N), 108.6 [C3(Py)], 109.2 [C5
торпиридином (110 мг) в присутствии CuI (19 мг),
(Py),
(CF3, 1JCF 274.8 Гц), 138.3 [C4(Py)], 146.3 к [C6
2-изобутирилциклогексанона (34 мг). Выход 75%.
F, δ,
2JCF 34.0 Гц], 158.6 [C2(Py)]. Спектр ЯМР 19
Спектр ЯМР 1Н, δ, м.д.: 1.56 д [2Н, H(Ad), JНН
м.д.:
-68.66. Масс-спектр (MALDI-TOF), m/z:
12.3 Гц], 1.73 уш.с [4Н, H(Ad)], 1.81-1.94 м [9Н,
325.177 [M + H]+. C18H24F3N2. M + H 325.189.
H(Ad)], 3.33 д (2Н, CH2Ad, 3JНН 7.2 Гц), 4.45 уш.с
N-[2-(Адамантан-2-ил)этил]-6-(трифторме-
(1Н, NH), 6.34 уш.с [1Н, H3(Py)], 7.18 д.д. [1Н,
тил)-N-[6-(трифторметил)пиридин-2-ил]пи-
H4(Py), 3JНН = 3JНF 8.3 Гц], 7.94 уш.с [1Н, H6(Py)].
ридин-2-амин (22а). Получен в качестве второго
Спектр ЯМР 13С, δ, м.д.: 27.9 (Ad), 28.2 (Ad),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
712
ЛЯХОВИЧ и др.
30.2 (2C, Ad), 31.7 (2C, Ad), 38.1 (Ad), 38.9 (2C,
N-[(Адамантан-2-ил)метил]-6-(трифторме-
Ad), 44.3 (Ad), 45.2 (CH2N), 107.0 уш.c [C3(Py)],
тил)пиридин-2-амин (27). Получен по общей
125.6 д [C4(Py), 2JCF 20.3 Гц], 134.5 уш.д [C6(Py),
методике б взаимодействием амина 3 (83 мг) с
2JCF 27.5 Гц], 155.9 [С2(Py)], 156.5 д [C5(Py), 1JCF
2-бром-6-(трифторметил)пиридином
(141 мг) в
262.0 Гц]. Масс-спектр (MALDI-TOF), m/z:
присутствии CuI (19 мг), 2-изобутирилциклогек-
261.1735 [M + H]+. C16H22FN2. M + H 261.1767.
санона (34 мг). Выход 97%. Спектр ЯМР 1Н, δ,
м.д.: 1.58 д [2Н, H(Ad), JНН 12.0 Гц], 1.74 уш.с
N-[(Адамантан-2-ил)метил]-4-(трифторме-
[4Н, H(Ad)], 1.82-1.95 м [9Н, H(Ad)], 3.39 д.д (2Н,
тил)пиридин-2-амин (25). Получен по общей
CH2N, 3JНН 7.0, 3JНН 5.9 Гц), 4.76 уш.с (1Н, NH),
методике б взаимодействием амина
3
(83 мг)
6.51 д [1Н, H3(Py), 3JНН 8.4 Гц], 6.89 д [1Н, H5(Py),
с
2-бром-4-(трифторметил)пиридином
(141 мг)
3JНН 7.3 Гц], 7.52 т [1Н, H4(Py), 3JНHнабл 7.9 Гц].
в присутствии CuI (19 мг), 2-изобутирилцикло-
Спектр ЯМР 13С, δ, м.д.: 27.8 (Ad), 28.1 (Ad), 30.1
гексанона (34 мг). Выход 64%. По общей ме-
(2C, Ad), 31.7 (2C, Ad), 38.0 (Ad), 38.8 (2C, Ad), 44.4
тодике А взаимодействием амина 3 (41 мг) с
(Ad), 44.5 (CH2N), 108.3 [C3(Py)], 109.0 [C5(Py)],
2-бром-4-(трифторметил)пиридином
(45 мг) в
121.6 к (CF3, 1JCF 274.2 Гц), 138.1 [C4(Py)], 146.4 к
присутствии Pd(dba)2 (2.3 мг), DavePhos (1.9 мг)
[C6(Py), 2JCF 33.7 Гц], 158.8 [C2(Py)]. Масс-спектр
получен с выходом 81%. Спектр ЯМР 1Н, δ, м.д.:
(MALDI-TOF), m/z: 311.1793 [M + H]+. C17H22F3N2.
1.58 д [2Н, H(Ad), JНН 12.5 Гц], 1.72-1.77 м [4Н,
M + H 311.1735.
H(Ad)], 1.83-1.96 м [9Н, H(Ad)], 3.40 д.д (2Н,
CH2N, 3JНН 7.5, 3JНН 5.6 Гц), 4.80 уш.с (1Н, NH),
N-[1-(Адамантан-1-ил)пропан-2-ил]-3-фтор-
6.54 с [1Н, H3(Py)], 6.71 [1Н, H5(Py), 3JНН 5.2 Гц],
пиридин-2-амин (28). Получен по общей ме-
8.19 д [1Н, H6(Py), 3JНН 5.2 Гц]. Спектр ЯМР 13С,
тодике а взаимодействием амина
4
(48 мг) с
δ, м.д.: 27.8 (Ad), 28.2 (Ad), 30.2 (2C, Ad), 31.7
2-бром-3-фторпиридином (35 мг) в присутствии
(2C, Ad), 38.1 (Ad), 38.8 (2C, Ad), 44.2 (Ad), 44.5
Pd(dba)2 (4.6 мг), DavePhos (3.5 мг). Выход 47%.
(CH2N), 101.9 уш.с [C3(Py)], 107.8 уш.с [C5(Py)],
Спектр ЯМР 1Н, δ, м.д.: 1.09 д.д (1H, AdСН2, 2JНН
123.1 к (CF3, 1JCF 273.0 Гц), 139.5 к [C4(Py), 2JCF
14.2, 3JНН 6.3 Гц), 1.17 д.д (1H, AdСН2, 2JНН 14.2,
33.7 Гц], 149.3 уш.с [C6(Py)], 159.3 [C2(Py)]. Масс-
3JНН 4.2 Гц), 1.17 д (3H, СН3, 3JНН 6.1 Гц), 1.54
спектр (MALDI-TOF), m/z: 311.1689 [M + H]+.
уш.с [6Н, СН2(Ad)], 1.57-1.67 м [6Н, СН2(Ad)],
C17H22F3N2. M + H 311.1735.
1.81-1.96 м [3Н, СН(Ad)], 3.02-3.10 м (1Н, СНN),
4.30 уш.с (1Н, NH), 6.42 д.д.д [1H, H5(Py), 3JНН 7.9,
N-[(Адамантан-2-ил)метил]-5-(трифторме-
3JНН 4.9, 4JНF 4.5 Гц], 7.06 д.д.д [1H, H4(Py), 3JНF
тил)пиридин-2-амин (26). Получен по общей
11.4, 3JНН 7.9, 4JНН 1.4 Гц], 7.87 д [1H, H6(Py), 3JНН
методике б взаимодействием амина 3 (83 мг) с
4.9 Гц]. Спектр ЯМР 13С, δ, м.д.: 23.8 (CH3), 28.6
2-бром-5-(трифторметил)пиридином
(141 мг) в
[3C, CH(Ad)], 32.5 [C(Ad)], 36.9 [3C, CH2(Ad)],
присутствии CuI (19 мг), 2-изобутирилциклогек-
41.9 (AdCH2), 42.8 [3C, CH2(Ad)], 52.7 (CHN),
санона (34 мг). Выход 69%. Спектр ЯМР 1Н, δ,
110.8
[C5(Py)], 119.5 д
[C4(Py), 2JCF 15.2 Гц],
м.д.: 1.57 д [2Н, H(Ad), JНН 12.4 Гц], 1.73 уш.с
142.8 д [C6(Py), 4JCF 5.9 Гц], 146.9 д [C3(Py), 1JCF
[4Н, H(Ad)], 1.80-1.95 м [9Н, H(Ad)], 3.42 уш.д
252.1 Гц], 147.9 д [C2(Py), 2JCF 11.0 Гц]. Масс-
(2Н, CH2N, 3JННнабл 6.7 Гц), 5.02 уш.с (1Н, NH),
спектр (MALDI-TOF), m/z: 289.2058 [M + H]+.
6.43 уш.с [1Н, H3(Py)], 7.55 д [1Н, H4(Py), 3JНН
C18H26FN2. M + H 289.2080.
8.7 Гц], 8.36 уш.с [1Н, H6(Py)]. Спектр ЯМР 13С,
δ, м.д.: 27.5 (Ad), 28.5(Ad), 29.8 (2C, Ad), 31.3
N-[1-(Адамантан-1-ил)пропан-2-ил]-5-фтор-
(2C, Ad), 37.7 (Ad), 38.4 (2C, Ad), 43.8 (Ad), 44.1
пиридин-2-амин (29). Получен по общей методи-
[CH2N), 105.4 уш.с [C3(Py)], 124.3 к (CF3, 1JCF
ке б взаимодействием амина 4 (97 мг) с 2-бром-5-
268.9 Гц), 133.9 [C4(Py)], 145.6 уш.с [C6(Py)], 160.2
фторпиридином
(110 мг) в присутствии CuI
[C2(Py)], сигнал С5(Py) однозначно не отнесен
(19 мг),
2-изобутирилциклогексанона
(34 мг).
из-за уширения сигнала. Масс-спектр (MALDI-
Выход 67%. Спектр ЯМР 1Н, δ, м.д.: 1.14 д (3Н,
TOF), m/z: 311.1702 [M + H]+. C17H22F3N2. M + H
СН3, 3JНН 6.1 Гц), 1.24-1.29 м (2Н, AdCH2), 1.52
311.1735.
уш.с [6Н, СН2(Ad)], 1.57-1.67 м [6Н, СН2(Ad)],
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
АРИЛИРОВАНИЕ АДАМАНТАНАМИНОВ: XI.
713
1.90 уш.с [3Н, СН(Ad)], 3.81 уш.с (1Н, СНN), 4.22
СН2(Ad)], 1.93 уш.с [3Н, СН(Ad)], 3.95 уш.с (1Н,
уш.с (1Н, NH), 6.28 уш.с [1Н, H3(Py)], 7.16 д.д. [1Н,
СНN), 5.07 уш.с (1Н, NH), 6.41 д [1Н, H3(Py), 3JНН
H4(Py), 3JНН = 3JНF 7.8 Гц], 7.94 уш.с [1Н, H6(Py)].
8.3 Гц], 7.59 д [1Н, H4(Py), 3JНН 8.3 Гц], 8.28 с [1Н,
Спектр ЯМР 13С, δ, м.д.: 23.4 (СН3), 28.8 [2С,
H6(Py)]. Спектр ЯМР 13С, δ, м.д.: 23.1 (СН3), 28.4
СH(Ad)], 32.4 [С(Ad)], 36.9 [3С, СH2(Ad)], 42.9
[2С, СH(Ad)], 32.3 [С(Ad)], 36.7 [3С, СH2(Ad)],
[3С, СH2(Ad)], 43.4 (AdCH2), 52.6 (CHN), 106.7
42.5
[3С, СH2(Ad)], 42.7 (AdCH2), 52.2 (CHN),
уш.с [C3(Py)], 125.1 д [C4(Py), 2JCF 20.5 Гц], 134.7
106.0 уш.с [C3(Py)], 124.8 к (CF3, 1JCF 269.1 Гц),
д [C6(Py), 2JCF 22.1 Гц], 153.0 уш.д [C5(Py), 1JCF
133.9 [C4(Py)], 146.0 [C6(Py)], 159.2 [C2(Py)], сиг-
236.6 Гц], 154.6 [C2(Py)]. Масс-спектр (MALDI-
нал С5(Py) однозначно не отнесен из-за уширения
TOF), m/z: 289.213 [M + H]+. C18H26FN2. M + H
сигнала. Масс-спектр (MALDI-TOF), m/z: 339.188
289.208.
[M + H]+. C19H26F3N2. M + H 339.205.
N-[1-(Адамантан-1-ил)пропан-2-ил]-4-(три-
N-[1-(Адамантан-1-ил)пропан-2-ил]-6-(три-
фторметил)пиридин-2-амин
(30). Получен по
фторметил)пиридин-2-амин
(32). Получен по
общей методике б взаимодействием амина
4
общей методике б взаимодействием амина
4
(97 мг) с
2-бром-4-(трифторметил)пиридином
(97 мг) с
2-бром-6-(трифторметил)пиридином
(141 мг) в присутствии CuI (19 мг), 2-изобути-
(141 мг) в присутствии CuI (19 мг), 2-изобути-
рилциклогексанона (34 мг). Выход 56%. По об-
рилциклогексанона (34 мг). Выход 67%. Спектр
щей методике а взаимодействием амина 4 (48 мг)
ЯМР 1Н, δ, м.д.: 1.17 д (3Н, СН3, 3JНН 6.4 Гц),
с 2-бром-4-(трифторметил)пиридином (45 мг) в
1.26 д.д (1Н, AdCH2, 2JНН 14.4, 3JНН 4.3 Гц), 1.32
присутствии Pd(dba)2 (2.3 мг), DavePhos (1.9 мг)
д.д (1Н, AdCH2, 2JНН 14.4, 3JНН 7.2 Гц), 1.53 уш.с
получен с выходом 75%. Спектр ЯМР 1Н, δ, м.д.:
[6Н, СН2(Ad)], 1.58-1.68 м [6Н, СН2(Ad)], 1.92
1.18 д (3Н, СН3, 3JНН 6.3 Гц), 1.31 д (2Н, AdCH2,
уш.с [3Н, СН(Ad)], 3.86-3.97 м (1Н, СНN), 4.57
3JНН 5.9 Гц), 1.54 уш.с [6Н, СН2(Ad)], 1.59-1.69
д (1Н, NH, 3JНН 7.6 Гц), 6.47 д [1Н, H3(Py), 3JНН
м [6Н, СН2(Ad)], 1.93 уш.с [3Н, СН(Ad)], 3.95
8.4 Гц], 6.85 д [1Н, H5(Py), 3JНН 7.3 Гц], 7.49 т [1Н,
септ. (1Н, СНN, 3JННнабл 6.6 Гц), 4.51 уш.д (1Н,
H4(Py), 3JННнабл 7.9 Гц]. Спектр ЯМР 13С, δ, м.д.:
NH, 3JННнабл 7.8 Гц), 6.48 с [1Н, H3(Py)], 6.69
23.2 (СН3), 28.5 [2С, СH(Ad)], 32.4 [С(Ad)], 36.9
[1Н, H5(Py), 3JНН 5.2 Гц], 8.20 д [1Н, H6(Py), 3JНН
[3С, СH2(Ad)], 42.8 [3С, СH2(Ad)], 42.9 (AdCH2),
5.2 Гц]. Спектр ЯМР 13С, δ, м.д.: 23.3 (СН3), 28.6
52.5 (CHN), 108.1 [C3(Py)], 109.3 [C5(Py)], 121.7
[2С, СH(Ad)], 32.5 [С(Ad)], 36.9 [3С, СH2(Ad)],
к (CF3, 1JCF 274.0 Гц),
137.8
[C4(Py)], 146.6 к
42.9
[3С, СH2(Ad)], 43.1 (AdCH2), 52.6 (CHN),
[C6(Py), 2JCF 33.0 Гц], 157.5 [C2(Py)]. Масс-спектр
102.3 [C3(Py)], 107.4 [C5(Py)], 123.2 к (CF3, 1JCF
(MALDI-TOF), m/z: 339.214 [M + H]+. C19H26F3N2.
272.8 Гц), 139.5 к [C4(Py), 2JCF 33.2 Гц], 149.7
M + H 339.205.
[C6(Py)],
157.9
[C2(Py)]. Масс-спектр (MALDI-
N-[2-(Адамантан-2-ил)пропил]-3-фторпи-
TOF), m/z: 339.191 [M + H]+. C19H26F3N2. M + H
ридин-2-амин (33). Получен по общей методике
339.205.
а взаимодействием амина 5 (48 мг) с 2-бром-3-
N-[1-(Адамантан-1-ил)пропан-2-ил]-5-(три-
фторпиридином (35 мг) в присутствии Pd(dba)2
фторметил)пиридин-2-амин
(31). Получен по
(4.6 мг), DavePhos (3.5 мг). Выход 63%. Спектр
общей методике б взаимодействием амина
4
ЯМР 1Н, δ, м.д.: 0.97 д (3H, СН3, 3JНН 6.7 Гц),
(97 мг) с
2-бром-5-(трифторметил)пиридином
1.40 д [1H, Н(Ad), 3JНН 10.7 Гц], 1.47-1.57 м [2H,
(141 мг) в присутствии CuI (19 мг), 2-изобути-
Н(Ad)], 1.72 уш.с [4H, Н(Ad)], 1.76-1.95 м [7H,
рилциклогексанона (34 мг). Выход 53%. По об-
Н(Ad)], 2.01-2.05 м [1H, Н(Ad)], 2.05-2.12 м (1H,
щей методике а взаимодействием амина 4 (48 мг)
AdСН), 3.18 д.д.д (1H, СH2N, 2JНН 12.8, 3JНН 8.0,
с 2-бром-5-(трифторметил)пиридином (45 мг) в
3JНН 5.8 Гц), 4.56 уш.с (1H, NН), 6.45 д.д.д [1H,
присутствии Pd(dba)2 (2.3 мг), DavePhos (1.9 мг)
H5(Py), 3JНН 7.7, 3JНН 4.9, 4JНF 3.4 Гц], 7.09 д.д.д
получен с выходом 51%. Спектр ЯМР 1Н, δ, м.д.:
[1H, H4(Py), 3JНF 11.5, 3JНН 7.7, 4JНН 1.4 Гц], 7.86
1.20 д (3Н, СН3, 3JНН 6.3 Гц), 1.30-1.36 м (2Н,
д.д.д [1H, H6(Py), 3JНН 4.9, 4JНН 1.4, 5JНF 1.0 Гц].
AdCH2), 1.53 уш.с [6Н, СН2(Ad)], 1.58-1.69 м [6Н,
Спектр ЯМР 13С, δ, м.д.: 16.0 (CH3), 27.7 (Ad), 27.9
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
714
ЛЯХОВИЧ и др.
(Ad), 29.1 (Ad), 29.2 (Ad), 31.7 (Ad), 32.1 (Ad), 32.5
2-бром-5-(трифторметил)пиридином
(141 мг) в
(Ad), 38.2 (Ad), 39.1 (Ad), 39.3 (Ad), 44.8 (CH2N),
присутствии CuI (19 мг), 2-изобутирилциклогек-
47.4 (Ad),
111.2
[C5(Py)],
119.5 д [C4(Py), 2JCF
санона (34 мг). Выход 71%. Спектр ЯМР 1Н, δ,
15.2 Гц], 142.7 д [C6(Py), 4JCF 5.9 Гц], 147.4 д
м.д.: 0.95 уш.с (3Н, СН3), 1.34-2.05 м [16Н, Н(Ad),
[C3(Py), 1JCF 251.2 Гц], 149.1 д
[C2(Py), 2JCF
AdCH], 2.99 уш.с (1Н, CH2N), 3.41 уш.с (1Н, CH2N),
11.0 Гц]. Масс-спектр (MALDI-TOF), m/z: 289.215
5.20 уш.с (1Н, NH), 6.52 уш.с [1Н, H3(Py)], 7.58
[M + H]+. C18H26FN2. M + H 289.208.
уш.с [1Н, H4(Py)], 8.01 уш.с [1Н, H6(Py)]. Спектр
ЯМР 13С, δ, м.д.: 16.0 (СН3), 27.6, 27.8, 29.0, 29.3,
N-[2-(Адамантан-2-ил)пропил]-5-фторпи-
31.6, 32.1, 32.2, 38.1, 39.0, 39.2, 46.0, 47.2, 134.3
ридин-2-амин (34). Получен по общей методике
[C4(Py)], 145.7 [C6(Py)], 160.7 [C2(Py)], сигналы
б взаимодействием амина 5 (97 мг) с 2-бром-5-
С3(Py), С5(Py) и CF3 однозначно не отнесены из-
фторпиридином
(110 мг) в присутствии CuI
за уширения сигнала. Масс-спектр (MALDI-TOF),
(19 мг),
2-изобутирилциклогексанона
(34 мг).
m/z: 339.195 [M + H]+. C19H26F3N2. M + H 339.205.
Выход 65%. Спектр ЯМР 1Н, δ, м.д.: 0.94 уш.с (3Н,
СН3), 1.38 д [1Н, Н(Ad), 3JНН 9.4 Гц], 1.48-1.56
N-[2-(Адамантан-2-ил)пропил]-6-(трифтор-
м [2H, Н(Ad)], 1.71 уш.с [4H, Н(Ad)], 1.75-2.03
метил)пиридин-2-амин (37). Получен по общей
м [9Н, Н(Ad), AdCH], 2.95 уш.с (1Н, CH2N), 3.32
методике б взаимодействием амина 5 (97 мг) с
уш.с (1Н, CH2N), 4.65 уш.с (1Н, NH), 6.42 уш.с
2-бром-6-(трифторметил)пиридином
(141 мг) в
[1Н, Н3(Py)], 7.18 уш.с [1Н, Н4(Py)], 8.00 уш.с [1Н,
присутствии CuI (19 мг), 2-изобутирилциклогекса-
Н6(Py)]. Спектр ЯМР 13С, δ, м.д.: 15.6 (СН3), 27.3,
нона (34 мг). Выход 69%. Спектр ЯМР 1Н, δ, м.д.:
27.5, 28.7, 28.9, 31.3, 31.7, 31.8, 37.8, 38.7, 38.9,
0.94 д (3Н, СН3, 3JНН 6.5 Гц), 1.37 д [1Н, Н(Ad),
46.4, 46.9, 106.5 уш.с [C3(Py)], 124.6 уш.с [C4(Py)],
3JНН 10.5 Гц], 1.48-1.56 м [2H, Н(Ad)], 1.71 уш.с
133.8 уш.с [С6(Py)], 155.8 [C2(Py)], сигнал С5(Py)
[4H, Н(Ad)], 1.73-2.08 м [9Н, Н(Ad), AdCH], 2.93
однозначно не отнесен из-за уширения сигнала.
уш.с (1Н, CH2N), 3.46 уш.д (1Н, CH2N, 2JННнабл
Масс-спектр (MALDI-TOF), m/z: 289.221 [M + H]+.
11.7 Гц), 4.89 уш.с (1Н, NH), 6.50 д (1Н, H3(Py),
C18H26FN2. M + H 289.208.
3JНН 8.4 Гц], 6.86 д (1Н, H5(Py), 3JНН 7.2 Гц], 7.48
т [1Н, H4(Py), 3JННнабл 7.8 Гц]. Спектр ЯМР 13С,
N-[2-(Адамантан-2-ил)пропил]-4-(трифтор-
δ, м.д.: 15.9 (СН3), 27.6, 27.9, 29.0, 29.2, 31.6, 32.0,
метил)пиридин-2-амин (35). Получен по общей
32.1, 38.1, 39.0, 39.2, 46.0, 47.1, 108.4 [C3(Py)],
методике б взаимодействием амина 5 (97 мг) с
109.2 [C5(Py)], 121.7 к (CF3, 1JCF 273.7 Гц), 138.0
2-бром-4-(трифторметил)пиридином
(141 мг) в
[C4(Py)], 146.4 к
[C6(Py), 2JCF 33.5 Гц],
158.9
присутствии CuI (19 мг), 2-изобутирилциклогекса-
[C2(Py)]. Масс-спектр (MALDI-TOF), m/z: 339.216
нона (34 мг). Выход 75%. Спектр ЯМР 1Н, δ, м.д.:
[M + H]+. C19H26F3N2. M + H 339.205.
0.97 д (3Н, СН3, 3JНН 6.5 Гц), 1.39 д [1Н, Н(Ad),
3JНН 10.8 Гц], 1.49-1.57 м [2H, Н(Ad)], 1.72 уш.с
ВЫВОДЫ
[4H, Н(Ad)], 1.74-2.07 м [9Н, Н(Ad), AdCH], 2.96-
В ходе проведенного исследования показа-
3.04 м (1Н, CH2N), 3.42 д (1Н, CH2N, 2JНН 12.2 Гц),
но, что оптимальная каталитическая система
4.94 уш.с (1Н, NH), 6.54 уш.с [1Н, H3(Py)], 6.70
для гетероарилирования адамантансодержа-
уш.с [1Н, H5(Py)], 8.19 уш.с [1Н, H6(Py)]. Спектр
щих аминов замещенными 2-бромпиридинами -
ЯМР 13С, δ, м.д.: 16.0 (СН3), 27.6, 27.8, 29.0, 29.3,
Pd(dba)2-DavePhos, причем в случае отсутствия
31.6, 32.0, 32.1, 38.1, 39.0, 39.2, 46.1, 47.1, 101.9
пространственных препятствий в реагентах пред-
уш.с [C3(Py)], 107.6 уш.с [C5(Py)], 123.0 к (CF3,
почтительно использовать 1 мол % катализато-
1JCF 272.9 Гц), 139.5 к [C4(Py), 2JCF 32.9 Гц], 149.4
ра для минимизации процесса образования N,N-
[C6(Py)],
159.4
[C2(Py)]. Масс-спектр (MALDI-
дипиридинилпроизводных, а при увеличении
TOF), m/z: 339.187 [M + H]+. C19H26F3N2. M + H
стерических затруднений в реагентах следует
339.205.
увеличить количество катализатора до 2-4 мол %.
N-[2-(Адамантан-2-ил)пропил]-5-(трифтор-
Максимальные выходы по данному способу в
метил)пиридин-2-амин (36). Получен по общей
наиболее благоприятных ситуациях достига-
методике б взаимодействием амина 5 (97 мг) с
ют 90 и более процентов. В случае небольших
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
АРИЛИРОВАНИЕ АДАМАНТАНАМИНОВ: XI.
715
стерических препятствий конкурентоспособно
тин А.В., Тютюнов А.А., Бойко В.Э., Игумнов С.М.,
медь-катализируемое гетероарилирование при
Дильман А.Д., Адонин Н.Ю., Бардин В.В., Ма-
соуд С.М., Воробьева Д.В., Осипов С.Н., Носо-
использовании каталитической системы CuI-2-
ва Э.В., Липунова Г.Н., Чарушин В.Н., Прима Д.О.,
изобутирилциклогексанон, однако для достиже-
Макаров А.Г., Зибаревa А.В., Трофимов Б.А.,
ния хороших выходов требуется использование
Собенина Л.Н., Беляева К.В., Сосновских В.Я.,
20:40 мол %. При этом в лучших случаях выхо-
Обыденнов Д.Л., Усачев С.А. Усп. хим. 2019, 88,
ды могут превышать 80%, а реакции с участием
425-569. [Politanskaya L.V., Selivanova G.A., Pantelee-
пространственно незатрудненного амина 2 приве-
va E.V., Tretyakov E.V., Platonov, V.E., Nikul’-
ли к продуктам гетеороарилирования с выходами
shin, P.V., Vinogradov A.S., Zonov Ya.V., Karpov V.M.,
79-89%.
Mezhenkova T.V., Vasilyev A.V., Koldobskii A.B.,
Shilova O.S., Morozova S.M., Burgart Ya.V., Shche-
ФОНДОВАЯ ПОДДЕРЖКА
golkov E.V., Saloutin V.I., Sokolov V.B., Aksinen-
Работа выполнена при финансовой поддержке
ko A.Yu., Nenajdenko V.G., Moskalik M.Yu., Asta-
гранта РФФИ № 17-03-00888.
khova V.V., Shainyan B.A., Tabolin A.A., Ioffe S.L.,
Muzalevskiy V.M., Balenkova E.S., Shastin A.V.,
КОНФЛИКТ ИНТЕРЕСОВ
Tyutyunov A.A., Boiko V.E., Igumnov S.M., Dil’-
man A.D., Adonin N.Yu., Bardin V.V., Masoud S.M.,
Авторы заявляют об отсутствии конфликта ин-
Vorobyeva D.V., Osipov S.N., Nosova E.V., Lipuno-
тересов.
va G.N., Charushin V.N., Prima D.O., Makarov A.G.,
СПИСОК ЛИТЕРАТУРЫ
Zibarev A.V., Trofimov B.A., Sobenina L.N., Belyae-
va K.V., Sosnovskikh V.Ya., Obydennov D.L., Usa-
1.
Ляхович М.С., Мурашкина А.В., Аверин А.Д.,
chev S.A. Russ. Chem. Rev. 2019, 88, 425-569] doi
Абель А.С., Малошицкая О.А., Савельев Е.Н.,
10.1070/RCR4871
Орлинсон Б.С., Белецкая И.П. ЖОрХ. 2019, 55,
829-840. [Lyakhovich M.S., Murashkina A.V., Ave-
8.
Hutchinson J. H., Rowbottom M.W., Lonergan D.,
rin A.D., Abel A.S., Maloshitskaya O.A., Save-
Darlington J., Prodanovich P., King C.D., Evans J.F.,
lyev E.N., Orlinson B.S., Beletskaya I.P. Russ.
Bain G. ACS Med. Chem. Lett. 2017, 8, 423-427. doi
J. Org. Chem. 2019, 55, 737-747.] doi 10.1134/
10.1021/acsmedchemlett.7b00014
S1070428019060010
9.
Evecen M., Kara M., Idil O., Tanak H. J. Mol.
2.
Gillis E.P., Eastman K.J., Hill M.D., Donnelly J.D.,
Struct.
2017,
1137,
206-215. doi
10.1016/
Meanwell N.A. J. Med. Chem. 2015, 58, 8315-8359.
j.molstruc.2017.02.060
doi 10.1021/acs.jmedchem.5b00258
10.
Kivitz A.J., Gutierrez-Ureña S.R., Poiley J., Genove-
3.
Swallow S. Prog. Med. Chem. 2015, 54, 65-133. doi
se M.C., Kristy R., Shay K., Wang X., Garg J.P.,
10.1016/bs.pmch.2014.11.001
Zubrzycka-Sienkiewicz A. Arthritis Rheumatol. 2017,
69, 709-719. doi 10.1002/art.39955
4.
Knight D. Curr. Opin. Investig. Drugs. 2004, 5, 557-
562.
11.
Leovac V.M., Rodić M.V., Jovanović L.S., Jokso-
vić M.D., Stanojković T., Vujčić M., Sladić D., Mar-
5.
Kang S., Min H.-J., Kang M.-S., Jung M.-G., Kim S.
ković V., Vojinović-Ješić L.S. Eur. J. Inorg. Chem.
Bioorg. Med. Chem. Lett. 2013, 23, 1748-1751. doi
2015, 2015, 882-895. doi 10.1002/ejic.201403050
10.1016/j.bmcl.2013.01.055
12.
Liu S., Qian P., Wan F.-X., Shi Y.-H., Jiang L.
6.
Nenajdenko V.G., Muzalevskiy V.M., Shastin A.V.
J. Chin. Chem. Soc. 2019, 66, 330-334. doi 10.1002/
Chem. Rev.
2015,
115,
973-1050. doi
10.1021/
jccs.201800259
cr500465n
13.
Ryu J.H., Kim S., Han H.Y., Son H.J., Lee H.J.,
7.
Политанская Л.В., Селиванова Г.А., Пантелее-
Shin Y.A., Kim J.-S., Park H.-g. Bioorg. Med.
ва Е.В., Третьяковa Е.В., Платоновa, П.В. Никуль-
Chem. Lett.
2015,
25,
695-700. doi
10.1016/
шинa, А.С. Виноградовa Я.В. Зоновa В.М. Карпо-
j.bmcl.2014.11.074
вa Т.В. Меженкова В.Е., Васильев А.В., Колдобс-
кий А.Б., Шилова О.С., Морозова С.М., Бургарт Я.В.,
14.
Rohde J.J., Pliushchev M.A., Sorensen B.K., Wodka D.,
Щегольков Е.В., Салоутин В.И., Соколов В.Б., Ак-
Shuai Q., Wang J., Fung S., Monzon K.M., Chiou W.J.,
синенко А.Ю., Ненайденко В.Г., Москалик М.Ю.,
Pan L., Deng X., Chovan L.E., Ramaiya A., Mullal-
Астахова В.В., Шаинян Б.А., Таболин А.А., Иоф-
ly M., Henry R.F., Stolarik D.F., Imade H.M.,
фе С.Л., Музалевский В.М., Баленкова Е.С., Шас-
Marsh K.C., Beno D.W.A., Fey T.A., Droz B.A.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
716
ЛЯХОВИЧ и др.
Brune M.E., Camp H.S., Sham H.L., Frevert E.U.,
24.
Lyakhovich M.S., Averin A.D., Grigorova O.K., Roz-
Jacobson P.B., Link J.T. J. Med. Chem. 2007, 50, 149-
nyatovsky V.A., Maloshitskaya O.A., Beletskaya I.P.
164. doi 10.1021/jm0609364
Molecules.
2020,
25,
1084-1103. doi
10.3390/
15.
Sorensen B., Rohde J., Wang J., Fung S., Monzon K.,
molecules25051084
Chiou W., Pan L., Deng X., Stolarik D., Frevert E.U.,
25.
Averin A.D., Ranyuk E.R., Golub S.L., Buryak A.K.,
Jacobson P., Link J.T. Bioorg. Med. Chem. Lett. 2006,
Savelyev E.N., Orlinson B.S., Novakov I.A., Belets-
16, 5958-5962. doi 10.1016/j.bmcl.2006.08.129
kaya I.P. Synthesis.
2007,
2007,
2215-2221. doi
16.
Collins K.C., Janda K.D. Bioconjugate Chem. 2014,
10.1055/s-2007-983760
25, 593-600. doi 10.1021/bc500016k
26.
Новиков С.С., Хардин А.П., Радченко С.С., Нова-
17.
Sambiagio C., Marsden S.P., Blacker A.J., McGo-
ков И.А., Орлинсон Б.С., Блинов В.Ф., Горе-
wan P.C. Chem. Soc. Rev. 2014, 43, 3525-3550. doi
лов В.И., Замах В.П. Пат. СССР 682507 (1978). C.A.
10.1039/C3CS60289C
1979, 91, P193887e.
18.
Okano K., Tokuyama H., Fukuyama T. Chem. Commun.
27.
Новаков И.А., Радченко С.С., Бирзниекс К.А., Бо-
2014, 50, 13650-13663. doi 10.1039/C4CC03895A
реко Е.И., Владыко Г.В., Коробченко Л.В. Хим.-
19.
Junge K., Wienhöfer G., Beller M., Tlili A., Evano G.,
фарм. ж. 1987, 21, 454-458. [Novakov I.A., Ku-
Taillefer M., Kempe R., Malbertz C., Klankermayer J.
lev I.A., Radchenko S.S., Birznieks K.A., Boreko E.I.,
Applied Homogeneous Catalysis with Organometallic
Vladyko G.V., Korobchenko L.V. Pharm. Chem. J.
Compounds: A Comprehensive Handbook in Three
1987, 21, 287-291.] doi 10.1007/BF00767400
Volumes. 3rd Edn. Eds. B. Cornils, W.A. Herrmann,
28.
Попов Ю.В., Мохов В.М., Танкабекян Н.А. ЖПХ.
M. Beller, R. Paciello. Hoboken: John Wiley & Sons
2013, 86, 435-440.
Inc. 2017, 691-808. doi 10.1002/9783527651733.ch10
29.
Новаков И.А., Орлинсон Б.С., Савельев Е.Н., По-
20.
Shaughnessy K.H., Ciganek E., De Vasher R.B.,
таенкова Е.А., Шилин А.К. Пат. RU 2495020 C1
Denmark S.E. Copper-Catalyzed Amination of Aryl
(2013). РФ.
and Alkenyl Electrophiles. Hoboken: John Wiley &
Sons Inc. 2017.
30.
Ukai T., Kawazura H., Ishii Y., Bonnet J.J., Ibers J.A.
21.
Neetha M., Saranya S., Ann Harry N., Anilkumar G.
J. Organomet. Chem. 1974, 65, 253-266. doi 10.1016/
ChemistrySelect.
2020,
5,
736-753. doi
10.1002/
S0022-328X(00)91277-4
slct.201904436
31.
Абель А.С., Аверин А.Д., Анохин М.В., Мало-
22.
Abel A.S., Averin A.D., Buryak A.K., Savelyev E.N.,
шицкая О.А., Бутов Г.М., Савельев Е.Н., Орлин-
Orlinson B.S., Novakov I.A., Beletskaya I.P. Synthesis.
сон Б.С., Новаков И.А., Белецкая И.П. ЖОрХ.
2017, 49, 5067-5080. doi 10.1055/s-0036-1590860
2015, 51, 319-326. [Abel A.S., Averin A.D., Ano-
23.
Abel A.S., Kotovshchikov Y.N., Averin A.D.,
khin M.V., Maloshitskaya O.A., Butov G.M., Save-
Maloshitskaya O.A., Savelyev E.N., Orlinson B.S.,
lyev E.N., Orlinson B.S., Novakov I.A., Beletskaya I.P.
Novakov I.A., Beletskaya I.P. Heterocycles. 2019, 99,
Russ. J. Org. Chem. 2015, 51, 301-308.] doi 10.1134/
1342-1354. doi 10.3987/COM-18-S(F)64
S1070428015030021
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
АРИЛИРОВАНИЕ АДАМАНТАНАМИНОВ: XI.
717
Arylation of Adamantaneamines: XI.
Comparison of the Efficiency of the Catalysis by Palladium
and Copper Complexes in the Reactions of Adamantaneamines
with Fluorine-containing Derivatives of 2-Bromopyridine
M. S. Lyakhovicha, A. V. Murashkinaa, S. P. Panchenkoa, A. D. Averina, b, *, A. S. Abela,
O. A. Maloshitskayaa, E. N. Savelyevc, B. S. Orlinsonc, I. A. Novakovc, and I. P. Beletskayaa, b
a Department of Chemistry, M.V. Lomonosov Moscow State University, Leninskie gory, 1/3, Moscow 119991 Russia
*e-mail: alexaveron@yandex.ru
b A.N. Frumkin Institute of Physical Chemistry and Electrochemistry RAS,
Leninskii prosp., 31/4, Moscow, 119991 Russia
c Volgograd State Technical University, prosp. Lenina, 28, Volgograd, 400005 Russia
Received April 15, 2021; revised April 17, 2021; accepted April 17, 2021
Using previously optimized catalytic systems the comparison of the efficiency of the catalysis by Pd(0) and Cu(I)
in the reactions of adamantaneamines with fluoro- and trifluoromethyl-substituted 2-bromopyridines was carried
out. The reactions revealed that in the case of the absence of the steric hindrances in the starting compounds the
results of the copper-catalyzed reactions are comparable with that of the palladium-catalyzed processes. In some
cases the yields of the target N-heteroarylated compounds in copper-catalyzed reactions were found to be even
higher what can be explained by the formation of side N,N-diheteroarylated products under palladium-catalyzed
conditions. Alternatively, I the case of 2-bromopyridines with ortho-substituents like fluorine or trifluoromethyl
group only palladium catalyzed reactions are efficient.
Keywords: adamantane, amines, pyridine, amination, homogeneous catalysis, palladium and copper complexes
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021