ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 5, с. 718-727
УДК 547.239
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ
МОЧЕВИН И ИХ ИЗОСТЕРИЧЕСКИХ АНАЛОГОВ,
СОДЕРЖАЩИХ ПОЛИЦИКЛИЧЕСКИЕ ФРАГМЕНТЫ:
X.1 1-[1-(4-ИЗОБУТИЛФЕНИЛ)ЭТИЛ]-3-R МОЧЕВИНЫ
© 2021 г. Б. П. Гладкихa, В. С. Дьяченкоa, В. В. Бурмистровa, Г. М. Бутовb, *
a ФГБОУ ВО «Волгоградский государственный технический университет» ВолгГТУ,
Россия, 400005 Волгоград, просп. Ленина, 28
b ФГБОУ ВО «Волжский политехнический институт» (филиал) ВолгГТУ,
Россия, 404121 Волжский, ул. Энгельса, 42а
*e-mail: butov@volpi.ru
Поступила в редакцию 12.02. 2021 г.
После доработки 27.02.2021 г.
Принята к публикации 28.02.2021 г.
Реакцией 1-изобутил-4-(1-изоцианатоэтил)бензола с различными аминами, а также, 1-(4-изобутилфе-
нил)этанамина с галогенсодержащими ароматическими изоцианатами синтезирована серия мочевин,
содержащих в своей структуре ибупрофеновый фрагмент. Выходы целевых продуктов составили до 95%.
Синтезированные мочевины являются потенциальными мультитаргетными ингибиторами растворимой
эпоксидгидролазы (sEH) и циклооксигеназы (COX).
Ключевые слова: ибупрофен, мочевина, галогенсодержащие фенилизоцианаты, растворимая эпокси-
дгидролаза, циклооксигеназа
DOI: 10.31857/S0514749221050049
ВВЕДЕНИЕ
наилучшую ингибирующую активность в отноше-
нии sEH, представляют собой молекулы, в струк-
В последние годы перспективной мишенью
туре которых содержится уреидный фрагмент.
для лечения невропатической боли у человека и
млекопитающих служит растворимая эпоксидги-
Эйкозанойды наиболее изучены на животных,
дролаза (sEH, К.Ф. 3.3.2.10) [2, 3]. sEH участвует
где они демонстрируют способность снижать ар-
в метаболизме эпоксиэйкозатриеновых кислот до
териальное давление, возможно, за счет стимуля-
соответствующих вицинальных диолов в резуль-
ции артериальной вазорелаксации и ингибирова-
тате реакции с молекулой воды [4]. Эти эйкоза-
ния задержки солей и воды почками, для уменьше-
ноиды, как правило, недолговечны, они быстро
ния внутрисосудистого объема крови. В этих мо-
превращаются из эпоксидов в менее активные или
делях эйкозанойды предотвращают артериальные
окклюзионные заболевания, такие, как сердечные
неактивные дигидроксиэйкозатриеновые кислоты.
приступы и мозговые инсульты, не только за счет
Следовательно, они действуют как гормоны корот-
своего антигипертензивного действия, но, возмож-
кого действия, то есть работают локально, чтобы
но, также, за счет их противовоспалительного воз-
регулировать функцию клеток, которые их произ-
действия на кровеносные сосуды, ингибирование
водят (аутокринные агенты) или соседних клеток
активации тромбоцитов и, следовательно, сверты-
(паракринные агенты). Соединения, проявляющие
вания крови, и содействия профибринолитическо-
1 Сообщение IX см. [1].
му удалению сгустков крови [5-8].
718
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : X.
719
Однако не все эйкозанойды - хорошие суб-
и токсикологическими свойствами. Повышается и
страты для sEH. Например, 5,6-EET (5,6-эпокси-
технологичность синтеза, так как полупродукты
эйкозатриеновая кислота) в клетках быстрее
уже получаются в промышленных масштабах.
метаболизируется циклооксигеназой-2 с обра-
В этой связи, нами был осуществлен синтез
зованием
5,6-эпоксипростагландина F1a
[9].
мочевин, содержащих в своей структуре фрагмент
Циклооксигеназа (COX) - фермент участвующий в
молекулы ибупрофена, а также парацетамола, це-
превращении арахидоновой кислоты в простаглан-
лекоксиба, амантадин и римантадина. Вполне ве-
дин H2, важный предшественник простациклина,
роятно, что синтезированные соединения могут
главным образом образующийся при воспалении
служить мультитаргетными препаратами, то есть
[10]. Одним из наиболее известных ингибиторов
проявлять ингибирующую активность не только в
циклооксигеназ выступает 2-(4-изобутилфенил)-
отношении растворимой эпоксидгидролазы sEH,
пропионовая кислота 1 (ибупрофен).
но и влиять на синтез простагландинов, путем по-
Ибупрофен
- нестероидный противоспали-
давления двух изоформ фермента циклооксигена-
тельный препарат (НПВП), использующийся для
зы. Мультитаргетность - актуальное направление
лечения боли, лихорадки и воспаления. Действие
современной медицинской химии, привлекающее
ибупрофена в основном проявляется в ингиби-
внимание все большего числа ученых [18].
ровании COX, что приводит к снижению синтеза
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
простагландинов, участвующих в опосредовании
воспаления [11]. Также, ибупрофен используется
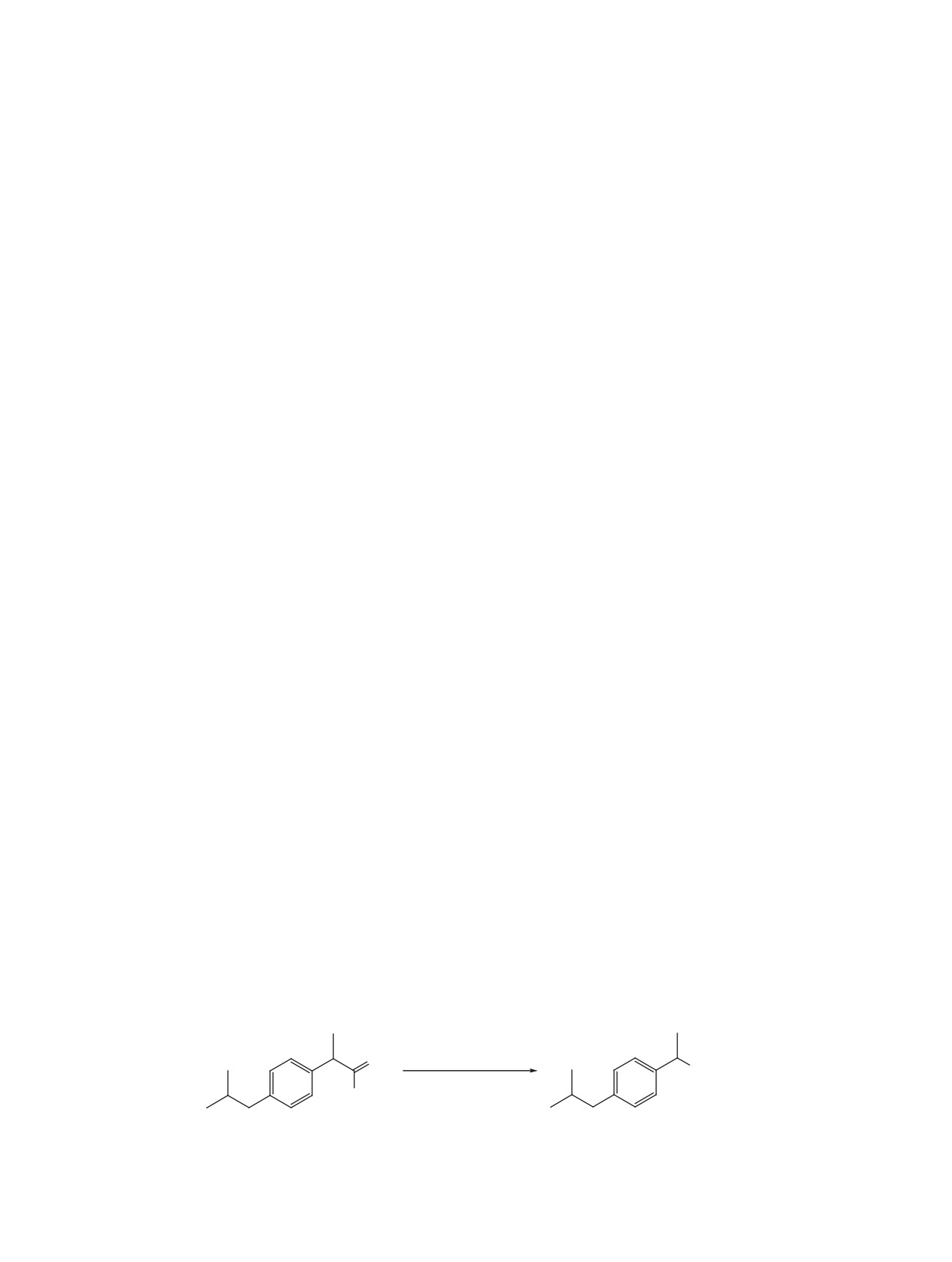
Хотя синтез из ибупрофена 1 соответствующе-
при таких воспалительных заболеваниях как, юве-
го изоцианата уже был описан ранее [17], в указан-
нильный идиопатический артрит и ревматоидный
ной работе, образующийся 1-изобутил-4-(1-изоци-
артрит [12, 13] и перикардит [14, 15]. Ибупрофен
анатоэтил)бензол 2 использовали для дальнейших
представляет собой рацемическую смесь (R,S)-
превращений без выделения и изучения физи-
энантиомеров. R-энантиомер подвергается пре-
ко-химических свойств и спектров. Нами изоциа-
вращению в S-энантиомер in vivo. Считается, что
нат 2 был впервые выделен в чистом виде и оха-
S-энантиомер - более фармакологически активен
рактеризован методами ЯМР-спектроскопии 1H
[16].
и 13С и хромато-масс спектрометрии. Кроме того
Известна работа [17], авторы которой предла-
при синтезе осуществлена замена растворителя с
гают синтез ингибиторов 5-липоксигеназы, пу-
бензола на менее токсичный и не канцерогенный
тем модификации уже известных лекарственных
толуол. Синтез изоцианата 2 был проведен по од-
препаратов, таких как напроксен, ибупрофен и
ностадийному методу из ибупрофена 1 и дифенил-
индометацин. Все соединения относятся к классу
фосфорил азида (ДФФА), как источника азидной
НПВП.
группы (схема 1). Продукт очищали экстракцией
безводным диэтиловым эфиром. Выход составил
Синтез биологически активных соединений
88%. В спектрах ЯМР 13C химический сдвиг угле-
на основе известных лекарственных препаратов,
рода изоцианатной группы составляет 120.34 м.д.
где они используются как полупродукты, - пер-
спективное направление в медицинской химии.
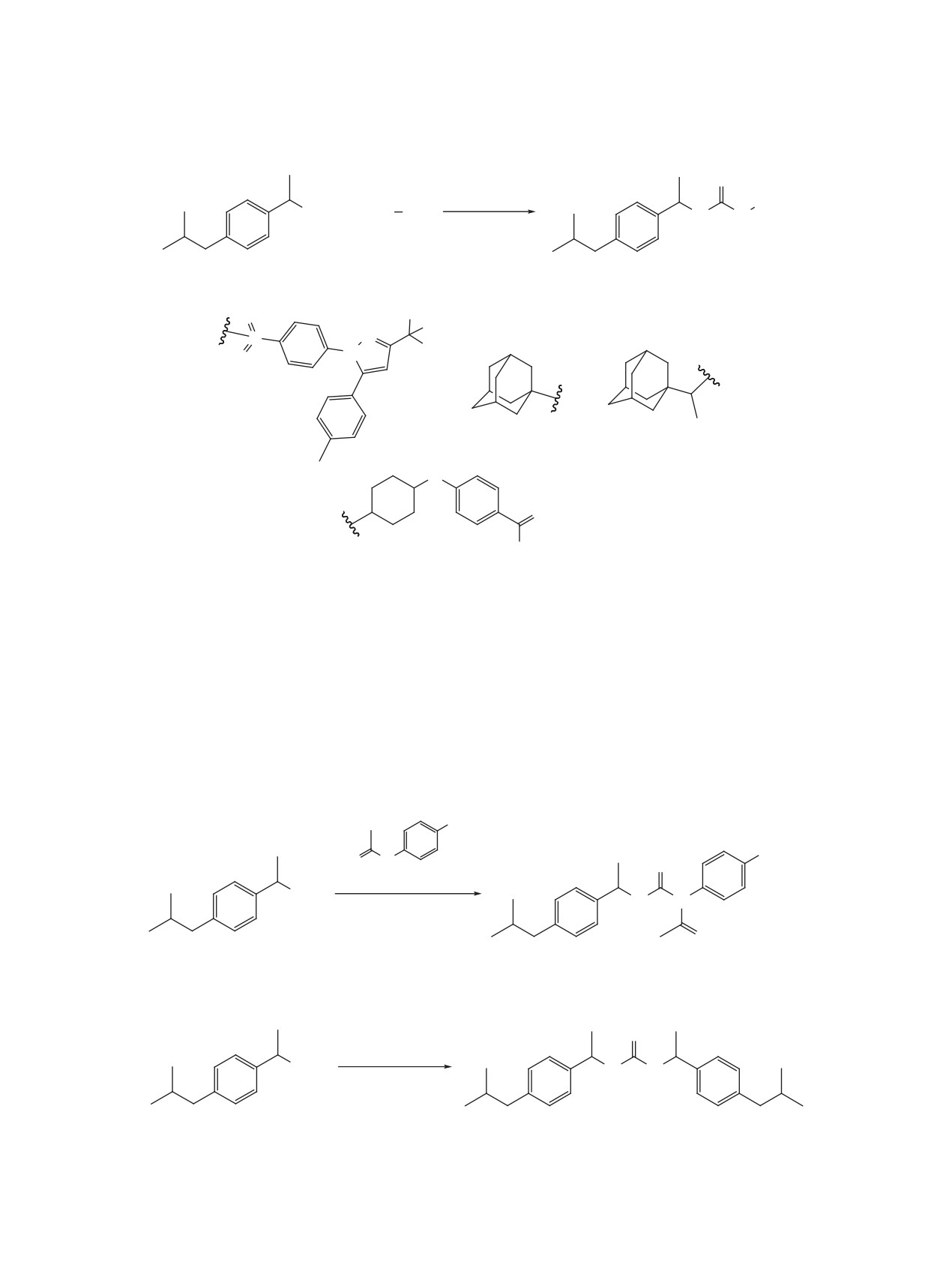
Изоцианат 2 далее использовали для синте-
Создание таких молекул позволяет также предпо-
за 1,3-дизамещенных мочевин 4a-d с участи-
ложить, что при их метаболизме могут получаться
ем
4-[5-(4-метилфенил)-3-(трифторметил)пира-
соединения с проверенными фармакологическими
зол-1-ил]бензолсульфонамида
3а (целекоксиб),
Схема 1
ДФФА, Et3N, толуол
O
110°C, 2 ч
NCO
OH
1
2
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
720
ГЛАДКИХ и др.
Схема 2
ДМФА, Et3N
O
25°C, 12 ч
R
NCO
+
R
NH2
N
N
H
H
2
3a-d
4a-d
F
O
F
S
N
F
N
HCl
O
R=
(3a),
(3b),
(3c),
O
O
(3d).
OH
1-аминоадамантаном 3b (амантадин), гидрохло-
Из изоцианата 2 была получена симметричная
ридом 1-(адамантан-1-ил)этан-1-амина 3c (риман-
мочевина 4f взаимодействием с диазобицикло-
тадин, схема 2), а также с N-(4-гидроксифенил)-
ундеценом (DBU) при комнатной температуре в
ацетамидом 3е (парацетамол, схема 3), - извест-
течение 12 ч с выходом 92% (схема 4).
ными лекарственными препаратами. Кроме того,
Изоцианат 2 был использован для получения
применяли транс-4-амино-(циклогексилокси)бен-
соответствующего
1-(4-изобутилфенил)этан-1-
зойную кислоту 3d, мочевины на основе которой
амина гидрохлорида 5 (схема 5). Синтез проводили
проявляют высокую ингибирующую активность в
путем перемешивания изоцианата 2 в смеси толуо-
отношении sEH [19].
ла и концентрированной HCl (20:1) при комнатной
Схема 3
OH
OH
O
N
O
H
3e
NCO
N N
ДМФА, Et3N
H
25°C, 12 ч
O
2
4e
Схема 4
DBU, ТГФ, H2O
O
25°C, 12 ч
NCO
N
N
H
H
2
4f
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : X.
721
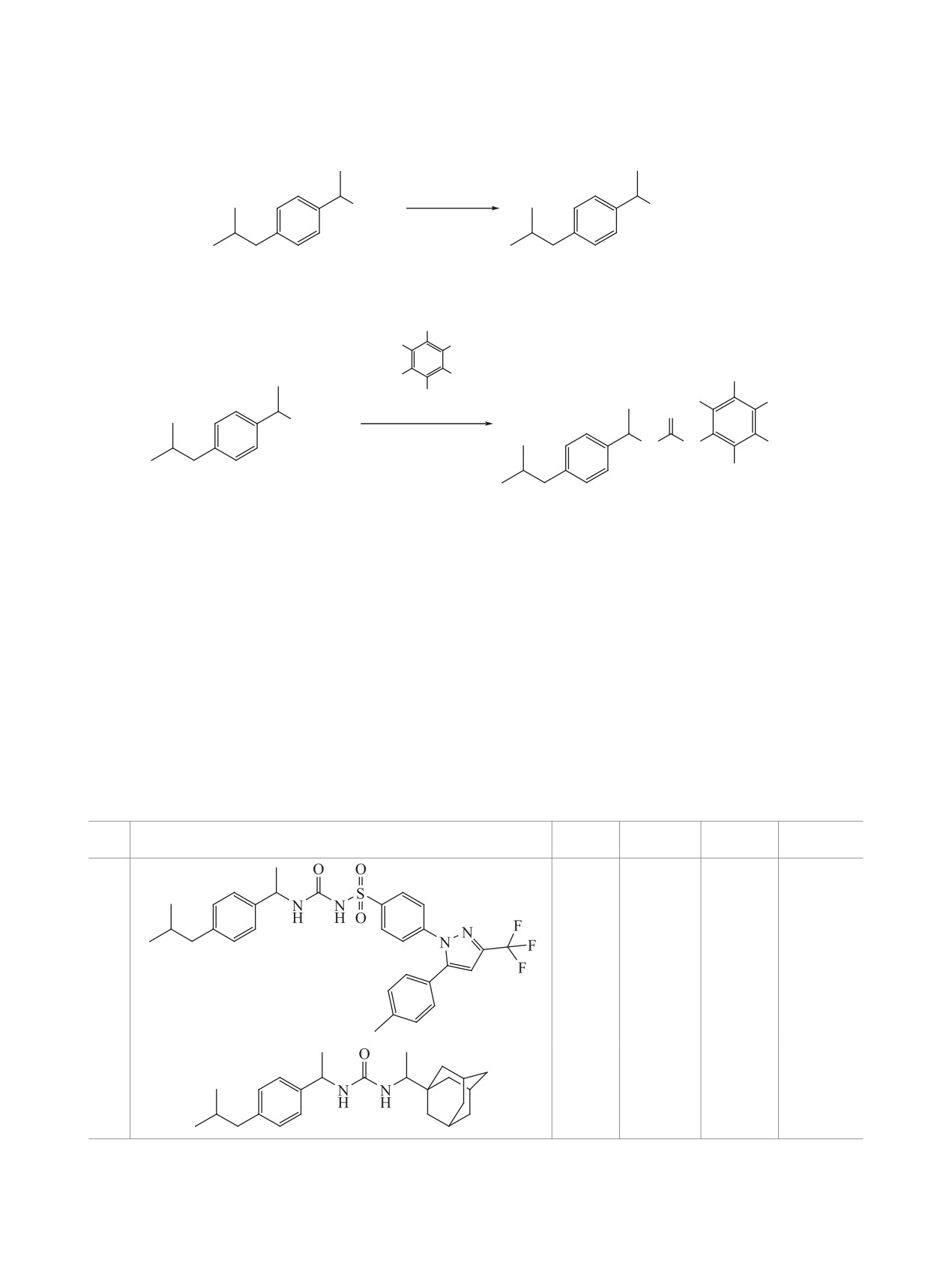
Схема 5
HCl, толуол
25°C, 18 ч
NCO
NH2∙HCl
2
5
Схема 6
R2
R1
R3
OC N
R4
R2
R5
R1
R3
6a-d
O
NH2∙HCl
ДМФА, Et3N
N
N
R4
25°C, 12 ч
H
H
R5
5
7a-d
R1 = R3 = R4 = R5 = H, R2 = F (7a); R1 = R2 = R3 = R5 = H, R4 = F (7b); R1 = R3 = R4 = R5 = H, R2 = Cl (7с);
R1 = R2 = R4 = R5 = H, R3 = Cl (7d).
температуре в течение 18 ч. Выход составил 98%,
ре. Выходы составили 39-92%. Структуру полу-
свойства амина 5 совпадают с литературными дан-
ченных соединений подтверждали методом ЯМР-
ными [17].
спектроскопии 1H, 13C, а также масс-спектроме-
трией. Свойства синтезированных 1,3-дизамещен-
Из амина 5 были синтезированы 1,3-дизаме-
ных мочевин 4a-g и 7a-d представлены в таблице.
щенные мочевины 7a-d по реакции с галогенза-
мещенными ароматическими изоцианатами 6a-d
В спектрах ЯМР 1H соединений 4a-f и 7a-d
(схема 6).
присутствует характерный сигнал в области 5.72-
Синтез осуществляли в среде безводного
7.43 м.д. соответствующий протону NH мочевин-
ДМФА в течение 12 ч при комнатной температу-
ной группы связанной с фрагментом молекулы
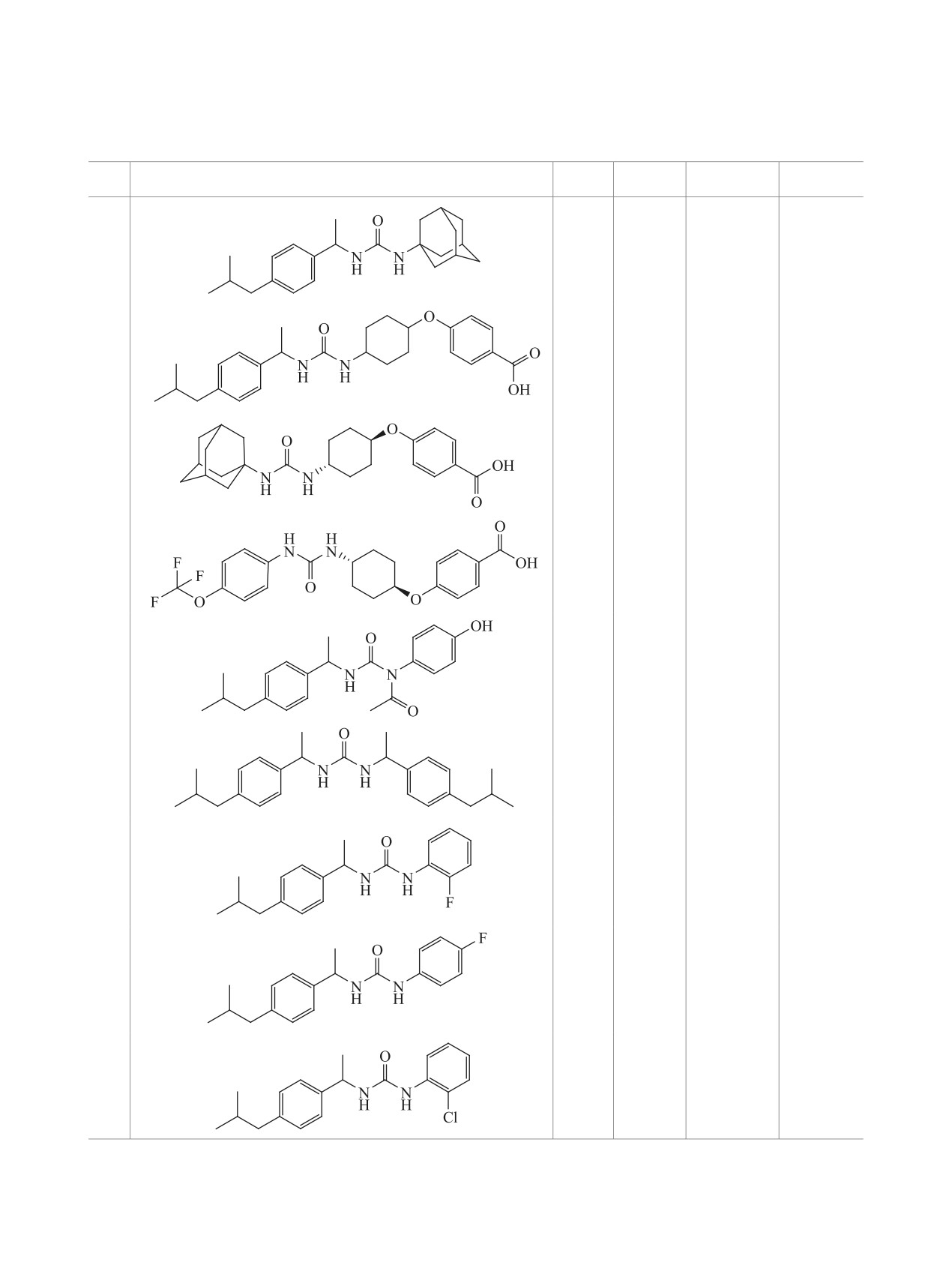
Коэффициенты липофильности, температуры плавления и выходы синтезированных соединений 4a-g и 7a-d
№
Структура
Mr
log Pa
tпл, °C
Выход, %
4a
584
6.89
65-67
39
4b
382
6.27
207-209
42
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
722
ГЛАДКИХ и др.
Таблица. (продолжение).
№
Структура
Mr
log Pa
tпл, °C
Выход, %
4c
354
5.93
200-201
83
4d
438
5.52
192-193
69
412
5.18
250-255 [19]
-
438
4.92
244-273 [19]
-
4e
354
3.83
165-167
83
4f
380
6.27
85-87
92
7a
314
4.82
100-102
53
7b
314
4.87
130-132
81
7c
330
5.33
119-121
47
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : X.
723
Таблица. (продолжение).
№
Структура
Mr
log Pa
tпл, °C
Выход, %
7d
330
5.36
120-121
75
ибупрофена. В спектрах соединений 7a-d присут-
мантан-1-ил)этан-1-амин гидрохлорид (99%, CAS
ствует также характерный сигнал в области 7.99-
1501-84-4), 2-(4-изобутилфенил)пропионовая кис-
8.69 м.д. соответствующий протону NH мочевин-
лота 1 (ибупрофен, 99%, CAS 15687-27-1), с N-(4-
ной группы связанной с ароматическим кольцом.
гидроксифенил)-ацетамид 3e (парацетамол, 98%,
В соединениях 4b-c сигнал в области 5.50 м.д.,
CAS
103-90-2) производства фирмы
«Sigma-
соответствует протону NH мочевинной группы,
Aldrich»;
4-фторфенилизоцианат
(98+%, CAS
связанной с молекулой адамантана.
1195-45-5),
2-хлорфенилизоцианат
(98%, CAS
3320-83-0) производства фирмы Alfa Aesar исполь-
Рассчитанный коэффициент липофильности
зовали без очистки.
log P для соединений 4a-f и 7a-d находится в пре-
делах 3.83-6.89. Коэффициент липофильности мо-
транс-4-Амино-(циклогексилокси)бензойная
чевины 4d на 0.34 единиц выше чем у аналогичной
кислота получена по известной методике [19].
мочевины, содержащей вместо фрагмента молеку-
4-[5-(4-Метилфенил)-3-(трифторметил)пиразол-
лы ибупрофена, - адамантан и на 0.6 выше чем
1-ил]-бензолсульфонамид
3a (целекоксиб, CAS
у аналогичной мочевины, полученной из 4-(три-
169590-42-5) был выделен из соответствую-
фторметокси)фенилизоцианата.
щего аптечного препарата в соответствии с Го-
сударственной Фармакопей Российской Феде-
Температуры плавления мочевин 7a-d находят-
рации (ГФ РФ) XIV издания. Свойства соединения
ся в пределах 100-132°C. При наличии в кольце
3a соответствовали литературным данным [21].
атомов хлора температура плавления практически
не зависит от его положения, а от положения атома
Строение полученных соединений подтвер-
фтора возрастает в ряду орто- < мета- < пара-.
ждали с помощью ЯМР 1Н, 13C и 19F спектроско-
Температура плавления мочевин 7a-b на 94-97°C
пии, хромато-масс-спектрометрии и элементного
ниже, чем у аналогичных соединений, но полу-
анализа. Масс-спектры регистрировали на хро-
ченных на основе 1-аминоадамантана и на ~90°C
мато-масс-спектрометре «Agilent GC 5975/MSD
ниже чем у аналогичных мочевин полученных из
7820» (Agilent Technologies, США) и «Advion
1-аминометиладамантана [20].
expression» (Аdvion Inc., США) в режиме full scan
(ESI). ЯМР 1Н, 13C и 19F выполнены на Bruker
Температура плавления мочевины 4d на 62°C
Avance 600 (Bruker Corporation, США) в раство-
ниже, чем у аналогичной мочевины, полученной
рителе DMSO-d6; химические сдвиги 1H приведе-
на основе незамещенного 1-изоцианатоадаманта-
ны относительно SiMe4. Элементный анализ вы-
на и почти на 80°C ниже, чем у аналогичной моче-
полнен на приборе «Perkin-Elmer Series II 2400»
вины, полученной на основе 4-(трифторметокси)-
(Perkin-Elmer, США). Температуры плавления
фенилизоцианата [19].
определены на приборе OptiMelt MPA100 (Stanford
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Research Systems, США).
Исходные триэтиламин (BioUltra ≥99.5%, CAS
1-Изобутил-4-(1-изоцианатоэтил)бензол
(2).
121-44-8), ДМФА (Anhydrous 99.8%, CAS 68-12-
К смеси 3.0 г (14.0 ммоль) 2-(4-изобутилфенил)-
2), 3-хлорфенилизоцианат (99%, CAS 2909-38-8),
пропионовой кислоты (1) и 1.47 г (14.0 ммоль)
1-аминоадамантан (97%, CAS 768-94-5), 1-(ада-
триэтиламина в 30 мл безводного толуола прика-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
724
ГЛАДКИХ и др.
пывали в течение 10 мин 4.2 г (14.0 ммоль) дифе-
ния 2 и 0.17 г (0.95 ммоль) 1-(адамантан-1-ил)-
нилфосфорилазида при комнатной температуре.
этан-1-амина (3b). Выход 0.155 г (42%), т.пл.
Затем реакционную смесь нагревали до кипения
207-209°C. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.87
и выдерживали 30 минут до полного прекращения
д (6H, CH3CHCH3, J 6.6 Гц), 0.91 д (3H, CH3, J
выделения азота. Толуол упаривали, продукт из ре-
6.9 Гц), 1.31 д (3H, CH3CHN, J 7.0 Гц), 1.39-1.52
акционной массы извлекали безводным диэтило-
м (6H, Ad), 1.55-1.70 м (6H, Ad), 1.80-1.86 м (1H,
вым эфиром. Выход 2.65 г (88%). Спектр ЯМР 1Н
CH3CHCH3), 1.93 уш.с (3H, Ad), 2.43 д (2H, CH2,
(CDCl3), δ, м.д.: 0.94 д (6H, CH3CHCH3, J 6.6 Гц),
J 7.1 Гц), 3.28 т (1H, CH-Ad, J 7.9 Гц), 4.71 т
1.62 д (3H, CH3CHN, J 6.7 Гц), 1.84-1.94 м (1H,
(1H, CH3CHN, J 7.4 Гц), 5.50 д (1H, NHCH-Ad, J
CH3CHCH3), 2.50 д (2H, CH2, J 7.2 Гц), 4.75 к
9.4 Гц), 6.06 д (1H, NHCH-Ph, J 8.1 Гц), 7.07-7.12
(1H, CH3CHN, J 6.7 Гц), 7.17 д (2H, 2,6-C аром., J
м (2Hаром), 7.17-7.22 м (2Hаром). Найдено, %: С
6.6 Гц), 7.26 д (2H, 3,5-C аром., J 6.7 Гц). Спектр
78.45; Н 10.04; N 7.35. C25H38N2О. Вычислено, %:
ЯМР 13C (DMSO-d6), δ, м.д.: 22.33 (2C, CH3CHCH3),
С 78.48; Н 10.01; N 7.32. М 382.59.
25.93 (CH3CHN), 30.16 (CH3CHCH3), 45.01 (CH2),
1-(Адамантан-1-ил)-3-[1-(4-изобутилфенил)-
54.41 (CH3CHN), 120.34 (NCO), 125.08 (2C, 2,6-C
этил]мочевина (4c). Получена аналогично со-
Ph), 129.44 (2C, 3,5-C Ph), 139.78 (4-С Ph), 141.35
единению 4a из 0.2 г (0.98 ммоль) соединения 2
(1-С Ph). Масс-спектр, m/z (Iотн, %): 203 (50.0)
и 0.15 г (0.99 ммоль) адамантан-1-амина (3c).
[М]+, 188 (100) [M - CH3]+, 160 (85.0) [M - i-Pr]+,
Выход 0.29 г (83%), т.пл. 200-201°C. Спектр ЯМР
146 (100) [M - i-Bu]+, 132 (15.0) [M - Et-NCO]+.
1Н (CDCl3), δ, м.д.: 0.87 д (6H, CH3CHCH3, J
Найдено, %: С 76.78; Н 8.40; N 6.93. C13H17NО.
6.6 Гц), 1.31 д (3H, CH3CHN, J 7.0 Гц), 1.39-1.52
Вычислено, %: С 76.81; Н 8.43; N 6.89. М 203.29.
м (6H, Ad), 1.55-1.70 м (6H, Ad), 1.80-1.86 м (1H,
N-{[1-(4-Изобутилфенил)этил]карбамоил}-
CH3CHCH3), 1.93 уш.с (3H, Ad), 2.43 д (2H, CH2,
J 7.1 Гц), 4.71 т (1H, CH3CHN, J 7.4 Гц), 5.50 д
4-[5-(п-толил)-3-(трифторметил)-1H-пиразол-
(1H, NH-Ad, J 9.4 Гц), 6.06 д (1H, NHCH-Ph, J
1-ил]бензолсульфонамид (4a). К 0.2 г (0.52 ммоль)
8.1 Гц), 7.07-7.12 м (2Hаром), 7.17-7.22 м (2Hаром).
4-[5-(4-метилфенил)-3-(трифторметил)пиразол-
Найдено, %: С 77.89; Н 9.70; N 7.88. C23H34N2О.
1-ил]бензолсульфон-амида (3a) в 5 мл диметил-
Вычислено, %: С 77.92; Н 9.67; N 7.90. М 354.54.
формамида прибавляли 0.1 г (0.52 ммоль) 1-изо-
бутил-4-(1-изоцианатоэтил)бензола (2) и 0.2 мл
транс-4-[(4-{3-[1-(4-Изобутилфенил)этил]-
триэтиламина. Реакционную смесь выдерживали
уреидо}циклогексил)окси]бензойная кислота
при комнатной температуре в течение 12 ч. После
(4d). Получена аналогично соединению
4a
добавления 5 мл 1н HCl, смесь перемешивали в
из 0.2 г (0.98 ммоль) соединения 2 и 0.23 г
течение 1 ч. Выпавший белый осадок отфильтро-
(0.98 ммоль) транс-4-[(4-аминоциклогексил)окси-
вывали и промывали водой. Продукт очищали
бензойная ксилоты (3e). Выход 0.297 г (69%), т.пл.
перекристаллизацией из этанола. Выход 0.117 г
192-193°C. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.87
(39%), т.пл. 65-67°C. Спектр ЯМР 1Н (CDCl3), δ,
д (6H, CH3CHCH3, J 6.6 Гц), 1.25-1.30 м (4H, ци-
м.д.: 0.84 д (6H, CH3CHCH3, J 6.6 Гц), 1.32 д (3H,
клогекс.), 1.32 д (3H, CH3CHN, J 6.9 Гц), 1.42-1.49
CH3CHN, J 6.7 Гц), 1.76-1.83 м (1H, CH3CHCH3),
м (2H, циклогекс.), 1.80-1.88 м (1H, CH3CHCH3),
2.32 с (3H, CH3-Ph), 2.40 д (2H, CH2, J 7.2 Гц),
2.00-2.06 м (2H, циклогекс.), 2.43 д (2H, CH2, J
4.62-4.68 м (1H, CH3CHN), 6.95 д (1H, NHCH, J
7.1 Гц), 3.44 уш.с (1H, циклогекс.), 4.39-4.45 м
7.9 Гц), 7.05-7.13 м (4Hаром), 7.14-7.22 м (4Hаром),
(1H, циклогекс.), 4.70-4.75 м (1H, CH3CHN), 5.72
7.20 с (1H, пиразол), 7.43 с (1H, NH-S), 7.53-7.59
уш.с (1H, NH), 6.08 д (1H, NH, J 7.5 Гц), 6.99-7.02 м
м (4Hаром). Найдено, %: С 61.65; Н 5.35; N 9.55.
(2Hаром), 7.08-7.11 м (2Hаром), 7.18-7.21 м (2Hаром),
C30H31F3N4О3S. Вычислено, %: С 61.63; Н 5.34; N
7.85-7.88 м (2Hаром), 12.38 уш.с (1H, COOH).
9.58. М 584.66.
Найдено, %: С 71.23; Н 7.85; N 6.36. C26H34N2О4.
Вычислено, %: С 71.21; Н 7.81; N 6.39. М 438.57.
1-[(Адамантан-1-ил)этил]-3-[1-(4-изобутил-
фенил)этил]мочевина (4b). Получена аналогич-
N-(4-Гидроксифенил)-N-{[1-(4-изобутилфе-
но соединению 4a из 0.2 г (0.98 ммоль) соедине-
нил)этил]карбамоил}ацетамид
(4e). Получен
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : X.
725
аналогично соединению 4a из 0.1 г (0.49 ммоль)
С 72.60; Н 7.40; N 8.88. C19H23FN2О. Вычислено,
соединения 2 и 0.074 г (0.49 ммоль) с N-(4-
%: С 72.58; Н 7.37; N 8.91. М 314.40.
гидроксифенил)ацетамидом (3d). Выход 0.14 г
1-(4-Фторфенил)-3-[1-(4-изобутилфенил)-
(83%), т.пл. 165-167°C. Спектр ЯМР 1Н (CDCl3), δ,
этил]мочевина (7b). Получена аналогично со-
м.д.: 0.88 д (6H, CH3CHCH3, J 6.6 Гц), 1.42 д (3H,
единению 4a из 0.1 г (0.47 ммоль) соединения 5
CH3CHN, J 6.7 Гц), 1.80-1.88 м (1H, CH3CHCH3),
и 0.064 г (0.46 ммоль) 4-фторфенилизоцианата
2.02 с (3H, CH3C), 2.32 с (3H, CH3-Ph), 2.44 д
(6b). Выход 0.132 г (81%), т.пл. 130-132°C. Спектр
(2H, CH2, J 7.2 Гц), 4.68-4.74 м (1H, CH3CHN),
ЯМР 1Н (CDCl3), δ, м.д.: 0.87 д (6H, CH3CHCH3, J
7.00 уш.с (2Hаром), 7.13 д (2Hаром, J 7.8 Гц), 7.28
6.6 Гц), 1.38 д (3H, CH3CHN, J 6.9 Гц), 1.80-1.88
д (2Hаром, J 7.8 Гц), 7.53 д (2Hаром, J 8.4 Гц), 8.06
м (1H, CH3CHCH3), 2.43 д (2H, CH2, J 7.1 Гц),
уш.с (1H, NH), 9.85 с (1H, OH). Найдено, %: С
4.78-4.85 м (1H, CH3CHN), 6.72 д (1H, NH, J
71.20; Н 7.42; N 7.87. C21H26N2О3. Вычислено, %:
8.0 Гц), 7.00-7.04 м (2Hаром), 7.11 д (2Hаром, J
С 71.16; Н 7.39; N 7.90. М 354.45.
7.8 Гц), 7.25 д (2Hаром, J 7.8 Гц), 7.36-7.40 м
1,3-Бис[1-(4-изобутилфенил)этил]мочевина
(2Hаром), 8.69 с (1H, NH). Найдено, %: С 72.61; Н
(4f). К смеси 0.2 г (0.98 ммоль) соединения (2) рас-
7.39; N 8.90. C19H23FN2О. Вычислено, %: С 72.58;
творенного в 5 мл ТГФ добавляли 0.1 мл диазоби-
Н 7.37; N 8.91. М 314.40.
циклоундецена (DBU) и 2 мл H2O. Реакционную
1-(2-Хлорфенил)-3-[1-(4-изобутилфенил)-
смесь выдерживали при комнатной температуре
этил]мочевина (7с). Получена аналогично со-
в течение 12 ч. После добавления 5 мл 1н HCl,
единению 4a из 0.1 г (0.47 ммоль) соединения 5
смесь перемешивали в течение 1 ч. Выпавший бе-
и 0.072 г (0.47 ммоль) 2-хлорфенилизоцианата
лый осадок отфильтровывали и промывали водой.
(6с). Выход 0.08 г (47%), т.пл. 119-121°C. Спектр
Продукт очищали перекристаллизацией из эта-
ЯМР 1Н (CDCl3), δ, м.д.: 0.88 д (6H, CH3CHCH3, J
нола. Выход 0.184 г (92%), т.пл. 85-87°C. Спектр
6.6 Гц), 1.41 д (3H, CH3CHN, J 6.9 Гц), 1.80-1.88
ЯМР 1Н (CDCl3), δ, м.д.: 0.86 д (6H, CH3CHCH3,
м (1H, CH3CHCH3), 2.44 д (2H, CH2, J 7.1 Гц),
J 6.6 Гц), 0.88 д (6H, CH3CHCH3, J 6.6 Гц), 1.29
4.79-4.85 м (1H, CH3CHN), 6.93 т.д (1Hаром, J 7.6,
д (3H, CH3CHN, J 6.7 Гц), 1.31 д (3H, CH3CHN,
1.6 Гц), 7.14 д (2Hаром, J 7.8 Гц), 7.19-7.23 м
J 6.7 Гц), 1.78-1.87 м (2H, 2CH3CHCH3), 2.41
(1Hаром), 7.26 д (2Hаром, J 7.8 Гц), 7.38 д.д (1Hаром,
д (2H, CH2, J 7.2 Гц), 2.43 д (2H, CH2, J 7.2 Гц),
J 8.0, 1.5 Гц), 7.43 д (1H, NH, J 7.7 Гц), 7.99 с (1H,
4.69-4.74 м (2H, 2CH3CHN), 6.19 д (2H, 2NH,
NH), 8.16 д.д (1Hаром, J 8.4, 1.6 Гц). Найдено, %: С
J 8.2 Гц), 7.06 д (2H, 2,6-C аром., J 6.6 Гц), 7.09
67.00; Н 7.00; N 8.50. C19H23ClN2О. Вычислено, %:
д (2H, 2,6-C аром., J 6.6 Гц), 7.17 д (2H, 3,5-C
аром., J 6.7 Гц), 7.19 д (2H, 3,5-C аром., J 6.7 Гц).
С 68.98; Н 7.01; N 8.47. М 330.86.
Найдено, %: С 78.87; Н 9.56; N 7.40. C25H36N2О.
1-(3-Хлорфенил)-3-[1-(4-изобутилфенил)-
Вычислено,
%: С
78.90; Н
9.54; N
7.36. М
этил]мочевина (7d). Получена аналогично со-
380.58.
единению 4a из 0.1 г (0.47 ммоль) соединения 5
1-(2-Фторфенил)-3-[1-(4-изобутилфенил)-
и 0.072 г (0.47 ммоль) 3-хлорфенилизоцианата
этил]мочевина (7a). Получена аналогично со-
(6d). Выход 0.13 г (75%), т.пл. 120-121°C. Спектр
единению 4a из 0.1 г (0.47 ммоль) соединения 5
ЯМР 1Н (CDCl3), δ, м.д.: 0.87 д (6H, CH3CHCH3, J
и 0.064 г (0.46 ммоль) 2-фторфенилизоцианата
6.6 Гц), 1.40 д (3H, CH3CHN, J 6.9 Гц), 1.80-1.87 м
(6a). Выход 0.087 г (53%), т.пл. 100-102°C. Спектр
(1H, CH3CHCH3), 2.44 д (2H, CH2, J 7.1 Гц), 4.78-
ЯМР 1Н (CDCl3), δ, м.д.: 0.88 д (6H, CH3CHCH3, J
4.85 м (1H, CH3CHN), 6.66 д (1H, NH, J 7.9 Гц),
6.6 Гц), 1.40 д (3H, CH3CHN, J 6.9 Гц), 1.80-1.88 м
6.92 д.д.д (1Hаром, J 7.9, 2.1, 1.1 Гц), 7.12 д (2Hаром,
(1H, CH3CHCH3), 2.44 д (2H, CH2, J 7.1 Гц), 4.78-
J 7.8 Гц), 7.17 д.д.д (1Hаром, J 8.2, 2.1, 1.1 Гц), 7.21
4.85 м (1H, CH3CHN), 6.89-6.93 (1Hаром), 7.01 д
д (1Hаром, J 7.9 Гц), 7.25 д (2Hаром, J 8.9 Гц), 7.64 т
(1H, NH, J 7.8 Гц), 7.06 т (1Hаром, J 7.8 Гц), 7.12-
(1Hаром, J 2.1 Гц), 8.64 с (1H, NH). Найдено, %: С
7.17 м (3Hаром), 7.25 д (2Hаром, J 7.7 Гц), 8.12 т.д
67.01; Н 6.98; N 8.45. C19H23ClN2О. Вычислено, %:
(1Hаром, J 8.3, 1.7 Гц), 8.18 с (1H, NH). Найдено, %:
С 68.98; Н 7.01; N 8.47. М 330.86.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
726
ГЛАДКИХ и др.
ВЫВОДЫ
7.
Tacconelli S., Patrignani P. Front. Pharmacol. 2014, 5,
239. doi 10.3389/fphar.2014.00239
По реакции 1-изобутил-4-(1-изоцианатоэтил)-
бензола с различными аминами, а также, 1-(4-изо-
8.
Huang H., Al-Shabrawey M., Wang M.H.
Prostaglandins Other Lipid Mediat. 2016, 122, 45-53.
бутилфенил)этанамина с галогенсодержащими
ароматическими изоцианатами синтезирована
doi 10.1016/j.prostaglandins.2015.12.007
серия мочевин, содержащих в своей структуре
9.
Frömel T., Fleming I. Antioxid. Redox Signal. 2015, 22,
ибупрофеновый фрагмент. Выходы целевых про-
1273-1292. doi 10.1089/ars.2014.6150
дуктов составили до 95%. Синтезированные мо-
10.
O’Banion M.K. Crit. Rev. Neurobiol. 1999, 13, 45-82.
чевины - потенциальные мультитаргетные инги-
doi 10.1615/critrevneurobiol.v13.i1.30
биторы растворимой эпоксидгидролазы (sEH) и
11.
Rao P., Knaus E.E. J. Pharm. Pharm. Sci. 2008, 11,
циклооксигеназы (COX).
81s-110s. doi 10.18433/J3T886
ФОНДОВАЯ ПОДДЕРЖКА
12.
Насонов Е.Л., Каратеев Д.Е., Чичасова Н.А., Чеме-
Работа выполнена при финансовой поддерж-
рис Н.А. Клин. Фармакол. терапия. 2005, 12, 72-75.
ке Российского научного фонда (грант № 19-73-
13.
Кузьмина Н.Н., Никишина Н.П., Салугина С.О.
10002).
РМЖ. 2003, 7, 419-424.
КОНФЛИКТ ИНТЕРЕСОВ
14.
Alabed S., Cabello J.B., Irving G.J., Qintar M.,
Burls A. Cochrane Database Syst. Rev. 2014, 8. doi
Авторы заявляют об отсутствие конфликта ин-
10.1002/14651858.CD010652
тересов.
15.
Rostas S.E., McPherson C.C. Curr. Pediatr. Rev. 2016,
СПИСОК ЛИТЕРАТУРЫ
12, 110-119. doi 10.2174/157339631202160506002028
1. Кузнецов Я.П., Дегтяренко Е.К., Бурмистров В.В.,
16.
Bonabello A., Galmozzi M.R., Canaparo R., Isaia G.C.,
Аббас Саиф М.Х., Питушкин Д.А., Вернигора А.А.,
Serpe L., Muntoni E., Zara G.P. Anesth. Analg. 2003, 97,
Бутов Г.М. ЖОрХ. 2021, 57, 485-496. [Kuzne-
402-408. doi 10.1213/01.ANE.0000073349.04610.42
tsov Y.P., Degtyarenko E.K., Burmistrov V.V., Abbas
Saeef M.H., Pitushkin D.A., Vernigora A.A., Bu-
17.
Kolasa T., Brooks C.D.W., Rodriques K.E., Sum-
tov G.M. Russ. J. Org. Chem. 2021, 57.] doi 10.1134/
mers J.B., Dellaria J.F., Hulkower K.I., Bouska J.,
S1070428021040035
Bell R.L., Carter G.W. J. Med. Chem. 1997, 40, 819-
2. Wagner K.M., McReynolds C.B., Schmidt W.K.,
824. doi 10.1021/jm9606150
Hammock B.D. Pharmacol. Ther. 2017, 180, 62-76.
18.
Keiser M.J., Setola V., Irwin J.J., Laggner C.,
doi 10.1016/j.pharmthera.2017.06.006
Abbas A.I., Hufeisen S.J., Jensen N.H., Kuijer M.B.,
3. Inceoglu B., Jinks S.L., Ulu A., Hegedus C.M., Geor-
Matos R.C., Tran T.B., Whaley R., Glennon R.A.,
gi K., Schmelzer K.R., Wagner K., Jones P.D., Moris-
Hert J., Thomas K.L.H., Edwards D.D., Shoichet B.K.,
seau C., Hammock B.D. Proc. Natl. Acad. Sci.
U. S. A. 2008, 105, 18901-18906. doi 10.1073/
Roth B.L. Nature. 2009, 462, 175-181. doi 10.1038/
pnas.0809765105
nature08506
4. Spector A.A., Kim H.Y. Biochim. Biophys. Acta Mol.
19.
Hwang S.H., Tsai H.J., Liu J.Y., Morisseau C.,
Cell Biol. Lipids. 2015, 1851, 356-365. doi 10.1016/
Hammock B.D. J. Med. Chem. 2007, 50, 3825-3840.
j.bbalip.2014.07.020
doi 10.1021/jm070270t
5. Spector A.A., Fang X., Snyder G.D., Weintraub N.L.
20.
Burmistrov V., Morisseau C., D’yachenko V., Ryba-
Prog. Lipid Res. 2004, 43, 55-90. doi 10.1016/S0163-
kov V.B., Butov G.M., Hammock B.D. J. Fluor. Chem.
7827(03)00049-3
2019, 220, 48-53. doi 10.1016/j.jfluchem.2019.02.005
6. Oni-Orisan A., Alsaleh N, Lee C.R., Seubert J.M.
J. Mol. Cell. Cardiol. 2014, 74, 199-208. doi 10.1016/
21.
Wang H., Ning Y., Sun Y., Sivaguru P., Bi X. Org. Lett.
j.yjmcc.2014.05.016
2020, 22, 2012-2016. doi 10.1021/acs.orglett.0c00395
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : X.
727
Synthesis and Properties of 1,3-Disubstituted Ureas
and its Isosteric Analogs Containing Polycyclic Fragments:
X1. 1-[1-(4-Isobutylphenyl)ethyl]-3-R Ureas
B. P. Gladkikha, V. S. D’yachenkoa, V. V. Burmistrova, and G. M. Butovb, *
a Volgograd state technical university (VSTU), Leninskii prosp., 28, Volgograd, 400005 Russia
b Volzhsky polytechnic institute (branch) VSTU, ul. Engelsa, 42a, Volzhsky, 404121 Russia
*e-mail: butov@post.volpi.ru
Received February 12, 2021; revised February 27, 2021; accepted February 28, 2021
The reaction of 1-isobutyl-4-(1-isocyanatoethyl)benzene with various amines, as well as, 1-(4-isobutylphenyl)-
ethanamine with halogenated aromatic isocyanates, led to a series of ureas containing an ibuprofen fragment in
their structure. Target product yields were up to 95%. The synthesized ureas are potential multitarget inhibitors
of soluble epoxide hydrolase (sEH) and cyclooxygenase (COX).
Keywords: ibuprofen, urea, halogenated aromatic isocyanates, soluble epoxide hydrolase, cyclooxygenase
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 5 2021