ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 6, с. 757-787
ОБЗОРНАЯ СТАТЬЯ
УДК 547.022.1
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ
БИСПЕРОКСИДОВ
© 2021 г. О. В. Битюков, В. А. Виль*, A. О. Терентьев**
ФГБУН Институт органической химии им. Н.Д. Зелинского Российской академии наук,
Россия, 142432 Москва, Ленинский просп., 47
e-mail: *vil@ioc.ac.ru; **terentev@ioc.ac.ru
Поступила в редакцию 15.03. 2021 г.
После доработки 23.03.20201 г.
Принята к публикации 24.03.2021 г.
Обзор освещает современный уровень развития методов синтеза ациклических геминальных бисперок-
сидов, таких как геминальные бисгидропероксиды, биспероксиды, 1,1'-бис(гидроперокси)бис(алкил)-
пероксиды и 1-гидроперокси-1'-гидроксибис(алкил)пероксиды. Наибольшее внимание уделено анализу
литературы с 2000-х годов по настоящее время. Указанный период характеризуется исследованиями меха-
низмов образования пероксидов и, как следствие, разработкой эффективных и масштабируемых методов
получения ациклических геминальных биспероксидов, основанных на взаимодействии карбонильных
соединений, кеталей и эфиров енолов с Н2О2 и гидропероксидами в новаторских для этой области химии
средах. Создание этих методов позволило более широко применить эти соединения в химии материалов
в качестве инициаторов свободнорадикальной полимеризации и сшивки.
Ключевые слова: органические пероксиды, карбонильные соединения, кетали, гидропероксиды, пе-
роксид водорода
DOI: 10.31857/S051474922106001X
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
758
1. ГЕМИНАЛЬНЫЕ БИСГИДРОПЕРОКСИДЫ
759
1.1. КОНДЕНСАЦИЯ КЕТАЛЕЙ И ЭФИРОВ ЕНОЛОВ С ПЕРОКСИДОМ ВОДОРОДА
760
1.2. КОНДЕНСАЦИЯ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ С ПЕРОКСИДОМ ВОДОРОДА
761
1.3. РЕАКЦИИ ТОЗИЛГИДРАЗОНОВ С ПЕРОКСИДОМ ВОДОРОДА
768
1.4. ОКИСЛИТЕЛЬНАЯ ТРАНСФОРМАЦИЯ БЕНЗИЛОВЫХ СПИРТОВ
768
1.5. РЕАКЦИИ ЦИКЛИЧЕСКИХ α,β-ЭПОКСИ КЕТОНОВ С ПЕРОКСИДОМ ВОДОРОДА
769
1.6. ОЗОНОЛИЗ ЕНОЛ ЭФИРОВ И АЛКЕНОВ В ПРИСУТСТВИИ ПЕРОКСИДА ВОДОРОДА
769
2. ГЕМИНАЛЬНЫЕ БИСПЕРОКСИДЫ
771
2.1. КИСЛОТНО КАТАЛИЗИРУЕМЫЕ РЕАКЦИИ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
772
С ГИДРОПЕРОКСИДАМИ
2.2. КОНДЕНСАЦИЯ АЛЬДЕГИДОВ С трет-БУТИЛТРИМЕТИЛСИЛИЛПЕРОКСИДОМ,
773
КАТАЛИЗИРУЕМАЯ ТРИТИЛПЕРХЛОРАТОМ
757
758
БИТЮКОВ и др.
2.3. АЛКИЛИРОВАНИЕ И АЦИЛИРОВАНИЕ ГЕМИНАЛЬНЫХ БИСГИДРОПЕРОКСИДОВ
773
2.4. СИЛИЛИРОВАНИЕ БИСГИДРОПЕРОКСИДОВ
774
2.5. ДРУГИЕ МЕТОДЫ СИНТЕЗА ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
774
3. 1-ГИДРОПЕРОКСИАЛКИЛ-1-ГИДРОКСИАЛКИЛПЕРОКСИДЫ
774
3.1. СИНТЕЗ ИЗ КЕТОНОВ
774
3.2. СИНТЕЗ ИЗ ГЕМИНАЛЬНЫХ БИСГИДРОПЕРОКСИДОВ
775
4. БИС(1-ГИДРОПЕРОКСИАЛКИЛ)ПЕРОКСИДЫ
776
4.1. СИНТЕЗ БИС(1-ГИДРОПЕРОКСИАЛКИЛ)ПЕРОКСИДОВ ИЗ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
776
И ИХ ПРОИЗВОДНЫХ
4.2. КОНДЕНСАЦИЯ ГЕМИНАЛЬНЫХ БИСГИДРОПЕРОКСИДОВ
777
4.3. ЗАМЕЩЕНИЕ ГИДРОКСИ ГРУППЫ НА ГИДРОПЕРОКСИ ГРУППУ
780
4.4. ДРУГИЕ МЕТОДЫ СИНТЕЗА БИС(1-ГИДРОПЕРОКСИАЛКИЛ)ПЕРОКСИДОВ
780
ВЫВОДЫ
780
СПИСОК ЛИТЕРАТУРЫ
781
ВВЕДЕНИЕ
роксидный фрагмент. Такие органические перок-
сиды как, алкил- и арилгидропероксиды, диал-
Более чем вековая история химии органиче-
кил- и диацилпероксиды, пероксиэфиры, перок-
ских пероксидов тесно связана с производством
сидикарбонаты, пероксиацетали и неорганические
широкого ряда практически ценных молекул и
пероксиды, являются наиболее важными класса-
материалов: противомалярийных (артеролан и
ми радикальных инициаторов в промышленных
артемизинин) [1-9], противоопухолевых [10-16],
процессах для производства полимеров из нена-
антигельминтных [17-21], противовирусных [22-
сыщенных мономеров [53-57]. Большое химиче-
25], фунгицидных [26, 27] и противомикробных
ское и структурное разнообразие промышленных
[28-33] препаратов, окислителей [34-39], иници-
мономеров и их составов требует использования
аторов полимеризации и вулканизующих веществ
[40-43], а также взрывчатых соединений [25, 44].
различных классов пероксидов в качестве иници-
аторов. Такие химические гиганты как Akzo Nobel
Несмотря на долгую историю развития химии пе-
роксидов, их селективный синтез и труднодоступ-
Polymer Chemicals и Arkema в промышленном
ность как определенных классов пероксидов, так
масштабе производят широкий спектр органиче-
и отдельных структур остаются фундаментальной
ских пероксидов, большинство из которых явля-
проблемой [45-52].
ются геминальными биспероксидами (схема 1).
Обозреваемый промежуток времени, с 1940-х
Инициирование радикальных процессов осу-
по настоящее время, в целом характеризуется раз-
ществляется, как правило, термическим методом
работкой новых, эффективных, промышленных
(в интервале температур от 25 до 250°С), в не-
методов получения соединений, содержащих пе-
которых случаях с использованием добавок со-
Схема 1. Радикальные инициаторы на основе биспероксидов
O
O
t-BuOO OOt-Bu t-BuOO OOt-Bu
HOO OOH
O
O
n
O On-Bu
n = 0 Luperox 533 (Arkema) Trigonox 29 (AkzoNobel) Luperox 331
Cyclonox (AkzoNobel)
n = 1 Trigonox 17 (AkzoNobel) Luperox 231 (Arkema)
(Arkema) Luperox® K4CE (Arkema)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
759
Схема 2. Представленные в обзоре ациклические геминальные биспероксиды
R3
R3
HOO OOH
R1OO
OOR4
OOH
OOH
R2
O
R2
O
R1
R2
R2
R3
O R4
O
R4
HO
HOO
1
R1
R
1
2
3
4
единений переходных металлов. Органические
от их конкретной структуры, построение этого об-
пероксиды применяются при полимеризации
зора основано на типах пероксидных фрагментов,
стирола, бутадиена, винилхлорида, акрилатов,
представленных на схеме 2. В обзоре обсуждается
этилена и тетрафторэтилена, а также в процессах
получение геминальных бисгидропероксидов 1,
получения силиконового, акрилонитрил-бутади-
геминальных биспероксидов 2, 1-гидропероксиал-
енового и фторированного каучука, полиэтиле-
кил-1-гидроксиалкил пероксидов 3 и бис(1-гидро-
на и этилен-пропиленовых сополимеров [58-61].
пероксиалкил)пероксидов 4. К настоящему време-
Растущий спрос на огромный спектр полимерных
ни известен довольно широкий спектр подходов
материалов требует быстрого расширения ассор-
к синтезу геминальных биспероксидов. Главным
тимента инициаторов полимеризации, которые
образом эти методы основаны на реакциях кар-
имеют различную структуру и свойства.
бонильных соединений с пероксидом водорода,
алкилгидропероксидами и геминальными бисги-
В настоящем обзоре обобщены и описаны из-
вестные на сегодняшний день подходы к синтезу
дропероксидами, а также на озонолизе ненасы-
ациклических геминальных биспероксидов, таких
щенных соединений в присутствии пероксида во-
как геминальные бисгидропероксиды 1, геминаль-
дорода. Большинство описанных методов требуют
ные биспероксиды 2, 1-гидропероксиалкил-1-ги-
использования кислот Льюиса (Lewis) и Бренстеда
дроксиалкилпероксиды 3 и бис(1-гидропероксиал-
(Bronsted) в качестве катализаторов.
кил)пероксиды 4 (схема 2).
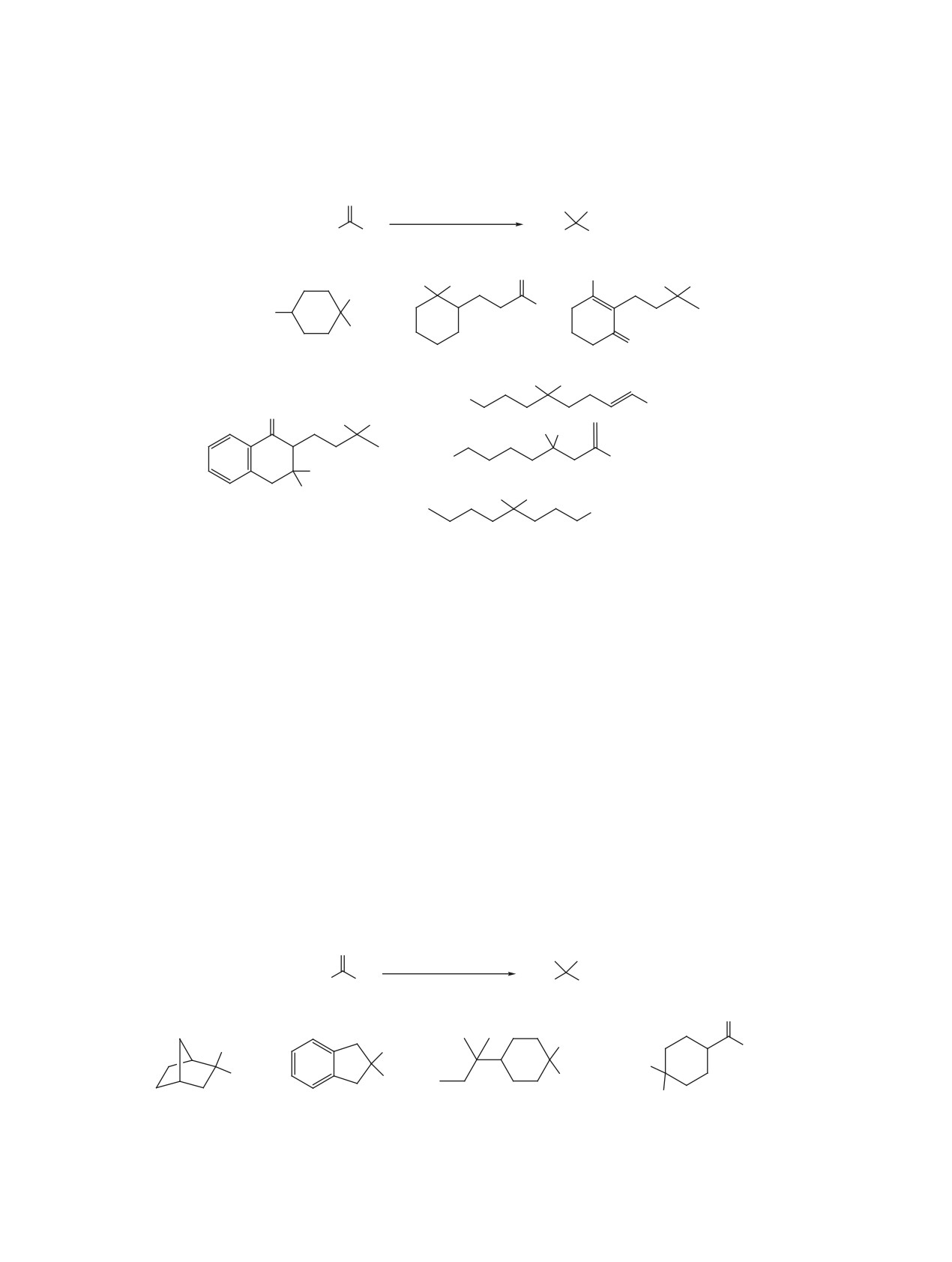
1. ГЕМИНАЛЬНЫЕ БИСГИДРОПЕРОКСИДЫ
В предыдущих обзорах по синтезу и свойствам
Наиболее распространенные подходы к син-
геминальных бисгидропероксидов [62-64] и α-за-
тезу геминальных бисгидропероксидов основаны
мещенных гидропероксидов [65] обсуждался в
на кислотно-катализируемом взаимодействии пе-
основном общий прогресс в химии ациклических
роксида водорода с ацеталям, эфирами енолов или
пероксидов [66], без существенного акцента на
карбонильным соединениям и озонолизе эфиров
конкретные синтетические методы их получения.
енолов или геминальных дизамещенных алкенов в
В настоящем обзоре систематизирован материал
присутствии пероксида водорода (схема 3).
по синтезу ациклических геминальных бисперок-
сидов. Поскольку подходы к синтезу различных
С практической точки зрения наиболее привле-
классов органических пероксидов часто зависят
кательным подходом для получения геминальных
Схема 3. Подходы к синтезу геминальных бисгидропероксидов
R3O OR3
O
H2O2
H2O
2
R1
R2
Кислоты
Кислоты
R1
R2
Бренстеда или
Бренстеда или
Льюиса
HOO OOH
Льюиса
R1
R2
R1
R2
O
OR3
H2O2
H2O2
O3
O
R4Кислоты
R1
Бренстеда или
OR3
R1
R2
Льюиса
R1
R2
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
760
БИТЮКОВ и др.
Схема 4. Продукты пероксидирования карбонильных соединений пероксидом водорода
R1
R2
O
H
HOO OOH
2O2
HO OOH H2O2
5
O
O
R1
R2
R1
R2
R1
R2
O O
H2O
H2O
R1
R2
5
6
1
10
5
6
R1
R2
R1
R2
R1
R2
H2O2
H2O2
HO O O
OH
HO
O O
OOH
HOO O O
OOH
H2O
H2O
R1
R2
R1
R2
R1
R2
7
8
9
H2O
5
R1
R2
R1
R2
O
O
O
O
O
O
O O
R1
R2
R1
R2
O
O
R2
R1
10
11
бисгидропероксидов является реакция карбониль-
зуя в качестве исходных реагентов кетали и эфиры
ных соединений с пероксидом водорода. Однако,
енолов в реакциях с Н2О2. Описан подход [69] к
данное взаимодействие может приводить к обра-
получению геминальных бисгидропероксидов 13
зованию многокомпонентных смесей различных
из кеталей 12 и 30%-го водн. Н2О2 с использовани-
продуктов, содержащих пероксидный фрагмент.
ем вольфрамовой кислоты (H2WO4) в качестве ка-
Добиться селективного образования геминаль-
тализатора (схема 5). Целевые геминальные бисги-
ных бисгидропероксидов
1 трудно, поскольку
дропероксиды 13 получены с выходом 67-83%.
они легко реагируют с исходным карбонильным
Взаимодействие циклических кеталей
14 с
соединением 5 или с промежуточными гидрок-
эфирным раствором Н2О2 в присутствии фосфор-
сигидроперокси соединениями 6 с образованием
номолибденовой кислоты
[H3Mo12O40P·nH2O]
бис(1-гидроксиалкил)пероксидов 7, 1 гидроперок-
приводит к геминальным бисгидропероксидам 15
сиалкил-1-гидроксиалкилпероксидов 8, бис(1-ги-
с высокими выходами (схема 6) [70].
дропероксиалкил)пероксидов 9, 1,2,4,5-тетраокса-
нов 10, 1,2,4,5,7,8-гексаоксонанов 11 и линейных
Использование комплексов трифторида бора в
олигомеров (схема 4). Соотношение продуктов за-
качестве катализатора пероксидирования кеталей
висит от субстрата, катализатора, количества Н2О2
16 позволяет получать геминальные бисгидро-
и условий реакции [67, 68].
пероксиды 17 как циклического, так и линейного
1.1. КОНДЕНСАЦИЯ КЕТАЛЕЙ И ЭФИРОВ
строения с выходом 48-91% (схема 7) [71, 72].
ЕНОЛОВ С ПЕРОКСИДОМ ВОДОРОДА
Данный метод может считаться наиболее надеж-
Проблему селективного образования геминаль-
ным для синтеза геминальных бисгидроперокси-
ных бисгидропероксидов удалось решить, исполь-
дов различного строения.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
761
Схема 5. Катализируемый H2WO4 синтез геминальных бисгидропероксидов 13 из кеталей 12 и Н2О2
H2O2
(30% водн.)
MeO OMe
H2WO4, 4°C
HOO OOH
R1
R2
CH3CN
R1
R2
12
13
HOO OOH
HOO OOH
n = 1, 83%
R1 = R2 = C4H9, 72%
n = 2, 81%
R1
R2
R1 = C2H5, R2 = C6H13, 70%
n = 8, 67%
n
Реакция кеталей с Н2О2, катализируемая ком-
роксид 24 из флуорен-9-она 23 (схема 10) [73]. На
плексом BF3·Et2O, вероятно протекает по механиз-
основе данных элементного анализа и криоскопи-
му, изображенному на схеме 8. На первой стадии
ческого метода (оценка молекулярной массы), для
происходит образование аддукта 18. Далее нукле-
установления структуры, им не удалось правильно
офильная атака пероксида водорода на 18 приво-
определить структуру полученного соединения,
дит к алкоксигидропероксиду 19, который обра-
вместо этого они предположили образование ок-
зует комплекс с трифторидом бора 20. Реакция
сониевой соли 25. Истинная структура полученно-
комплекса 20 с Н2О2 приводит к геминальному
го соединения была установлена Криге (Criegee)
бисгидропероксиду 17 (схема 8) [72].
в 1949 г. [74]. На основании результатов дополни-
тельных экспериментов по взаимодействию по-
При взаимодействии циклических эфиров
лученного соединения с ацетатом свинца (IV) и
енолов 21 с Н2О2, катализируемом комплексом
бензоилхлоридом Криге (Criegee) предположил,
BF3·Et2O, с хорошими выходами образуются ге-
что соединение, полученное Виттигом (Wittig) и
минальные бисгидропероксиды 22 (схема 9) [72].
Пипером (Pieper), содержало гидропероксигруппу.
1.2. КОНДЕНСАЦИЯ КАРБОНИЛЬНЫХ
Значение молекулярной массы, диапазон темпера-
СОЕДИНЕНИЙ С ПЕРОКСИДОМ ВОДОРОДА
туры плавления, содержание активного кислорода
В 1940 г. Виттиг (Wittig) и Пайпер (Pieper)
и водорода указывали на то, что полученное со-
впервые синтезировали геминальный бисгидропе-
единение 24 представляет собой смесь двух моле-
Схема 6. Катализируемый фосфорномолибденовой кислотой синтез геминальных бисгидропероксидов 15
из кеталей 14 и Н2О2
H2O2 (р-р в Et2O)
H3Mo12O40P·nH2O
HOO OOH
O
O
Et2O
R1
R2
R1
R2
14
15
O
CH2
HOO OOH
HOO OOH
HOO OOH
CN
OEt
O
93%
92%
96%
CH2
HOO OOH
HOO OOH
O
90%
CO2Me
HOO OOH
PMBO
97%
CO2Me
95%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
762
БИТЮКОВ и др.
Схема 7. Катализируемый BF3 синтез геминальных бисгидропероксидов 17 из кеталей 16 и Н2О2
H2O2 (Et2O р-р)
MeO OMe
BF2∙Et2O
HOO OOH
R1
R2
Et2O
R1
R2
16
17
HOO OOH
HOO OOH
HOO OOH
n = 1, 60%
n = 1, 61%
R1
R2
n = 3, 80%
n = 7, 91%
R1 = R2 = C7H15, 48%
n
n = 4, 71%
BF3∙MeOH вместо BF3∙Et2O
n
R1 = CH3, R2 = i-C4H9, 78%
Схема 8. Предполагаемый механизм взаимодействия кеталей 16 и Н2О2, катализируемого комплексом BF3·Et2O
3
R
R3O OR3
H2O2
R3O OOH
+
BF3 Et2O
R3O
O
BF
3
1
-Et2O
-BF3∙R3OH
R
R2
R1
R2
R1
R2
16
18
19
R3
BF3∙R3OH
H2O2
HOO OOH
F
3B
O OOH
-R3OH
–BF3∙R3OH
R1
R2
R1
R2
20
17
кул флуорен-9-она 23 с одной молекулой бисги-
Образование геминального бисгидропероксида
дропероксида.
29 в реакции циклогексанона 28 с Н2О2 предпо-
лагалось в нескольких исследованиях [74, 77-80]
В течение длительного периода времени хи-
на основании аналогичных реакций с соответ-
мия геминальных бисгидропероксидов развива-
ствующими производными других кетонов [74,
лась медленно [75]. Основными сдерживающими
76, 81-83]. В 1968 г. Cosijn и Ossewold сообщили
факторами являлись: нестабильность полученных
о получении бисгидропероксида 29 в граммовых
соединений, отсутствие техники их выделения, а
количествах (схема 12) [84].
главное - недостаточно развитые методы физи-
ко-химического анализа.
В 1957 г. Веллуз (Velluz) и его коллеги сооб-
щили о синтезе стероидного геминального бисги-
В 1948 г. Криге (Criegee) и Дитрих (Dietrich)
дропероксида 31 из соответствующего кетона 30 и
сообщили о методе синтеза циклического геми-
пероксида водорода (схема 13) [82, 83].
нального бисгидропероксида 27 с четырьмя ги-
дропероксигруппами из циклического дикетона
Получение геминальных бисгидроперокси-
26 с использованием 92% водного раствора Н2О2
дов 32 и 33 из ацетона и бутан-2-она, соответ-
(схема 11) [76]. Предположение о структуре про-
ственно, было описано в 1959 г. Миласом (Milas)
дукта было основано на данных элементного ана-
и Голубовичем (Golubović) (схема 14) [85, 86].
лиза и молекулярной массе, полученной криоско-
Спустя три года компания J.R. Short Milling
пическим методом.
Company закрепила за собой патентное право на
Схема 9. Синтез геминальных бисгидропероксидов 21 из эфиров енолов 22 и Н2О2
OMe
HOO OOH
n = 1, R1 = H, 83%
H2O2 (р-р в Et2O)
n = 2, R1 = H, 99%
R1
BF3 Et2O
R1
n = 2, R1 = Me, 79%
Et2O
n = 8, R1 = C19H39, 64%
n
n
21
22
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
763
Схема 10. Синтез первого геминального биспероксида
O
O
H2O2 (р-р в Et2O)
O
P2O5
HOO OOH
O
O
25
23
24
Схема 11. Синтез 1,1,6,6-тетрагидроперокси циклододекана 27
O
HOO OOH
H2O2 (92% водн.)
0°C
O
HOO OOH
26
27, 73%
Схема 12. Первый синтез 1,1-дигидропероксициклогексана 29
O
HOO OOH
H2O2 (85% водн.)
(EtO)3PO
28
29
отбеливающие композиции для муки, включаю-
тонов или альдегидов и пероксида водорода, ис-
щие в свой состав 2,2-бис(гидроперокси)бутан 33
пользуя в качестве катализаторов широкий спектр
[87].
кислот Бренстеда и Льюиса. Было установлено,
В 1975 г. структура геминального бисгидропе-
что в значительной степени важна природа раство-
роксидного фрагмента была впервые подтвержде-
рителя, в котором идут эти реакции. Также боль-
на методом рентгеноструктурного анализа на при-
шое внимание было уделено созданию гетероген-
мере 1,1-бис(гидроперокси)циклододекана [88].
ных катализаторов, на основе кислот Бренстеда
В последующие десятилетия удалось достиг-
и Льюиса нанесенных на твердую подложку, для
нуть прогресса в селективном синтезе геминаль-
селективного синтеза геминальных бисгидропе-
ных бисгидропероксидов непосредственно из ке-
роксидов.
Схема 13. Синтез стероидного геминального бисгидропероксида 31
OOH
O
OOH
H2O2
AcO
AcO
30
31
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
764
БИТЮКОВ и др.
Схема 14. Синтез геминальных бисгидропероксидов 32 и 33 из ацетона и метилэтил кетона
H2O2 (50% водн.)
O
H2SO4
HOO OOH
32, R = Me
R
33, R = Et
R
Схема 15. Катализируемый муравьиной кислотой синтез геминальных бисгидропероксидов 35 из карбонильных
соединений 34 и Н2О
O
H2O2 (30% водн.)
HOO OOH
HCO2H
R1
R2
R1
R2
34
35
HOO OOH
OOH
n = 1, 26%
HOO OOH R1 = R2 = C4H9, 24%
n = 6, 46%
OOH
R1
R2
R1 = R2 = C5H11, 27%
n = 7, 25%
n
99%
H2O2 (50% водн.), CH2Cl2
1.2.1. КОНДЕНСАЦИЯ, КАТАЛИЗИРУЕМАЯ
тить, что при этом не наблюдается процессов рас-
КИСЛОТАМИ БРЕНСТЕДА
пада с разрывом связи С-С [100-103].
Геминальные бисгидропероксиды 35 получе-
Существующие подходы к получению геми-
ны в результате взаимодействия кетонов 34 с во-
нальных бисгидропероксидов основаны не только
дным раствором Н2О2 в присутствии муравьиной
на использовании гомогенных катализаторов, так-
(схема 15) [89-92] и уксусной [93] кислот с выхода-
же разработаны более технологичные и удобные
ми 24-46%. Известен метод синтеза геминальных
методики с применением гетерогенного катализа.
бисгидропероксидов циклоалканонов с использо-
Кроме того, гетерогенный катализ часто в большей
ванием системы HClO4-CH3CH2COOH в качестве
степени удовлетворяет общим принципам «зеле-
катализатора [90].
ной» химии: катализаторы можно регенерировать
Использование минеральных кислот приводит
и использовать в нескольких последовательных
к более высоким выходам целевых бисгидропе-
циклах без потери эффективности. Принимая во
роксидов. Так, пероксидирование кетонов 36 во-
внимание большое значение геминальных бисги-
дным раствором пероксида водорода в присут-
дропероксидов для полимерной промышленности,
ствии серной кислоты в ТГФ приводит к геминаль-
были разработаны метод синтеза геминальных
ным бисгидропероксидам 37 с выходом 43-90%
бисгидропероксидов 40 с использованием гете-
(схема 16) [94]. Также хорошие результаты пока-
рогенных катализаторов, нанесенных на подлож-
зывает катализ соляной [95-97], NH2SO3H [98] и
ку - гидросульфат натрия на силикагеле [104], а
камфорсульфоновой кислотами [99]. Стоит отме-
также силикагель, пропитанный серной кислотой
Схема 16. H2SO4-катализируемый синтез геминальных бисгидропероксидов 37 из карбонильных соединений 36
и Н2О2
O
H2O2 (37% водн.)
H2SO
HOO OOH
4
R1
R2
ТГФ
R1
R2
36
37
OOH HOO OOH
n = 1, 80%
HOO OOH
HOO OOH
R1 = R2 = C5H11, 43%
n = 2, 81%
OOH
R1 = Me, R2 = C4H9, 72%
n = 3, 86%
R1
R2
R1 = Me, R2 = i-C4H9, 67%
n = 4, 39%
n
78%
90%
n = 8, 12%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
765
Схема 17. Катализируемый SiO2-H2SO4 синтез геминальных бисгидропероксидов 40 из карбонильных
соединений 39 и Н2О2
H2O2 (30% водн.)
SiO2-H2SO4
R
R
R = H, 85%
CH3CN
R = Br, 75%
OOH
O
OOH
39
40
Схема 18. Катализируемый комплексом поли-4-винилпиридина с H2SO4 синтез геминальных
бисгидропероксидов 42 из карбонильных соединений 41 и Н2О2
OOH
O
64%
1. PVP-H2SO4 (1:5), ТГФ, rt
OOH
2. PVD-H2O2 (1:4.5), 24 ч
OOH
O
OOH
71%
41
42
(схема 17) [105]. Геминальные бисгидроперокси-
переходных металлов - фосфорномолибденовая
ды 40 из карбонильных производных камфоры 39
кислота [70, 108], хлорид цинка (II) [109], метил-
получены с высокими выходами в присутствии
триоксорений (VII) (MeReO3) [110], оксид рения
SiO2-H2SO4 (схема 17) [105].
(VII) [111, 112], пост-переходных металлов - хло-
рид олова (II) [113], трихлорид алюминия [114],
В качестве пероксидирующего агента мо-
трифторметансульфонат висмута (III) [115], соеди-
жет быть использован не только водный рас-
нения неметаллов - молекулярный йод [116, 117],
твор пероксида водорода, но и комплекс поли
и комплекс BF3·Et2O [118] а также аммоний-церий
(N-винилпирролидона) с пероксидом водорода
(IV) нитрат [119]. Эти катализаторы обеспечивают
(PVD/H2O2) [106]. Описан метод синтеза геми-
высокие выходы геминальных бисгидроперокси-
нальных бисгидропероксидов 42 из кетонов 41
дов из циклоалканонов или алкилкетонов, но пе-
под действием PVD/H2O2 и комплекса поли-4-ви-
роксидирование альдегидов или арилметилкето-
нилпиридина с серной кислотой (PVP/H2SO4)
нов в большинстве случаев дает низкие или уме-
(схема 18) [106].
ренные выходы.
1.2.2. КОНДЕНСАЦИЯ, КАТАЛИЗИРУЕМАЯ
Предложен оригинальный метод синтеза геми-
КИСЛОТАМИ ЛЬЮИСА
нальных бисгидропероксидов 44 из кетонов 43 с
использованием хлорида стронция (II) (схема 19)
Для синтеза геминальных бисгидропероксидов
[107]. Процесс протекал в ацетонитриле под дей-
путем пероксидирования карбонильных соедине-
ствием 30%-го водн. Н2О2.
ний может быть использован широкий ряд кислот
Льюиса. К ним относятся соединения щелочнозе-
Использование переходных металлов в синтезе
мельных металлов - хлорид стронция (II) [107],
органических пероксидов является нетривиальной
Схема 19. Катализируемый SrCl2·6H2O синтез геминальных бисгидропероксидов 44 из карбонильных
соединений 43 и Н2О2
H2O2 (30% водн.)
O
SrCl2∙6H2O
HOO OOH
R1 = CH3, R2 = Ph, 45%
CH3CN
R1 = CH3, R2 = i-C4H9, 92%
R1
R2
R1
R2
43
44
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
766
БИТЮКОВ и др.
Схема 20. Катализируемый PMA синтез геминальных бисгидропероксидов 46 из карбонильных соединений 45
и Н2О2
H2O2 (р-р в Et2O)
O
H3Mo12O40P∙nH2O
HOO OOH
R1
R2
R1
R2
45
46
O
OAc
HOO OOH
HOO OOH
OOH
OEt
TBDMSO
OOH
O
95%
92%
89%
HOO OOH
MOMO
90%
CH2
CO2Bn
HOO OOH
HOO OOH
BnO
CO2Et
74%
CO2Me
CO2Me
HOO OOH
OBz
96%
89%
задачей, поскольку пероксиды склонны к распаду
пероксиды 46 с различными функциональными
и перегруппировкам в присутствии металл-содер-
группами с выходом 74-96% (схема 20).
жащих соединений [120]. Широко известная реак-
Было показано, что фосфорновольфрамовая
ция Фентона, применяемая для окисления загряз-
кислота, нанесенная на цеолит, катализирует пре-
нителей в сточных водах, основана на разложении
вращение карбонильных соединений в геминаль-
пероксида водорода переходным металлом (ионом
ные бисгидропероксиды [121]. Следует отметить,
железа). Несмотря на нестабильность пероксидов
что селективное образование желаемых продуктов
в присутствии металлов, были открыты методы
пероксидирования в гетерогенных условиях яв-
получения геминальных бисгидропероксидов 46
ляются скорее исключением из практики химии
из кетонов 45 с использованием соединений пере-
пероксидов [122-124], поскольку подавляющее
ходных металлов - фосфорномолибденовой кис-
большинство превращений пероксидов в присут-
лоты (схема 20) [70, 108], хлорида цинка (II) [109],
ствии твердой поверхности или солей переходных
метилтриоксорения (VII) (MeReO3) [110], оксида
металлов происходит с разрывом связи О-О [125-
рения (VII) [111, 112], и церий-аммоний (IV) ни-
130].
трата [119]. Катализ фосфорномолибденовой кис-
Функционализированные трифторметансуль-
лотой позволяет получать геминальные бисгидро-
фоновой кислотой магнитные наночастицы
Схема 21. Катализируемый γ-Fe2O3@SiO2-TfOH синтез геминальных бисгидропероксидов 48 из карбонильных
соединений 47 и Н2О2
H2O2 (30% водн.)
O
Fe2O3@SiO2-TfOH HOO OOH
R1
R2
CH3CN
R1
R2
47
48
O
OOH
OOH
OOH
OEt
HOO
OOH
OOH
OOH
HOO
94%
84%
90%
81%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
767
Схема 22. Катализируемый SnCl2·2H2O синтез геминальных бисгидропероксидов 50 из карбонильных
соединений 49 и Н2О2
H2O2 (30% водн.)
O
SnCl2∙2H2O
HOO OOH
R1
R2
CH3CN
R1
R2
49
50
HOO OOH
n = 1, 94%
HOO OOH R1 = R2 = C2H5, 93%
n = 2, 90%
R1
R2
R1 = CH3, R2 = C7H15, 95%
n = 3, 90%
n
Схема 23. Катализируемый йодом синтез геминальных бисгидропероксидов 52 из карбонильных соединений 51 и
пероксида водорода
4 экв H2O2 (30% водн.)
O
I2 (10 мол %)
HOO OOH
R1
R2
CH3CN
R1
R2
51
52
O
OOH
OOH HOO OOH
OOH
OOH
HOO
HOO
91%
50%
70%
77%
(γ-Fe2O3@SiO2-TfOH) (схема 21) [131] показали
из альдегидов 51 с хорошим выходом (схема 23)
себя эффективными катализаторами для синтеза
[116, 117]. Образование галогенидов [132-134] не
геминальных бисгидропероксидов 48 из карбо-
наблюдается предположительно из-за использова-
нильных соединений 47 с использованием водного
ния избытка пероксида водорода и каталитических
раствора пероксида водорода.
количеств иода. Комплекс BF3·Et2O также приме-
няли для синтеза геминальных бисгидроперокси-
Геминальные бисгидропероксиды
50 были
дов [118].
получены с высокими выходами из алифатиче-
Реакция пероксида водорода и 1,2-бис(дифе-
ских кетонов 49 и 30%-го водн. Н2О2 с примене-
нилфосфино)этана в ацетоне 53, катализируемая
нием хлорид олова (II) в качестве катализатора
дихлордиметилстаннаном, приводит к образова-
(схема 22) [113]. Также среди соединений пост-пе-
нию аддукта 1,2-бис(дифенилфосфорил)этана и
реходных металлов для синтеза геминальных
2,2-бис(гидроперокси)пропана 54 в соотношении
бисгидропероксидов 50 применялись трихлорид
1:2, стабилизированному водородными связями
алюминия [114] и трифторметансульфонат висму-
между гидропероксидными группами и атомами
та (III) [115].
кислорода фосфорильных групп (схема 24) [135].
Использование в качестве катализатора молеку-
Это единственный пример, когда бисидроперок-
лярного иода приводит к образованию геминаль-
сид образуется селективно из низкомолекулярного
ных бисгидропероксидов 52 как из кетонов, так и
кетона с высоким выходом.
Схема 24. Образование аддукта из 1,2-бис(дифенилфосфорил)этана и 2,2-бис(гидроперокси)пропана 54
H2O2 (10% водн.)
Ph
Ph
O
dppe, Me2SnCl2
O O
H
H
O
O
O P
P O
48 ч
O O
H
H
O
O
Ph
Ph
53
54, 90%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
768
БИТЮКОВ и др.
1.2.3. СИНТЕЗ ГЕМИНАЛЬНЫХ БИСГИДРО-
минальных бисгидропероксидов 62, полученных
ПЕРОКСИДОВ БЕЗ ИСПОЛЬЗОВАНИЯ
таким способом. Более подробно этот процесс
КИСЛОТ В КАЧЕСТВЕ КАТАЛИЗАТОРА
изучался группой Искры (Iskra) [139]. Используя
метод азеотропной отгонки воды, удалось селек-
Ито (Itoh) и его коллеги сообщили о фотоката-
тивно и с высокими выходами (72-99%) получить
литическом методе пероксидирования карбониль-
соответствующие геминальные бисгидроперокси-
ных соединений 55 с использованием молекуляр-
ды 62 из циклических и ациклических кетонов 61
ного кислорода, пропанола-2 и антрацена [136]
(схема 27).
или антрахинона-9,10 (схема 25) [137] в качестве
1.3. РЕАКЦИИ ТОЗИЛГИДРАЗОНОВ
фотосенсибилизатора.
С ПЕРОКСИДОМ ВОДОРОДА
Авторы предполагают, что образовавшийся
Образование геминальных бисгидроперокси-
при поглощении видимого света антрахинон-
дов 66 при окислении тозилгидразонов 63 перок-
9,10 в возбужденном состоянии отрывает атом
сидом водорода в присутствии пероксида натрия
водорода от пропанола-2 с образованием ради-
происходит в результате присоединения перокси-
кальной частицы
57, которая перехватывает-
да водорода по C=N связи. Последующее окисле-
ся молекулярным кислородом (схема 26) [136].
ние аддукта 64 пероксидом водорода и разложение
Гидроксигидропероксид 59 образуется через пе-
получающейся геминальной гидропероксидиазо-
роксирадикал 58. Гидроксигидропероксид 59 (или
ниевой соли 65 под действием пероксида водорода
пероксид водорода, генерируемый in situ) реагиру-
приводит к геминальному бисгидропероксиду 66
ет с карбонильным соединением 55 с образовани-
(схема 28) [140].
ем геминального бисгидропероксидного продукта
1.4. ОКИСЛИТЕЛЬНАЯ ТРАНСФОРМАЦИЯ
56 через гидроксигидропероксид 60.
БЕНЗИЛОВЫХ СПИРТОВ
Геминальные бисгидропероксиды
62 были
Геминальные бисгидропероксиды 69 с выхо-
успешно получены из карбонильных соединений
дом до 42% могут быть получены в результате
и 30-35% водного раствора пероксида водорода,
окислительного превращения соответствующих
методом азеотропной отгонки воды из реакцион-
бензиловых спиртов 67 через стадию образования
ной смеси (схема 27) [138, 139]. В работах Ито
бензильных гидропероксидов 68. Реакцию прово-
(Itoh) [138], азеотропная отгонка воды отдельно
дят при комнатной температуре в течение 3 дней
не обсуждалась, но были приведены выходы ге-
(схема 29) [141].
Схема 25. Фотокатализируемый синтез геминальных бисгидропероксидов 56 из карбонильных соединений 55 при
облучении светом
O2
антрахинон (10 мол %)
O
пропанол-2, hν (VIS)
HOO OOH
R1
R2
R1
R2
55
56
OOH
OOH
OOH
OOH
OOH
OOH
58%
97%
76%
OOH
HOO OOH
73%
OOH
OOH
81%
OOH
71%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
769
Схема 26. Предполагаемый механизм in situ генерации пероксида водорода с последующим синтезом геминальных
бисгидропероксидов 56
OH
OH
57
*
O
OH
O
O2
hv
O
O
O
O
HOO OH
OO OH
+ H
2O2
59
58
O
H2O2 или 59
HOO OH
H2O2 или 59
HOO OOH
R1
R2
R1
R2
R1
R2
55
60
56
1.5. РЕАКЦИИ ЦИКЛИЧЕСКИХ α,β-ЭПОКСИ
Существенным недостатком использования
КЕТОНОВ С ПЕРОКСИДОМ ВОДОРОДА
озона для синтеза геминальных бисгидроперокси-
При взаимодействии циклических α,β-эпокси
дов 83 из енол эфиров 76 (X = OMe) является низ-
кетонов 70 с пероксидом водорода, катализируе-
кая селективность и ограниченная применимость
мом (+)-камфорсульфоновой кислотой (схема 30)
для субстратов, в структуре которых содержатся
из смеси продуктов реакции удается выделить ге-
заместители, чувствительные к высокоактивному
минальные бисгидропероксиды 71 [142].
озону.
1.6. ОЗОНОЛИЗ ЕНОЛ ЭФИРОВ И АЛКЕНОВ
Ключевой стадией превращения енол эфиров
В ПРИСУТСТВИИ ПЕРОКСИДА ВОДОРОДА
76 или алкенов 77 в геминальные бисгидроперок-
Озонолиз циклических енол эфиров 72 при
сиды 83 является разложение образующегося на
температуре -70°C в диэтиловом эфире в присут-
первой стадии озонида 78 на карбонилоксид 79 и
ствии избытка пероксида водорода приводит к об-
метилформиат (80, Х = ОМе) или формальдегид
разованию геминальных бисгидропероксидов 73 с
выходом 33-47% (схема 31) [143].
(81, Х = Н). Геминальный бисгидропероксид 83
образуется в результате атаки H2O2 по пероксикар-
При озонолизе тетрафенилэтилена 74 вместо
бениевому катиону 79 с последующим переносом
ожидаемого метоксигидропероксидного произво-
дного был получен бис(гидроперокси)дифенилме-
протона от пероксида водорода к промежуточному
тан 75 с выходом 50% (схема 32) [144].
соединению 82 (схема 33) [145, 146].
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
770
БИТЮКОВ и др.
Схема 27. Синтез геминальных бисгидропероксидов 62 из карбонильных соединений 61 и Н2О2 методом
азеотропной отгонки воды
1. H2O2 (30-35% водн.), растворитель, rt
O
2. Отгонка воды при пониженном давлении
HOO OOH
R1
R2
R1
R2
61
62
OOH
OOH
OOH
OOH
OOH
OOH
OOH
OOH
73%
99%
90%
89%
OOH
OOH
OOH
OOH
OOH
OOH
MeO
65%
80%
85%
OOH
OOH
OOH
OOH
OOH
OOH
99%
81%
94%
OOH
HOO OOH
HOO
OOH
EtO2C
OOH
HOO
OOH
94%
86%
72%
OOH
OOH
OOH
OOH
78%
95%
Схема 28. Окисление тозилгидразонов 63 с образованием геминальных бисгидропероксидов 66
H2O2 (30% водн.), Na2O2
Ts
R1
H
ТГФ, 25°C, 15 дней
H2O2
HOO
N2
Ts HOO HOO OOH
N
HOO
N
NH
2
R1
R2
R
NHTs
R1
R2
R1
R2
63
64
65
66
HOO OOH
HOO
HOO
22%
20%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
771
Схема 29. Синтез геминальных бисгидропероксидов 69 путем окислительной трансформации гидропероксидов 67
R1
R1
R1
H2O2 (50% водн.)
OH
OOH
OH
H2O2 (50% водн.)
H2SO4
OOH
OOH
( )
( )
( )
n
n
n
67
68
69
R1 = Me, n = 2, 42%; R1 = Me, n = 3, 12%; R1 = Et, n = 2, 32%
Схема 30. Синтез геминальных бисгидропероксидов 71 путем окислительной трансформации циклических
α,β-эпокси кетонов 70
O
O
O
H2O2 (70% водн.)
O
HO
n
OH
Камфора-10-сульфокислота, Et2O
OOH
O
R1
+
+
O
O
R1
OOH R1 OH
n
R1
n
OH
70
71
R1 = Me, n = 0, 2%
R1 = Et, n = 1, 19%
R1 = Me, n = 1, 12%
R1 = Ph, n = 1, 19%
R1 = Me, n = 3, 4%
Схема 31. Синтез геминальных бисгидропероксидов 73 озонолизом циклических енол эфиров 72 в присутствии
Н2О2
OMe
O3, H2O2
HOO OOH
Et2O, -70oC
R1
R2
R1
R2
72
73
OOH
OOH
OOH
OOH
OOH
OOH
33%
47%
42%
2. ГЕМИНАЛЬНЫЕ БИСПЕРОКСИДЫ
нений с трет-бутилтриметилсилилпероксидом и
алкилированием геминальных бисгидроперокси-
Основные подходы к синтезу геминальных
дов алкилиодидами (схема 34). Первая группа этих
биспероксидов основаны на кислотно-катализи-
реакций была подробно рассмотрена в монографи-
руемых реакциях карбонильных соединений или
ях и обзорах [46-50, 147-149], поэтому в данном
кеталей с гидропероксидами, тритилперхлорат-ка-
обзоре обсуждаются только наиболее значимые и
тализируемой конденсации карбонильных соеди-
интересные работы.
Схема 32. Синтез бис(гидроперокси)дифенилметана 75 озонолизом тетрафенилэтилена 74
O3/O2
Ph
Ph
CH3OH/CHCl3
HOO OOH
Ph
Ph
Ph
Ph
74
75, 50%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
772
БИТЮКОВ и др.
Схема 33. Ключевые стадии озонолиза енолэфиров 76 и алкенов 77 в механизме образования геминальных
бисгидропероксидов 83
O
O
O
R1
O3
O
O
R1
O
+ H
R1
H
R2
X
R2
X
R2
X
76, 77
78
79
80, 81
-H+
H2O2
HOO OOH H2O2 HOO OO
R1
R2
R1
R2
83
82
X = OMe (76, 80), H (77, 81).
Схема 34. Основные подходы к синтезу геминальных биспероксидов
R3OOTMS
O
O
−
R3OOH
Tr+ClO4
Кислоты Бренстеда
R1
R2
R1
R2
или Льюиса
R3OO OOR3
R1
R2
R3I
HOO OOH
R4O OR4
R3OOH
Ag2O или CsOH
Кислоты Бренстеда
R1
R2
R1
R2
или Льюиса
2.1. КИСЛОТНО КАТАЛИЗИРУЕМЫЕ
[150-153], соляной [154-158], хлорной [155, 159-
РЕАКЦИИ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
164], 4-толуолсульфоновой [165] и других кислот,
С ГИДРОПЕРОКСИДАМИ
как правило, с использованием водоотнимающих
агентов (CaCl2, Na2SO4, B2O3 и т.д.). При катализе
Реакция карбонильных соединений
84 с
трет-бутилгидропероксидом приводит к образо-
серной кислотой геминальные ди-трет-бутилпе-
ванию геминальных ди-трет-бутилпероксидов 85.
роксиды 85 были получены с выходами от средних
Синтез протекает в присутствии серной (схема 35)
до высоких (схема 35) [150-153].
Схема 35. Катализируемый серной кислотой синтез геминальных биспероксидов 85 из карбонильных соединений
84 и трет-бутилгидропероксида
O
t-BuOOH, H2SO4
t-BuOO OOt-Bu
бензол или кумол
R1
R2
R1
R2
84
85
t-BuOO OOt-Bu
t-BuOO OOt-Bu
OOt-Bu
t-BuOO OOt-Bu
CO2Et
CO2Et
COOR
OOt-Bu
n
87-93%
n = 1, 36%
95%
85%
n = 2, 89%
n = 4, 17%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
773
Схема 36. Катализируемый йодом синтез геминального биспероксида 87 из карбонильного соединения 86
и трет-бутилгидропероксида
t-BuOOH, I2
OOt-Bu
t-Bu
O
t-Bu
CH3CN, 24 ч
OOt-Bu
86
87
Схема 37. Кислотно-катализируемый синтез геминальных биспероксидов 90 из карбонильных соединений 88
и алкилгидропероксида 89
O
R1 = H, R2 = Alk, 78-81%
HCl (35%)
O
O
+
OOH
R1 = Alk, R2 = Alk, 58-79%
CaCl2, 0-5°C, 1 ч
O O
R1 = Me, R2 = HetAr, 32%
R1
R2
R1
R2
88
89
90
Молекулярный йод также был использован в
рат получают из трифенилметанола с хлорной кис-
качестве катализатора превращения кетона 86 в ге-
лотой в уксусном ангидриде [172].
минальные ди-трет-бутилпероксид 87 (схема 36)
2.3. АЛКИЛИРОВАНИЕ И АЦИЛИРОВАНИЕ
[117].
ГЕМИНАЛЬНЫХ БИСГИДРОПЕРОКСИДОВ
Кислотно-катализируемое взаимодействие кар-
Геминальные биспероксиды могут быть по-
бонильных соединений 88 с алкилгидроперок-
лучены путем алкилирования или ацилирования
сидом 89 приводит к образованию геминальных
бисгидропероксидов с использованием алкилга-
диалкилпероксидов 90, распространенным ката-
логенидов, алкилтрифторметансульфонатов или
лизатором такого превращения является соляная
ацилхлоридов. Синтез симметричных геми-
кислота (схема 37) [155, 157]. Также возможно
нальных биспероксидов 96 из соответствующих
использование хлорной кислоты [159, 162, 163] и
бисгидропероксидов 95 достигается с помощью
катионообменной смолы KRS-40t [166].
широкого спектра алкилгалогенидов: иодидов
Катализ тетрафторборной кислотой позволил
или бромидов или алкилтрифторметансульфона-
получать геминальные биспероксиды 92 из раз-
тов в присутствии различных оснований: Ag2O
личных алифатических кеталей 91 (схема 38) [167,
(схема 40) [89, 173-176], CsOH [89, 143, 173, 175],
168]. Также синтез геминальных биспероксидов
Cs2CO3 [175], t-BuOK [175], KOH [175].
92 из кеталей 91 был выполнен с использованием
Моноалкилированные геминальные бисперок-
4-толуолсульфокислоты [169]. Достоинством дан-
сиды 98 получают из 1,1-бис(гидроперокси)цикло-
ного метода является его универсальность и при-
ундекана 97 путем взаимодействия с 1 эквивален-
менимость к кеталям различного строения.
том йодистого алкила. Последующее алкилирова-
2.2. КОНДЕНСАЦИЯ АЛЬДЕГИДОВ
ние 98 приводит к образованию несимметричных
С трет-БУТИЛТРИМЕТИЛСИЛИЛ-
1,1-бис(алкилперокси) соединений 99 (схема 41)
ПЕРОКСИДОМ, КАТАЛИЗИРУЕМАЯ
[173, 176].
ТРИТИЛПЕРХЛОРАТОМ
Описанные в схемах 40 и 41 подходы ограни-
Катализируемая тритилперхлоратом реакция
чены необходимостью использования первичных
альдегидов
93 с трет-бутилтриметилсилилпе-
галогеналканов для алкилирования геминальных
роксидом приводит к образованию геминальных
бисгидропероксидов. Вторичные алкильные заме-
ди-трет-бутилпероксидов 94 с высокими выхода-
стители могут быть введены только при исполь-
ми (схема 39) [170]. трет-Бутилтриметилсилил-
зовании производных трифторметансульфоната и
пероксид используют в виде раствора в толуоле с
трет-бутоксида калия в качестве алкилирующего
концентрацией 4 моль×кг-1 [171], а тритилперхло-
агента и основания, соответственно [175].
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
774
БИТЮКОВ и др.
Схема 38. Кислотно-катализируемый синтез геминальных биспероксидов 92 из кеталей 91
и трет-бутилгидропероксида
MeO OMe
HBF4 (50% водн.)
t-BuOO OOt-Bu
+
t-BuOOH
R1
R2
CaCl2, пентан, rt
R1
R2
91
92
R1 = R2 = Alk, 33-92%
Внутримолекулярная циклизация моноалкил-
да-муравьиная кислота с последующим силили-
замещенных биспероксидов 100, катализируемая
рованием триэтилхлорсиланом или триэтилсилил-
бис(2,4,6-триметилпиридин)иод (I) гексафторфос-
трифторметансульфонатом (схема 45) [92].
фатом, позволяет получать циклические геминаль-
2.5. ДРУГИЕ МЕТОДЫ СИНТЕЗА
ные биспероксиды 101 (схема 42) [176].
ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
Моноацилированные геминальные бисперок-
При взаимодействии аллилтриметилсилана с
сиды 103 получают из геминальных бисгидропе-
2-метокси-2-(октилперокси)пропаном 108 в при-
роксидов 102 с выходами от умеренных до хоро-
сутствии комплекса BF3·Et2O с выходом
60%
ших путем ацилирования уксусным ангидридом
образуется
2,2-бис(октилперокси)пропан
109
или ацилхлоридами в присутствии DMAP и пири-
(схема 46) [178].
дина в хлористом метилене (схема 43) [112, 177].
При нагревании фталоилхлорида 110 с трет-
Несимметричные геминальные бисперокси-
бутилгидропероксидом в пиридине нуклеофиль-
ды 105 были получены с хорошими выходами из
ное замещение атомов хлора трет-бутилгидропе-
моноацилированных геминальных биспероксидов
роксидом приводит к образованию 3,3-бис(трет-
104 путем силилирования триэтилхлорсиланом
бутилперокси)изобензофуран-1(3H)-она
111
(схема 44) [112].
(схема 47) [179].
2.4. СИЛИЛИРОВАНИЕ
3. 1-ГИДРОПЕРОКСИАЛКИЛ-
БИСГИДРОПЕРОКСИДОВ
1-ГИДРОКСИАЛКИЛПЕРОКСИДЫ
Геминальные бис-силилпероксиды 107 были
3.1. СИНТЕЗ ИЗ КЕТОНОВ
получены из кетонов 106 с выходом 48-75% путем
превращения в соответствующие бисгидроперок-
1-Гидропероксиалкил-1-гидроксиалкилперок-
сиды с использованием системы пероксид водоро-
сиды
[1-гидроперокси-1'-гидроксибис(алкил)пе-
Схема 39. Синтез геминальных ди-трет-бутилпероксидов 94 из альдегидов 93
Tr+ClO4- (5 мол %)
t-BuOOTMS (3 экв)
O
CH2Cl2
t-BuOO OOt-Bu
R1
−78÷0°C
R1
H
H
93
94
Br
OOt-Bu
OOt-Bu
OOt-Bu
MeS
OOt-Bu
OOt-Bu
OOt-Bu
88%
78%
89%
OOt-Bu
OOt-Bu
OOt-Bu
OOt-Bu
OOt-Bu
O
OOt-Bu
72%
92%
95%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
775
Схема 40. Синтез симметричных биспероксидов 96 алкилированием бисгидропероксидов 95 алкилгалогенидами
HOO OOH
R3I, Ag2O
R3OO OOR3
EtOAc, 0°C
R1
R2
R1
R2
95
96
OOR3
t-Bu
R3OO
OOR3
OOR3
R3 = CH3, 83%
R3 = CH3, 92%
O O
R3 = C2H5, 87%
R3 = C10H21, 89%
R3 = C4H9, 13%
O
O
12
R3 = C6H13, 79%
MeOO OOMe
R3 = C10H21, 93%
C
4H9
C4H9
92%
22%
Схема 41. Синтез несимметричных биспероксидов 98 и 99 последовательным алкилированием
1,1-бис(гидроперокси)циклоундеканана 97 алкил йодидами
HOO OOH
R3OO
OOH
R3OO
OOR4
R3I, Ag2O
R4I, Ag2O
EtOAc, 0°C
EtOAc, 0°C
97
98
99
R3 = CH3, R4 = CH2CH2CH2I, 53%
R3 = CH3, 62%
R3 = CH3, R4 = CH2(CH2)4CH2I, 52%
R3 = C4H9, 66%
R3OO
OOR4
R3OO
OOH
R3 = C4H9, R4 = CH3, 83%
R3 = Ph(CH2)2CH2, 60%
R3 = Ph(CH2)2CH2, R4 = CH3, 75%
R3 =
OTHP, 47%
R3 =
OTHP
, R4 = CH3, 78%
6
6
R3 =
, 54%
2
R3 =
, R4 = CH3, 98%
2
R
3 =
, 55%
R3 =
, R4 = CH3, 83%
роксиды] можно получить из циклических кето-
3.2. СИНТЕЗ ИЗ ГЕМИНАЛЬНЫХ
нов и пероксида водорода в присутствии кислоты:
БИСГИДРОПЕРОКСИДОВ
серной [67], соляной [74, 78, 180-183], азотной
Несимметричный
1-гидропероксиалкил-1-ги-
[184] или хлорной [185] с хорошими выходами.
дроксиалкилпероксид 115 может быть получен из
Взаимодействие циклогексанона 112 с 86%-
геминального бисгидропероксида 114 при взаимо-
действии с формальдегидом в присутствии анили-
ным водным раствором Н2О2 в присутствии сер-
на с выходом 60% (схема 49) [186].
ной кислоты приводит к 1-гидропероксицикло-
гексил-1-гидроксициклогексилпероксиду
113 с
Было установлено, что катализируемое йодом
выходом 84% (схема 48) [67]. Важным условием
взаимодействие геминальных бисгидроперокси-
достижения высокого выхода 113 является поря-
дов с ацеталями протекает с заменой только одной
док и скорость прибавления реагентов.
алкоксигруппы на пероксидную с образованием
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
776
БИТЮКОВ и др.
Схема 42. Синтез циклических геминальных биспероксидов 101 внутримолекулярной циклизацией
моноалкилбиспероксидов 100
+
N I PF6
O
I
O
n = 1, 95%
n
2
O O
n = 3, 57%
CH2Cl2, 20°C, 2 ч
n
n = 6, 52%
O
O
OOH
100
101
1-гидроперокси-1'-алкоксипероксидов с выхода-
4.1. СИНТЕЗ БИС(1-ГИДРОПЕРОКСИАЛКИЛ)-
ми до 64% [187]. Эти же соединения образуются
ПЕРОКСИДОВ ИЗ КАРБОНИЛЬНЫХ
в катализируемых йодом реакциях геминальных
СОЕДИНЕНИЙ И ИХ ПРОИЗВОДНЫХ
бисгидропероксидов с эфирами енолов [187].
Бис(1-гидропероксиалкил)пероксиды 117 были
4. БИС(1-ГИДРОПЕРОКСИАЛКИЛ)-
получены с выходами от хороших до высоких при
ПЕРОКСИДЫ
взаимодействии карбонильных соединений
116
с пероксидом водорода [188] или его растворами
Бис(1-гидропероксиалкил)пероксиды [1,1'-бис-
[74, 180, 189, 190] в присутствии серной кислоты
(гидроперокси)бис(алкил)пероксиды] могут быть
в различных растворителях (схема 51) [67, 86, 191,
получены из карбонильных соединений, кеталей
192]. В качестве катализатора также могут быть ис-
или бисгидропероксидов при взаимодействии с пе-
пользованы различные кислоты Бренстеда: хлор-
роксидом водорода, катализируемом различными
ная [193], соляная [57, 191, 194, 195], 10-камфор-
кислотами (схема 50). Замена гидроксигруппы на
сульфоновая [189, 190], а также кислоты Льюиса:
гидропероксигруппу в 1-гидропероксиалкил-1-ги-
метилтриоксорений (VII) (MeReO3) [196] и оксид
дроксиалкилпероксидах также приводит к обра-
рения (VII) [111].
зованию бис(1-гидропероксиалкил)пероксидов
(схема 50). Другие подходы к синтезу бис(1-ги-
Альтернативный метод синтеза бис(1-гидро-
дропероксиалкил)пероксидов включают озонолиз
пероксиалкил)пероксидов 119 основан на реак-
эфиров енолов или алкенов.
ции кеталей 118 с пероксидом водорода, катали-
Схема 43. Синтез моноацилированных геминальных биспероксидов 103 из геминальных бисгидропероксидов 102
HOO OOH
Ac2O или RC(O)Cl
AcylOO OOH
DMAP, пиридин
R2
R1
R2
R1
CH2Cl2, 0°C
102
103
HOO OOAc
AcOO OOH
n = 3, 76%
HOO OOAc
HOO OOAc
n = 4, 73%
Ph
n = 8, 81%
n
t-Bu
86%
76%
84%
OOH
HOO OOAc
t-Bu
R = Ph, 37%
O O
R = OEt, 76%
R
O
t-Bu
84%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
777
Схема 44. Синтез несимметричных геминальных биспероксидов 105 из моноацилированных
геминальных биспероксидов 104
AcOO OOH
Et3SiCl, DMAP
AcOO
OOSiEt3
R1
R2
Et3N, CH2Cl2, 0oC
R1
R2
104
105
Et3SiOO
OOAc
OOSiEt3
n = 3, 81%
Et
OOAc
Et
OOAc
3SiOO
3SiOO
t-Bu
n = 4, 70%
Ph
n = 8, 80%
OOAc
n
58%
79%
73%
Схема 45. Синтез геминальных бисилилпероксидов 107 из кетонов 106
1. H2O2 (50% водн.)
O
HCO2H, CH2Cl2, 25°C, 10 мин
Et3SiOO
OOSiEt3
2. Et3SiCl или Et3SiOTf,
R1
R2
R1
R2
Et3N, DMAP, 0-25°C, 4-18 ч
106
107
Et3SiOO
OOSiEt3
Et3SiOO
OOSiEt3
Et3SiOO
OOSiEt
3
Et3SiOO
OOSiEt3
n = 1, 54%
BnO
n = 2, 54%
Ph
n
t-Bu
75%
53%
48%
зируемой комплексом BF3·Et2O или BF3·CH3OH
акции эфиров енолов 124 с Н2О2 (схема 54) [72],
(схема 52) [71].
но труднодоступность исходных эфиров енолов
ограничивает практическое использование этого
Известно, что взаимодействие эфиров енолов
метода.
120 и 122 с пероксидом водорода в кислой среде
приводит к образованию симметричных бис(1-ги-
4.2. КОНДЕНСАЦИЯ ГЕМИНАЛЬНЫХ
дропероксиалкил)пероксидов 121 и 123, соответ-
БИСГИДРОПЕРОКСИДОВ
ственно (схема 53) [188, 197].
Гомоконденсация геминальных бисгидропе-
Установлено, что бис(1-гидропероксиалкил)-
роксидов 126 и 128 в присутствии кислот приво-
пероксиды 125 являются одним из продуктов в ре-
дит к получению бисгидропероксидных произво-
Схема 46. Синтез 2,2-бис(октилперокси)пропана 109
TMS
BF3 OEt2
MeO
O
CH2Cl2, -78°C
O
O
O
7
7
O
O
7
108
109, 60%
Схема 47. Синтез 3,3-бис(трет-бутилперокси)изобензофуран-1(3H)-она 111
O
Cl
t-BuOO
Cl
OOt-Bu
t-BuOOH, пиридин
Cl
50-60oC, 2 ч
O
O
Cl
O
O
O
110
111, 14%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
778
БИТЮКОВ и др.
Схема 48. Синтез 1-гидропероксиалкил-1-гидроксиалкилпероксидов 113 из циклических кетонов 112
O
HO
OOH
H2O2 (86% водн.), H2SO4 (конц.)
10°C, 1 ч
O
O
112
113, 84%
Схема 49. Синтез 1-гидропероксиалкил-1-гидроксиалкилпероксида 115 из геминального бисгидропероксида 114
HOO OOH
HO
OOH
HCOH, PhNH2
ТГФ
O
O
114
115, 60%
Схема 50. Основные подходы к синтезу бис(1-гидропероксиалкил)пероксидов
O
H2O2
HOO OOH
Кислоты Бренстеда
Кислоты Бренстеда
R1
R2
R1
R2
или Льюиса
или Льюиса
HOO
OOH
R1
R2
O
O
R2
R1
HO
OOH
R3O OR3
H2O2
H2O
2
R1
R2
1
Кислоты Бренстеда
O
O
R
R2
R2
R1
или Льюиса
дных циклододеканона 127 и фенолсодержащего
пероксиды 131 с выходами от умеренным до хо-
кетона 129 с умеренным выходом (схема 55) [85,
роших (схема 56) [199, 200]. Благодаря широкому
141, 198].
спектру подходов к получению исходных геми-
Конденсация
1,1-бис(гидроперокси)циклоал-
нальных бисгидропероксидов этот метод является
канов 130 в присутствии комплекса BF3·Et2O по-
наиболее перспективным для получения бис(1-ги-
зволяет получать бис(1-гидропероксициклоалкил)
дропероксиалкил)пероксидов.
Схема 51. Синтез бис(1-гидропероксиалкил)пероксидов 117 из кетонов 116
HOO
OOH
O
H2O2 (водн. р-р)
1
R
R1
H2SO4 (конц.)
R1
R2
O
O
CH3CN или бензол
R2
R2
116
117
HOO
OOH
HOO
OOH
HOO
OOH
1
n
n
R
R1
O
O
O
O
2
O
O
R
R2
R1
R1
R1 = R2 = CH3, 75%
n = 1, R1 = H, 63%
46%
R1 = R2 = C2H5, 85%
n = 2, R1 = H, 56%
R1 = R2 = CH2Ph, 55%
n = 1, R1 = Me, 60%
R1 = CH3, R2 = C2H5, 45%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
779
Схема 52. Синтез бис(1-гидропероксиалкил)пероксидов 119 из кеталей 118
H2O2 (р-р в Et2O)
BF3∙Et2O или BF3∙MeOH
HOO
OOH
MeO OMe
Et2O, rt, 1-3 ч
R1
R2
R1
R2
O
O
R2
R1
118
119
HOO
OOH
HOO
OOH
HOO
OOH
n = 1, 30%
C7H15
C
n = 2, 59%
7H15
O
O
O
O
O
O
n = 4, 59%
C7H15
C
n
n
7H15
15%
22%
Схема 53. Синтез симметричных бис(1-гидропероксиалкил)пероксидов 121 и 123 из эфиров енолов 120 и 122,
соответственно
H2O2, H2SO4
OOH
OOH
O
20-25°C
O O
120
121
O O
OH
O
HO
O O
122
123
Схема 54. Синтез бис(1-гидропероксиалкил)пероксидов 125 из енол эфиров 124
H2O2 (р-р в Et2O)
HOO
OOH
OMe
BF3∙Et2O
R1
R2
Et2O
R3
O O
R1
3
R2
R3R2
R
2
R
124
125
HOO
OOH
HOO
OOH
HOO
OOH
n = 1, R1 = H, 29%
C7H15
C7H15
n = 7, R1 = H, 52%
O
O
O
O
O
O
n = 1, R1 = CH3, 12%
C7H15
C7H15
R1R1
n
n
29%
16%
Схема 55. Синтез симметричных бис(1-гидропероксиалкил)пероксидов 127 и 129 из бисгидропероксидов 126 и 128
HOO OOH
HOO
OOH
CH3CH2CO2H
HClO4, AcOH
O
O
−20÷0°C, 16 ч
126
127, 80%
OH
OH
HO
H2SO4
OOH
O O
3 дня
OOH
OOH OOH
128
129, 48%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
780
БИТЮКОВ и др.
Схема 56. Конденсация 1,1-бис(гидроперокси)циклоалканов 130 катализируемая BF3·Et2O
HOO OOH
n = 1, 36%
HOO
OOH
BF3∙Et2O
n = 6, 64%
n
n
n = 7, 86%
Et2O
O
O
20°C, 1-12 ч
n = 8, 64%
n
n = 10, 84%
130
131
Схема 57. Синтез бис(1-гидропероксициклогексил)пероксида 133
H2O2 (86% водн.)
H2SO4
20oC, 24 ч
HO
OOH
92%
HOO
OOH
H2O2 (84% водн.)
O
O
O
O
20oC, 16 ч
53%
132
133
Схема 58. Синтез бис(1-гидропероксиалкил)пероксидов 135 и 137 из простых эфиров 134 и 136
O2, hν
HOO
OOH
O
50°C, 9-13 ч
O
O
134
135
O
HOO
OOH
O2, hν
50°C, 9-13 ч
O
O
136
137
4.3. ЗАМЕЩЕНИЕ ГИДРОКСИ ГРУППЫ
реакция моделирует хорошо известные процессы
НА ГИДРОПЕРОКСИ ГРУППУ
автоокисления простых эфиров (например, диэти-
лового эфира или тетрагидрофурана) молекуляр-
В нейтральной или кислой среде геминальная
ным кислородом [202, 203].
гидроксигруппа
1-гидропероксиалкил-1-гидрок-
сиалкилпероксида может быть заменена гидро-
ВЫВОДЫ
пероксидной группой. Так, бис(1-гидроперокси-
Анализ литературных данных показал, что к на-
циклогексил)пероксид 133 может быть получен
стоящему моменту известен достаточно широкий
из гидрокси-аналога 132 с хорошим выходом
спектр подходов к синтезу геминальных бисперок-
(схема 57) [67, 74].
сидов. Главным образом эти методы основаны на
реакциях карбонильных соединений с пероксидом
4.4. ДРУГИЕ МЕТОДЫ СИНТЕЗА
водорода, алкилгидропероксидами и геминальны-
БИС(1-ГИДРОПЕРОКСИАЛКИЛ)-
ми бисгидропероксидами, а также на озонолизе
ПЕРОКСИДОВ
ненасыщенных соединений в присутствии Н2О2.
Бис(1-гидропероксиалкил)пероксиды
могут
Большинство описанных методов синтеза требу-
быть получены из простых эфиров при облучении
ют использования катализаторов на основе кислот
в атмосфере кислорода. При мощном облучении
Льюиса и Бренстеда. Ограничением большинства
(500 Вт) в кварцевом реакторе эфиры 134 и 136
известным методов синтеза геминальных биспе-
окисляются до соответствующих гидроперокси-
роксидов является крайне низкая селективность
дов 135 и 137 (схема 58) [201]. Фактически, эта
синтеза целевого пероксида. Как правило, в реак-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
781
циях образуется смесь близких по строению пе-
10.
Dembitsky V.M. Eur. J. Med. Chem. 2008, 43, 223-
роксидных соединений. Проблему селективного
251. doi 10.1016/j.ejmech.2007.04.019
образования геминальных бисгидропероксидов
11.
Chaturvedi D., Goswami A., Pratim Saikia P., Ba-
удалось решить путем использования в качестве
rua N.C., Rao P.G. Chem. Soc. Rev. 2010, 39, 435-454.
исходных реагентов кеталей и эфиров енолов в ре-
doi 10.1039/B816679J
акциях с Н2О2
и гидропероксидами.
12.
Liu D.-Z., Liu J.-K. Nat. Prod. Bioprospect. 2013, 3,
161-206. doi 10.1007/s13659-013-0042-7
Прогресс в химии геминальных биспероксид-
ных соединений был и остается тесно связанным с
13.
Yaremenko I.A., Coghi P., Prommana P., Qiu C.,
использованием кеталей, карбонильных соедине-
Radulov P.S., Qu Y., Belyakova Y.Y., Zanforlin E.,
Kokorekin V.A., Wu Y.Y.J., Fleury F., Uthaipibull C.,
ний, эфиров енолов и алкенов в качестве исходных
Wong V.K.W., Terent’ev A.O. ChemMedChem. 2020,
субстратов. Дальнейшее развитие методов синтеза
15, 1118-1127. doi 10.1002/cmdc.202000042
геминальных бисгидропероксидов, бисперокси-
14.
Vil’ V.A., Yaremenko I.A., Fomenkov D.I., Levits-
дов, 1,1'-бис(гидроперокси)бис(алкил)пероксидов,
ky D.O., Fleury F., Terent’ev A.O. Chem. Heterocycl.
1-гидроперокси-1'-гидроксибис(алкил)пероксидов
Compd. 2020, 56, 722-726. doi 10.1007/s10593-020-
и аналогичных структур основывается на поиске
02722-4
новых ненасыщенных и геминальных дизамещен-
15.
Coghi P., Yaremenko I.A., Prommana P., Radulov P.S.,
ных исходных соединений, которые могут реаги-
Syroeshkin M.A., Wu Y.J., Gao J.Y., Gordillo F.M.,
ровать с гидропероксидами.
Mok S., Wong V.K.W., Uthaipibull C., Terent’ev A.O.
ФОНДОВАЯ ПОДДЕРЖКА
ChemMedChem. 2018, 13, 902-908. doi 10.1002/
cmdc.201700804
Работа выполнена при финансовой поддержке
гранта Российского научного фонда (проект № 21-
16.
Yaremenko I.A., Syroeshkin M.A., Levitsky D.O.,
43-04417).
Fleury F., Terent’ev A.O. Med. Chem. Res. 2017, 26,
170-179. doi 10.1007/s00044-016-1736-2
КОНФЛИКТ ИНТЕРЕСОВ
17.
Keiser J., Utzinger J. Trends Parasitol. 2007, 23, 555-
Авторы заявляют об отсутствии конфликта ин-
562. doi 10.1016/j.pt.2007.07.012
тересов.
18.
Muraleedharan K.M., Avery M.A. Drug Discov. Today.
СПИСОК ЛИТЕРАТУРЫ
2009, 14, 793-803. doi 10.1016/j.drudis.2009.05.008
1. Zhou W.-S., Xu X.-X. Acc. Chem. Res. 1994, 27, 211-
19.
Panic G., Duthaler U., Speich B., Keiser J. Int. J. Pa-
216. doi 10.1021/ar00043a005
rasitol. Drugs Drug Resist. 2014, 4, 185-200. doi
10.1016/j.ijpddr.2014.07.002
2. White N.J. Science. 2008, 320, 330-334. doi 10.1126/
science.1155165
20.
Cowan N., Yaremenko I.A., Krylov I.B., Teren-
3. Haynes R.K., Vonwiller S.C. Acc. Chem. Res. 1997, 30,
t’ev A.O., Keiser J. Biorg. Med. Chem. 2015, 23, 5175-
73-79. doi 10.1021/ar950058w
5181. doi 10.1016/j.bmc.2015.02.010
4. Kumar V., Mahajan A., Chibale K. Biorg. Med. Chem.
21.
Ingram K., Yaremenko I.A., Krylov I.B., Hofer L.,
2009, 17, 2236-2275. doi 10.1016/j.bmc.2008.10.072
Terent’ev A.O., Keiser J. J. Med. Chem. 2012, 55,
8700-8711. doi 10.1021/jm3009184
5. Meshnick S.R., Jefford C.W., Posner G.H., Ave-
ry M.A., Peters W. Parasitol. Today. 1996, 12, 79-82.
22.
Efferth T., Marschall M., Wang X., Huong S.-M.,
doi 10.1016/0169-4758(96)80660-0
Hauber I., Olbrich A., Kronschnabl M., Stammin-
6. Vil’ V.A., Yaremenko I.A., Ilovaisky A.I., Teren-
ger T., Huang E.-S. J. Mol. Med. 2002, 80, 233-242.
t’ev A.O. Molecules. 2017, 22, 117. doi 10.3390/
doi 10.1007/s00109-001-0300-8
molecules22010117
23.
Efferth T., Romero M.R., Wolf D.G., Stamminger T.,
7. Tang Y., Dong Y., Vennerstrom J.L. Med. Res. Rev.
Marin J.J.G., Marschall M. Clin. Infect. Dis. 2008, 47,
2004, 24, 425-448. doi 10.1002/med.10066
804-811. doi 10.1086/591195
8. Jefford C.W. Drug Discov. Today. 2007, 12, 487-495.
24.
Jia M., Zhao R., Xu B., Yan W., Chu F., Gu H.,
doi 10.1016/j.drudis.2007.04.009
Xie T., Xiang H., Ren J., Chen D., Wang P., Lei H.
9. Opsenica D.M., Šolaja B.A. J. Serb. Chem. Soc. 2009,
MedChemComm. 2017, 8, 148-151. doi 10.1039/
74, 1155-1193. doi 10.2298/JSC0911155O
C6MD00344C
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
782
БИТЮКОВ и др.
25.
Vil’ A.V., Yaremenko A.I., Ilovaisky I.A., Teren-
42.
Russell K.E. Prog. Polym. Sci. 2002, 27, 1007-1038.
t’ev O.A. Molecules. 2017, 22, 1881. doi 10.3390/
doi 10.1016/S0079-6700(02)00007-2
molecules22111881
43.
Islamova R.M., Ishkinina O.I., Nazarova S.V.,
26.
Yaremenko I.A., Radulov P.S., Belyakova Y.Y., Demi-
Chupakhin O.N., Utepova I.A., Andriyashina N.M.,
na A.A., Fomenkov D.I., Barsukov D.V., Subboti-
Terent’ev A.O. Russ. Chem. Bull. 2013, 62, 1282-1285.
na I.R., Fleury F., Terent’ev A.O. Chem. Eur. J. 2020,
doi 10.1007/s11172-013-0177-z
26, 4734-4751. doi 10.1002/chem.201904555
44.
Klapötke T.M., Wloka T. Patai’S Chemistry of
27.
Yaremenko I.A., Syromyatnikov M.Y., Radulov P.S.,
Functional Groups. Hoboken: John Wiley & Sons, Ltd.
Belyakova Y.Y., Fomenkov D.I., Popov V.N., Teren-
2009, 1-28. doi 10.1002/9780470682531.pat0879
t’ev A.O. Molecules. 2020, 25, 1954. doi 10.3390/
45.
Flory P.J. Principles of Polymer Chemistry. New York:
molecules25081954
Cornell University Press, 1953.
28.
Kitis M. Environ. Int. 2004, 30, 47-55. doi 10.1016/
46.
Антоновский В.Л. Органические перекисные иници-
S0160-4120(03)00147-8
аторы. М.: Химия, 1972.
29.
Chassot A.L.C., Poisl M.I.P., Samuel S.M.W. Braz.
47.
Антоновский В.Л., Хурсан С.Л. Физическая химия
Dent. J. 2006, 17, 117-121. doi 10.1590/S0103-
органических пероксидов. М.: Академкнига, 2003.
64402006000200006
48.
Рахимов А.И. Химия и технология органических пе-
30.
Baldry M.G.C., French M.S. Water Sci. Technol. 1989,
рекисных соединений. М.: Химия, 1979.
21, 203-206. doi 10.2166/wst.1989.0100
49.
Swern D. Organic peroxides. New York: Wiley-
31.
Alvaro J.E., Moreno S., Dianez F., Santos M., Carras-
Interscience, 1970.
co G., Urrestarazu M. J. Food Eng. 2009, 95, 11-15.
50.
The Chemistry of Peroxides. Ed. F. Liebman, A. Greer,
doi 10.1016/j.jfoodeng.2009.05.003
Z. Rappoport, I. Marek, S. Patai. Hoboken: John Wiley
& Sons. 2015, 3.
32.
Luukkonen T., Pehkonen S.O. Crit. Rev. Env. Sci.
Technol.
2017,
47,
1-39.
doi
10.1080/
51.
Schulz M. Peroxide Chemistry: Mechanistic and
10643389.2016.1272343
Preparative Aspects of Oxygen Transfer. Weinheim:
Wiley-VCH Verlag GmbH & Co. KGaA. 2005, 1-38.
33.
Tropina V.I., Krivykh O.V., Sadchikova N.P., Teren-
doi 10.1002/3527600396.ch1
t’ev A.O., Krylov I.B. Pharm. Chem. J. 2010, 44, 248-
250. doi 10.1007/s11094-010-0441-6
52.
Vil’ V.A., Gomes G.d.P., Ekimova M.V., Lyssen-
ko K.A., Syroeshkin M.A., Nikishin G.I., Alabugin I.V.,
34.
Wu X.-F., Gong J.-L., Qi X. Org. Biomol. Chem. 2014,
Terent’ev A.O. J. Org. Chem. 2018, 83, 13427-13445.
12, 5807-5817. doi 10.1039/C4OB00276H
doi 10.1021/acs.joc.8b02218
35.
Schmidt R.J. Appl. Catal., A. 2005, 280, 89-103. doi
53.
Denisov E.T., Denisova T.G., Pokidova T.S. Handbook
10.1016/j.apcata.2004.08.030
of Free Radical Initiators. Hoboken: John Wiley &
36.
Zhu Y., Wang Q., Cornwall R.G., Shi Y. Chem. Rev.
Sons, Inc. 2005, 61-127. doi 10.1002/0471721476.ch4
2014, 114, 8199-8256. doi 10.1021/cr500064w
54.
Denisov E.T., Denisova T.G., Pokidova T.S. Handbook
37.
Fisher T.J., Dussault P.H. Tetrahedron. 2017, 73, 4233-
of Free Radical Initiators. Hoboken: John Wiley &
4258. doi 10.1016/j.tet.2017.03.039
Sons, Inc. 2005, 129-282. doi 10.1002/0471721476.
38.
Vil’ V.A., Gorlov E.S., Bityukov O.V., Barsegyan Y.A.,
ch5
Romanova Y.E., Merkulova V.M., Terent’ev A.O. Adv.
55.
Sheppard C.S., Kamath V.R. Polym. Eng. Sci. 1979, 19,
Synth. Catal. 2019, 361, 3173-3181. doi 10.1002/
597-606. doi 10.1002/pen.760190902
adsc.201900271
56.
Handbook of Vinyl Polymers: Radical Polymerization,
39.
Barsegyan Y.A., Vil’ V.A. Chem. Heterocycl. Compd.
Process, and Technology. 2nd Edn. Eds. M. Mishra, Y.
2019, 55, 1035-1037. doi 10.1007/s10593-019-02572-
Yagci. Boca Raton: CRC Press, 2016.
9
57.
Terent’ev A.O., Platonov M.M., Tursina A.I.,
40.
Gaylord N.G., Mandal B.M., Martan M. J. Polym.
Chernyshev V.V., Nikishin G.I. J. Org. Chem. 2008, 73,
Sci., Polym. Lett. Ed. 1976, 14, 555-559. doi 10.1002/
3169-3174. doi 10.1021/jo7027213
pol.1976.130140908
58.
Luft G., Bitsch H., Seidl H. J. Macromol. Sci. A. 1977,
41.
Emami S.H., Salovey R., Hogen-Esch T.E. J. Polym.
11, 1089-1112. doi 10.1080/00222337708061313
Sci., Part A: Polym. Chem. 2002, 40, 3021-3026. doi
59.
Lowell A.I., Price J.R. J. Polym. Sci. 1960, 43, 1-12.
10.1002/pola.10367
doi 10.1002/pol.1960.1204314101
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
783
60.
Li X., Koseki H., Iwata Y., Mok Y.-S. J. Loss
Bryan J.D. J. Chem. Soc. 1952, 1178-1189. doi
Prev. Process Ind. 2004, 17, 23-28. doi 10.1016/
10.1039/JR9520001178
j.jlp.2003.08.003
78.
Kharasch M.S., Sosnovsky G. J. Org. Chem. 1958, 23,
61.
Adam W. Peroxide Chemistry: Mechanistic and
1322-1326. doi 10.1021/jo01103a021
Preparative Aspects of Oxygen Transfer. Weinheim:
79.
Brown N., Hartig M.J., Roedel M.J., Anderson A.W.,
Wiley-VCH. 2000.
Schweitzer C.E. J. Am. Chem. Soc. 1955, 77, 1756-
62.
Schwartz C., Dussault P.H. Patai’S Chemistry of
1759. doi 10.1021/ja01612a010
Functional Groups. Hoboken: John Wiley & Sons, Ltd.
80.
Zorn H., Till H., Mitterhofer F. Monatsh Chem. Verw.
2009, 1-38. doi 10.1002/9780470682531.pat0871
Teile Anderer Wiss. 1965, 96, 430-442. doi 10.1007/
63.
van Tonder J.H. Synlett. 2014, 25, 1629-1630. doi
BF00909451
10.1055/s-0034-1378210
81.
Milas N.A., Belič I. J. Am. Chem. Soc. 1959, 81, 3358-
64.
Kropf H. Methoden der Organischen Chemie (Houben-
3361. doi 10.1021/ja01522a050
Weyl). 1988.
82.
Warnant J., Jofy R., Muthieu J., Velluz L. Bull. Soc.
65.
Zmitek K., Zupan M., Iskra J. Org. Biomol. Chem.
Chim. Fr. 1957, 331.
2007, 5, 3895-3908. doi 10.1039/B711647K
83.
Velluz L., Amiard G., Martel J., Warnant J. Bull. Soc.
66.
Gandhi H., O’Reilly K., Gupta M.K., Horgan C.,
Chim. Fr. 1957, 879.
O’Leary E.M., O’Sullivan T.P. RSC Adv. 2017, 7,
84.
Cosijn A.H.M., Ossewold M.G.J. Recl. Trav. Chim.
19506-19556. doi 10.1039/C6RA28489B
Pays-Bas.
1968,
87,
1264-1271. doi
10.1002/
recl.19680871108
67.
McCullough K.J., Morgan A.R., Nonhebel D.C.,
Pauson P.L., White G.J. J. Chem. Res. (M). 1980, 601-
85.
Milas N.A., Golubovic A. J. Am. Chem. Soc. 1959, 81,
628.
6461-6462. doi 10.1021/ja01533a033
68.
Cubbon R.C.P., Hewlett C. J. Chem. Soc. C. Org. 1968,
86.
Milas N.A., Golubović A. J. Am. Chem. Soc. 1959, 81,
2986-2988. doi 10.1039/J39680002986
5824-5826. doi 10.1021/ja01530a068
69.
Jefford C.W., Li Y., Jaber A., Boukouvalas J.
87.
Ferrari C.G., Kazuo H. Пат. US3047406A (1962).
Synth. Commun.
1990,
20,
2589-2596. doi
США.
10.1080/00397919008051466
88.
Groth P. Acta Chem. Scand. 1975, 29a, 840-842. doi
70.
Li Y., Hao H.-D., Zhang Q., Wu Y. Org. Lett. 2009, 11,
10.3891/acta.chem.scand.29a-0840
1615-1618. doi 10.1021/ol900262t
89.
Kim H.-S., Nagai Y., Ono K., Begum K., Wataya Y.,
71.
Terent’ev A.O., Kutkin A.V., Platonov M.M., Ogi-
Hamada Y., Tsuchiya K., Masuyama A., Nojima M.,
bin Y.N., Nikishin G.I. Tetrahedron Lett. 2003, 44,
McCullough K.J. J. Med. Chem. 2001, 44, 2357-2361.
7359-7363. doi 10.1016/S0040-4039(03)01844-6
doi 10.1021/jm010026g
72.
Terent’ev A.O., Kutkin A.V., Platonov M.M.,
90.
Ledaal T. S.T. Acta Chem. Scand. 1967, 1658-1659.
Vorontsov I.I., Antipin M.Y., Ogibin Y.N., Niki-
doi 10.3891/acta.chem.scand.21-1658
shin G.I. Russ. Chem. Bull. 2004, 53, 681-687. doi
91.
Dåshes T L.T. Acta Chem. Scand. 1971, 1906-1908.
10.1023/B:RUCB.0000035657.58776.cc
doi 10.3891/acta.chem.scand.25-1906
73.
Wittig G., Pieper G. Ber. Dtsch. Chem. Ges. 1940, 73,
92.
Ramirez A., Woerpel K.A. Org. Lett. 2005, 7, 4617-
295-297. doi 10.1002/cber.19400730402
4620. doi 10.1021/ol051703u
74.
Criegee R., Schnorrenberg W., Becke J. Liebigs Ann.
93.
Nagahama S., Kobayashi H., Akiyoshi S. Bull. Chem.
1949, 565, 7-21. doi 10.1002/jlac.19495650103
Soc. Jpn. 1959, 32, 366-370. doi 10.1246/bcsj.32.366
75.
Criegee R., Pilz H., Flygare H. Ber. Dtsch. Chem. Ges.
94.
Terent’ev A.O., Platonov M.M., Ogibin Y.N., Niki-
1939, 72, 1799-1804. doi 10.1002/cber.19390720926
shin G.I. Synth. Commun. 2007, 37, 1281-1287. doi
76.
Criegee R., Dietrich H. Liebigs Ann. 1948, 560, 135-
10.1080/00397910701226384
141. doi 10.1002/jlac.19485600107
95.
Todorović N.M., Stefanovic M., Tinant B., Dec-
lercq J.-P., Makler M.T., Solaja B.A. Steroids. 1996, 61,
77.
Wooding N.S., Higginson W.C.E., Cooper W., Davi-
688-696. doi 10.1016/S0039-128X(96)00203-6
son W.H.T., Cocker W., Cross B.E., McCormick J.,
Pelletier S.W., Josey A.D., Bauer L., Baxter J.N.,
96.
Šolaja B.A., Terzić N., Pocsfalvi G., Gerena L., Ti-
Cymerman J., Sheldon W.J., Dawson J.K., Astell-
nant B., Opsenica D., Milhous W.K. J. Med. Chem.
Burt A., Hammick D.L., Curtis R.G., Silberman H.,
2002, 45, 3331-3336. doi 10.1021/jm020891g
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
784
БИТЮКОВ и др.
97.
Kumawat M.K., Parida P., Chetia D. Med. Chem. Res.
115.
Sashidhara K.V., Avula S.R., Ravithej Singh L.,
2016, 25, 1993-2004. doi 10.1007/s00044-016-1644-
Palnati G.R. Tetrahedron Lett. 2012, 53, 4880-4884.
5
doi 10.1016/j.tetlet.2012.07.001
98.
Khosravi K., Pirbodaghi F., Kazemi S., Asgari A.
116.
Žmitek K., Zupan M., Stavber S., Iskra J. Org. Lett.
J. Iran. Chem. Soc. 2015, 12, 1333-1337. doi 10.1007/
2006, 8, 2491-2494. doi 10.1021/ol060590r
s13738-015-0598-8
117.
Žmitek K., Zupan M., Stavber S., Iskra J. J. Org.
99.
BungeA., Hamann H.-J., Liebscher J. Tetrahedron Lett.
Chem. 2007, 72, 6534-6540. doi 10.1021/jo0708745
2009, 50, 524-526. doi 10.1016/j.tetlet.2008.11.055
118.
Zhang Q., Li Y., Wu Y.-K. Chin. J. Chem. 2007, 25,
100.
Terent’ev A.O., Platonov M.M., Kashin A.S., Niki-
1304-1308. doi 10.1002/cjoc.200790242
shin G.I. Tetrahedron. 2008, 64, 7944-7948. doi
119.
Das B., Krishnaiah M., Veeranjaneyulu B., Ravi-
10.1016/j.tet.2008.06.027
kanth B. Tetrahedron Lett. 2007, 48, 6286-6289. doi
101.
Vil’ V.A., Gomes G.d.P., Bityukov O.V., Lyssen-
10.1016/j.tetlet.2007.07.012
ko K.A., Nikishin G.I., Alabugin I.V., Terent’ev A.O.
120.
Radulov P.S., Vil’ V.A. Chem. Heterocycl. Compd.
Angew. Chem. Int. Ed. 2018, 57, 3372-3376. doi
2020, 56, 299-301. doi 10.1007/s10593-020-02657-w
10.1002/anie.201712651
121.
Khosravi K., Zendehdel M., Naserifar S., Tavakoli F.,
102.
Terent’ev A., Platonov M., Kutkin A. Open Chem.
Khalaji K., Asgari A. J. Chem. Res. 2016, 40, 744-
2006, 4, 207-215. doi 10.2478/s11532-006-0012-6
749. doi 10.3184/174751916X14792244600532
103.
Vil’ V.A., Barsegyan Y.A., Kuhn L., Ekimova M.V.,
122.
Do S.-H., Batchelor B., Lee H.-K., Kong S.-H.
Semenov E.A., Korlyukov A.A., Terent’ev A.O.,
Chemosphere.
2009,
75,
8-12. doi
10.1016/
Alabugin I.V. Chem. Sci. 2020, 11, 5313-5322. doi
j.chemosphere.2008.11.075
10.1039/D0SC01025A
123.
Hasan M.A., Zaki M.I., Pasupulety L., Kumari K.
104.
Das B., Veeranjaneyulu B., Krishnaiah M., Bala-
Appl. Catal., A. 1999, 181, 171-179. doi 10.1016/
subramanyam P. J. Mol. Catal. A Chem. 2008, 284,
S0926-860X(98)00430-X
116-119. doi 10.1016/j.molcata.2008.01.016
124.
Yang Y., Tseung A.C.C., Lin Z.G. J. Electroanal.
105.
Azarifar D., Najminejad Z., Khosravi K. Synth.
Chem.
1994,
370,
159-164. doi
10.1016/0022-
Commun.
2013,
43,
826-836. doi
10.1080/
0728(94)03201-7
00397911.2011.610549
125.
Masuyama A., Sugawara T., Nojima M., McCul-
106.
Surya Prakash G.K., Shakhmin A., Glinton K.E.,
lough K.J. Tetrahedron. 2003, 59, 353-366. doi
Rao S., Mathew T., Olah G.A. Green Chem. 2014, 16,
10.1016/S0040-4020(02)01522-3
3616-3622. doi 10.1039/C4GC00586D
126.
Lempers H.E.B., Sheldon R.A., Swift K.A.D. Chem.
107.
Azarifar D., Khosravi K., Soleimanei F. Molecules.
Lett. 2002, 31, 830-831. doi 10.1246/cl.2002.830
2010, 15, 1433. doi 10.3390/molecules15031433
127.
Ogibin Y.N., Terent’ev A.O., Ananikov V.P., Niki-
108.
Yan X., Chen J., Zhu Y.-T., Qiao C. Synlett. 2011,
shin G.I. Russ. Chem. Bull. 2001, 50, 2149-2155. doi
2011, 2827-2830. doi 10.1055/s-0031-1289864
10.1023/A:1015009603719
109.
Khosravi K., Kazemi S. J. Chin. Chem. Soc. 2012, 59,
128.
Blank O., Raschke N., Heinrich M.R. Tetrahedron
641-644. doi 10.1002/jccs.201100605
Lett.
2010,
51,
1758-1760. doi
10.1016/
110.
Iskra J., Bonnet-Delpon D., Bégué J.-P. Tetrahedron
j.tetlet.2010.01.098
Lett.
2003,
44,
6309-6312. doi
10.1016/S0040-
129.
Prechter A., Heinrich M.R. Synthesis. 2011, 2011,
4039(03)01472-2
1515-1525. doi 10.1055/s-0030-1260006
111.
Ghorai P., Dussault P.H. Org. Lett. 2008, 10, 4577-
130.
Ogibin Y.N., Starostin E.K., Aleksandrov A.V.,
4579. doi 10.1021/ol801859c
Pivnitsky K.K., Nikishin G.I. Synthesis. 1994, 1994,
112.
Hang J., Ghorai P., Finkenstaedt-Quinn S.A., Fin-
901-903. doi 10.1055/s-1994-25596
dik I., Sliz E., Kuwata K.T., Dussault P.H. J. Org.
131.
Liu Y.-H., Deng J., Gao J.-W., Zhang Z.-H. Adv.
Chem. 2012, 77, 1233-1243. doi 10.1021/jo202265j
Synth. Catal. 2012, 354, 441-447. doi 10.1002/
113.
Azarifar D., Khosravi K., Soleimanei F. Synthesis.
adsc.201100561
2009, 2009, 2553-2556. doi 10.1055/s-0029-1217394
132.
Terent’ev A.O., Khodykin S.V., Krylov I.B., Ogi-
114.
Azarifar D., Khosravi K. J. Iran. Chem. Soc. 2011, 8,
bin Y.N., Nikishin G.I. Synthesis. 2006, 2006, 1087-
1006-1013. doi 10.1007/BF03246556
1092. doi 10.1055/s-2006-926386
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
785
133.
Terent’ev A.O., Borisov D.A., Krylov I.B., Niki-
151.
Matsuyama K., Kumura H. J. Org. Chem. 1993, 58,
shin G.I. Synth. Commun. 2007, 37, 3151-3164. doi
1766-1770. doi 10.1021/jo00059a029
10.1080/00397910701545171
152.
Yasushi S., Yasumasa W., Hiromi K., Tomoyuki N.,
134.
Nikishin G.I., Kapustina N.I., Sokova L.L., Bityu-
Shuji S., Yasuhiko S. Bull. Chem. Soc. Jpn. 1992, 65,
kov O.V., Terent’ev A.O. Tetrahedron Lett. 2020, 61,
664-667. doi 10.1246/bcsj.65.664
152154. doi 10.1016/j.tetlet.2020.152154
153.
Nwoko D., Wells M.O., Bock L.A. Пат.
135.
Pettinari C., Marchetti F., Cingolani A., Drozdov A.,
WO/2003/000655 (2003).
Troyanov S. Chem. Commun. 2000, 1901-1902. doi
154.
Rieche A., Bischoff C., Dietrich P. Chem. Ber. 1961,
10.1039/B005221N
94, 2932-2936. doi 10.1002/cber.19610941115
136.
Tada N., Cui L., Okubo H., Miura T., Itoh A. Adv.
155.
Nazarova Z.F., Bocharova Y.E., Batog A.E.,
Synth. Catal. 2010, 352, 2383-2386. doi 10.1002/
Romancevich M.K. Russ. J. Org. Chem. 1966, 2,
adsc.201000357
249-251.
137.
Cui L., Tada N., Okubo H., Miura T., Itoh A.
156.
Augusto P., Giuliano B., Carlo B., Augusto P.C.,
Green Chem. 2011, 13, 2347-2350. doi 10.1039/
Spartaco F. Пат. US3296184A (1967). США.
C1GC15437K
157.
Yurzhenko T.I., Elagin G.I., Karpenko A.N., Mam-
138.
Tada N., Cui L., Okubo H., Miura T., Itoh A. Chem.
chur L.P. Izv. Vuzov, Ser. Khim. Khim. Tekhnol.
Commun.
2010,
46,
1772-1774. doi
10.1039/
1970, 13, 1457-1460.
B917056A
158.
Schweitzer-Chaput B., Boess E., Klussmann M.
139.
Starkl Renar K., Pecar S., Iskra J. Org. Biomol. Chem.
Org. Lett.
2016,
18,
4944-4947. doi
10.1021/
acs.orglett.6b02419
2015, 13, 9369-9372. doi 10.1039/C5OB01503K
159.
Oldekop Y.A., Moiseichuk K.L., Yuvchenko A.P.,
140.
Caglion L., Gasparrini F., Misiti D., Palmieri G.
Isahanyan A.L. Vestsi Akad. Navuk BSSR, Ser. Khim.
Tetrahedron. 1978, 34, 135-139. doi 10.1016/0040-
Navuk. 1976, 2, 105-108.
4020(78)88048-X
160.
Bloodworth A.J., Bunce R.J. J. Organomet.
141.
Hamann H.-J., Liebscher J. J. Org. Chem. 2000, 65,
Chem.
1973,
60,
11-18. doi
10.1016/S0022-
1873-1876. doi 10.1021/jo991457y
328X(00)85432-7
142.
Hamann H.-J., Bunge A., Liebscher J. Chem. Eur. J.
161.
Chapurkin V.V., Drevin V.E. Russ. J. Org. Chem.
2008, 14, 6849-6851. doi 10.1002/chem.200800932
1999, 35, 1551-1551.
143.
Tsuchiya K., Hamada Y., Masuyama A., Nojima M.,
162.
Sorokina A.N., Batog A.E., Romancevich M.K. Russ.
McCullough K.J., Kim H.-S., Shibata Y., Wataya Y.
J. Org. Chem. 1967, 3, 827.
Tetrahedron Lett. 1999, 40, 4077-4080. doi 10.1016/
163.
Mashnenko O.M., Sorokina A.N., Batog A.E.,
S0040-4039(99)00653-X
Mironenko N.I., Romancevich M.K. Sov. Prog. Chem.
144.
Robertson J.C., Verzino W.J. J. Org. Chem. 1970, 35,
(Engl. Transl.). 1971, 37, 97-99.
545-547. doi 10.1021/jo00827a068
164.
Schulz M., Likowski K. Z. Chem. 1980, 20, 53-53.
145.
Разумовский С.Д., Заиков Г.Е. Озон и его реакции
doi 10.1002/zfch.19800200205
с органическими соединениями. М.: Наука, 1974.
165.
Wang X., Pan Y., Huang K.-W., Lai Z. Org. Lett. 2015,
146.
Bailey P.S. Ozonation in Organic Chemistry. New
17, 5630-5633. doi 10.1021/acs.orglett.5b02881
York: Academic Press, 1978, 25-43.
166.
Yuvchenko A.P., Beresnevich L.B., Zhukovs-
147.
Эмануэль Н.М. Успехи химии органических пере-
kaya N.A., Kozlov N.G., Moiseichuk K.L., Olde-
кисных соединений и аутоокисления. М.: Химия,
kop Y.A. Russ. J. Org. Chem. 1988, 24, 1703-1706.
1969.
167.
Terent’ev A.O., Kutkin A.V., Troizky N.A., Ogi-
148.
Adam W. Four-membered Ring Peroxides:
bin Y.N., Nikishin G.I. Synthesis. 2005, 2005, 2215-
1,2-Dioxetanes and α-Peroxylactones. Ed. S. Patai.
2219. doi 10.1055/s-2005-872093
Chichester: John Wiley & Sons, Ltd. 1983, 829-920.
168.
Schweitzer-Chaput B., Sud A., Pintér Á., Dehn S.,
doi 10.1002/9780470771730.ch24
Schulze P., Klussmann M. Angew. Chem. Int. Ed.
149.
Organic Peroxides. Ed. W. Ando. Chichester: Wiley.
2013, 52, 13228-13232. doi 10.1002/anie.201306752
1992.
169.
Matsuyama K., Sugiura T., Minoshima Y. J. Org.
150.
Maltha P.R.A., Tijssen S.B. Пат. US3409600A
Chem.
1995,
60,
5520-5525. doi
10.1021/
(1968). США.
jo00122a035
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
786
БИТЮКОВ и др.
170.
Mukaiyama T., Miyoshi N., Kato J.-I., Ohshima M.
188.
Criegee R., Metz K. Chem. Ber. 1956, 89, 1714-1718.
Chem. Lett. 1986, 15, 1385-1388. doi 10.1246/
doi 10.1002/cber.19560890720
cl.1986.1385
189.
Bunge A., Hamann H.-J., Dietz D., Liebscher J.
171.
Buncel E., Davies A.G. J. Chem. Soc. 1958, 1550-
Tetrahedron. 2013, 69, 2446-2450. doi 10.1016/
1556. doi 10.1039/JR9580001550
j.tet.2013.01.032
172.
Dauben J.H., Honnen L., Harmon K. J. Org. Chem.
190.
Bunge A., Hamann H.-J., McCalmont E., Liebscher J.
1960, 25, 1442-1445. doi 10.1021/jo01078a608
Tetrahedron Lett. 2009, 50, 4629-4632. doi 10.1016/
173.
Hamada Y., Tokuhara H., Masuyama A., Nojima M.,
j.tetlet.2009.05.096
Kim H.-S. Ono K., Ogura N., Wataya Y. J. Med. Chem.
2002, 45, 1374-1378. doi 10.1021/jm010473w
191.
Milas N.A., Golubović A. J. Am. Chem. Soc. 1959,
81, 3361-3364. doi 10.1021/ja01522a051
174.
McCullough K.J., Ito T., Tokuyasu T., Masuyama A.,
Nojima M. Tetrahedron Lett. 2001, 42, 5529-5532.
192.
Sanderson J.R., Zeiler A.G. Synthesis. 1975, 1975,
doi 10.1016/S0040-4039(01)01015-2
388-390. doi 10.1055/s-1975-23765
175.
Kyasa S., Puffer B.W., Dussault P.H. J. Org. Chem.
193.
Busch P., Story P.R. Synthesis. 1970, 1970, 181-183.
2013, 78, 3452-3456. doi 10.1021/jo4001564
doi 10.1055/s-1970-21592
176.
Ito T., Tokuyasu T., Masuyama A., Nojima M.,
194.
Terent’ev A.O., Platonov M.M., Sonneveld E.J.,
McCullough K.J. Tetrahedron. 2003, 59, 525-536.
Peschar R., Chernyshev V.V., Starikova Z.A., Niki-
doi 10.1016/S0040-4020(02)01556-9
shin G.I. J. Org. Chem. 2007, 72, 7237-7243. doi
177.
Ghorai P., Dussault P.H. Org. Lett. 2009, 11, 4572-
10.1021/jo071072c
4575. doi 10.1021/ol9018216
195.
Hawkins E.G.E. J. Chem. Soc. C. Org. 1969, 2671-
178.
Dussault P.H., Lee I.Q., Lee H.-J., Lee R.J., Niu Q.J.,
2677. doi 10.1039/J39690002671
Schultz J.A., Zope U.R. J. Org. Chem. 2000, 65,
8407-8414. doi 10.1021/jo991714z
196.
Franco L.L., de Almeida M.V., e Silva L.F.R.,
179.
Milas N.A., Klein R.J. J. Org. Chem. 1968, 33, 848-
Vieira P.P.R., Pohlit A.M., Valle M.S. Chem. Biol.
851. doi 10.1021/jo01266a084
Drug. Des. 2012, 79, 790-797. doi 10.1111/j.1747-
180.
Kropf H., Bernert C.R., Dahlenburg L. Tetrahedron.
0285.2012.01345.x
1970,
26,
3279-3287. doi
10.1016/S0040-
197.
McCapra F., Leeson P. J. Chem. Soc., Chem. Commun.
4020(01)92907-2
1976, 1037-1038. doi 10.1039/C39760001037
181.
Cardinale G., Laan J.A.M., Ward J.P. Tetrahedron.
198.
Paul K., Story P.R., Busch P., Sanderson J.R.
1985,
41,
2899-2902. doi
10.1016/S0040-
J. Org. Chem. 1976, 41, 1283-1285. doi 10.1021/
4020(01)96613-X
jo00869a054
182.
Cooper W., Davison W.H.T. J. Chem. Soc. 1952,
199.
Terent’ev A.O., Kutkin A.V., Platonov M.M.,
1180-1182. doi 10.1039/JR9520001178
Starikova Z.A., Ogibin Y.N. Nikishina G.I. Russ.
183.
Kerur D.R., Diaper D.G.M. Can. J. Chem. 1973, 51,
Chem. Bull. 2005, 54, 1214-1218. doi 10.1007/
3110-3113. doi 10.1139/v73-463
s11172-005-0383-4
184.
Zang N., Qian X.-M., Liu Z.-Y., Shu C.-M. J. Therm.
Anal. Calorim. 2016, 124, 1131-1139. doi 10.1007/
200.
Arzumanyan A.V., Terent’ev A.O., Novikov R.A.,
s10973-015-5209-5
Lakhtin V.G., Chernyshev V.V., Fitch A.N., Niki-
185.
Lee B., Story P.R., Sanderson J.R. J. Org. Chem.
shin G.I. Eur. J. Org. Chem. 2014, 2014, 6877-6883.
1976, 41, 2314-2315. doi 10.1021/jo00875a021
doi 10.1002/ejoc.201402895
186.
Tyumkina T.V., Makhmudiyarova N.N., Kiyamut-
201.
Belič I., Kastelic-Suhadolc T., Kavčič R., Marsel J.,
dinova G.M., Meshcheryakova E.S., Bikmukhame-
Kramer V., Kralj B. Tetrahedron. 1976, 32, 3045-
tov K.S., Abdullin M.F., Khalilov L.M., Ibragi-
3049. doi 10.1016/0040-4020(76)80164-0
mov A.G., Dzhemilev U.M. Tetrahedron. 2018, 74,
202.
Clover A.M. J. Am. Chem. Soc. 1924, 46, 419-430.
1749-1758. doi 10.1016/j.tet.2018.01.045
doi 10.1021/ja01667a017
187.
Terent’ev A.O., Platonov M.M., Krylov I.B., Cher-
nyshev V.V., Nikishin G.I. Org. Biomol. Chem. 2008,
203.
Milas N.A. Chem. Rev. 1932, 10, 295-364. doi
6, 4435-4441. doi 10.1039/B809661A
10.1021/cr60036a002
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ АЦИКЛИЧЕСКИХ ГЕМИНАЛЬНЫХ БИСПЕРОКСИДОВ
787
Acyclic Geminal Bisperoxides Synthesis
O. V. Bityukov, V. A. Vil’*, and A. O. Terent’ev**
N.D. Zelinsky Institute of Organic Chemistry, Russian Academy of Sciences,
Leninskii prosp., 47, Moscow, 119991 Russia
e-mail: *vil@ioc.ac.ru; **terentev@ioc.ac.ru
Received March 15, 2021; revised March 23, 2021; accepted March 24, 2021
The review highlights the current level of development of the synthesis of acyclic geminal bisperoxides, such
as geminal bishydroperoxides, bisperoxides, 1,1'-bis(hydroperoxy)bis(alkyl)peroxides, and 1-hydroperoxy-1'-
hydroxybis(alkyl)peroxides. Most attention is paid to the literature analysis from the 2000s to the present. The
above period is characterized by studies on the mechanisms of peroxide formation and, as a consequence, the
development of effective and scalable methods for the preparation of acyclic geminal bisperoxides based on
the reactions of carbonyl compounds, ketals and enol ethers with H2O2 and hydroperoxides in media, which are
innovative for this area of chemistry. The discovery of these methods made it possible to apply acyclic geminal
bisperoxides more widely in material chemistry as initiators of free-radical polymerization and crosslinking.
Keywords: organic peroxides, carbonyl compounds, hydrogen peroxide
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021