ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 6, с. 802-819
УДК 547-326 + 547-312 + 547.363
СИНТЕЗ НОВОГО 10,11-ДИДЕГИДРОАНАЛОГА
ЭПОТИЛОНА D
© 2021 г. Р. Ф. Валеев, Г. Р. Сунагатуллина, В. В. Лоза, А. Н. Лобов, М. С. Мифтахов*
Уфимский институт химии - обособленное структурное подразделение Федерального государственного
бюджетного научного учреждения Уфимского федерального исследовательского центра РАН,
Россия, 450054 Уфа, просп. Октября, 71
*e-mail: tsynth@anrb.ru
Поступила в редакцию 29.12.2020 г.
После доработки 11.01.2021 г.
Принята к публикации 13.01.2021 г.
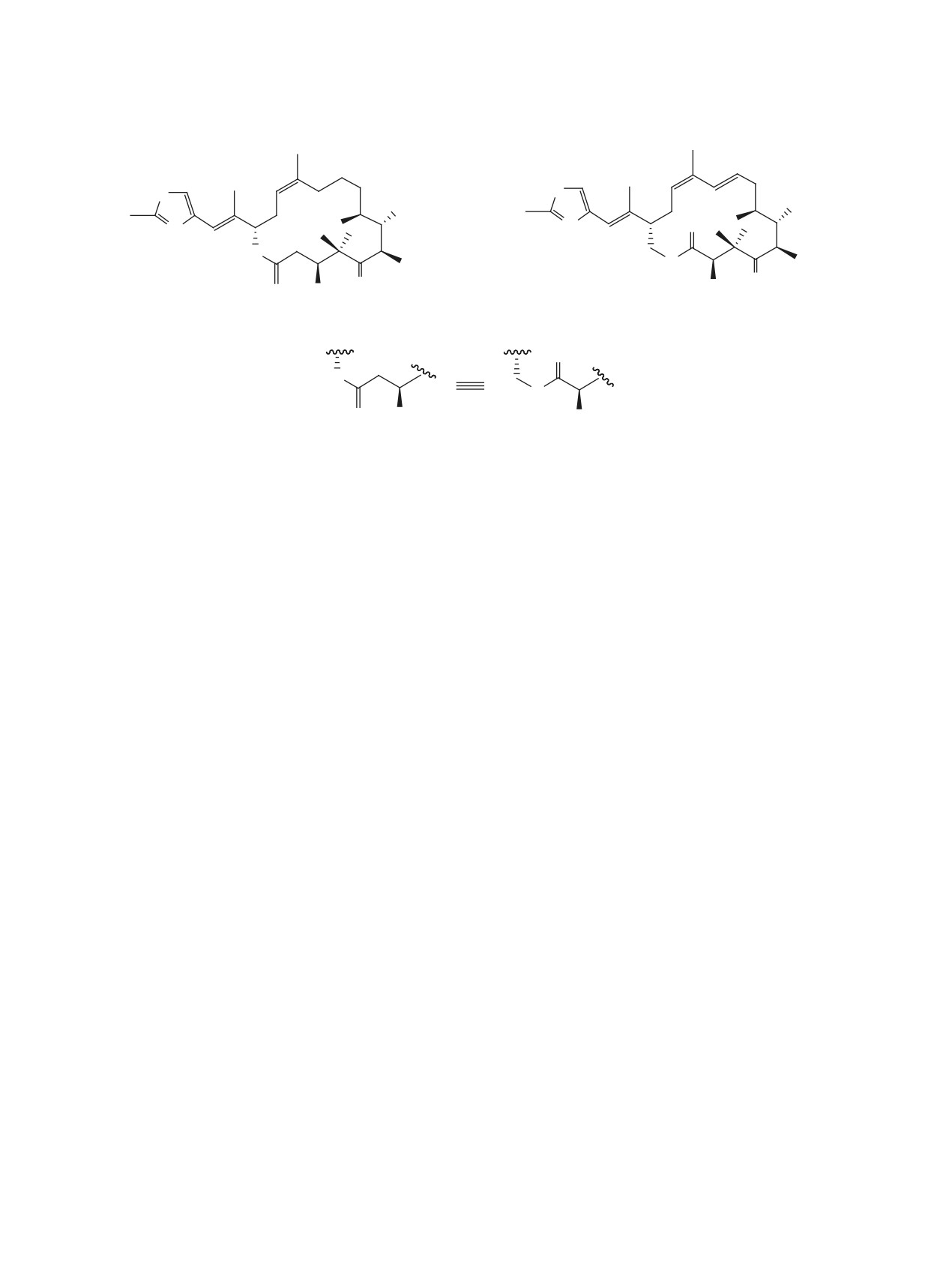
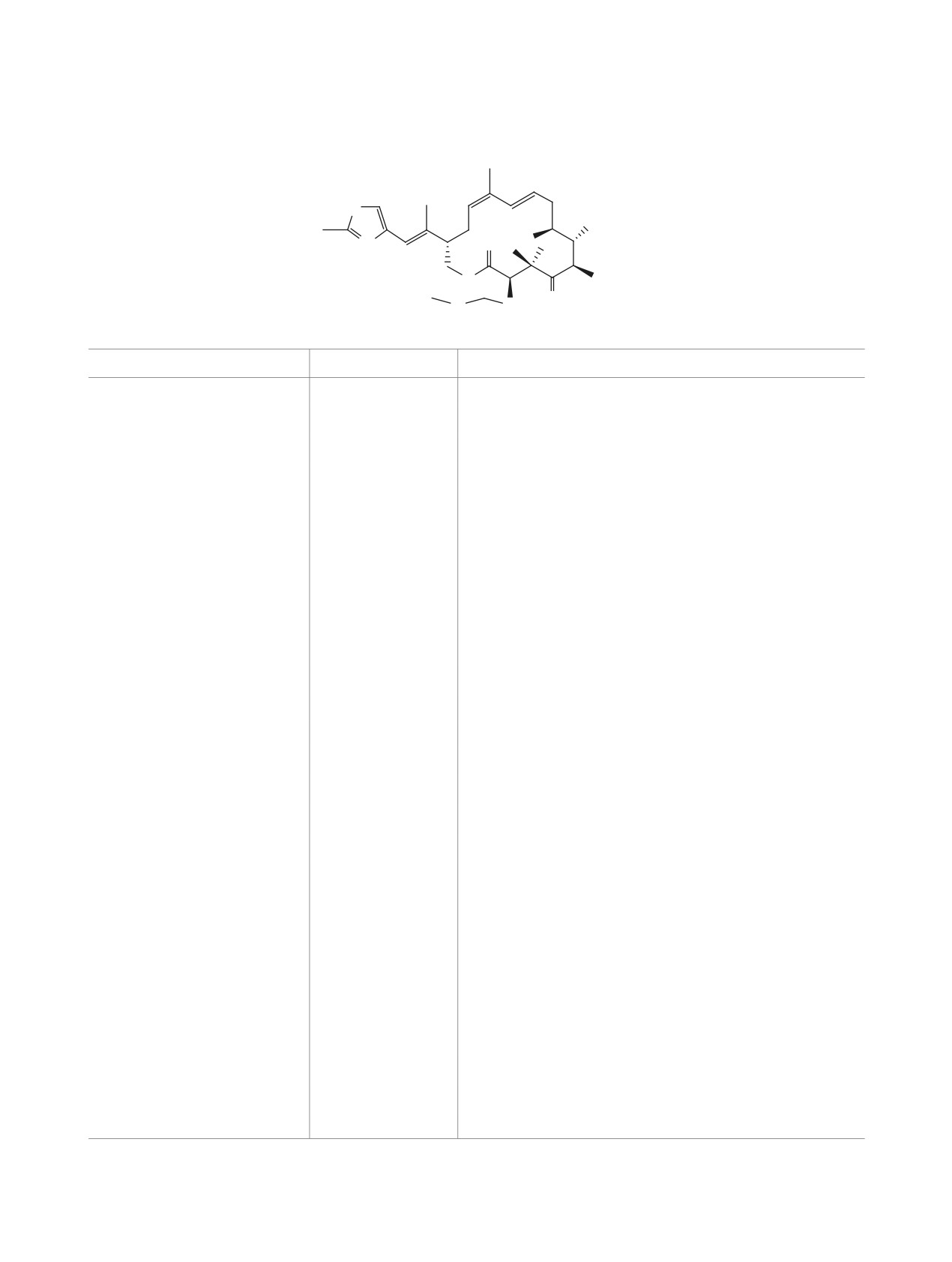
Синтезирован хиральный 10,11-дидегидроаналог эпотилона D с изостерическим замещением на участке
С15-С3 природных эпотилонов.
Ключевые слова: эпотилон D, аналоги, синтез, источники хиральности, R-(-)-карвон, R-(-)-пантолак-
тон, S-(+)-оксазолидин-2-он Эванса, межмолекулярная этерификация, реагенты Ямагучи и Мукаяма,
метатезисное циклозамыкание, реагент Граббса
DOI: 10.31857/S0514749221060033
ВВЕДЕНИЕ
Целью данной работы было получение нового
Эпотилоны (Epo) - таксолоподобного действия
«глубоко» модифицированного диенового аналога
Epo D 1, в котором С3-С15-фрагмент А природ-
макролиды - представляют интерес в качестве ос-
новы (scaffold) в дизайне и синтезе новых структур
ного Epo D заменен на изостерный фрагмент В
с высокой противоопухолевой активностью [1, 2].
(рис.
1). Полагаем, что преобразование С15-
Основная задача таких исследований - получение
аллилово-спиртового фрагмента А в Epo D на
метаболически и химически более устойчивых и
гомоаллиловую группу в соединении 1 приведет
более активных аналогов по сравнению с природ-
к заметному увеличению химической устойчиво-
ными Еро. К настоящему времени изучено влия-
сти последнего. Кроме того, наличие в структуре
ние на биологическую активность таких структур-
1 Δ10,11-двойной связи, как и в Epo 190, приведет
ных модификаций как замена тиазольной части
к увеличению противоопухолевой активности
на ароматические фрагменты, функционализация
[8].
С11-С12-двойной связи, вариации с заместителями
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
в боковой цепи при С5, расширение макроцикла,
замена лактонной функции на лактамную и др.
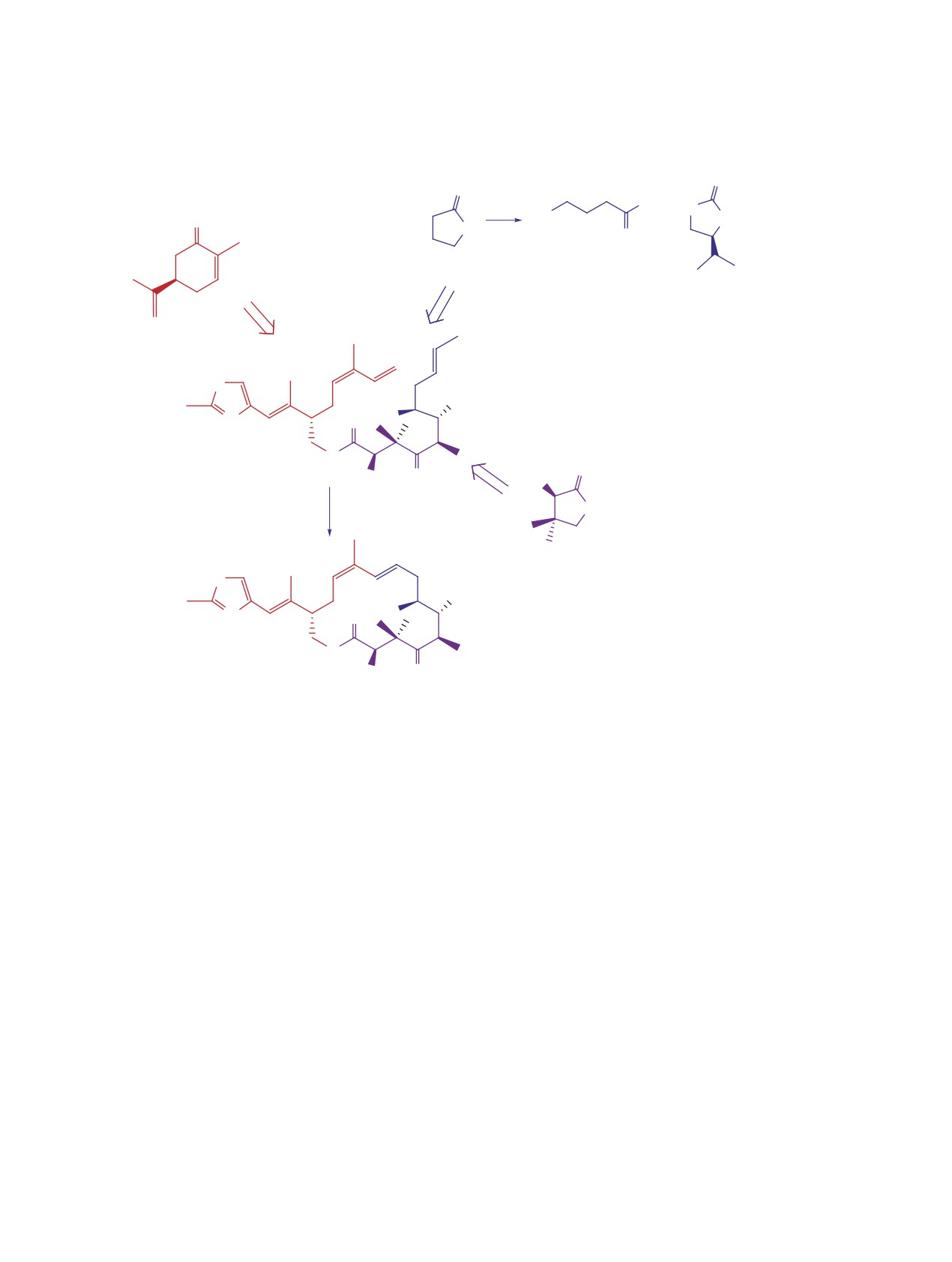
В основу синтеза принят линейный подход,
[3-6].
предполагающий поэтапное сочетание отдельно
Из числа исследуемых в настоящее время Еро
приготовленных хиральных субъединиц, которые
полусинтетический лактам Epo B ixabepilone
были синтезированы по ранее разработанным
разрешен управлением по санитарному надзору
схемам из коммерчески доступных R-(-)-карвона,
за качеством пищевых продуктов и медикамен-
R-(-)-пантолактона, γ-бутиролактона и S-(+)-
тов США (Food and Drug Administration, FDA) в
оксазолидин-2-она Эванса при построении хи-
2007 г. и применяется для лечения агрессивных
рального Me-содержащего центра в данном блоке.
и невосприимчивых форм метастатического рака
На завершающей стадии синтеза 1 планировали
молочной железы [7].
использовать технологию Ru-катализируемого
802
СИНТЕЗ НОВОГО 10,11-ДИДЕГИДРОАНАЛОГА ЭПОТИЛОНА D
803
10
9
S
S
OH
OH
15
7
N
O
N
O
2
O
3
5
O
O
HO
O
HO
Epo D
1
O
O
O
O
HO
HO
A
B
Модифицирование на участке С3-С15 природного Epo D
метатезисного циклозамыкания (RCM)
[9,
10]
и альдегида 7 [16] с получением соединения 8. В
ациклического предшественника 1 (схема 1).
свою очередь использованный в той реакции блок
7 синтезировали по методу асимметрического
Блок 5, предназначенный для использования
алкилирования Эванса с участием 4-бромбути-
при построении верхней полусферы 1, синтези-
роилхлорида и MeI [17, 18]. Дальнейшее продви-
ровали из R-карвона (схема 2) через ацикличе-
жение от соединения 8 к соединению 12 включа-
ское моно TBS-производное соответствующего
ло стадии блокировки свободной гидроксильной
диола - спирт 2. 12-Стадийный синтез спирта 2,
группы 8 в виде TES-эфира 9 и стадию олефиниро-
описанный нами ранее [11], был улучшен и чис-
вания 9 по Джулиа-Кочински с ацетальдегидом. В
ло стадий сокращено до 10 [12]. Блок 2 привлека-
отличие от терминальных, полученный «внутрен-
телен прежде всего тем, что содержит стереохи-
ний» E-алкен, согласно [19, 20], должен быть ме-
мически чистую «происшедшую» из R-карвона
нее подверженным изомеризации и ациклической
тризамещенную Z-двойную связь Epo. Далее на
полимеризации в условиях метатезиса. Переход
пути к соединению 5 тиазолсодержащий спирт 2
соединений 10→11→12 был выполнен без слож-
ввели в реакцию TEMPO-катализируемого окис-
ностей по известным методикам и кислота 12 была
ления PhI(OAc)2 [13] и с высоким выходом полу-
введена в следующую стадию межмолекулярной
чили альдегид 3. Осуществить метиленирование
этерификации.
альдегида 3 in situ генерируемым метилентрифе-
нилфосфораном не удалось. При этом выход со-
Полученные спирт 5 и кислота 12 были испы-
единения 4 был крайне низким, основным продук-
таны в стандартных условиях межмолекулярной
том реакции была низкополярная смолообразная
этерификации по Ямагучи [21]. Для активации
масса (предположительно промежуточные бетаи-
вначале кислоту 12 обработкой 1,4,6-трихлорбен-
ны). Напротив, желаемый триен 5 был получен с
зоилхлоридом в ТГФ в присутствии Et3N превра-
хорошим выходом в условиях олефинирования по
щали в смешанный ангидрид, в массу при переме-
Джулиа-Кочински [14]. Снятие TBDPS-защитной
шивании добавляли спирт 5 и затем в течение 5 ч
группы в соединении 4 гладко протекает в системе
прикапывали раствор 0.25 экв 4-(диметиламино)-
CH2Cl2-MeOH-p-TSAcat и приводит к одному из
пиридина (DMAP) в ТГФ. При этом по ТСХ на-
ключевых блоков 5.
блюдали образование двух соединений, которые
Блок 6 для нижней полусферы 1 синтезирова-
были выделены колоночной хроматографией на
ли из R-(-)-пантолактона (схема 3) [15]. Также в
SiO2. Минорный продукт (~7%) по структуре со-
наших предыдущих публикациях были приведе-
ответствовал образцу соединения 14, полученного
ны результаты альдольной конденсации кетона 6
ацилированием спирта 12 трихлорбензоилхлори-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
804
ВАЛЕЕВ и др.
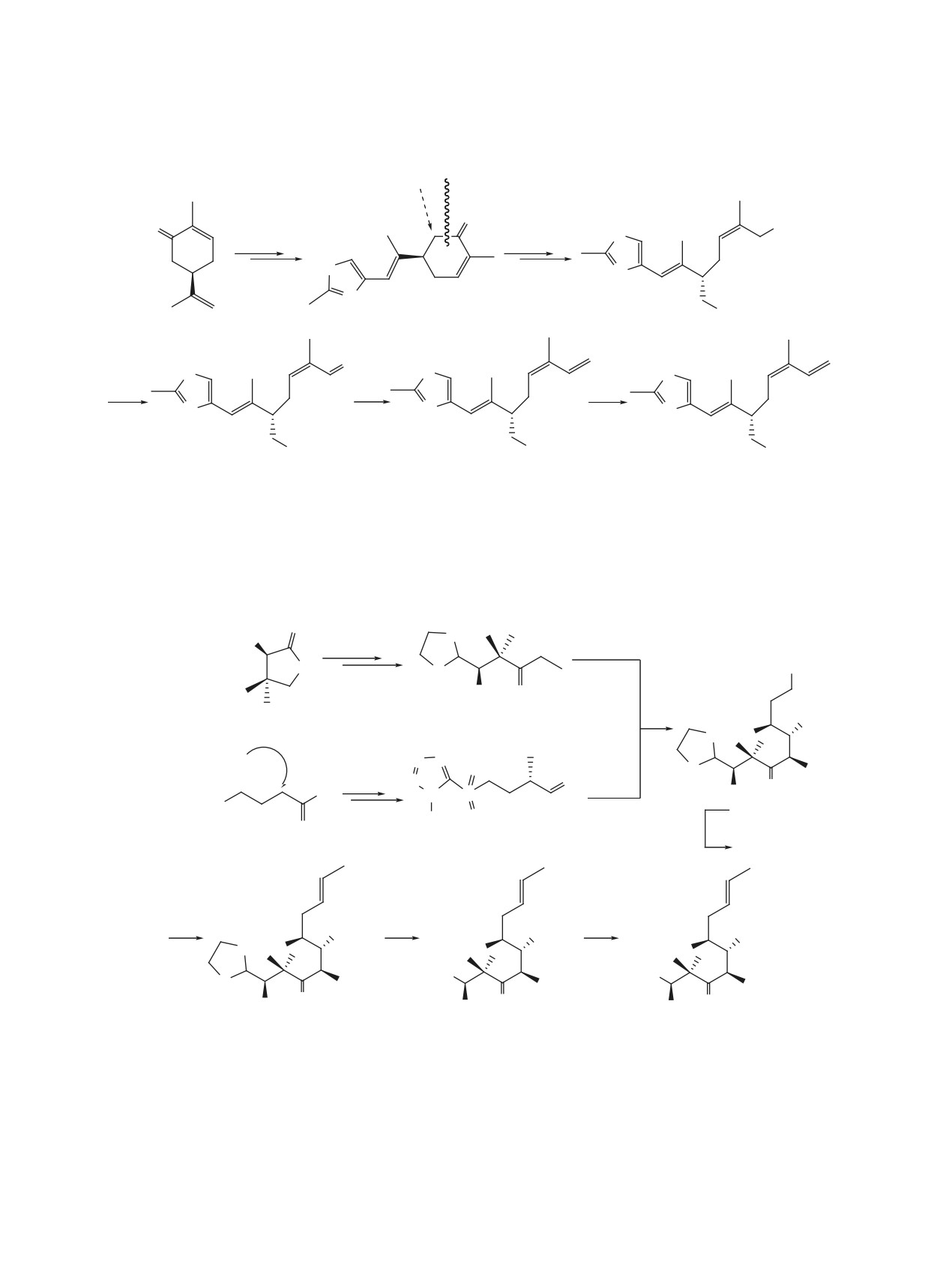
Схема 1
O
O
Cl
O
Br
O
+
NH + MeI
O
O
γ-бутиролактон
S-(+)-оксазолидин-2-он
R-(-)-карвон
S
OH
N
O
O
O
HO
O
HO
RCM
O
R-(-)-пантолактон
S
OH
N
O
O
RO
O
1
Новый Epo D
аналог
R = H, MOM; MOM-метоксиметил.
дом в стандартных условиях (схема 4). Выход ос-
На следующей стадии полученный по схе-
новного продукта 13 был на уровне 21%.
ме 4 (вариант а) блок 13 испытали в ключевой
RCM-реакции с использованием Ru-катализатора
Для удобства восприятия структурная формула
Граббса ІІ поколения в условиях высокого разбав-
13 и данные спектров приведены ниже в табл. 1.
ления (10 ммоль) и после обработки реакционной
Касательно «происхождения» соединения 14
массы, ожидаемый продукт циклизации соедине-
(схема 5) отметим, что побочный продукт обра-
ния 15 выделили с выходом 20% (схема 6).
зовался в результате атаки спирта по трихлорбен-
Однако, согласно спектральным данным, по-
зоильной карбонильной группе в промежуточном
лученное соединение представляло собой смесь
смешанном ангидриде А (путь b). В альтернатив-
ном варианте, чтобы исключить нежелательное
двух изомеров в соотношении ~1:1.5 (ЯМР 1Н).
побочное направление для активации кислотной
При этом, вновь образованная 10,11-двойная связь
компоненты 12, использовали реагент Мукаямы
у обоих изомеров была трансоидной (J 15.5 Гц). К
[22]. В этом случае минимизировано образование
тому же возможная Z,E-изомеризация в C12 центре
подобных соединению 14 побочных продуктов
также исключалась, поскольку в спектре ЯМР 13С
взаимодействия спирта с интермедиатом В и вы-
обоих изомеров сдвиги C12-Me были одинаковыми
ход эфира 13 составил 45%.
(δС12 20.50 м.д.). Поэтому возможность образова-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ НОВОГО 10,11-ДИДЕГИДРОАНАЛОГА ЭПОТИЛОНА D
805
Схема 2
HO
Оксигенирование
расщепление
по Рубботому
O
O
OH
S
3 стадии
7 стадий
S
N
N
OTBS
R-(-)-карвон
2
O
S
S
S
a
b
c
N
N
N
OTBS
OTBS
OH
3
4
5
Реагенты и условия: a, TEMPO, PhI(OAc)2, CH2Cl2, 20°С, 6 ч, 92%; b, MeSO2PT, KHMDS, ТГФ, -78°C,
30 мин, 88%; c, p-TSA, CH2Cl2-MeOH (1:1), 20°С, 5 ч, 95%.
TEMPO - (2,2,6,6-тетраметилпиперидин-1-ил)оксил, PhI(OAc)2 - фенилйоддиацетат,
MeSO2PT - 5-(метилсульфонил)-1-фенил-1H-тетразол,
KHMDS - гексаметилдисилазид калия.
Схема 3
O
S
HO
8 стадий
Li-HMDS
O
SO2PT
S
MOMO O
R-(-)-пантолактон
6
OR
S
Асимметрическое
N
N
алкилирование
O
S
Эванса
6 стадий
N
O
O
Cl
N
S
MOMO
Br
8, R = OH
Ph O
O
a
4-бромбутироилхлорид
7
9, R = OTES
b
c
d
OTES
OTES
OTES
S
OHC
HO2C
S
O
O
O
MOMO
MOMO
MOMO
10
11
12
Реагенты и условия: a, Et3SiOTf, 2,6-лутидин, CH2Cl2, 0-5°C, 20 мин, 77%; b, KHMDS, -78°C, ТГФ,
10 мин, затем CH3CHO, -78°C, 20 мин, 83%; c, CaCO3, MeI, Me2CO-H2O (4:1), 50-60°C, 72 ч, 69%
за две стадии; d, 2,3-диметилбутен-2, NaClO2, Na2HPO4, t-BuOH-ТГФ-H2O (5:5:1), 16 ч, 20°C, 81%
Et3SiOTf - триэтилсилилтрифлат, KHMDS - гексаметилдисилазид калия,
t-BuOH - 2-метилпропанол-2.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
806
ВАЛЕЕВ и др.
Схема 4
S
S
a
Cl
OTES
N
O
+
12
или b
N
O
O
Cl
O
O
MOMO
Cl
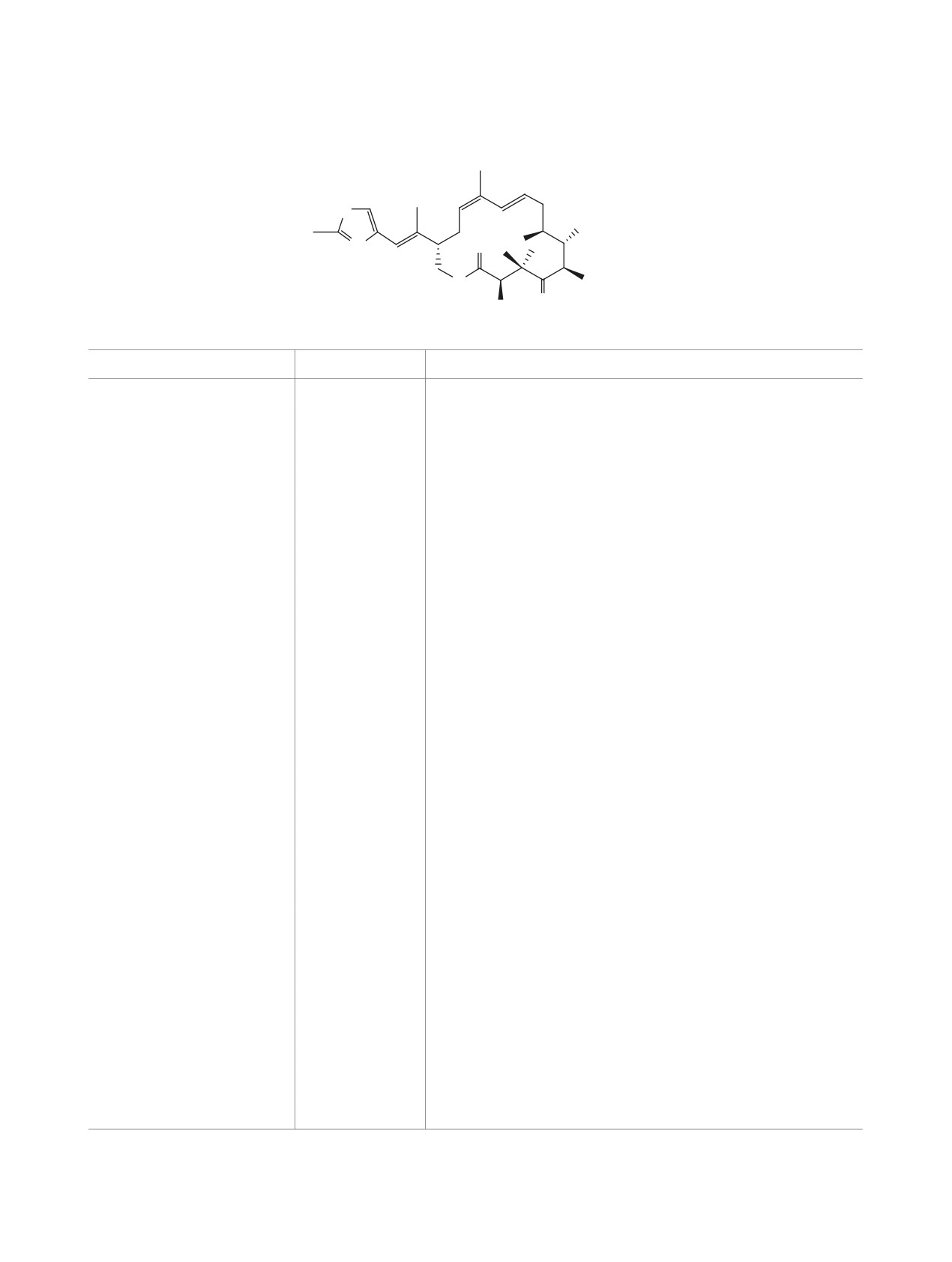
13: a, 21%, b, 45 %
14: a, 5%, b, 0%
Реагенты и условия: a, 2,4,6-трихлорбензоилхлорид, Et3N, ТГФ, 20°С, 2 ч, затем 5, DMAP в ТГФ, 5 ч;
b, 2-хлор-1-метилпиридиний иодид, Bu3N, ТГФ.
Таблица 1. ЯМР 1H и 13С эфира 13
11
10
5'
7'
9
1'''
5'''
4'
8
S
6'
2'''
4'''
1''
OTES
2'
3'
6
7
N
O
2''
3'''
1'
5
2
4
1
3
O
O
MOMO
13
Номер атома
13C, acetone-d6
1H, acetone-d6
1
171.23
-
2
81.20
4.38 c (1H, 2-H)
3
51.69
-
3-CH3
20.42
1.16 c (3H, 3-CH3)
3-CH3
22.70
1.30c (3H, 3-CH3)
4
216.37
-
5
44.79
3.26 м (1Н, 5-Н)
5-СН3
15.60
1.08 д (3Н, J 6.9 Гц, 5-СН3),
6
78.67
3.86 м (1H, 6-H)
СН2ОSiEt3
5.91
0.67 м (6Н, SiCH2)
СН3ОSiEt3
7.22
0.99 м (9Н, SiCH2CH3)
7
38.92
1.46 м (1Н, 7-Н)
7-CH3
17.68
0.89 д (3Н, J 6.9 Гц, 7-СН3)
1.76 м (1-Н, 8-НA)
8
34.65
2.20 м (1Н, 8-НB)
9
131.05
5.40 м (1H, 9-H)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ НОВОГО 10,11-ДИДЕГИДРОАНАЛОГА ЭПОТИЛОНА D
807
Таблица 1. (продолжение).
Номер атома
13C, acetone-d
1H, acetone-d6
6
10
126.54
5.42 м (1H, 10-H)
11
1.63 д (3Н, J 4.7 Гц, 11-Н)
5.10 д (1H, Jцис 10.9 Гц, 7'-Hцис)
7’
114.19
5.23 д (1H, J
17.1 Гц, 7'-Hтранс),
транс
6'
134.18
6.87 д.д (1H, J 17.1, 10.9 Гц, 6'-H)
5'
5'-CH3
19.92
1.79 с (3Н, 5'-СН3)
4'
128.98
5.45 м (1H, 4'-H)
2.41 д.т (1H, J 14.6, 8.1, 7.3 Гц, 3'-H)
3'
28.59
2.52 д.д.д (1H, J 14.6, 7.3, 7.3 Гц, 3'-H)
2'
49.74
2.65 м (1H, 2'-H)
4.15 д.д (1H, J 11.0, 6.0 Гц, 1'-HA)
1'
66.56
4.32 д.д (1H, J 11.0, 8.2 Гц, 1'-H
)
B
OCH2O
97.56
4.56 м (2H, OCH2O)
CH3O
56.45
3.27 c (3H, CH3O)
2''
122.04
6.37 с (1H, 2''-H)
1''
139.26
-
1''-CH3O
15.74
2.11 с (3Н, 1''-CH3)
1'''
-
-
2'''
164.71
-
2'''-CH3
18.93
2.66 c (3H, 2'''-CH3)
3'''
-
-
4'''
155.74
-
5'''
116.58
7.13 с (1H, 5'''-H)
a Сигналы ЯМР 1Н и 13С приведены для образца индивидуального 13, полученного с использованием реагента Мукаяма (мето-
дика для 13, опыт b)
ния 12-E-изомера исключалась, равно, как и изоме-
мерных соединений 15a, b этот вариант далее не
рии по С7 центру. Напротив, здесь вполне реальна
разрабатывался.
изомерия по С3-центру, этот центр может инвер-
Структурные формулы и спектральные данные
тироваться через енолообразование. Наблюдаемые
индивидуального стереоизомера 15а и его изомера
в спектре значительные различия в сдвигах сигна-
15b приведены ниже в табл. 2 и в табл. 3.
лов С1', C15, C14 могут быть связаны с транс-ан-
Полагая, что в условиях получения соединения
нулярным влиянием OMOM-заместителя в 3α-
13 по Ямагучи (схема 4, путь а), а также в ходе
эпимере 15b.
циклизации эфира 13 на катализаторе Граббса
Из-за низких выходов на стадии этерификации
вполне возможна эпимеризация в его С3-центре, в
по Ямагучи и образования трудноразделимых изо-
реакцию был введен образец соединения 13, полу-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
808
ВАЛЕЕВ и др.
Схема 5
O Cl
O
Cl
Cl
R'
R O
Cl
O O
a
13
Cl
Cl
O
R O
Cl
Ямагучи
b
R'
a
O
Cl
b Cl
HO-R'
Cl
A
14
12
-
+
I
Br
N
O
O
Me
-
+
I
R'
+
Мукаяма
R
O
N
R O
O
N
Me
Me
HO-R'
B
13
R' - спиртовая компонента в эфире 13
R - кислотная компонента в эфире 13
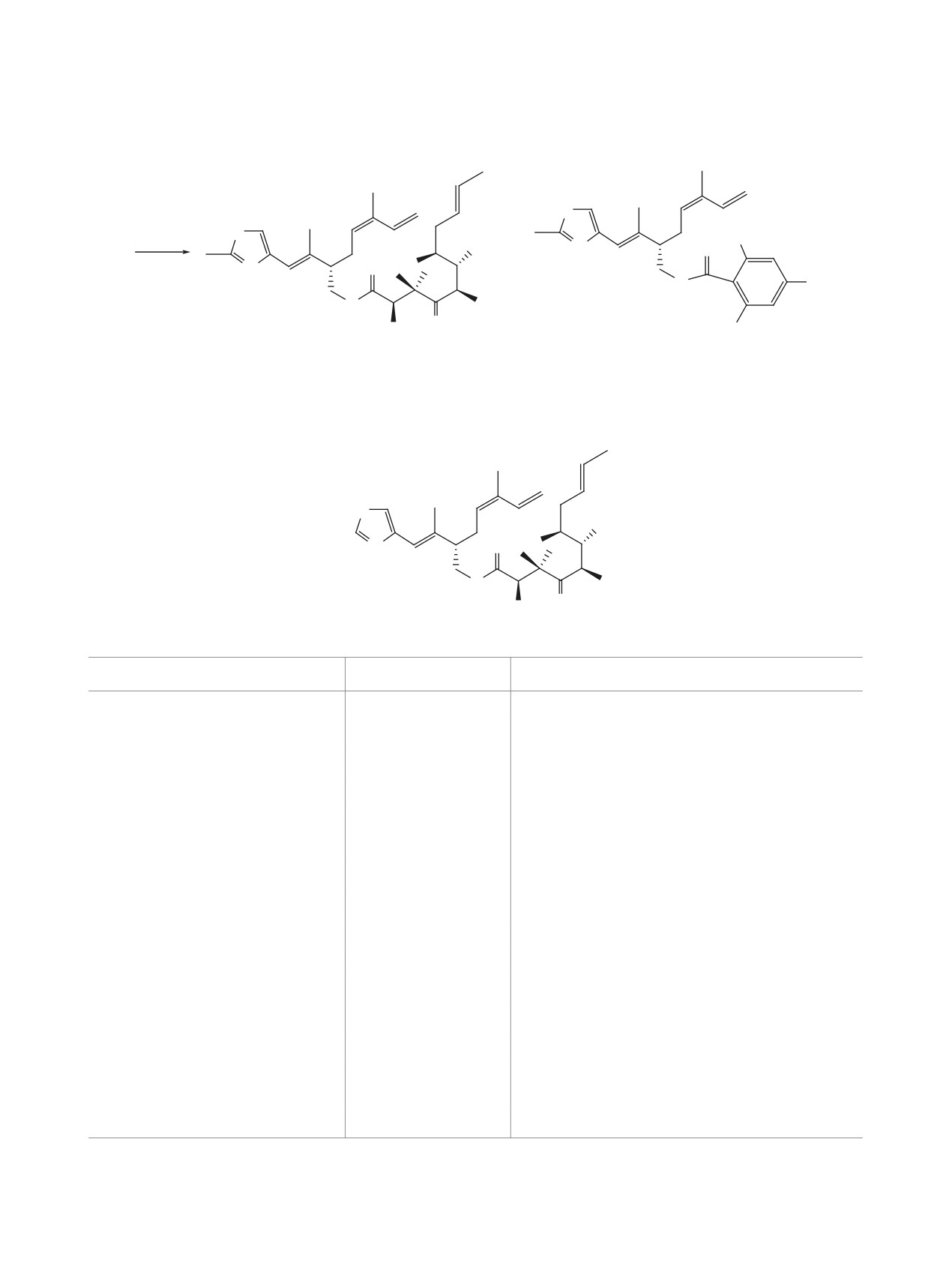
ченный по методу Мукаямы (схема 4, путь b), су-
Деблокирование MOM-защитной группы в со-
щественно сократив при этом время реакций, как
единении 1 оказалось затруднительным, несмотря
на стадии этерификации, так и на стадии циклиза-
на апробацию ряда методов [23]. Поэтому в био-
ции. В этом случае выход соединений 15 удалось
тестировании был испытан MOM-эфир 1, который
проявил умеренную цитотоксичность в отноше-
поднять до 45% и получить индивидуальный сте-
нии испытанных линий раковых клеток (Hek293,
реоизомер 15а. Кислотный гидролиз 15а привел к
SH-SY5Y, MCF-7, A549). Очевидно, наличие
соединению 1 с выходом 60% (схема 7).
MOM-защитной группы в фармакологически зна-
Структурная формула и спектральные дан-
чимом С3-гидроксиле значительно снижает ток-
ные целевого аналога Epo 1 приведены ниже в
сичность. Видимо, предпринятое «глубокое» мо-
табл. 4.
дифицирование на участке C15-C3 (А на В, рис.1)
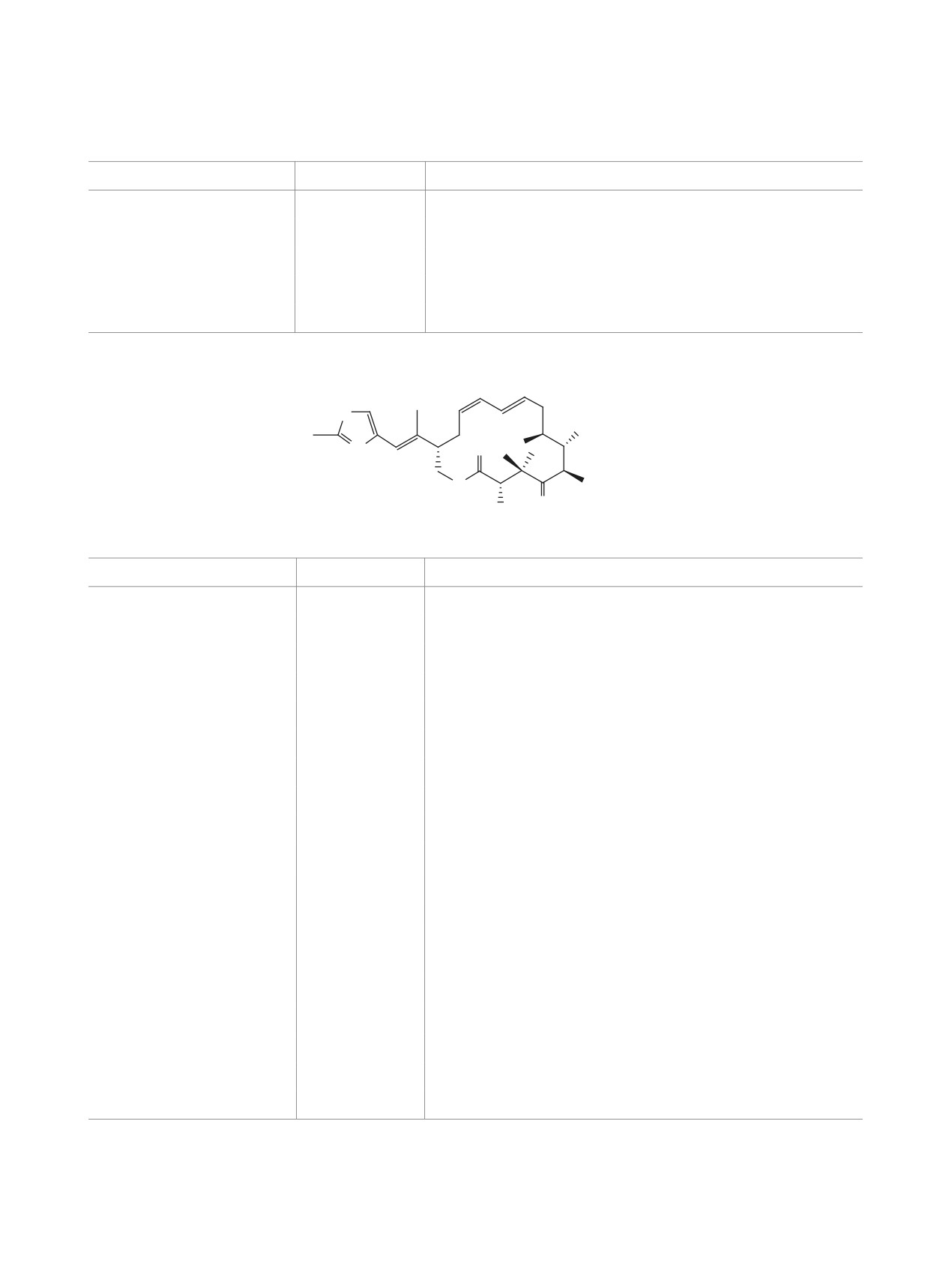
Схема 6
S
S
a
OTES
OTES
13
O
+
O
N
N
O
O
O
O
MOMO
MOMO
15a
15b
Реагенты и условия: a, Граббс ІІ (10 мол %), CH2Cl2 (1.0 ммоль), 20°С, 12 ч, 20%.
Граббс ІІ - [1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден]дихлор(фенилметилен)-
(трициклогексилфосфин)рутений.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ НОВОГО 10,11-ДИДЕГИДРОАНАЛОГА ЭПОТИЛОНА D
809
Таблица 2. ЯМР 1H и 13С мажорного изомера 15а
12
10
5''
13
9
1''S
11
4''
2'
14
OTES
15
7
2''
8
N
O
1'
3''
6
16
1
3
5
2
4
O
O
MOMO
15a
Номер атома
13C, CDCl3
1H, CDCl3
1
-
-
2
170.52
-
3
80.00
4.43 с (1H, 3-H)
4
51.81
-
4-CH3
20.69
1.08 с (3H, 4-CH3)
4-CH3
23.10
1.32 с (3H, 4-CH3)
5
216.77
-
6
44.26
3.22 м (1H, 6-H)
6-CH3
16.73
1.10 д (3H, 3J 6.8 Гц, 6-CH3)
7
78.15
3.85 д.д (1H, 3J7-8 7.7, 3J6-7 1.8 Гц, 7-H)
8
39.78
1.44 м (1H, 8-H)
8-CH3
18.25
1.03 д (3H, 3J 6.9 Гц, 8-CH3)
2.03 м (1H, 9-HA)
9
35.50
2.20 м (1H, 9-HB)
10
129.12
5.74 д.д.д (1H, 3J10-13 15.7, 3J10-9A 10.7, 3J10-9B 4.3 Гц, 10-H)
11
128.99
6.71 д (1H, 3J11-10 15.7 Гц, 11-H)
12
133.50
-
12-CH3
20.50
1.80 с (3H, 12-CH3)
13
126.17
5.36 д.д (1H, 3J13-14B 11.4, 3J13-14B 5.2 Гц, 13-H)
2.11 м (1H, 14-HA)
14
27.65
3.02 д.д.д (1H, 2J 13.6, 3J14B-13 11.4, 3J14B-15 6.1 Гц, 14-HB)
15
48.06
2.34 м (1H, 15-H)
16
65.23
4.22 м (2H, 16-H)
OCH2O
96.90
4.67 с (2H, OCH2O)
CH3O
56.84
3.36 с (3H, CH3O)
1'
120.02
6.38 с (1H, 1'-H)
2'
139.86
-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
810
ВАЛЕЕВ и др.
Таблица 2. (продолжение).
Номер атома
13C, CDCl3
1H, CDCl3
3'
17.71
2.09 с (3H, 3'-H)
4''
153.04
-
5''
115.26
6.90 с (1H, 5''-H)
(CH2-SiEt3)
7.07
0.98 м (6H, CH2-SiEt3)
(CH3-SiEt3)
5.49
0.64 м (9H, CH3-SiEt3)
Таблица 3. ЯМР 1H и 13С минорного изомера 15b
10
12
9
1''S
5''
13
11
2'
14
OTES
7
2''
4''
8
N
15
O
1'
3''
6
16
1
3
5
2
4
O
O
MOMO
15b
Номер атома
13C, CDCl3
1H, CDCl3
1
-
-
2
170.59
-
3
80.28
4.52 с (1H, 3-H)
4
51.45
-
4-CH3
20.82
1.14 с (3H, 4-CH3)
4-CH3
23.52
1.32 с (3H, 4-CH3)
5
217.44
-
6
44.78
3.23 м (1H, 6-H)
6-CH3
16.96
1.11 д (3H, 3J 6.8 Гц, 6-CH3)
7
78.22
3.85 д.д (1H, 3J7-8 7.9, 3J6-7 1.7 Гц, 7-H)
8
39.82
1.48 м (1H, 8-H)
8-CH3
18.31
1.01 д (3H, 3J 6.9 Гц, 8-CH3)
2.04 м (1H, 9-HA)
9
34.46
2.22 м (1H, 9-HB)
10
129.26
5.79 д.д.д (1H, 3J10-13 15.5, 3J10-9A 9.3, 3J10-9B 4.9 Гц, 10-H)
11
129.38
6.69 д (1H, 3J11-10 15.7 Гц, 11-H)
12
134.52
-
12-CH3
20.50
1.79 с (3H, 12-CH3)
13
124.43
5.35 д.д (1H, 3J13-14B 9.9, 3J13-14B 7.1 Гц, 13-H)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ НОВОГО 10,11-ДИДЕГИДРОАНАЛОГА ЭПОТИЛОНА D
811
Таблица 3. (продолжение).
Номер атома
13C, CDCl3
1H, CDCl3
2.43 м (1H, 14-HA)
14
27.39
2.58 м (1H, 14-H
B
)
15
49.62
2.59 м (1H, 15-H)
3.97 д.д (1H, 2J 10.7, 3J16A-15 11.2 Гц, 16-HA)
16
65.76
4.37 д.д (1H, 2J 10.7, 3J
3.4 Гц, 16-HB)
16B-15
4.73 д (1H, 2J 7.0 Гц, HA-OCH2O)
OCH2O
97.17
4.78 д(1H, 2J 7.0 Гц, H
B
-OCH2O)
CH3O
56.99
3.42 с (3H, CH3O)
1'
120.04
6.28 с (1H, 1'-H)
2'
138.83
-
3'
18.00
2.08 с (3H, 3'-H)
1''
-
-
2''
164.52
-
2''-CH3
19.19
2.71 с (3H, 2''-CH3)
3''
-
-
4''
152.95
-
5''
115.32
6.90 с (1H, 5''-H)
(CH2-SiEt3)
7.10
0.98 м (6H, CH2-SiEt3)
(CH3-SiEt3)
5.52
0.65 м (9H, CH3-SiEt3)
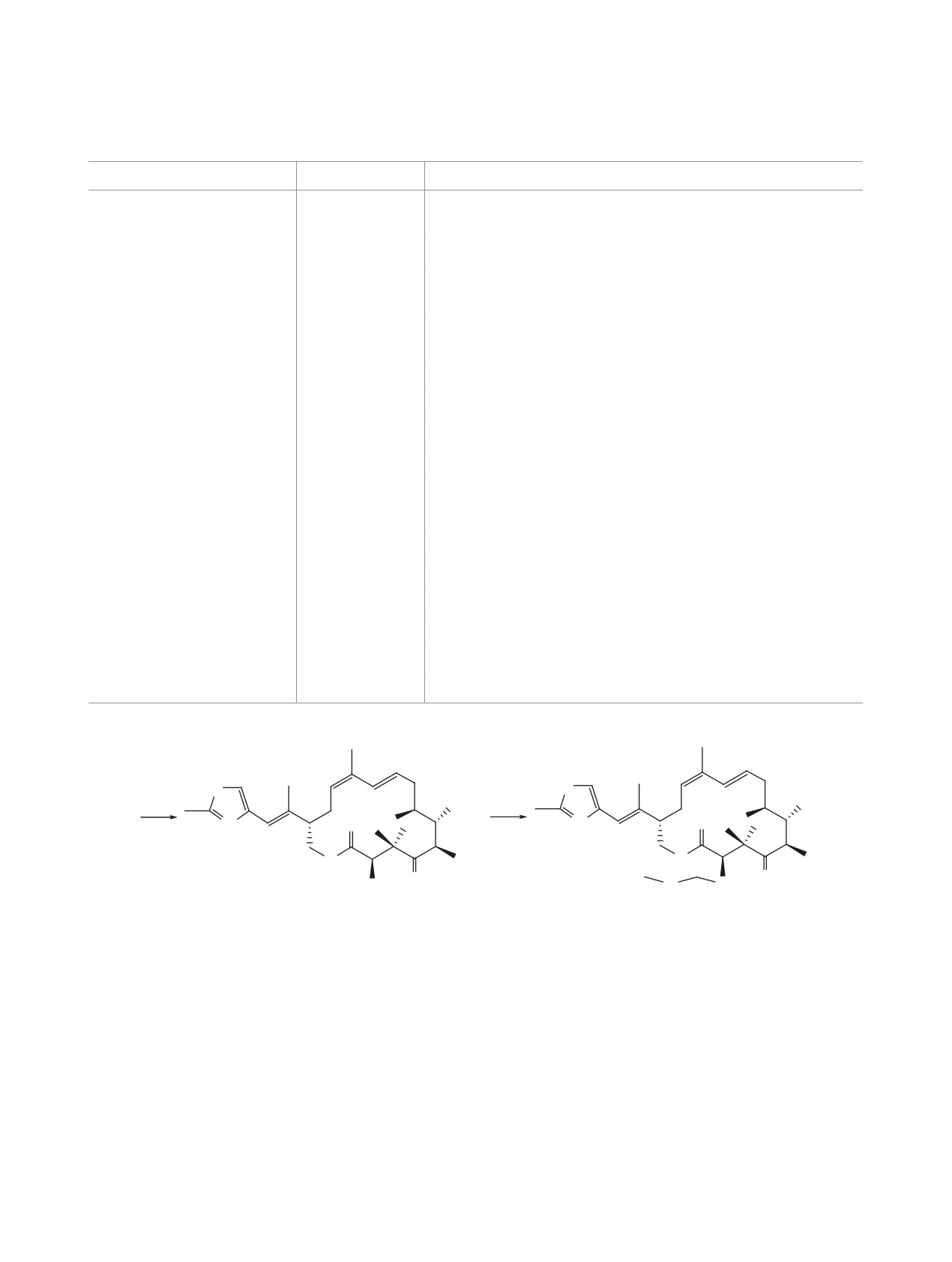
Схема 7
S
S
a
OTES
b
OH
13
O
N
O
N
O
O
O
O
MOMO
O
O
15a
1
Реагенты и условия: а, Граббс ІІ (10 мол %), CH2Cl2 (1.0 ммоль), 20°С, 5 ч, 45%;
b, CSA (15 мол %), MeOH-EtOH (1:1).
CSA - камфора-10-сульфокислота
также нежелательно, при модифицировании сле-
ха, очевидно, на ранних стадиях следует заменить
дует придерживаться максимального сохранения
MOM-защитную группу на другую более лабиль-
структуры Epo B. Но в то же время эфир 1 ожидае-
ную группу.
мо отличился химической стабильностью, не пре-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
терпевал изменений даже при достаточно жестких
условиях кислотного гидролиза MOM-эфиров
Растворители были очищены и высушены
(MeOH, H+-смолы, Δ; HCl-MeOH и др.). Для успе-
стандартными процедурами перед использо-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
812
ВАЛЕЕВ и др.
Таблица 4. ЯМР 1H и 13С соединения 1
12
10
11
9
5''
13
1''S
4''
2'
8
OH
15
14
7
2'' N
O
3''
1'
6
16
1
3
5
2
4
O
O
O
O
1
Номер атома
13C, CDCl3
1H, CDCl3
1
-
-
2
170.1
-
3
78.65
4.37 с (1Н, 3-Н)
4
52.5
-
4-CH3
21.5
1.00 c (3Н, 4-СН3)
4-CH3
20.5
1.30 c (3Н, 4-СН3)
5
218.4
-
6
40.1
3.27 д.к (1Н, 3J 6.8, 3J 2.4 Гц, 6-H)
6-CH3
12.25
1.02 д (3Н, J 6.8 Гц, 6-СН3)
7
72.35
3.76 д.д (1Н, J 2.0, 6.8 Гц, 7-H)
7-OH
-
3.45-3.36 м (1Н)
8
36.36
1.95 пентет (1Н, J 6.7 Гц, 8-H)
8-CH3
16.26
0.99 с (3Н, 8-СН3),
9
36.15
2.05-2.12 м (1Н, 9-H)
10
130.2
5.70 д.д.д (1Н, J 6.0, 15.3, 8.9, 6.0 Гц, 10-Н)
11
134.8
6.44 д (1Н, J 15.7 Гц, 11-Н)
12
141.1
-
12-CH3
17.8
2.08 с (3H, 12-СН3)
13
128.6
5.26 д.д (1Н, J 5.1, 9.5 Гц, 13-H)
14
28.42
2.50-2.60 м (2Н, 14-H)
15
48.3
2.25 д.т (1Н, J 5.3, 12.3 Гц, 15-H)
4.35 д.д (1Н, J 5.9, 11.0 Гц, 16-H)
16
65.62
4.04-4.14 д.д (1Н, J 4.6, 11.0 Гц, 16-H)
1'
124.6
6.40 с (1Н, 1'-H)
2'
140.8
-
2'-CH3
17.8
1.76 с (3H, 2'-СН3)
OCH2O
96.9
4.67 к (2Н, J 7.0Гц)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ НОВОГО 10,11-ДИДЕГИДРОАНАЛОГА ЭПОТИЛОНА D
813
Таблица 4. (продолжение).
Номер атома
13C, CDCl3
1H, CDCl3
CH3O
56.6
3.37 с (3H, ОСН3)
1''
-
-
2''
165.3
-
2''-CH3
20.2
2.74 с (3H, 2''-СН3)
3''
-
-
4''
151.7
-
5''
115.2
6.94 с (1Н, 5'-CH3)
ванием. Реагенты производства
«Alfa-Aestar»
м
(1Н,
=CHCH),
2.66-2.76 м
(4H, N=CCH3,
(США),
«Sigma-Aldrich» (США),
«Lancaster»
=CHCH), 2.89-3.04 м (1Н, CH2CH), 3.60-3.66
(Великобритания) были высшего качества и ис-
м (1Н, CHOSi), 3.72-3.77 м (1Н, CHOSi), 6.36 с
пользовались без дальнейшей очистки, если не
(1Н, =CH), 6.53 д.д (1Н, =CH, J 8.1, 7.2 Гц), 6.88 с
указано иное. В работе использовали оборудова-
(1Н, =CHS), 10.16 с (1Н, HC=O). Спектр ЯМР 13С
ние ЦКП «Химия» УфИХ РАН. ИК спектры за-
(125 МГц, CDCl3-CHCl3), δ, м.д.: -5.5, 16.5, 16.9,
писывали на спектрофотометре UR-20 в тонком
18.2, 19.1, 25.8, 26.8, 52.1, 65.3, 115.1, 121.0, 136.6,
слое или вазелиновом масле. Спектры ЯМР 1H и
139.5, 147.7, 152.7, 164.5, 191.2. Mасс-спектр, m/z
13С записаны на спектрометрах Bruker AM-300
(Iотн, %): 381 (20) [M + H]+, 351 (100). Найдено, %: С
[300 МГц (1Н)] и AM-500 [125 МГц (13С)] для рас-
63.4; H 8.8; N 3.5; S 8.3. С20Н33NO2SSi. Вычислено,
творов веществ в CDCl3, (D3C)2CO, внутренний
%: C 63.28; H 8.76; N 3.69; S 8.45. M 379.63.
стандарт - ТМС. Масс-спектры сняты в этаноле
4-[(1E,3S,5Z)-3-({[трет-Бутил(диметил)си-
на спектрометре Shimadzu LCMS-2010 EV. Для
лил]окси}метил)-2,6-диметилокта-1,5,7-триен-
ТСХ анализа применяли хроматографические пла-
1-ил]-2-метил-1,3-тиазол (4). К перемешиваемо-
стины Sorbfil (Россия). Для колоночной хромато-
му раствору 5-(метилсульфонил)-1-фенил-1H-те-
графии применяли силикагель марки «Lancaster»
тразола (0.14 г, 0.63 ммоль) в 10 мл сухого ТГФ
(Великобритания). Оптическое вращение измере-
в атмосфере Ar при -78°C добавляли 1.5 М рас-
но на поляриметре «Perkin-Elmer 241 МС».
твор KHMDS в ТГФ (0.4 мл, 0.63 ммоль). После
(2Z,5S,6E)-5-({[трет-Бутил(диметил)силил]-
перемешивания реакционной смеси в течение
окси}метил)-2,6-диметил-7-(2-метил-1,3-тиа-
20 мин добавляли альдегид 3 (0.16 г, 0.42 ммоль)
зол-4-ил)гепта-2,6-диеналь (3). К раствору спир-
в виде раствора в 3 мл TГФ. Реакционную смесь
та 2 (0.18 г, 0.47 ммоль) в хлористом метилене до-
перемешивали в течение 30 мин при -78°C, затем
бавляли йодбензол диацетат (0.21 г, 0.71 ммоль) и
температуру реакционной массы повышали до
TEMPO (0.02 г, 0.13 ммоль), перемешивали при
комнатной. Добавляли 20 мл насыщенного рас-
комнатной температуре до израсходования ис-
твора NH4Cl, органический слой отделяли, во-
ходного спирта (~6 ч, контроль методом ТСХ).
дный слой обрабатывали этилацетатом (3×20 мл).
Раствор упаривали и остаток хроматографировали
Объединенные органические экстракты сушили
на колонке с SiO2 (элюент 10% EtOAc-петролей-
MgSO4, фильтровали, упаривали, концентриро-
ный эфир). Выход 0.18 г (92%). Желтая масляни-
вали под вакуумом, остаток хроматографировали
стая жидкость, Rf 0.52 (элюент 25% EtOAc-пе-
на SiO2(элюент 9% EtOAc-петролейный эфир).
тролейный эфир), [α]D20 +9.2 (c 2.02, CH2Cl2). ИК
Выход 0.14 г (88%). Светло-желтая жидкость, Rf
спектр, ν, см-1: 2954, 2928, 2857, 1678, 1472, 1253,
0.75 (элюент
25% EtOAc-петролейный эфир),
1109, 837, 776. Спектр ЯМР 1Н (500 МГц, CDCl3),
[α]D20 +1.2 (c 0.50, CH2Cl2). ИК спектр, ν, см-1:
δ, м.д.: 0.04 с [6H, Si(CH3)2], 0.88 с [9H, SiC(CH3)3],
2954, 2927, 2856, 1472, 1463, 1256, 1252, 1111, 837,
1.75 с (3H, =CCH3), 2.01 с (3H, =CCH3), 2.41-2.50
775. Спектр ЯМР 1Н (500 МГц, CDCl3), δ, м.д.:
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
814
ВАЛЕЕВ и др.
0.03 с [6H, Si(CH3)2], 0.88 с [9H, SiC(CH3)3], 1.79 с
октан-3-он
(8)
[15]. Светло-желтая жидкость,
(3H, =CCH3), 1.98 с (3H, =CCH3), 2.23-2.42 м (2Н,
[α]D20 +14.3 (с 1.35, CH2Cl2). ИК спектр, ν, см-1:
=CHCH2), 2.51-2.60 м (1H, CH2CH), 2.71 с (3Н,
3512, 2971, 2936, 1684, 1498, 1465, 1342, 1152,
N=CCH3), 3.57-3.71 м (2Н, CH2OSi), 5.07 д (1H,
1027, 764, 690, 545. Спектр ЯМР 1Н (500 МГц,
=CH2, J 10.8 Гц), 5.18 д (1H, =CH2, J 17.2 Гц), 5.38
CDCl3), δ, м.д.: 0.95 д (3Н, C6СН3, J 6.8 Гц), 1.07 д
т (1Н, =CH, J 7.0 Гц), 6.35 с (1H, =CH), 6.80 д.д
(3Н, С4СН3, J 6.8 Гц), 1.25-1.26 с (6Н, 2СН3-гем),
(1H, HC=CH2, J 17.2, 10.8 Гц), 6.86 с (1Н, =CHS).
1.78 т.к.д (1Н, С6Н, J 6.4, 6.8, 9.5 Гц), 1.87-1.91 м
Спектр ЯМР 13С (125 МГц, CDCl3-CHCl3), δ, м.д.:
(1H, C7H), 2.21-2.25 м (1H, С7Н), 3.21-3.25 м (1Н,
-5.4, 16.8, 18.3, 19.1, 19.8, 25.9, 27.6, 52.3, 65.5,
C4H), 3.05-3.20 м (4H, CH2-дитиолан), 3.40 с (3Н,
113.4,114.5, 120.3, 129.0, 133.0, 133.9, 141.4, 153.3,
OCH3), 3.48 д (1Н, С5Н, J 9.5 Гц), 3.80 д.т (1Н,
164.3. Mасс-спектр, m/z (Iотн, %): 379 (33) [M + H]+,
С8Н, 2J 14.6, Jтранс 11.2, Jцис 4.9 Гц), 3.92 д.т (1Н,
433 (100). Найдено, %: C 66.7; H 9.4; N 3.6; S 8.3.
С8Н, 2J 14.6, Jтранс 11.2, Jцис 4.9 Гц), 4.14 д (1Н,
OСН2O, J 5.6 Гц), 4.45 д (1Н, ОСН2O, J 5.6 Гц),
C21H35NOSSi. Вычислено, %: C 66.79; H 9.34; N
3.71; S 8.49. M 377.66.
4.78 д (1Н, С1Н, J 5.7 Гц), 4.91 д (1Н, СН-дитиолан,
J 6.1 Гц), 7.45-7.68 м (3Н, Ph), 7.51-7.57 м (2H,
(2S,4Z)-5-Метил-2-[(E)-1-метил-2-(2-метил-
Ph). Спектр ЯМР 13С (125 МГц, CDCl3-CHCl3),
1,3-тиазол-4-ил)этенил]гепта-4,6-диен-1-ол
δ, м.д.: 10.00, 16.25, 20.00, 23.52, 26.51, 34.45,
(5). К перемешиваемому раствору соединения 4
38.07, 38.29, 41.43, 53.56, 54.63, 55.53, 56.84, 74.97,
(0.14 г, 0.37 ммоль) в 16 мл смеси растворителей
85.52, 99.63, 125.01, 129.63, 129.73, 131.39, 133.01,
СH2Cl2-MeOH (1:1) добавляли моногидрат п-то-
153.40, 219.50. Mасс-спектр, m/z (Iотн, %): 574 [M +
луолсульфоновой кислоты (p-TSA∙H2O) (0.032 г,
Н]+. Найдено, %: С 50.46; H 6.41, N 9.59, S 16.85.
0.19 ммоль) при 0°С. Смесь выдерживали при
C24H36N4O6S3. Вычислено, %: С 50.33; H 6.34, N
комнатной температуре в течение 5 ч, затем ней-
9.78; S 16.80. M 572.76.
трализовали добавлением NaHCO3, фильтровали,
(5R,8R,9S)-5-(1,3-Дитиолан-2-ил)-11,11-ди-
концентрировали на вакууме, остаток очищали
этил-6,6,8-триметил-9-{(1S)-1-метил-3-[(1-фе-
методом колоночной хроматографии на SiO2 (элю-
нил-1H-тетразол-5-ил)сульфонил]пропил}-
ент 70% EtOAc-петролейный эфир). Выход 0.093 г
2,4,10-триокса-11-силатридекан-7-он (9). К пе-
(95%). Бесцветная жидкость, Rf 0.22 (50% EtOAc-
ремешиваемому раствору соединения 8 (0.25 г,
петролейный эфир), [α]D20 +4.4 (c 0.82, CH2Cl2). ИК
0.44 ммоль) в 30 мл CH2Cl2 в атмосфере аргона до-
спектр, ν, см-1: 3353, 2969, 2923, 2861, 1457, 1437,
бавляли 2,6-лутидин (0.25 г, 2.18 ммоль) и Et3SiOTf
1375, 1268, 1183, 1047, 987, 902, 732. Спектр ЯМР
(0.24 мл, 1.09 ммоль) при 0°С. Полученный рас-
1Н (500 МГц, CDCl3), δ, м.д.: 1.76 с (3H, =CCH3),
твор перемешивали при этой температуре в тече-
2.04 с (3H, =CCH3), 2.23-2.43 м (2Н, =CHCH2),
ние 20 мин, затем нейтрализовали добавлением
2.46-2.54 м (1H, CH2CH), 2.64 с (3Н, N=CCH3),
30 мл насыщенного раствора NaHCO3. Орга-
2.76 с (1H, OH), 3.49-3.67 м (2Н,CH2OH), 5.06
нический слой отделяли, водный слой обрабаты-
д (1H, =CH2, J 10.8 Гц), 5.18 д (1H, =CH2, J
вали CH2Cl2 (3×30 мл). Объединенные органи-
17.2 Гц), 5.41 т (1Н, =CH, J 6.8 Гц), 6.30 с (1H,
ческие экстракты сушили MgSO4, фильтровали,
=CH), 6.84 д.д (1H, HC=CH2, J 17.2, 10.8 Гц), 7.07
упаривали, концентрировали под вакуумом, оста-
с (1Н, =CHS). Спектр ЯМР 13С (125 МГц, CDCl3-
ток хроматографировали на SiO2 (20% EtOAc-пе-
CHCl3), δ, м.д.: 15.1, 18.2, 19.1, 27.5, 53.1, 64.0,
тролейный эфир). Выход 0.23 г (77%). Бесцветная
113.0, 115.2, 120.6, 129.3, 132.6, 133.8, 140.1, 153.9,
жидкость, Rf 0.68 (элюент 30% EtOAc-петролей-
164.9. Mасс-спектр, m/z (Iотн, %): 264 (18) [M +
ный эфир), [α]D20 -2.2 (c 1.16, CH2Cl2). ИК спектр,
H]+, 278 (100). Найдено, %: C 68.5; H 8.0; N 5.1; S
ν, см-1: 2958, 2877, 1690, 1497, 1458, 1341, 1153,
12.2. C15H21NOS. Вычислено, %: C 68.40; H 8.04;
1023, 990, 763, 740, 689. Спектр ЯМР 1Н (500 МГц,
N 5.32; S 12.17. M 263.39.
CDCl3), δ, м.д.: 0.65 к (6H, SiCH2, J 7.9 Гц), 0.97
(1R,4R,5S,6S)-1-(1'3'-Дитиолан-2'-ил)-5-ги-
т (9H, SiCH2CH3, J 7.9 Гц), 1.05 д (3H, CHCH3,
дрокси-1-(метоксиметокси)-2,2,4,6-тетраметил-
J 6.8 Гц), 1.15 д (3H, CHCH3, J 6.9 Гц), 1.22 с
8-[(1''-фенил-1''Н-тетразол-5''-ил)сульфонил]-
(3H, CCH3), 1.31 с (3H, CCH3), 1.55-1.66 м (1H,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ НОВОГО 10,11-ДИДЕГИДРОАНАЛОГА ЭПОТИЛОНА D
815
CHCH3), 1.68-1.84 м (1H, CH2), 2.03-2.11 м (1H,
6.4 Гц), 5.26-5.32 м (1H, =CH), 5.34-5.40 м (1H,
CH2), 3.11-3.16 м (4H, SCH2CH2S), 3.21-3.25 м
=CH). Спектр ЯМР 13С (125 МГц, CDCl3-CHCl3),
(1H, CHCH3), 3.42 с (3H, OCH3), 3.54-3.64 м (1H,
δ, м.д.: 5.5, 7.1, 15.6, 17.8, 17.9, 19.3, 24.4, 33.8,
CH2SO2), 3.79-3.86 м (1H, CH2SO2), 3.91 д.д (1H,
37.9, 38.5, 45.1, 53.3, 56.0, 56.7, 78.1, 84.3, 99.5,
CHOSi, J 7.6, 1.5 Гц), 4.19 д (1H, CHOCH2OCH3,
126.0, 130.0, 217.0. Mасс-спектр, m/z (Iотн, %): 506
J 4.2 Гц), 4.48 д (1H, SCHS, J 4.2 Гц), 4.78 д (1H,
(21) [M + H]+. Найдено, %: C 59.3; H 9.4; S 12.6.
OCH2OCH3, J 6.0 Гц), 4.93 д (1H, OCH2OCH3, J
C25H48O4S2Si. Вычислено, %: C 59.47; H 9.58; S
6.0 Гц), 7.58-7.63 м (3H, Ph), 7.69-7.71 м (2H, Ph).
12.70. M 504.86.
Спектр ЯМР 13С (125 МГц, CDCl3-CHCl3), δ, м.д.:
(2R,5R,6S,7S,9E)-2-(Метоксиметокси)-3,3,5,7-
5.4, 7.1, 16.0, 17.9, 20.0, 23.0, 23.8, 36.2, 38.0, 38.5,
тетраметил-4-оксо-6-[(триэтилсилил)окси]ун-
45.5, 53.4, 54.7, 55.8, 56.8, 78.2, 84.0, 99.4, 125.1,
дека-9-еналь (11). К перемешиваемому раствору
129.6, 131.4, 133.1, 153.3, 217.0. Mасс-спектр, m/z
соединения 10 (0.14 г, 0.27 ммоль) в 10 мл смеси
(Iотн, %): 688 (33) [M + H]+. Найдено, %: C 52.3; H
растворителей ацетон-вода (4:1) добавляли CaCO3
7.3; N 8.0; S 14.1. C30H50N4O6S3Si. Вычислено, %:
(0.83 ммоль) и MeI (2,7 ммоль) порциями в тече-
C 52.45; H 7.34; N 8.16; S 14.00. M 687.02.
ние 5-6 ч при 50-60°C. К реакционной смеси до-
(5R,8R,9S)-5-(1,3-Дитиолан-2-ил)-11,11-ди-
бавляли CH2Cl2, сушили над MgSO4, фильтровали,
этил-6,6,8-триметил-9-[(1S,3E)-1-метилпент-
упаривали, остаток хроматографировали на SiO2
3-ен-1-ил]-2,4,10-триокса-11-силатридекан-7-
(элюент 20% EtOAc-петролейный эфир). Выход
он (10). К перемешиваемому раствору сульфона
0.06 г (59%). Бесцветная жидкость, Rf 0.65 (элю-
9 (0.23 г, 0.33 ммоль) в 35 мл ТГФ в атмосфере
ент 25% EtOAc-петролейный эфир), [α]D20 +6.5
аргона добавляли 1.2 M раствор KHMDS в ТГФ
(c 1.058, CH2Cl2). ИК спектр, ν, см-1: 2957, 2936,
(0.42 мл, 0.50 ммоль) при -78°C. Реакционную
2913, 2877, 1729, 1710, 1653, 1471, 1108, 1049,
смесь перемешивали в течение 10 мин, затем
1032, 985, 737. Спектр ЯМР 1Н (500 МГц, CDCl3),
добавляли ацетальдегид (29.5 мг, 0.67 ммоль) в
δ, м.д.: 0.62, 0.64 (6H, перекрывающиеся кварте-
3 мл ТГФ. Смесь выдерживали в течение 20 мин,
ты, Si-CH2, J 8.0 Гц), 0.88 д (3H, CHCH3, J 6.8 Гц),
затем температуру реакционной массы доводи-
0.97 д (9H, 5-CH3, J 7.8 Гц), 1.10 д (3H, 5-CH3, J
ли до комнатной. Добавляли 20 мл насыщенного
7.2 Гц), 1.26 с (3H, CCH3), 1.33 с (3H, CCH3),
раствора NH4Cl, органический слой отделяли, во-
1.63 д (3H, =CHCH3, J 5.5 Гц), 1.52-1.70 м (2H),
дный слой обрабатывали этилацетатом (3×20 мл).
2.08-2.13 м (1H), 3.05-3.18 м (1H, 7-H), 3.39 с
Объединенные органические экстракты сушили
(3H, OCH3), 3.75 с (1H, 2-H), 3.84 д (1H, CHOSi, J
MgSO4, фильтровали, упаривали, концентриро-
7.0 Гц), 4.67 к (2H, OCH2OCH3, J 6.2 Гц), 5.25-5.50
вали под вакуумом, остаток хроматографировали
м (2H, H9, H10), 9.72 д (1H, CHO, J 2.4 Гц). Спектр
на SiO2 (элюент 9% EtOAc-петролейный эфир).
ЯМР 13С (125 МГц, CDCl3-CHCl3), δ, м.д.: 5.4
Выход 0.14 г, (83%) (Z/E, 1:7).Бесцветная жид-
(SiCH2), 7.0 (SiCH2CH3), 15.8 (CH3), 17.9 (CH3),
кость, Rf 0.65 (25% EtOAc-петролейный эфир),
18.0 (CH3), 22.0 (CH3), 22.4 (CH3), 33.4 (C8), 37.3
[α]D20 -0.3 (c 2.74, CH2Cl2). ИК спектр, ν, см-1:
(C7), 44.8 (C5), 53.4 (C3), 56.2 (OCH3), 78.4 (C6),
2956, 2934, 2877, 1692, 1456, 1154, 1023, 990, 739.
86.7 (C2), 97.6 (OCH2O), 126.1 (C10), 130 (C9), 202.3
Спектр ЯМР 1Н (500 МГц, CDCl3), δ, м.д.: 0.61 к
(C1), 216.5 (C4). Mасс-спектр, m/z (Iотн, %): 427.4
(6H, SiCH2, J 7.9 Гц), 0.87 д (3H, CHMe, J 6.7 Гц),
(100) [M + H]+. М 428.67.
0.94 т (9H, SiCH2CH3, J 7.9 Гц), 1.08 д (3H, CHCH3,
J 7.0 Гц), 1.15 с (3H, CCH3), 1.28 с (3H, CCH3),
(2R,5R,6S,7S,9E)-2-(Метоксиметокси)-3,3,5,7-
1.31-1.37 м (1H, CHCH3), 1.60 д (3H, =CHCH3, J
тетраметил-4-оксо-6-[(триэтилсилил)окси]ун-
6.1 Гц), 1.68-1.74 м (1H, CH2), 2.12-2.15 м (1H,
дека-9-еновая кислота (12). К перемешиваемо-
CH2), 3.05-3.15 м (4H, SCH2CH2S), 3.18-3.24
му раствору альдегида 11 (0.06 г, 0.14 ммоль) в
м (1H, CHCH3), 3.39 с (3H, OCH3), 3.82 д.д (1H,
13.2 мл смеси растворителей t-BuOH-ТГФ-H2O
CHOSi, J 7.4, 2.2 Гц), 4.17 д (1H, CHOCH2OCH3,
(5:5:1) добавляли 2,3-диметилбут-2-ен (2.1 мл),
J 4.2 Гц), 4.44 д (1H, SCHS, J 4.2 Гц), 4.75 д (1H,
Na2HPO4 (0.06 г, 0.35 ммоль) и NaClO2 (0.08 г,
OCH2OCH3, J 6.4 Гц), 4.93 д (1H, OCH2OCH3, J
0.73 ммоль). Реакционную массу перемешивали
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
816
ВАЛЕЕВ и др.
при комнатной температуре в течение 16 ч и за-
1.63 д (3Н, 11-Н, J 4.7 Гц), 1.74-1.78 м (1Н, 8-HA),
тем фильтровали. Осадок на фильтре промывали
1.79 с (3Н, 5'-СН3), 2.11 с (3Н, 1''-CH3), 2.19-2.23
EtOAc (10 мл), фильтрат сушили над MgSO4 и
м (1Н, 9-НB), 2.41 д.т (1H, 3'-H, J 14.6, 8.1, 7.3 Гц),
концентрировали. Остаток хроматографировали
2.52 д.д.д (1H, 3'-H, J 14.6, 7.3, 7.3 Гц), 2.62-2.68
на SiO2 (элюент 50% EtOAc-петролейный эфир).
м (1H, 15-H), 2.66 c (3H, 2'''-CH3), 3.24-3.29 м (1H,
Выход 0.05 г (82%). Желтая маслянистая жид-
6-H), 3.27 c (3H, CH3O), 3.84-3.89 м (1H, 6-H),
кость, Rf 0.23 (EtOAc), [α]D20 +9 (c 0.13, CH2Cl2).
4.15 д.д (1H, 1'-H, J 11.0, 6.0 Гц), 4.32 д.д (1H,
ИК спектр, ν, см-1: 3396, 2957, 2931, 2876, 2855,
1'-H, J 11.0, 8.2 Гц), 4.38 c (1H, 2-H), 4.55-4.59
1723, 1697, 1457, 1046, 999, 737, 726. Спектр ЯМР
м (2H, OCH2O), 5.10 д (1H, 7'-Hцис, Jцис 10.9 Гц),
1Н (500 МГц, CDCl3), δ, м.д.: 0.65 т (6H, SiCH2,
5.23 д (1H, 7'-Hтранс, Jтранс 17.1 Гц), 5.37-5.41 м
J 7.9 Гц), 0.88 (1H, 7-CH3, J 6.8 Гц), 0.97 т (9H,
(1H, 9-H), 5.40-5.45 м (1H, 10-H), 5.42-5.48 м (1H,
SiCH2CH3, J 7.7 Гц), 1.2 д (3H, 5-H, J 7.0 Гц), 1.27 с
4'-H), 6.37 с (1H, 2''-H), 6.87 д.д (1H, 6'-H, J 17.1,
(3H, 3-CH3), 1.32 с (3H, 3-CH3), 1.63 д (3H, =CH3, J
10.9 Гц), 7.13 с (1H,
5'''-H). Спектр ЯМР 13С
5.3 Гц), 1.50-1.60 м (2H), 2.11-2.15 м (1H), 3.17 т.д
(125 МГц, ацетон-d6), δ, м.д.: 5.91 (SiCH2), 7.22
(1H, 5-H, J 7.2, 13.5 Гц), 3.79-3.88 м (1H, 6-H), 4.40
(SiCH2CH3), 15.60 (5-СН3), 15.74 (1''-CH3), 17.68
с (1H, 2-H), 5.25-5.40 м (2H, 9H, 10-H). Спектр
(7-CH3), 18.93 (2'''-CH3), 19.92 (5'-CH3), 20.42 (3-
ЯМР 13С (125 МГц, CDCl3-CHCl3), δ, м.д.: 5.5
CH3), 22.70 (3-CH3), 28.59 (C3'), 34.65 (C8), 38.92
(SiCH2), 7.0 (SiCH2CH3), 12.9 (CH3), 17.7 (CH3),
(C7), 44.79 (C5), 51.69 (C3), 56.45 (CH3O), 66.56
17.9 (CH3), 20.7 (CH3), 22.6 (CH3), 33.7 (C8), 37.9
(C1'), 78.67 (C6), 82.20 (C2), 97.56 (OCH2O), 114.19
(C7), 44.7 (C5), 56.5 (OCH3), 78.2 (C6), 80.9 (C2),
(С7'), 116.58 (C5'''), 122.04 (C2''), 126.54 (C10), 128.98
97.4 (OCH2O), 126.0 (C9), 130.1 (C10), 174.6 (C1),
(C4'), 131.05 (C9), 134.18 (C6'), 139.26 (C1''), 155.74
217.0 (C4). Mасс-спектр, m/z (Iотн, %): 443.0 (100)
(C4'''), 164.71 (C2'''), 171.23 (C1), 216.37 (C4). М
[M - H]-. М 444.67.
690.06.
(2S,4Z)-5-Метил-2-[(E)-1-метил-2-(2-метил-
(2S,4Z)-5-Метил-2-[(E)-1-метил-2-(2-метил-
1,3-тиазол-4-ил)винил]гепта-4,6-диен-1-
1,3-тиазол-4-ил)винил]гепта-4,6-диен-1-ил-
2,4,6-трихлорбензоат (14). Выход 0.0029 г (5%).
ил(2R,5R,6S,7S,9E)-2-(метоксиметокси)-
Бесцветная жидкость, Rf 0.51 (EtOAc-петролей-
3,3,5,7-тетраметил-4-оксо-6-[(триэтилсилил)-
ный эфир, 4:1), [α]D20 -8.40, (c 3.355, CH2Cl2). ИК
окси]ундека-9-еноат (13). a. Методика с исполь-
спектр, ν, см-1: 3082, 2970, 2925, 2856, 1739, 1576,
зованием реагента Ямагучи. К перемешиваемому
1549, 1507, 1437, 1373, 1272, 1120, 856, 734. Спектр
раствору кислоты 12 (0.06 г, 0.135 ммоль) в 10 мл
ЯМР 1Н (500 МГц, CDCl3), δ, м.д.: 1.78 с (СН3),
ТГФ в атмосфере аргона добавляли Et3N (0.027 г,
2.15 с (СН3), 2.45 д.т (1Н, СН2, J 14.9, 7.9 Гц),
0.27 ммоль) и 2,4,6-трихлорбензоил хлорид (0.033 г,
2.55 д.т (1Н, СН2, J 14.9, 6.8 Гц), 2.63 с (СН3), 2.75
0.135 ммоль). Реакционную массу перемешивали
д.д.д (1Н, СН, J 6.2, 8.2, 14.4 Гц), 4.45 д.д (1Н,
при комнатной температуре 2 ч, затем добавля-
СН2О, J 9.7, 11.0 Гц), 4.55 д.д (1Н, СН2О, J 10.4,
ли раствор спирта 5 (0.035 г, 0.135 ммоль) в 1 мл
11.0 Гц), 5.10 д (1Н, =СН2, J 10.9 Гц), 5.22 д (1Н,
ТГФ. Затем DMAP (0.004 г, 0.034) разбавляли
=СН2, J 17.2), 5.45 д.д (1Н, СН, J 7.2, 7.3 Гц), 6.40
0.5 мл ТГФ и добавляли порциями в течение 5 ч.
с (1Н, 2'-H), 6.85 д.д (1Н, 6-Н, J 10.8, 17.3 Гц), 7.10
Реакционную смесь концентрировали в вакууме,
(1Н, SCH=), 7.55 уш.с (2Наром), 7.55 уш.с (2Наром).
остаток очищали колоночной хроматографией
Спектр ЯМР 13С (125 МГц, CDCl3-CHCl3), δ, м.д.:
(элюент 9% EtOAc-петролейный эфир). Выход
14.9 (СН3), 18.4 (СН3), 19.2 (СН3), 27.7 (СН2), 48.90
0.020 г (21%). Светло-желтая жидкость, Rf 0.44
(СН), 67.4 (СН2О), 113.6 (=СН2), 115.9 (S-CH=),
(20% EtOAc-петролейный эфир), [α]D20 -7 (c 0.2,
121.6, 127.8, 128.2, 128.7 (Cчетв), 132.2 (Cчетв),
CH2Cl2). ИК спектр, ν, см-1: 2936, 1744, 1701,
132.5 (Cчетв), 133.5, 136.0, 137.8, 153.5 (Cчетв),
1460, 1369, 1154, 1040, 994, 738. Спектр ЯМР 1Н
163.4 (CO), 163.9 [CH3C(S-)=N-]. Масс-спектр, m/z
(500 МГц, ацетон-d6), δ, м.д.: 0.67 м (6Н, SiCH2),
(Iотн, %): 472.1 (100) [M + H]+. М 470.84.
0.89 д (3Н, 7-СН3, J 6.9 Гц), 0.94-0.97 м (9Н,
SiCH2CH3), 1.08 д (3Н, 5-СН3, J 6.9 Гц), 1.16 с (3Н,
b. Методика с использованием реагента
3-СН3), 1.30 с (3Н, 3-CH3), 1.45-1.51 м (1Н, 8-Н),
Мукаямы. К перемешиваемому раствору кис-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ НОВОГО 10,11-ДИДЕГИДРОАНАЛОГА ЭПОТИЛОНА D
817
лоты 12 (0.03 г, 0.067 ммоль) и спирта 5 (0.018 г,
(CH3O), 65.23 (C16), 78.15 (C7), 80.00 (C3), 96.90
0.067 ммоль) в 10 мл CH2Cl2 в атмосфере арго-
(OCH2O), 115.26 (C5''), 120.02 (C1'), 126.17 (C13),
на добавляли
1-метил-2-бромпиридиний йодид
128.99 (C11), 129.12 (C10), 133.50 (C12), 139.86 (C2'),
(0.04 г, 0.013), затем DMAP (0.033 г, 0.27 ммоль).
153.04 (C4''), 164.42 (C2''), 170.52 (C2), 216.77 (C5).
Реакционную массу перемешивали при комнатной
Минорныйизомер
15b. Спектр ЯМР
1Н
температуре 2 ч, затем фильтровали, упаривали,
(500 МГц, CDCl3), δ, м.д.: 0.64-0.66 м (9H, CH3-
концентрировали под вакуумом, остаток хрома-
SiEt3), 0.97-0.99 м (6H, CH2-SiEt3), 1.11 д (3H,
тографировали на SiO2 (элюент 9% EtOAc-петро-
6-CH3, 3J 6.8 Гц), 1.14 с (3H, 4-CH3), 1.32 с (3H,
лейный эфир). Выход 0.02 г (45%).
4-CH3), 1.47-1.49 м (1H, 8-H), 1.79 с (3H, 12-
(3R,6R,7S,8S,10E,12Z,15S)-3-(Метокси-
CH3), 2.03-2.05 м (1H, 9-HA), 2.08 с (3H, 3'-H),
метокси)-7-[(триэтилсилил)окси]-4,4,6,8,12-
2.21-2.23 м (1H, 9-HB), 2.42-2.44 м (1H, 14-HA),
пентаметил-15-[(E)-1-(2-метилтиазол-4-ил)-
2.57-2.59 м (1H, 14-HB), 2.58-2.60 м (1H, 15-H),
проп-1-ен-2-ил]оксациклогексадека-10,12-ди-
2.71 с (3H, 2''-CH3), 3.22-3.24 м (1H, 6-H), 3.42
ен-2,5-дион (15а) и его 3S-изомер (15b). a. К пе-
с (3H, CH3O), 3.85 д.д (1H, 7-H, 3J7-8 7.9, 3J6-7
ремешиваемому раствору соединения 13 (0.064 г,
1.7 Гц), 3.97 д.д (1H,
16-HA, 2J
10.7, 3J16A-15
0.093 ммоль) в 93 мл (1.0 ммоль) дегазированно-
11.2 Гц), 4.37 д.д (1H, 16-HB, 2J
10.7, 3J16B-15
го CH2Cl2 добавляли второго поколения реагент
3.4 Гц), 4.52 с (1H, 3-H), 4.73 д (1H, HA-OCH2O, 2J
Граббса (10 мол %). Смесь перемешивали при
7.0 Гц), 4.78 д (1H, HB-OCH2O, 2J 7.0 Гц), 5.35 д.д
комнатной температуре в течение 12 ч, фильтро-
(1H, 13-H, 3J13-14B 9.9, 3J13-14B 7.1 Гц), 5.79 д.д.д
вали через слой SiO2, промывая последовательно
(1H, 10-H, 3J10-13 15.5, 3J10-9A 9.3, 3J10-9B 4.9 Гц),
6.28 с (1H, 1'-H), 6.69 д (1H, 11-H, 3J11-10 15.7 Гц),
CH2Cl2 и Et2O. Объединенные фильтраты кон-
центрировали в вакууме и остаток очищали ко-
6.90 с (1H, 5''-H). Спектр ЯМР 13С (125 МГц,
CDCl3-CHCl3), δ, м.д.:
5.52 (CH3-SiEt3),
7.10
лоночной хроматографией на SiO2 (элюент 9%
(CH2-SiEt3),
16.96
(6-CH3),
18.00 (C3'),
18.31
EtOAc-петролейный эфир). Выход 0.012 г (20%).
(8-CH3), 19.19 (2''-CH3), 20.50 (12-CH3), 20.82 (4-
Бесцветная жидкость, Rf 0.36 (25% EtOAc-петро-
CH3), 23.52 (4-CH3), 27.39 (C14), 34.46 (C9), 39.82
лейный эфир), [α]D20 -10.6 (c 0.43, CH2Cl2).
(C8), 44.78 (C6), 49.62 (C15), 51.45 (C4),
56.99
Мажорный изомер
15a. Спектр ЯМР
1Н
(CH3O), 65.76 (C16), 78.22 (C7), 80.28 (C3), 97.17
(500МГц,CDCl3),δ,м.д.:0.62-0.66м(9H,CH3-SiEt3),
(OCH2O), 115.32 (C5''), 120.04 (C1'), 124.43 (C13),
0.96-1.00 м (6H, CH2-SiEt3), 1.03 д (3H, 8-CH3, 3J
129.26 (C10), 129.38 (C11), 134.52 (C12),
138.83
6.9 Гц), 1.08 с (3H, 4-CH3), 1.10 д (3H, 6-CH3, 3J
(C2'), 152.95 (C4''), 164.52 (C2''), 170.59 (C2), 217.44
6.8 Гц), 1.32 с (3H, 4-CH3), 1.42-1.46 м (1H, 8-H),
(C5). Mасс-спектр, m/z (Iотн, %): 648.5 [M + H]+. M
1.80 с (3H, 12-CH3), 2.01-2.05 м (1H, 9-HA), 2.09
647.98.
с (3H, 3'-H), 2.09-2.13 м (1H, 14-HA), 2.18-2.22 м
b. К перемешиваемому раствору соединения 13
(1H, 9-HB), 2.33-2.35 м (1H, 15-H), 2.70 с (3H, 2''-
(0.04 г, 0.058 ммоль) в 60 мл (1.0 ммоль) дегази-
CH3), 3.02 д.д.д (1H, 14-HB, 2J 13.6, 3J14B-13 11.4,
рованного CH2Cl2 добавляли второго поколения
3J14B-15 6.1 Гц), 3.21-3.23 м (1H, 6-H), 3.36 с (3H,
реагент Граббса (10 мол %). Смесь перемешивали
CH3O), 3.85 д.д (1H, 7-H, 3J7-8 7.7, 3J6-7 1.8 Гц),
при комнатной температуре в течение 6 ч, филь-
4.21-4.23 м (2H, 16-H), 4.43 с (1H, 3-H), 4.67 с (2H,
тровали через слой SiO2,промывая последова-
OCH2O), 5.36 д.д (1H, 13-H, 3J13-14B 11.4, 3J13-14B
тельно CH2Cl2 и Et2O. Объединенные фильтраты
5.2 Гц), 5.74 д.д.д (1H, 10-H, 3J10-13 15.7, 3J10-9A
концентрировали в вакууме и остаток очищали
10.7, 3J10-9В 4.3 Гц), 6.38 с (1H, 1'-H), 6.71 д (1H,
колоночной хроматографией на SiO2 (элюент 9%
11-H, 3J11-10 15.7 Гц), 6.90 с (1H, 5''-H).Спектр
EtOAc-петролейный эфир). Выход 0.0175 г (45%).
ЯМР 13С (125 МГц, CDCl3-CHCl3), δ, м.д.: 5.49
(CH3-SiEt3), 7.07 (CH2-SiEt3), 16.73 (6-CH3), 17.71
(3R,6R,7S,8S,10E,12Z,15S)-7-Гидрокси-3-(ме-
(C3'), 18.25 (8-CH3), 19.17 (2''-CH3), 20.50 (12-CH3),
токсиметокси)-4,4,6,8,12-пентаметил-15-
20.69 (4-CH3), 23.10 (4-CH3), 27.65 (C14), 35.50 (C9),
[(E)-1-(2-метилтиазол-4-ил)проп-1-ен-2-ил]ок-
39.78 (C8), 44.26 (C6), 48.06 (C15), 51.81 (C4), 56.84
сациклогексадека-10,12-диен-2,5-дион (1). К пе-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
818
ВАЛЕЕВ и др.
ремешиваемому раствору соединения 15 (0.0175 г,
катализатора Граббса. В итоге целевой аналог Epo
0.027 ммоль) в 10 мл смеси растворителей MeOH-
1 получен из R-(-)-карвона в 16 стадий с общим
EtOH (1:1) добавляли камфора-10-сульфокислоту
выходом 1.1%.
(15 мол %). Смесь выдерживали при комнатной
БЛАГОДАРНОСТИ
температуре в течение 4 ч, затем нейтрализовали
Спектральная часть исследования и теорети-
добавлением насыщенного раствора NaHCO3, упа-
ческие вычисления проведены на оборудовании
ривали, водный слой обрабатывали этилацетатом
ЦКП «Химия» УфИХ УФИЦ РАН.
(3×10 мл). Объединенные органические экстракты
сушили MgSO4, фильтровали, упаривали, концен-
ФОНДОВАЯ ПОДДЕРЖКА
трировали под вакуумом, остаток хроматографи-
Работа выполнена при финансовой поддержке
ровали на SiO2(элюент 25% EtOAc-петролейный
Министерства образования и науки Российской
эфир). Выход 0.0085 г (60%). Бесцветное масло,
Федерации (тема «Направленные синтезы при-
Rf 0.52 (элюент 50% EtOAc-петролейный эфир),
родных и неприродных биоактивных соединений,
[α]D20 +42 (c
0.17, CH2Cl2). Спектр ЯМР
1Н
конструирование новых структур для оптоэлектро-
(500 МГц, CDCl3), δ, м.д.: 0.99 с (3Н, СН3), 1.02
ники», госзадание AAAA-A20-120012090021-4 и
д (3Н, 6-СН3, J 6.8 Гц), 1.13 д (3Н, СН3, J 6.8 Гц),
№ АААА-А17-117011910032-4) и финансовой
1.30 с (3Н, СН3), 1.76 с (СН3), 1.95 пентет (1Н, J
поддержке РФФИ (грант
№
20-33-90039
6.7 Гц), 2.08 с (СН3), 2.05-2.12 м (1Н), 2.25 д.т (1Н,
Аспиранты).
J 5.3, 12.3 Гц), 2.50-2.60 м (2Н), 2.74 с (СН3), 3.27
КОНФЛИКТ ИНТЕРЕСОВ
д.к (1Н, J 6.8, 2.4 Гц), 3.37 с (3Н, ОСН3), 3.45-3.36
м (1Н, ОН), 3.76 д.д (1Н, J 2.0, 6.8 Гц), 4.04-4.14
Авторы заявляют об отсутствии конфликта ин-
д.д (1Н, J 4.6, 11.0 Гц), 4.35 д.д (1Н, J 5.9, 11.0 Гц),
тересов.
4.37 с (1Н, 3-Н), 4.67 к (2Н, J 7.0 Гц), 5.26 д.д (1Н,
СПИСОКЛИТЕРАТУРЫ
J 5.1, 9.5 Гц), 5.70 д.д.д (1Н, 10-Н, J 6.0, 15.3, 8.9,
1. Kingston D.G.I. Chem. Biol. 2004, 11, 153-155. doi
6.0 Гц), 6.40 с (1Н), 6.44 д (1Н, 11-Н, J 15.7 Гц), 6.94
10.1016/j.chembiol.2004.02.009
с (1Н). Спектр ЯМР 13С (125 МГц, CDCl3-CHCl3),
2. Feyen F., Cachoux F., Gertsch J., Wartmann M.,
δ, м.д.: 12.25, 16.26, 17.8, 20.2, 20.5, 21.5 (СН3),
Altmann K.-H. Acc. Chem. Res. 2008, 41, 21-31. doi
28.42, 36.15 (2СН2), 36.36, 40.0, 48.3, 52.5, 56.6
10.1021/ar700157x
(ОСН3), 65.62 (СН2О), 72.35 (С7), 78.65 (С3), 96.9
3. Harris C.R., Danishefsky S.J. J. Org. Chem. 1999, 64,
(ОСН2О), 115.2, 124.6, 128.6, 130.3, 134.8, 140.8,
8434-8456. doi 10.1021/jo991006d
141.1, 151.7, 165.3, 170.1, 218.4. Mасс-спектр, m/z
4. Monti C., Sharon O., Gennari C. Chem. Commun.
(Iотн, %): 534 (100) [M + H]+. М 533.72.
2007, 4271-4273.doi 10.1039/B708820E
ВЫВОДЫ
5. Gerth K., Bedorf N., Höfle G., Irshik H., Reichen-
bach H. J. Antibiotics.
1996,
49,
560-563. doi
Нами описан разработанный полный синтез из
10.7164/antibiotics.49.560
R-(-)-карвона нового 10,11-дегидроаналога эпо-
6. Mulzer J., Altmann K.-H., Höfle G., Müller R.,
тилона D. Ключевые этапы этого синтеза вклю-
Prantz K. C. R. Chim. 2008, 11, 1336-1368.
чают оригинальный вариант дециклизации R-(-)-
карвона с сохранением его Z-тризамещенной двой-
ixabepilone
ной связи с получением важной спиртовой компо-
8. Biswas K., Lin H., Njardarson J.T., Chappel M.D.,
ненты сложного эфира для RCM-циклизации; в
Chou T.-C., Guan Y., Tong W.P., He L., Horwitz S.B.,
синтезе новой топологии кислотной компоненты
Danishefsky S.J. J. Am. Chem. Soc. 2002, 124, 9825-
данного эфира задействованы R-(-)-пантолактон
9832. doi 10.1021/ja0262333
(8 стадий) и хиральный метилсодержащий блок
9. Scholl M., Ding S., Lee C.W., Grubbs R.H. Org. Lett.
(6 стадий); в финале межмолекулярная конденса-
1995, 1, 953-956. doi 10.1021/ol990909q
ция кислотной и спиртовой компонент и внутри-
10. Scholl M., Trnka T.M., Morgan J.P., Grubbs R.H.
молекулярная циклизация полученного α,ω-не-
Tetrahedron Lett. 1999, 40, 2247-2250. doi 10.1016/
предельного эфира выполнена с использованием
S0040-4039(99)00217-8
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ НОВОГО 10,11-ДИДЕГИДРОАНАЛОГА ЭПОТИЛОНА D
819
11. Valeev R.F., Bikzhanov R.F., Yagafarov N.Z.,
17. Evans D.A., Ennis M.D., Mathre D.J. J. Am. Chem.
Miftakhov M.S. Tetrahedron. 2012, 68, 6868-6872.
Soc. 1982, 104, 1737-1739. doi 10.1021/ja00370a050
doi 10.1016/j.tet.2012.06.020
18. Bull S.D., Davies S.G., Jones S., Sanganee H.J.
12. Валеев Р.Ф., Бикжанов Р.Ф., Мифтахов М.С. ЖОрХ.
J. Chem. Soc. Perkin Trans. 1. 1999, 52, 387-398. doi
2015, 51, 679-682. [Valeev R.F., Bikzhanov R.F.,
10.1039/A809715A
Miftakhov M.S. Russ. J. Org. Chem. 2015, 51, 660-
19. Kotha S., Mandal K. Eur. J. Org. Chem. 2006, 23,
663.] doi 10.1134/S1070428015050139
5387-5393. doi 10.1002/ejoc.200600549
13. De Mico A., Margarita R., Parlanti L., Vescovi A.,
Piancatelli G. J. Org. Chem. 1997, 62, 6974-6977. doi
20. Sytniczuk A., Dabrowski M., Banach L., Urban M.,
10.1021/jo971046m
Czarnocka-Sniadala S., Milewski M., Kajetanowicz A.,
14. Blakemore P.R., Cole W.J., Kocienski P.J., Morley A.
Grela K. J. Am. Chem. Soc. 2018, 140, 8895-8901. doi
Synlett. 1998, 1, 26-28. doi 10.1055/s-1998-1570
10.1021/jacs.8b04820
15. Валеев Р.Ф., Сунагатуллина Г.Р., Мифтахов М.С.
21. Inanaga J., Kirata K., Saeki H., Katsuki T., Yamagu-
ЖОрХ.
2017,
53,
1651-1654.
[Valeev R.F.,
chi M. Bull. Chem. Soc. Jpn. 1979, 52, 1989-1993. doi
Sunagatullina G.R.,
Miftakhov M.S. Russ. J.
10.1246/bcsj.52.1989
Org. Chem. 2017, 53, 1687-1690.] doi 10.1134/
22. Mukaiyama T., Usui M., Shimada E., Saigo K.
S1070428017110136
Chem. Lett.
1975,
4,
1045-1048. doi
10.1246/
16. Валеев Р.Ф., Сунагатуллина Г.Р., Лоза В.В., Мифта-
cl.1975.1045
хов М.С. ЖОрХ. 2018, 54, 1535-1539. [Valeev R.F.,
Sunagatullina G.R., Loza V.V., Miftakhov M.S. Russ.
23. Kocienski P.G. Protecting Groups. Stuttgard,
J. Org. Chem. 2018, 54, 1548-1552.] doi 10.1134/
New York: Thieme. 1994, 129-131. doi 10.1002/
S1070428018100172
ange.19951071834
Synthesis of the New 10,11-Didehydro Analogue of Epothilone D
R. F. Valeev, G. R. Sunagatullina, V. V. Loza, A. N. Lobov, and M. S. Miftakhov*
Ufa Institute of Chemistry, Ufa Federal Research Center,Russian Academy of Sciences,
prosp. Oktyabrya, 71, Ufa, 450054 Russia
*e-mail: bioreg@anrb.ru
Received December 29, 2020; revised January 11, 2021; accepted January 13, 2021
A chiral 10,11-didehydro analogue of epothilone D with isosteric substitution at the C15-C3 region of natural
epothilones was synthesized.
Keywords: epothilone D, analogs, synthesis, sources of chirality, d-carvone, (+)-pantolactone, Evans oxazoli-
din-2-one, intermolecular esterification, Yamaguchi and Mukayama reagents, metathesis cyclic closure, Grubbs
reagent
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021