ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 6, с. 832-841
УДК 547.79
СИНТЕЗ ПРОИЗВОДНЫХ 1,2,3-ТРИАЗОЛА
ЦИКЛОКОНДЕНСАЦИЕЙ АЛКИЛАЗИДОВ
С МЕТИЛЕНАКТИВНЫМИ КЕТОНАМИ
В СИСТЕМЕ К2СО3/ДМСО
© 2021 г. Н. Т. Походыло, Р. Д. Савка, М. Д. Обушак*
Львовский национальный университет им. Ивана Франко, Украина, 79005 Львов, ул. Кирилла и Мефодия, 6
*e-mail: mykola.obushak@lnu.edu.ua
Поступила в редакцию 18.01.2021 г.
После доработки 10.02.2021 г.
Принята к публикации 12.02.2021 г.
Взаимодействие β-кетоэфиров и ацетилацетона с алкилазидами в системе К2СО3/ДМСО выступает
удобным методом синтеза три- и дизамещенных 1Н-1,2,3-триазолов с алкильными заместителями в
положении 1 триазольного цикла.
Ключевые слова: азиды, 1,2,3-триазолы, реакция Димрота, 1,3-дикарбонильные соединения, цикло-
конденсации
DOI: 10.31857/S0514749221060057
ВВЕДЕНИЕ
имидазола, тетрабутиламмоний йодида и триэти-
ламина и последующую циклизацию азидов с ме-
Интерес к производным 1Н-1,2,3-триазола в
тиленактивными кетонами [18]. Такие превраще-
значительной мере обусловлен биологической ак-
ния получили название органоклик-реакции и им
тивностью многих соединений, содержащих этот
обычно приписывают механизм 1,3-диполярного
фрагмент [1, 2]. В частности, ранее обнаружена
[3+2]-циклоприсоединения [19-21].
противоопухолевая активность некоторых про-
изводных 1,2,3-триазола и найдены зависимости
Считалось, что реакции азидов с метиленак-
строение - активность, позволяющие оптимизиро-
тивными кетонами, активированными сложно-
вать поиск более активных соединений [3-5].
эфирной группой (β-кетоэфирами), хемоселек-
тивны. Однако недавно нами обнаружено, что
Одним из наиболее удобных методов синтеза
сложноэфирная группа может конкурировать с
1,2,3-триазолов, набирающих популярность в по-
следние годы, выступает взаимодействие азидов с
кетогруппой при взаимодействии с азидами [12,
15]. Так, при изучении реакций арилазидов с ал-
метиленактивными кетонами (реакция Димрота)
[6-17], поскольку некоторые варианты этой ре-
кил-3-R-3-оксопропаноатами в условиях реакции
акции соответствуют требованиям концепции
Димрота (МеОNa/МеОН) было установлено, что
клик-химии и могут быть осуществлены без ис-
в ряде случаев в результате атаки азидогруппы на
пользования тяжелых металлов в качестве ката-
сложноэфирную образуются стабильные 3-R-2-
лизаторов. Более того, такие превращения можно
диазо-3-оксо-N-(арил)пропанамиды. Показано, что
проводить однореакторно, что было показано на
с наибольшими выходами такие диазосоединения
примере синтеза 1,2,3-триазолов, включающего
образуются, если радикал является изопропилом,
преобразование спиртов в азиды действием ази-
циклопропилом, диэтоксиметилом, арилазиды
да натрия в присутствии N-(п-толуолсульфонил)-
содержат электроноакцепторные заместители, а
832
СИНТЕЗ ПРОИЗВОДНЫХ 1,2,3-ТРИАЗОЛА ЦИКЛОКОНДЕНСАЦИЕЙ АЛКИЛАЗИДОВ
833
определяющее влияние на выход диазопродуктов
азида 4 с ацетоуксусным эфиром 2а синтезирова-
имеет выбор системы основание-растворитель
но соединение 5 с выходом 87% (схема 2). Рядом
[15].
дальнейших преобразований эфир 5 превращен
в соответствующую кислоту 6 и бис-аллиламид
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
7, который служит перспективным мостиковым
В настоящей работе мы исследовали взаимо-
лигандом для синтеза π-комплексов переход-
действие β-кетоэфиров с алкилазидами. В отли-
ных металлов. Так, ранее было показано, что
чие от ароматических азидов, алкилазиды менее
N-аллиламиды 1,2,3-триазол-4-карбоновых кислот
реакционноспособны и гораздо менее изучены в
образуют π-комплексы меди, в которых координа-
таких циклизациях. В большинстве работ исследо-
ционная сфера атома Cu(I) состоит из аллильного
вано их взаимодействие с ацетоуксусным эфиром.
фрагмента, атома кислорода карбонильной группы
Изучены, например, эфиры 3-арил-2-азидопропа-
и атома азота N3 триазольного ядра [28].
новых кислот [22] и 2-азидонорборнен [23]. На
Как уже отмечалось, в последнее время все
основе 1-алкил-1,2,3-триазол-4-карбоновых кис-
шире применяют однореакторные методы синтеза,
лот получены соединения, обладающие широким
позволяющие получать азиды in situ и вводить их в
спектром биологической активности. Среди них
реакции с метиленактивными карбонильными сое-
найдены активаторы калиевых каналов большой
динениями. Этот подход был реализован нами при
проводимости [24], ингибиторы сукцинатдегидро-
использовании метил-5-(хлорметил)фуран-2-кар-
геназы [25], соединения, обладающие фунгицид-
боксилата (8). Нуклеофильное замещение хлора
ным и инсектицидным действием [26].
азидогруппой и циклизацию ацетоуксусного эфи-
ра с образовавшимся азидом проводили без выде-
Ранее показано, что в системе K2CO3/ДМСО
бензилазиды выступают удобными реагентами
ления последнего, в результате чего получено сое-
для получения
1,4,5-тризамещенных
1,2,3-три-
динение 9 с выходом 57% (схема 3).
азолов [27]. В данной работе мы исследовали
В аналогичных условиях однореакторного син-
взаимодействие бензилазида 1а с рядом β-кето-
теза испытан также 4,4'-бис(бромметил)бифенил
эфиров разного строения, содержащих алкиль-
(10). Получен бис-эфир 11, который легко подвер-
ные, арильные и гетарильные заместители. Было
гается гидролизу в щелочных условиях с образо-
установлено, что бензилазид 1а реагирует с 3-
ванием соответствующей кислоты 12 (схема 4).
алкил-3-оксопропаноатами 2a-f, 3-оксо-3-фенил-
Контроль за ходом гидролиза осуществляли с по-
пропаноатом
2g и
3-(фуран-2-ил)-3-оксопропа-
мощью ИК спектроскопии, наблюдая изменения в
ноатом 2h хемоселективно, без образования ди-
интенсивности полос поглощения карбонильных
азосоединений, что дало возможность получить
групп соединений 11 (1708 см-1) и 12 (1682 см-1).
с хорошими выходами 1-бензил-5-R1-1,2,3-триа-
Установлено, что 3-азидопропанамид 1b в си-
зол-4-карбоновые кислоты 3a-h (схема 1).
стеме K2CO3/ДМСО реагирует с ацетилацетоном
Для синтеза соединений, содержащих 2 три-
13 с образованием триазола 14 с хорошим выхо-
азольных цикла в одной молекуле, использовали
дом (83%) (схема 5). 4-Ацетилтриазолы типа 14 -
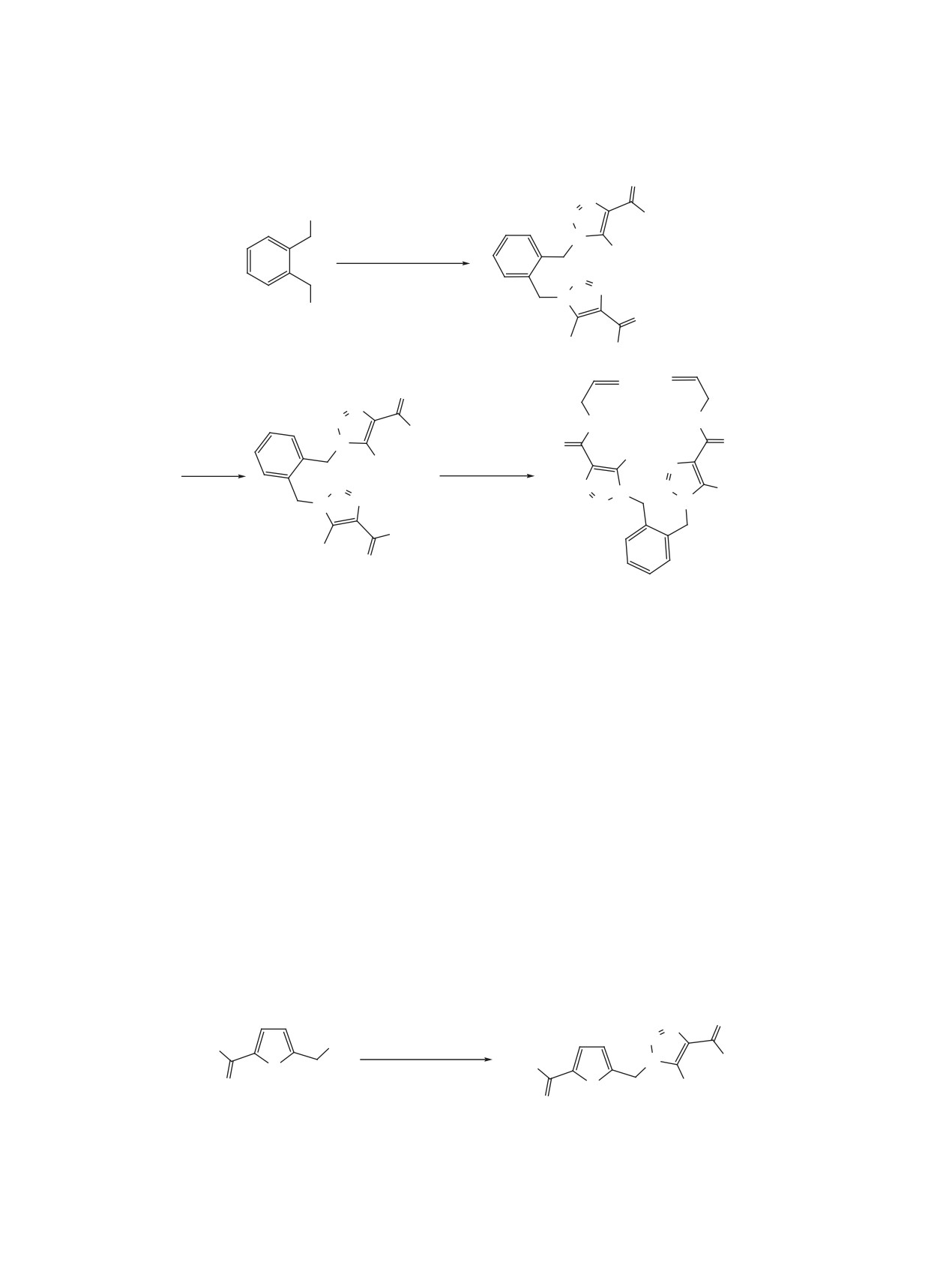
1,2-бис(азидометил)бензол (4). Конденсацией ди-
удобные реагенты для дальнейших преобразова-
Схема 1
O
N
O O
N3
1. K2CO3/ДМСО
N
OH
+
2. NaOH/H2O
N
R1
OAlk
R1
1a
2a-h
3a-h
R1 = Me (a), Et (b), Pr (c), i-Pr (d), цикло-Pr (e), EtSCH2 (f), Ph (g), фуран-2-ил (h).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
834
ПОХОДЫЛО и др.
Схема 2
O
N
N3
N
OEt
CH3COCH2COOEt
N
2a
Me
K2CO3/ДМСО
N
N
N
N3
O
Me
OEt
4
5
O
N
N
NH
HN
OH
N
O
O
Me
NaOH
Me
SOCl2
N
H2O
N
аллиламин,
N
N
N
Me
N
N
Et3N,
N
N
диоксан
OH
Me
O
6
7
ний по ацетильной группе [29, 30]. Для этих же
алюмогидрида лития восстановлен до спирта 16.
целей может быть использован амидный фрагмент
На примере соединения 15b показана возмож-
соединения 14.
ность получения 1,5-дизамещенных триазолов.
Гидролизом эфира 15b и последующим декарбок-
Разработанная методика была использова-
силированием кислоты 17 получен триазол 18, в
на нами для синтеза соединений, содержащих
котором амидный фрагмент был восстановлен до
5-(бензо[d][1,3]диоксол-5-ил)-1Н-1,2,3-триазоль-
амина 19.
ный фрагмент. Выбор такой группировки обуслов-
лен поиском соединений с противоопухолевой
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
активностью с учетом того, что недавно произво-
Спектры ЯМР
1Н записаны на приборах
дные {5-(бензо[d][1,3]диоксол-5-ил)-1H-тетразол-
VarianUnity +400 (Varian Co., CША) и BrukerAvance
1-ил}уксусной кислоты продемонстрировали зна-
500 (Bruker Co., CША) с рабочей частотой 400 и
чительный уровень активности на линиях клеток
500 МГц соответственно, внутренний стандарт -
рака молочной железы [31]. Было изучено взаимо-
ТМС. Масс-спектры получены на хроматомасс-
действие азидов 1b,c с эфиром 2i и установлено,
спектрометре Agilent
1100 LC/MSD (Agilent
что при этом образуются триазолы 15a, b с уме-
Technologies Co., США) со способом ионизации
ренным выходом (схема 6). Эфир 15а действием
APCI. Спектры ИК записаны на спектрометре
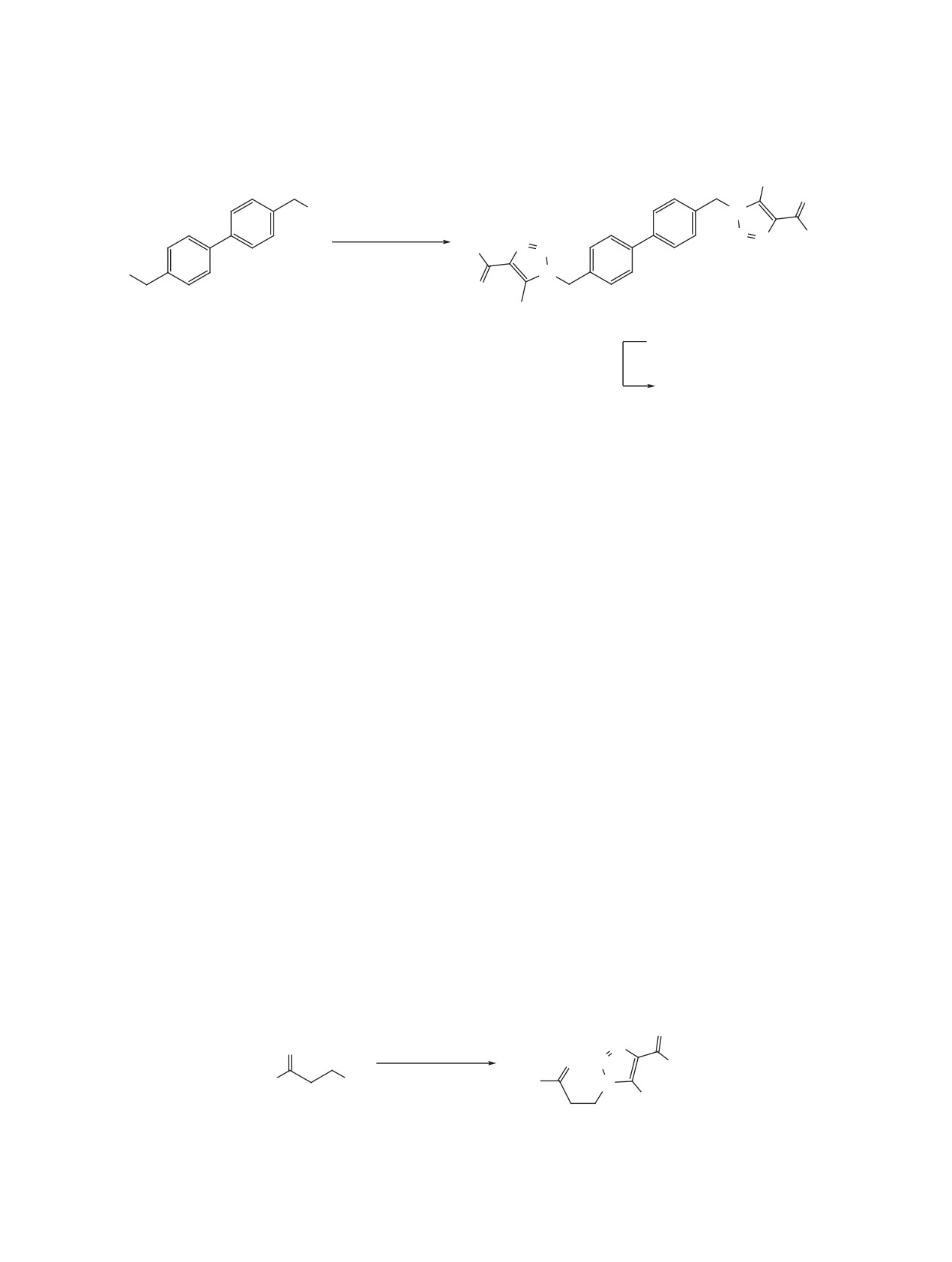
Схема 3
O
N
CH3COCH2COOEt
N
MeO
Cl
2a
MeO
N
OEt
O
NaN3, K2CO3, ДМСО
O
O
Me
O
8
9
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ ПРОИЗВОДНЫХ 1,2,3-ТРИАЗОЛА ЦИКЛОКОНДЕНСАЦИЕЙ АЛКИЛАЗИДОВ
835
Схема 4
Me
O
Br
CH3COCH2COOEt
N
2a
N N
OR
RO
N
N
NaN3, K2CO3, ДМСО
Br
N
O
Me
10
11, 12
COOEt
NaOH
EtOH,
11
H2O
COOH
R = Et (11), H (12).
12
FTIR Spectrum 2000 Perkin Elmer. Элементный
C 31.51; H 5.34; N 49.07. C3H6N4O. Вычислено, %:
анализ выполнен на приборе Carlo Erba
1106
C 31.58; H 5.30; N 49.10.
(Carlo-Erba Co., Италия). Температуру плавления
1-(2-Азидоэтил)пирролидин
(1c).
Выход
определяли на приборе Boetius (VEB Wägetechnik
13.31 г (95%), бесцветная жидкость. Спектр ЯМР
Rapido, Германия). Контроль за ходом реакции осу-
1H (400 МГц, ДМСО-d6), δ, м.д.: 1.72-1.85 м (4H,
ществлялся методом ТСХ на пластинках Silufol,
СН2), 2.54-2.62 м (4H, СН2), 2.70 т (2H, СН2, J
UV-254.
6.1 Гц), 3.35 т (2H, СН2, J 6.1 Гц). Масс-спектр
Кетоэфиры 2 получены по описанной нами
(ХИ), m/z: 141 [М + Н]+. Найдено, %: C 51.52; H
ранее методике [32].
8.71; N 39.83. C6H12N4. Вычислено, %: C 51.41; H
8.63; N 39.97.
Азиды 1а-с (общая методика). К раствору га-
логенпроизводного (0.1 моль) в 50 мл MeOH при-
1,2-Бис(азидометил)бензол (4) синтезировали
бавляли раствор 6.5 г NaN3 в 15 мл Н2О и кипяти-
аналогично соединению 1, используя 2 экв NaN3.
ли 2-3 ч. Упаривали в вакууме метанол и экстра-
Выход 18.05 г (96%), бесцветная жидкость [33].
гировали азид хлористым метиленом. После упа-
Масс-спектр (ХИ), m/z: 189 [М + Н]+. Найдено, %:
ривания растворителя в вакууме получали чистые
C 51.14; H 4.22; N 44.71. C8H8N6. Вычислено, %: C
азиды.
51.06; H 4.28; N 44.66.
Бензилазид (1a). Выход 12.65 г (95%), бес-
1,2,3-Триазол-4-карбоновые кислоты 3a-h,
цветная жидкость [27]. Масс-спектр (ХИ), m/z: 134
5, 14, 15 (общая методика). К раствору 0.01 моль
[М + Н]+. Найдено, %: C 63.07; H 5.43; N 31.51.
соответствующего азида в 4 мл ДМСО прибавляли
C7H7N3. Вычислено, %: C 63.14; H 5.30; N 31.56.
9.6 г (0.07 моль) K2CO3 и 0.01 моль β-кетоэфира
3-Азидопропанамид
(1b). Выход
10.61 г
2 или ацетилацетона 13 (для синтеза эфира 5 ис-
(93%), т.пл. 55-57°С. Спектр ЯМР 1H (400 МГц,
пользовали двойное количество ДМСО, K2CO3 и
ДМСО-d6), δ, м.д.: 2.34 т (2H, СН2, J 6.5 Гц), 3.46 т
ацетоуксусного эфира). Суспензию перемешивали
(2H, СН2, J 6.5 Гц), 6.85 с (1H, NH), 7.36 с (1H, NH).
при 40-50°С в течение 10 ч, охлаждали до 5°С и
Масс-спектр (ХИ), m/z: 115 [М + Н]+. Найдено, %:
прибавляли 30 мл воды. Осадок отфильтровывали
Схема 5
O
CH3COCH2COCH3
O
13
N
O N
Me
K2CO3, ДМСО
H2N
N3
H2N
N
Me
1b
14
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
836
ПОХОДЫЛО и др.
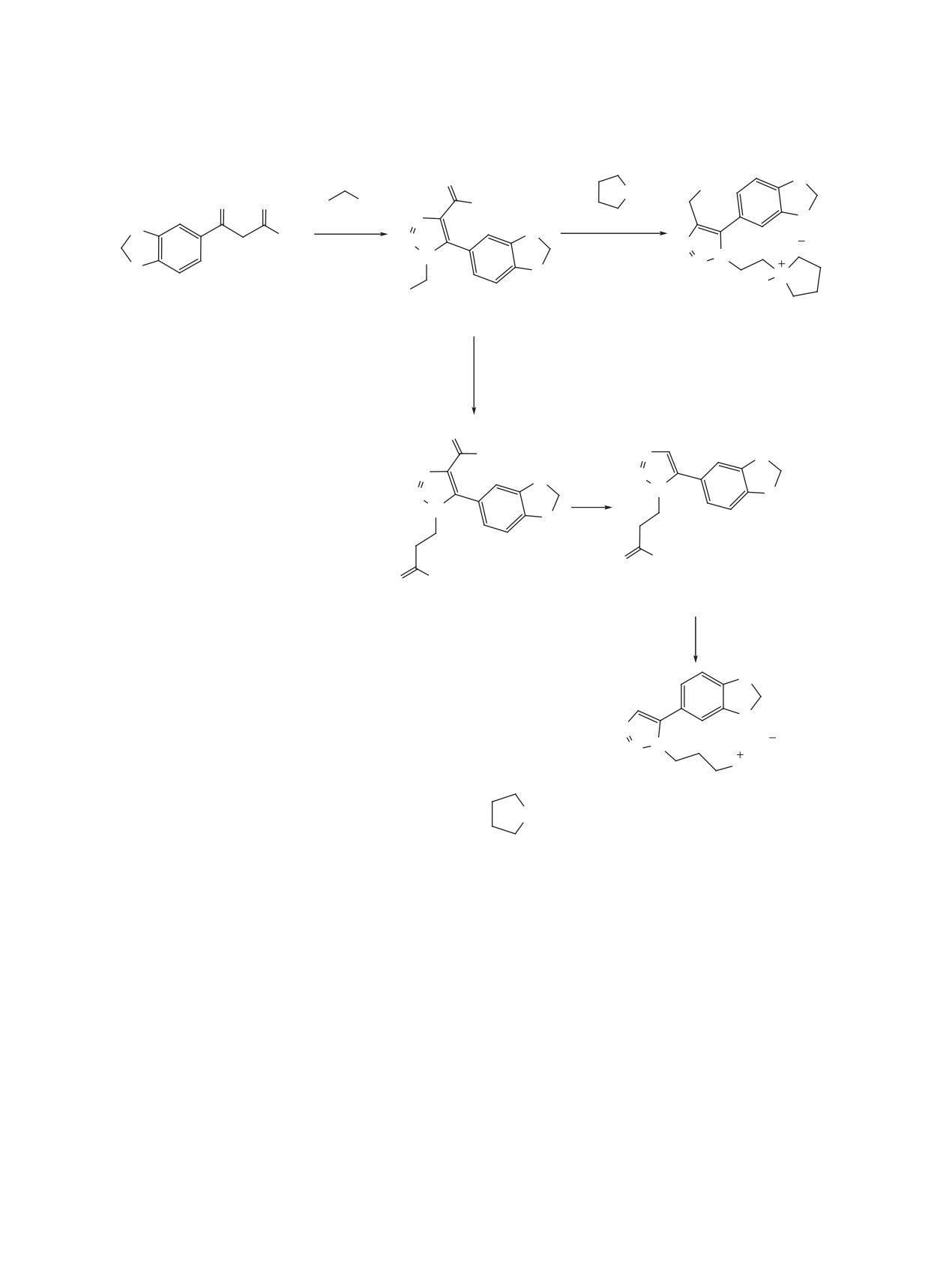
Схема 6
O
O
OH
R =
NCH2
O
O
R
N3
OEt
1b, c
N
O
LAH, ТГФ
O
O
OEt
N
K2CO
3
0°C, до rt, 12 ч
N
Cl
N
N
ДМСО
N
O
O
N
H
R
2i
15a, b
16
R = CH2CONH2
NaOH, EtOH
H2O, rt, 12 ч
O
OH
N
O
N
O
N
N
N
∆
O
N
O
O
NH2
O
NH2
17
18
LAH
ТГФ
O
O
N
Cl
N N
NH
3
19
R = CH2CONH2 (b),
NCH2
(c).
,6
,4
и получали эфиры кислот 3 и 5. Для превращения
H2
ом
, J 7.2 Гц), 7.25-7.38 м (3H, H3
о,
5, 12.75 уш.с
эфиров в кислоты их растворяли в 10 мл спирта и
(1H, СООН). Масс-спектр (ХИ), m/z: 218 [M + H]+.
прибавляли 4 мл 30%-го водного раствора NaOH.
Найдено, %: C 60.65; H 5.19; N 19.38. C11H11N3O2.
Для синтеза кислоты 6 использовали 4 мл 60%-го
Вычислено, %: C 60.82; H 5.10; N 19.34.
водного раствора NaOH. Смесь кипятили в тече-
1-Бензил-5-этил-1Н-1,2,3-триазол-4-карбо-
ние 1 ч, охлаждали до комнатной температуры и
новая кислота (3b). Выход 1.78 г (77%), т.пл.
подкисляли соляной кислотой до рН 1.0. Осадок
108-109°С. Спектр ЯМР 1H (400 МГц, ДМСО-d6),
отфильтровывали и при необходимости перекри-
δ, м.д.: 0.90 т (3H, СН3, J 7.4 Гц), 2.91 к (2H, СН2,
сталлизовывали из спирта или смеси спирт-вода.
,6
J 7.4 Гц), 5.64 с (2H, CH2бенз), 7.21 д (2H, H2
ом
, J
,4,
1-Бензил-5-метил-1Н-1,2,3-триазол-4-карбо-
7.2 Гц), 7.27-7.46 м (3H, H3
о
м
5), 12.92 уш.с (1H,
новая кислота (3a) [27]. Выход 1.58 г (73%), т.пл.
СООН). Масс-спектр (ХИ), m/z: 232 [M + H]+.
160-161°С. Спектр ЯМР 1H (400 МГц, ДМСО-d6),
Найдено, %: C 62.43; H 5.78; N 18.22. C12H13N3O2.
δ, м.д.: 2.44 с (3H, СН3), 5.59 с (2H, СН2), 7.19 д (2H,
Вычислено, %: C 62.33; H 5.67; N 18.17.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ ПРОИЗВОДНЫХ 1,2,3-ТРИАЗОЛА ЦИКЛОКОНДЕНСАЦИЕЙ АЛКИЛАЗИДОВ
837
1-Бензил-5-пропил-1Н-1,2,3-триазол-4-кар-
[M + H]+. Найдено, %: C 68.91; H 4.74; N 15.17.
боновая кислота (3с). Выход 1.84 г (75%), т.пл.
C16H13N3O2. Вычислено, %: C 68.81; H 4.69; N
72-73°С. Спектр ЯМР 1H (400 МГц, ДМСО-d6),
15.05.
δ, м.д.: 0.78 т (3H, СН3, J 7.2 Гц), 1.23-1.41 м
1-Бензил-5-(фуран-2-ил)-1Н-1,2,3-триазол-
(2H, СН2), 2.87 т (2H, СН2, J 7.6 Гц), 5.64 с (2H,
4-карбоновая кислота (3h). Выход 1.70 г (63%),
,6
CH2N), 7.21 д (2H, H2
, J 7.4 Гц), 7.26-7.47 м
ом
т.пл.
156-157°С. Спектр ЯМР
1H (400 МГц,
,4
(3H, H3
5), 12.93 уш.с (1H, СООН). Масс-спектр
о,
ДМСО-d6), δ, м.д.: 5.82 с (2Н, СН2), 6.62 д.д (1Н,
(ХИ), m/z: 246 [M + H]+. Найдено, %: C 63.81; H
,6
H4фуран, J 1.6, 3.2 Гц), 7.12 д (2Н, H2
, J 7.6 Гц);
ом
6.02; N 17.02. C13H15N3O2. Вычислено, %: C 63.66;
,4,
7.25-7.28 м (4Н, H3
5 + H3фуран), 7.84 уш.c (1H,
о м
H 6.16; N 17.13.
H5фуран), 13.00 уш.с (1Н, СООН). Масс-спектр
(ХИ), m/z: 270 [M + H]+. Найдено, %: C 62.67; H
1-Бензил-5-изопропил-1Н-1,2,3-триазол-4-
3.96; N 15.73. C14H11N3O3. Вычислено, %: C 62.45;
карбоновая кислота (3d). Выход 1.74 г (71%),
H 4.12; N 15.61.
т.пл.
80-81°С. Спектр ЯМР
1H
(400 МГц,
ДМСО-d6), δ, м.д.: 1.14 д (6H, СН3, J 6.9 Гц), 3.42
Диэтил-1,1'-[1,2-фениленбис(метилен)]бис-
гептет (2H, СН, J 6.9 Гц), 5.71 с (2H, СН2), 7.14
(5-метил-1Н-1,2,3-триазол-4-карбоксилат)
(5).
,6
,4,
д (2H, H2
, J 7.2 Гц), 7.24-7.41 м (3H, H3
5),
Выход 2.84 г (69%), т.пл. 98-99°С. Спектр ЯМР 1H
ом
о
м
12.95 уш.с (1H, СООН). Масс-спектр (ХИ), m/z:
(500 МГц, ДМСО-d6), δ, м.д.: 1.33 т (6Н, СН3, J
246 [M + H]+. Найдено, %: C 63.74; H 6.11; N 17.01.
7.3 Гц), 2.50 с (6H, СН3триазол), 4.33 к (4Н, СН2СН3,
C13H15N3O2. Вычислено, %: C 63.66; H 6.16; N
J 7.3 Гц), 5.85 с (4Н, СН2N), 6.74-6.78 м (2Наром),
17.13.
7.30-7.34 м (2Наром). Масс-спектр (ХИ), m/z: 413
[M + H]+. Найдено, %: C 58.41; H 5.66; N 20.23.
1-Бензил-5-циклопропил-1Н-1,2,3-триазол-
C20H24N6O4. Вычислено, %: C 58.24; H 5.87; N
4-карбоновая кислота
(3e). Выход
1.58 г
20.38.
(65%), т.пл. 64-65°С. Спектр ЯМР 1H (400 МГц,
3-(4-Ацетил-5-метил-1Н-1,2,3-триазол-1-ил)-
ДМСО-d6), δ, м.д.: 0.94-0.98 м (4H, Нциклопр), 1.71-
пропанамид (14). Выход 1.63 г (83%), т.пл. 63-
1.75 м (1Н, Нциклопр), 5.65 c (2H, CH2N), 7.19 д (2Н,
,6
64°С. Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ,
H2
ом
, J 6.8 Гц), 7.28 т (1Н, H4аром, J 6.8 Гц), 7.33 т
,5
м.д.: 2.47 с (3H, СН3), 2.51 с (3H, СН3), 2.68 т (2H,
(2Н, H3
, J 6.8 Гц). Масс-спектр (ХИ), m/z: 244
ом
CH2, J 5.2 Гц), 4.42 т (1H, CH2N, J 5.2 Гц), 6.89
[M + H]+. Найдено, %: C 63.99; H 5.58; N 17.13.
c (1H, NH), 7.40 с (1H, NH). Масс-спектр (ХИ),
C13H13N3O2. Вычислено, %: C 64.19; H 5.39; N
m/z: 197 [M + H]+. Найдено, %: C 48.90; H 6.27; N
17.27.
28.48. C8H12N4O2. Вычислено, %: C 48.97; H 6.16;
1-Бензил-5-(этилтиометил)-1Н-1,2,3-три-
N 28.56.
азол-4-карбоновая кислота (3f). Выход 1.77 г
Этил-5-(бензо[d][1,3]диоксол-5-ил)-1-[2-
(64%), т.пл. 53-54°С. Спектр ЯМР 1H (400 МГц,
(пирролидин-1-ил)этил]-1Н-1,2,3-триазол-
ДМСО-d6), δ, м.д.: 1.11 т (3Н, СН3, J 7.3 Гц), 2.43
4-карбоксилат (15а). Выход 1.83 г (51%), т.пл.
к (2Н, СН2СН3, J 7.3 Гц), 4.15 c (2Н, СН2S), 5.67
42-43°С. Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ,
,6
c (2H, CH2N), 7.27 д (2Н, H2
, J 7.8 Гц), 7.30-
ом
м.д.: 1.24 т (3H, CH3, J 7.1 Гц). 1.59-1.71 м (4H,
,4,
7.42 м (3Н, H3
о
м
5). Масс-спектр (ХИ), m/z: 278
CH2), 2.26-2.37 м (4H, CH2N), 2.80 т (2H, CH2N,
[M + H]+. Найдено, %: C 56.50; H 5.64; N 15.26.
J 6.0 Гц), 4.20 к (2H, CH2O, J 7.1 Гц), 4.31 т (2H,
C13H15N3O2S. Вычислено, %: C 56.30; H 5.45; N
CH2N, J 6.0 Гц), 6.10 с (2H, OCH2O), 6.91 д (1H,
15.15.
,6
H5аром, J 8.0 Гц), 6.94-7.03 м (2H, H2
). Масс-
ом
спектр (ХИ), m/z: 359 [M + H]+. Найдено, %: C
1-Бензил-5-фенил-1Н-1,2,3-триазол-4-кар-
60.41; H 6.28; N 15.52. C18H22N4O4. Вычислено, %:
боновая кислота (3g). Выход 1.87 г (67%), т.пл.
C 60.32; H 6.19; N 15.63.
188-189°С. Спектр ЯМР 1H (400 МГц, ДМСО-d6),
δ, м.д.: 5.45 c (2H, CH2N), 6.93-7.00 м (2Наром),
Этил-1-(3-амино-3-оксопропил)-5-(бензо[d]-
7.22-7.28 м (3Наром), 7.31 д (2Наром, J 7.8 Гц),
[1,3]диоксол-5-ил)-1Н-1,2,3-триазол-4-карбок-
7.42-7.49 м (3Наром). Масс-спектр (ХИ), m/z: 280
силат (15b). Выход 2.49 г (75%), т.пл. 58-59°С.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
838
ПОХОДЫЛО и др.
Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.: 1.08
Гидролиз эфиров 5 и 11. К раствору 0.01 моль
т (3H, CH3, J 7.2 Гц), 2.74 т (2H, CH2, J 6.8 Гц),
эфира в 20 мл спирта прибавляли 4 мл 60%-го
4.20 к (2H, CH2O, J 7.2 Гц), 4.34 т (1H, CH2N, J
водного раствора NaOH. Смесь кипятили в тече-
6.8 Гц), 6.10 с (2H, OCH2O), 6.76 с (1H, NH),
ние 1 ч, охлаждали до комнатной температуры и
,7
6.93-7.01 м (2H, H6
), 7.03 с (1H, H4аром), 7.38
подкисляли соляной кислотой до рН 1.0. Осадок
ом
с (1H, NH). Масс-спектр (ХИ), m/z: 333 [M + H]+.
отфильтровывали и при необходимости перекри-
Найдено, %: C 54.34; H 4.97; N 16.81. C15H16N4O5.
сталлизовывали из спирта или смеси спирт-вода.
Вычислено, %: C 54.21; H 4.85; N 16.86.
1,1'-[1,2-Фениленбис(метилен)]бис(5-метил-
Однореакторный синтез эфиров 1,2,3-три-
1Н-1,2,3-триазол-4-карбоновая кислота)
(6).
азол-4-карбоновой кислоты 9, 11 (общая методи-
Выход 3.38 г (95%), т.пл. 218-219°С. Спектр
ка). К раствору 2.86 г (0.016 моль) метил-5-(хлор-
ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.: 2.49 с (6H,
метил)фуран-2-карбоксилата
(8) или
2.72 г
СНтриазол), 5.84 с (4Н, СН2), 6.74-6.80 м (2Наром),
(0.008 моль) 4,4'-бис(бромметил)бифенила
(10)
7.30-7.37 м (2Наром). Масс-спектр (ХИ), m/z: 357
в 10 мл ДМСО прибавляли 1.25 г (0.019 моль)
[M + H]+. Найдено, %: C 53.75; H 4.67; N 23.40.
NaN3. Суспензию перемешивали при комнатной
C16H16N6O4. Вычислено, %: C 53.93; H 4.53; N
температуре в течение 5 ч. Затем к реакцион-
23.58.
ной смеси прибавляли 10 г (0.072 моль) K2CO3 и
1,1'-[Бифенил-4,4'-диилбис(метилен)]бис(5-
2.05 мл (0.016 моль) ацетоуксусного эфира и пере-
метил-1Н-1,2,3-триазол-4-карбоновая кисло-
мешивали при 40-50°С в течение 12 ч, охлаждали
та) (12). Выход 3.59 г (83%), т. пл. 256-257°С. ИК
до 5°С и прибавляли 100 мл воды. Экстрагировали
спектр, ν, см-1: 3040, 2885, 2657, 2586, 1682 (СО),
50 мл хлористого метилена, сушили сульфатом на-
1574, 1479, 1451, 1337, 1301, 1266, 1234, 1195,
трия. Растворитель упаривали и получали триазо-
1097, 932, 781, 757. Спектр ЯМР 1H (400 МГц,
лы 9 и 11.
ДМСО-d6), δ, м.д.: 2.50 с (6H, СН3), 5.69 с (4H,
Этил-1-{[5-(метоксикарбонил)фуран-2-ил]-
СН2), 7.31 д (4Hаром, J 8.0 Гц), 7.68 д (4Hаром, J
метил}-5-метил-1Н-1,2,3-триазол-4-карбок-
8.0 Гц), 13.04 уш.с (2H, СООН). Масс-спектр (ХИ),
силат (9). Выход 2.67 г (57%), желтая жидкость.
m/z: 433 [M + H]+. Найдено, %: C 61.01; H 4.74; N
Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.:
19.57. C22H20N6O4. Вычислено, %: C 61.10; H 4.66;
1.26 т (3H, CH3, J 6.8 Гц), 2.46 с (3H, CH3), 3.74
N 19.43.
с (3H, CH3O), 4.26 к (2H, CH2O, J 6.8 Гц), 5.76 с
1,1'-[1,2-Фениленбис(метилен)]бис(N-аллил-
(2H, CH2N), 6.70 д (1H, Hфуран, J 3.2 Гц),7.24 д
5-метил-1Н-1,2,3-триазол-4-карбоксамид) (7). К
(1H, Hфуран, J 3.2 Гц). Масс-спектр (ХИ), m/z: 294
5 г (0.014 моль) кислоты 6 прибавляли 10 мл ти-
[M + H]+. Найдено, %: C 53.30; H 5.24; N 14.21.
онилхлорида и кипятили 3 ч. После упаривания
C13H15N3O5. Вычислено, %: C 53.24; H 5.16; N
остатка тионилхлорида получали хлорангидрид
14.33.
кислоты 6 с количественным выходом. Прибавляли
Диэтил-1,1'-[бифенил-4,4'-диилбис(мети-
порциями 3.93 г (0.01 моль) хлорангидрида к
лен)]бис(5-метил-1Н-1,2,3-триазол-4-карбокси-
охлажденному на ледяной бане раствору 1.14 г
лат) (11). Выход 2.81 (72%), т.пл. 166-167°С. ИК
(0.02 моль) аллиламина и 2.8 мл (0.02 моль) три-
спектр, ν, см-1: 2988, 2934, 2906, 1708 (СО), 1567,
этиламина в 10 мл диоксана. Смесь оставляли при
1480, 1450, 1425, 1398, 1370, 1341, 1305, 1242,
комнатной температуре на ночь. Прибавляли 30 мл
1200, 1185, 1099, 1081, 1021, 981, 848, 796, 786.
воды, осадок отфильтровывали и перекристалли-
Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.: 1.40
зовывали из спирта. Выход 3.65 г (84%), т.пл. 117-
т (6H, CH3CH2, J 7.1 Гц), 2.48 с (6H, СН
3триазол),
118°С. Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ,
4.41 к (4H, CH3CH2, J 7.1 Гц), 5.56 с (4H, NCH2),
м.д.: 2.54 c (6Н, СН3), 3.86-3.90 м (4Н, CH2NHСО),
7.23 д (4Hаром, J 8.2 Гц), 7.51 д (4Hаром, J 8.2 Гц).
5.07 д.д (2Н, HцCиH=CH, J 1.4, 10.2 Гц), 5.15 д.д (2Н,
Масс-спектр (ХИ), m/z: 489 [M + H]+. Найдено, %:
HтCрHа=нCсH, J 1.4, 17.1 Гц), 5.85 с (4Н, СН2), 5.93-
C 63.79; H 5.67; N 17.40. C26H28N6O4. Вычислено,
5.97 м (2Н, -СН=), 6.67-6.72 м (2Наром), 7.29-7.33
%: C 63.92; H 5.78; N 17.20.
м (2Наром), 8.65 уш.с (2Н, NH). Масс-спектр (ХИ),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ ПРОИЗВОДНЫХ 1,2,3-ТРИАЗОЛА ЦИКЛОКОНДЕНСАЦИЕЙ АЛКИЛАЗИДОВ
839
m/z: 435 [M + H]+. Найдено, %: C 60.71; H 5.81; N
ния выделения СО2. Охлаждали. Выход соедине-
25.90. C22H26N8O2. Вычислено, %: C 60.81; H 6.03;
ния 18 количественный, т.пл. 128-129°С. Спектр
N 25.79.
ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.: 2.71 т (2H,
CH2, J 7.1 Гц), 4.35 т (2H, CH2, J 6.8 Гц), 6.12 с
{5-(Бензо[d][1,3]диоксол-5-ил)-1-[2-(пирро-
(2H, OCH2O), 6.75 с (1H, NH), 6.94-7.02 м (2H,
лидин-1-ил)этил]-1Н-1,2,3-триазол-4-ил}ме-
,7
H6
), 7.02 с (1H, H4аром), 7.61 с (1Hтриазол), 7.33
танола гидрохлорид (16). К раствору 1.18 г
ом
с (1H, NH). Масс-спектр (ХИ), m/z: 261 [M + H]+.
(0.0033 моль) соединения 15а в 50 мл ТГФ при
Найдено, %: C 55.25; H 4.53; N 21.40. C12H12N4O3.
0°С и перемешивании прибавляли порциями
Вычислено, %: C 55.38; H 4.65; N 21.53.
0.14 г (0.0033 моль) алюмогидрида лития и остав-
ляли на ночь. Охлаждали и прибавляли капля-
3-[5-(Бензо[d][1,3]диоксол-5-ил)-1Н-1,2,3-
ми 0.14 мл воды, 0.28 мл 10%-го NaOH и снова
триазол-1-ил]пропан-1-амина гидрохлорид (19).
0.28 мл воды. Перемешивали при комнатной тем-
К раствору 0.26 г (1 ммоль) амида 18 в 5 мл ТГФ
пературе 15 мин, фильтровали через тонкий слой
при 0°С и перемешивании прибавляли порциями
силикагеля и после упаривания растворителя в ва-
0.1 г (2.1 ммоль) алюмогидрида лития и оставляли
кууме прибавляли 4 мл эфира, насыщенного хлори-
на ночь. Кипятили 2 ч, охлаждали и прибавляли по
стым водородом (~2.0 M). Образовавшийся осадок
каплям 0.1 мл воды, затем 0.2 мл 10%-го NaOH и
отфильтровывали. Выход 0.98 г (95%), т.пл. 176°С
снова 0.1 мл воды. Перемешивали при комнатной
(разл.). Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ,
температуре 15 мин, фильтровали через тонкий
м.д.: 1.73-1.85 м (2H, CH2). 1.88-2.03 м (2H, CH2),
слой силикагеля и после упаривания растворителя
2.87-3.00 м (2H, CH2), 3.38-3.49 м (2H, CH2), 3.61-
в вакууме прибавляли 1 мл эфира, насыщенного
3.69 м (2H, CH2), 4.36-4.41 м (3H, CH2 + ОН), 4.68
хлористым водородом (~2.0 M). Образовавшееся
т (2H, CH2, J 6.5 Гц), 6.12 с (2H, OCH2O), 7.05 д
вязкое масло отделяли. Выход 0.21 г (75%). Спектр
(1H, H5аром, J 7.9 Гц), 7.09 д (1H, H6аром, J 7.9 Гц),
ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.: 1.09 т (2H,
7.17 с (1H, H2аром), 10.97 с (1H, NH). Масс-спектр
CH2, J 7.2 Гц). 3.26-3.47 м (2H, CH2), 4.46 т (2H,
(ХИ), m/z: 317 [M + H]+. Найдено, %: C 54.33; H
CH2, J 7.1 Гц), 6.12 с (2H, OCH2O), 7.02 д (1H,
6.14; N 15.96. C16H20N4O3·HCl. Вычислено, %: C
Н7аром, J 7.5 Гц), 7.09 д (1H, Н6аром, J 7.6 Гц), 7.15 с
54.47; H 6.00; N 15.88.
(1H, Н4аром), 7.83 с (1Hтриазол), 7.89 уш.с (3H, NH3+).
Масс-спектр (ХИ), m/z: 247 [M + H]+. Найдено, %: C
1-(3-Амино-3-оксопропил)-5-(бензо[d][1,3]-
50.84; H 5.22; N 19.98. C12H15ClN4O2. Вычислено,
диоксол-5-ил)-1Н-1,2,3-триазол-4-карбоно-
%: C 50.98; H 5.35; N 19.82.
вая кислота (17). Растворяли 0.64 г (2 ммоль)
эфира 15b в 30 мл этанола, прибавляли раствор
ВЫВОДЫ
0.08 г (2 ммоль) NaOH в 1 мл воды и оставляли
Показано, что циклоконденсация алкилазидов
на ночь. Упаривали этанол, остаток растворяли
с β-кетоэфирами или 1,3-дикетонами в условиях
в воде, экстрагировали хлористым метиленом.
оснóвного катализа выступает удобным методом
Водный слой подкисляли НСl до кислой реакции.
синтеза производных 1,2,3-триазола с алкильными
Образовавшийся осадок кислоты 17 отфильтровы-
заместителями в положении 1, привлекательных
вали. Выход 0.56 г (92%), т.пл. 156-157°С. Спектр
для исследований противоопухолевой активнос-
ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.: 2.73 т (2H,
ти.
CH2, J 7.1 Гц), 4.33 т (2H, CH2, J 6.8 Гц), 6.11 с (2H,
,7
OCH2O), 6.75 с (1H, NH), 6.93-7.00 м (2H, H6
),
ФОНДОВАЯ ПОДДЕРЖКА
ом
7.02 с (1H, H4аром), 7.35 с (1H, NH), 12.56 уш.с (1Н,
Работа выполнена при финансовой поддерж-
СООН). Масс-спектр (ХИ), m/z: 305 [M + H]+.
ке Национального фонда исследований Украины
Найдено, %: C 51.45; H 3.92; N 18.37. C13H12N4O5.
(проект 2020.01/0166) и Министерства образова-
Вычислено, %: C 51.32; H 3.98; N 18.41.
ния и науки Украины (проект «Разработка пер-
3-{5-(Бензо[d][1,3]диоксол-5-ил)-1Н-1,2,3-
спективных методов конструирования соединений
триазол-1-ил}пропанамид (18). Кислоту 17 на-
с антимикробным и противораковым действием»
гревали при температуре плавления до прекраще-
№ 0121U107777).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
840
ПОХОДЫЛО и др.
КОНФЛИКТ ИНТЕРЕСОВ
15.
Pokhodylo N.T., Shyyka O.Ya., Matiychuk V.S.,
Obushak M.D., Pavlyuk V.V. ChemistrySelect. 2017, 2,
Авторы заявляют об отсутствии конфликта ин-
5871-5876. doi 10.1002/slct.201700577
тересов.
16.
Pokhodylo N.T., Shyyka O.Ya. Synth. Commun. 2017,
СПИСОК ЛИТЕРАТУРЫ
47, 1096-1101. doi 10.1080/00397911.2017.1313427
17.
Singh H., Khanna G., Khurana J.M. Tetrahedron Lett.
1.
Farooq T. Advances in Triazole Chemistry. 1st Edn,
2016, 57, 3075-3080. doi 10.1016/j.tetlet.2016.05.082
Elsevier. 2020.
18.
Jin G., Zhang J., Fu D., Wu J., Coa S. Eur. J. Org. Chem.
2.
Rani A., Singh G., Singh A., Maqbool U., Kaur G.,
2012, 12, 5446-5449. doi 10.1002/ejoc.201200830
Singh J. RSC Adv. 2020, 5610-5635. doi 10.1039/
C9RA09510A
19.
Jalani H.B., Karagöz A.C., Tsogoeva S.B. Synthesis.
2017, 49, 29-41. doi 10.1055/s-0036-1588904.
3.
Pokhodylo N., Shyyka O., Finiuk N., Stoika R.
Ukr. Biochem. J. 2020, 92, 23-32. doi 10.15407/
20.
John J., Thomas J., Dehaen W. Chem. Commun. 2015,
ubj92.05.023
51, 10797-10806. doi 10.1039/C5CC02319J
4.
Pokhodylo N.T., Shyyka O.Ya., Finiuk N.S.
21.
Lima C.G.S., Ali A., van Berkel S.S., Westermann B.,
Biopolym. Cell. 2019, 35, 321-330. doi 10.7124/
Paixao M.W. Chem. Commun. 2015, 51, 10784-10796.
bc.000A0F
doi 10.1039/C5CC04114G
5.
Manikala V.K., Rao V.M. Russ. J. Org. Chem. 2020, 56,
22.
Походыло Н.Т., Савка Р.Д., Обушак М.Д. ЖОрХ.
863-868. doi 10.1134/S1070428020050206
2017, 53, 723-726. [Pokhodylo N.T., Savka R.D.,
6.
Голобокова Т.В., Пройдаков А.Г., Кижня-
Obushak M.D. Russ. J. Org. Chem. 2017, 53, 734-
ев В.Н. ЖОрХ.
2020,
56,
442-450.
[Goloboko-
737.] doi 10.1134/S1070428017050141
va T.V., Proidakov A.G., Kizhnyaev V.N. Russ.
23.
Походыло Н.Т., Матийчук В.С., Обушак М.Д.
J. Org. Chem. 2020, 56, 446-453.] doi 10.1134/
ЖОрХ. 2017, 53, 470-472. [Pokhodylo N.T., Matii-
S1070428020030136
chuk V.S., Obushak M.D. Russ. J. Org. Chem. 2017,
7.
Pokhodylo N.T., Shyyka O.Ya., Goreshnik E.A.,
53, 481-483.] doi 10.1134/S1070428017030332
Obushak M.D. ChemistrySelect. 2020, 5, 260-264. doi
24.
Calderone V., Fiamingo F.L., Amato G., Giorgi I.,
10.1002/slct.201904688
Livi O., Martelli A., Martinotti E. Eur. J. Med.
8.
Походыло Н.Т., Обушак М.Д. ЖОрХ. 2019, 55,
Chem.
2008,
43,
2618-2626. doi
10.1016/
1300-1303. [Pokhodylo N.T., Obushak M.D. Russ.
j.ejmech.2008.02.032
J. Org. Chem. 2019, 55, 1241-1243.] doi 10.1134/
25.
Wang Z.-J., Gao Y., Hou Y.-L., Zhang C., Yu S.-J.,
S107042801908027X
Bian Q., Li Z.-M., Zhao W.-G. Eur. J. Med. Chem.
9.
Yan Z., Li Y., Ma M. Org. Lett. 2019, 21, 7204-7208.
2014, 86, 87-94. doi 10.1016/j.ejmech.2014.08.029
doi 10.1021/acs.orglett.9b02089
26.
Chen X.-B., Shi D.-Q. Phosphorus Sulfur
10.
Походыло Н.Т., Шийка О.Я., Савка Р.Д., Обу-
Silicon Rel. Elem.
2008,
183,
1134-1144. doi
шак М.Д. ЖОрХ. 2018, 54, 1083-1091. [Pokhody-
10.1080/10426500701578522
lo N.T., Shyyka O.Y., Savka R.D., Obushak M.D. Russ.
27.
Cottrell I.F., Hands P., Houghton P.G., Humphrey G.R.,
J. Org. Chem. 2018, 54, 1090-1099.] doi 10.1134/
Wright S.H.B. J. Heterocycl. Chem. 1991, 28, 301-304.
S1070428018070205
doi 10.1002/jhet.5570280216
11.
Blastik Z.E., Klepetarova B., Beier P. ChemistrySelect.
28.
Слывка Ю.И., Павлюк А.В., Ардан Б.Р., Походы-
2018, 3, 7045-7048. doi 10.1002/slct.201801344
ло Н.Т., Горешник Е.А., Демченко П.Ю. ЖНХ. 2012,
12.
Pokhodylo N.T., Shyyka O.Ya., Obushak M.D. Chem.
57, 885-891. [Slyvka Yu.I., Pavlyuk A.V., Ardan B.R.,
Нeterocycl. Сompd. 2018, 54, 773-779. doi 10.1007/
Pokhodilo N.T., Goreshnik E.A., Demchenko P.Yu.
s10593-018-2348-1
Russ. J. Inorg. Chem. 2012, 57, 815-821.] doi 10.1134/
S0036023612060216
13.
Pokhodylo N.T., Shyyka O.Ya., Tupychak M.A.,
Obushak M.D. Chem. Нeterocycl. Сompd. 2018, 54,
29.
Походыло Н.Т., Савка Р.Д., Обушак М.Д. ХГС.
209-212. doi 10.1007/s10593-018-2256-4
2014, 50, 593-598. [Pokhodylo N.T. Savka R.D., Obu-
shak M.D. Chem. Нeterocycl. Сompd. 2014, 50, 544-
14.
Lin W., Wang Y.-M., Chai S.C., Lv L., Zheng J.,
549.] doi 10.1007/s10593-014-1505-4
Wu J., Zhang Q., Wang Y.D., Griffin P.R., Chen T.
Nat. Commun. 2017, 741. doi 10.1038/s41467-017-
30.
Pokhodylo N., Savka R., Obushak M. Curr. Chem. Lett.
00780-5
2021, 10, 53-66. doi 10.5267/j.ccl.2020.7.004
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ ПРОИЗВОДНЫХ 1,2,3-ТРИАЗОЛА ЦИКЛОКОНДЕНСАЦИЕЙ АЛКИЛАЗИДОВ
841
31. Arshad M., Bhat A.R., Pokharel S., Kim J.-E., Lee E.J.,
Obushak M.D. Russ. J. Org. Chem. 2020, 56, 1421-
Athar F., Choi I. Eur. J. Med. Chem. 2014, 71, 229-
1431.] doi 10.1134/S1070428020080138
236. doi 10.1016/j.ejmech.2013.11.008
33. Chen M., Bao L., Peng P., Zheng S., Xie Y., Lu X.
32. Походыло Н.Т., Савка Р.Д., Обушак М.Д. ЖОрХ.
Angew. Chem. Int. Ed. 2016, 55, 11887-11891. doi
2020, 56, 1267-1279. [Pokhodylo N.T., Savka R.D.,
10.1002/anie.201606385
Synthesis of 1,2,3-Triazole Derivatives by the Cyclocondensation
of Alkylazides with Active Methylene Ketones
in the K2CO3/DMSO System
N. T. Pokhodylo, R. D. Savka, and M. D. Obushak*
Ivan Franko National University of Lviv, ul. Kyryla i Mefodiya, 6, Lviv, 79005 Ukraine
*e-mail: mykola.obushak@lnu.edu.ua
Received January 1, 2021; revised February 10, 2021; accepted February 12, 2021
It was shown that the reaction of β-ketoesters and acetylacetone with alkyl azides in the K2CO3/DMSO system
is a convenient method for the synthesis of tri- and disubstituted 1H-1,2,3-triazoles with alkyl substituents in
position 1 of the triazole ring.
Keywords: azides, 1,2,3-triazoles, Dimroth reaction, 1,3-dicarbonyl compounds, cyclocondensation
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021