ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 6, с. 842-851
УДК 547.821.2
ДИАЗОТИРОВАНИЕ АМИНОПИРИДИНОВ В
ПРИСУТСТВИИ КАМФОРСУЛЬФОКИСЛОТЫ.
СИНТЕЗ И НЕКОТОРЫЕ СВОЙСТВА
ПИРИДИНИЛКАМФОРСУЛЬФОНАТОВ
© 2021 г. А. Н. Санжиев, Е. А. Краснокутская*, К. Д. Ерин, В. Д. Филимонов
ФГАОУ ВО «Национальный исследовательский Томский политехнический университет»,
Россия, 634050 Томск, просп. Ленина, 30
*e-mail: eak@tpu.ru
Поступила в редакцию: 20.02.2021 г.
После доработки 26.02.2021 г.
Принята к публикации 27.02.2021 г.
2-, 3- и 4-Аминопиридины при диазотировании в присутствии как рацемической камфорсульфокислоты,
так и ее индивидуальных энантиомеров образуют соответствующие пиридинилкамфорсульфонаты с
умеренными выходами. Реакционная способность пиридинилкамфорсульфонатов в щелочном алкоголизе
оказывается выше, чем у пиридинилтрифлатов и пиридинилтозилатов.
Ключевые слова: аминопиридины, пиридинилсульфонаты, пиридинилкамфорсульфонаты, камфор-
сульфокислота, алкоголиз
DOI: 10.31857/S0514749221060069
ВВЕДЕНИЕ
лишь один пример получения 4-[(2-метилцикло-
гексил)окси]-6-фенетилпиридин-2-илкамфорсуль-
Диазотирование ароматических аминов в при-
фоната реакцией ацилирования соответствующего
сутствии таких сульфокислот, как п-толуолсуль-
гидроксипиридина хлорангидридом камфорсуль-
фокислота (p-TsOH), трифторметансульфокислота
фокислоты [9].
(TfOH) или камфорсульфокислота (CamphSO3H)
обеспечивает получение относительно устойчи-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
вых арендиазония сульфонатов (ArN2+RSO3-) [1-3].
Цель работы - исследование диазотирования
В противоположность этому диазотирование
ряда аминопиридинов 1a-g в присутствии раце-
аминопиридинов в присутствии p-TsOH и TfOH
мической CamphSO3H. Ранее было показано, что
приводит к получению не пиридиндиазония суль-
получение пиридинилтозилатов PyOTs и пириди-
фонатов, но пиридинил-р-толуолсульфонатов (то-
нилтрифлатов PyOTf может быть достигнуто че-
зилатов) и пиридинилтрифторметансульфонатов
рез диазотирование методом растирания аминопи-
(трифлатов) (PyOSO2R) [4-6] в результате не-
ридинов в водных пастах с NaNO2 и p-TsOH, либо
стабильности диазониевых солей пиридинового
диазотированием под действием н-бутилнитрита в
строения. По тем же причинам диазотирование
растворах ДМСО или ДМФА [4-6]. Апробированы
аминопиридинов в ацетонитриле дает пиридини-
оба подхода, и впервые нами установлено, что диа-
лацетамиды [7] или N,N-диметиламинопиридины
зотирование аминопиридинов 1a-g в присутствии
[8], если диазотирование проводится в ДМФА.
CamphSO3H во всех случаях приводит к пириди-
Пиридинилкамфорсульфонаты - почти неиз-
нилкамфорсульфонатам 2a-g в качестве основных
вестные производные пиридина. Нами найден
продуктов. Наилучшие выходы 45-70% получены
842
ДИАЗОТИРОВАНИЕ АМИНОПИРИДИНОВ В ПРИСУТСТВИИ КАМФОРСУ
ЛЬФОКИСЛОТЫ
843
Схема 1
R
R
NaNO2, (+)-CamphSO3H
NH2
O-SO2Camph
паста H2O, 2 ч
N
N
1a-g
2a-g
R = H, 2-NH2 (a), R = H, 3-NH2 (b), R=H, 4-NH2 (c), R = 5-Cl, 2-NH2 (d), R = 6-Me, 2-NH2 (e),
R = 5-Br, 2-NH2 (f), R = 5-NO2, 2-NH2 (g).
в варианте диазотирования при растирании исход-
выходы соединений 2a-g оказываются более низ-
ных аминопиридинов в водных пастах с NaNO2 и
кими, чем при диазотировании в присутствии
CamphSO3H при комнатной температуре в течение
p-TsOH и TfOH [4-6]. Одной из причин снижения
2 ч в соотношении субстрат-NaNO2-CamphSO3H
выходов соединений 2a-g может выступать побоч-
1:2.5:3 (схема 1, см. таблицу). При этом показано,
ное образование гидроксипиридинов, присутствие
что «+»- и «-»-энантиомеры камфорсульфокисло-
которых зафиксировано методом ГХ-МС.
ты дают почти те же выходы продуктов, что и ра-
2-Замещенные пиридины часто используют
цемат (см. таблицу).
как лиганды для получения разнообразных ком-
Установлено, что диазотирование аминопири-
плексов с металлами и другими субстратами [10].
динов 1a-g в присутствии CamphSO3H обеспечи-
Органические эфиры камфорсульфокислоты так-
вает качественно тот же результат, что и с p-TsOH и
же применяются в качестве лигандов для селекции
TfOH [4-6], т.е. образование пиридинилсульфона-
энантиомерно чистых соединений [9, 11]. За счет
тов в этих условиях носит общий характер. Однако
комбинации двух сайтов связывания у произво-
Выход пиридинилкамфорсульфонатов 2a-g в реакции диазотирования аминопиридинов 1a-g действием NaNO2 в
присутствии камфорсульфокислоты в водной пасте в течение 2 ч
Соединение
Продукт
Выход, %
Соединение
Продукт
Выход, %
2a
45
2e
63
N NH
2
N NH2
1a
1e
NH2
Br
2b
70a
2f
53
N
N NH2
1b
1f
O2N
NH2
2c
55
2g
40
N
N NH2
1c
1g
Cl
2d
50b
N NH2
1d
a Время реакции 4 ч
b (+)-Пиридил-2-камфорсульфонат 60%, (-)-пиридил-2-камфорсульфонат 54%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
844
САНЖИЕВ и др.
данным ГХ-МС в смесь 2-этокси-5-хлорпиридина
3.158
(3a), 1-этил-5-хлорпиридина-2(1Н)-она (3b) и эти-
лового эфира камфорсульфокислоты (4) (схема 2).
В тех же условиях 5-хлорпиридин-2-илтрифлат
(5) превращается в продукты 3a и b за более дли-
тельное время - в течение 3 ч, а в случае 5-хлор-
3.200
пиридин-2-илтозилата (6) полная конверсия не до-
стигнута и после 6 ч реакции, хотя продукты 3a,
b фиксируются во всех случаях. Проведение той
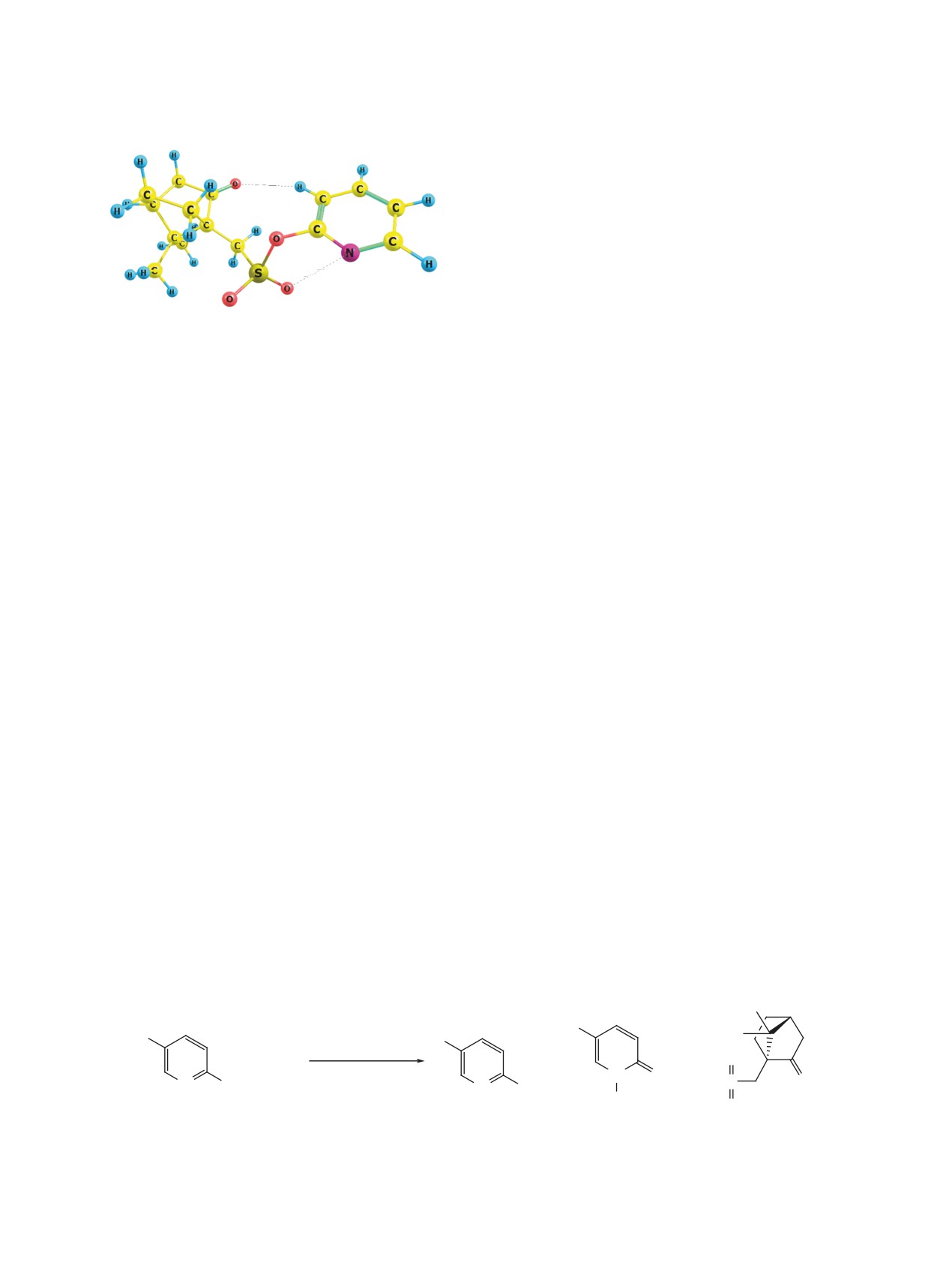
Строение пиридин-2-илкамфорсульфоната 2a, вычис-
ленное методом b3lyp в базисе 6-31+g(d,p)
же реакции с пиридинилсульфонатами 2d, 5 и 6 в
течение 2 ч показало (метод ГХ, внутренний стан-
дных пиридина с камфорсульфонатным замести-
дарт бифенил) полное отсутствие в реакционной
телем в положении 2 соединения 2a, d, e-g могут
смеси исходного соединения 2d, в то время как
представлять интерес в качестве новых хелатиру-
конверсия трифлата 5 составляла 20%, а тозилата
ющих агентов, в том числе и хиральных в случае
6 - всего 5%.
R- и S-изомеров. Мы провели оптимизацию стро-
Учитывая установленную высокую активность
ения пиридин-2-илкамфорсульфоната 2a методом
пиридина 2d в этанолизе, мы поставили задачу
функционала плотности b3lyp в базисе 6-31+g(d,p)
определить, возможно ли использование пириди-
(см. рисунок), из которого следует, что 2-камфор-
нилкамфорсульфонатов для препаративного полу-
сульфонаты могут представлять интерес в каче-
чения эфиров камфорсульфокислоты. На приме-
стве новых хелатирующих агентов за счет участия
ре соединения 2a показано, что его нагревание с
в координации центров С=О----β-H и SO2O---N
гексафторизопропанолом или 2-нафтолом в MeCN
пиридинового ядра (на рисунке приведены вычис-
обеспечивает простое получение соответству-
ленные дистанции между указанными центрами).
OR 7 (60%) и 8 (84%)
ющих эфиров CamphSO2
Пиридинилтрифлаты и пиридинилтозилаты об-
(схема 3). Таким образом, фрагмент 2-пиридинола
ладают высокой активностью в ряде химических
в соединении 2a оказывается хорошей уходящей
превращений и находят применение в органиче-
группой.
ском синтезе [12]. Поскольку химические свой-
Дополнительным подтверждением более вы-
ства пиридинилкамфорсульфонатов практически
сокой реакционной способности пиридинилкам-
неизвестны, представляет интерес определение их
форсульфонатов по сравнению с трифлатами и
реакционной способности в сопоставлении с род-
тозилатами явилась реакция пиридин-2-илкам-
ственными пиридинилтозилатами и пиридинил-
форсульфоната 2a с бромистым изопропилом при
трифлатами. В качестве модельной реакции для
нагревании в условиях микроволнового облуче-
такого сравнения выбрана основно-катализируе-
ния. В результате препаративно были выделены
мая реакция алкоголиза.
O- и N-изопропильные производные 9а, b с сум-
Оказалось, что
5-хлорпиридин-2-илкамфор-
марным выходом 65% и в соотношении 1:1.5 (схе-
сульфонат (2d) при нагревании в этаноле в при-
ма 4). Пиридин-2-илтрифлат и пиридин-2-илтози-
сутствии K2CO3 в течение 2 ч превращается по
лат оказались в данной реакции инертными.
Схема 2
Cl
Cl
Cl
K2CO3
O
+
+
EtOH, 70°C, 0.5 ч
N
O
EtO S
O
N
OSO2Camph
N OEt
Et
O
2d
3a
3b
4
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
ДИАЗОТИРОВАНИЕ АМИНОПИРИДИНОВ В ПРИСУТСТВИИ КАМФОРСУ
ЛЬФОКИСЛОТЫ
845
Схема 3
ROH, K2CO3
R
O
MeCN, 70°C, 1 ч
N OSO2Camph
O S
O
O
2a
7, 8
R = (CF3)2CH (7, 60%);
(8, 84%).
Таким образом, показано, что пиридинил-
пиридин-2-илтрифлатом (10). Расчеты проводили
камфорсульфонаты проявляют в алкоголизе ак-
методом функционала плотности b3lyp в базисе
тивность, заметно превышающую таковую для
6-31+g(d,p), влияние растворителей оценивали в
пиридинилтрифлатов и пиридинилтозилатов.
рамках модели CPCM.
Возможно, этот фактор - одна из причин снижен-
Поскольку трифторметансульфонатная груп-
ных выходов целевых соединений 2a-g по срав-
па - лучшая уходящая группа, чем камфорсульфо-
нению с аналогичными пиридинилтозилатами и
натная, как уже указывалось выше, большая реак-
пиридинилтрифлатами за счет распада продуктов
ционная способность сульфоната 2a по сравнению
2a-g до соответствующих гидроксипиридинов.
с трифлатом 10 не может объясняться реакциями
Эти результаты не могут объясняться отщепле-
замещения остатков RSO2O- (R = CF3, Camph) в
нием сульфонатных групп RSO2O-, посколь-
ку наилучшая уходящая группа в исследуемом
соединениях 2a и 10. Это подтверждают и вычис-
ленные энергии гетеролитического разрыва свя-
ряду - трифлатная.
зей углерод-сульфонатная группа в положении 2
Очевидно, что исследуемые реакции со спир-
пиридина, составляющие 153.2 и 139.3 ккал/моль
тами ROH относятся к процессам переэтерифи-
для CamphSO2O- и TfO- соответственно. Расчеты
кации эфиров сульфокислот, проходящих через
в полярной водной среде также предсказывают
атаку нуклеофила на S=O связи с последующим
большую энергию отрыва CamphSO2O- нежели
отщеплением PyrO- и образованием эфира суль-
TfO- - 53.85 и 38.84 ккал/моль соответственно.
фокислоты RO-SO2R [13]. Последний, выступая
Более прочная связь Py-OSO2Camph, чем Py-OTf,
хорошим алкилирующим агентом, взаимодейству-
в соединениях 2a и 10 подтверждается из сравне-
ет с PyrO-, обеспечивая образование продуктов ал-
ния вычисленных длин связей Py-OSO2 1.397 Å
коксилирования в зависимости от строения исход-
для 2a и 1.408 Å для пиридинилтрифлата 10.
ного пиридинового субстрата, как было описано
выше.
Один из известных механизмов щелочного ги-
Для объяснения повышенной реакционной
дролиза сульфонатов включает нуклеофильную
способности пиридинилкамфорсульфонатов в об-
атаку на атом серы SO2 группы с последующим раз-
суждаемых превращениях проведено моделиро-
рывом связи ацил-кислород [13]. Моделирование
вание реакций алкоголиза и щелочного гидролиза
этой элементарной реакции для пиридинилсуль-
пиридин-2-илкамфорсульфоната 2a в сравнении с
фонатов 2a, 10 привело к синхронному процессу
Схема 4
K2CO3
+
Br
+
N O
MeCN, 60°C, MW, 6 ч
N O
N OSO2Camph
2a
9a
9b
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
846
САНЖИЕВ и др.
Схема 5
O-
O
+ HO-
SO2
S
O
Camph
N O
Camph
OH
2a
11a
O-
O
+ HO-
S
N O
CF3
N OTf
OH
10
11b
атаки НО- на атом серы с образованием интерме-
модинамически выгодный процесс. Свободная
диатов 11a, b (схема 5).
энергия депротонирования
(∆G) составляет
–48.6 ккал/моль, т.е. эта реакция даже несколько
Согласно полученным расчетам, эти процессы
более экзотермична, чем нуклеофильная атака
(схема
5) экзотермичны и протекают без
НО- (схема 5). Отсюда следует, что щелочной
энергетических барьеров. Изменение свободных
алкоголиз пиридинилкамфорсульфоната
2a, в
энергий при этом (∆G, ккал/моль) составляет
отличие от пиридинил трифлата 10, термоди-
–45.3 и -34.7 для 11a и 11b соответственно,
намически почти равновероятно может протекать
что, казалось бы, указывает на большую
по 2 маршрутам согласно схемам 5 и 6, что и
термодинамическую выгодность омыления
может быть причиной обнаруженной повышенной
камфорсульфонатного производного
2a по
активности пиридинилкамфорсульфонатов в
сравнению с пиридинилтрифлатом 10. Однако
алкоголизе.
в полярной водной среде (∆GН
) и в метаноле
2О
(∆GМеОН), согласно расчетам, термодинамика об-
Таким образом, впервые синтезирован ряд ранее
разования интермедиата
11b за счет большей
неизвестных пиридинилкамфорсульфонатов, уста-
энергии его сольватации становится несколько
новлена их молекулярная структура и исследовано
более выгодной (для 11b ∆GН
-22.1, ∆GМеОН
поведение в реакции со спиртами в присутствии
2О
–22.4 ккал/моль, для 11a ∆GН
-19.4, ∆GМеОН
основания.
2О
–19.7 ккал/моль). Таким образом, данный меха-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
низм не объясняет повышенную активность кам-
форсульфоната 2a при щелочном алкоголизе.
Хроматомасс-спектры регистрировали на газо-
вом хроматографе Agilent Technologies 7890A GC
Важное структурное различие сульфонатов 10 и
System (США) с масс-селективным детектором
2a - наличие сульфометиленовой группы SO2CH2 в
Agilent 5975C (70 эВ) газ-носитель - гелий, спек-
последнем. Для некоторых арилалкансульфонатов
тры ЯМР 1Н (400 МГц), 13С (100 МГц) записы-
RCH2SO3Ar показано, что в основных средах может
вали на спектрометре Bruker AC400 (Германия),
проходить депротонирование фрагмента SO2CH2 с
внутренний стандарт - ТМС. Спектры ИК запи-
отщеплением ArOH в последующих превращениях
сывали на ИК Фурье-спектрометре Agilent Cary
[14]. Мы провели расчет термодинамики ста-
630 FTIR. Температуру плавления определяли на
дии депротонирования камфорсульфоната 2a по
приборе MP50 Melting Point System Mettler Toledo
схеме 6.
(США). Элементный анализ выполняли на CHNS
Действительно оказалось, что ионизация
Flash2000 (США). Оборудование для проведения
камфорсульфоната
2a действием НО-
- тер-
органического синтеза - микроволновый реактор
Схема 6
CamphCH2SO2OPy + HO-
CamphCH-SO2OPy + H2O
2a
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
ДИАЗОТИРОВАНИЕ АМИНОПИРИДИНОВ В ПРИСУТСТВИИ КАМФОРСУ
ЛЬФОКИСЛОТЫ
847
СЕМ (США) на базе модуля Discover labmate с ча-
ИК спектр, ν, см-1: 2973-2908 (CH), 1741 с (С=O),
стотой излучения 2455 МГц. Контроль за ходом
1373 c (SO2), 1159 c (SO2), 1050-781 (S-O-C).
реакции и чистотой полученных продуктов вели
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.90 с (3H, CH3),
методом ТСХ на пластинках Merck, silica gel 60,
1.13 с (3H, CH3), 1.44-1.54 м (1H, CH2), 1.80-1.70
F254. Детектирование пятен проводили УФ-светом
м (1Н, CH2), 1.99 д (1H, J 20.0 Гц), 2.03-2.18 м (2H,
при длине волны 254 нм.
CH2), 2.38-2.53 м (2H, CH2), 3.26 д (1H, CH2, J
16.0 Гц), 3.85 д (1H, J 12.0 Гц), 7.38 д (2H, J
Препаративное разделение продуктов осущест-
4.0 Гц), 8.73 д (2H, J 8.0 Гц). Спектр ЯМР 13C
вляли с помощью флеш-хроматографии на колон-
ках 15×1 см, сорбент Silica gel (40/60 μ).
(CDCl3), δ, м.д.: 19.80, 19.90, 25.28, 26.97, 42.53,
42.92, 48.25, 49.20, 58.24, 116.95, 213.78. Масс-
Аминопиридины 1a-g - коммерческие пре-
спектр, m/z (Iотн, %): 215 (88) [M+ - PyrO], 151 (32),
параты компании Aldrich (США). Пиридинил-
133 (11), 123 (50), 109 (100), 95 (30), 81 (80), 67
сульфонаты 5, 6, 10 получены по методике [6].
(50), 55 (32). Найдено, %: C 55.14; H 6.27; N 4.62; S
Пиридин-2-илкамфорсульфонаты 2a-g (об-
10.15. C15H19NO4S Вычислено, %: C 58.23; H 6.19;
щая методика). Смесь аминопиридина (3 ммоль)
N 4.53; S 10.36.
и камфорсульфокислоты (2.088 г, 9 ммоль) расти-
Пиридин-3-илкамфорсульфонат (2b). Выход
рали в ступке в присутствии 1 мл H2O до образова-
0.216 г (70%), белый порошок, т.пл. 112-113°С. ИК
ния гомогенной смеси. К смеси добавляли NaNO2
спектр, ν, см-1: 2967-2893 (CH), 1744 с (С=O), 1355
(0.414 г, 6 ммоль) при постоянном растирании в
c (SO2), 1157 c (SO2), 1025-798 (S-O-C). Спектр
течение 5 мин. Реакционную массу оставляли в
ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.84 с (3Н, CH3), 1.04 с
течение времени, указанном в таблице. Контроль
реакции вели по ТСХ (элюент этилацетат-гексан,
(3Н, CH3), 1.40-1.50 м (1Н, CH2), 1.57-1.69 м (1Н,
CH2), 1.98 д (1Н, J 20.0 Гц), 2.09 с (1Н), 2.09-2.10 м
3:1). Реакционную массу разбавляли H2O (40 мл),
и обрабатывали 10%-ным водным NaHCO3 (10 мл)
(2Н), 3.68 д (1Н, CH2, J 16.0 Гц), 3.765 д (1Н, CH2,
до pH 8.0. Выпавший осадок пиридинилкамфор-
J 16.0 Гц), 7.56-7.59 м (1Н), 7.88 д (1Н, J 8.0 Гц),
сульфоната отфильтровали и промывали H2O.
8.6 д (1Н, J 8.0 Гц), 8.64 с (1Н). Спектр ЯМР 13C
Cушили в эксикаторе под вакуумом, при необхо-
(ДМСО-d6), δ, м.д.: 19.14. 19.19, 25.02, 26.28, 41.93,
димости переосаждали из ацетона.
42.15, 47.79, 48.13, 57.56, 125.06, 130.24, 143.70,
146.08, 148.40, 213.49. Масс-спектр, m/z (Iотн, %):
Пиридин-2-илкамфорсульфонат (2a). Выход
215 (98) [M+ - PyrO], 151 (36), 133 (10), 123 (62),
0.139 г (45%), белый порошок, т.пл. 97-98°С. ИК
109 (100), 95 (31), 81 (81), 67 (48), 55 (22). Найдено,
спектр, ν, см-1: 2963-2920 (CH), 1742 с (С=O),
%: C 57.37; H 6.25; N 4.39; S 10.46. C15H19NO4S
1366 c (SO2), 1157 c (SO2), 1053-784 (S-O-C).
Вычислено, %: C 58.23; H 6.19; N 4.53; S 10.36.
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.97 с (3H, CH3),
1.19 с (3H, CH3), 1.48 уш.с (1H, CH2), 1.80 уш.с
5-Бромпиридин-2-илкамфорсульфонат
(2f).
(1H, CH2), 2.00 д (1H, J 20.0 Гц), 2.11-2.16 м (2H,
Выход 0.205 г (53%), белый порошок, т.пл. 107.5-
CH2), 2.43-2.56 м (2H, CH2), 3.8 д (1H, CH2, J
108.5°С. ИК спектр, ν, см-1: 2963 (CH),
1742
16.0 Гц), 4.19 д (1H, CH2, J 16.0 Гц), 7.16-7.30
с (С=O), 1368 c (SO2), 1157 c (SO2), 1009-794
м (2H), 7.84-7.85 м (1H), 8.39 уш.с (1H). Спектр
(S-O-C). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.93 с
ЯМР 13C (CDCl3), δ, м.д.: 19.79, 19.98, 25.24, 26.95,
(3H, CH3), 1.15 с (3H, CH3), 1.42-1.49 м (1Н, CH2),
42.54, 42.89, 48.04, 50.60, 58.40, 115.93, 122.73,
1.72-1.79 м (1Н, CH2), 1.97 д (1H, J 20.0 Гц), 2.03-
140.45, 148.16, 157.48, 214.10. Масс-спектр, m/z
2.16 м (2H), 2.28-2.54 м (2H), 3.68 д (1Н, CH2, J
(Iотн, %): 166 (16) [M+ - SO2, - Pyr], 151 (18), 138
16.0 Гц), 4.12 д (1Н, CH2, J 16.0 Гц), 7.06 д (1H, J
(76), 123 (100), 109 (23), 95 (82), 81 (34), 67 (54), 55
8.0 Гц), 7.90-7.93 д.д (1H, J 8.6, 2.4 Гц), 8.41 д (1H,
(32). Найдено, %: С 57.53; Н 6.33; N 4.48; S 10.41.
J 2.4 Гц). Спектр ЯМР 13C (CDCl3), δ, м.д.: 19.77,
C15H19NO4S Вычислено, %: C 58.23; H 6.19; N
19.95, 25.27, 26.93, 42.51, 42.89, 48.05, 50.69, 58.38,
4.53; S 10.36.
117.48,
118.73,
142.96,
149.13,
156.14,
213.92.
Пиридин-4-илкамфорсульфонат (2c). Выход
Масс-спектр, m/z (Iотн, %): 166 (17) [M+ - SO2, -
0.17 г (55%), белый порошок, т.пл. 85°С (разл.).
Pyr], 151 (16), 138 (64), 123 (100), 109 (19), 95 (71),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
848
САНЖИЕВ и др.
81 (33), 67 (50), 55 (29). Найдено, %: C 46.04; H
J 2.8 Гц). Спектр ЯМР 13C (CDCl3), δ, м.д.: 19.78,
4.61; N 3.50; S 8.43. C15H18BrNO4S Вычислено, %:
19.91, 25.40, 26.95, 42.49, 42.90, 48.15, 51.55, 58.49,
C 46.40; H 4.67; N 3.61; S 8.26.
115.67, 135.85, 144.69, 160.64, 213.74. Масс-спектр,
m/z (Iотн, %): 166 (13) [M+ - SO2, - Pyr], 151 (15),
5-Хлорпиридин-2-илкамфорсульфонат (2d).
138 (79), 123 (100), 109 (25), 95 (83), 81 (35), 67
Выход 0.171 г (50%), белый порошoк, т.пл. 102-
(58), 55 (31). Найдено, %: C 50.79; H 5.25; N 7.83; S
103°С. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.93 с
8.96. C15H18N2O6S Вычислено, %: C 50.84; H 5.12;
(3H, CH3), 1.15 с (3H, CH3), 1.43-1.49 м (1Н, CH2),
N 7.91; S 9.05.
1.73-1.80 м (1Н, CH2), 1.97 д (1H, J 20.0 Гц), 2.04-
2.16 м (2H), 2.37-2.54 м (2H), 3.69 д (1Н, CH2, J
Взаимодействие пиридин-2-илкамфорсуль-
12.0 Гц), 4.12 д (1Н, CH2, J 16.0 Гц), 7.11 д (1H, J
фоната (2a) с бромистым изопропилом. К рас-
8.0 Гц), 7.76-7.79 д.д (1H, J 8.0, 2.4 Гц), 8.31 д (1H,
твору пиридин-2-илкамфорсульфоната 2a (0.618 г,
J 2.4 Гц). Спектр ЯМР 13C (CDCl3), δ, м.д.: 19.88.
2 ммоль) и изопропилбромида (1.23 г, 10 ммоль)
20.06, 25.38, 27.04, 42.62, 43.01, 48.15, 50.75, 58.49,
в 4 мл ацетонитрила добавляли K2CO3 (0.552 г,
117.10,
130.80,
140.24,
146.94,
155.70,
214.02.
4 ммоль) и перемешивали при 60°С в течение
Масс-спектр, m/z (Iотн, %): 166 (16) [M+ - SO2, -
6 ч в микроволновом реакторе (1.3 Бар, 50 Вт).
Pyr], 151 (16), 138 (72), 123 (100), 109 (22), 95 (74),
Далее к реакционной массе добавляли H2O и экс-
81 (31), 67 (45), 55 (29). Найдено, %: C 53.26; H
трагировали хлористым метиленом (3×20 мл).
5.29; N 3.99; S 9.41. C15H18ClNO4S Вычислено, %:
Органический слой сушили над Na2SO4, раство-
C 52.40; H 5.28; N 4.07; S 9.32.
ритель отгоняли. Очистку технического продукта
проводили флэш-хроматографией (элюент мета-
6-Метилпиридин-2-илкамфорсульфонат
(2e). Выход 0.203 г (63%), белый порошoк, т.пл.
нол-хлористый метилен, 50:2).
130-131°С. ИК спектр, ν, см-1: 2967 (CH), 1742
2-Изопропоксипиридин (7a). C8H11NO. Выход
с (С=O), 1367 c (SO2), 1161 c (SO2), 1075-795
0.086 г (21%), желтое масло [15]. Спектр ЯМР
(S-O-C). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.94 с
1Н (CDCl3), δ, м.д.: 1.32 с (3H, CH3), 1.34 с (3H,
(3H, CH3), 1.17 с (3H, CH3), 1.42-1.48 м (1Н, CH2),
CH3), 5.26-5.32 м (1H, CH), 6.66 д (1H, J 8.0 Гц),
1.73-1.80 м (1Н, CH2), 1.96 д (1H, J 16.0 Гц), 2.04-
6.78-6.80 м (1H), 7.50-7.54 м (1H), 8.12 д.д (1H, J12
2.14 м (2H), 2.38-2.45 м (1H), 2.50-2.58 м (4H),
5.2, J13 1.2 Гц). Спектр ЯМР 13C (CDCl3), δ, м.д.:
3.86 д (1Н, CH2, J 12.0 Гц), 4.16 д (1H, J 16.0 Гц),
22.16, 67.92, 111.74, 116.30, 138.63, 146.90, 163.53.
6.93 д (1H, J 8.0 Гц), 7.11 д (1H, J 8.0 Гц), 7.70-7.66
Масс-спектр, m/z (Iотн, %): 137 (14) [М]+, 122 (31),
м (1H). Спектр ЯМР 13C (CDCl3), δ, м.д.: 19.86,
95 (74), 79 (29), 67 (100), 51 (7).
20.11, 23.99, 25.24, 27.06, 42.64, 42.92, 48.13, 50.66,
58.47, 112.66, 122.24, 140.58, 156.82, 157.98, 214.13.
1-Изопропилпиридин-2(1H)-он
(7b).
C8H11NO. Выход 0.152 г (37%), желтое масло
Масс-спектр, m/z (Iотн, %): 166 (15) [M+ - SO2, -
Pyr], 151 (17), 138 (75), 123 (100), 109 (26), 95 (89),
[16]. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.31 c (3H,
81 (38), 67 (58), 55 (36). Найдено, %: C 59.14; H
CH3), 1.33 с (3H, CH3), 5.22-5.28 м (1H, CH),
6.38; N 4.20; S 10.14. C16H21NO4S Вычислено, %:
6.18-6.22 (1H), 6.55 д (1H, J 12.0 Гц), 7.24-7.32
C 59.42; H 6.55; N 4.33; S 9.91.
м (2H). Спектр ЯМР 13C (CDCl3), δ, м.д.: 22.02,
46.26, 106.59, 120.70, 132.80, 138.72, 162.41. Масс-
5-Нитропиридин-2-илкамфорсульфонат
спектр, m/z (Iотн, %): 137 (50) [М]+, 120 (7), 109 (3),
(2g). Выход 0.141 г (40%), белый порошок, т.пл.
95 (60), 78 (21), 67 (100), 51 (7).
86-87°С. ИК спектр, ν, см-1: 2965-2890 (CH),
1736 с (С=O), 1355 c (SO2), 1163 c (SO2), 1011-759
Сравнение реакционной способности 5-хлор-
(S-O-C). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.95 с
пиридин-2-илсульфонатов 2d, 5, 6 в реакции
(3H, CH3), 1.17 с (3H, CH3), 1.45-1.52 м (1Н, CH2),
этанолиза методом внутреннего стандарта.
1.76-1.83 м (1Н, CH2), 1.99 д (1H, J 20.0 Гц), 2.07-
К раствору пиридинилсульфоната
(0.5 ммоль)
2.18 м (2H), 2.40-2.53 м (2H), 3.74 д (1Н, CH2, J
в 4 мл ацетонитрила добавляли K2CO3 (0.138 г,
12.0 Гц), 4.24 д (1Н, CH2, J 16.0 Гц), 7.28 д (1H,
1 ммоль), EtOH (0.3 мл, 5 ммоль) и 5 мг (0.03 ммоль)
J 8.8 Гц), 8.62 д.д (1H, J 8.8, 2.8 Гц), 9.24 д (1H,
дифенила. Реакционную массу перемешива-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
ДИАЗОТИРОВАНИЕ АМИНОПИРИДИНОВ В ПРИСУТСТВИИ КАМФОРСУ
ЛЬФОКИСЛОТЫ
849
ли 2 ч при 60°С, отбирая пробы каждые 60 мин.
127.98, 130.18, 131.98, 133.63, 146.85, 214.19.
Концентрацию пиридинилсульфоната определяли
Масс-спектр, m/z (Iотн, %): 358 (1) [М]+, 215 (25),
с помощью ГХ-МС, методом внутреннего стан-
151 (19), 144 (100), 123 (27), 115 (44), 109 (38), 93
дарта. Пробу для анализа готовили следующим
(8), 81 (26), 67 (15), 55 (6).
образом: 0.15 мл реакционной массы выливали в
Взаимодействие пиридин-2-илкамфорсуль-
2.5 мл EtOAc, центрифугировали, жидкую фрак-
фоната
(2а) с
1,1,1,3,3,3-гексафторпропан-2-
цию анализировали.
олом. Реакцию и выделение технического про-
Расчет концентрации 5-хлорпиридин-2-илсуль-
дукта проводили по методике, описанной выше.
фонатов 2d, 5, 6 проводили в соответствии с урав-
Очистку технического продукта проводили
нением:
флэш-хроматографией (элюент гексан).
Sопр
1,1,1,3,3,3-Гексафторпропан-2-илкамфор-
(
)
∙Сопр
Sстанд
проба
сульфонат (5). Выход 0.316 г (60%), желтое масло
X =
,
(CAS № 2305189-69-7). Спектр ЯМР 1Н (CDCl3),
Sопр
(
)
δ, м.д.: 0.90 c (3H, CH3), 1.13 c (3H, CH3), 1.45-1.51
Sстанд
стандарт
м (1H, CH2), 1.70-1.77 м (1H, CH2), 1.99 д (1H, J
где Х, моль/л - концентрация определяемого ве-
20.0 Гц), 2.05-2.17 м (2H), 2.35-2.46 м (2H), 3.24
- площадь пика определяе-
щества в пробе; Sопр
д (1H, CH2, J 16 Гц), 3.80 д (1H, CH2, J 12.0 Гц),
- площадь пика внутреннего
мого вещества; Sстанд
5.30-5.38 м (1H, CH). Спектр ЯМР 13C (CDCl3), δ,
, моль/л - начальная концентрация
стандарта; Сопр
м.д.: 19.73, 19.84, 25.38, 26.96, 42.47, 43.01, 48.14,
определяемого вещества.
50.39, 58.20, 70.97-72.38 м [(F3C)2CH-O], 115.87-
Взаимодействие пиридин-2-илкамфорсуль-
124.29 к (J 281 Гц). Масс-спектр, m/z (Iотн, %): 382
фоната (2а) с 2-нафтолом. В нагретую до 70°С
(1) [М]+, 325 (1), 235 (1), 151 (64), 133 (11), 123
(46), 109 (100), 93 (29), 81 (60), 67 (27), 55 (11).
смесь 2-нафтола (0.2 мл, 1.7 ммоль) и NaOH
(0.072 г, 1.8 ммоль) в 4 мл ацетонитрила по каплям
ВЫВОДЫ
вносили раствор пиридин-2-илкамфорсульфо-
Показано, что аминопиридины при диазотиро-
ната 2а (0.55 г, 1.78 ммоль) в 2 мл ацетонитрила.
вании в присутствии камфорсульфокислоты об-
Реакционную массу грели в течение 1 ч до исчез-
разуют не пиридиндиазония камфорсульфонаты,
новения субстрата, ТСХ (элюент этилацетат-гек-
но пиридинилкамфорсульфонаты. Активность
сан, 3:1). Реакционную массу разбавляли водой,
пиридинилкамфорсульфонатов в алкоголизе ока-
охлаждали, выпавший осадок отфильтровывали,
зывается выше, чем пиридинилтрифлатов и пи-
промывали дистиллированной водой, сушили под
ридинилтозилатов. Причиной этого, согласно
вакуумом. Полученный нафталин-2-илкамфор-
сравнительным квантово-химическим расчетам,
сульфонат (6) не нуждался в дальнейшей очист-
может быть распад пиридинилкамфорсульфонатов
ке.
по 2 реакционным маршрутам. Установлено, что
Нафталин-2-илкамфорсульфонат
(6).
пиридинилкамфорсульфонаты относительно легко
S. Выход 0.511 г (84%), т.пл. 97.5-98.5°С
C20H22O4
вступают в реакцию переэтерификации с гексаф-
), δ, м.д.: 0.91
(97°С [17]). Спектр ЯМР 1Н (CDCl3
торизопропанолом и 2-нафтолом, при этом обра-
), 1.44-1.50 м (1H,
c (3H, CH3), 1.18 с (3H, CH3
зуются соответствующие эфиры, что может рас-
), 1.98 д (1H, J 16.0 Гц),
сматриваться как новый прием функционализации
CH2), 1.73-1.80 м (1H, CH2
2.05-2.16 м (2H), 2.40-2.46 м (1H), 2.56-2.63 м
камфорсульфокислоты.
(1H), 3.26 д (1H, CH2, J 12.0 Гц), 3.89 (1H, CH2, J
ФОНДОВАЯ ПОДДЕРЖКА
12.0 Гц), 7.42-7.45 д.д (1H, J12 8.8, J13 2.4 Гц),
7.49-7.56 м (2H), 7.80 д (1H, J 2.0 Гц), 7.85-7.90
Работа выполнена в рамках государственного
(3H). Спектр ЯМР 13C (CDCl3), δ, м.д.: 19.75,
задания Министерства науки и высшего образо-
20.02, 25.18, 25.18, 26.91, 42.50, 42.88, 47.62,
вания Российской Федерации (Наука № FSWW-
48.00, 58.21, 119.51, 121.01, 126.47, 127.05, 127.84,
2020-011)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
850
САНЖИЕВ и др.
КОНФЛИКТ ИНТЕРЕСОВ
8. Санжиев А.Н., Потапова М.И., Краснокутская Е.А.,
Филимонов В.Д. ЖОрХ. 2020, 56, 920-926. [San-
Авторы заявляют об отсутствии конфликта ин-
zhiev A.N., Potapova M.I., Krasnokutskaya E.A.,
тересов.
Filimonov V.D. Russ. J. Org. Chem. 2020, 56, 1023-
СПИСОК ЛИТЕРАТУРЫ
1028.] doi 10.31857/S0514749220060099
1. Filimonov V.D., Trusova M.Е., Postnikov P.М., Kras-
9. Wu S., Yin Q., Zhao L., Fan N., Tang X., Zhao J.,
nokutskaya E.A., Lee Y.M., Hwang H.Y., Kim H.,
Wang X. Org. Biomolec. Chem. 2016, 14, 1413-1420.
Chi K.W. Org. Lett. 2008, 10, 3961-3964. doi 10.1021/
ol8013528
doi 10.1039/C5OB02154E
2. Filimonov V.D., Krasnokutskaya E.A., Kassanova A.Z.,
10. Hagui Х.W., Soulé J.-F. J. Org. Chem. 2020, 85, 3655-
Fedorova V.A., Stankevich K.S., Naumov N.G.,
3663. doi 10.1021/acs.joc.9b03306
Bondarev A.A., Kataeva V.A. Eur. J. Org. Chem. 2019,
11. Wang Y.-X., Liu L., Zeng Q.-X., Fan T.-Y., Jiang J.-D.,
2019, 665-674. doi 10.1002/ejoc.201800887
Deng H.-B., Song D.-Q. Molecules. 2017, 22, 1257-
3. Vajpayee V., Moon M.E., Lee S., Ravikumar S.,
1270. doi 10.3390/molecules22081257
Kim H., Ahn B., Choi S., Hong S.H., Chi K.W.
12. Касанова А.Ж., Краснокутская Е.А., Филимо-
Tetrahedron.
2013,
69,
3511-3517. doi
10.1016/
нов В.Д. Изв. АН. Сер. хим. 2016, 11, 2559-2567.
j.tet.2013.02.016
4. Tretyakov A.N., Krasnokutskaya E.A., Gorlushko D.A.,
13. Смит М. Органическая химия Марча. Реакции, ме-
Ogorodnikov V.D., Filimonov V.D. Tetrahedron Lett.
ханизмы, строение. М.: Лаборатория знаний, 2020,
2011, 52, 85-87. doi 10.1016/j.tetlet.2010.10.163
3.
5. Krasnokutskaya E.A., Kassanova A.Z., Estaeva M.T.,
14. Оае С. Химия органических соединений серы. М.:
Filimonov V.D. Tetrahedron Lett. 2014, 55, 3771-
Химия, 1975.
3773. doi 10.1016/j.tetlet.2014.05.052
15. Legault C., Charette A.B. J. Org. Chem. 2003, 68,
6. Kassanova A.Z., Krasnokutskaya E.A., Beisembai P.S.,
7119-7122. doi 10.1021/jo034456l
Filimonov V.D. Synthesis. 2016, 48, 256-262. doi
16. Giam C.S., Hauck A.E. Org. Prep. Proced. Int. 1977, 9,
10.1055/s-0035-1560392
5-8. doi 10.1080/00304947709355652
7. Чудинов А.А., Краснокутская Е.А. Довбня Р.С.,
Огородников В.Д., Филимонова И.Л. Изв. РАН. Сер.
17. Singh B.K., Sarma S.R. J. Indian Chem. Soc. 1958, 35,
хим. 2016, 9, 2312-2314.
49-51.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
ДИАЗОТИРОВАНИЕ АМИНОПИРИДИНОВ В ПРИСУТСТВИИ КАМФОРСУ
ЛЬФОКИСЛОТЫ
851
Diazotization of Aminopyridines in the Presence
of Camphorsulfonic Acid. Synthesis and Some Properties
of Pyridinyl Camphorsulfonates
A. N. Sanzhiev, E. A. Krasnokutskaya*, K. D. Erin, and V. D. Filimonov
National Research Tomsk Polytechnic University, Leninskii prosp., 30, Tomsk, 634050 Russia
*e-mail: eak@tpu.ru
Received February 20, 2021; revised February 26, 2021; accepted February 27, 2021
2-, 3- and 4-Aminopyridines when diazotized in the presence of both racemic camphor sulfonic acid and its
individual enantiomers form the corresponding pyridinyl camphorsulfonates in moderate yields. The activity
of pyridinyl camphorsulfonates in alkaline alcoholysis is higher than that of pyridinyl triflates and pyridinyl
tosylates.
Keywords: aminopyridines, pyridinyl sulfonates, pyridinyl camphorsulfonates, camphorsulfonic acid, alco-
holysis
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021