ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 6, с. 868-876
УДК 547.756 + 547.745
ОДНОСТАДИЙНАЯ ТРЕХКОМПОНЕНТНАЯ РЕАКЦИЯ
1,3-ДИПОЛЯРНОГО ЦИКЛОПРИСОЕДИНЕНИЯ
ДЛЯ СИНТЕЗА СПИРОПИРРОЛИДИНОНОВ
© 2021 г. И. Г. Мамедов*, Е. В. Мамедова
Бакинский государственный университет, химический факультет, Азербайджан, 1148 Баку, ул. З. Халилова, 23
*е-mail: bsu.nmrlab@gmail.com
Поступила в редакцию 17.01.2021 г.
После доработки 28.01.2021 г.
Принята к публикации 30.01.2021 г.
Осуществлена трехкомпонентная реакция 1,3-диполярного циклоприсоединения между изатином, бензи-
ламином и α,β-ненасыщенными кетонами для синтеза спиропирролидинонов при комнатной температуре.
Продукты были получены с хорошими выходами и в некоторых случаях в виде одного диастереомера.
Первичный амин послужил основным компонентом для in situ получения азометин-илидов из изатина.
Регио- и стереоизомеры были исследованы с применением квантово-химического полуэмпирического
метода PM7 и ЯМР-спектроскопии.
Ключевые слова: изатин, бензиламин, непредельный кетон, циклоприсоединение
DOI: 10.31857/S0514749221060094
ВВЕДЕНИЕ
химия изатина хорошо изучена, в последние
годы было сообщено о многих интересных
α,β-Ненасыщенные кетоны (халконы), как
результатах, и синтезе сложных молекул с бис-
продукты конденсации ацетофенонов с арома-
пирооксиндольными каркасами, которые имеют
тическими альдегидами по реакции Клайзена-
большое значение в органической и медицинской
Шмидта,
- важные промежуточные продукты
химии. Как известно в литературе, изатин и
для синтеза различных гетероциклов. Дан-
его производные нашли широкое практическое
ные соединения имеют два реакционных электро-
применение благодаря своей высокой биологичес-
фильных центра по карбонильной группе и
кой и физиологической активности. Соедине-
ненасыщенным связям, приводящих к син-
ния на основе изатина широко используются
тезу продуктов практического значения. Произ-
в качестве антибактериальных, противоопу-
водные халкона демонстрируют различную
холевых, противосудорожных и др. препаратов
биологическую активность: противоопухолевую,
[12-25].
противомикробную,
противовоспалительную,
обезболивающую, антиагрегантную, противо-
Реакция 1,3-диполярного циклоприсоединения
язвенную, противомалярийную, противовирус-
азометин-илида к α,β-ненасыщенному кетону
ную, антилейшманическую, антиоксидантную,
и изатиновой системе создает удобный одно-
противотуберкулезную, антигипергликемическую,
стадийный путь для конструирования множества
иммуномодулирующую и т.д. [1-11].
сложных спиросоединений со стереоцентрами
[26-29].
Спирооксиндольные циклические системы
присутствуют в натуральных продуктах, син-
В настоящей работе описан синтез спиро-
тетических фармацевтических препаратах и
пирролидиноновых систем взаимодействием
биоактивных молекулах. Несмотря на то, что
азометин-илидов к (E)-1-(4-бромфенил)-3-(тио-
868
ОДНОСТАДИЙНАЯ ТРЕХКОМПОНЕНТНАЯ РЕАКЦИЯ
869
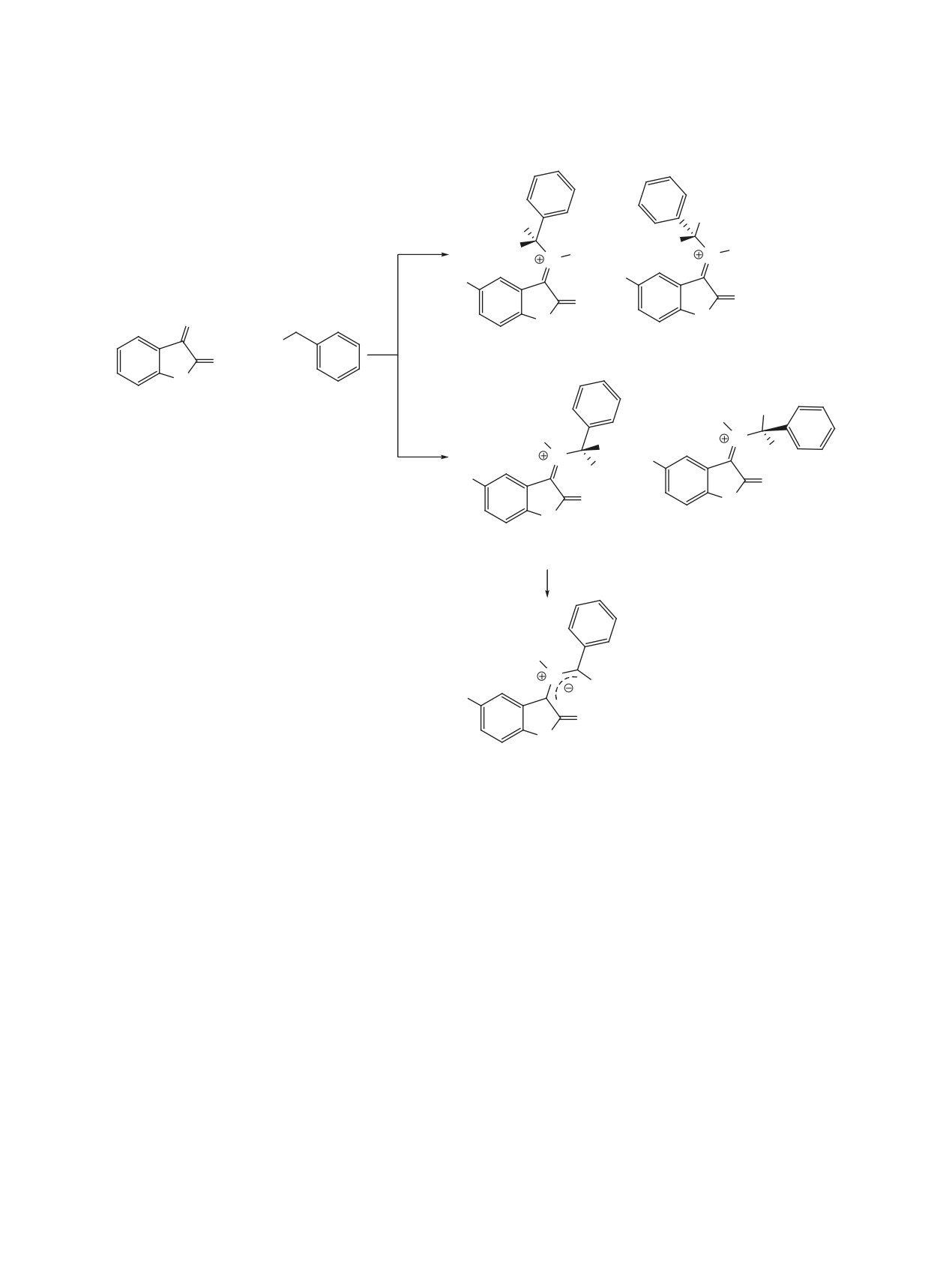
Схема 1. Вероятный механизм образования анти-азометин-илида
H
H
H
H
H
H
+
N
N
R
R
O
O
O
N
N
H
H
H2N
+
E2
O
E1
N
H
H
H
1
2
H
N
H
H
N
+
R
R
H
O
O
N
H
N
H
Z1
Z2
H
N
H
R
O
N
H
анти-азометин-илид
фен-2-ил)проп-2-ен-1-ону (3a) и (2E,4E)-1-(2-ги-
барьеров
1,3-диполярных циклоприсоединений
дроксифенил)-5-фенилпента-2,4-диен-1-ону (3b).
для эндо-изомеров меньше, чем экзо-изомеры,
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
и можно предсказать, что эндо-продукты будут
преобладать (схемы 2, 3). Также электрофильность
Трехкомпонентная реакция изатина 1a (или
халкона выше, чем у азометин-илида, и
5-бромизатина 1b), бензиламина (2) и (E)-1-(4-
возможность реакции циклоприсоединения с
бромфенил)-3-(тиофен-2-ил)проп-2-ен-1-она
(3a)
образованием ассортимент изомеров различна
[или (2E,4E)-1-(2-гидроксифенил)-5-фенилпента-
[29].
2,4-диен-1-она (3b)] проводили в сухом ДМСО
(или 96% этаноле) при комнатной температуре.
В данном случае лучшая экзо-региосе-
Как известно из литературы,
1,3-диполярное
лективность была получена в растворителе ДМСО
циклоприсоединение происходит после стадии
(табл. 1). Количество изатина и бензиламина также
образования промежуточного анти-азометин-
важно для высокого выхода спиросоединений.
илида [26-28]. Вероятный механизм образования
Это может быть связано с нестабильностью
анти-азометин-илида представлен на схеме 1 [29].
соответствующих анти-азометин-илидов, поэтому
Согласно литературным данным, анти-азо-
было использовано избыточное количество
метин-илид образуется из Z1 и активационных
изатина и бензиламина. Реакции проводились
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
870
МАМЕДОВ, МАМЕДОВА
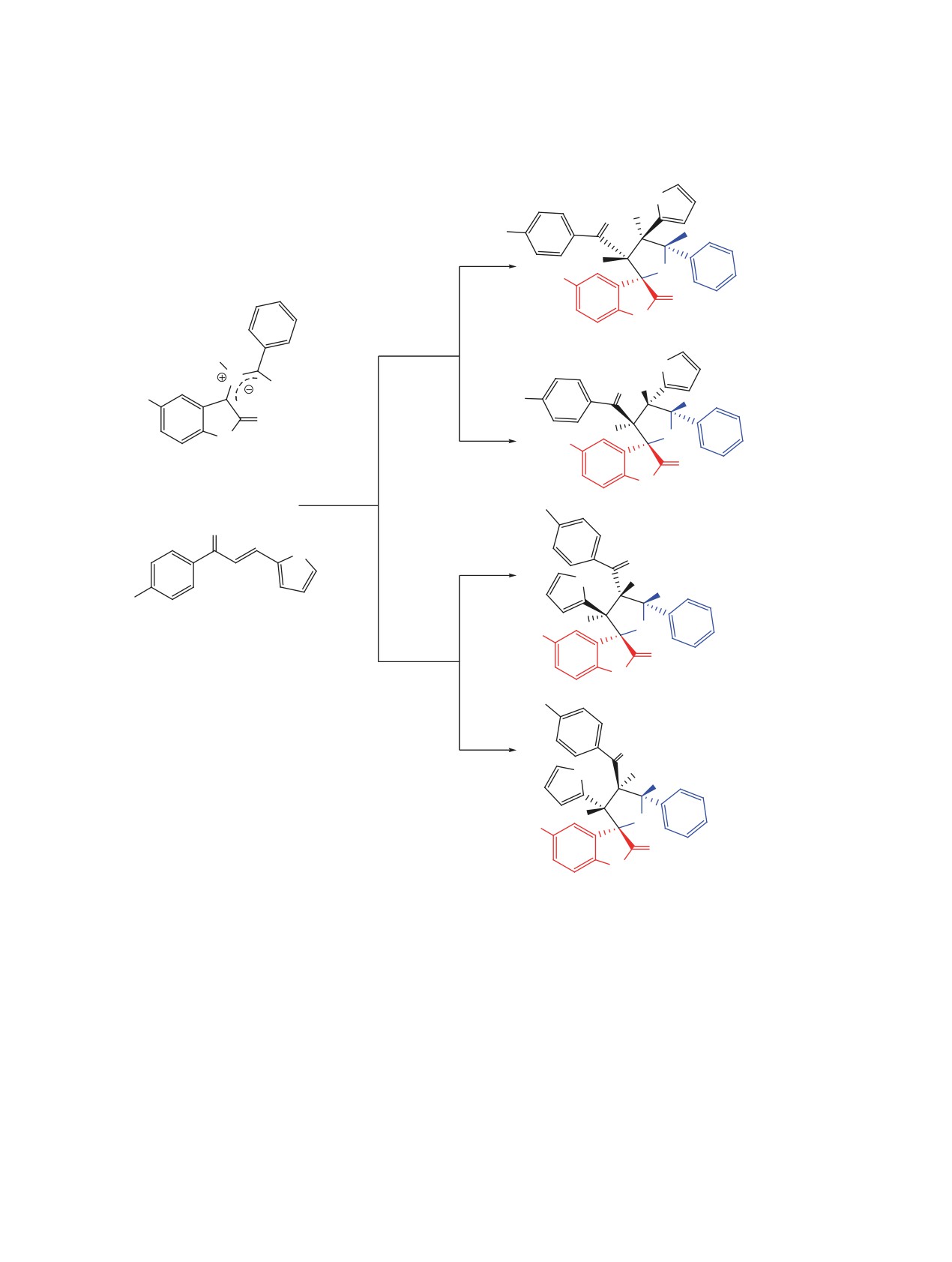
Схема 2. Регио- и стереоизомерные маршруты реакции 1,3-диполярного циклоприсоединения между
анти-азометин-илидом и халконом 3a
S
HB
O
Br
HC
HA
эндо-4a, b
R
NH
O
N
H
Стереоизомер
H
S
N
H
H
O
R
Br
H
O
H
N
R
NH
экзо-4a, b
H
O
1a, b
N
Региоизомер
анти-азометин-илид
H
Br
O
S
O
S
H
эндо-5a, b
H
Br
3a
H
R
NH
Стереоизомер
O
N
H
Br
O
экзо-5a, b
S
H
H
H
R
NH
O
N
H
R = H (a), Br (b).
в 1 мл ДМСО (или 96% этанола) при комнатной
продуктов смесей на один диастереомер (табл. 1,
температуре в закрытых флаконах. Как уже от-
позиции 1, 3, 5, 7 и 8).
мечалось, лучшая экзо-региоселективность была
Перекристаллизованные новые соединения яв-
получена с растворителем ДМСО и для
ляются аморфными и получить монокристаллы
компонентов реакции 1a/3a, 1b/3a, 1a/3b (табл. 1,
для рентгеноструктурного исследования не уда-
позиции 2, 4, 6).
лось. Принимая во внимание вышеизложенное,
Только продукты от реакции
1a/3a,
1b/3a,
регио- и стереохимия всех ожидаемых продуктов
1a/3b были разделены на один региоизомер с
была исследована на основе квантово-химическо-
использованием перекристаллизации из этанола.
го полуэмпирического метода PM7 и по практи-
В других случаях было невозможно разделение
ческому и теоретическому значению константы
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
ОДНОСТАДИЙНАЯ ТРЕХКОМПОНЕНТНАЯ РЕАКЦИЯ
871
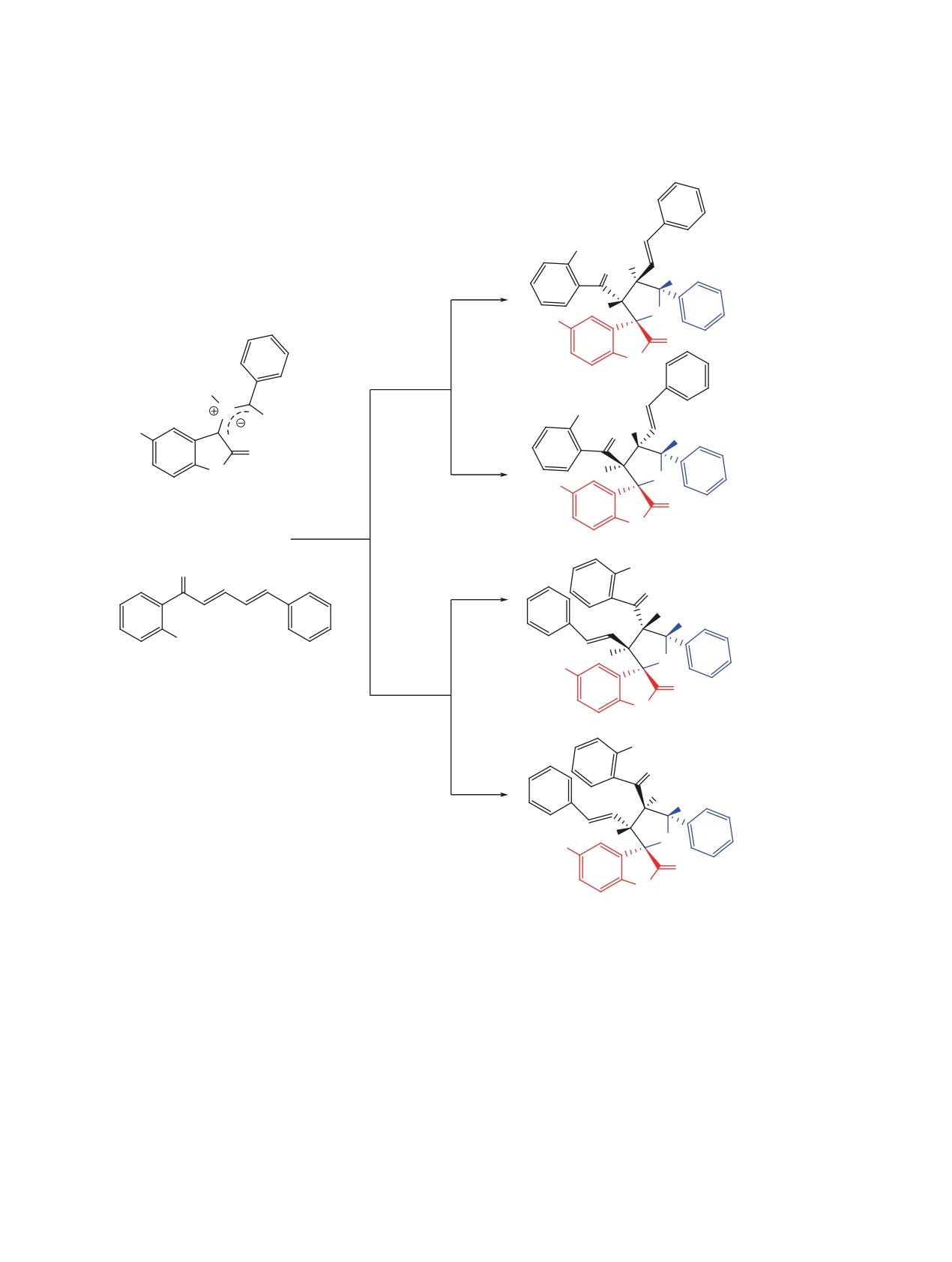
Схема 3. Регио- и стереоизомерные маршруты реакции 1,3-диполярного циклоприсоединения между
анти-азометин-илидом и халконом 3b
OH
O H
H
эндо-6a, b
H
R
NH
O
N
Стереоизомер
H
H
N
OH
H
H
R
O
H
O
N
H
экзо-6a, b
R
NH
H
1a, b
O
Региоизомер
N
анти-азометин-илид
H
O
OH
O
H
эндо-7a, b
H
OH
H
3b
R
NH
Стереоизомер
O
N
H
OH
O
H
экзо-7a, b
H
H
R
NH
O
N
H
R = H (a), Br (b).
спин-спинового взаимодействия ЯМР для прото-
для всех
изомеров. Это означает, что ДМСО
нов HA, HB, HC (табл. 2).
как растворитель просто селективно влиял на
образование экзо-изомеров для реакций 1a/3a,
Сравнивая теоретическую и практическую
1b/3a, 1a/3b (табл. 2, позиции 2, 4, 6). Это может
константу
спин-спинового
взаимодействия,
быть связано с более стерически свободным
можно отметить, что перекристаллизованные
пространством экзо-изомеров. Конформационная
соединения - это экзо-5а, экзо-5b и экзо-7а. Но
трехмерная структура и электростатический
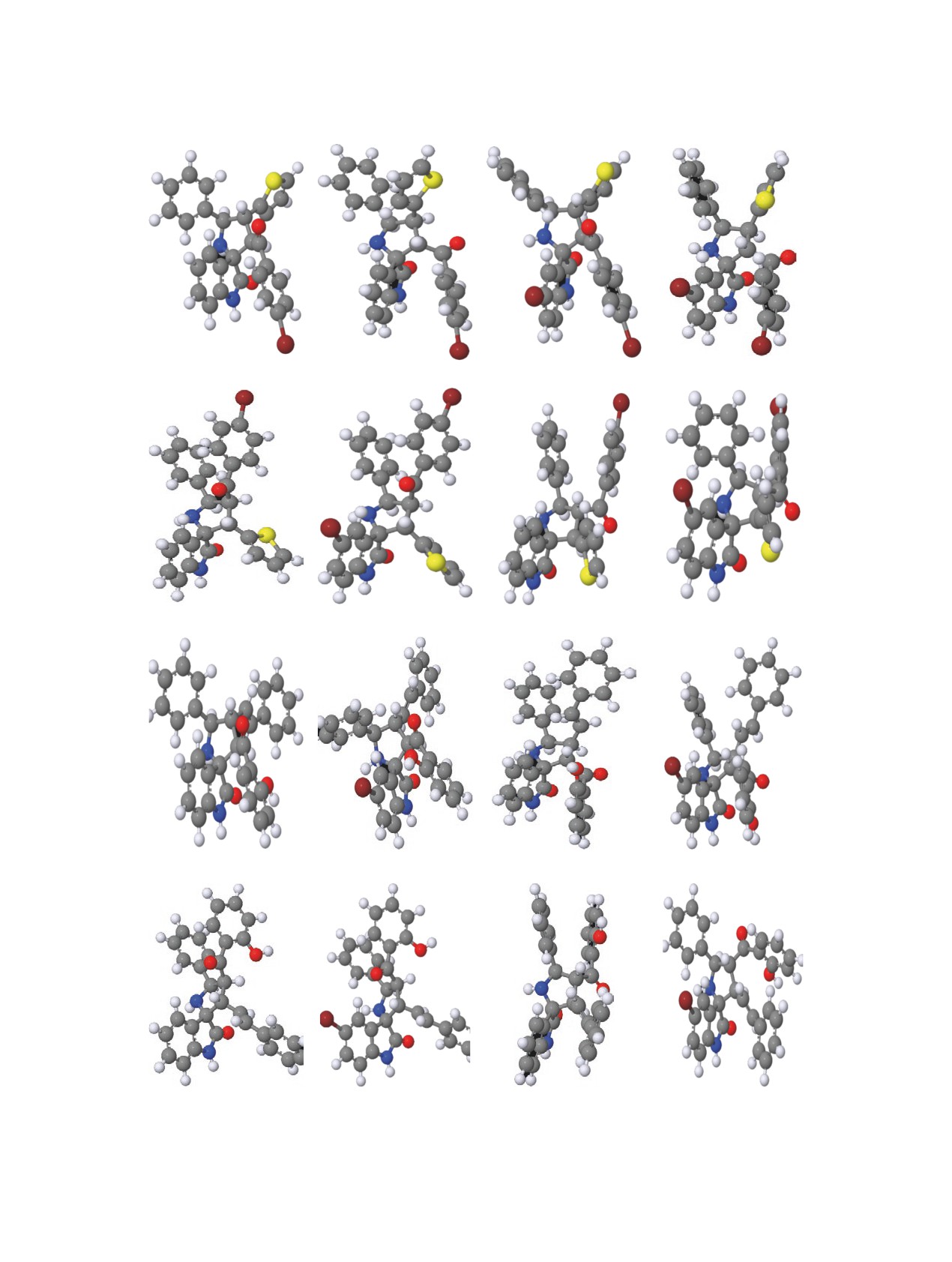
данные PM7 оптимизации продемонстрировали
потенциал для всех изомеров были рассчитаны
положительную (помимо эндо-6a и 7b) и прак-
с использованием квантово-химического полу-
тически одинаковую энергию теплоты образования
эмпирического метода PM7 (см. рисунок и S7).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
872
МАМЕДОВ, МАМЕДОВА
Таблица 1. Реакция 1,3-диполярного циклоприсоединения изатина 1a, b и бензиламина (2) с халконами 3a, b
Позиция и компоненты
Региоизомерное соотношение
Растворитель
Время, ч
Температура, °C
Выход, %
реакции
экзо-5a, 5b и 7a/эндо + экзо
1. 1a и 3a
Этанол
3
25
33
смесь
2. 1a и 3a
ДМСО
3
25
78
95:5
3. 1b и 3a
Этанол
3
25
58
смесь
4. 1b и 3a
ДМСО
3
25
90
97:3
5. 1a и 3b
Этанол
3
25
27
смесь
6. 1a и 3b
ДМСО
3
25
33
смесь
7. 1b и 3b
Этанол
3
25
37
смесь
8. 1b и 3b
ДМСО
3
25
67
90:10
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Magnet) Avance
300
(300.130 МГц для
1H и
75.468 МГц для 13C) с блоком датчиком регулято-
Все химические вещества были получены
ра температуры BVT 3200 в 5-миллиметровых
из коммерческого источника (Aldrich) и испо-
пробирках с использованием программного
льзовались в том виде, в котором они были
обеспечения Bruker Standard (TopSpin 3). Хи-
получены.
мические сдвиги 1H и 13C отнесены к внутреннему
ЯМР-эксперименты были выполнены на
тетраметилсилану (ТМС); экспериментальные па-
спектрометре ЯМР Bruker FT (UltraShield TM
раметры для 1H: цифровое разрешение = 0.23 Гц,
Таблица 2. PM7 программная оптимизация, практические и теоретические данные константы спин-спиновой связи
3JAB, Гц
3JBC
, Гц
Теплота образования,
Потенциал ионизации,
Дипольный момент,
Изомеры
ккал/моль
эВ
D
Теор.
Прак.
Теор.
Прак.
эндо-4a
40.55
9.12
1.01
6.6
-
8.43
-
эндо-4b
41.58
8.99
1.82
6.6
-
8.43
-
эндо-5a
43.87
8.95
1.71
9.25
-
8.02
-
эндо-5b
46.06
9.03
3.3
9.25
-
8.02
-
экзо-4a
42.16
8.93
3.67
6.68
-
7.54
-
экзо-4b
43.12
9.02
2.54
6.68
-
7.54
-
экзо-5a
43.81
8.98
1.95
9.25
9.0
9.28
9
экзо-5b
46.39
8.98
1.74
9.25
9.0
9.28
12
эндо-6a
-0.84
9.02
3.96
9.6
-
9.28
-
эндо-6b
0.70
8.97
4.67
9.6
-
9.28
-
экзо-6a
0.16
9.07
5.55
8.4
-
8.02
-
экзо-6b
3.99
8.92
3.92
8.4
-
8.02
-
эндо-7a
0.19
8.90
2.16
8.4
-
8.02
-
эндо-7b
1.43
8.81
3.87
8.4
-
8.02
-
экзо-7a
-0.91
8.96
3.39
9.6
9.0
9.28
9.0
экзо-7b
0.36
8.96
4.68
9.6
-
9.28
-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
ОДНОСТАДИЙНАЯ ТРЕХКОМПОНЕНТНАЯ РЕАКЦИЯ
873
эндо-4a
эндо-4b
экзо-4a
экзо-4b
эндо-5a
эндо-5b
экзо-5a
экзо-5b
эндо-6a
эндо-6b
экзо-6a
экзо-6b
эндо-7a
эндо-7b
экзо-7a
экзо-7b
Конформационная трехмерная структура для всех изомеров
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
874
МАМЕДОВ, МАМЕДОВА
SWH = 7530 Гц, TD = 32 K, SI = 16 K, длительность
(3S,3'R,4'R,5'R)-5-Бром-3'-(4-бромбензоил)-
импульса 90° = 10 мкс, PL1 = 3 dB, ns = 1, ds = 0,
5'-фенил-4'-(тиофен-2-ил)спиро[индол-3,2'-
d1 = 1 с; для 13C: цифровое разрешение = 0.27 Гц,
пирролидин]-2(1H)-он (экзо-5b). Беловато-жел-
SWH = 17985 Гц, TD = 64 K, SI = 32 K, длительность
тый порошок, выход 97%, т.пл. 163-165°С. Спектр
импульса 90° = 9 мкс, PL1 = 1.5 dB, ns = 100,
ЯМР 1H, δ, м.д.: 4.21 т (1H, CH, J 9.0 Гц), 4.55 д
ds = 2, d1 = 3 с (Рис. S1-S6). Для экзо-5a, 5b и 7a ис-
(1H, CH, J 12.0 Гц), 6.47 д (1H, CH, J 9.0 Гц), 8.57-
пользовали ацетон-d6 для ЯМР-спектроскопии).
7.02 м (15Haром), 9.47 с (1H, NH). Спектр ЯМР 13C,
δ, м.д.: 38.8 (СН), 48.0 (СН), 63.9 (СН), 65.9 (Счетв),
Квантово-химические расчеты были выполне-
110.9 (Саром), 119.8 (СНаром), 124.1 (СНтиоф.), 125.6
ны с помощью метода MOPAC PM7 оптимизации
(СНтиоф), 126.2 (СНтиоф), 127.1 (СНаром),
128.1
(см. рисунок и S7).
),
130.2
(СНаром), 129.2 (СНаром), 129.6 (СНаром
Чистота синтезированных соединений под-
(СНаром),131.6 (СНаром),
132.7 (СНаром),
136.0
тверждена методом тонкослойной хроматографии
(Саром), 137.1 (Саром), 139.0 (Саром), 140.8 (Саром),
(ТСХ) на коммерческих пластинах силикагеля
142.6 (Стиоф), 159.9 (Cаром), 180.6 (CONH), 195.3
с алюминиевой подложкой (60 F254), пары йода
(СО). Найдено, %: C 55.21; H 3.41; N 4.56; S 5.22;
использовали в качестве визуализирующего агента,
Br 26.26. Вычислено, %: C 55.23; H 3.42; N 4.58; S
элюент гексан-этилацетат,
5:2. Температуры
5.23; Br 26.28.
плавления измерены на приборе Stuart SMP30 без
(3S,3'R,4'R,5'R)-5-Бром-3'-(4-Бромбензоил)-
коррекции.
5'-фенил-4'-[(E)-2-фенилэтенил]спиро[индол-
Общая методика синтеза спиропирролиди-
3,2'-пирролидин]-2(1H)-он (экзо-7a). Беловато-
нонов. Смесь 0.16 ммоль (0.03 г) изатина 1a [или
желтый порошок, выход 90%, т.пл. 168-170°С.
0.04 г, 5-бромизатина (1b)], 0.25 ммоль (0.03 г)
Спектр ЯМР 1H, δ, м.д.: 3.72 т (1H, CH, J 9.0 Гц),
бензиламина (2) и 0.2 ммоль (0.06 г) (E)-1-(4-
4.89 д (1H, CH, J 9.0 Гц), 5.26 д (1H, CH, J 9.0 Гц),
бромфенил)-3-(тиофен-2-ил)проп-2-ен-1-она
(3a)
5.67 д (1H, =CH, J 9.0 Гц), 5.86 д (1H, =CH, J
[или
0.05 г,
(2E,4E)-1-(2-гидроксифенил)-5-фе-
15.0 Гц), 7.69-6.41 м (18Hаром), 8.93 с (1H, NH),
нилпента-2,4-диен-1-она (3b)] в 1 мл ДМСО (или
12.54 с (1H, OH), 11.44 с (1H, NH). Спектр ЯМР 13C,
96% этанола) перемешивали при 25°C в течение
δ, м.д.: 53.0 (СН), 54.1 (СН), 62.7 (СН), 68.9 (Счетв),
3 ч. Кристаллическое вещество, образовавшееся
109.4 (СНаром), 117.6 (СНаром), 118.1 (СНаром),
в реакционной смеси, фильтровали и для получе-
118.9 (СНаром),
121.3 (Саром),
122.1 (СНаром),
ния чистого продукта перекристаллизовывали из
123.8 (СНаром), 125.1 (СНаром), 126.1 (СНаром),
EtOH.
127.0 (=СН), 127.3 (СНаром), 127.4 (СНаром), 128.4
(3S,3'R,4'R,5'R)-3'-(4-Бромбензоил)-5'-фе-
(СНаром), 128.9 (СНаром), 129.4 (СНаром),
130.0
нил-4'-(тиофен-2-ил)спиро[индол-3,2'-пирро-
(=СН), 131.1 (СНаром), 133.7 (Саром), 136.2 (Саром),
лидин]-2(1H)-он (экзо-5a). Белый порошок, выход
136.4 (Саром), 145.6 (Саром), 154.3 (С-О),
178.3
95%, т.пл. 155-157°С. Спектр ЯМР 1H, δ, м.д.: 4.07
(CONH), 192.1 (СО). Найдено, %: C 78.99; H 5.33;
т (1H, CH, J 9.0 Гц), 4.64 д (1H, CH, J 9.0 Гц), 6.37
N 5.73. Вычислено, %: C 79.01; H 5.35; N 5.76.
д (1H, CH, J 9.0 Гц), 7.25 с (1H, NH), 7.65-6.51 м
ВЫВОДЫ
(16Hаром), 8.96 с (1H, NH), 8.66 с (1H, NH). Спектр
ЯМР 13C, δ, м.д.: 49.97 (СН), 54.9 (СН), 63.2 (СН),
Осуществлен синтез функционализированных
68.2 (Счетв), 109.1 (СНаром), 120.1 (СНаром), 121.7
спиропирролидинонов посредством односта-
(СНаром), 122.0 (СНаром), 124.1 (СНтиоф),
124.7
дийного
1,3-диполярного циклоприсоединения
(СНтиоф.), 125.3 (СНтиоф), 127.3 (СНаром),
127.6
азометин-илидов к производным халкона. Чис-
(СНаром), 128.1 (СНаром), 128.5 (СНаром),
128.7
тые продукты выделяли перекристаллизацией
(СНаром), 129.3 (Саром), 129.7 (Саром), 130.2 (Саром),
из этанола. Данные PM7 оптимизации проде-
131.9 (Саром), 132.6 (Стиоф), 137.1 (Cаром), 179.7
монстрировали положительную и одинаковую
(CONH), 196.7 (СO). Найдено, %: C 63.49; H 3.94;
энергию теплообразования для экзо-5a, экзо-
N 5.25; S 6.07; Br 15.09. Вычислено, %: C 63.52; H
5b и экзо-7a. В отличие от этанола ДМСО, как
3.97; N 5.29; S 6.05; Br 15.12.
растворитель, селективно влияет на образование
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
ОДНОСТАДИЙНАЯ ТРЕХКОМПОНЕНТНАЯ РЕАКЦИЯ
875
указанных экзо-изомеров. Вероятно, это связано
14.
Nunes R.C., A.Ribeiro C.J., Monteiro A., Rodri-
с более свободной пространственной структурой
gues C.M.P., Amaral J.D., Santos M.M.M. Eur.
J. Med. Chem. 2017, 139, 68-179. doi 10.1016/
экзо-изомеров.
j.ejmech.2017.07.057
КОНФЛИКТ ИНТЕРЕСОВ
15.
Магеррамов А.М., Нагиев Ф.Н., Мамедова Г.З., Аса-
Авторы заявляют об отсутствии конфликта
дов Х.А., Мамедов И.Г. ЖОрХ. 2018, 54, 1713-1715.
интересов.
[Magerramov A.M., Naghiyev F.N., Mamedova G.Z.,
Asadov Kh.A., Mamedov I.G. Russ. J. Org. Chem. 2018,
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
54, 1731-1734.] doi 10.1134/S1070428018110192
Дополнительные материалы доступны на
16.
Mamedova Y.V., Hasanova A.E., Gasimova Sh.Z.,
Huseynova R.A., Mamedov I.G. New Mat., Comp.
Appl. 2020, 4, 16.
СПИСОК ЛИТЕРАТУРЫ
17.
Sun W., Hong L., Zhu G., Wang Z., Wei X., Ni J.,
1.
Dhar D.N. The Chemistry of Chalcones and Related
Wang R. Org. Lett. 2014, 16, 544-547. doi 10.1021/
Compounds. New York: Wiley, 1981.
ol4034226
2.
Mamedov I.G., Magerramov A.M., Bairamov M.R.,
18.
Aguilar A., Sun W., Liu L., Lu J., Eachern D., Ber-
Mamedova E.V. Russ. J. Phys. Chem. 2010, 84, 2182-
nard D., Deschamps J.R., Wang S.J. Med. Chem. 2014,
2186. doi 10.1134/S0036024410120307
57, 10486-10498. doi 10.1021/jm501541j
3.
Mamedov I.G., Bayramov M.R., Mamedova Y.V., Ma-
19.
Zhang B., Feng P., Sun L.-H., Cui Y., Ye S., Jiao N.
harramov A.M. Magn. Reson. Chem. 2013, 51, 600-
Chem. Eur. J. 2012, 18, 9198-9203. doi 10.1002/
604. doi 10.1002/mrc.3982
chem.201201375
4.
Mamedov I.G., Bayramov M.R., Mamedova Y.V., Ma-
20.
Noole A., Oseka M., Pehk T., Oeren M., Jarving I.,
harramov A.M. Magn. Reson. Chem. 2013, 51, 234-
Elsegood M.R.J., Malkov A.V., Lopp M., Kanger T.
239. doi 10.1002/mrc.3933
Adv. Synth. Catal. 2013, 355, 829-835. doi 10.1002/
5.
Mamedov I.G., Bayramov M.R., Salamova A.E., Ma-
adsc.201300019
harramov A.M. Ind. J. Chem. 2015, 54B, 1518-1527.
21.
Klein J.E.M.N., Taylor R.J.K. Eur. J. Org. Chem. 2011,
34, 6821-6841. doi 10.1002/ejoc.201100836
6.
Mamedov I.G., Bayramov M.R., Mamedova Y.V., Ma-
22.
Singh G.S., Desta Z.Y. Chem. Rev. 2012, 112, 6104-
harramov A.M. Magn. Reson. Chem. 2015, 53, 147-
6155. doi 10.1021/cr300135y
153. doi 10.1002/mrc.4172
23.
Походыло Н.Т., Тупычак М.А., Шийка О.Я., Обу-
7.
Mamedov I.G., Abbasoglu R., Bayramov M.R., Ma-
шак М.Д. ЖОрХ. 2019, 55, 1393-1405. [Pokhody-
harramov A.M. Magn. Reson. Chem. 2016, 54, 315-
lo N.T., Tupychak M.A., Shyyka O.Ya., Obushak N.D.
319. doi 10.1002/mrc.437
Russ. J. Org. Chem. 2019, 55, 1310-1321.] doi 10.1134/
8.
Mamedov I.G., Mamedova Y.V., Khrustalev V.N.,
S1070428019090082
Bayramov M.R., Maharramov A.M. Ind. J. Chem.
24.
Мороз А.А., Дмитриев М.В., Масливец А.Н. ЖОрХ.
2017, 56B, 192-196.
2020, 56, 1046-1054. [Moroz A.A., Dmitriev M.V.,
9.
Mamedov I.G., Farzaliyeva A.E., Mamedova Y.V.,
Maslivets A.N. Russ. J. Org. Chem. 2020, 56, 1166-
Hasanova N.N., Bayramov M.R., Maharramov A.M.
1173.] doi 10.1134/S1070428020070076
Ind. J. Chem. 2018, 57B, 1310-1314.
25.
Farghaly T.A., Abbas I.M., Hassan W.M.I., Lotfy M.S.,
10.
Mamedov I.G., Shikhaliyeva I.M., Mamedova Y.V.,
Al-Qurashi N.T., Ben Hadda T. Russ. J. Org. Chem. 2020,
Abdurahmanli S.G., Maharramov A.M. Ind. J. Chem.
56, 1258-1271.] doi 10.1134/S1070428020070210
2019, 58B, 930-934.
26.
Dutta K., Kumar M., Ghosh S.K., Das A., Chowdhu-
11.
Mishra N., Arora P., Kumar B., Mishra L.C.,
ry R. Synth. Commun.
2019,
49,
444-455. doi
Bhattacharya A., Awasthi S.K., Bhasin V.K. Eur.
10.1080/00397911.2018.1560472
J. Med. Chem. 2008, 43, 1530-1535. doi 10.1016/
27.
Peng C., Ren J., Xiao J., Zhang H., Yang H.,
j.ejmech.2007.09.014
Luo Y. Beilstein J. Org. Chem. 2014, 10, 352-360. doi
12.
Tiwari Sh., Pathak P., Sagar R. Bioorg. Med. Chem. Lett.
10.3762/bjoc.10.33
2016, 10, 2513-2516. doi 10.1016/j.bmcl.2016.03.093
28.
Thangamani A. Eur. J. Med. Chem. 2010, 45, 6120-
13.
Shi X., Qin T., Liu W., Zhang X., Li L., Huo J.,
6126. doi 10.1016/j.ejmech.2010.09.051
Zhou K., Yang D., Zhang Y., Wang C. Biomed.
29.
Sarrafi Y., Hamzehloueian M., Alimohammadi K.,
Pharmacother. 2017, 96, 1186-1192. doi 10.1016/
Yeganegi S. J. Mol. Struct. 2012, 1030, 168-176. doi
j.biopha.2017.11.100
10.1016/j.molstruc.2012.04.013
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
876
МАМЕДОВ, МАМЕДОВА
One-pot Three-component 1,3-Dipolar Cycloaddition Reaction
for Synthesis of Spiropyrrolidinones
I. G. Mamedov* and Y. V. Mamedova
Baku State University, faculty of chemistry, ul. Z. Khalilova, 23, Baku, Az-1148 Azerbaijan
*e-mail: bsu.nmrlab@gmail.com
Received January 17, 2021; revised January 28, 2021; accepted January 30, 2021
A three-component one-pot 1,3-dipolar cycloaddition reaction between the isatin, benzylamine and α,β-unsa-
turated ketones have been carried out for the synthesis of a spiropyrrolidinones at ambient temperature. The
products were obtained with good yields and as a single diastereomer in some cases. Primary amine was served
as a base component for the in-situ generation of azomethine ylides from isatin. Regio- and stereo-isomers were
investigated on the based PM7 optimization and NMR methods.
Keywords: isatin, benzylamine, unsaturated ketone, cycloaddition
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021