ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 6, с. 895-900
КРАТКИЕ СООБЩЕНИЯ
УДК 547.849:547.31:547.914.4
СИНТЕЗ ТРИТЕРПЕНОИДА С ЭТИЛИДЕНОВЫМ
ФРАГМЕНТОМ В ЦИКЛЕ Е ИЗ АЛЛОБЕТУЛИНА
© 2021 г. З. И. Галимова, М. С. Бабаев, А. Н. Лобов, О. Б. Казакова*
Уфимский Институт химии - обособленное структурное подразделение
ФГБНУ «Уфимского федерального исследовательского центра РАН»,
450054, Россия, Уфа, просп. Октября, 71
*e-mail: obf@anrb.ru
Поступила в редакцию 18.02.2021 г.
После доработки 11.03.2021 г.
Принята к публикации 14.03.2021 г.
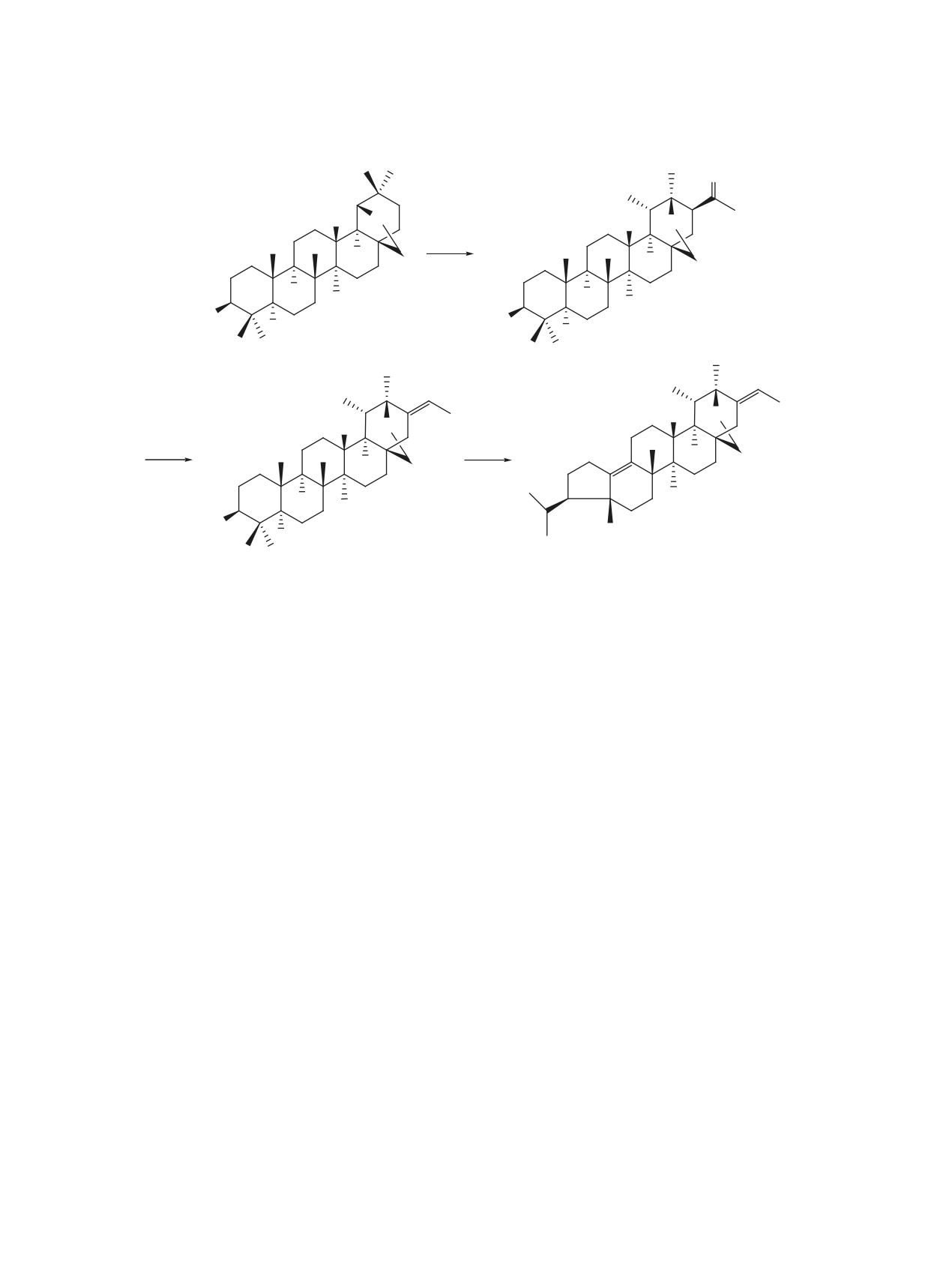
Из аллобетулина через стадию его превращения в 3β-ацетокси-21β-ацетил-20β,28-эпокси-18α,19βН-урсан
с последующей кислотно-катализируемой дегидратацией продукта восстановления ацетильного фраг-
мента синтезировали тритерпеноид с транс-этилиденовым заместителем в цикле Е, структура которого
установлена с использованием двумерных корреляционных методик {1H, 1H} COSY, {1H, 1H} NOESY,
{1H, 13С} HSQC и {1H, 13С} HMBC.
Ключевые слова: бетулин, аллобетулин, урсановые тритерпеноиды
DOI: 10.31857/S0514749221060148
Один из наиболее доступных производных
[14], обладающие противовирусной активнос-
лупанового тритерпеноида бетулина - аллобету-
тью.
лин 1 [1], относящийся к группе тритерпеноидов
В литературе нам удалось найти несколько
ряда германикана - достаточно редкому классу
примеров по превращению тритерпеноидов с аце-
природных соединений [2]. Среди тритерпено-
тильной группой в структуре до этилиденовой че-
идов с 19β,28-эпокси-18α-олеанановым остовом
рез стадию восстановления с последующей деги-
выявлены соединения с противоязвенной и про-
дратацией [15-17]. Соединение 2 содержит в сво-
тивовоспалительной [3], противовирусной [4-6],
ей структуре ацетильную группу в положении С21,
цитотоксической [7], иммунорегуляторной [8] и
в настоящей работе проведена модификация этого
другими видами биологической активности. В ре-
тритерпеноида с образованием производного с
зультате раскрытия тетрагидрофуранового кольца
этилиденовым фрагментом.
аллобетулина синтезированы тритерпеноиды ряда
олеан-18(19)-ена и 20(21)-урсена, такие как мора-
Взаимодействием
3β-ацетокси-21β-ацетил-
диол и гетеробетулин [9-12]. Из бетулина получе-
20β,28-эпокси-18α,19βH-урсана (2) с алюмогидри-
ны α,β-непредельные метилкетоны 18αH,19βH-ур-
дом лития при кипячении в ТГФ мы планировали
санового типа с последующей гетероциклизацией
получить
3,31-дигидрокси-производное, однако
до пиразолинов [13]. Нами показано, что в среде
продуктом реакции стало соединение 3 с этили-
HClO4-Ac2O 3-ацетокси- или 3-оксоаллобетулин
деновым фрагментом (выход 73%) (схема 1). Его
превращаются в 3β-ацетокси-21β-ацетил-20β,28-
образование может быть объяснено кислотно-ка-
эпокси-18α,19βН-урсан
(2)
[12] и 3,28-диацет-
тализируемой дегидратацией восстановленного
окси-21-ацетил-2(3),20(21)-18α,19βH-урсандиен
ацетильного фрагмента, образующегося в ре-
895
896
ГАЛИМОВА и др.
Схема 1
O
20
31
19
H
O
21
32
H
O
i
H
H
28
H
H
3
HO
AcO
H
H
1
2
20
31
31
19
20
19
21
32
H
O
21
32
H
O
ii
iii
9
H
28
H
28
10
24
3
H
4
3
HO
H
23
3
4
Реагенты и условия: i, HClO4, Ac2O, 140°C, 5 ч;
ii, LiAlH4, ТГФ, Δ, 4 ч, 10% HCl; iii, AcCl, CH3CN, Δ, 5 ч.
зультате обработки реакционной массы 10%-ным
метильных групп в положении С30 и С32 (δH 1.16
раствором HCl. ТСХ-анализ реакционной массы
и 1.57 м.д.), а также метиновый протон H19 (δH
указывал на наличие одного продукта реакции,
1.50 м.д.) и метиленовый протон Hβ22 (δH 2.07 м.д.).
хотя ожидаемо образование изомерных алкенов.
Наблюдаемая квартет-триплетная мультиплет-
Известно, что транс-алкены более стабильны,
ность сигнала протона двойной связи при δH
чем цис-изомеры, и обычно выступают основным
5.35 м.д. обусловлена спин-спиновым взаимодей-
образующимся продуктом [18]. Соединение 3 под
ствием с метильной группой (δH 1.57 м.д.) с ха-
действием хлористого ацетила в ацетонитриле
рактерной величиной 3J 6.7 Гц и дальним взаимо-
превратили в производное 4 с пятичленным ци-
действием с протонами Hα22 и Hβ22 (4J 2.9 Гц). В
клом А, аналогичные превращения под действием
спектре NOESY наблюдаются кросс-пики между
кислотных катализаторов описаны ранее [19-21].
протоном двойной связи H31 и метильными про-
тонами H30 (δH 5.35 и 1.16 м.д. соответственно),
Структуры соединений 3 и 4 установлены с
а также между протонами метильной группы при
использованием двумерных корреляционных ме-
двойной связи H32 (δH 1.57 м.д.) и метиленовыми
тодик {1H, 1H} COSY, {1H, 1H} NOESY, {1H, 13С}
протонами в положении Н22 (δH 2.07 и 1.88 м.д.),
HSQC и {1H, 13С} HMBC. В спектре ЯМР 13С со-
что однозначно указывает на транс-конфигура-
единения 3 наблюдаются сигналы двойной свя-
цию двойной связи.
зи: CH-группа при δC 117.04 м.д. и четвертичный
углерод при δC 137.99 м.д., а также сигнал метиль-
Перестройка шестичленного цикла А в пяти-
ной группы при двойной связи при δC 12.67 м.д.
членный с изопропильным заместителем в положе-
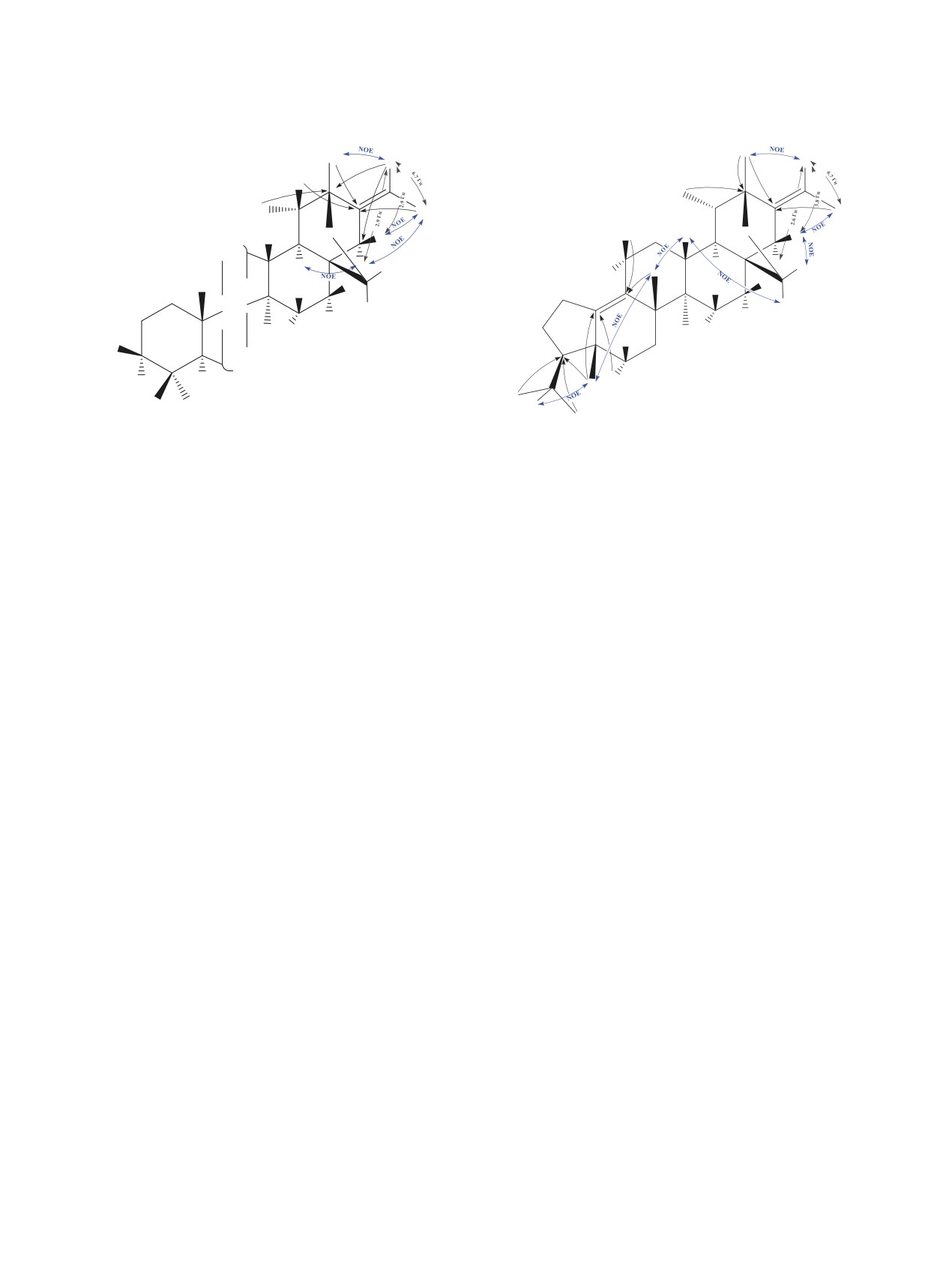
Положение и ориентация этилиденового фрагмен-
нии С3 подтверждена данными ЯМР 13С: две мети-
та относительно цикла E были локализованы на
леновые группы при δC 26.52 (C1), 27.60 (C2) м.д.,
основании HMBC, COSY и NOESY корреляций
метиновая группа c δC 59.22 (C3) м.д., два четвер-
(рис. 1). В HMBC спектре с четвертичным сиг-
тичных углерода c δC 42.82 (C5), 141.85 (C2) м.д.
налом при δC 137.99 м.д. коррелируют протоны
и сигналы изопропильной группы при δC 29.87
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ ТРИТЕРПЕНОИДА С ЭТИЛИДЕНОВЫМ ФР
АГМЕНТОМ
897
30CH3
30
H
H
H
20
29
20
31
31
H3C
19
21
CH3
19
21
32
29
32
E
O
Hax
O
H
Hβ
H
22
Hβ
18
22
18
12
11
H
17
Hα
13
H
17
Hα
HA
13
HA
Heq
26
C
D
28
28
Heq
Heq
CH3
Hax
9
Hax
14
16
14
16
HB
1
10
HB
1
8
15
Hax
15
Hax
2
10
Heq
Heq
H3C
2
27
A
B
5
Hax
HO
3
7
3
5
4
6
H
Heq
H
4
25
24
H3C
CH3
H
23
Рис. 1. Значимые НМВС, COSY и NOESY корреляции
Рис. 2. Значимые НМВС, COSY и NOESY корреляции
соединения 3
соединения 4
(C4), 22.94 (C23) и 23.13 (C24) м.д., для которых
3J15eq-16eq
2.7 Гц), 1.00-1.08 м (1H, H1a2x), 1.16 с
наблюдаются взаимодействия в спектрах HMBC и
(3H, H30), 1.16 д.д.д (1H, H1e6q, 2J 13.9, 3J16eq-15ax
COSY (рис. 2). Локализация двойной связи в по-
4.1, 3J16eq-15eq 2.7 Гц), 1.27 к.д (1H, H1a1x, 2J 12.2,
ложении C9, С10 проведена на основании HMBC
3J11ax-12ax 12.2, 3J11ax-9 12.2, 3J11ax-12eq 4.3 Гц), 1.34
кросс-пиков H6eq (δH 1.78 м.д.) и H25 (δH 0.82 м.д.)
д.д (1H, H9, 3J9-11ax 12.6, 3J9-11eq 2.4 Гц), 1.35-1.39
с четвертичным сигналом двойной связи при δC
м (1H, H7eq), 1.35-1.43 м (1H, H7ax), 1.35-1.43 м (1H,
141.85 м.д., а также H1a1x (δH 1.96 м.д.) и H26 (δH
H6ax), 1.41 д.д.д (1H, H1a6x, 2J 13.9, 3J16ax-15ax 13.9,
1.11 м.д.) с сигналом C9 при δC 131.24 м.д. β-По-
3J16ax-15eq 4.4 Гц), 1.47-1.53 м (1H, H19), 1.48-1.54
ложение изопропильной группы установлено на
м (1H, H1a5x), 1.51-1.55 м (1H, H6eq), 1.54-1.58 м
основании NOESY кросс-пика H4 (δH 1.58 м.д.) с
(1H, H1e1q), 1.57 д (3H, H32, 3J32-31 6.7 Гц), 1.58 к.д
метильной группой H25 (δH 0.82 м.д.), которая в
(1H, H2ax, 2J 11.5, 3J2ax-3 11.5, 3J2ax-1ax 11.5, 3J2ax-1eq
свою очередь взаимодействует в спектре NOESY с
4.5 Гц), 1.64 м (1H, H2eq), 1.68 т.д (1H, H13, 3J13-18
метильной группой H26 (δH 1.11 м.д.).
11.7, 3J13-12ax
11.7, 3J13-12eq 3.4 Гц), 1.72 м (1H,
H1eq), 1.71-1.75 м (1H, H1e2q), 1.88 д.т (1H, Hα22, 2J
3β-Гидрокси-21-транс-этилиден-20β,28-
16.8, 3J22α-28B 2.9, 4J22α-31 2.9 Гц), 2.07 д.д (1H, Hβ22,
эпокси-18α,19βH-урсан (3). К раствору 0.53 г
2J 16.8, 4J22β-31 2.9 Гц), 3.20 д.д (1H, H3, 3J3-2ax 11.5,
(1 ммоль) соединения 2 в 30 мл абсолютизиро-
3J3-2eq 4.9 Гц), 3.24 д.д (1H, HA28, 2J 8.5, 4J28A-18
ванного ТГФ добавляли 0.11 г (3 ммоль) LiAlH4
1.5 Гц), 4.21 д.д (1H, HB28, 2J 8.5, 4J28B-22α 2.9 Гц),
и кипятили с обратным холодильником 4 ч, затем
5.35 к.т (1H, H31, 3J31-32 6.7, 4J31-22α 2.9, 4J31-22β
добавляли 100 мл H2O и 10 мл HCl (10%). Про-
2.9 Гц). Спектр ЯМР 13C (СDCl3), δ, м.д.: 12.67
дукт реакции экстрагировали CHCl3 (3×15 мл), ор-
(C32), 14.31 (C27), 15.38 (C24), 15.77 (C26), 16.38
ганический слой промывали H2O (3×100 мл), су-
(C25), 18.26 (C6), 20.06 (C29), 20.75 (C3), 21.29 (C11),
шили над CaCl2, растворитель упаривали в вакуу-
25.72 (C12), 26.59 (C15), 27.42 (C2), 27.99 (C23), 29.90
ме и хроматографировали на колонке с Al2O3 (элю-
(C16), 33.00 (C17), 33.96 (C7), 37.20 (C10), 38.86 (C1),
ент петролейный эфир-этилацетат,
10:0→5:1).
38.88 (C4), 39.80 (C13), 40.73 (C8), 40.96 (C22), 41.38
Выход 0.34 г (73%), Rf 0.54, т.пл. 179-180°C,
(C14), 42.99 (C19), 46.48 (C18), 50.80 (C9), 55.45
[α]D20 +19° (c
0.025, CHCl3). Спектр ЯМР 1H
(C5), 68.89 (C28), 74.95 (C20), 78.97 (C3), 117.04
(СDCl3), δ, м.д.: 0.70 д.д (1H, H5, 3J5-6ax 12.6, 3J5-6eq
(C31), 137.99 (C21). Найдено, %: С 82.00; H 11.17.
2.4 Гц), 0.72 д (3H, H29, 3J29-19 6.9 Гц), 0.77 с
Масс-спектр, m/z (Iотн, %): 469.4 [М]+. C32H52O2.
(3H, H24), 0.77 д.д.д (1H, H18, 3J18-13 10.9, 3J18-19
Вычислено, %: С 81.99; H 11.18. M 468.75.
6.1, 4J18-28A 1.5 Гц), 0.85 с (3H, H25), 0.91 с (3H,
H27), 0.95 м (1H, H1ax), 0.97 с (3H, H23), 0.99 с (3H,
α-нео-5β-Метил-25-нор-9-ен-21-транс-этил-
H26), 1.03 д.д.д (1H, H1e5q, 2J 13.7, 3J15eq-16ax 4.5,
иден-20β,28-эпокси-18α,19βH-урсан (4). К рас-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
898
ГАЛИМОВА и др.
твору 0.47 г (1 ммоль) соединения 3 в 15 мл осу-
при 100-120°С в течение 2-3 мин. Элементный
шенного СН3СN прикапывали 1 мл свежеперег-
анализ осуществляли на СHNS-анализаторе
нанного АсСl и кипятили с обратным холодильни-
EuruEA-3000, основной стандарт ацетанилид.
ком 5 ч. Смесь выливали в 100 мл холодной воды,
Масс-спектры соединений снимали на приборе
выпавший осадок отфильтровывали, промывали
Thermo Finnigan MAT 95 XP. Спектры ЯМР 1Н и
водой до нейтральной реакции, сушили на воздухе,
13С зарегистрированы на импульсном спектроме-
кристаллизовали из гексана. Выход 0.31 г (68%), Rf
тре «Bruker» Avance III с рабочей частотой 500.13
0.76, т.пл. 107-108°C, [α]D20 +88° (c 0.025, CHCl3).
(1H) и 125.47 (13C) МГц с использованием 5 мм
Спектр ЯМР 1H (СDCl3), δ, м.д.: 0.73 д (3H, H29,
датчика с Z-градиентом PABBO при постоянной
3J29-19 6.9 Гц), 0.80 с (3H, H27), 0.82 с (3H, H25),
температуре образца 298 K. Химические сдвиги
0.82 д.д.д (1H, H18, 3J18-13 10.9, 3J18-19 6.1, 4J18-28A
в спектрах ЯМР 1Н и 13С приведены в м.д. отно-
1.5 Гц), 0.91 д (3H, H24, 3J24-4 6.8 Гц), 0.95 д (3H,
сительно сигнала внутреннего стандарта тетраме-
H23, 3J23-4 6.8 Гц), 0.97-1.07 м (1H, H1a2x), 1.04-1.07
тилсилана (ТМС).
м (1H, H3), 1.11 с (3H, H26), 1.17 с (3H, H30), 1.19 с
ВЫВОДЫ
(1H, H1e6q), 1.26-1.29 м (1H, H6ax), 1.30-1.34 м (1H,
H1e5q), 1.31-1.35 м (1H, H7eq), 1.35-1.39 м (1H, HA2),
Из аллобетулина через стадию его превра-
1.39-1.45 м (1H, H1a6x), 1.41-1.47 м (1H, H1a5x), 1.53-
щения в
3β-ацетокси-21β-ацетил-20β,28-эпокси-
1.58 м (1H, H19), 1.58 д (3H, H32, 3J32-31 6.7 Гц),
18α,19βН-урсан с последующей кислотно-катали-
1.56-1.60 м (1H, H4), 1.63-1.67 м (1H, H1e2q), 1.76-
зируемой дегидратацией продукта восстановления
1.80 м (1H, H6eq), 1.84 д.д.д (1H, H13, 3J13-18 11.9,
ацетильного фрагмента синтезировали тритерпе-
3J13-12ax 11.4, 3J13-12eq 3.4 Гц), 1.84-1.88 м (1H, HB2),
ноид с транс-этилиденовым заместителем в ци-
1.87-1.93 м (1H, Hα22), 1.90-1.94 м (1H, H7ax), 1.94-
кле Е, который далее превратили в производное с
1.98 м (1H, H1a1x), 2.09 д.д (1H, Hβ22, 2J 16.7, 4J22β-31
пятичленным циклом А.
2.6 Гц), 2.20-2.24 м (1H, HA1), 2.25-2.29 м (1H, HB1),
БЛАГОДАРНОСТИ
2.31-2.35 м (1H, H1e1q), 3.26 д.д (1H, HA28, 2J 8.5,
ЯМР, масс-спектры записаны на оборудова-
4J28A-18 1.5 Гц), 4.26 д.д (1H, HB28, 2J 8.5, 4J28B-22α
нии ЦКП «Химия» УфИХ УФИЦ РАН и РЦКП
2.9 Гц), 5.37 к.т (1H, H31, 3J31-32 6.7, 4J31-22α 3.8,
«Агидель» УфИЦ РАН.
4J31-22β 2.6 Гц). Спектр ЯМР 13C (СDCl3), δ, м.д.:
12.73 (C32), 16.39 (C27), 18.01 (C25), 20.09 (C29),
ФОНДОВАЯ ПОДДЕРЖКА
20.82 (C30), 22.94 (C23), 23.13 (C24), 25.61 (C12),
Работа выполнена в рамках проекта
25.68 (C26), 26.46 (C11), 26.52 (C1), 27.32 (C15),
РФФИ (№ 19-33-60083) и темы Госзадания
27.60 (C2), 29.50 (C7), 29.87 (C4), 30.02 (C16), 33.17
(№ АААА-А20-120012090029-0).
(C17), 37.38 (C6), 40.49 (C8), 40.98 (C22), 41.25 (C13),
КОНФЛИКТ ИНТЕРЕСОВ
41.68 (C14), 42.82 (C5), 43.02 (C19), 46.38 (C18),
59.22 (C3), 68.97 (C28), 75.02 (C20), 117.10 (C31),
Авторы заявляют об отсутствии конфликта ин-
131.24 (C9), 138.08 (C21), 141.85 (C10). Найдено, %:
тересов.
С 85.27; H 11.18. Масс-спектр, m/z (Iотн, %): 451.3
СПИСОК ЛИТЕРАТУРЫ
[М]+. C32H50O. Вычислено, %: С 85.30; H 11.21. M
1. Толстиков Г.А., Флехтер О.Б., Шульц Э.Э., Балти-
450.74.
на Л.А., Толстиков А.Г. Хим. в интересах устойч.
Температуру плавления синтезированных сое-
развития. 2005, 1, 1-30.
динений определяли на микростолике «Boetius».
2. Dehaen W., Mashentseva A. A., Seitembetov T.S.
Оптическое поглощение измеряли на поляриметре
Molecules.
2011,
16,
2443-2466. doi
10.3390/
«Perkin-Elmer 241 MC» (Германия) в трубке дли-
molecules16032443
ной 1 дм. ТСХ-анализ проводили на пластинках
3. Флехтер О.Б., Медведева Н.И., Карачурина Л.Т.,
Сорбфил (ЗАО Сорбполимер, Россия), используя
Балтина Л.А., Галин Ф.З., Зарудий Ф.С., Толсти-
систему растворителей хлороформ-этилацетат,
ков Г.А. Хим.-фарм. ж. 2005, 39, 401-404. [Flekh-
40:1. Вещества обнаруживали 10%-ным раство-
ter O.B., Medvedeva N.I., Karachurina L.T., Balti-
ром серной кислоты с последующим нагреванием
na L.A., Galin F.Z., Zarudii F.S., Tolstikov G.A. Pharm.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
СИНТЕЗ ТРИТЕРПЕНОИДА С ЭТИЛИДЕНОВЫМ ФР
АГМЕНТОМ
899
Chem. J. 2005, 39, 401-404.] doi 10.30906/0023-1134-
12.
Khusnutdinova E.F., Medvedeva N.I., Kazakov D.V.,
2005-39-8-9-12
Kukovinets O.S., Lobov A.N., Suponitsky K.Y.,
4.
Бореко Е.И., Павлова Н.И., Савинова О.В., Флех-
Kazakova O.B. Tetrahedron Lett. 2016, 57, 148-151.
тер О.Б., Нигматуллина Л.Р., Балтина Л.А., Га-
doi 10.1016/j.tetlet.2015.11.086
лин Ф.З., Толстиков Г.А. Пат. 7809 (2005). Респ.
13.
Nazarov M.A., Tolmacheva I.A., Grishko V.V. Arkivoc.
Беларусь.
2019, vi, 267-276. doi 10.24820/ark.5550190.p011.035
5.
Галайко Н.В., Толмачева И.А., Гришко В.В., Волко-
14.
Babaev M., Khusnutdinova E., Lobov A., Galimova Z.,
ва Л.В., Перевозчикова Е.Н., Пестерева С.А. Биоорг.
Petrova A., Rybalova T., Nguyen H.T.T., Meyers C.,
Хим. 2010, 36, 556-562. [Galayko N.V., Tolmache-
va I.A., Grishko V.V., Volkova L.V., Perevozchiko-
Prichard M., Kazakova O. Nat. Prod. Res. 2020, 1-11.
va E.N., Pestereva S.A. Russ J. Bioorg. Chem. 2010,
doi 10.1080/14786419.2020.1855159
36, 516-521.] doi 10.1134/S1068162010040114
15.
Klinot J., Hovorkova N., Vystrcil A. Collect. Czech.
6.
Khusnutdinova E.F., Kazakova O.B., Lobov A.N.,
Chem. Commun. 1970, 35, 1105-1119. doi 10.1002/
Kukovinets O.S., Suponitsky K.Yu., Meyers C.B.,
chin.197025170
Prichard M.N. Org. Biomol. Chem. 2019, 17, 585-597.
16.
Klinotova E., Hovorkova N., Klinot J., Vystrčil A.
doi 10.1039/C8OB02624F
Collect. Czech. Chem. Commun. 1973, 38, 1179-1189.
7.
Хуснутдинова Э.Ф., Смирнова И.Е., Казакова О.Б.
doi 10.1135/cccc19731179
ХПС. 2020, 56, 465-471. [Khusnutdinova E.F., Smir-
17.
Wang M., Li H., Liu W., Cao H., Hu X., Gao X.,
nova I.E., Kazakova O.B. Chem. Nat. Compd. 2020,
56, 465-471.] doi 10.1007/s10600-020-03064-5
Xu F., Li Z., Hua H., Li D. Eur. J. Med. Chem. 2020,
189, 112087. doi 10.1016/j.ejmech.2020.112087
8.
Gein S.V., Grishko V.V., Baeva T.A., Tolmacheva I.A.
Int. J. Pharmacol. 2013, 9, 74-79. doi 10.3923/
18.
Рэмсден Е.Н. Начала современной химии. Ред.
ijp.2013.74.79
В.И. Барановский, А.А. Белюстин, А.И. Ефимов,
9.
Klinot J., Vystrčil A. Collect. Czech. Chem. Commun.
А.А. Потехин. Л.: Химия, 1985, 645-648.
1964, 29, 516-530.
19.
Li T. S., Wang J. X., Zheng X. J. J. Chem. Soc., Perkin
10.
Казакова О.Б., Хуснутдинова Э.Ф., Толстиков Г.А.,
Trans. 1. 1998, 23, 3957-3966. doi 10.1039/A806735J
Супоницкий К.Ю. Биоорг. Хим. 2010, 36, 552-555.
20.
Pakulski Z., Cmoch P., Korda A., Luboradzki R.,
[Kazakova O.B., Khusnutdinova E.F., Tolstikov G.A.,
Gwardiak K., Karczewski R. J. Org. Chem. 2021, 86,
Suponitsky K.Yu. Russ. J. Bioorg. Chem. 2010, 36,
1084-1095. doi 10.1021/acs.joc.0c02560
512-515.] doi 10.1134/S1068162010040102
11.
Kazakova O.B., Giniyatullina G.V., Yamansarov E.Y.,
21.
Kazakova O.B., Khusnutdinova E.F., Lobov A.N.,
Tolstikov G.A. Bioorg. Med. Chem. Lett. 2010, 20,
Medvedeva N.I., Spirikhin L.V. Chem. Nat. Compd.
4088-4090. doi 10.1016/j.bmcl.2010.05.083
2011, 47, 579. doi 10.1007/s10600-011-9999-9
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021
900
ГАЛИМОВА и др.
Synthesis of Triterpenoid with an Ethylidene Fragment
in the E Cycle from Allobetulin
Z. I. Galimova, M. S. Babaev, A. N. Lobov, and O. B. Kazakova*
Ufa Institute of Chemistry of the Ufa Federal Research Centre of the Russian Academy of Science,
prosp. Оktyabrya, 71, Ufa, 450054 Russia
*e-mail: obf@anrb.ru
Received February 18, 2021; revised March 11, 2021; accepted March 14, 2021
On the basis of 3β-acetoxy-21β-acetyl-20β,28-epoxy-18α,19βH-ursan, synthesized from allobetulin, with further
acid-catalyzed dehydration of the reduction product’s acetyl group, a new derivative with a trans-ethylidene
fragment in the E cycle was obtained, its structure was established on the basis of two-dimensional NMR tech-
niques (1H-1H COSY, 1H-1H NOESY, 1H-13С HSQC, 1H-13С HMBC).
Keywords: betulin, allobetulin, ursane type triterpenoids
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 6 2021