ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 7, с. 907-928
ОБЗОРНАЯ СТАТЬЯ
УДК 547.024, 547-302
РАДИКАЛЬНАЯ ФУНКЦИОНАЛИЗАЦИЯ
гем-ДИФТОРАЛКЕНОВ
© 2021 г. М. О. Зубков, М. Д. Кособоков, А. Д. Дильман*
ФГБУН Институт органической химии им. Н.Д. Зелинского Российской академии наук,
Россия, 119991 Москва, Ленинский просп., 47
*e-mail: dilman@ioc.ac.ru
Поступила в редакцию 22.03.2021 г.
После доработки 28.03.2021 г.
Принята к публикации 29.03.2021 г.
гем-Дифторалкены - легкодоступные строительные блоки для получения широкого спектра фтороргани-
ческих соединений. В обзоре обобщены данные о радикальных реакциях с участием гем-дифторалкенов.
Эти процессы включают стадию присоединения радикала по двойной связи или стадию одноэлектрон-
ного восстановления дифторалкенового фрагмента. Отдельный акцент сделан на фотокаталитических
реакциях, которые протекают при воздействии видимого света.
Ключевые слова: фторорганические соединения, гем-дифторалкены, радикальные реакции, фотокатализ
DOI: 10.31857/S0514749221070016
ВВЕДЕНИЕ
сы, интенсивно развившиеся за последние десять
лет, также не обошли стороной данный класс со-
Введение атомов фтора в органические моле-
единений. Однако систематического обзора ради-
кулы может радикально менять их химические,
кальных превращений гем-дифторалкенов до сих
физико-химические, а также биологические свой-
пор проведено не было. Цель настоящего обзора -
ства. Способность фторированных фрагментов
обобщение современных знаний о радикальных
влиять на профиль биологической активности со-
методах функционализации гем-дифторалкенов.
единений сделала их незаменимым инструментом
Особое внимание уделено применению для этих
для дизайна потенциальных лекарственных препа-
целей фотокаталитических методов.
ратов [1-3] и агрохимикатов [4]. В то же время из-
за уникальной реакционной способности фторор-
РЕАКЦИИ, ПРОТЕКАЮЩИЕ
В ТЕРМИЧЕСКИХ УСЛОВИЯХ
ганических соединений введение фторированных
фрагментов зачастую - нетривиальная задача [5].
Исторически первым радикальным превра-
щением гем-дифторалкенов было присоедине-
гем-Дифторалкены - доступные соединения,
ние к ним тиолов, описанное в 1981 г. (схема 1)
получающиеся при помощи реакций олефини-
[14]. Реакция протекает при нагревании алкена 1 с
рования карбонильной группы [6, 7]. Известно
тиолом 2 в присутствии бензоилпероксида (BPO)
много примеров фторзамещенных алкенов, про-
в качестве радикального инициатора. При этом
являющих биологическую активность [8-11]. В то
тиолированию подвергаются в том числе алифати-
же время гем-дифторалкены представляют собой
ческие гем-дифторалкены.
удобный класс строительных блоков для синтеза
фторорганических соединений самой разнообраз-
В той же работе была предпринята попытка
ной структуры [6, 12, 13]. Радикальные процес-
распространения данного подхода на соединения,
907
908
ЗУБКОВ и др.
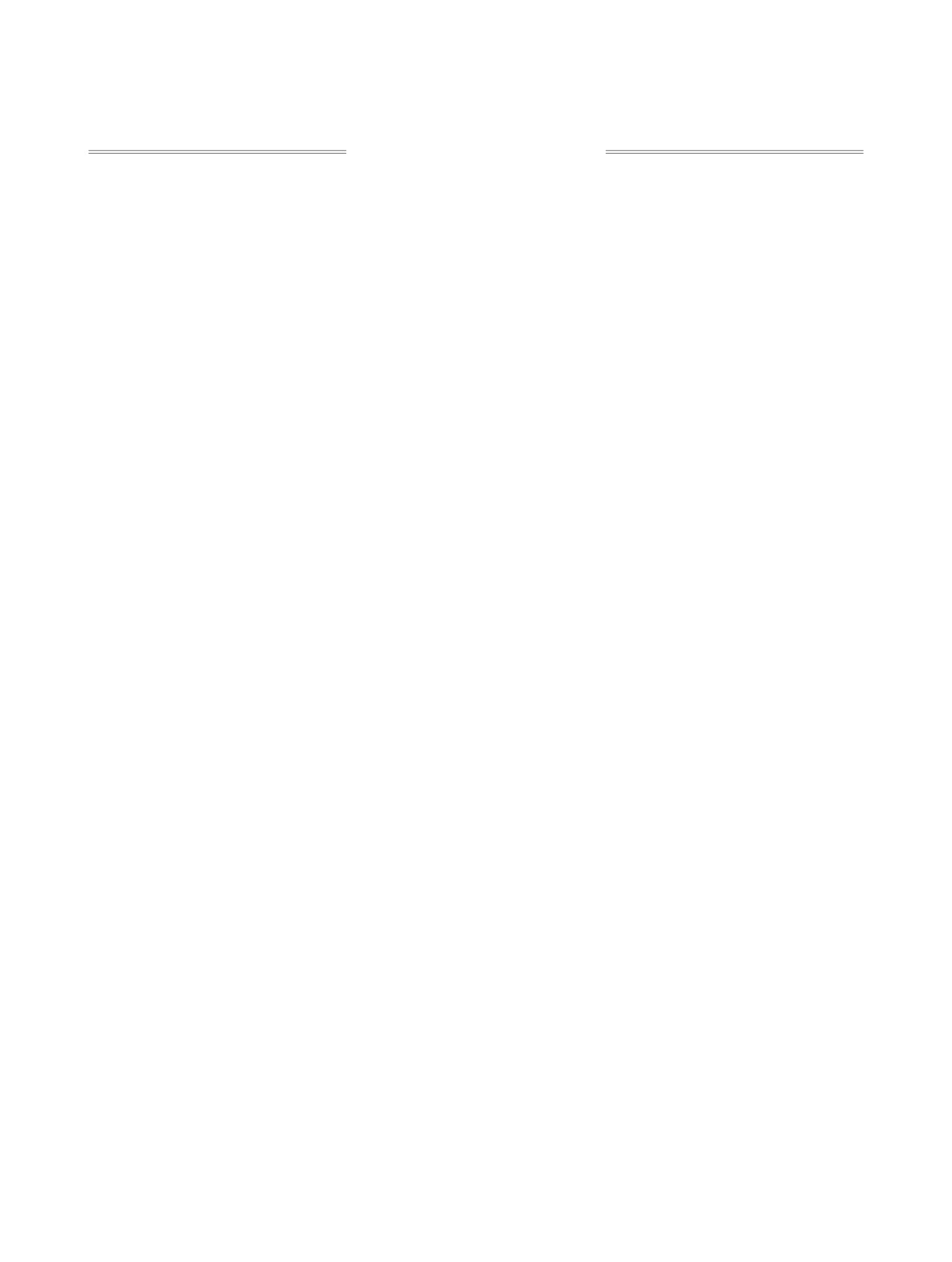
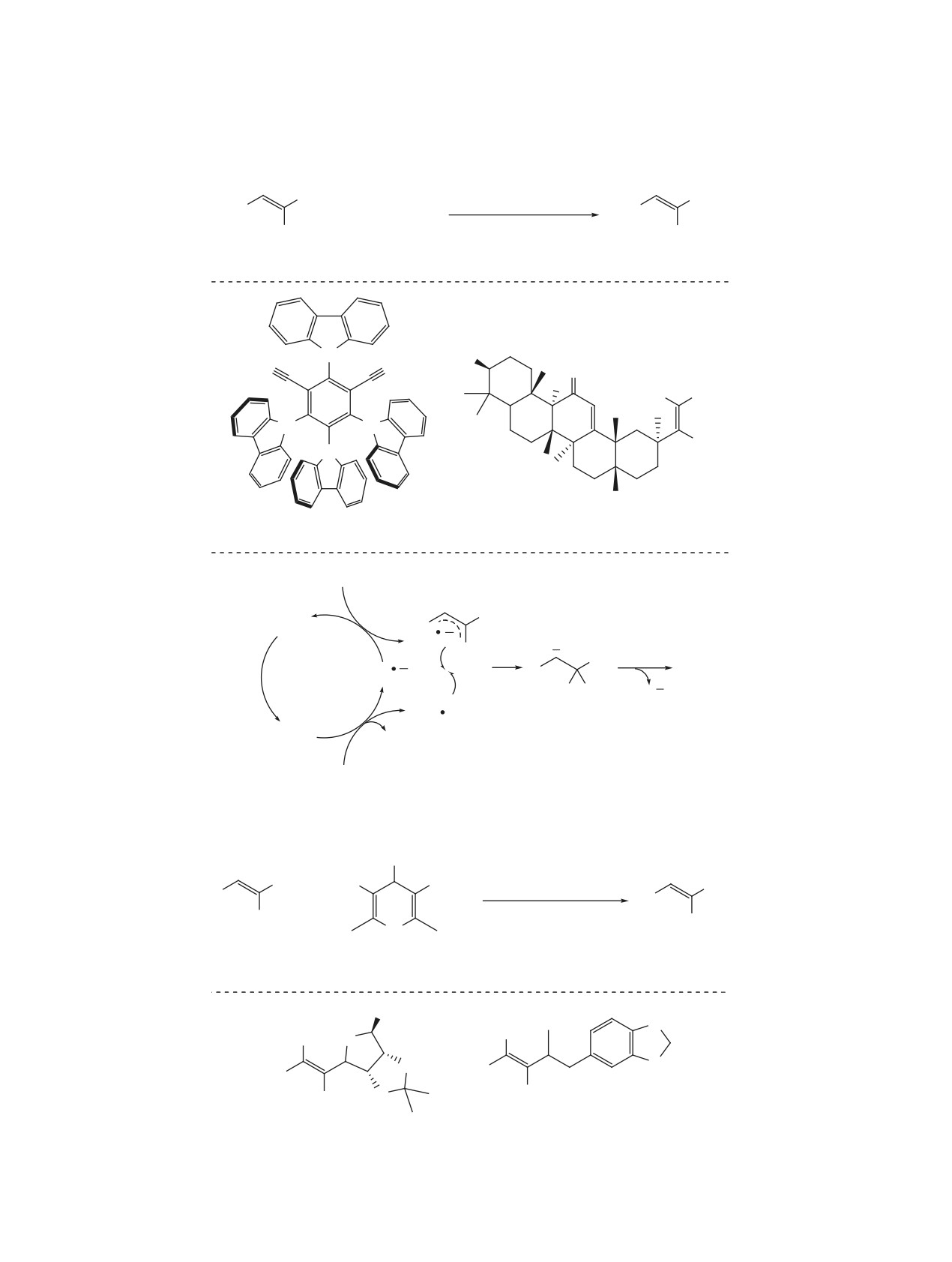
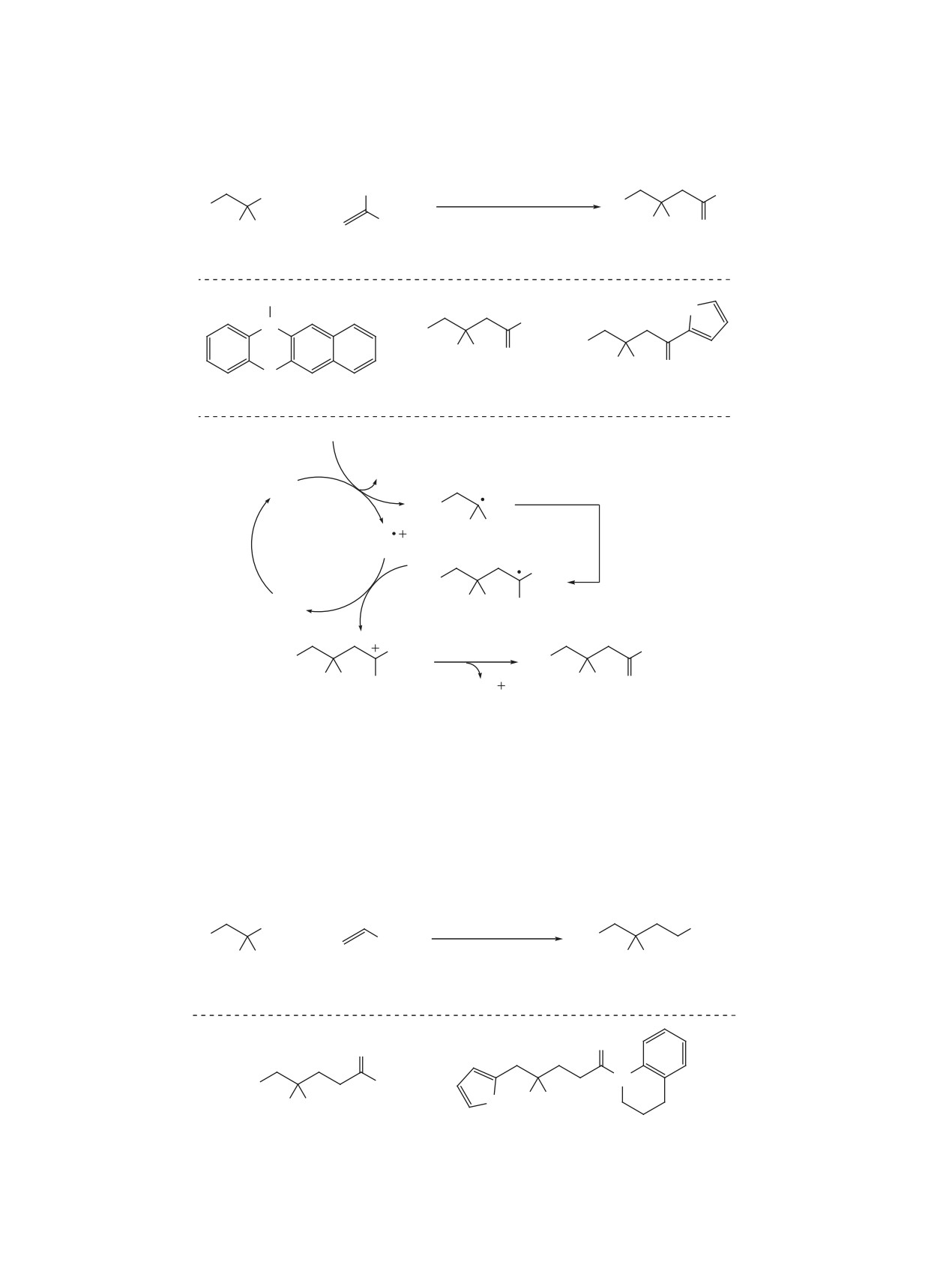
Схема 1
F
кат. BPO
SR
R
R
+ RSH
ТГФ, ∆
F F
F
1
2
3, 58-78%
O
S
S
O
F F
F F
Cl
3a, 69%
3b, 58%
содержащие другие C-H связи с относительно не-
Его использование позволяет снизить температуру
высокой энергией диссоциации, а именно альде-
реакции до 60°С, что благотворно сказывается на
гиды. Однако низкие выходы продуктов застави-
выходах продуктов (схема 4). Кроме того, в реак-
ли искать альтернативные подходы. Позднее была
цию вступают также тиофосфиты и даже гипофос-
описана реакция присоединения альдегидов к ак-
фит натрия с образованием продуктов типа 9b и
цепторным сульфонил-замещенным гем-дифтора-
9с, соответственно [18].
лекенам, протекающая в присутствии бензоилпе-
В последние годы такая стратегия была рас-
роксида при кипячении в бензоле (схема 2) [15].
пространена и на другие слабые связи, обеспечив
подход к присоединению карбен-боранов и акти-
В аналогичных условиях в данное превращение
вированных силанов к гем-дифторалкенам. В этих
вступают и простые эфиры 6, в которых активи-
реакциях наилучшим образом себя проявили клас-
руется C-H связь, находящаяся в α-положении по
сические инициаторы азобис(карбонитрильного)
отношению к атому кислорода. Так, тетрагидро-
типа, такие как ACCN и AIBN. Так, недавно был
фуран, диоксолан и диоксан успешно реагируют с
описан подход к присоединению к гем-дифторал-
гем-дифторалкенами с образованием продуктов 7
кенам боранов 10, выступающих производными
(схема 3) [15].
N-гетероциклических карбенов (схема 5) [19, 20].
Неоднократные попытки ввести в подобное
Было показано, что в реакцию с успехом вступают
превращение диалкилфосфиты 8 посредством ак-
как гем-дифторстиролы, так и гем-дифторакрила-
тивации связи водород-фосфор показали, что оп-
ты и гем-дифторакриламиды. Важно отметить, что
тимальный радикальный инициатор в данном слу-
для осуществления присоединения необходимо
чае - трет-бутил пероксопивалат (TBPP) [16, 17].
присутствие в реакции не только инициатора, но и
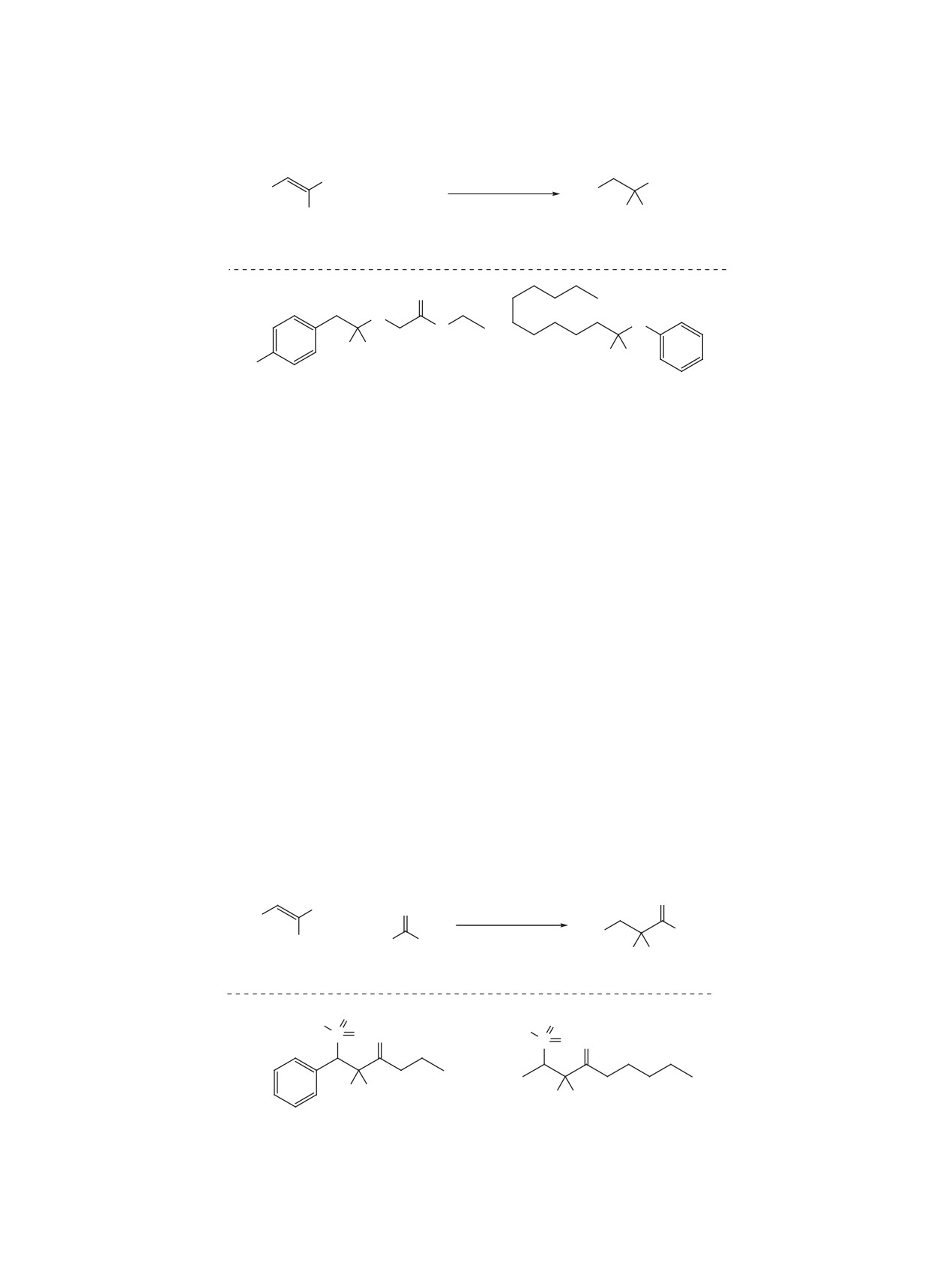
Схема 2
O
F
O
кат. BPO
R
+
6-15 ч
R
R'
F
H R'
бензол, ∆
F F
1
4
5, 53-93%
O
Ph
O
Ph
S
O
O
S
O O
F F
F F
5a, 71%
5b, 79%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
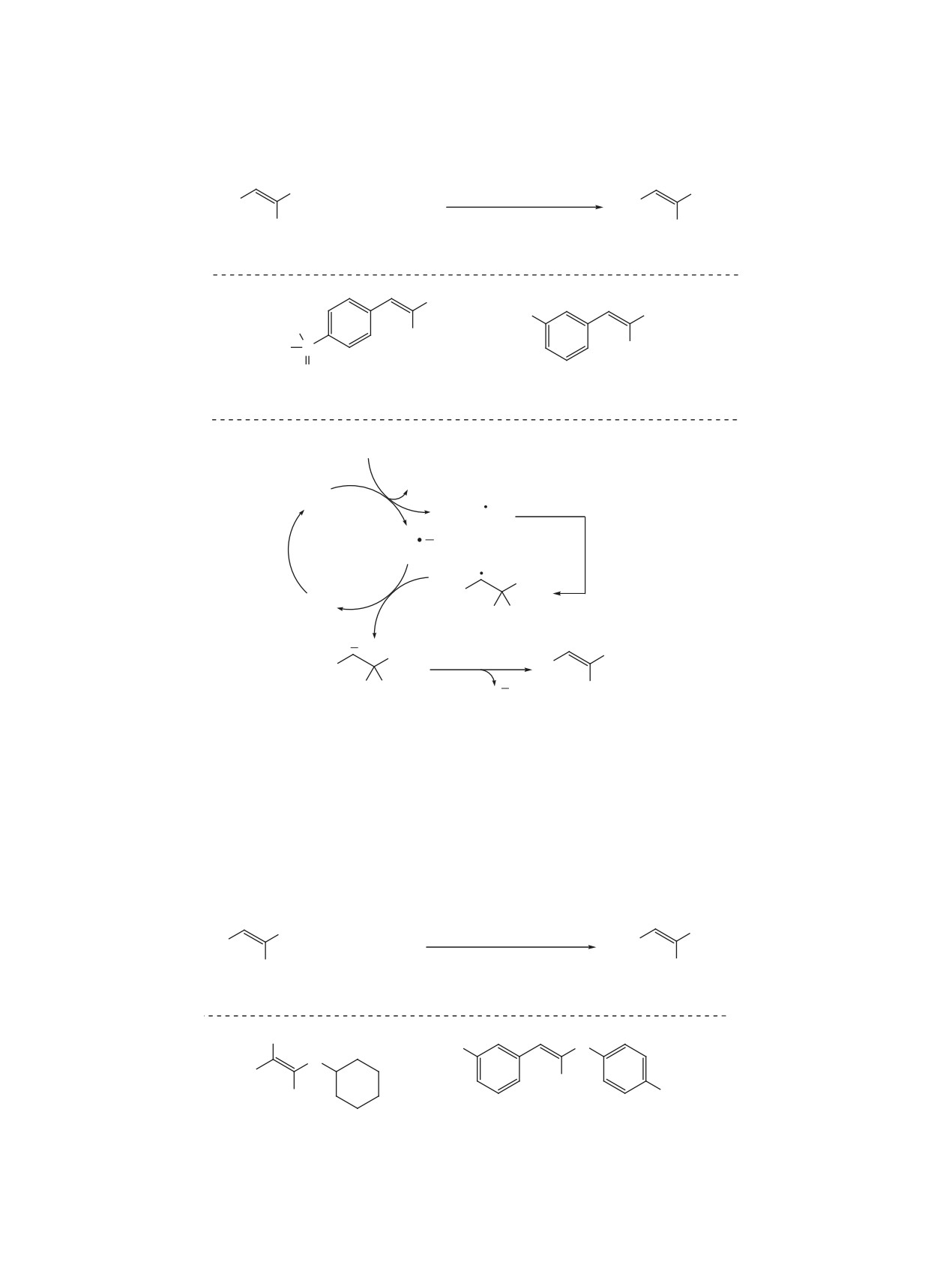
Р
АДИКАЛЬНАЯ ФУНКЦИОНАЛИЗАЦИЯ гем-ДИФТОРАЛКЕНОВ
909
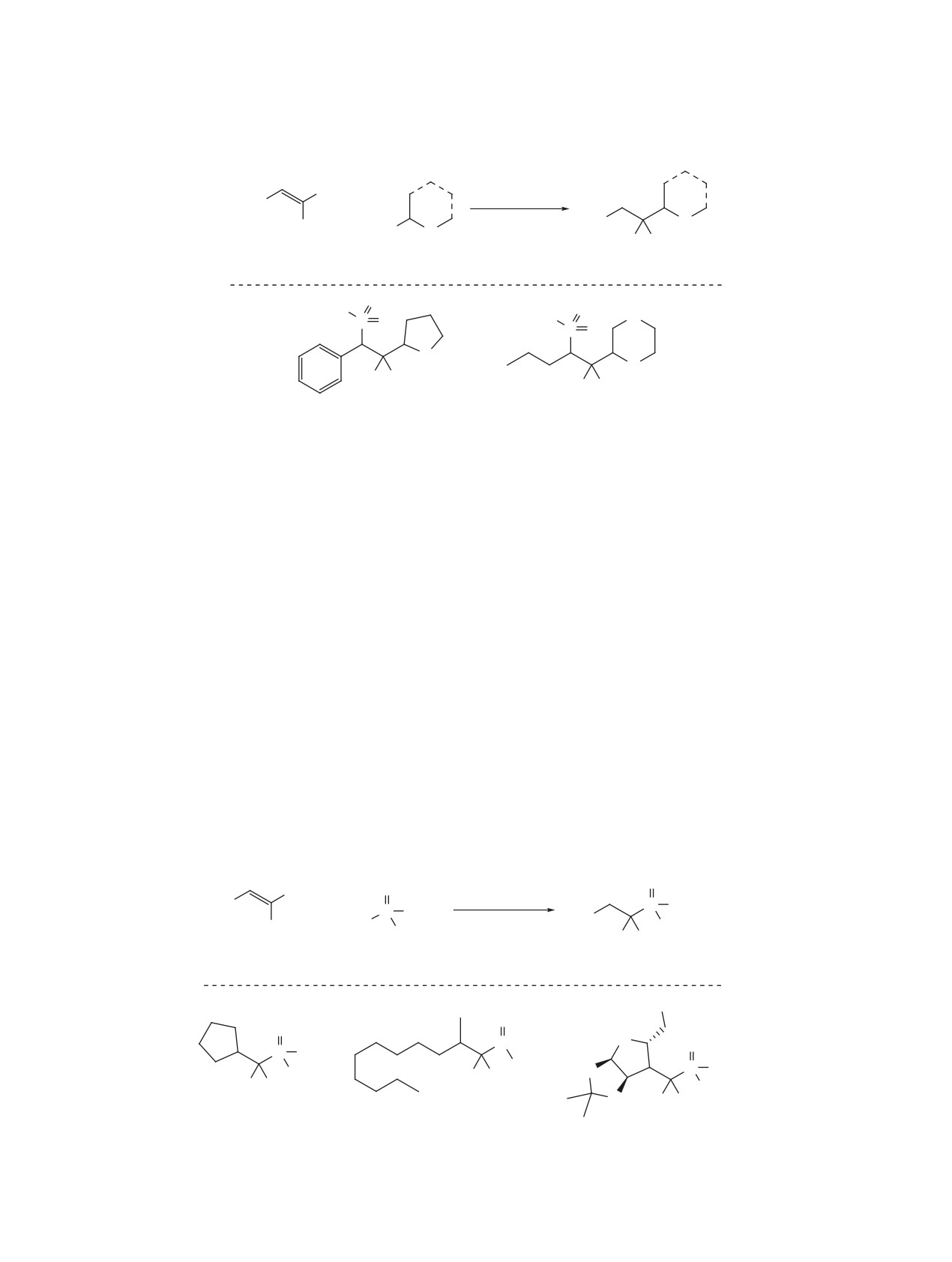
Схема 3
F
кат. BPO
R
+
1-11 ч
R
O
F
H
O
бензол, ∆
F F
1
6
7, 40-92%
O
Ph
O
S
O
Ph
O
S
O
O
O
F F
F F
7a, 88%, dr 3:1
7b, 63%, dr 5:4
каталитического количества тиола, выступающего
ролам и последующее восстановление приводит
в роли катализатора переноса атома водорода от
к элиминированию фторид-аниона и получению
борана к промежуточному алкильному радикалу.
формального продукта замещения атома фтора.
Также было показано, что в аналогичных ус-
Аналогичный процесс протекает при генера-
ловиях гем-дифторстиролы эффективно вступа-
ции радикалов из алкенов в рамках железо-ката-
ют в реакцию с трис(триметилсилил)силаном 12
лизируемого процесса переноса атома водорода
(схема 6) [20]. Данный процесс не требует тиоль-
(схема 8) [22]. В качестве стехиометрического вос-
ного катализа и приводит к образованию фториро-
становителя в данном случае выступает фенил-
ванных силанов 13 с хорошими выходами.
силан. В реакцию вступают как алифатические
алкены (продукт 17a), так и эфиры енолов (про-
Приведенные выше реакции присоединения
дукт 17b).
относятся к редокс-нейтральным цепным процес-
сам. В то же время в ряде случаев генерация ра-
Окислительная генерация радикала использу-
дикала требует наличия в системе стехиометриче-
ется в процессе аннелирования гем-дифторстиро-
ского окислителя или восстановителя. Например,
лов к арил-замещенным оксамовым кислотам 18
под действием металлического цинка алкильные
(схема 9) [23]. Реакция протекает через радикаль-
радикалы генерируются из ацилоксифталимидов
ное присоединение к гем-дифторстиролу карба-
14, получаемых напрямую из карбоновых кислот
моильного радикала, образующегося в результате
(схема 7) [21]. Их присоединение к гем-дифторсти-
декарбоксилирования исходной кислоты в присут-
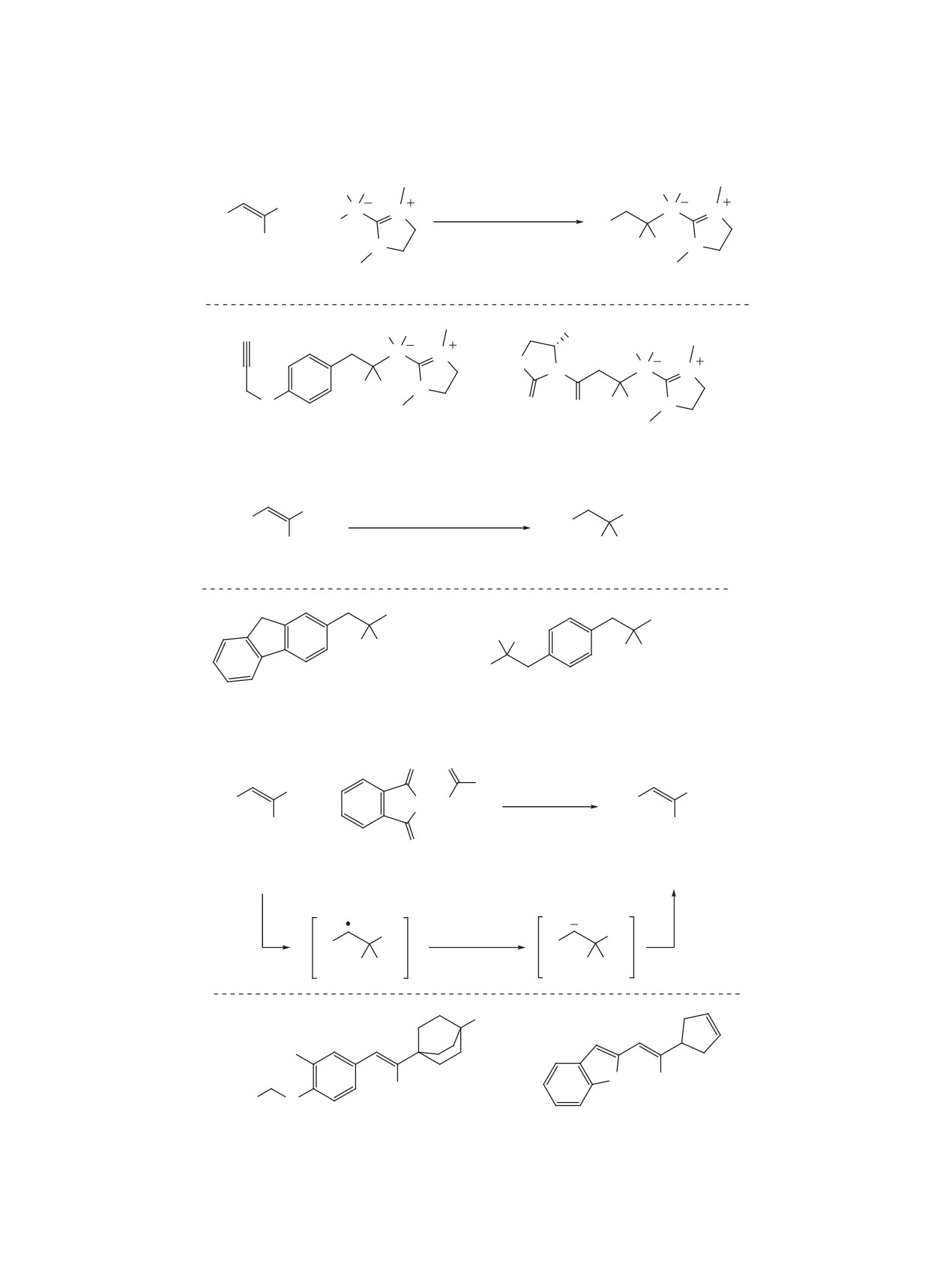
Схема 4
O
F
O
кат. TBPP
R
P
OR
+
P
OR
бензол
R
F
H
OR
OR
60°C, 20 ч
F F
1
8 (4 экв)
9, 30-95%
PivO
S
O
O
P OBn
O
P
OMe
OBn
O
P
OH
OMe
F F
F F
H
O
F F
9a, 66%
9b, 65%
9с, 78%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
910
ЗУБКОВ и др.
Схема 5
H CN
H CN
ACCN (20 мол %)
F
RSH (50 мол %)
B
N
B N
R
+
H
R
CH3CN, 95°C, 15 ч
F
N
F F
N
1
10 (1.2 экв)
11, 46-83%
H CN
Bn
H CN
B N
O
N
B
N
F F N
O
O
O
F F N
11a, 72%
11b, 79%, dr 1.1:1
Схема 6
(Me3Si)3SiH (12, 2 экв)
F
Si(SiMe3)3
AIBN (20 мол %)
R
R
F
4 ч, PhCF3, 130°C
F F
1
13, 40-95%
Si(SiMe3)3
Si(SiMe3)3
F
F
F F
F F
(Me3Si)3Si
13a, 87%
13b, 70%
Схема 7
O O
R'
F
R'
Zn (3 экв)
R
R
+
N O
24-48 ч
F
F
ДМА, 20°C
O
1
14 (3 экв)
15, 36-96%
R'
Zn
R'
R
R
F F
F F
CO2Me
Br
S
F
F
F3C O
15a, 72% (Z/E > 50:1)
15b, 77% (Z/E > 50:1)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
Р
АДИКАЛЬНАЯ ФУНКЦИОНАЛИЗАЦИЯ гем-ДИФТОРАЛКЕНОВ
911
Схема 8
Fe(dibm)3 (10 мол %)
F
PhSiH3 (6 экв)
R
+
R'
R
R'
EtOH, 60°C, 18 ч
F
F
1
16 (3 экв)
17, 20-88%
H
O O
PhSiH
3
Fe(III)
Fe(III)
F
Fe(II)
dibm
1
R'
R
R'
F F
OMe
OMe
OH
OMe
O
F
NC
F
NC
17a, 57%
17b, 78%
ствии персульфата калия и каталитических коли-
метильные группы у соседних атомов углерода
честв нитрата серебра.
(схема 10) [24]. Реакция протекает в темноте в
присутствии стехиометрического количества фто-
Другой интересный процесс, промотируемый
солями серебра, позволяет получать из гем-ди-
рида серебра. Механистически, данный процесс
фторстиролов соединения, содержащие трифтор-
протекает через присоединение фторида серебра
Схема 9
R
1 (1 экв)
O OH
F
AgNO3 (10 мол %)
K2S2O8 (2 экв)
F
N O
ацетон/H2O 1:1
N O
90°C, 9 ч
R'
R'
18 (1.5 экв)
19, 21-81%
Br
N
MeO2C
F
F
Me
F
F
F
F
N O
N O
N O
19a, 63%
19b, 57%
19c, 36%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
912
ЗУБКОВ и др.
Схема 10
CF3
AgF (3 экв)
F
MS 4Å
R
R
R
Py/ТГФ 1:1
F
80°C, 6 ч
CF3
1
20, 47-78%
CN
O
CF3
CF3
O
O
CF3
CF
3
O
NC
20a, 67%, dr 51:49
21, 45% (Z/E = 1:0.9)
Схема 11
F
Ar
CF3
Ar
AgF (3 экв)
R
+
NMP, 80°C, 48 ч
F
Ar
R
Ar
1
22 (3 экв)
23, 21-83%
CF3
Ph
CF3
Ph
Ph
Ph
O
I
23a, 60%
23b, 47%
к двойной связи гем-дифторстирола с последую-
(схема 11) [25]. Реакция протекает при нагревании
щим термически-индуцируемым гомолизом связи
в N-метилпирролидоне в течение 48 ч. В данном
углерод-серебро. Образовавшиеся радикалы могут
случае фторид серебра также выполняет функцию
эффективно димеризоваться с образованием про-
окисления промежуточного интермедиата до целе-
дуктов 20. В случае акцепторного циано-замещен-
вого продукта.
ного гем-дифторстирола наблюдается образование
Помимо этого, данный процесс обеспечива-
неожиданного дегидрированного продукта 21.
ет удобный подход к синтезу β-CF3-замещенных
В случае перехвата образующегося ради-
кетонов [25]. Так, присоединение генерируемого
кала 1,2-диарилэтеном 22 образуется алкен
23
радикала к α-метоксистиролам 24 с последующим
Схема 12
OMe
CF3
O
F
AgF (3 экв)
R
+
NMP, 80°C, 48 ч
F
Ar
R
Ar
затем HCl
1
24 (3 экв)
25, 64-85%
CF3
O
CF3
O
NC
N
25a, 85%
25b, 64%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
Р
АДИКАЛЬНАЯ ФУНКЦИОНАЛИЗАЦИЯ гем-ДИФТОРАЛКЕНОВ
913
Схема 13
OTMS
O
F
F
F
Cu(OTf)2 (1.1 экв)
R
R
R
-30°C → 0°C
F
F F
O
CH3CN, 20 мин
26
27, 58-86%
Cu(II)
Cu(II)
OTMS
TMSO
F
F
26
F
R
R
R
F
F F
O
Cl
O
F
F
O
F
F
O
O
F F
F F
O
O
Cl
27a, 72%
27b, 58%
гидролизом продукта соляной кислотой приводит
медью (II) приводит к снятию силильной группы
к образованию кетонов 25 с хорошими выходами
и образованию целевого продукта. В частности,
(схема 12).
в отсутствие дополнительного нуклеофила в его
роли может выступать сам енолят, приводя к про-
Донорные силилокси-замещенные дифторалке-
дуктам формальной димеризации исходных алке-
ны 26 реагируют с нуклеофилами в присутствии
нов (соединения 27).
стехиометрических количеств трифлата меди (II)
(схема 13) [26]. Авторы объясняют наблюдаемое
В присутствии других нуклеофилов наблюда-
обращение полярности α,α-дифторсилиленолятов
ется образование продукта кросс-сочетания
28
образованием промежуточного катион-радика-
(схема 14) [26]. В частности, в качестве эффектив-
ла, реагирующего с нуклеофилами с образовани-
ных нуклеофилов могут выступать пятичленные
ем α-силилокси радикала. Окисление последнего
гетероциклы и спирты. Более того, в описанных
Схема 14
OTMS
O
NuH
F
Cu(OTf)2 (1.1-2.1 экв)
Nu
R
R
CH3CN/H2O 50:1
F
F F
0°C, 3 ч
26
28, 61-88%
O
O
O
O
O
OTf
Ar
F F
F F
F F
MeO
28a, 88%
28b, 73%
29
(NuH = фуран)
(NuH = изопропил)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
914
ЗУБКОВ и др.
Схема 15
PhSH (1.25 экв)
Ph2S2 (5 мол %)
SPh
Ph
CH2Cl2, 20°C, 2 ч
F F
hν (400 нм)
31, 98%
F
Ph
F
30
C6F5SH (1.2 экв)
32 (0.5 мол %)
SC6F5
Ph
циклогексан, 20°C, 18 ч
F F
hν (465 нм)
33, 99%
O
N
32
N
реакциях часто наблюдается образование по-
ключается в том, что относительно долгоживущее
бочного продукта сочетания катион-радикала с
триплетное возбужденное состояние молекулы ка-
трифлат-анионом 29.
тализатора проявляет более выраженные окисли-
тельные и восстановительные свойства по сравне-
РЕАКЦИИ, ПРОТЕКАЮЩИЕ
нию с ее невозбужденным состоянием [31-33]. На
ПРИ ОБЛУЧЕНИИ ВИДИМЫМ СВЕТОМ
первой стадии каталитического цикла возбужден-
Радикальная химия с давних пор неразрывно
ный фотокатализатор окисляется (окислительный
связана с реакциями, протекающими при облуче-
цикл) или восстанавливается (восстановительный
нии светом. Особый интерес представляют собой
цикл) подходящим для этого субстратом или реа-
процессы, протекающие при действии видимо-
гентом (схема 16). Затем, после протекания требу-
го света, ввиду своей безопасности и легкости в
емой реакции, происходит регенерация фотоката-
постановке эксперимента. В частности, преиму-
лизатора. В известных на сегодняшний день про-
щества этого подхода можно применить и к опи-
цессах гем-дифторалкены выступают в роли как
санным выше процессам. Так, например, в нашей
акцепторов, так и доноров электронов. На схеме
группе были развиты фотокаталитические подхо-
16 приведены структуры катализаторов на осно-
ды к присоединению тиолов к гем-дифторстиро-
ве комплексов иридия и рутения 34-39, наиболее
лам (схема 15), термический вариант которого об-
часто применяющихся для функционализации
суждался нами ранее. Вместо пероксидного ини-
гем-дифторалкенов.
циатора было предложено использовать каталити-
Одно из первых приложений фоторедокс-ка-
ческие количества соответствующего дисульфида
тализа к функционализации гем-дифторалке-
при облучении видимым светом (400 нм) [27].
нов было описано группой Хашми в 2016 г. [34].
Другой метод инициации цепной реакции состо-
Предложенный ими процесс монофторалкенили-
ит в использовании фотоактивного органического
рования диметиламино-производных 40 стал от-
основания при облучении синим светом (465 нм)
правной точкой в области фоторедокс-активации
[28].
гем-дифторстиролов (схема 17). Авторы предпо-
Одно из наиболее динамично растущих на-
ложили, что данная реакция протекает через гене-
правлений современной фотохимии
- фото-
рацию ранее неизвестного монофторалкенильного
редокс-катализ, который начал развиваться с
радикала, который образуется в результате восста-
2008-го г. [29, 30]. Суть фоторедокс-катализа за-
новления гем-дифторстирола и далее рекомбини-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
Р
АДИКАЛЬНАЯ ФУНКЦИОНАЛИЗАЦИЯ гем-ДИФТОРАЛКЕНОВ
915
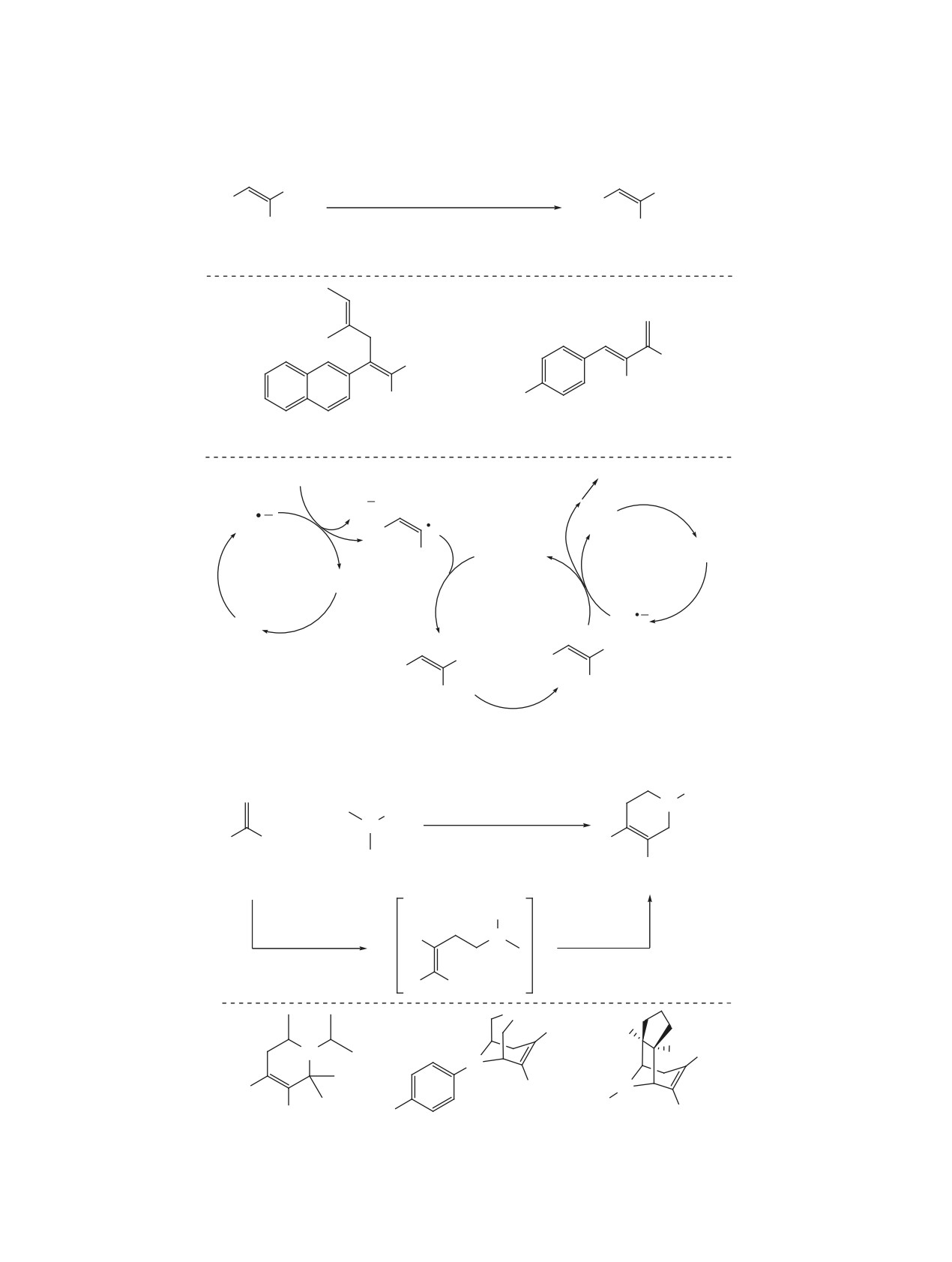
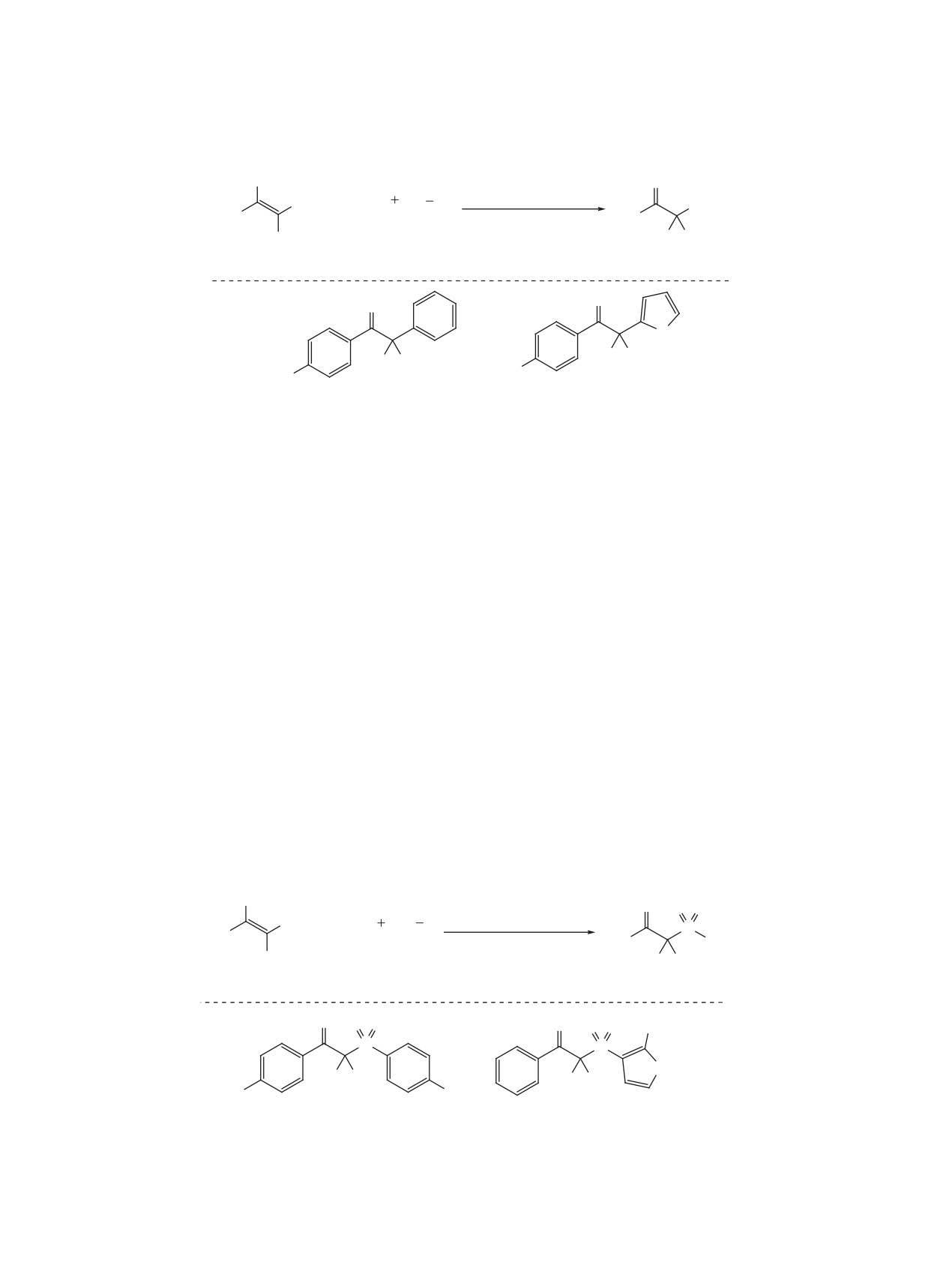
Схема 16
а. Окислительный цикл
б. Восстановительный цикл
hν
D
hν
A
кат*
кат*
D
A
кат
кат
кат
кат
A
D
A
D
в. Катализаторы
2+
2Cl
N
N
N
N
N
Ir
Ru
N
N
N
N
34
35
R3
R2
PF6
R1
R2
R3
R4
R5
R4
5
R
36
F
F
CF3
H t-Bu
N
N
R1
37
F F CF3
CF3
H
Ir
R1
N
38
CH3
H
CH3
H t-Bu
N
R5
39
H H H H t-Bu
2
R4
R
R3
рует со стабилизированным α-амино-замещенным
продуктам 43 (схема 18) [35]. Данное превраще-
радикалом. Таким образом, механизм данной ре-
ние также протекает в рамках восстановительного
акции реализуется по типу восстановительного
фоторедокс-цикла, в котором роль восстановителя
цикла. Эта гипотеза была подтверждена данными
выполняет карбоксилат-анион.
циклической вольтамперометрии, а также DFT-
При использовании хинуклидина в качестве ка-
расчетом энергетического профиля реакции.
тализатора переноса атома водорода в данную ре-
акцию удалось вовлечь в том числе соединения с
Впоследствии данная методология была силь-
активированными С-Н связями, такие как амиды,
но развита путем варьирования типа радикалов,
эфиры и алканы (схема 19) [36].
сочетающихся с монофторалкенильным фрагмен-
том, и способа их генерации. Так, α-аминокисло-
Важный аспект таких радикал-радикальных
ты в результате декарбоксилирования генерируют
сочетаний - относительно большое время жизни
схожие α-амино радикалы, что в итоге приводит к
радикальных частиц, которые в итоге вступают в
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
916
ЗУБКОВ и др.
Схема 17
36 (1 мол %)
F
Na2CO3 (1.5 экв)
R
+
N
R
N
ДМФА, 20°C, 3-36 ч
F
hν (465 нм)
F
Ar
Ar
1
40 (1.5 экв)
41, 43-99%
Ph
Ph
N N
O
F
Ph
O
O
O
Ph
N
HN
F
O
S
41a, 73%
41b, 52%
1
36
F
F
F
R
R
F
36
hν
41
N
N
36*
Ar
H
Ar
40
сочетание с нестабильным монофторалкенильным
кислоты успешно реагируют с гем-дифторстиро-
радикалом. Это справедливо в отношении всех
лами (схема 21) [39]. Несмотря на сходство с ре-
обсужденных выше процессов и объясняется так
акциями аминокислот (схема 18), авторы справед-
называемым персистентным эффектом [37]. Эти
ливо полагают, что в данном случае в качестве ста-
соображения позволяют провести реакцию трех-
билизированного радикала может выступать ани-
компонентного сочетания гем-дифторстиролов,
он-радикал гем-дифторстирола. Дополнительная
донорных алкенов и трифторметилсульфината
стабилизация такой частицы может быть обуслов-
натрия как источника CF3-радикала (схема 20)
лена ее существованием в виде ионной пары с ка-
[38]. Образующийся в ходе реакции нестабильный
тионом цезия. Сочетание данного анион-радикала
CF3-радикал не предполагает эффективной реком-
с алкильным радикалом с последующим элимини-
бинации с другими радикалами, однако будучи
рованием фторид-аниона приводит к образованию
перехваченным виниловым эфиром или енами-
требуемого продукта 51. Важно отметить, что в
дом, образует требуемый персистентный радикал,
данном случае, в качестве фоторедокс-катализато-
вступающий в сочетание с монофторалкенильным
ра выступает органический краситель 50, что де-
радикалом.
монстрирует применимость органокатализаторов
в фоторедокс реакциях.
Тем не менее, нестабилизированные радикалы
также вступают в аналогичные трансформации.
Еще один подход к алкилированию гем-диф-
Например, неактивированные алкилкарбоновые
торстиролов - использование в качестве источни-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
Р
АДИКАЛЬНАЯ ФУНКЦИОНАЛИЗАЦИЯ гем-ДИФТОРАЛКЕНОВ
917
Схема 18
36
(1 мол %)
F
Li2CO3 (1.5 экв)
R
+
N
CO2H
R
N
ДМCO, 25°C, 36-72 ч
F
R'
белый свет
F
R'
1
42 (2 экв)
43, 45-96%
OH
Ph
N
Boc
Ph
NHBoc
F
MeO
F
43a, 82%
43b, 88% (Z/E = 1:1)
1
F
F
36
F
R
R
F
36
43
hν
O
N
N
36*
R'
O
CO2
Ar
42
ков алкильных радикалов дигидропиридинов 52
смотренных нами ранее фоторедокс-процессов,
(схема 22) [40]. Данные предшественники радика-
эта реакция - не редокс-нейтральна, а в качестве
лов легко получаются из альдегидов и эффективно
стехиометрического восстановителя здесь исполь-
генерируют радикалы при одноэлектронном окис-
зуется основание Хьюнига. Механизм реакции
лении.
содержит сразу два восстановительных фоторе-
докс-цикла - для восстановления гем-дифторсти-
Наконец, еще один вариант протекания таких
рола и для регенерации активной частицы Pd(0),
процессов - присоединение радикала к двойной
участвующей во внедрении молекулы диоксида
связи гем-дифторстирола с последующим вос-
углерода. Формально это приводит к тому, что
становлением образовавшейся частицы (схема 7).
гем-дифторстирол в данном процессе выступает
Такой механизм был предложен для реакции триф-
эквивалентом карбанионного синтона. Более того,
торметилирования гем-дифторстиролов с помо-
в данных условиях авторы успешно вовлекли в со-
щью трифторметилсульфината натрия (схема 23)
четание ацетофенон вместо диоксида углерода. В
[41].
этом случае дегидратация промежуточного аддук-
Тот же механизм предлагается для недавно опи-
та приводит к образованию продукта 58.
санного процесса, в котором атом фтора гем-диф-
Еще один интересный пример
- реакция
торстирола 1 формально замещается на сульфид-
α-трифторметилстиролов
59 с аминами
60
ный фрагмент (схема 24) [42].
(схема
26)
[44]. В данном процессе гем-ди-
Особого внимания заслуживает развитый груп-
фторалкен образуется в качестве интермедиата в
пой Фенга подход к функционализации гем-диф-
результате аллильного замещения одного из ато-
торстиролов, совмещающий палладиевый и фото-
мов фтора алкена 59 радикалом, образующимся
редокс-катализ (схема 25) [43]. В отличие от рас-
при окислении амина 60. Дальнейшее превра-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
918
ЗУБКОВ и др.
Схема 19
36
(1 мол %)
F
хинуклидин (20 мол %)
R'
R
+
R' H
R
K3PO4 (1 экв)
F
CH3CN/H2O, 10:1
1
44 (1.5 экв)
20°C, hν (465 нм)
45, 22-95%
Ph
O
Ph
Ph
Ph
N N
Ph
O
Ph
F
F
F
45a, 76%
45b, 95%
45c, 31%
1
F
36
F
R
R'
R
36
hν
F
45
NR3
R'
36*
NR3 =
NR3
N
R' H
H NR3
H
щение не отличается от процесса монофторалке-
ным бициклическим структурам (продукты 61b,
нилирования, ранее развитого группой Хашми
c). Кроме того, позднее было показано, что в ана-
(схема 17). Такой тандемный процесс двух фото-
логичное превращение вступают и аминокислоты
редокс-циклов обеспечивает доступ к нетривиаль-
[45].
Схема 20
CF3SO2Na (47, 1 экв)
X
F
36(1 мол %)
R
CF3
+
X
ДМФА, 20°C
R
F
48 ч, hν (465 нм)
F
1 (6 экв)
46 (3 экв)
48, 28-85%
X = OR, NR2.
OPh
O
Ph N
O
CF
3
CF3
Ph
F
O
F
48a, 80%
48b, 74% (Z/E = 68:32)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
Р
АДИКАЛЬНАЯ ФУНКЦИОНАЛИЗАЦИЯ гем-ДИФТОРАЛКЕНОВ
919
Схема 21
50 (4 мол %)
F
Cs2CO3 (6 экв)
R'
R
R
+ R' CO2H
ДМФА, 25°C, 24 ч
F
F
белый свет
1 (4 экв)
49
51, 30-90%
N
HO
N
N
O
H
Ph
Ph
N
N
F
N
50
51a, 66%
1
F
50
R
F
R'
51
50
R
hν
F F
F
R'
50*
CO2
49
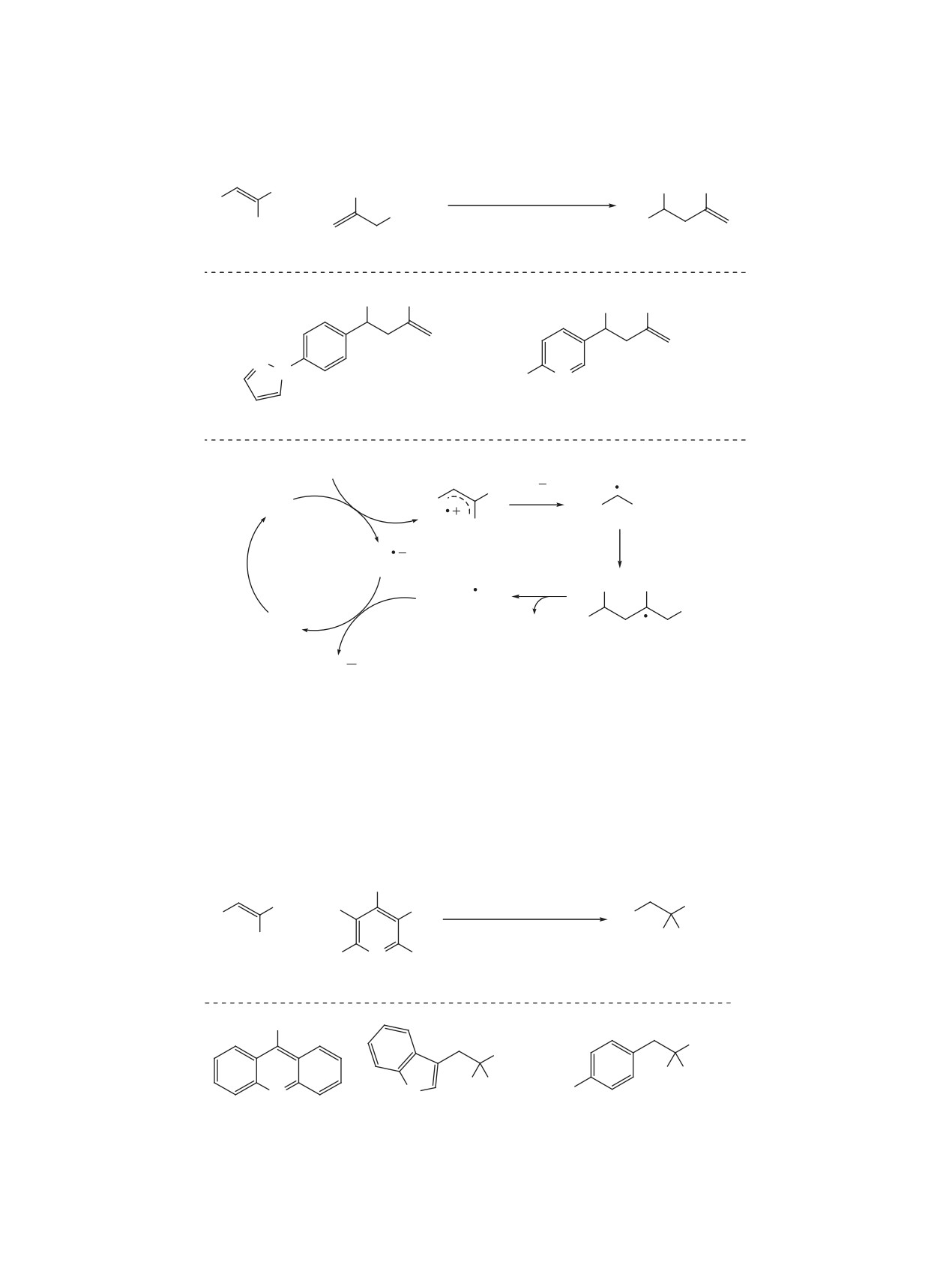
Схема 22
R'
F
EtO
CO2Et
2C
34
(1.5 мол %)
R'
R
R
+
ДМСО, 25°C, 24 ч
F
F
hν (465 нм)
N
H
1
52 (2 экв)
53, 26-92%
OMe
O
Ph
Ph O
O
O
Ph
Ph
O
F
F
53a, 79%
53b, 63%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
920
ЗУБКОВ и др.
Схема 23
37 (3 мол %)
F
LiClO4 (6 экв)
CF3
R
R
+
CF3SO2Na
ацетон, 25°C, 36 ч
F
F
hν (465 нм)
1
47 (2 экв)
54, 47-53%
CF3
NC
CF3
EtO
F
EtO
P
F
O
54a, 51% (Z/E = 96:4)
54b, 47% (Z/E = 99:1)
47
SO2
37*
1
CF3
37
hν
CF3
R
37
F F
CF3
CF3
R
R
F F
F
F
54
Все вышеописанные фоторедокс трансформа-
процесс генерации трифторметил-замещенных
ции гем-дифторалкенов протекали с замещением
бензильных радикалов, протекающий через пря-
одного из атомов фтора. Несмотря на многочислен-
мое окисление гем-дифторстирола (схема 27) [46].
ность таких реакций, имеются примеры превра-
Образующиеся радикалы аналогичны по структу-
щений, протекающих без элиминирования атомов
ре тем, что генерируются в присутствии фторида
фтора. Так, группой Фенга был описан элегантный
серебра (схема 10), однако этот метод выгодно
Схема 24
36 (1 мол %)
F
K2CO3 (2 экв)
SR'
R
R
+ R'SH
CH3CN, 25°C, 18-72 ч
F
F
hν (465 нм)
1
55 (2 экв)
56, 38-95%
Ph
MeO
S
S
Ph
F
F
OMe
56a, 85%
56b, 70% (Z/E = 8:92)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
Р
АДИКАЛЬНАЯ ФУНКЦИОНАЛИЗАЦИЯ гем-ДИФТОРАЛКЕНОВ
921
Схема 25
CO2 (1 атм),36
(1 мол %)
F
PdCl2 (5 мол %), PPh3 (20 мол %)
CO2Me
R
R
Cs2CO3 (3 экв),
i -Pr2NEt (3 экв)
F
F
ДМА, 25°C, 24 ч, hν (465 нм)
1
57, 35-96%
затем TMSCHN
2
CO2Me
Ph
F
F
Ph
57a, 71% (Z/E = 66:34)
58b, 60% (Z/E = 67:33)
57
1
hν
F
36
36
R
PdL2
36*
F
NR3
36
NR3
36*
36
hν
CO2PdL
PdL
R
R
F
F
CO
2
Схема 26
38 (2 мол %)
R'
Li2CO3 (2 экв)
N
R'
+
N
R CF3
ДМСО, 25°C, 24-60 ч
R
hν (465 нм)
F
59
60 (1 экв)
61, 42-78%
R'
R
N
F
F
O
Ph
H
N
H Ph
N
Ph
F
N
Ph
F
Br
F
61a, 62%
61b, 75%
61с, 69%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
922
ЗУБКОВ и др.
Схема 27
37 (0.2 мол %)
F
R'
Et3N∙3HF (2 экв)
CF3
R'
R
+
SO2Ph
CH3CN, 25°C, 24-96 ч
F
R
hν (465 нм)
1
62 (3 экв)
63, 27-85%
CF3
CO2Et
CF3
CO2Et
N
N
MeO
N
63a, 60%
63b, 62%
1
F
F
R
37*
R CF3
F
62
37
hν
CF3
R'
PhSO2
SO2Ph
37
R
63
PhSO2
отличается использованием недорогого и доступ-
несмотря на малую загрузку катализатора и нали-
ного источника фторид-аниона - аддукта фторо-
чие в продукте терминальной кратной связи, в ре-
водорода с триэтиламином. Радикал генерируется
акции наблюдаются приемлемые выходы.
путем атаки фторид-аниона по катион-радикалу
Недавно в нашей группе был развит подход к
гем-дифторстирола, а затем вводится в реакцию
активации гем-дифторстиролов, позволяющий
аллильного замещения. Стоит также отметить, что
вводить в органические соединения CF2-фрагмент.
Схема 28
SH
F
65 (0.5 мол %)
SPyf
F
F
R
+
R
циклогексан, 25°C
F F
F
18 ч, hν (465 нм)
F
N
F
1
64 (1.1 экв)
66, 10-95%
Ph
SPyf
SPyf
F F
F F
pinB
N
TsN
65
66a, 93%
66b, 73%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
Р
АДИКАЛЬНАЯ ФУНКЦИОНАЛИЗАЦИЯ гем-ДИФТОРАЛКЕНОВ
923
Схема 29
68 (5 мол %)
OTMS
Zn(OAc)2 (0.6 экв)
R'
SPyf
R
+
R
PPh3 (0.2 экв)
R'
F F
F F O
ДМФА, 25°C
66
67 (1.3 экв)
12 ч, hν (465 нм)
69, 25-88%
Ph
S
Ph
N
Ph
Ph
F F
O
F F
O
S
68
69a, 85%
69b, 58%
66
-
PyfS
37*
67
R
F F
hν
37
R'
R
37
F F OTMS
R'
R'
R
R
F F OTMS
F F O
TMS
69
Для этого был разработан метод их модификации
лизатора при облучении синим светом (схема 28)
за счет введения фоторедокс-активного сульфид-
[47].
ного фрагмента - тетрафторпиридинтио-группы
Дальнейшее восстановление сульфидов 66 в
(PyfS). Реакция алкена 1 с тетрафторпиридинтио-
условиях фоторедокс-катализа позволяет сочетать
лом 64 (PyfSH) протекает с хорошими выходами в
образующийся радикал с различными непредель-
присутствии 9-фенилакридина 65 в качестве ката-
ными субстратами. Это было продемонстриро-
Схема 30
34 (0.5 мол %)
SPyf
Py∙BH3 (5 экв)
EWG
R
+
R
EWG
Py (1.5 экв)
F F
F F
MeOH, 25°C
12 ч, hν (465 нм)
66
70 (1.2 экв)
71, 58-85%
O
O
N
Ph
Ot-Bu
S
F F
F F
71a, 70%
71b, 58%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
924
ЗУБКОВ и др.
Схема 31
66 (1.5 экв)
34 (0.25 мол %)
NR2
N
Zn(OAc)2 (1 экв)
ДМСО, 20°C, 15 ч
R
R
hν (465 нм)
F F
NR2
N
73, 41-91%
R
66 (1.5 экв)
72
NR2
34 (0.25 мол %)
HN
Zn(OAc)2 (1 экв)
AscH (1.5 экв)
R
R
KOAc (1.5 экв)
F F
ДМСО, 20°C, 4 ч
hν (465 нм)
74, 17-85%
O Ph
O
N
NH
HN
Cl
N
N
F F
F F
N
Cl
O
73a, 76%
74a, 76%
вано на примере реакций с силиленолятами 67
ввести в реакцию - нитроны и алкенилтрифторбо-
(схема 29) [47]. Реакция протекает в присутствии
раты. Реакция с алифатическим алкеном позволя-
органического фотокатализатора 68, хотя в некото-
ет провести его внедрение по связи углерод-сера
рых случаях более эффективным оказался иридие-
сульфида 66 [48].
вый комплекс 39.
Также представляет интерес реакция сульфи-
Сульфиды 66 также эффективно присоединяют-
дов 66 с гидразонами, которую возможно провести
ся к акрилатам, акриламидам и другим акцептор-
в двух направлениях (схема 31) [49]. В классиче-
ным алкенам 70 в присутствии пиридин-борана в
ских условиях образуется фторалкил-замещенный
качестве восстановителя (схема 30). Среди других
гидразон 73, однако в присутствии стехиометри-
акцепторов радикалов, которые удалось успешно
ческого количества аскорбиновой кислоты (AscH)
Схема 32
SPyf
LiI (3 экв)
I
R
R
ДМФА, 15 ч, 5°C
F F
F F
hν (455 нм)
66
75, 67-90%
I
O
I
I
F F
O
F F
F F
S
75a, 76%
74b, 76%
74c, 84%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
Р
АДИКАЛЬНАЯ ФУНКЦИОНАЛИЗАЦИЯ гем-ДИФТОРАЛКЕНОВ
925
Схема 33
OTMS
35 (0.05 мол %)
O
Cs2CO3 (3 экв)
F
Ar
+
Ar N2 BF4
R
CH3CN, 25°C, 2 ч
R
F
белый свет
F F
26
76
77, 20-90%
O
O
S
F F
F F
F
3C
MeO
77a, 76%
77b, 85%
образуется продукт восстановительного присое-
(схема 33) [51]. Предполагаемый механизм реак-
динения - гидразин 74.
ции идентичен тому, что приведен для аналогич-
ной реакции на схеме 30. Тем не менее, по мне-
Кроме того, обмен сульфидного фрагмента на
нию авторов, свой вклад в течение реакции также
иод обеспечивает доступ к CF2I-производным 75
вносит цепной процесс, в ходе которого окисление
(схема 32) [50]. Процесс протекает при облуче-
нии сульфида 66 с избытком иодида лития в N,N-
α-силилокси-замещенного радикала происходит
диметилформамиде. С учетом предварительной
под действием диазониевой соли 76.
функционализации эта двухстадийная трансфор-
Позднее другая группа исследователей описала
мация соответствует формальному присоедине-
схожий процесс, дополненный внедрением моле-
нию иодоводорода к гем-дифторстиролу, неосуще-
кулы диоксида серы, в качестве источника кото-
ствимому иными методами.
рого используется пиросульфит натрия (схема 34)
Другой подход к введению CF2-фрагмента в
[52]. Данное трехкомпонентное сочетание также
органические соединения
- функционализация
катализируется рутениевым комплексом 35.
α,α-дифторсилиленолятов в условиях фоторе-
Уже упоминавшийся источник радикала - аци-
докс-катализа. В отличие от реакций, описанных
локсифталимид 14 - также эффективен в реак-
в начале этой главы, в данных процессах исполь-
зуются источники радикалов, склонные к восста-
ции алкилирования α,α-дифторсилиленолятов
новлению, а не к окислению. Так, например, в
(схема
35)
[53]. Данное сочетание протекает
присутствии рутениевого катализатора 35 в такие
эффективно с производными первичных, вторич-
реакции успешно вступают диазониевые соли 76
ных и третичных карбоновых кислот.
Схема 34
OTMS
Na2S2O5 (2 экв)
O
O
O
35 (2 мол %)
F
Ar N2
BF4
S
R
+
CH3CN, 25°C, 12 ч
R
Ar
F
hν (465 нм)
F F
26
76
78, 37-80%
O
O
O
O
O
O
CO2Me
S
S
S
F F
F F
Cl
Cl
78a, 80%
78b, 41%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
926
ЗУБКОВ и др.
Схема 35
O O
OTES
O
R'
34 (1-0.01 мол %)
F
R'
+
N O
R
ДМФА, 60-65°C
R
F
48 ч, hν (465 нм)
F F
O
79 (3 экв)
14
80, 60-98%
NH
O
O
Ph
F F
F F
80a, 60%
80b, 81%
Схема 36
Ph
Ph
OTES
O
39 (1 мол %)
F
R'
+
N
BF4
R
ДМА/ДМЭ 1:3
R
R'
50°C, 36 ч
F
F F
Ph
hν (465 нм)
79 (2 экв)
81
82, 41-94%
O
CO2Me
O
S
N
F F
F F
82a, 67%
82b, 65%
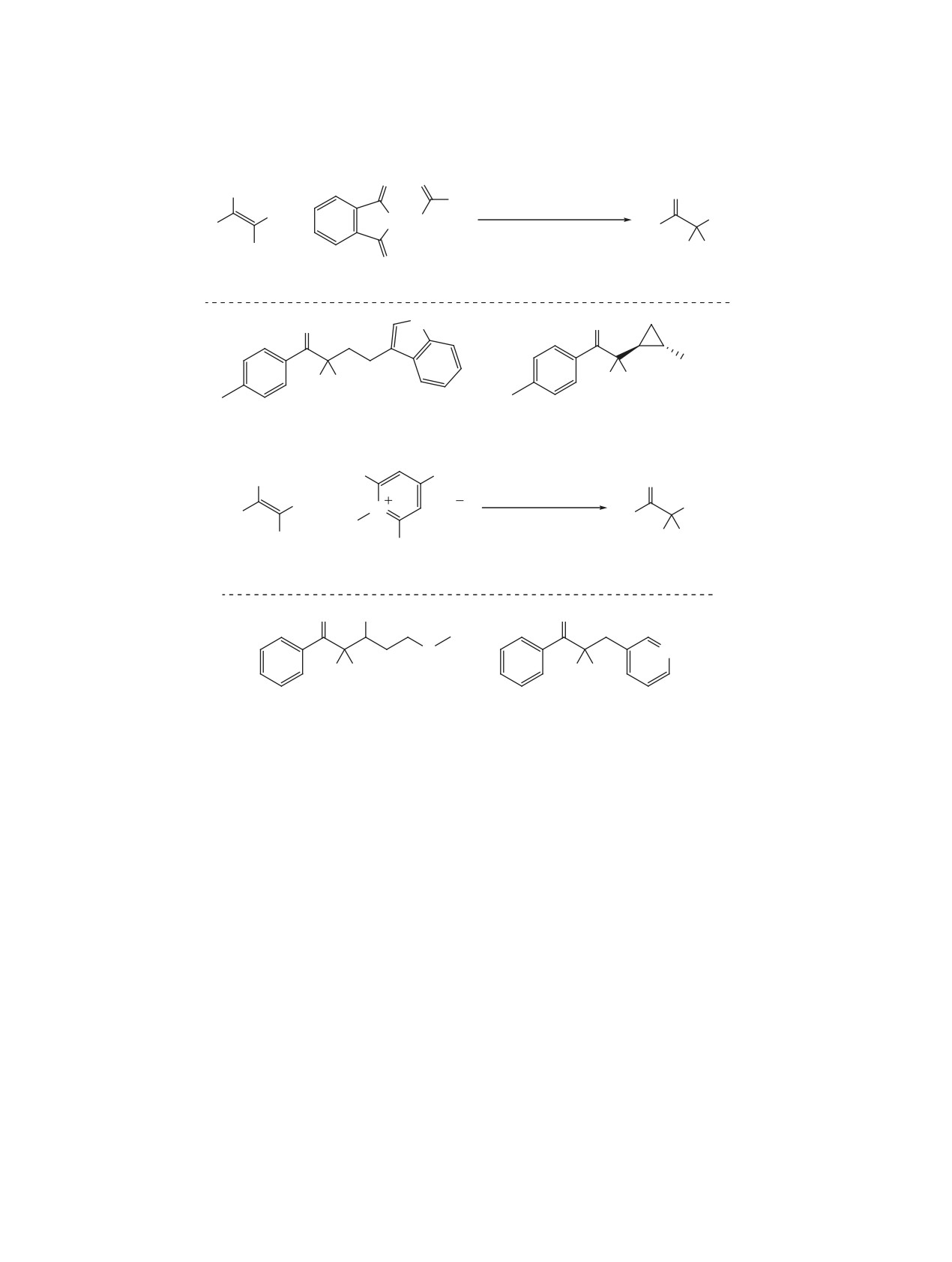
Одновременно с этим был разработан метод
кальных процессов, многие превращения гем-диф-
алкилирования α,α-дифторсилиленолятов 79 с по-
торалкенов проявляют удивительную толерант-
мощью алкилпиридиниевых солей Катрицкого 81,
ность к различным функциональным группам. Тем
получаемых из алифатических аминов (схема 36)
не менее, радикальная химия гем-дифторалкенов
[53, 54]. Данный метод, например, позволяет по-
сильно отличается от химии их нефторированных
лучать фторированные производные природных
аналогов. В особенности это касается окислитель-
аминокислот (продукт 82a). Тем не менее, серьез-
но-восстановительных процессов, большая часть
ное ограничение - невозможность ввести в пре-
из которых реализуется в условиях фотокатализа.
вращение третичные алкильные радикалы ввиду
Также нельзя не отметить, что многие процессы
недоступности соответствующих алкилпиридини-
протекают только с гем-дифторстиролами, в то
евых солей 81.
время как неактивированные гем-дифторалкены
во многих случаях неактивны. Мы полагаем, что
ВЫВОДЫ
богатая реакционная способность гем-дифторал-
гем-Дифторалкены - удобные субстраты для
кенов сделает возможным разработку множества
функционализации самых разнообразных орга-
новых методов получения фторорганических сое-
нических соединений, в том числе обладающих
динений.
биологической активностью. гем-Дифторалкены
ФОНДОВАЯ ПОДДЕРЖКА
могут выступать в качестве синтетических экви-
валентов различных синтонов, содержащих один,
Работа выполнена при финансовой поддержке
два или три атома фтора. Как и большинство ради-
Российского научного фонда (грант№ 19-73-00088).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
Р
АДИКАЛЬНАЯ ФУНКЦИОНАЛИЗАЦИЯ гем-ДИФТОРАЛКЕНОВ
927
КОНФЛИКТ ИНТЕРЕСОВ
19.
Jin J.-K., Zheng W.-X., Xia H.-M., Zhang F.-L.,
Wang Y.-F. Org. Lett. 2019, 21, 8414-8418. doi
Авторы заявляют об отсутствии конфликта ин-
10.1021/acs.orglett.9b03173
тересов.
20.
Liu X., Lin E.E., Chen G., Li J.-L., Liu P., Wang H.
СПИСОК ЛИТЕРАТУРЫ
Org. Lett.
2019,
21,
8454-8458. doi
10.1021/
1.
Meanwell N.A. J. Med. Chem. 2018, 61, 5822-5880.
acs.orglett.9b03218
doi 10.1021/acs.jmedchem.7b01788
21.
Yu L., Tang M.-L., Si C.-M., Meng Z., Liang Y.,
2.
Inoue M., Sumii Y., Shibata N. ACS Omega. 2020, 5,
Han J., Sun X. Org. Lett. 2018, 20, 4579-4583. doi
10633-10640. doi 10.1021/acsomega.0c00830
10.1021/acs.orglett.8b01866
3.
Johnson B.M., Shu Y.-Z., Zhuo X., Meanwell N.A.
22.
Yang L., Ji W.-W., Lin E., Li J.-L., Fan W.-X., Li Q.,
J. Med. Chem. 2020, 63, 6315-6386. doi 10.1021/
Wang H. Org. Lett. 2018, 20, 1924-1927. doi 10.1021/
acs.jmedchem.9b01877
acs.orglett.8b00471
4.
Ogawa Y., Tokunaga E., Kobayashi O., Hirai K.,
23.
Chen G., Li C., Peng J., Yuan Z., Liu P., Liu X. Org.
Shibata N. iScience. 2020, 23, 101467. doi 10.1016/
Biomol. Chem. 2019, 17, 8527-8532. doi 10.1039/
j.isci.2020.101467
c9ob01236b
5.
Ni C., Hu J. Chem. Soc. Rev. 2016, 45, 5441-5454. doi
24.
Gao B., Zhao Y., Ni C., Hu J. Org. Lett. 2014, 16, 102-
10.1039/c6cs00351f
105. doi 10.1021/ol403083e
6.
Zhang X., Cao S. Tetrahedron Lett. 2017, 58, 375-392.
25.
Gao B., Zhao Y., Hu J. Angew. Chem. Int. Ed. 2015, 54,
doi 10.1016/j.tetlet.2016.12.054
638-642. doi 10.1002/anie.201409705
7.
Chelucci G. Chem. Rev. 2012, 112, 1344-1462. doi
26.
Uneyama K., Tanaka H., Kobayashi S., Shioyama M.,
10.1021/cr200165q
Amii H. Org. Lett. 2004, 6, 2733-2736. doi 10.1021/
8.
Pan Y., Qiu J., Silverman R.B. J. Med. Chem. 2003, 46,
ol049055m
5292-5293. doi 10.1021/jm034162s
27.
Ashirbaev S.S., Levin V.V., Struchkova M.I., Dil-
9.
Juncosa J.I., Takaya K., Le H.V., Moschitto M.J.,
man A.D. Fluorine Notes. 2017, 115, 6. doi 10.17677/
Weerawarna P.M., Mascarenhas R., Liu D., Dewey S.L.,
fn20714807.2017.06.01
Silverman R.B. J. Am. Chem. Soc. 2018, 140, 2151-
2164. doi 10.1021/jacs.7b10965
28.
Levin V.V., Dilman A.D. J. Org. Chem. 2019, 84,
10.
Asahina Y., Iwase K., Iinuma F., Hosaka M., Ishiza-
8337-8343. doi 10.1021/acs.joc.9b01331
ki T. J. Med. Chem. 2005, 48, 3194-3202. doi
29.
Nicewicz D.A., MacMillan D.W.C. Science. 2008, 322,
10.1021/jm0402061
77-80. doi 10.1126/science.1161976
11.
Song Y., Clizbe L., Bhakta C., Teng W., Li W.,
30.
Ischay M.A., Anzovino M.E., Du J., Yoon T.P. J. Am.
Wong P., Huang B., Sinha U., Park G., Reed A., Scar-
Chem. Soc. 2008, 130, 12886-12887. doi 10.1021/
borough R.M., Zhu B.-Y. Bioorg. Med. Chem. Lett.
ja805387f
2002, 12, 2043-2046. doi S0960-894X(02)00304-9
31.
Shaw M.H., Twilton J., MacMillan D.W.C. J. Org.
12.
Koley S., Altman R.A. Isr. J. Chem. 2020, 60, 313-
Chem.
2016,
81,
6898-6926. doi
10.1021/
339. doi 10.1002/ijch.201900173
acs.joc.6b01449
13.
Liu C., Zeng H., Zhu C., Jiang H. Chem. Commun.
32.
Tucker J.W., Stephenson C.R.J. J. Org. Chem. 2012,
2020, 56, 10442-10452. doi 10.1039/d0cc04318d
77, 1617-1622. doi 10.1021/jo202538x
14.
Suda M. Tetrahedron Lett. 1981, 22, 2395-2396. doi
33.
Prier C.K., Rankic D.A., MacMillan D.W.C. Chem.
10.1016/S0040-4039(01)82917-8
Rev. 2013, 113, 5322-5363. doi 10.1021/cr300503r
15.
Jeong I.H., Jeon S.L., Kim B.T. Synth. Commun. 2000,
30, 4309-4316. doi 10.1080/00397910008087053
34.
Xie J., Yu J., Rudolph M., Rominger F., Hashmi A.S.K.
Angew. Chem. Int. Ed. 2016, 55, 9416-9421. doi
16.
Herpin T.F., Houlton J.S., Motherwell W.B., Ro-
10.1002/anie.201602347
berts B.P., Weibel J.-M. Chem. Commun. 1996, 613-
614. doi 10.1039/cc9960000613
35.
Li J., Lefebvre Q., Yang H., Zhao Y., Fu H. Chem.
17.
Piettre S.R. Tetrahedron Lett. 1996, 37, 2233-2236.
Commun.
2017,
53,
10299-10302. doi
10.1039/
doi 10.1016/0040-4039(96)00239-0
c7cc05758j
18.
Gautier A., Garipova G., Salcedo C., Balieu S.b., Piett-
36.
Tian H., Xia Q., Wang Q., Dong J., Liu Y., Wang Q.
re S.R. Angew. Chem. Int. Ed. 2004, 43, 5963-5967.
Org. Lett.
2019,
21,
4585-4589. doi
10.1021/
doi 10.1002/anie.200460519
acs.orglett.9b01491
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
928
ЗУБКОВ и др.
37. Leifert D., Studer A. Angew. Chem. Int. Ed. 2020, 59,
46. Liu H., Ge L., Wang D.-X., Chen N., Feng C. Angew.
74-108. doi 10.1002/anie.201903726
Chem. Int. Ed. 2019, 58, 3918-3922. doi 10.1002/
anie.201814308
38. Wang Q., Qu Y., Tian H., Liu Y., Song H., Wang Q.
Chem. Eur. J. 2019, 25, 8686-8690. doi 10.1002/
47. Zubkov M.O., Kosobokov M.D., Levin V.V., Kokore-
chem.201901349
kin V.A., Korlyukov A.A., Hu J., Dilman A.D. Chem.
Sci. 2020, 11, 737-741. doi 10.1039/c9sc04643g
39. Yang H., Tian C., Qiu D., Tian H., An G., Li G. Org.
48. Kosobokov M.D., Zubkov M.O., Levin V.V., Kokore-
Chem. Front.
2019,
6,
2365-2370. doi
10.1039/
kin V.A., Dilman A.D. Chem. Commun. 2020, 56,
c9qo00495e
9453-9456. doi 10.1039/d0cc04617e
40. Du H.-W., Sun J., Gao Q.-S., Wang J.-Y., Wang H.,
49. van der Worp B.A., Kosobokov M.D., Levin V.V.,
Xu Z., Zhou M.-D. Org. Lett. 2020, 22, 1542-1546.
Dilman A.D. Adv. Synth. Cat. 2021, 363, 1152-1158.
doi 10.1021/acs.orglett.0c00134
doi 10.1002/adsc.202001381
41. Wu L.-H., Cheng J.-K., Shen L., Shen Z.-L., Loh T.-P.
50. van der Worp B.A., Kosobokov M.D., Dilman A.D.
Adv. Synth. Catal. 2018, 360, 3894-3899. doi 10.1002/
ChemPhotoChem. 2021, 5, 565-570. doi 10.1002/
adsc.201800740
cptc.202100042
42. Wang J., Huang B., Yang C., Xia W. Chem. Commun.
51. Wu Y.-b., Lu G.-p., Zhou B.-j., Bu M.-j., Wan L.,
2019, 55, 11103-11106. doi 10.1039/c9cc05293c
Cai C. Chem. Commun. 2016, 52, 5965-5968. doi
43. Zhu C., Zhang Y.-F., Liu Z.-Y., Zhou L., Liu H.,
10.1039/c6cc00177g
Feng C. Chem. Sci.
2019,
10,
6721-6726. doi
52. He F.-S., Yao Y., Xie W., Wu J. Chem. Commun. 2020,
10.1039/c9sc01336a
56, 9469-9472. doi 10.1039/d0cc03591b
44. Li L., Xiao T., Chen H., Zhou L. Chem. Eur. J. 2017,
53. Song H., Cheng R., Min Q.-Q., Zhang X. Org. Lett.
23, 2249-2254. doi 10.1002/chem.201605919
2020, 22, 7747-7751. doi 10.1021/acs.orglett.0c02997
45. Chen H., Xiao T., Li L., Anand D., He Y., Zhou L.
54. Huang Y., Jia J., Huang Q.-P., Zhao L., Wang P., Gu J.,
Adv. Synth. Catal. 2017, 359, 3642-3647. doi 10.1002/
He C.-Y. Chem. Commun. 2020, 56, 14247-14250. doi
adsc.201700852
10.1039/d0cc05725h
Radical Functionalization of gem-Difluoroalkenes
M. O. Zubkov, M. D. Kosobokov, and A. D. Dilman*
N.D. Zelinsky Institute of Organic Chemistry, Leninsky prosp. 47, Moscow, 119991 Russia
*e-mail: dilman@ioc.ac.ru
Received March 22, 2021; revised March 28, 2021; accepted March 29, 2021
gem-Difluoroalkenes are readily available building blocks, which are used for the synthesis of wide spectrum
of organofluorine compounds. In the review, data on radical reactions of gem-difluoroalkenes are considered.
These processes involve step of radical addition at the double bond or step of single electron reduction of the
difluoroalkene fragment. Special emphasis is placed on photocatalytic reactions that proceed under visible light
irradiation.
Keywords: organofluorine compounds, gem-difluoroalkenes, radical reactions, photocatalysis
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021