ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 7, с. 987-993
УДК 547.327
СИНТЕЗ 4-ЗАМЕЩЕННЫХ
N-АЛКИЛ-1,3-ДИТИОЛАН-2-ИМИНОВ
В. А. Ширяевa, *, И. А. Борисоваb, А. К. Ширяевa
а ФГБОУ ВО «Самарский государственный технический университет»,
Россия, 443100 Самара, ул. Куйбышева, 153
*e-mail: shiryaev.va@samgtu.ru
b ФГБУН Институт органической химии им. Н.Д. Зелинского Российской академии наук,
Россия, 119991 Москва, Ленинский просп., 47
Поступила в редакцию 03.03.2021 г.
После доработки 13.03.2021 г.
Принята к публикации 14.03.2021 г.
Из N-алкил-1,3-оксатиолан-2-иминов реакцией с тиоцианатом калия были получены S-(2-тиоцианопро-
пил)-N-алкилкарбаматы, которые при взаимодействии со спиртами в условиях реакции Риттера приводят
к 4-замещенным N-алкил-1,3-дитиолан-2-иминам.
Ключевые слова: оксатиоланы, дитиоланы, тиокарбаматы
DOI: 10.31857/S0514749221070089
ВВЕДЕНИЕ
3a-e были получены из 5-замещенных N-алкил-
1,3-оксатиолан-2-иминов
1a-e, которые изна-
Химия пятичленных гетероциклических соеди-
чально подвергали кватернизации при помощи
нений привлекает все большее внимание иссле-
диметилсульфата, с образованием соли N-алкил-
дователей [1, 2], разрабатываются новые методы
N-метил-1,3-оксотиолан-2-иммония
2a-e, а за-
синтеза и новые реакции пятичленных серосодер-
тем вводили в реакцию с тиоцианатом аммония.
жащих гетероциклов [3, 4]. Производные 1,3-окса-
Алкилирование 1,3-оксатиолан-2-иминов по атому
тиоланов и дитиоланов проявляют анти-ВИЧ [5-7]
азота увеличивает частично положительный заряд
и противомикробную активность [8] и использу-
в положении 5 насыщенного гетероцикла, что спо-
ются в качестве селективных ингибиторов ци-
собствует реакции исходных 1,3-оксатиолан-2-и-
тохрома P450 печени человека [9]. 1,3-Дитиолан-
минов с нуклеофилами (схема 1) [13].
2-иммониевые соли - прекурсоры для тетратиа-
При синтезе соединений 3a-e в ДМФА выхо-
фульваленов, применяемых в синтезе органиче-
ды оказались очень низкими, что связано с осмо-
ских соединений с высокой электропроводностью
лением непредельных соединений, которые обра-
[10, 11] и молекулярных переключателей [12].
зуются при депротонировании иммониевой соли,
В настоящей работе рассмотрен синтез 4-заме-
или из производного тиирана, получающегося
щенных N-алкил-1,3-дитиолан-2-иминов.
при термическом распаде 1,3-оксатиолан-2-имина
[14]. Кроме того, тиоцианатная группа способна
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
реагировать с различными соседними функци-
С целью синтеза 1,3-дитиолан-2-имина с функ-
ональными группами [15]. В связи с этим была
циональной группой при С4 были изучены особен-
проведена оптимизация условий реакции 5-бензо-
ности взаимодействия 5-замещенных N-алкил-1,3-
илоксиметил-N-(1-адамантил)-N-метил-1,3-окса-
оксатиолан-2-иминов с неорганическими тиоциа-
тиолан-2-иммониевой соли 2c с различными тио-
натами. S-(2-Тиоцианопропил)-N-алкилкарбаматы
цианатами (см. таблицу).
987
988
ШИРЯЕВ и др.
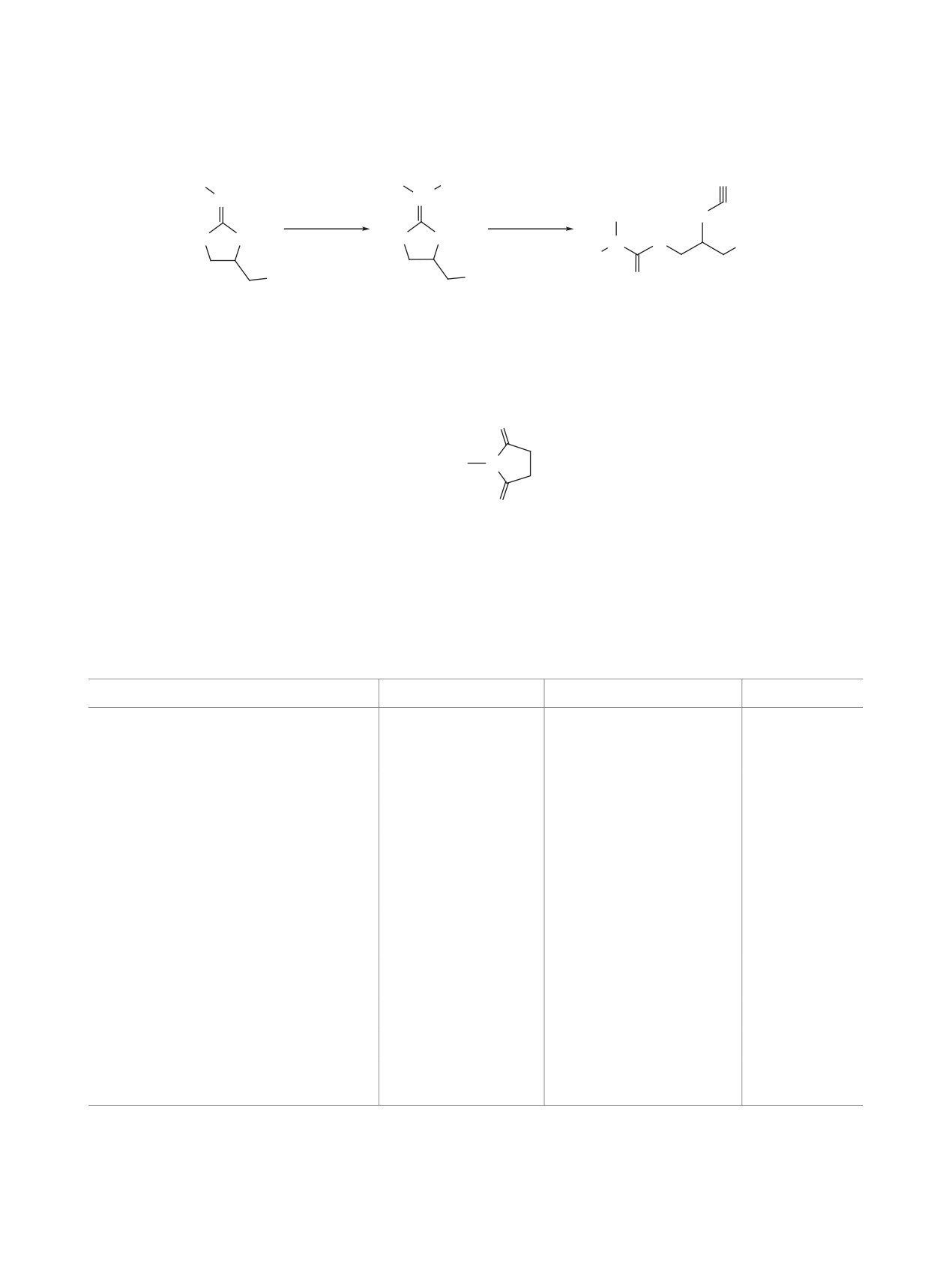
Схема 1
N
R1
R1
CH3
N
N+
(CH3)2SO4
NH4SCN
CH3
S
S
O
S
O
CHCl
3
N S
R
R1
-
R
CH
R
O
3SO4
1a-e
2a-e
3a, 38%
3b, 62%
3c, 40%
3d, 36%
3e, 45%
R = OAc, R1 = 1-Ad (a); R = OAc, R1 = t-Bu (b); R = OBz, R1 = 1-Ad (c);
O
R = Cl, R1 = 1-Ad (d); R =
N
, R1 = 1-Ad (e).
O
Реакция солей 2a-e c тиоцианатами бария и
соотношении 2 к 1 позволило увеличить выход це-
аммония в полярных апротонных растворителях
левых S-(2-тиоцианопропил)-N-алкилкарбаматов
давала низкие выходы продуктов, однако было
до 40%.
замечено, что использование хлороформа при вы-
делении целевых соединений увеличивает выход.
Из S-(2-тиоцианопропил)-N-алкилтиокарбама-
Проведение реакции в смеси хлороформ-ДМФА в
тов 3a-e в условиях реакции Риттера были получе-
Оптимизация метода получения 5-бензоилоксиметил-N-(1-адамантил)-N-метил-1,3-оксатиолан-2-иммониевой соли
Реагентыа
Соотношение
Условия
Выход, %
1. 24 ч
Соль 2c-NH4SCN-ДМФА
1:2:2
2. Н2О
13
3. CHCl3, 1,5 ч, ∆
Соль 2c-NH4SCN-ДМСО
1:4:4
∆, 48 ч
-
Соль 2c-NH4SCN-ацетон
1:4:4
∆, 24 ч
-
Соль 2c-NH4SCN-CHCl3-ТЭБАХ
1:4:4:0.1
24 ч
-
1. ∆, 12 ч
Соль 2c-NH4SCN-этанол
1:4:2
-
2. бензол
1. ∆, 12 ч
Соль 2c-NH4SCN-ПЭГ-400
1:4:2
-
2. Н2О, CHCl3
1. Н2О
Соль 2c-Ba(SCN)2-ДМФА
1:2:4
10
2. CHCl3, 2 ч, ∆
Соль 2c-КSCN-бензол-18-краун-6
1:8:2:2
∆, 48 ч
26
Соль 2c-NaSCN-КSCN
1:0.3:0.7
Cплавление
Осмоление
1. ∆, 48 ч
Соль 2c-КSCN-CHCl3:-ДМФА
1:4:4:2
40
2. Н2О, CHCl3
а ДМФА - N,N-диметилформамид, ДМСО - диметилсульфоксид, ТЭБАХ - триэтилбензиламмоний хлорид, ПЭГ - полиэтилен-
гликоль
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
СИНТЕЗ 4-ЗАМЕЩЕННЫХ N-АЛКИЛ-1,3-ДИТИОЛАН-2-ИМИНОВ
989
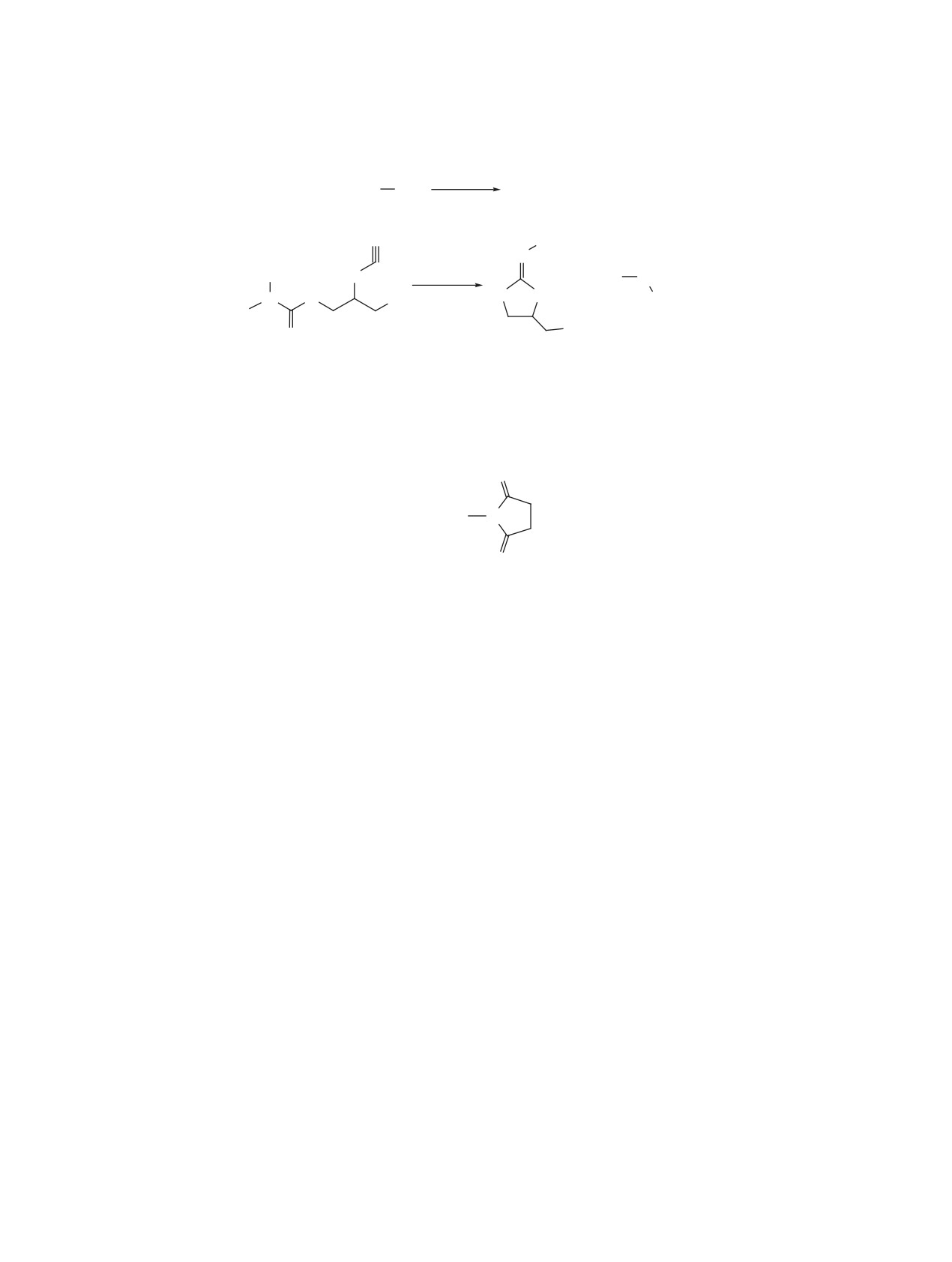
Схема 2
H2SO4
R2
OH
+
R2 +
-H2O
R2
N
N
CH3
S
R2 +
R1
NH
+
AcOH
S
S
N S
R
CH
3
R1
R
O
3a-e
4a, 57%
4b, 48%
4c, 61%
4d, 56%
4e, 48%
R = OAc, R1 = R2 = 1-Ad (a); R = OAc, R1 = R2 = t-Bu (b); R = OBz, R1 = R2 = 1-Ad (c);
O
R = Cl, R1 = R2 = 1-Ad (d); R =
N
, R1 = R2 = 1-Ad (e).
O
ны 4-замещенные N-алкил-1,3-дитиолан-2-имины
Shimadzu Irrafinity-1 (Япония) в таблетках KBr и
4a-e. Синтез основан на присоединении третич-
в тонкой пленке. Спектры ЯМР 1Н и 13C записы-
ного карбкатиона, сгенерированного серной кис-
вали на приборе JEOL JNM ECX-400 (Япония) с
лотой, к атому азота тиоцианатной группы S-(2-
рабочей частотой 400 и 100 МГц соответственно
тиоцианопропил)-N-алкилкарбамата 3a-e с после-
в растворе CDCl3 (внутренний стандарт CDCl3);
дующей атакой неподеленной пары электронов
химические сдвиги определены по шкале δ, м.д.
атома серы на атом углерода тиоцианатной группы
Масс-спектры получены на хроматомасс-спектро-
и отщеплением молекулы N-алкил-N-метиламина
метре Thermo Finnigan Trace GC (США) с элек-
(схема 2) [13].
тронным возбуждением, ионизационный потен-
циал 70 эВ. Органические растворители очища-
Целевые соединения были выделены при по-
лись по стандартным методикам и перегонялись.
мощи вакуумной хроматографии на сухой колонке
1-Адамантанол и трет-бутанол использовались
[16].
без предварительной очистки.
Структуры приведенных соединений были под-
Глицидиловые эфиры были получены по мето-
тверждены методами ИК- и ЯМР-спектроскопии.
дике [17], N-алкил-1,3-оксатиолан-2-имины - по
В спектрах соединений 4a-e были отмечены ха-
методике [4].
рактерные полосы поглощения связи С=О и С=N
в областях 1740-1760 и 1630-1660 см-1 соответ-
N-Алкил-N-метил-1,3-оксатиолан-2-иммо-
ственно, а в спектрах ЯМР 13С все углеродные
нийметилсульфаты 2a-e (общая методика). В
атомы представлены двойным набором сигналов
круглодонную колбу вносили 25 ммоль N-алкил-
из-за наличия E/Z-изомерии полученных 4-заме-
1,3-оксатиолан-2-имина 1a-e, растворяли в 40 мл
щенных N-алкил-1,3-дитиолан-2-иминов.
хлороформа, прикапывали 20 мл диметилсульфа-
та, тщательно перемешивали и оставляли на ночь.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Избыток хлороформа упаривали на роторном
ИК спектры соединений записывали в режи-
испарителе, далее реакционную смесь промыва-
ме подавления сигнала H2O и CO2 в интервале
ли диэтиловым эфиром (3×15 мл) для удаления
волновых чисел 400-4000 см-1 на спектрометре
избытка диметилсульфата, остаток растворителя
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
990
ШИРЯЕВ и др.
упаривали. В реакционной колбе оставалось вяз-
N-(1-Адамантил)-N-метил-S-(3-бензоилокси-
кое масло, - соль N-алкил-N-метил-1,3-дитиолан-
2-тиоцианопропил)карбамат (3c). Получен из
2-иммония 2a-e.
7.5 г соли иммония 2c. Выход 2.67 г (40%), бесцвет-
ное масло. ИК спектр (KBr), ν, см-1: 2912, 2862,
S-(2-Тиоцианопропил)-N-алкилтиокарба-
2154, 1718, 1226, 1065. Спектр ЯМР 1Н (CDCl3), δ,
маты 3a-e (общая методика). Соль иммония
м.д.: 1.62-1.66 м [6H, 3СН2(Ad)], 2.08-2.17 м [9H,
2a-e (25 ммоль) растворяли в 50 мл хлорофор-
3СН(Ad) + 3СН2(Ad)], 2.94 с (3H, NCH3), 3.32-3.34
ма, добавляли 0.1 моль тиоцианата калия и 25 мл
м (2H, CH2S), 3.75-3.77 м (1H, CH), 4.66-4.68 м
N,N-диметилформамида. Реакционную колбу
(2Н, СН2О), 7.43-8.10 м (5Н, Ph). Спектр ЯМР
снабжали магнитной мешалкой с нагревом, обрат-
13C (CDCl3), δ, м.д.: 30.17 (NCH3), 32.65 (Ad),
ным холодильником и нагревали в течение 24 ч
36.34 (Ad), 39.96 (Ad), 48.73 (CH), 60.64 (Ad),
при 60°C. Окончание реакции контролировали по
65.09 (CH2O), 110.47 (SCN), 128.59 (Ph), 129.33
ТСХ (элюэнт петролейный эфир-этилацетат, 3:1).
(Ph), 130.01 (Ph), 133.53 (Ph), 165.12 (C=O), 166.03
Далее реакционную смесь выливали в холодную
(SC=O). Найдено, %: C 62.20; H 6.21; N 6.24; S
воду, органическую фазу отделяли, промыва-
14.07. C23H28N2O3S2. Вычислено, %: C 62.13; H
ли водой (3×50 мл) для удаления остатков N,N-
6.35; N 6.30; S14.42.
диметилформамида, а водный слой промывали
N-(1-Адамантил)-N-метил-S-(3-хлор-2-тио-
хлороформом (2×15 мл). Органические вытяжки
цианопропил)карбамат (3d). Получен из 10.5 г
объединяли, растворитель упаривали досуха.
соли иммония 2d. Выход 3.47 г (38%), желтое мас-
N-(1-Адамантил)-N-метил-S-(3-ацетилокси-
ло. ИК спектр (тонкий слой), ν, см-1: 2912, 2854,
2-тиоцианопропил)карбамат (3a). Получен из
2153, 1678, 1512, 1226, 1065. Спектр ЯМР 1Н
15.8 г соли иммония 2а. Выход 2.52 г (38%), бес-
(CDCl3), δ, м.д.: 1.69-1.70 м [6H, 3СН2(Ad)], 2.10-
цветное масло. ИК спектр (тонкий слой), ν, см-1:
2.16 м [9H, 3СН2(Ad) + 3СН(Ad)], 2.94 с (3H, NCH3),
2916, 2851, 2156, 1743, 1728, 1512, 1226, 1065.
3.24-3.31 м (2H, CH2Сl), 3.62-3.78 м (1H, CH),
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 2.13 с (3H,
3.90-3.93 м (2Н, CH2S). Спектр ЯМР 13C (CDCl3),
COCH3), 2.92 с (3H, NCH3), 3.23-3.24 м (2H, CH2),
δ, м.д.: 30.17 (NCH3), 30.97 (Ad), 33.05 (CH2S),
3.57-3.59 м (1Н, СН), 4.38-4.45 м (2Н, CH2O).
36.49 (Ad), 39.97 (Ad), 45.81 (CH), 51.71 (CH2Cl),
Спектр ЯМР 13C (CDCl3), δ, м.д.: 20.70 (CН3),
60.70 (Ad), 110.39 (SCN), 165.00 (SC=O). Найдено,
26.73 (NCH3), 29.71 (CH2), 41.84 (CH),
64.61
%: C 53.57; H 6.48; N 7.76; S 17.67. C16H23ClN2OS2.
(CH2O), 110.41 (SCN), 165.14 (CH3C=O), 170.49
Вычислено, %: C 53.54; H 6.46; N 7.80; S 17.87.
(SC=O). Найдено, %: C 56.50; H 6.86; N 7.20; S
N-(1-Адамантил)-N-метил-S-[3-(пирро-
17.05. C18H26N2O3S2. Вычислено, %: C 56.51; H
лидин-2,5-дион)-2-тиоцианопропил]карбамат
6.85; N 7.32; S 16.76.
(3e). Получен из 4.0 г. соли иммония 2e. Выход
N-трет-Бутил-N-метил-S-(3-ацетилокси-2-
1.59 г (45%), желтое масло. ИК спектр (тонкий
тиоцианопропил)карбамат
(3b). Получен из
слой), ν, см-1: 2912, 2862, 2154, 1756, 1742, 1716,
4.7 г соли иммония 2b. Выход 2.47 г (62 %), жел-
1226, 1065. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.15-
тое масло. ИК спектр (тонкий слой), ν, см-1: 2928,
1.23 т [6H, 2СН3(эфир)], 1.59-1.69 с [6H, 3СН2(Ad)],
2910, 2156, 1753, 1512, 1226, 1065. Спектр ЯМР
2.03-2.10 с
[6H,
3СН2(Ad)],
2.65-2.89 м
(9H,
1Н (CDCl3), δ, м.д.: 1.40 с (9H, 3СН3), 2.14 с (3H,
2СН2N
+ NCH3
+ CH2S),
3.55-3.85 м
[4Н,
COCH3), 2.95 с (3H, NCH3), 3.23-3.27 м (2H, CH2S),
СН2(эфир)], 3.89-4.05 м (Н, CH). Спектр ЯМР 13C
3.55-3.63 м (1H, CH), 4.35-4.47 м (2H, CH2О).
(CDCl3), δ, м.д.: 15.36 [СН3(эфир)], 28.26 (Ad), 29.69
Спектр ЯМР 13C (CDCl3), δ, м.д.: 20.72 (CН3),
(Ad), 30.14 (NCH3), 33.49 (CH2S), 36.38 (Ad), 41.73
28.35 (CH3, t-Bu), 32.06 (NCH3), 32.50 (CH2S),
(СН2N), 48.34 (CH), 60.52 (Ad), 65.94 [C=O(эфир)]
48.57 (CH), 59.20 (Cчетв, t-Bu), 64.57 (CH2O), 110.38
110.43 (SCN), 165.16 (SC=O), 177.25 (NC=O).
(SCN), 165.40 (C=O), 170.49 (SC=O). Найдено, %:
Найдено, %: C 57.06; H 6.52; N 10.06; S 15.01.
C 47.31; H 6.70; N 9.22; S 20.26. C12H20N2O3S2.
C20H27N3O3S2. Вычислено, %: C 56.98; H 6.46; N
Вычислено, %: C 47.34; H 6.62; N 9.20; S 21.07.
9.97; S 15.21.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
СИНТЕЗ 4-ЗАМЕЩЕННЫХ N-АЛКИЛ-1,3-ДИТИОЛАН-2-ИМИНОВ
991
1,3-Дитиолан-2-имины 4a-e (общая методи-
(CDCl3), δ, м.д.: 1.40 с (9H, 3СН3), 2.14 с (3H, CH3),
ка). В круглодонную колбу, снабженную механиче-
2.95 с (3H, NCH3), 3.23-3.27 м (2H, CH2), 3.55-
ской мешалкой, капельной воронкой, термометром
3.63 м (1H, CH), 4.35-4.47 м (2H, CH2О). Спектр
и ледяной баней помещали 7 мл (d420 1.84) серной
ЯМР 13C (CDCl3), δ, м.д.: 20.85 (СH3), 28.43 (t-
кислоты, 10 мл (d420 1.04) уксусной кислоты и
Bu), 45.28(CH), 34.48 (CH2S), 58.23 (t-Bu), 63.91
8.2 ммоль третичного спирта (1-адамантанола для
(CH2O), 158.38, 159.20 (C=NE/Z), 170.52, 171.95
соединений 4a, c-e и трет-бутанола для соедине-
(C=ОE/Z). Найдено, %: C 48.66; H 6.84; N 5.77; S
ния 4b), поддерживая температуру реакционной
26.68. C10H17NO2S2. Вычислено, %: C 48.55; H
смеси не выше 15°С. В капельную воронку по-
6.93; N 5.66; S 25.92.
мещали 10 ммоль полученного ранее N-алкил-N-
N-(1-Адамантил)-4-бензоилоксиметил-1,3-
метил-S-(2-тиоцианопропил)карбамата и прибав-
дитиолан-2-имин (4c). Получен из 2.67 г тиокар-
ляли по каплям к раствору третичного спирта в
бамата 3c. Выход 1.42 г (61%), желтые кристал-
смеси серной и уксусной кислот так, чтобы темпе-
лы, т.пл. 65-67°C. ИК спектр (KBr), ν, см-1: 2916,
ратура была не выше 5°С, перемешивали в течение
2851, 1718, 1596, 1451, 1271, 1065. Спектр ЯМР 1Н
1 ч и оставляли нагреваться до комнатной темпера-
(CDCl3), δ, м.д.: 1.62-1.67 м [6H, 3СН(Ad)], 2.00-
туры на 1 сут. Затем реакционную массу выливали
2.07 м [3H, 3СН(Ad)], 2.44-2.58 м [6H, 3СН2(Ad)],
на лед, отфильтровывали не до конца прореагиро-
2.88-3.07 м (2Н, CH2), 3.20-3.30 м (1Н, CH), 4.36-
вавший третичный спирт и образовавшийся в ходе
4.61 м (2H, CH2О), 7.42-8.04 м (5Н, Ph). Спектр
реакции N-алкил-N-метиламин и нейтрализовали
ЯМР 13C (CDCl3), δ, м.д.: 30.20 (Ad), 30.96 (NCH3),
карбонатом натрия до pH 9.0-11.0. Водный рас-
36.44 (Ad), 36.44 (CH2), 40.13 (CH), 58.39 (CH2O),
твор экстрагировали хлороформом (3×30 мл), ор-
64.59 (Ad), 128.48 (Ph), 128.51 (Ph), 129.77 (Ph),
ганический слой отделяли, сушили сульфатом на-
133.30 (Ph), 149.50 (С=N), 166.34 (C=O). Найдено,
трия. Избыток хлороформа отгоняли на роторном
%: C 65.06; H 6.56; N 3.55; S 16.49. C21H25NO2S2.
испарителе, целевой продукт очищали вакуумной
Вычислено, %: C 65.08; H 6.50; N 3.61; S 16.55.
хроматографией на сухой колонке, в качестве элю-
N-(1-Адамантил)-4-хлорметил-1,3-дитиолан-
ента использовали смесь хлористого метилена с
2-имин (4d). Получен из 3.47 г. тиокарбамата 3d.
добавлением 1% метанола.
Выход 1.63 г (56%), кристаллы желтого цвета, т.пл.
N-(1-Адамантил)-4-ацетилоксиметил-1,3-
53-55°C. ИК спектр (тонкий слой), ν, см-1: 2904,
дитиолан-2-имин (4a). Получен из 2.52 г тио-
2849, 1600, 1257, 1083. Спектр ЯМР 1Н (CDCl3), δ,
карбамата 3a. Выход 1.22 г (57%), масло желто-
м.д.: 1.65-1.70 м [6H, 3СН2(Ad)], 1.90-1.96 м [6H,
го цвета. ИК спектр (тонкий слой), ν, см-1: 2970,
3СН2(Ad)], 2.08 с [3H, 3СН(Ad)], 2.40-3.68 м (2Н,
2927, 2851, 1743, 1601, 1224, 1031. Спектр ЯМР 1Н
CH2S), 3.79-3.87 м (2Н, СН2S), 4.17-4.88 м (2Н,
(CDCl3), δ, м.д.: 1.56-1.74 с [6H, 3СН2(Ad)], 1.89-
СН2Cl). Спектр ЯМР 13C (CDCl3), δ, м.д.: 31.02
1.95 м [3H, 3СН(Ad)], 2.07-2.13 с [6H, 3СН2(Ad)],
(Ad), 34.43 (CH2S), 36.48 (Ad), 40.95 (Ad), 44.21
2.08 с (3H, CH3), 3.20-3.41 м (2H, CH2), 3.56-
(CH2Cl), 47.63 (СН), 58.99 (Ad), 156.40, 157.63
3.59 м (1H, CH), 4.25-4.29 м (2Н, ОСН2). Спектр
(C=NE/Z). Найдено, %: C 55.76; H 6.62; N 4.61; S
ЯМР 13C (CDCl3), δ, м.д.: 20.85 (СH3), 29.75 (Ad),
20.26. C14H20ClNS2. Вычислено, %: C 55.70; H
30.88 (Ad), 34.19 (CH2S), 36.49 (Ad), 40.93 (CH),
6.68; N 4.64; S 21.24.
45.45 (Ad), 53.32 (CH2O), 156.50, 157.50 (C=NE/Z),
N-(1-Адамантил)-4-(пирролидин-2,5-дион-
170.49, 170.51 (C=ОE/Z). Найдено, %: C 59.12; H
1-метил)-1,3-дитиолан-2-имин (4e). Получен из
7.15; N 4.35; S 20.21. C16H23NO2S2. Вычислено, %:
1.59 г тиокарбамата 3e. Выход 0.77 г. (48%), кри-
C 59.04; H 7.12; N 4.30; S 19.70.
сталлы белого цвета, т.пл. 167-169°C. ИК спектр
N-(трет-Бутил)-4-ацетилоксиметил-1,3-
(тонкий слой), ν, см-1: 2922, 2851, 1774, 1713,
дитиолан-2-имин (4b). Получен из 2.47 г. тио-
1586, 1450, 1225. Спектр ЯМР 1Н (CDCl3), δ, м.д.:
карбамата 3b. Выход 0.96 г (48%), масло желто-
1.42 с (6Н, С6Н12), 1.66 с [6H, 3СН2(Ad)], 1.91-1.99
го цвета. ИК спектр (тонкий слой), ν, см-1: 2966,
т [6H, 3СН2(Ad)], 2.16 с [3H, 3СН(Ad)), 2.74-2.75 д
2850, 1735, 1605, 1467, 1254, 1027. Спектр ЯМР 1Н
(4H, CH2N), 3.06-3.39 м (1H, CH), 3.81-3.98 м (2Н,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
992
ШИРЯЕВ и др.
СН2N), 4.32-4.34 м (2Н, СН2N). Спектр ЯМР 13C
2.
Rodriguez J., Bonne D. Stereoselective Multiple
(CDCl3), δ, м.д.: 26.99 [СH2(циклогексан)], 28.22 (Ad),
Bond-Forming Transformations in Organic Syn-
29.74 (Ad), 36.49 (NCH3), 41.39 (Ad), 42.59 (NCH2),
thesis. Hoboken: John Wiley & Sons, 2015. doi
10.1002/9781119006220
53.18 (CH2O), 58.92 (Ad), 156.50, 157.50 (C=NE/Z),
170.49, 170.51 (C=ОE/Z). Найдено, %: C 59.36; H
3.
Mlosto G., Heimgartner H. Curr. Org. Chem. 2011, 15,
6.58; N 7.57; S 17.07. C18H24N2O2S2. Вычислено,
675-693. doi 10.2174/138527211794518961
%: C 59.31; H 6.64; N 7.68; S 17.59.
4.
Shiryaev A., Shiryaev V., Korlukov A., Khamitova D.
Synthesis. 2011, 19, 3204. doi 10.1055/s-0030-1260175
ВЫВОДЫ
5.
Mansour T.S., Evans C.A., Siddiqui M.A., Charron M.,
Осуществлен синтез ряда 5-замещенных 1,3-
Zacharie B., Nguyen-Ba N., Lee N., Korba B.
оксатиолан-2-(N-алкил)иминов. Подобраны ус-
Nucleosid. Nucleotid. 1997, 16, 993-1001. doi 10.1080/
ловия для эффективного раскрытия оксатио-
07328319708006122
ланового цикла, в результате получен ряд но-
6.
Nguyen-Ba N., Brown W.L., Laval Chan, Lee N.,
вых S-(2-тиоцианопропил)-N-алкилкарбаматов.
Brasili L., Lafleur D., Zacharie B. Chem. Commun.
Взаимодействием последних с третичными спир-
1999, 13, 1245-1246. doi 10.1039/A901927H
тами в условиях реакции Риттера синтезирова-
7.
Nguyen-Ba N., Brown W.L., Lee N., Zacharie B.
ны соответствующие
5-замещенные
1,3-дитио-
Synthesis. 1998, 5, 759-762. doi 10.1055/s-1998-2065
лан-2-(N-алкил)имины. Наличие липофильного
8.
Mandala D., Lal N., Kumar L., Kushwaha B., Gup-
фрагмента, наряду с реакционноспособным заме-
ta S., Kumar L., Bala V., Yadav S.K., Singh P.,
тителем в положении 5 оксатиоланового цикла, а
Singh N., Maikhuri J.P., Sankhwar S.N., Shukla P.K.,
также основного атома азота, позволяет использо-
Siddiqi I., Gupta G., Sharma V.L. Chem. Med. Chem.
вать данные соединения в качестве структурных
2015, 10, 1739. doi 10.1002/cmdc.201500291
блоков для создания новых биологически актив-
9.
Diaz P., Huang W., Keyari C.M., Buttrick B., Price L.,
ных соединений.
Guilloteau N., Tripathy S., Sperandio V.G., Fronc-
БЛАГОДАРНОСТИ
zek F.R., Astruc-Diaz F., Isoherranen N. J. Med. Chem.
2016, 59, 2579. doi 10.1021/acs.jmedchem.5b01780
Работа выполнена с использованием научно-
10.
Belei D., Bicu E., Jones P.G., Birsa M.L. Synlett. 2010,
го оборудования центра коллективного пользова-
6, 931-933. doi 10.1055/s-0029-1219547
ния СамГТУ «Исследование физико-химических
11.
Belei D., Bicu E., Jones P.G., Birsa M.L. J. Heterocycl.
свойств веществ и материалов»
Chem. 2011, 48, 129-134. doi 10.1002/jhet.529
ФОНДОВАЯ ПОДДЕРЖКА
12.
Liu Y., Saha S., Vignon S.A., Flood A.H., Stoddart J.F.
Синтез соединений выполнен при финансовой
Synthesis. 2005, 19, 3437-3445. doi 10.1055/s-2005-
поддержке Российского научного фонда (проект
918468
№ 20-73-00254). Исследование спектральных ха-
13.
Ширяев А.К. ЖОрХ. 2003, 39, 1806. doi 10.1023/
рактеристик выполнено при финансовой поддерж-
B:RUJO.0000019752.39928.3a
ке Минобрнауки РФ в рамках проектной части го-
14.
Ширяев А.К., Крыслов И.Ю. ЖОрХ. 2002, 38, 1433-
сударственного задания № 0778-2020-0005.
1434. [Shiryaev A.K., Kryslov I.Y. Russ. J. Org. Chem.
2002, 38, 1382-1383.] doi 10.1023/A:1021636704131
КОНФЛИКТ ИНТЕРЕСОВ
15.
Leuschner J., Schaefer H., Leuschner F. Eur. J.
Авторы заявляют об отсутствии конфликта ин-
Med. Chem.
1994,
29,
241. doi
10.1016/0223-
тересов.
5234(94)90042-6
СПИСОК ЛИТЕРАТУРЫ
16.
Pedersen D.S., Rosenbohm C. Synthesis. 2001, 16,
2431-2434. doi 10.1055/s-2001-18722
1. Lednicer D. Five-Membered Heterocycles, in The
Organic Chemistry of Drug Synthesis. Hoboken: John
17.
Castanheiro T., Suffert J., Donnard M., Gulea M. Chem.
Wiley & Sons, Inc. 2007, 7.
Soc. Rev. 2016, 45, 494-505. doi 10.1039/c5cs00532a
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021
СИНТЕЗ 4-ЗАМЕЩЕННЫХ N-АЛКИЛ-1,3-ДИТИОЛАН-2-ИМИНОВ
993
Synthesis of 4-Substituted N-Alkyl-1,3-dithiolan-2-imines
V. A. Shiryaeva, *, I. A. Borisovab, and A. K. Shiryaeva
a Samara State Technical University, ul. Kuybisheva, 153, Samara, 443100 Russia
*e-mail: shiryaev.va@samgtu.ru
b N.D. Zelinsky Institute of Organic Chemistry Russian Academy of Sciences,
Leninsky prosp., 47, Moscow, 119991 Russia
Received March 3, 2021; revised March 13, 2021; accepted March 14, 2021
From N-alkyl-1,3-oxathiolan-2-imines under reaction with potassium thiocyanate S-(2-thiocyanopropyl)-N-al-
kylcarbamates were obtained. The reaction of thiocarbamates with tertiary alcohols under Ritter reaction con-
ditions yilded 4-substituted N-alkyl-1,3-dithiolan-2-imines.
Keywords: oxathiolanes, dithiolanes, thiocarbamates
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 7 2021