ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 8, с. 1084-1119
ОБЗОРНАЯ СТАТЬЯ
УДК 547.791.9 + 547-304.4
КАСКАДНЫЕ ТРАНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]-
ТРИАЗОЛО[1,5-a]ПИРИДИНОВ В КАЧЕСТВЕ УДОБНЫХ
ПРЕДШЕСТВЕННИКОВ ДИАЗОСОЕДИНЕНИЙ
И МЕТАЛЛОКАРБЕНОИДОВ
© 2021 г. Ю. Н. Котовщиков*, В. А. Волошкин, Г. В. Латышев,
Н. В. Лукашев, И. П. Белецкая
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»,
химический факультет, Россия, 119991 Москва, Ленинские горы, 1/3
*e-mail: kotovshchikov@org.chem.msu.ru
Поступила в редакцию 10.04.2020 г.
После доработки 19.04.2020 г.
Принята к публикации 25.04.2020 г.
Обзор посвящен использованию [1,2,3]триазоло[1,5-a]пиридинов в качестве предшественников тауто-
мерных 2-(диазометил)пиридинов. Данная методология - удобный инструмент в синтезе различных
типов азотсодержащих гетероциклов. Представлены как некаталитические превращения, так и активно
исследуемые в последние годы каскадные реакции с участием металлокарбеноидов. Обзор также содер-
жит описание основных методов получения исходных [1,2,3]триазоло[1,5-a]пиридинов.
Ключевые слова: триазолы, диазосоединения, карбеноиды, таутомерия, гетероциклы
DOI: 10.31857/S0514749221080024
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
МЕТОДЫ ПОЛУЧЕНИЯ ТРИАЗОЛО[1,5-а]ПИРИДИНОВ
АННЕЛИРОВАНИЕ 1,2,3-ТРИАЗОЛЬНОГО ЦИКЛА К ПИРИДИНУ
ФУНКЦИОНАЛИЗАЦИЯ ТРИАЗОЛО[1,5-а]ПИРИДИНОВ
ТАУТОМЕРИЯ ТРИАЗОЛО[1,5-а]ПИРИДИНОВ
РАСКРЫТИЕ 1,2,3-ТРИАЗОЛА В НЕКАТАЛИТИЧЕСКИХ РЕАКЦИЯХ
МЕТАЛЛ-КАТАЛИЗИРУЕМЫЕ РЕАКЦИИ ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
КАТАЛИЗАТОРЫ НА ОСНОВЕ Rh(II)
КАТАЛИЗАТОРЫ НА ОСНОВЕ Rh(III)
КАТАЛИЗАТОРЫ НА ОСНОВЕ Cu
КАТАЛИЗАТОРЫ НА ОСНОВЕ Pd
КАТАЛИЗАТОРЫ НА ОСНОВЕ ДРУГИХ МЕТАЛЛОВ
КАТАЛИТИЧЕСКИЕ РЕАКЦИИ ТРИАЗОЛО[1,5-a]ПИРИДИНОВ БЕЗ ИСПОЛЬЗОВАНИЯ МЕТАЛЛОВ
ЗАКЛЮЧЕНИЕ
1084
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1085
ВВЕДЕНИЕ
МЕТОДЫ ПОЛУЧЕНИЯ ТРИАЗОЛО[1,5-а]-
ПИРИДИНОВ
Диазосоединения - ценные интермедиаты в
синтезе различных классов органических веществ
АННЕЛИРОВАНИЕ 1,2,3-ТРИАЗОЛЬНОГО
ЦИКЛА К ПИРИДИНУ
[1-4]. Наиболее часто они выступают предше-
ственниками карбокатионов, карбенов или карбе-
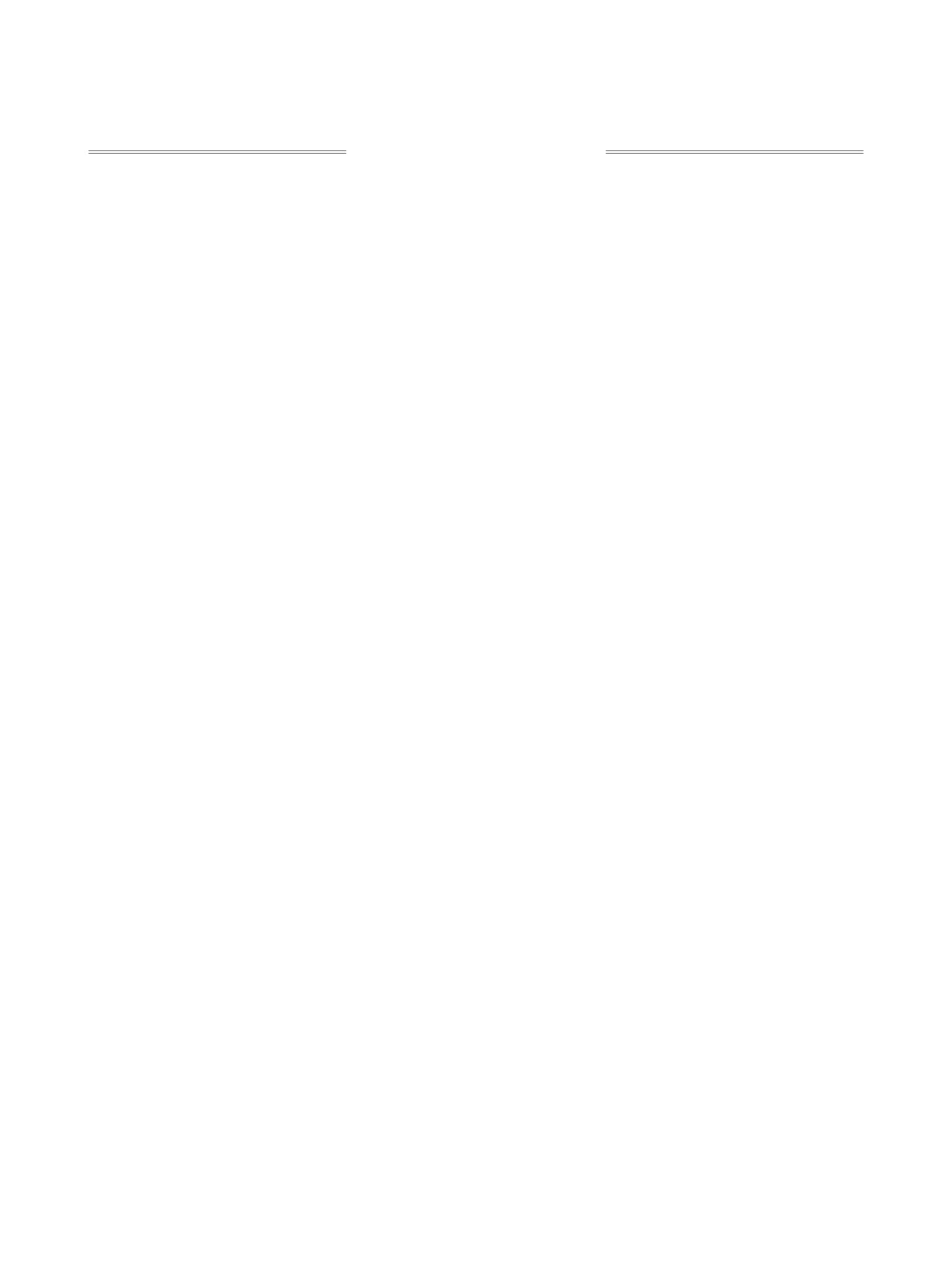
Триазоло[1,5-а]пиридины
- легкодоступный
ноидов, а также используются в качестве 1,3-ди-
тип конденсированных гетероциклических си-
полей в реакциях циклоприсоединения. Однако
стем. Наиболее распространенные подходы к син-
токсичность, низкая термическая стабильность и
тезу этих веществ основаны на применении клас-
потенциальная взрывоопасность диазосоединений
сических методов получения диазосоединений,
сильно ограничивают применение этих реагентов.
которые самопроизвольно превращаются в более
По этой причине в синтезе предпочитают заменять
стабильный циклический таутомер. Исходными
диазосоединения на их более безопасные и удоб-
соединениями для синтеза триазоло[1,5-а]пири-
ные в работе предшественники.
динов почти всегда выступают α-замещенные пи-
ридины. Один из общих подходов заключается в
Большинство 1,2,3-триазолов представляет со-
действии гидразина на пиридин-2-карбальдегиды
бой стабильные гетероциклические соединения,
или кетоны и последующем окислении получен-
обладающие относительно низкой реакционной
ных гидразонов различными реагентами (схема 2),
способностью. Тем не менее, существуют неко-
наиболее часто используемым из которых является
торые типы 1,2,3-триазолов, которые способны
MnO2 [18, 19]. В частности, этим методом был по-
самопроизвольно претерпевать электроцикличе-
лучен ряд трициклических аналогов триазолопи-
ское раскрытие с образованием изомерных α-ди-
ридинов (схема 3) [20]. В качестве альтернативных
азоиминов. Это свойство позволяет использовать
окислителей были предложены также пероксид
триазолы в качестве удобных предшественников
никеля [21] и фенилиодозоацетат [22]. В 2014 г.
диазосоединений и соответствующих металло-
описано каталитическое окисление гидразонов
карбеноидов. Самый распространенный тип таких
кислородом воздуха в присутствии 5% Cu(OAc)2 в
соединений
- N-сульфонил-1,2,3-триазолы, хи-
растворе этилацетата при комнатной температуре
мия которых бурно развивается в последние годы
[23]. Данный метод позволяет достигать высоких
[5-10]. Кольчато-цепная таутомерия характерна
выходов (59-99%) триазолопиридинов также в
также для ряда конденсированных гетероцикли-
варианте one-pot без промежуточного выделения
ческих систем на основе 1,2,3-триазола [11-15],
соответствующих гидразонов. Избежать исполь-
наиболее изученные из которых - триазоло[1,5-а]-
зования переходных металлов можно с помощью
пиридины (схема 1) [16, 17]. Несмотря на то, что
предложенного в 2019 г. электрохимического вари-
эти гетероциклы были впервые синтезированы в
анта окисления [24].
середине прошлого века, именно в последнее вре-
мя они начали активно использоваться в качестве
Вышеописанный способ синтеза триазолопи-
предшественников диазосоединений.
ридинов неприменим, если в структуре содержит-
Схема 1
4
3
3a
5
N2
N
2
N
6
N
N N
8
1
N N
7
Схема 2
O
R
R
R
N2H4
Окисление
R
N
N2
N
N
N NH2
N
N N
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1086
КОТОВЩИКОВ и др.
Схема 3
N
N
N
N
1. N2H4, EtOH, rt
O
2. MnO2,
CHCl3, 60°C
X
X
n
n
Y
Y
28-61%
X, Y = CH2, O, NSO2Ph.
n = 1, 2.
Схема 4
R2
O
R2
R1
R1
R1
TsNHNH2
NaOH
N
R2
H2O
N
N HN
N
N N
Ts
ся чувствительный к окислению фрагмент. Для
ру, действие тозилазида на (пиридин-2-илметил)-
таких соединений может быть использован метод,
кетоны в присутствии этилата калия в этаноле
основанный на разложении N-тозилгидразонов
приводит к α-диазокетонам, в результате циклиза-
при действии оснований (схема 4) [25].
ции которых образуются 3-ацилтриазолопириди-
ны [27].
Недавним развитием данного подхода является
предложенный в 2021 г. метод синтеза бензоанало-
В 2019 г. предложен новый подход к триазо-
гов триазолопиридинов, исходя из легкодоступных
лопиридинам, заключающийся в диазотировании
2-метилхинолинов (схема 5) [26]. Иодирование в
2-пиколиламинов (схема 7) [28]. Реакция проте-
кает в мягких условиях при действии трет-бу-
DMSO при 110°C приводит к галогенпроизвод-
ному, которое в условиях реакции подвергается
тилнитрита в бензиловом спирте при комнатной
температуре, однако возможное применение этого
окислению по Корнблюму и превращается в соот-
подхода ограничивается умеренными выходами, а
ветствующий альдегид. Последующее добавление
также меньшей доступностью исходных веществ
тозилгидразина и K3PO4 в качестве основания и
по сравнению с вышеописанными альтернативны-
продолжение нагревания завершает синтез кон-
ми вариантами.
денсированных триазолов. Несмотря на относи-
тельно жесткие условия, данный метод позволяет
ФУНКЦИОНАЛИЗАЦИЯ ТРИАЗОЛО[1,5-a]-
получать целевые соединения с хорошими выхо-
ПИРИДИНОВ
дами (54-83%), однако он не годится для синтеза
Введение дополнительных заместителей в три-
простейших триазолопиридинов из 2-пиколинов.
азолопиридины может осуществляться различны-
Реакция диазопереноса является одним из наи-
ми методами, многие их которых являются клас-
более распространенных альтернативных методов
сическими для химии гетероциклических соеди-
получения триазолопиридинов (схема 6). К приме-
нений. В частности, с помощью стандартных ме-
Схема 5
R
R
1. I2 (2.5 экв), DMSO,
X
X
110°C, 4-6 ч
2. TsNHNH2
(1.2 экв),
X
N
K3PO4·3H2O (3 экв),
X
N
Me
110°C, 5 ч
N N
54-83%
X = CH, N.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1087
Схема 6
O
R
O R
O
R
TsN3
EtOK/EtOH
N2
N
N
N
N N
Схема 7
R2
R2
R1
R1
t-BuONO
NH2
PhCH2OH, rt
N
N
N
N
25-80%
R1 = Me, Br; R2 = H, Ar.
тодов электрофильного замещения можно вводить
Литиевые производные можно использовать
ряд заместителей в 3-е положение, что подробно
также и для введения в 7-е положение брома, од-
освещено в более ранних обзорах по химии триа-
нако для этого необходим достаточно мягкий га-
золопиридинов [29-31].
логенирующий агент, не затрагивающий триазоль-
ное кольцо. Хорошо себя зарекомендовал 1,2-ди-
Прямое металлирование является распростра-
бром-1,1,2,2-тетрахлорэтан, при добавлении кото-
ненным методом модификации триазолопириди-
рого к раствору литиевого производного в толуоле
нов. В частности, литирование при действии ди-
7-бромтриазолопиридин был получен с выходом
изопропиламида лития в диэтиловом эфире при
70% (схема 9) [34].
-40°C происходит по положению 7 (схема 8) [32].
Это позволяет с умеренными выходами получать
Главной целью усовершенствования методик
различные замещенные триазолопиридин-7-ил-
металлирования триазолопиридинов по 7 положе-
карбинолы.
нию было повышение толерантности к функцио-
Позднее было проведено теоретическое иссле-
нальным группам. Этого эффекта удалось достичь
дование процесса литирования триазоло[1,5-a]-
использованием ат-комплексов магния и кадмия в
пиридина методом функционала плотности [33].
качестве металлирующих агентов (схема 10) [35].
Оказалось, что литированное производное по по-
Кроме того, Bu3MgLi позволил проводить данную
ложению 7 более чем на 40 кДж/моль стабильнее,
реакцию при -10°С, а не при -40°С, как это требо-
чем литированное по 3-му положению.
валось при использовании BuLi.
Схема 8
O
N
LDA
N
R2
N N
N
O, -40°C
N NR1
N NEt2
Li
HO
R2
R1
25-69%
Схема 9
1. BuLi, PhMe, -40°C
N
N
2. BrCl2C-CCl2Br
N N
N N
Br
70%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1088
КОТОВЩИКОВ и др.
Схема 10
R
R
R
1. Bu3MgLi
THF, -10°C
N
N
или
N
N
2. I2 или ArCHO
N
N N
3. H2O
N N
I
Ar
OH
35-75%
32-61%
R = H, Me, Ph.
Ar = 3,4,5-(MeO)3C6H2.
Схема 11
R
R
1. (TMP)3CdLi
THF, rt
N
N
2. I2
N N
N
3. H2O
H
N N
I
38-76%
TMPH
R = H, Me, Ph, CN,
2-пиридинил, 2-тиенил.
При использовании для тех же целей
ющиеся
7-(трифторацетил)триазолопиридины в
(TMP)3CdLi реакцию можно проводить при ком-
процессе выделения легко превращаются в ге-
натной температуре (схема 11). В этих условиях
минальные диолы при действии воды (схема 13)
региоселективно протекает металлирование 3-ци-
[37].
анотриазолопиридина, тогда как аналогичная ре-
Высокая активность литиевых производных
акция с BuLi приводила к смеси продуктов [36].
триазолопиридинов позволяет успешно вводить
Особое влияние атома фтора на биологиче-
их в реакции и с достаточно слабыми электрофи-
ские свойства соединений обусловило интерес к
лами, в частности, рядом электронодефицитных
синтезу фторпроизводных триазолопиридинов.
азагетероциклов, среди которых пиримидин, пи-
Однако предпринятая попытка введения фтора
разин, пиридазин и 1,3,5-триазин (схема 14) [38].
при действии N-фторбензолсульфонимида на Li-
Последующее окисление образующегося аддукта
производное триазолопиридина с высоким выхо-
при действии KMnO4 приводит к восстановлению
дом привела к образованию продукта димериза-
ароматичности, что открывает простой метод вве-
ции (схема 12) [37].
дения азинового фрагмента в 7-ое положение три-
Гладко протекает реакция литиевых произво-
азолопиридина, хотя достигаемые выходы обычно
дных с этилтрифторацетатом, при этом образу-
невысоки (10-61%).
Схема 12
PhO2S
N
F
Li
N
N
N
BuLi
PhO2S
N
N N
N
N
N THF
THF
N N
N N
N N
-40°C
N N
N
Li
F
88%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1089
Схема 13
R
R
R
1. BuLi, PhMe,
H2O
-40°C
N
N
N
2. CF3CO2Et
N N
N N
3. HCl, H2O
N N
OH
F3C
O
F3C
OH
36-86%
R = H, Me, Ph.
Схема 14
1. BuLi, PhMe, -40°C
N
R
N
R
N
2.
3. NH4Cl, H2O
Nn
Nn
4. KMnO
N
N N
N N
4
10-61%
R = H, Me, Ph,
N
N
N
N N
N
N
;
;
;
n
=
N
N
N
N
Получение арилборных кислот и их эфиров из
все же удалось осуществить при использовании
триазолопиридинов стало важным шагом функ-
эфира арилборной кислоты, однако выход оказал-
ционализации данного типа гетероциклических
ся весьма низким (схема 16).
систем, поскольку это позволило исследовать
Гораздо более эффективный подход для вве-
их способность вступать в реакцию Сузуки-
дения арильных групп в триазолопиридин был
Мияуры. Обработка литированных произво-
реализован путем проведения реакции Сузуки-
дных триазолопиридинов триизопропилборатом
Мияуры с участием 7-бром- и 3-иодтриазолопири-
позволяет получать арилборные кислоты и их
динов и различных арилборных кислот [40]. При
эфиры с препаративными выходами (схема 15)
использовании стандартных условий были достиг-
[39].
нуты высокие выходы продуктов кросс-сочетания
(схема 17).
Синтезированные арилборные кислоты ока-
зались проблемными субстратами для реак-
Были проведены попытки ввести в реакцию
ций кросс-сочетания. Так, проведение реакции
кросс-сочетания различные Cd-металлированные
Сузуки-Мияуры с 4-иоданизолом в присутствии
по 7 положению триазолопиридины (схема 18). С
Pd(PPh3)4 привело к образованию лишь продукта
помощью данного подхода получена серия про-
протодеборирования [39]. Аналогичную реакцию
дуктов сочетания с 2-бромпиридином, при этом
Схема 15
R
R
1. BuLi, PhMe, -40°C
N
N
2. B(Oi-Pr)3
N N
3. HCl, H2O или
N N
пинакон, AcOH
BX2
R = H, Me, 2-Py.
BX2 = B(OH)2 (40-78%) или Bpin.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1090
КОТОВЩИКОВ и др.
Схема 16
ArI, 4-5% Pd(PPh3)4
K3PO4 или Ba(OH)2
N
N
+
N N
диоксан или DMF
N
N N
N
H2O, 70-100°C
N
Bpin
Ar
10-20%
55-70%
Схема 17
ArB(OH)2 (1.2 экв)
4-5% Pd(PPh3)4
N
N
Na2CO3
N N
N N
диоксан, 85°C
Br
Ar
52-96%
I
ArB(OH)2 (1.2 экв)
Ar
4-5% Pd(PPh3)4
N
Na2CO3
N
диоксан, 85°C
N N
N N
27-81%
оказалось, что выходы сильно зависят от природы
региоселективность данной реакции в случае не-
заместителя в 3 положении [35].
симметричных ацетиленов. Предполагаемый ме-
ханизм включает в себя предварительную коорди-
Функционализация CH-связей, катализируе-
нацию триазолопиридина с кислотой Льюиса и Ni-
мая комплексами переходных металлов, - одно
катализируемую CH-активацию (схема 19). После
из приоритетных направлений в химии триазоло-
координации никелевого комплекса с алюминатом
пиридинов в последнее время. Алкенилирование
и окислительного присоединения происходит кар-
триазолопиридинов было исследовано в усло-
бометаллирование тройной связи, региоселектив-
виях Ni-катализа в присутствии кислот Льюиса
ность которого определяется стерическими факто-
(схема 19) [41]. В качестве алкенилирующих аген-
рами.
тов были использованы различные алкил- и арил-
замещенные ацетилены. Оптимизация на примере
Триазолопиридиновый фрагмент может высту-
реакции с дифенилацетиленом показала, что наи-
пать направляющей группой для региоселектив-
более эффективной системой является Ni(COD)2 с
ной активации CH-связей фенильного заместителя
PPh3 в качестве лиганда и AlMe3 в качестве кисло-
в 3-ем положении. В 2019 г. был предложен подход
ты Льюиса. C высокими выходами до 97% были
для ацетоксилирования триазолопиридинов при
получены продукты алкенилирования ряда заме-
действии карбоновых кислот в условиях паллади-
щенных триазолопиридинов, а также исследована
евого катализа (схема 20) [42]. Среди недостатков
Схема 18
R
R
CdLi, THF, rt
1. (TMP)3
N
N
N
2. 3% Pd(OAc)2, 4% dppf,
N
N
2-бромпиридин, ∆, 18 ч
N N
26-67%
R = H, Me, Ph.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1091
Схема 19
R
X
RS
R
10% Ni(COD)2
X
10% PPh3
N
N
+
N
N
AlMe3 (1.2 экв)
N
N
RL
PhMe, 70°C
RS
RL
R = H, Me, Ph; RS = Me, Et; RL = i-Pr, Ar.
51-97%
N
RS
N
N
N N
N
[Ni]
AlMe3
AlMe3
H
H
RS
RL
RL
N
N N
N
RS
N N
H AlMe2
AlMe
3
[Ni]
H
[Ni]
Me
R
S
RL
RL
N
RS
N N
AlMe3
Ni
H
RL
PPh3
метода можно отметить жесткие условия (120°C,
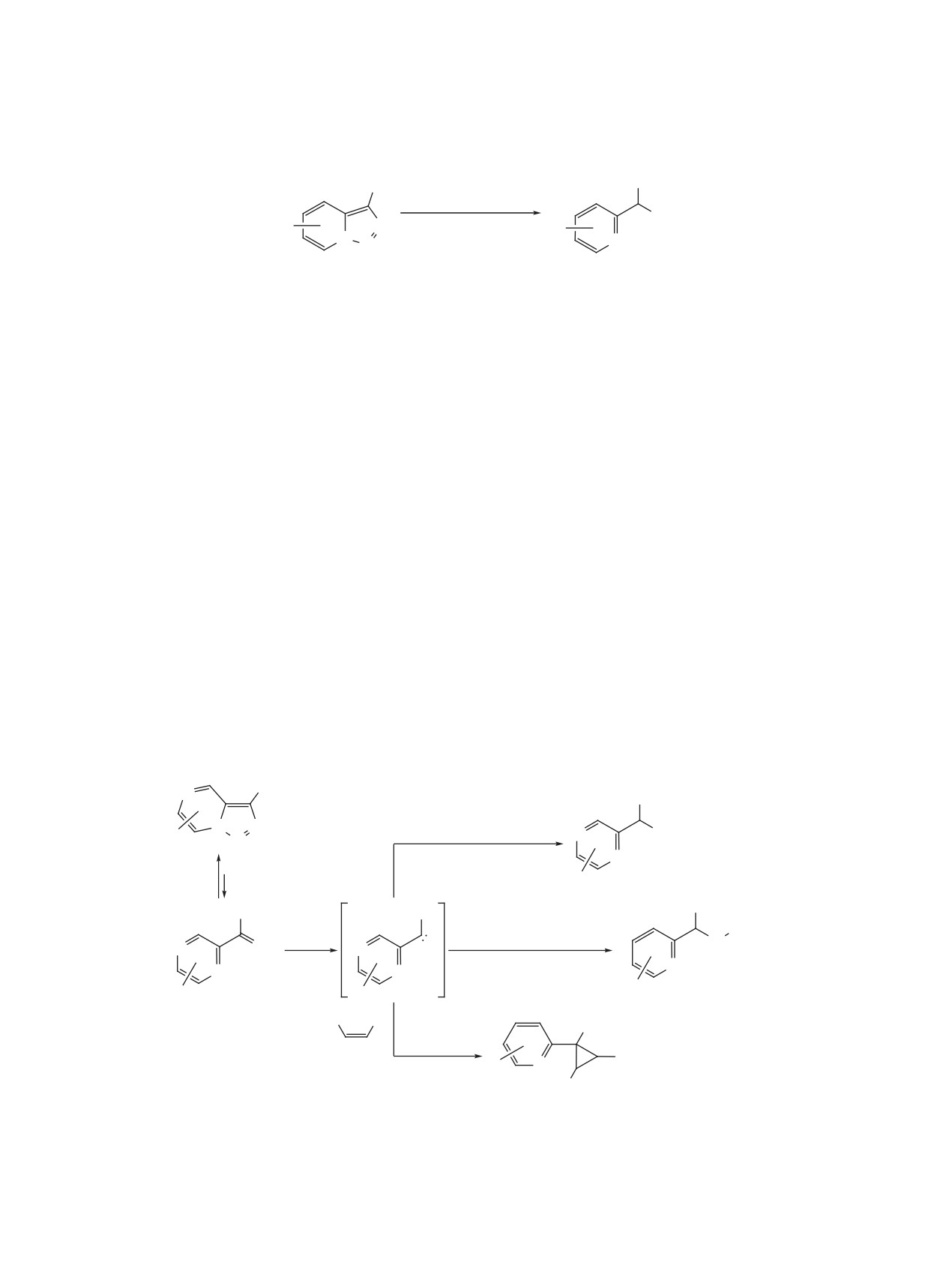
ТАУТОМЕРИЯ ТРИАЗОЛО[1,5-а]ПИРИДИНОВ
24 ч), а также необходимость использования сте-
Характерной особенностью триазоло[1,5-a]пи-
хиометрических количеств фенилиодозоацетата в
ридинов является склонность к раскрытию триа-
качестве окислителя. Тем не менее, он применим
зольного цикла с образованием (2-пиридил)диазо-
к достаточно широкому кругу алифатических кар-
метанов (схема 21). Как правило, это таутомерное
боновых кислот и дает стабильно высокие выходы.
равновесие сильно смещено в сторону триазола,
Легкость гидролиза полученных сложных эфиров
при действии K2CO3 в метаноле делает вполне до-
и количество диазоформы слишком мало для об-
ступными и соответствующие фенольные произ-
наружения спектральными методами. Известны
водные.
лишь редкие примеры родственных гетероцикли-
Схема 20
X
X
3% Pd(Ph3P)4
N
3 экв RCO2H
N
O R
1.5 экв PhI(OAc)2
N N
N N
DCE, 120°C, 24 ч
O
68-86%
X = H, Cl.
R = алкил, циклоалкил, Ad.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1092
КОТОВЩИКОВ и др.
Схема 21
N
N
N N
N
N
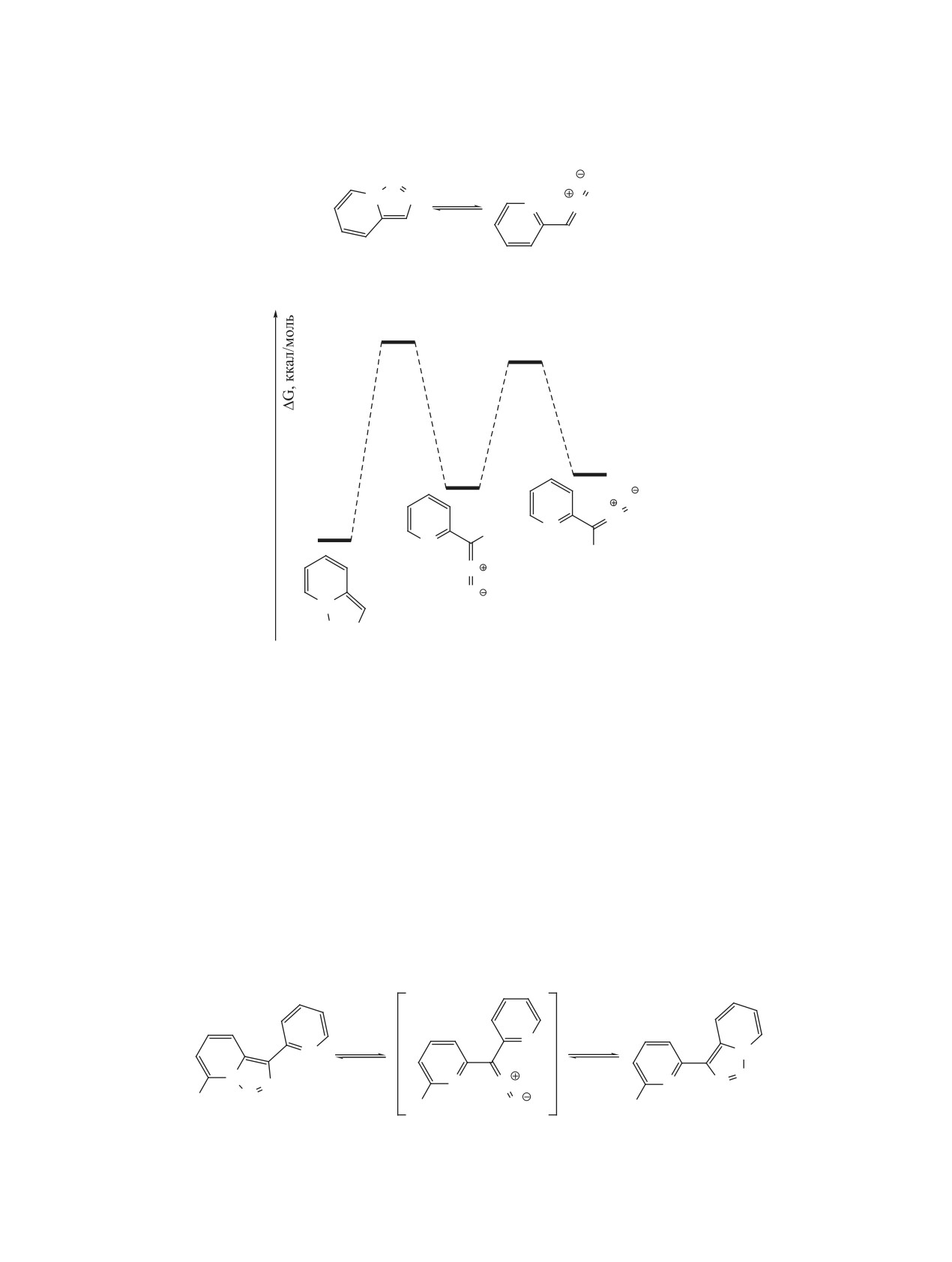
Схема 22
B3LYP/6-31G*
17
15
5.2
4.6
N
N
0
N
H
N
H
N
N
N
N N
ческих систем, к примеру, триазоло[1,5-a]пирими-
(2-пиридил)диазометана являются менее стабиль-
дин, для которых диазоформа легко наблюдается в
ными по сравнению с циклической формой на
растворе, а иногда и является преобладающей [43,
~5 ккал/моль.
44]. Поскольку повышение температуры способ-
Склонность триазол-конденсированных систем
ствует электроциклическому раскрытию, зафик-
к раскрытию цикла может сильно зависеть от при-
сировать диазоформу триазолопиридина удалось с
помощью ИК-спектроскопии путем флэш-пироли-
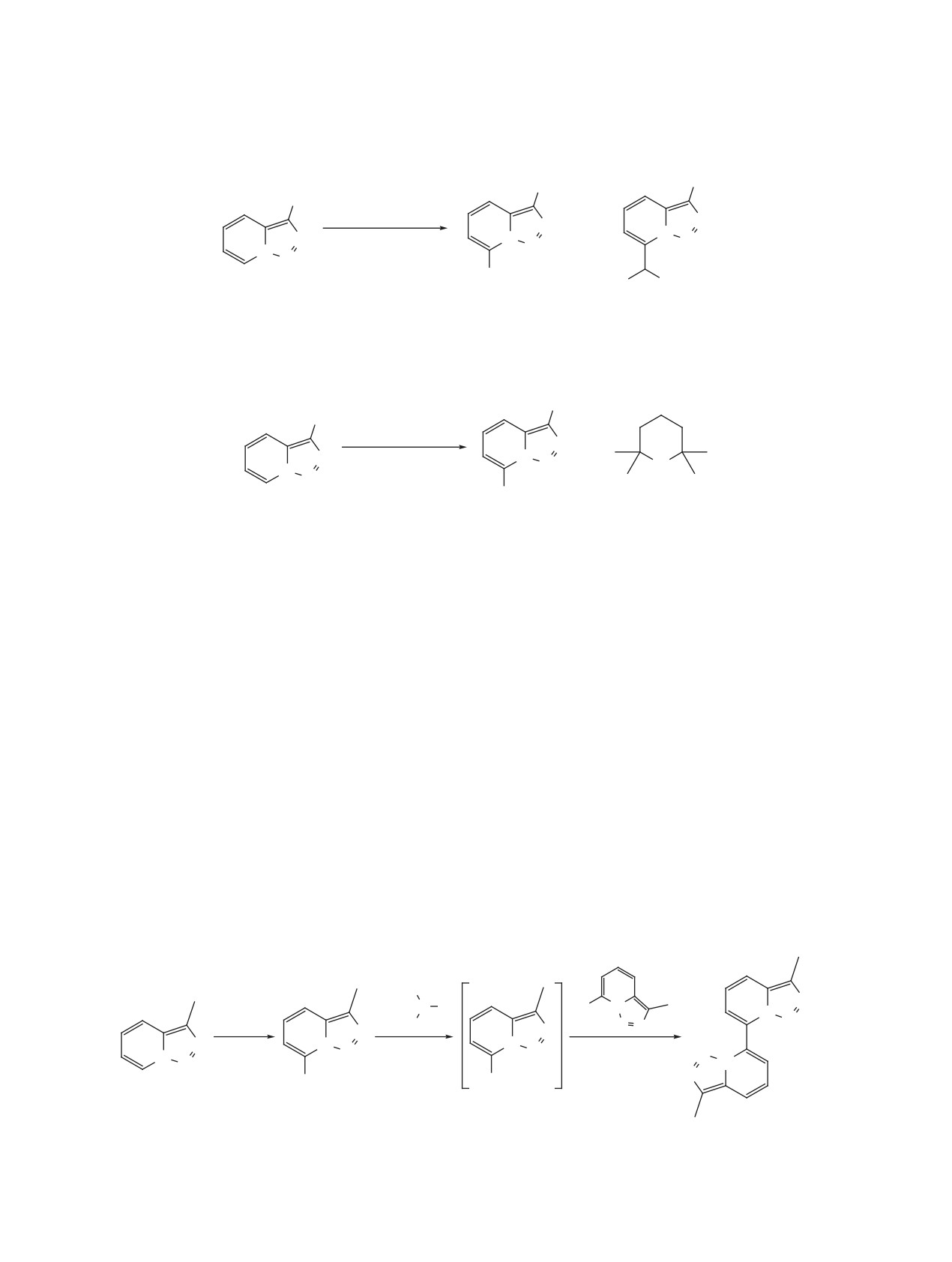
роды заместителей. Так, в 2005 г. таутомерное рав-
за в вакууме при температуре 400°C и последую-
новесие триазолопиридинов было исследовано на
щего резкого охлаждения [45].
примере изомеризации производных, содержащих
в 3-м положении 2-пиридиновый фрагмент (схе-
Квантовохимическое моделирование процес-
ма 23) [46]. Выяснилось, что электронодонорные
са таутомеризации триазолопиридина с помощью
теории функционала плотности показало, что
заместители в 7-м положении смещают равнове-
барьер раскрытия триазольного кольца составля-
сие в сторону изомера A, а электроноакцептор-
ет ~17 ккал/моль (схема 22) [45]. Оба ротамера
ные - в сторону изомера B.
Схема 23
N
N
N
N
N
N
N N
N
N
R
N
R
N
R
A
B
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1093
Схема 24
H
E
E
H E
E+
Nu-
N
N
2
Nu
N
-N2
N N
N
N
N
N
С помощью квантовохимических расчетов
зовании исходной кислоты в качестве растворите-
(B3LYP/6-31+G**) была произведена оценка вли-
ля.
яния природы заместителей на энергетические
Более обширную работу, посвященную реакци-
параметры таутомеризации [33]. В то время как
ям раскрытия триазольного кольца в триазолопи-
существенного эффекта не наблюдается от групп
ридинах, позже опубликовал Джонс с сотр. [48].
в положениях 4, 5 и 6, значительное влияние ока-
При действии разбавленной серной кислоты были
зывают заместители в положениях 3 и 7. Наиболее
получены
2-пиридинилкарбинолы, бромирова-
важным в практическом отношении является тот
ние привело к образованию дигалогенметилзаме-
факт, что наличие атома галогена в положении 7
щенных пиридинов, а нагревание в присутствии
снижает энергию активации для раскрытия триа-
диоксида селена - к соответствующим кетонам
зола и уменьшает разницу в энергиях таутомеров,
(схема 26).
смещая тем самым равновесие в сторону диазои-
мина. Для 7-фторпроизводного диазоформа оказы-
При увеличении температуры таутомерное
вается даже более стабильна по сравнению с триа-
равновесие смещается от триазолопиридина в
золопиридином на ~3 ккал/моль.
сторону диазоиминной формы, которую можно
перехватывать диполярофилами. Впервые данный
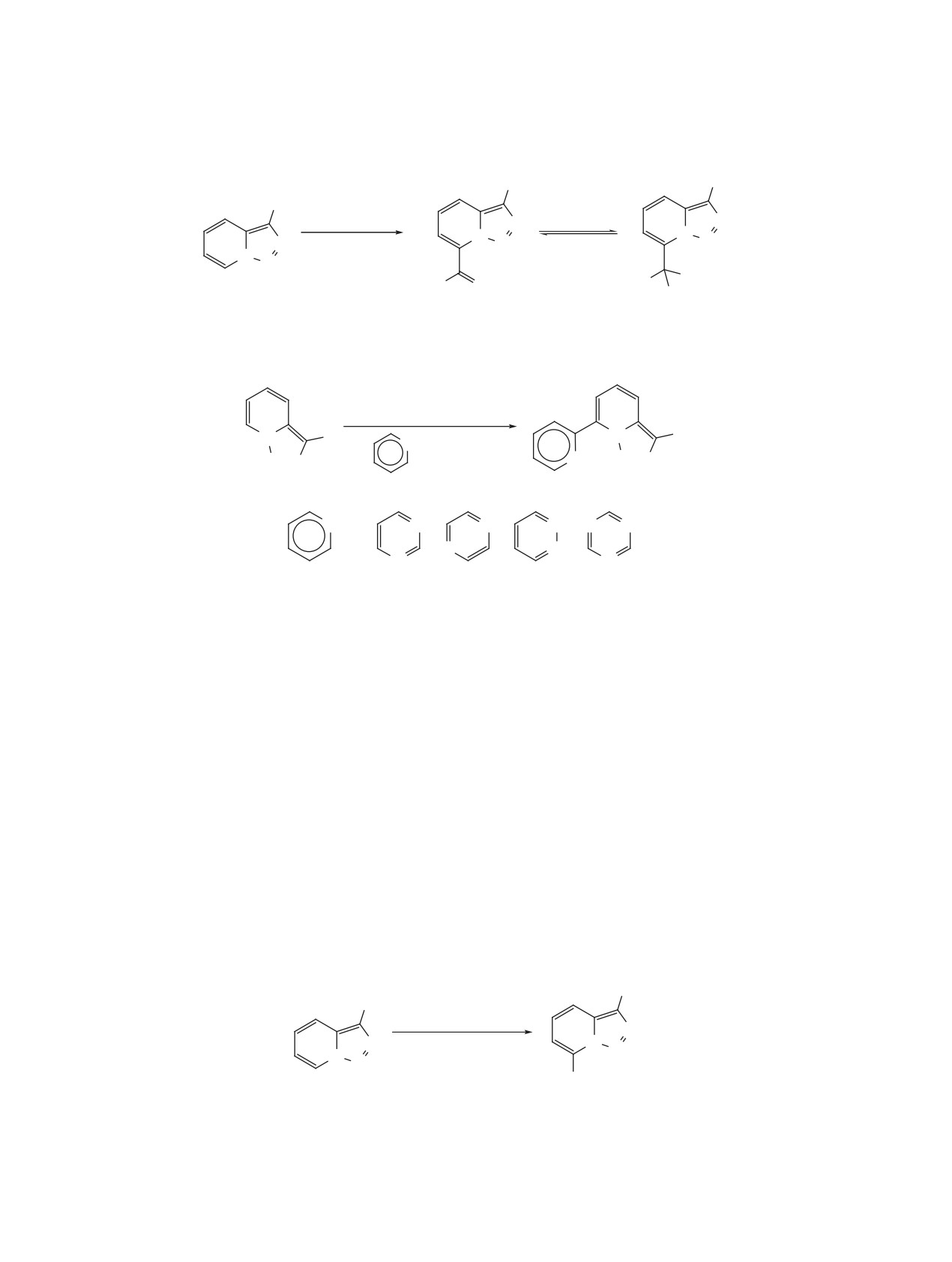
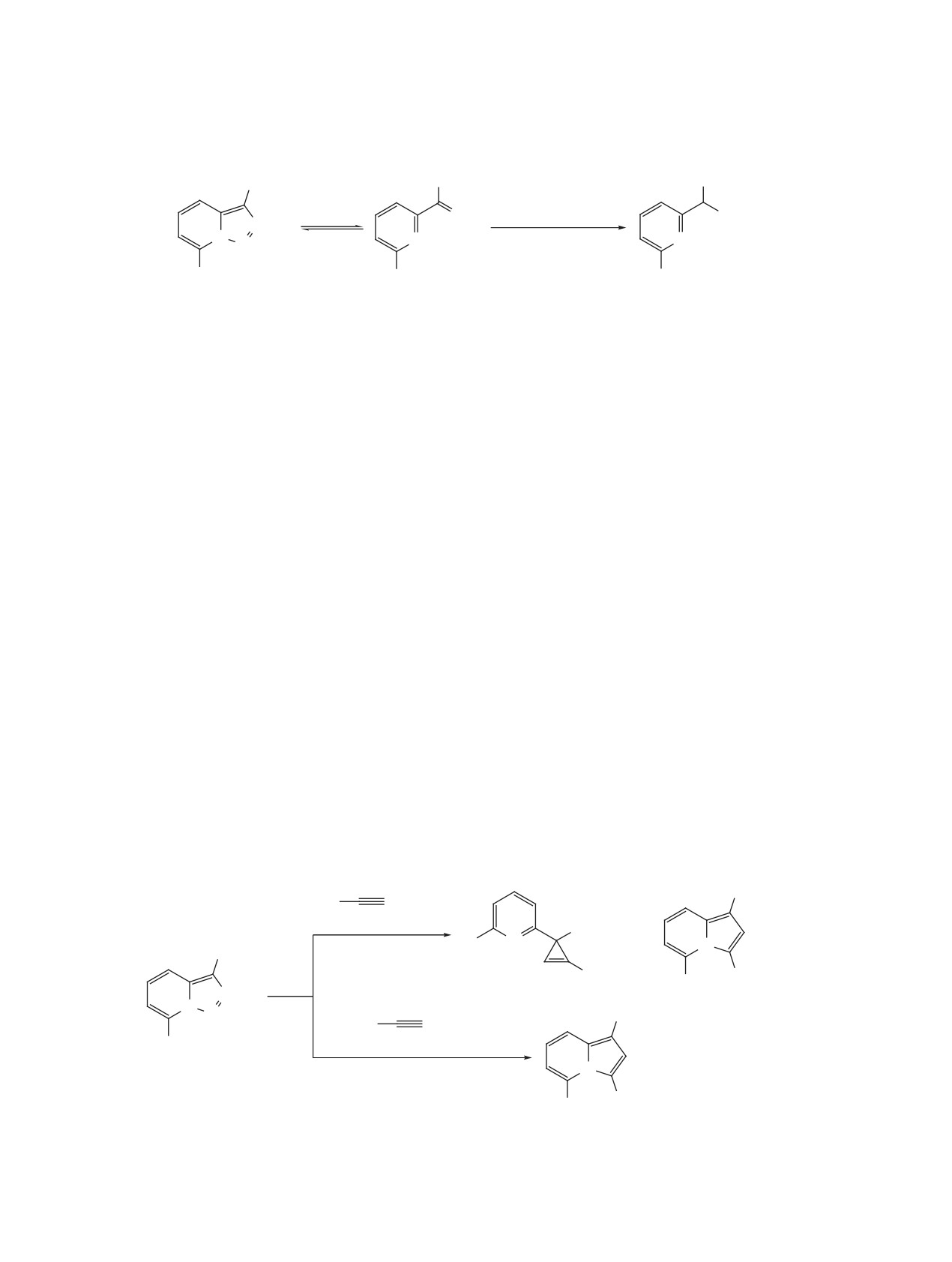
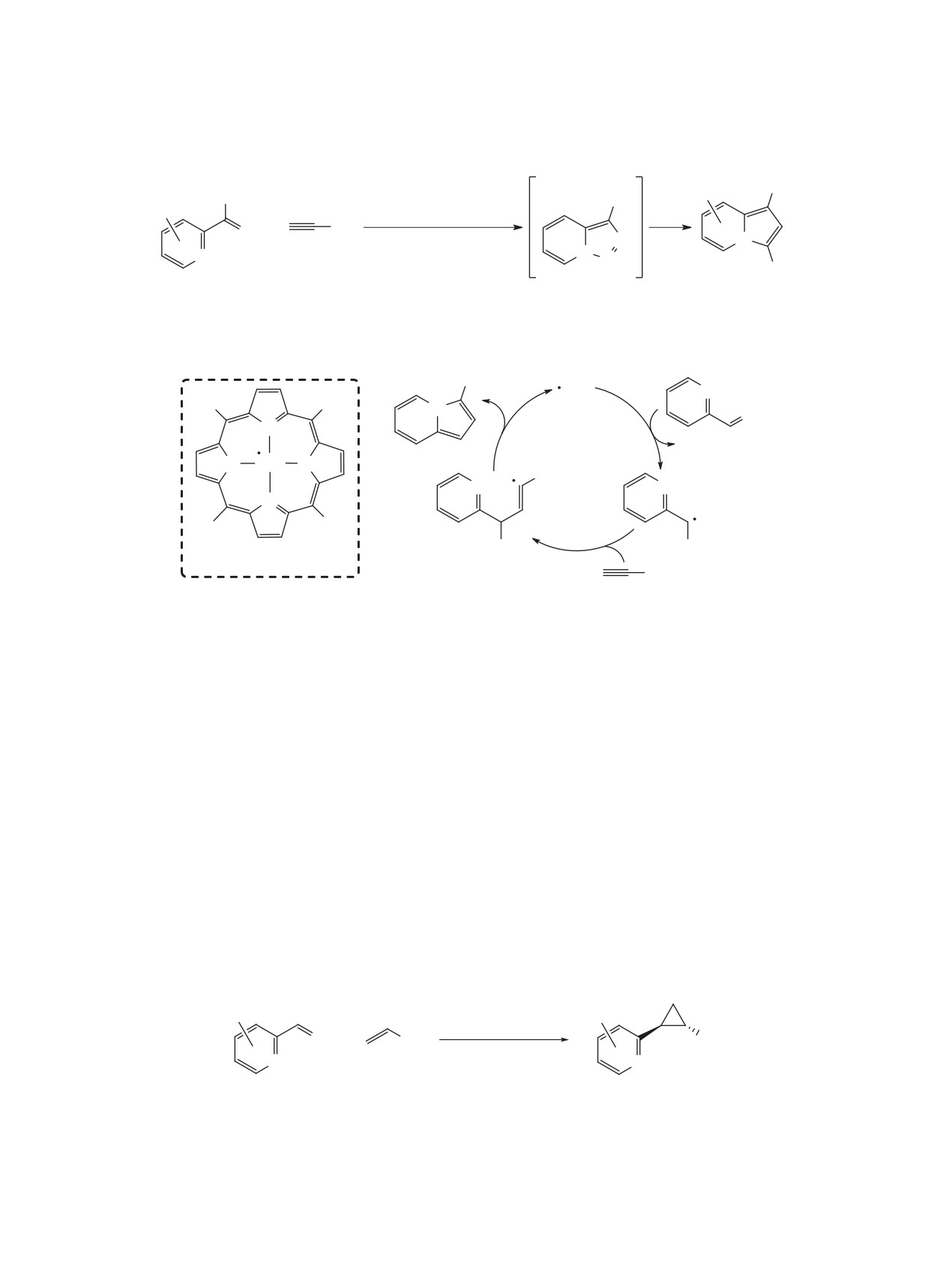
РАСКРЫТИЕ 1,2,3-ТРИАЗОЛА
процесс был описан в работах Вентрапа при на-
В НЕКАТАЛИТИЧЕСКИХ РЕАКЦИЯХ
гревании триазолопиридина в растворе дифени-
Раскрытие триазольного цикла триазоло[1,5-a]-
лового эфира в присутствии большого избытка
пиридинов с высвобождением молекулы азота мо-
фумаронитрила (схема 27) [49, 50]. Первоначально
жет происходить под действием различных реа-
образующийся пиразолин не удается зафиксиро-
гентов. В частности, подобные процессы довольно
вать из-за быстрого разложения, приводящего к
часто протекают в реакциях с электрофильными
соответствующему циклопропану в виде смеси
агентами (схема 24). Атака электрофила в 3 поло-
диастереомеров. Автор исключает возможность
жение приводит к разрыву связи N1-N8 и образо-
образования карбена, поскольку заметное разло-
ванию катиона диазония, вступающего в реакцию
жение триазолопиридина в отсутствие фумарони-
нуклеофильного замещения.
трила происходит при более высокой температуре
(180 вместо 130°C для начала процесса).
Первое исследование реакций триазолопири-
динов с органическими кислотами, приводящих к
В 2016 г. Абарка и Баллестерос продолжили
образованию 2-пиколилкарбоксилатов, было про-
исследование термических реакций триазолопи-
ведено Уолфордом (схема 25) [47]. Синтез прово-
ридинов с участием электронодефицитных ди-
дился при нагревании в толуоле либо при исполь-
полярофилов [51]. (3+2)-Циклоприсоединение к
Схема 25
R1
R1
R2CO2H
O
N
90-210°C
PhMe или
N
N N
без растворителя
O
R2
19-69%
R1 = H, Ph,
R2 = Me, Et, Ar.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1094
КОТОВЩИКОВ и др.
Схема 26
Br
Br2, CCl4
Br
R1
0-5°C
N
30-80%
OH
R2
2.5M H2SO4
R2
95°C
R1
R1
N
N
N N
52-89%
O
SeO2
2
R
80-140°C
R1
N
44-100%
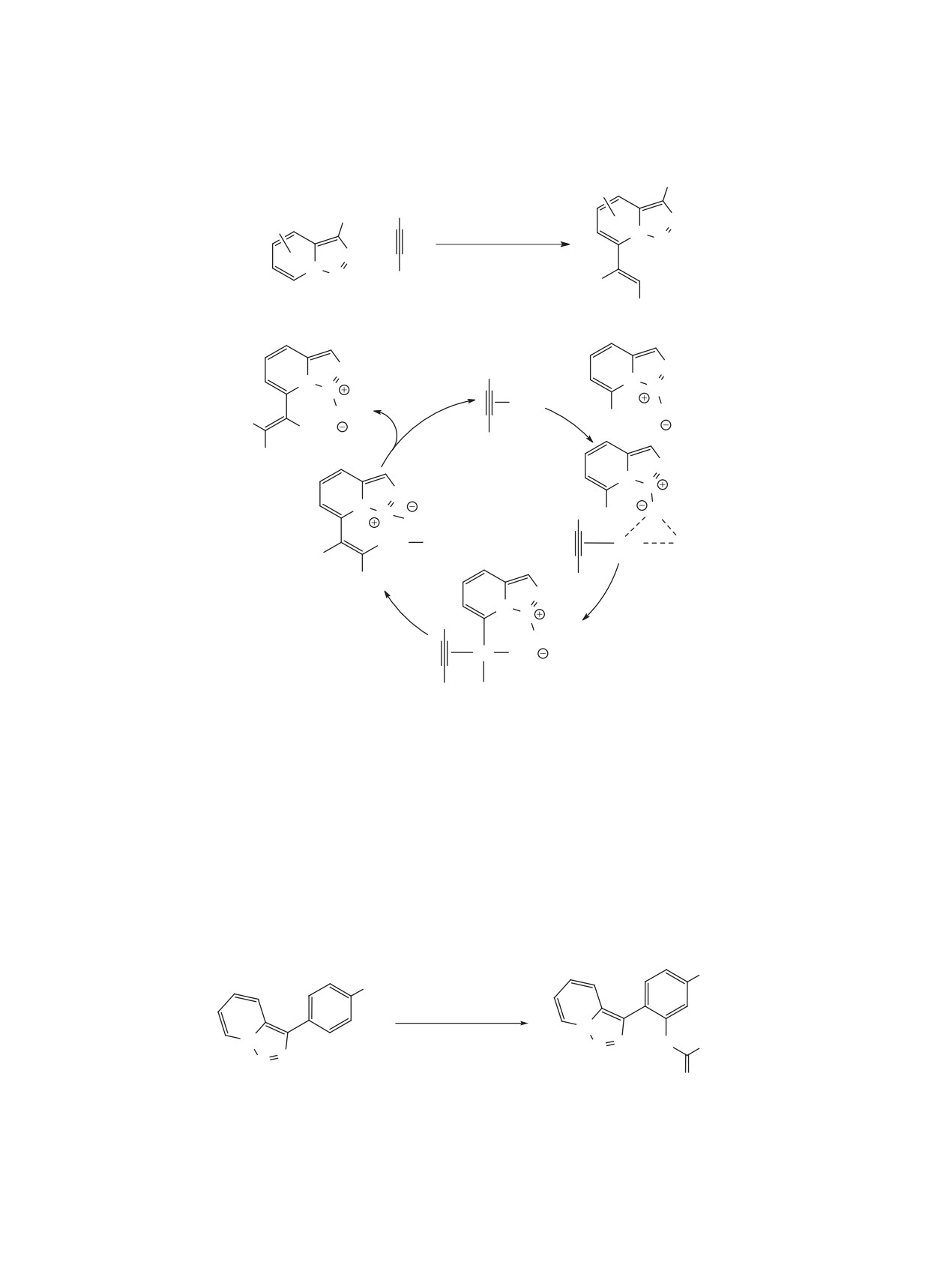
этилпропиолату протекает с умеренной региосе-
В 2019 г. было показано, что триазолопириди-
лективностью, при этом образующиеся пиразолы
ны можно использовать в качестве источников
превращаются в N-винилпроизводные в результа-
диазосоединений в реакции с арилборными кисло-
те взаимодействия с избытком алкина (схема 28).
тами для синтеза 2-замещенных пиридинов (схе-
В случае 3-метилзамещенного триазолопиридина
ма 31) [54]. Данный подход не требует катализа-
в реакции с диметиловым эфиром ацетилендикар-
тора или каких-либо добавок и с высокими вы-
боновой кислоты образуется стабильный неаро-
ходами позволяет получать продукты сочетания.
матический аддукт, в то время как при использо-
Некоторым недостатком является введение в ре-
вании этилпропиолата происходит 1,2-алкильный
акцию достаточно большого избытка арилборных
сдвиг и ароматизация гетероцикла. В аналогичных
кислот (2.5 экв). Тем не менее, в работе проде-
условиях реакция с этилакрилатом протекает бо-
монстрирована применимость метода к широко-
лее гладко и приводит с хорошими выходами (61-
му кругу арил- и гетарилборных кислот, а также к
88%) к 2-пиридилциклопропанам (схема 29).
ряду их алифатических аналогов.
Флэш-пиролиз в вакууме 3-ацилтриазолопири-
Фотохимически индуцированные превращения
динов, таутомерная форма которых представляет
триазолопиридинов начали исследовать достаточ-
собой α-диазокетон, вызывает перегруппировку
но давно, однако долгое время реакции на их ос-
Вольфа и генерацию 2-пиридилкетенов (схема 30)
нове не находили заметного синтетического при-
[52, 53]. Образовавшиеся кетены димеризуются по
менения в силу ряда ограничений, среди которых
механизму [4+2]-циклоприсоединения и превра-
невысокие выходы, низкая селективность и необ-
щаются в хинолизин-2,4-дионы с высоким выхо-
ходимость использования источников ультрафи-
дом.
олетового излучения [19, 55, 56]. Существенный
Схема 27
CN
N
N
NC
N2
CN
CN
N
164°C, Ph2O
-N2
N
CN
N N
N CN
N
32%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1095
Схема 28
CO2Et
EtO2C
CO2Et
(3 экв)
N
N
+
PhMe
N
N
CO2Et
150°C, 24 ч
CO2Et
N
N
65%
10%
N
N N
X
X
X
X
X
X
X
(3 экв)
NH
N
+
DMF
N
N
150°C, 24 ч
X
N
N
X = CO2Me
27%
19%
X
CO2Et
X
Me
X
X
Me
CO2Et
CO2Et
Me
(3 экв)
(3 экв)
N
N
N
DMF
N
PhMe
N
150°C, 24 ч
N N
150°C, 24 ч
N
N
X = CO2Me
63%
33%
прогресс в данной области был достигнут недав-
страты, содержащие в 3-м положении арильный
но в 2019 г. группой Геворгяна, обнаружившей,
или гетероароматический заместитель, которые,
что реакции с участием диазоформы триазолопи-
благодаря расширенной системе сопряжения, в
ридинов можно инициировать при облучении ви-
существенной степени поглощают излучение в
димым светом [57]. Для этой цели подходят суб-
коротковолновой области спектра при 390 нм.
Схема 29
R
R
CO2Et
(3 экв)
N
PhMe или DMF
CO2Et
N
N N
150°C, 24 ч
R = H (88%), Me (61%).
Схема 30
R
R O
R O
R
O
650-700°C
30 мин
C
N2
-N2
10-4 мбар
O
N
N
N
N
N N
O
R
O
R
C
R
R
+
N
N
C
N
N
O
O
R = Me (92%), Ph (75%).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1096
КОТОВЩИКОВ и др.
Схема 31
R2
R2
RB(OH)2 (2.5 экв)
1
R
R
N
диоксан, 100°C
R1
N
N N
40-98%
Согласно предполагаемому механизму, облучение
для генерации металлокарбеноидов, стали кар-
может вызывать экструзию молекулы азота и ге-
боксилаты родия(II). В частности, в 2007 г. было
нерацию 2-пиридилкарбена, вступающего в даль-
показано, что таутомерную форму триазолопи-
нейшие превращения. Данный подход успешно
ридина можно перехватывать триэтилсиланом в
использован для осуществления кросс-сочетания
присутствии Rh2(OAc)4 (схема 33) [58]. Несмотря
с арилборными кислотами, циклопропанирования
на то, что сложноэфирная группа в 3 положении
олефинов, а также внедрения карбенов в OH-связь
стабилизирует диазоиминную форму, оказалось,
спиртов, фенолов и карбоновых кислот и NH-связь
что этого недостаточно для осуществления Rh-
сульфонамидов и фталимида (схема 32). Все опи-
катализируемой реакции. Образование целевого
санные превращения протекают в очень мягких
продукта наблюдается лишь при наличии атома
условиях в растворе бензола при комнатной тем-
галогена в 7 положении, необходимого для увели-
пературе.
чения концентрации диазоформы в равновесии.
МЕТАЛЛ-КАТАЛИЗИРУЕМЫЕ РЕАКЦИИ
Более привлекательными с синтетической точ-
ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
ки зрения оказались каскадные процессы, приво-
дящие после первоначального раскрытия триазола
КАТАЛИЗАТОРЫ НА ОСНОВЕ Rh(II)
и взаимодействия с дополнительными реагента-
Применение металлокомплексного катализа
ми к циклизации с образованием новой конден-
вдохнуло новую жизнь в химию триазолопириди-
сированной гетероциклической системы. Данная
нов. Данные исследования были инициированы
стратегия стала приоритетным направлением в
циклом работ, выполненных в группе Геворгяна.
современной химии триазолопиридинов, получив
Первыми катализаторами, использованными
название трансаннелирование (transannulation).
Схема 32
Ar
X
Ar
N
N
R
R1B(OH)2 (1.5 экв)
X
R1
N
K2CO3, PhH, rt
N
390 нм
R
LED
30-94%
Ar
Ar
Ar
390 нм
R2
LED
R2YH (4 экв)
Y
X
N2
X
-N2
PhH, rt
N
N
N
R
R
R
Y = O (47-80%)
R4
R3
Ar
OC(O) (60-65%)
(3 экв)
3
NSO2R (40-90%)
R
PhH, rt
R
N
R4
30-99%
X = CH, N.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1097
Схема 33
CO2Me
CO2Me
CO2Me
1% Rh2(OAc)4
Et3SiH (2 экв)
N2
SiEt3
N
N
CH2Cl2, rt, 2 ч
N
N N
X
X
X
X = H (0%)
Cl (88%)
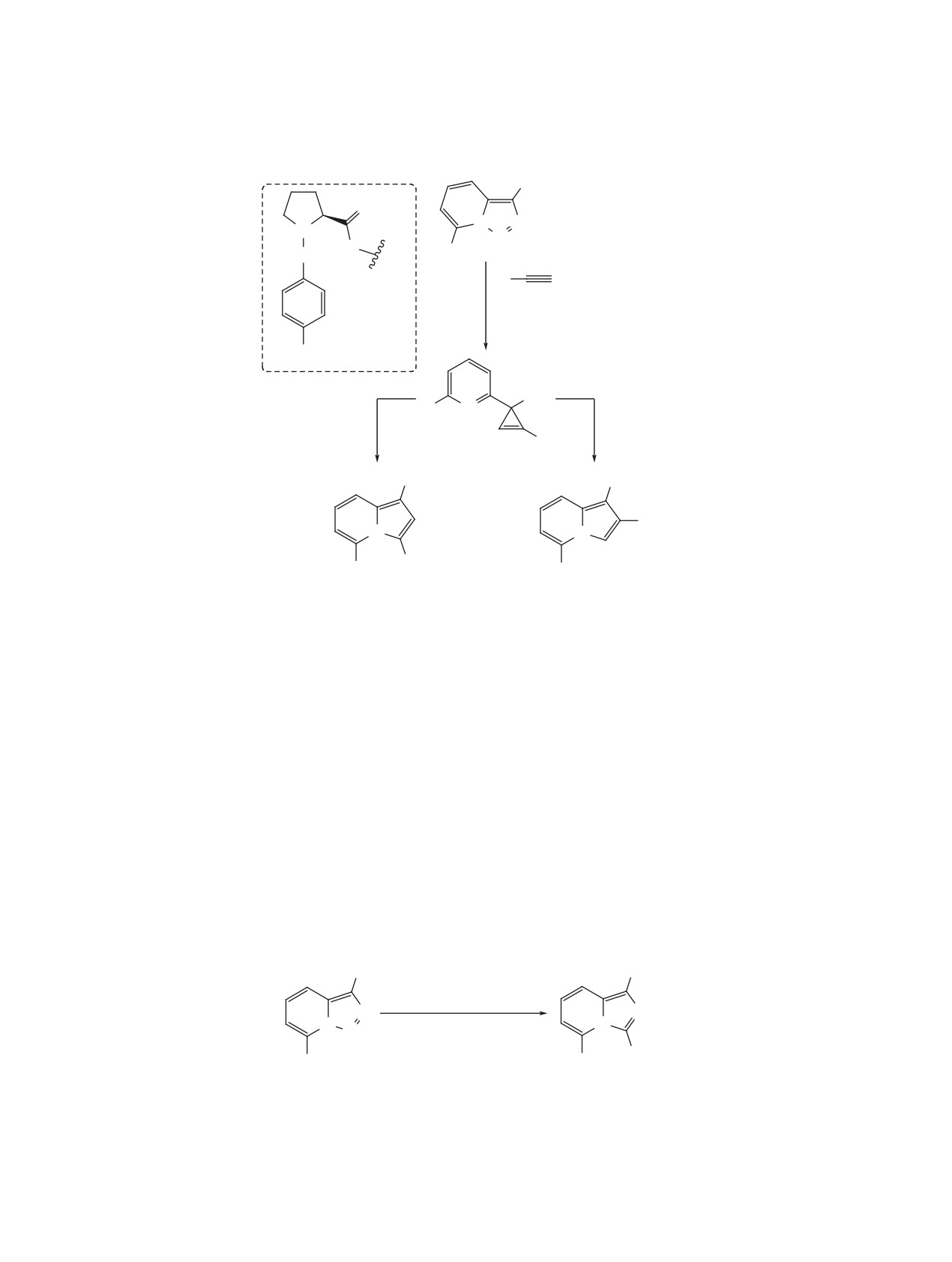
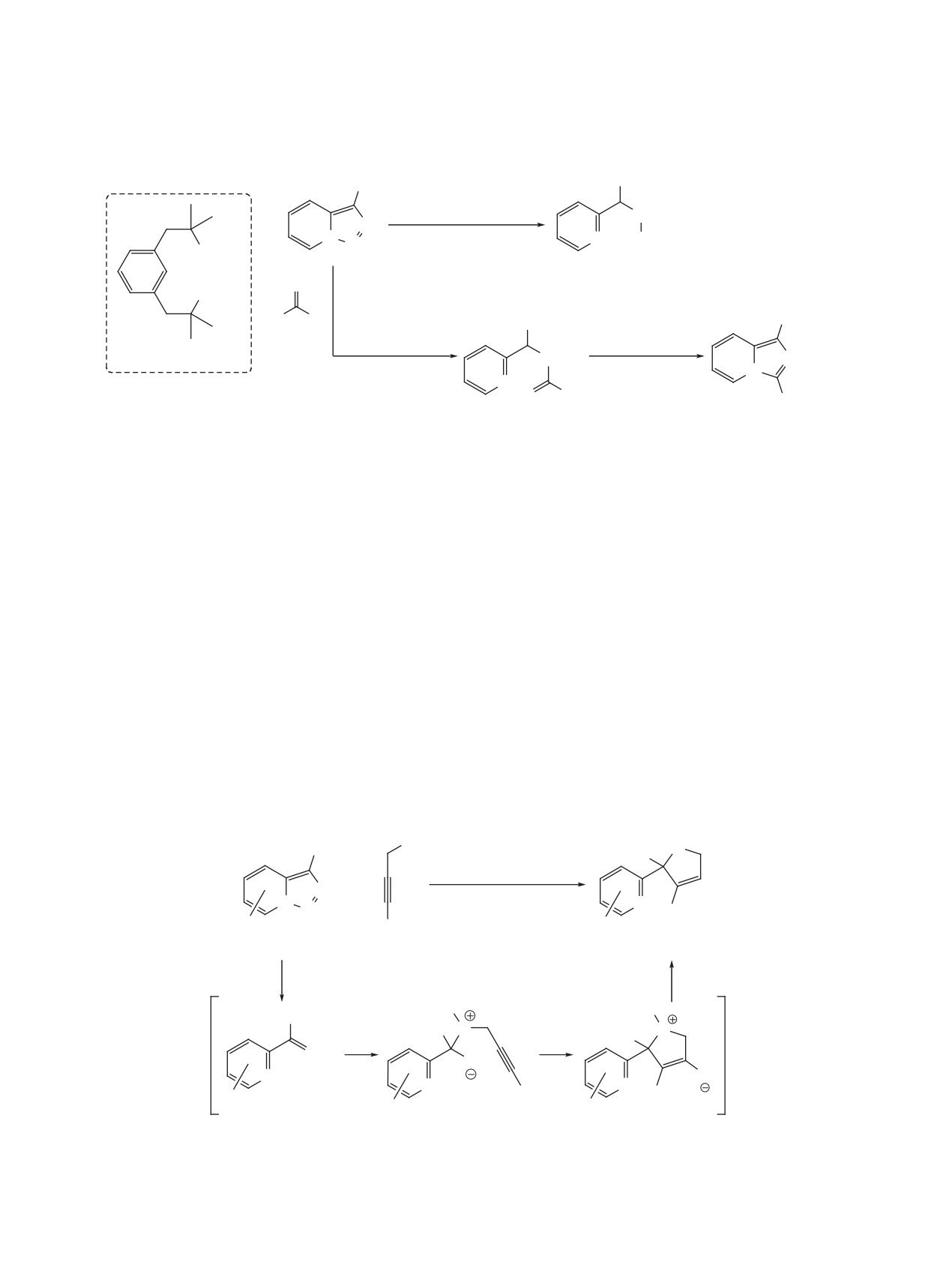
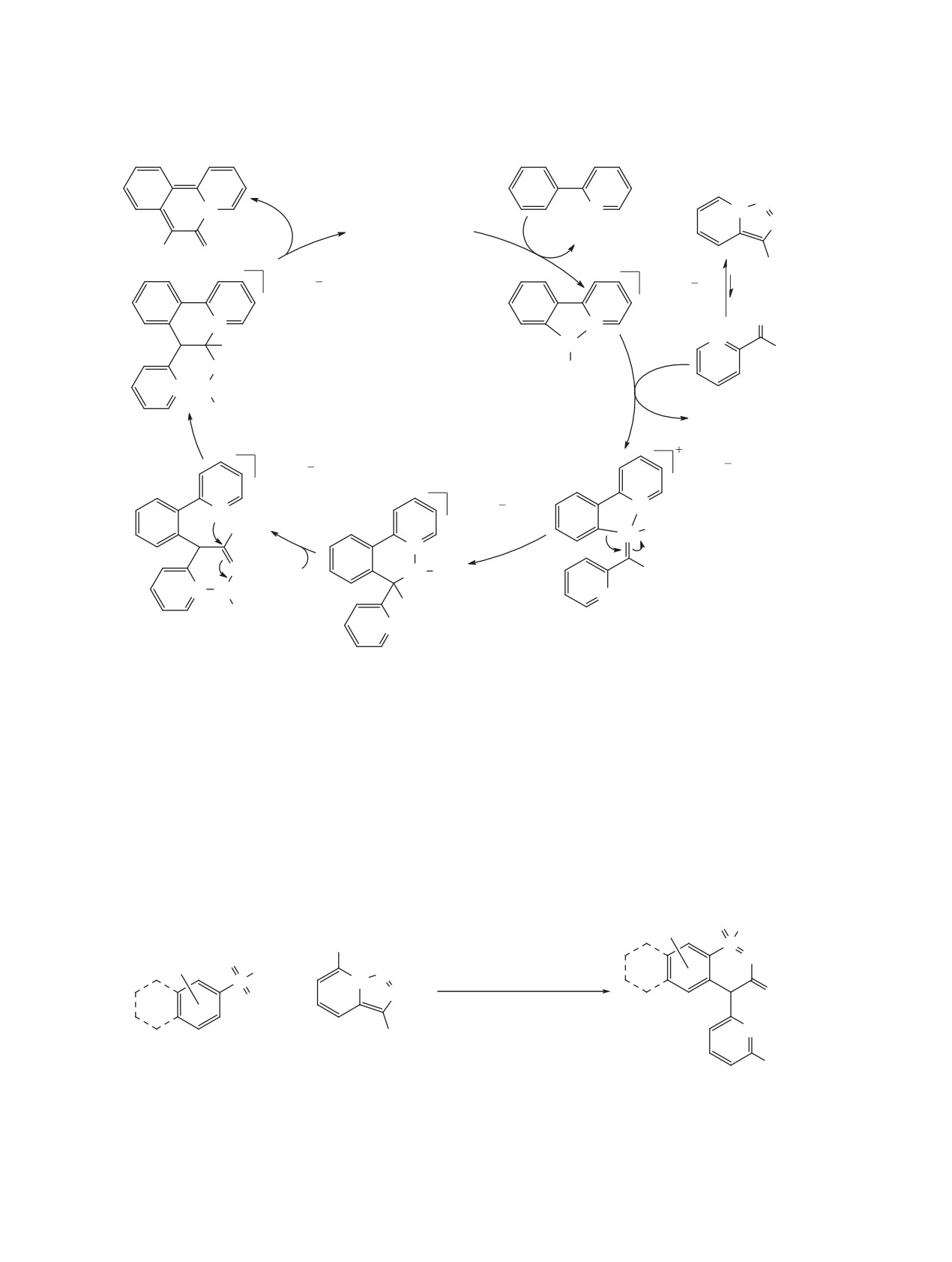
Первая попытка реализации подобного подхода
данного дивергентного подхода являются исклю-
заключалась в превращении триазольного цикла в
чительная региоселективность и высокие выходы
пиррольный в результате реакции родиевого кар-
на стадии циклоизомеризации, а также примени-
беноида с избытком фенилацетилена (схема 34)
мость, в том числе, к алифатическим алкинам.
[58]. Однако использование Rh2(OAc)4 приводило
Другим примером Rh-катализируемого тран-
к смеси целевого индолизина и изомерного пири-
саннелирования является взаимодействие триазо-
дилциклопропена. Замена катализатора на более
лопиридинов с нитрилами, в результате которого
электрофильный гептафторбутират родия(II) по-
триазольный цикл превращается в имидазольный
зволила повысить хемоселективность процесса и
(схема 36) [58]. Реакция протекает в толуоле в при-
получить индолизины с хорошими выходами (57-
сутствии 1% Rh2(OAc)4 при температуре 60°C и
85%). Метод был успешно применен к терминаль-
приводит к имидазо[1,5-a]пиридинам с выходами
ным винил- и арилацетиленам, однако оказался
51-89%. Стоит отметить широкий круг возмож-
неэффективен в случае алифатических 1-алкинов.
ных субстратов, среди которых арил-, алкил- и ал-
позво-
Применение катализатора Rh2(S-DOSP)4
кенилнитрилы.
лило изменить направление реакции триазолопи-
Предполагается, что трансаннелирование
ридинов с терминальными ацетиленами и осуще-
ствить селективный синтез пиридилзамещенных
с участием ацетиленов и нитрилов протекает
циклопропенов (схема 35) [59]. Кроме того, были
по аналогичным механизмам (схема
37)
[58].
найдены мягкие условия для перегруппировки по-
Таутомеризация триазолопиридина приводит к
лученных соединений в региоизомерные индоли-
раскрытию триазольного кольца и образованию
зины. Так, в присутствии катализатора Уилкинсона
диазоимина, который при действии карбоксилата
происходит образование 1,3-дизамещенных ин-
родия теряет молекулу азота. Дальнейшие пре-
долизинов, а при использовании CuI образуются
вращения родиевого карбеноида могут осущест-
1,2-дизамещенные изомеры. Преимуществами
вляться двумя путями (A и B). Первый (путь A) -
Схема 34
CO2Me
Ph
(3 экв)
1% Rh2(OAc)4
CO2Me
+
CH2Cl2, rt, 2 ч
Cl
N
N
CO2Me
Ph
Ph
Cl
N
68%
28%
N N
CO2Me
R
(3 экв)
Cl
1% Rh2(C3F7CO2)4
CH2Cl2, rt, 3.5 ч
N
R = Ar, циклогекс-1-енил.
R
Cl
57-85%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1098
КОТОВЩИКОВ и др.
Схема 35
R1
X = Cl, Br
O
R1 = Ar, CO2Me
N N
N
N
R2 = Ar, алкил
O
O S O
X
R2
(3 экв)
0.25%
S-DOSP
Rh2(S-DOSP)4
PhMe, rt, 6 ч
(CH2)10-12CH3
R1
X
N
2% Rh(PPh3)3Cl
5% CuI
DMF, rt, 24 ч
DMF, rt, 10 ч
R2
45-93%
R1
R1
R2
N
N
R2
X
X
79-93%
67-95%
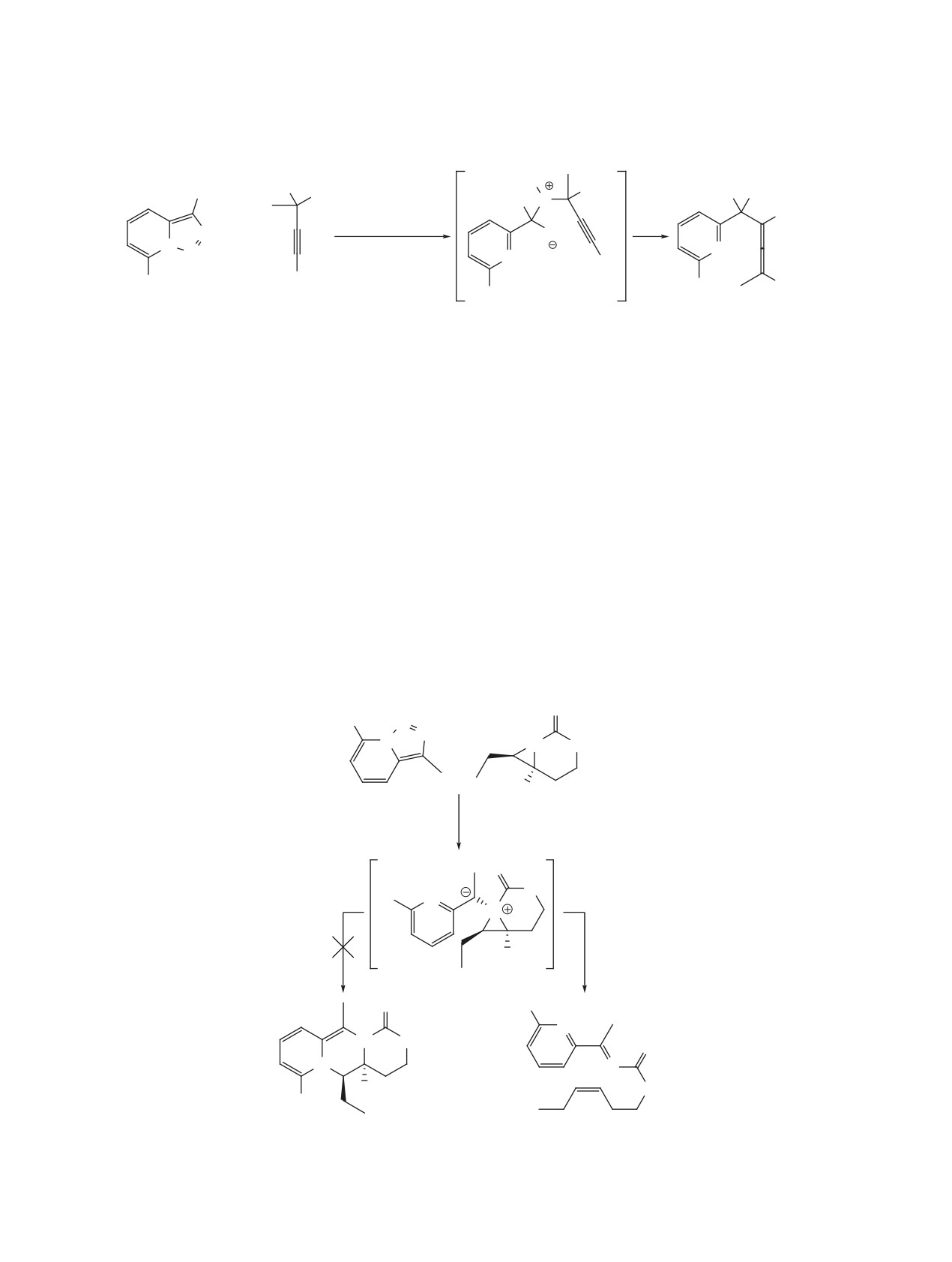
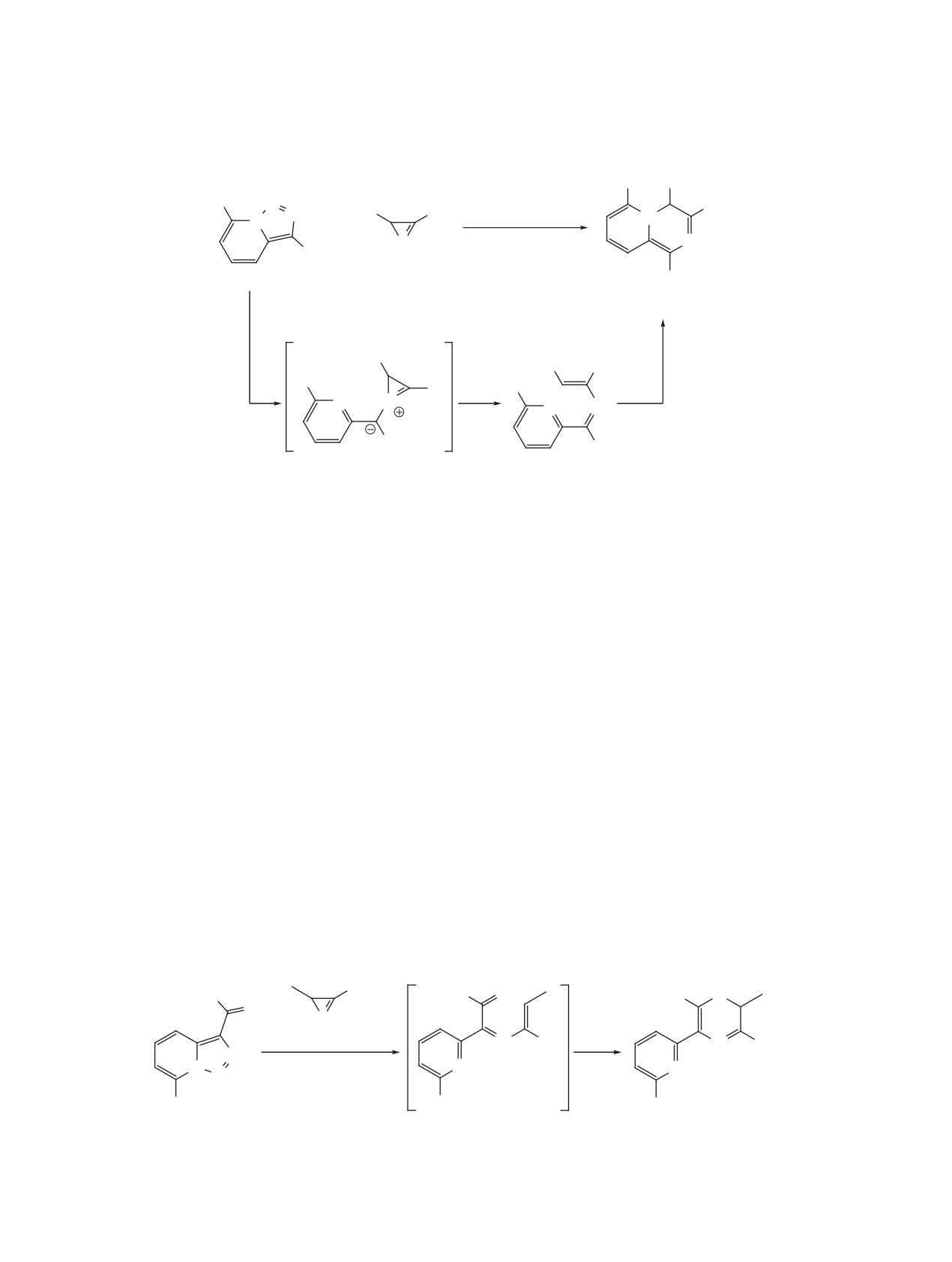
нуклеофильная атака нитрила или алкина, в ре-
быстрая стадия восстановительного элиминирова-
зультате которой образуется бетаин, претерпе-
ния, ведущая к циклопропену.
вающий гетероциклизацию в имидазопиридин
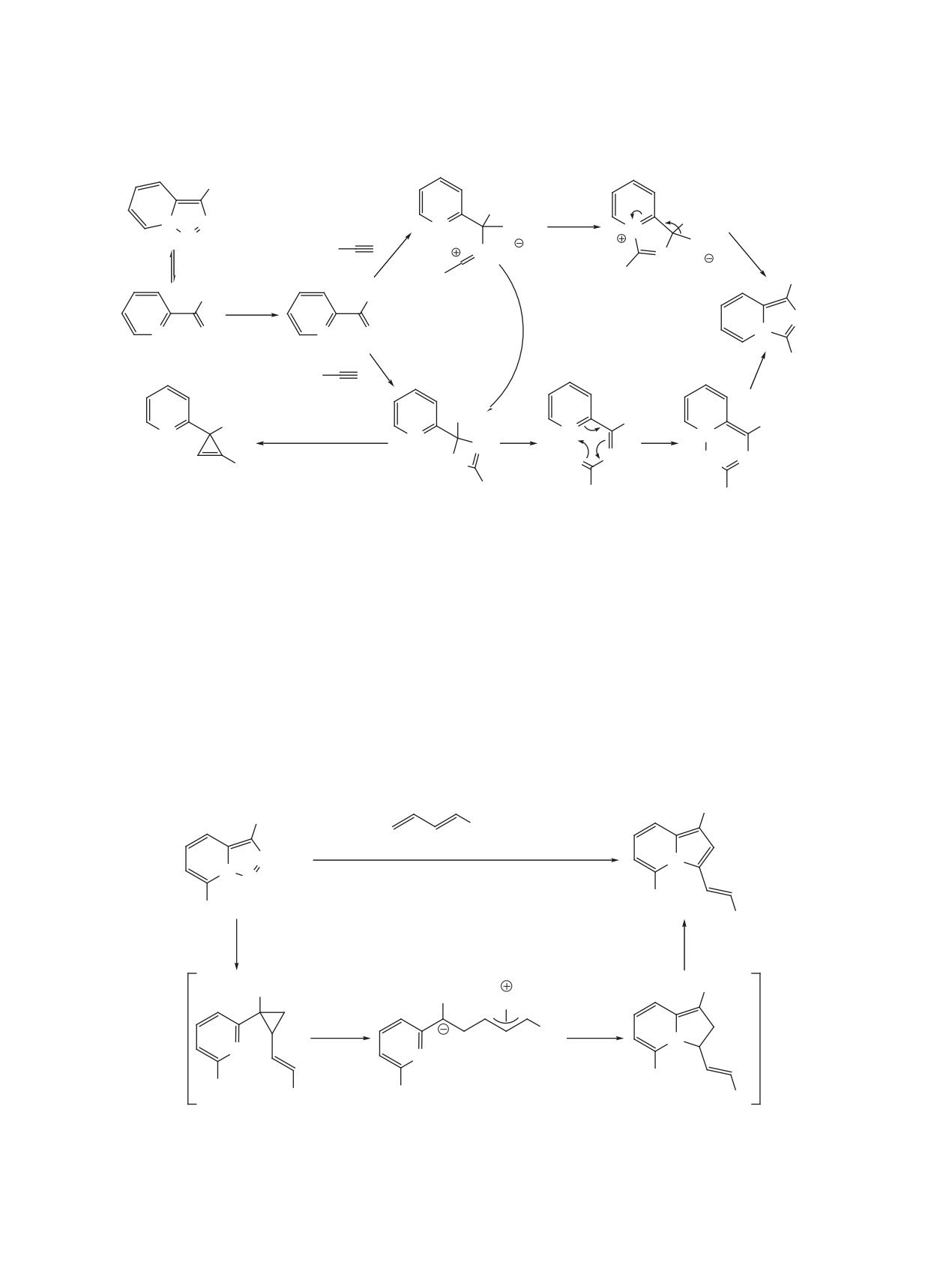
Превращение триазолопиридинов в 3-винилин-
или индолизин соответственно. Второй механизм
долизины было осуществлено с помощью 3-хста-
(путь B) начинается с [2+2]-циклоприсоединения.
дийного one-pot процесса с участием сопряжен-
Далее металлациклобутен, который также может
ных диенов (схема 38) [61]. На первой стадии в
образовываться из бетаина, раскрывается в роди-
присутствии октаноата родия(II) происходит ци-
евый карбеноид, после чего происходит 6π-элек-
клопропанирование концевой двойной связи дие-
троциклизация и восстановительное элиминиро-
на. Далее при катализе Pd(Ph3P)4 полученный ви-
вание. В 2017 г. было проведено квантовохимиче-
нилциклопропан вступает в перегруппировку, со-
ское исследование альтернативных механизмов,
провождающуюся промежуточным образованием
подтвердившее реализуемость пути A с участием
аллильного комплекса палладия и приводящую к
бетаина [60]. Согласно расчетным данным, после
2,3-дигидроиндолизину. На последней стадии осу-
образования металлациклобутена (путь B) следует
ществляется окислительная ароматизация гете-
Схема 36
R1
R1
R2CN (3 экв)
1% Rh2(OAc)4
N
N
PhMe, 60°C, 1 ч
N
N N
2
R
X
X
51-89%
X = Cl, Br, OMe; R1 = CO2Me, 4-CF3C6H4;
R2 = Ar, Bn, алкил, циклогекс-1-енил.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1099
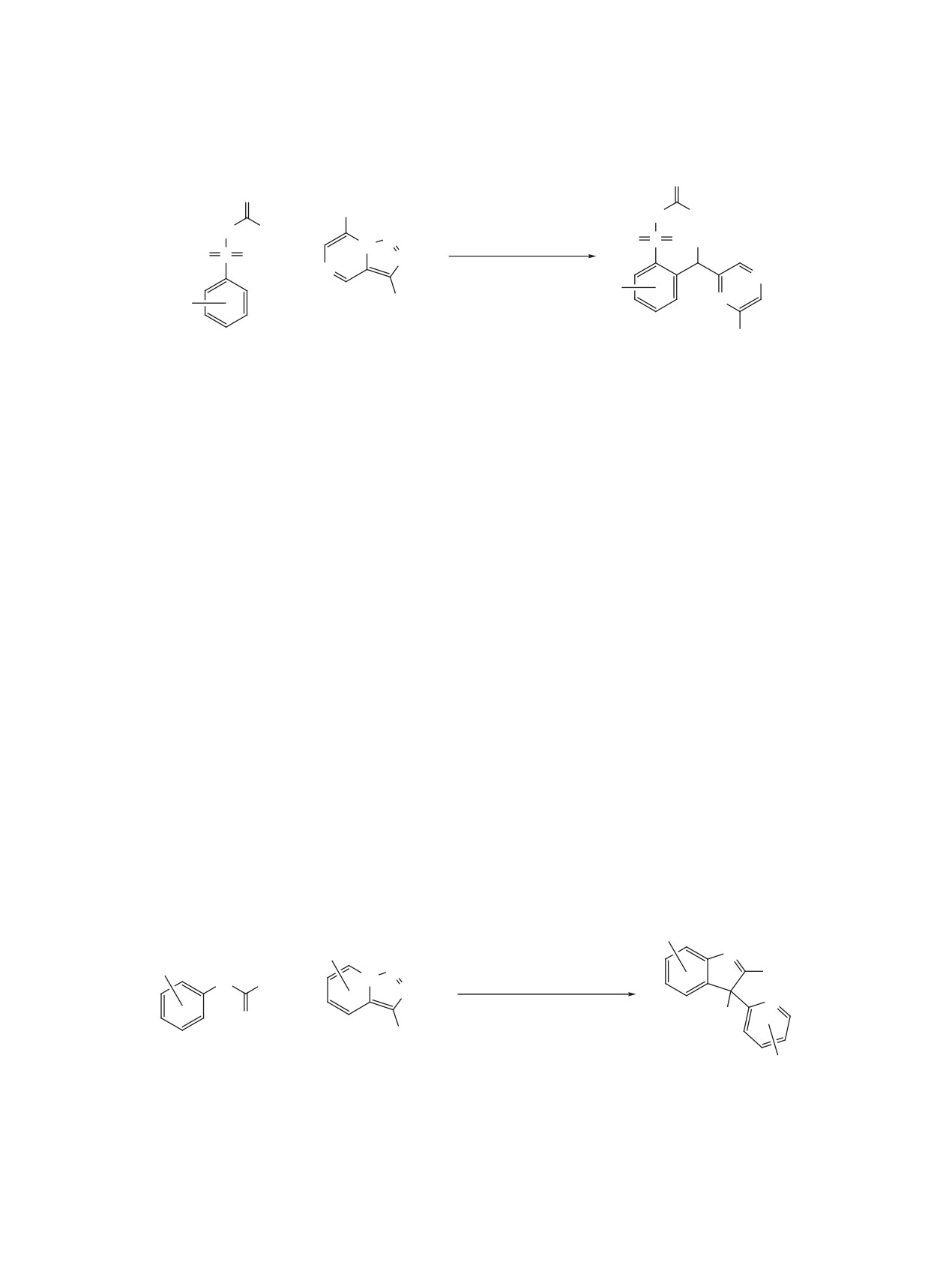
Схема 37
R
путь А
R
R
N
N
N
[Rh]
N
N
[Rh]
R'
X
X
X
R'
R'
R
R
R
[Rh]
X
−N2
N
N N2
N
[Rh]
R'
R'
X
R
R
R
R
N
N
N
N
X
X = CH
[Rh]
X
[Rh]
[Rh]
X
R'
R'
R'
путь B
R'
X = N, CH.
роцикла при действии диоксида марганца. Метод
карбаматы, а также N-фенилмочевина и метансуль-
применим к монозамещенным 1,3-диенам и позво-
фонамид. Высокая температура синтеза (120°C)
ляет получать целевые индолизины с суммарным
обеспечивает возможность использования менее
активированных триазолопиридинов, не содержа-
выходом 42-75%.
щих атома галогена в 7 положении и электроноак-
В 2014 г. родиевый катализ был успешно ис-
цепторной группы в 3 положении. При увеличении
пользован для внедрения пиридилкарбенов в N-H
загрузки катализатора до 3% в реакцию вступают
связь достаточно слабых азотных нуклеофилов
также различные анилины и некоторые слабоос-
(схема 39) [62]. В присутствии 1% Rh2(esp)2
в ре-
новные α-CF3-замещенные алифатические амины.
акцию эффективно вступают первичные амиды,
Полученные N-пиколиламиды могут подвергаться
Схема 38
1
CO2R
CO2R1
R2
(1.1 экв)
, DCE, 25°C, 1 ч
1. 1% Rh2(oct)4
N
N
2. 4% Pd(PPh3)4, 50°C, 4 ч
N N
3. MnO2 (5 экв), 80°C, 1 ч
Cl
Cl
R2
[Rh]
[O]
42-75%
CO2R1
CO2R1
CO2R1
PdL2
[Pd]
R2
N
N
N
Cl
Cl
R2
Cl
R2
R1 = Me, Et; R2 = Ar, Me, гексил, CO2Et.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1100
КОТОВЩИКОВ и др.
Схема 39
R
R
R1NH2 (1.5 экв)
3% Rh2(esp)2
NH
N
DCE, 120°C
N R1
N N
CO2H
47-91%
O
R = CO2Et; R1 = Ar, CH(CF3)Ph, CH(CF3)CO2Et.
CO2H
H2N
R2
R
R
TsOH·H2O
(1.5 экв)
1% Rh2(esp)2
(1 экв)
H2esp
NH
N
DCE, 120°C
Ac2O, 120°C
N
N
O R2
R2
63-91%
58-81%
R = CO2Et, CO2Me, Ph, 4-MeOC6H4, Me;
R = CO2Et, Ph, Me;
R2 = Pr, CH2CN, Ph, CH=CH2, Ot-Bu, OBn, OPh, NHPh.
R2 = Pr, Ph, стирил.
внутримолекулярной циклизации при нагревании
при температуре от комнатной до 140°C в зависи-
с TsOH и уксусным ангидридом. Данный подход
мости от склонности триазола к переходу в диа-
был осуществлен в варианте one pot и представля-
зоформу. Согласно предполагаемому механизму,
ет собой альтернативный способ трансаннелиро-
родиевый карбеноид взаимодействует со спиртом
с образованием оксониевого илида, после чего
вания триазолопиридинов с образованием имида-
происходит циклизация посредством внутримоле-
зо[1,5-a]пиридинов.
кулярного карбометаллирования алкина. Данный
В 2019 г. предложен метод получения пири-
метод эффективен в случае первичных пропарги-
дилзамещенных 2,5-дигидрофуранов с помощью
ловых спиртов и приводит к дигидрофуранам с
Rh-катализируемой реакции триазолопиридинов
выходами до 90%. При использовании вторичного
с 3-арилпропаргиловыми спиртами в результате
и третичного спиртов оксониевый илид претерпе-
формального
(4+1)-циклоприсоединения (схе-
вает [2,3]-сигматропную перегруппировку и пре-
ма 40) [63]. Реакция протекает в присутствии 2%
вращается в аллен, не вступающий в гетероцикли-
Rh2(esp)2 и молекулярных сит (4Å) в дихлорэтане
зацию в условиях реакции (схема 41).
Схема 40
OH
CO2R
O
RO2C
2% Rh2(esp)2
+
N
DCE, мол. сита
N N
25, 115 или 140°C
N Ar
X
Ar
X
(1.2 экв)
31-90%
-N
2
[Rh]
H
H
CO2R
RO2C
O
O
RO2C
[Rh]
Rh
N
Rh
N
Ar
N Ar
X
X
X
X = H, F, Cl, Br, Me; R = Me, Et, t-Bu.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1101
Схема 41
H
R
R
CO2t-Bu
OH
HO
CO2t-Bu
t-BuO2C
O
Ph
2% Rh2(esp)2
N
+
Rh
мол. сита
N
N N
DCE, 25°C
N
Ph
Ph
Cl
Cl
R
Cl
(1.2 экв)
R = H (82%) (dr 86:14); Me (51%).
В 2020 г. несколько научных групп прове-
должен был приводить к нарушению ароматично-
ли исследование Rh-катализируемого взаимо-
сти пиридинового цикла.
действия триазолопиридинов с некоторыми
Более успешным и синтетически полезным
N-нуклеофилами, обнаружив ряд новых необыч-
оказалось взаимодействие триазолопиридинов с
ных превращений. Так, реакция с бициклическим
2H-азиринами (схема 43) [65]. В этом случае пе-
азиридином приводит к непредельному имину в
регруппировка соответствующих илидов приво-
результате хелетропной фрагментации промежу-
дит к 2-азабутадиенам, претерпевающим 1,6-элек-
точно образующегося азиридиниевого илида (схе-
троциклизацию с образованием неароматических
ма 42) [64]. Данное превращение описано лишь на
4H-пиридо[1,2-a]пиразинов. Природа заместите-
единственном примере, поскольку цель авторов
лей оказывает существенное влияние на степень
заключалась в расширении трехчленного цикла
для получения конденсированного производного
обратимости последней стадии, и в ряде случа-
дегидропиперидина. Квантовохимические расче-
ев конечные продукты находятся в равновесии с
ты подтверждают неблагоприятность изначально
ациклическими изомерами. При наличии бензо-
предполагавшегося реакционного пути, который
ильного заместителя в 3-м положении триазолопи-
Схема 42
O
Br
N
N
N
N O
+
H
3% Rh2(esp)2
CHCl3, 25°C, 3 ч
O
O
Br
N
N
H
Br
O
N
N O
O
N
N
H
O
Br
38%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1102
КОТОВЩИКОВ и др.
Схема 43
R1
R3
R1
N
3
Ar
N
R
Ar
2% Rh2(OAc)2
N
N
+
PhMe, 110°C
N
N
R2
R2
15-65%
R3
3
R
Ar
R1
Ar
R1
N N
N N
R2
R2
R1 = H, Cl, Br, OMe; R2 = CO2Me, CN;
R3 = H, Me, Ph, CH2CO2Me.
ридина электроциклизация происходит с участием
грации не только ацильных, но также алкокси- и
карбонильной группы, не затрагивая ароматиче-
аминокарбонильных групп.
ский гетероцикл, и приводит к 2H-1,4-оксазину
КАТАЛИЗАТОРЫ НА ОСНОВЕ Rh(III)
(схема 44).
Использование комплексов родия(III) позво-
Взаимодействие 2-ацилоксипиридинов с ро-
лило вовлечь триазолопиридины в каталитиче-
диевыми карбеноидами, генерируемыми путем
ские процессы образования новых С-С-связей
перехвата диазоформы триазолопиридинов, со-
при направленной CH-активации ряда аромати-
провождается
1,4-миграцией ацильной группы
ческих соединений. Первым примером успешной
(схема 45) [66]. Нуклеофильный атом углерода
реализации данной методологии является работа,
промежуточно образующегося пиридиниевого
опубликованная в 2015 г. группами Штрассерта
илида внутримолекулярно присоединяется по кар-
и Глориуса [67]. Триазолопиридины, содержащие
бонильной группе, давая пятичленный бетаин, ко-
сложноэфирную группу в 3-м положении, взаимо-
торый раскрывается и превращается в конечный
продукт. Синтез осуществляется в присутствии
действуют с 2-арилпиридинами при температуре
2% Rh2(esp)2 при температуре 90°C, при этом эф-
140°C в трифторэтаноле в присутствии катали-
фективность реакции сильно зависит от выбора
затора на основе катионного комплекса Cp*RhIII
растворителя, наиболее оптимальным из которых
(Cp* = η-C5Me5) (схема 46). Данная реакция позво-
является циклопентан. Данный метод позволил
ляет с высокими выходами (50-99%) получать пи-
получить большую серию целевых N-замещенных
ридилзамещенные изохинолиноны, проявляющие
2-пиридонов с выходами 33-93% в результате ми-
флуоресцентные свойства и исследованные в ка-
Схема 44
Ph
Ph
Ph
O
Ph
O
O
N
2% Rh2(OAc)2
N
Ph
N
Ph
N
PhMe, 110°C
N
N
N N
OMe
OMe
OMe
63%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1103
Схема 45
R4
2
R
O
R2
O
R4
O
2% Rh2(esp)2
+
3
R
циклопентан
N
R1
N
O
N
R1
N
90°C, 4-20 ч
N
N
(2 экв)
R3
33-93%
O
R4
O
O
R2
O R4
R2
N
N
1
R
R1
N
N
R3
R3
R1, R3 = H, Cl, Br, Me; R2 = Me, Ph, Het, CO2Me;
R4 = Me, Ph, MeO, t-BuO, NMe2, NPh2.
честве сенсоров на катионы металлов. Несколько
ния которого происходит миграционное внедрение
ранее тем же коллективом был разработан анало-
и расширение родацикла. Протодеметаллирование
гичный процесс с участием α-диазокарбоксилатов,
приводит к продукту сочетания, который претер-
катализируемый более доступным комплексом на
певает циклизацию и превращается в конечное
основе Cp*CoIII [68], однако в реакции с триазоло-
соединение. Вопреки изначальным опасениям ав-
пиридинами кобальтовые катализаторы оказались
торов, связанным с возможным отравлением ката-
не эффективны.
лизатора за счет нежелательного хелатирования с
продуктом, родиевый комплекс выступил в каче-
Пиридиновое кольцо выполняет роль направ-
стве кислоты Льюиса, облегчающей замыкание
ляющей группы, обеспечивающей региоселектив-
цикла при внутримолекулярном ацилировании пи-
ность CH-активации за счет образования катионно-
ридина сложным эфиром.
го металлацикла (схема 47). Согласно предложен-
ному механизму, триазолопиридин выступает пре-
Другим примером реализации синтетической
курсором родиевого карбеноида, после образова-
стратегии, основанной на Rh(III)-катализируемой
Схема 46
R2
R2
R3
2.5%
N
N
N
[Cp*Rh(MeCN)3](SbF6)2
N
+
X
CF3CH2OH, 140°C, 24 ч
N
O
1
R
CO2Me
N
R1
X
R3
50-99%
X = CH, N; R1 = H, Hal, Me, CF3, OMe, NMe2;
R2 = H, Me; R3 = H, Br, Me, CF3, Ar, 2-тиенил.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1104
КОТОВЩИКОВ и др.
Схема 47
N
N
N
N
[Cp*Rh(MeCN)3]
N
+ MeOH
(SbF6)2
H+
2-Py
O
CO2Me
+
+
[SbF6]2
[SbF6]
+
N2
N
N
N
OMe
Rh
CO2Me
O
Cp*
N Rh
Cp*
N
2
2+
[SbF6]2
[SbF6]
+
N
N
[SbF6]
OMe
Cp*
Rh
N
O
Rh
Cp*
CO2Me
H+
N Rh
N
CO
Cp*
2Me
N
CH-активации с последующей внутримолекуляр-
триазолопиридинов ограничен лишь наиболее ак-
ной лактамизацией, является работа по синтезу
тивными 7-галогензамещенными производными.
пиридилзамещенных 1,2-бензотиазинов (схема 48)
Практически аналогичные условия пригодны
[69]. В этом случае в качестве направляющей
и для орто-направленного внедрения родиевых
группы выступает сульфоксиминовый фрагмент.
металлокарбеноидов, генерируемых in situ из
Катионный комплекс Cp*RhIII катализирует реак-
триазолопиридинов, в CH-связь N-ацилбензол-
цию в толуоле при температуре 100°C в присут-
ствии 1 экв NaOAc. Метод позволяет получать
сульфонамидов (схема 49) [70]. В силу низкой ну-
целевые 1,2-бензотиазины с хорошими выходами
клеофильности атома N сульфонамида, лактамиза-
(50-99%), однако круг вовлеченных в реакцию
ция не наблюдается, и реакция останавливается на
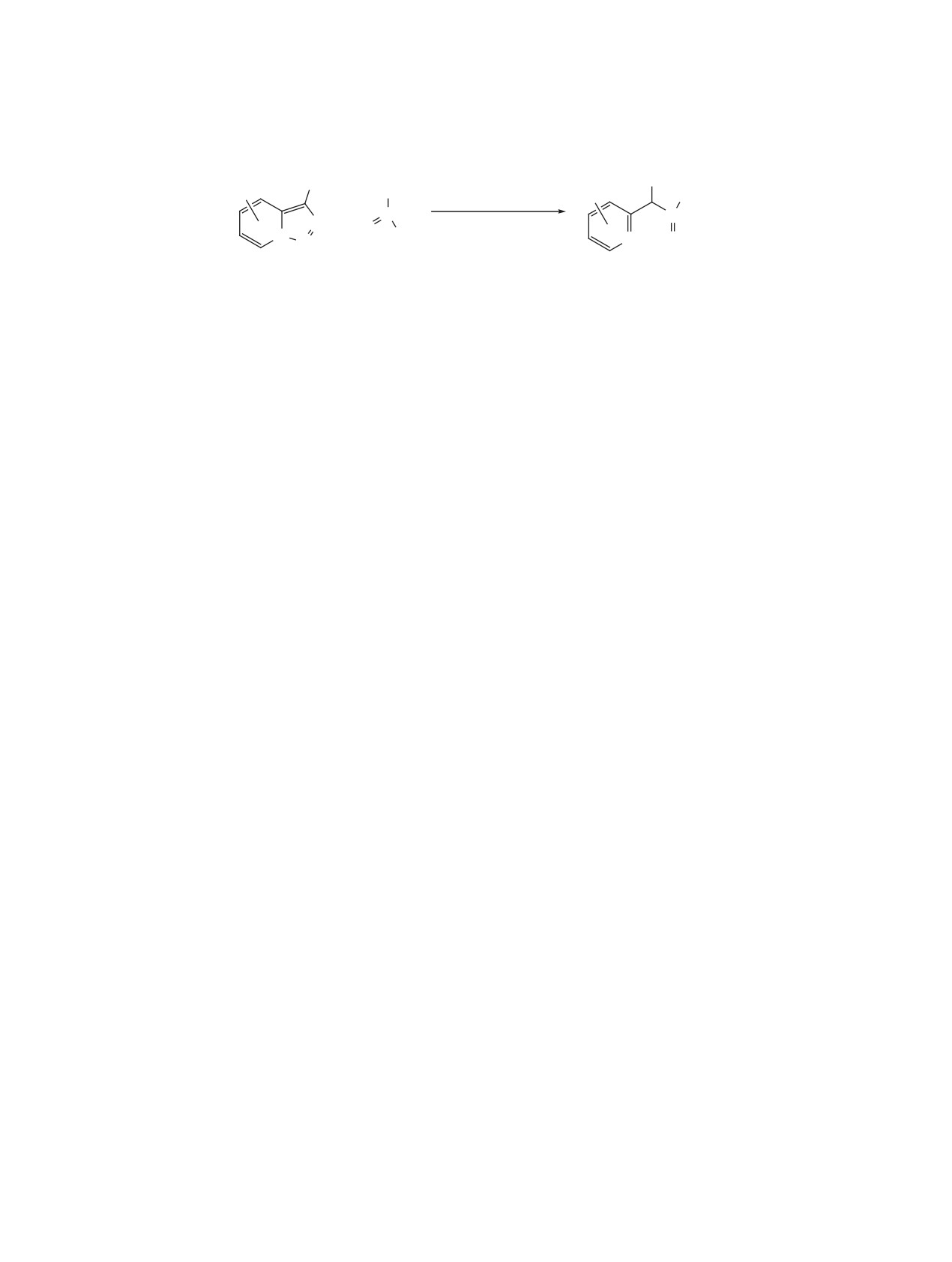
Схема 48
O
R2
R1
Hal
S
O
3%
N
R1
R2
[Cp*Rh(MeCN)3](SbF6)2
S
N N
+
N
O
NH
NaOAc (1 экв)
PhMe, 100°C, 2 ч
N
CO2R3
Hal
50-99%
Hal = Cl, Br; R1 = H, Me, Cl, Br, OMe;
R2 = алкил, циклопропил, Ph; R3 = Me, Et.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1105
Схема 49
O
O
R3
HN
R2
HN
R2
4
5% [Cp*RhCl2]2
O
S
O
CO2R
N N
O
S
O
+
N
X
20% NaOAc
X
PhMe, 120°C
R1
R1
CO2R4
N
R3
38-88%
X = CH, N; R1 = H, Me, Cl, F, Br, OMe, CO2Me, Ph;
R2 = алкил, Cy, CH=CHPh; R3 = H, Me, Cl, Br; R4 = Me, Et.
стадии C-C-сочетания. Любопытно, что, в отличие
катализаторам. Тем не менее, на настоящий мо-
от предыдущих примеров, оптимальным катализа-
мент известно не так много примеров эффективно-
тором оказался [Cp*RhCl2]2, при этом активация
го использования медных катализаторов для гене-
комплекса путем добавлении солей серебра лишь
рации карбеноидов из триазолопиридинов. Первая
ухудшает протекание реакции вплоть до полного
успешная попытка реализации данного подхода
подавления.
проведена группой Геворгяна в 2015 г. на приме-
ре трансаннелирования с участием терминаль-
В 2019 г. в качестве нового субстрата для Rh(III)-
ных ацетиленов (схема 51) [72]. Медный катализ
катализируемой CH-активации с участием триазо-
неожиданно решил одну из ключевых проблем, а
лопиридинов были исследованы N-ариламидины
именно, значительно расширил круг возможных
(схема 50) [71]. В этом случае реакция завершает-
субстратов. В то время как родиевые катализато-
ся гетероциклизацией, сопровождающейся элими-
ры эффективны лишь при наличии активирующих
нированием аммиака, и приводит к 3H-индолам.
групп в 3 и 7 положениях триазолопиридина, ис-
Эффективность данного подхода сильно зависит
пользование комплекса Cu(MeCN)4PF6 позволило
от природы заместителей в ароматическом кольце
преодолеть эти ограничения. Кроме того, данный
амидина. Так, электроноакцепторные группы об-
метод применим не только к арил-, но и алкилаце-
легчают протекание реакции (выходы 69-97%), в
тиленам, а также не требует использования инерт-
то время как при наличии электронодонорных за-
ной атмосферы. В то же время, по сравнению с
местителей выходы резко снижаются до 35-47%.
родиевым катализом, реакция протекает в более
КАТАЛИЗАТОРЫ НА ОСНОВЕ Cu
жестких условиях при температуре 130°C в толуо-
В химии диазосоединений комплексы меди ча-
ле и при гораздо более высоких загрузках катали-
сто выступают весьма привлекательной альтерна-
затора (15 вместо 1%). Однако, несмотря на эти не-
тивой по отношению к очень дорогим родиевым
достатки, совокупность вышеперечисленных пре-
Схема 50
R1
3
R
N
5% [Cp*RhCl2]2
R1
H
R2
N N
30% AgNTf2, 30% NaOAc
N
R2
+
N
N
1-AdCO2H (1 экв)
NH
DCE, 120°C, 12-24 ч
MeO2C
CO2Me
R3
35-97%
R1 = H, Me, Hal, OMe, CF3, NO2;
R2 = Ph, 2-тиенил, 2-фурил; R3 = H, Me, Cl, Br.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1106
КОТОВЩИКОВ и др.
Схема 51
R2
(1.2 экв)
R1
R1
15% Cu(MeCN)4PF6
N
PhMe, 130°C, 1-12 ч
N
N N
R2
33-94%
R1 = CO2Et, Ph, Me, H;
R2 = Ar, 3-тиенил, Bn, Cy, алкил.
R1
R1
R2
Cu(I)
N
N
N
H+
N
R2
H+
R2
[Cu]
R1
R1
N N2
[Cu]
N2
N
R1
[Cu]
R2
1
R
[Cu]
Cu+
Cu+
N
R2
N
R2
Cu+
имуществ делает этот метод синтеза индолизинов
помимо известного «карбенового» механизма, су-
вполне конкурентоспособным. Согласно одному
ществует альтернативный путь, представляющий
из предложенных механизмов, ацетиленид меди
собой катионный процесс.
превращается в карбеновый комплекс, претерпе-
В 2016 г. предложен медь-катализируемый ме-
вающий миграционное внедрение. Образующийся
тод получения имидазопиридинов, основанный
2-пропаргилпиридин вступает в циклоизомериза-
на перехвате диазоиминной формы первичным
цию в результате электрофильной активации алки-
амином и последующем окислительном анне-
на при координации с Cu+, давая индолизин после
лировании (схема 53) [74]. Подход применим к
протонолиза.
различным бензиламинам, фурфуриламину и ци-
В 2015 г. был разработан внутримолекулярный
клопропилметиламину, хотя и требует высокой
вариант трансаннелирования триазолопиридинов
температуры 150°C и достаточно большой загруз-
с участием ацетиленов [73]. Синтез осуществля-
ки катализатора (20% CuI). При увеличении ко-
ется при температуре 140°C в DCE в присутствии
личества CuI с 20 до 40% в реакцию, претерпевая
15% CuBr·SMe2
и приводит к конденсированным
декарбоксилирование, также вступают α-амино-
полициклическим системам на основе индолизина
кислоты. Эта модификация позволяет получать не
(схема 52). В отличие от межмолекулярной реак-
только 3-арил-, но и 3-алкилзамещенные имидазо-
ции, данный метод эффективен для интернальных
пиридины. Предполагаемый механизм основан на
алкинов, особенно арил- и гетарилзамещенных
внедрении медного карбеноида в NH-связь, после
(выходы до 95%). Отмечается, что в случае не-
чего полученный амин последовательно окисляет-
которых субстратов реакция может катализиро-
ся до имина и далее до аза-алленильного катиона,
ваться кислотами Льюиса, в частности, In(OTf)3
который циклизуется с образованием конечного
и TIPSOTf. Это позволяет предположить, что,
продукта (схема 54).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1107
Схема 52
O
O
X
X
15% CuBr·SMe2
DCE, 140°C
N
N
N N
R
R
23-95%
X = -, O, NMe; R = Ar, Het, n-Bu, t-Bu, Bz, TBS, H.
Схема 53
R2 = Ar, 2-фурил, циклопропил.
H2N
R2
(3 экв)
20% CuI, O2 (воздух)
45-92%
DCB, 150°C, 6 ч
R1
R1
CO2H
N
N
(3 экв)
N
N N
H2N R2
R1 = Ph,
40% CuI, O2 (воздух)
R2
26-93%
CO2Et.
DCB, 150°C, 6 ч
R2 = Ar, Me, i-Bu.
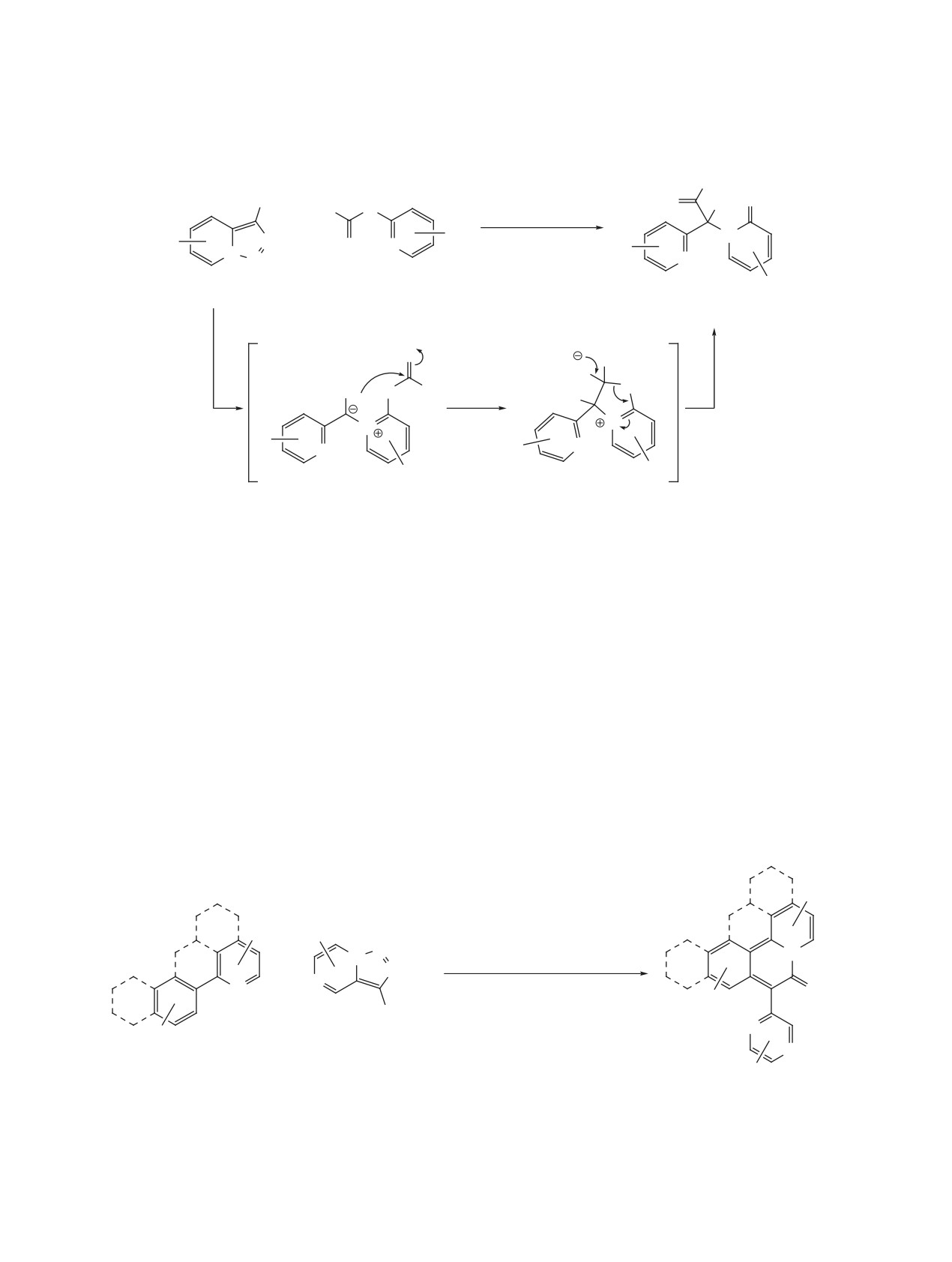
В 2018 г. медный катализ позволил впервые
происходит формальное внедрение пиридилкар-
ввести триазолопиридины в реакцию образования
бенов в P-H связь различных дизамещенных фос-
связи C-P (схема 55) [75]. При кипячении в диокса-
финоксидов с выходами до 87%. Реакция также
не в присутствии простого катализатора Cu(OAc)2
применима к метиловому эфиру фенилфосфино-
Схема 54
R1
R1
R1
[Cu]
N2
[Cu]
-N2
N
N
N
N N
H2N R2
1
R
R1
R1
[Cu]
[Cu]
N
N
NH
[O]
[O]
N
N
N
R2
R2
R2
[Cu]
[O]
1
R
R1
R1
N
N
N
N
N
N
R2
R2
H
R2
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1108
КОТОВЩИКОВ и др.
Схема 55
R
R
X
H
10% Cu(OAc)2
X
R1
+
2
P R
P R2
N
диоксан
O
R1
100°C, 6-10 ч
N O
N N
(1.5 экв)
30-87%
X = H, Br, Me, Ar; R = H, Me, Ph;
R1, R2 = Ar, Het, алкил, n-Bu, OEt, OMe.
вой кислоты и диэтилфосфиту и приводит к целе-
ния t-BuOK вместо K2CO3 происходит Pd-ката-
вым фосфорилированным пиколинам с выходами
лизируемая CH-активация и арилирование триа-
53-66%.
золопиридина по 7-му положению. Это позволяет
осуществлять последовательное региоселектив-
КАТАЛИЗАТОРЫ НА ОСНОВЕ Pd
ное введение двух арильных групп, весьма эф-
По сравнению с наиболее популярными Rh- и
фективное, в том числе, при проведении данных
Cu-содержащими катализаторами, комплексы Pd
стадий in-one-pot (схема 58). Первоначально триа-
реже применяются в химии диазосоединений и их
золопиридин выполняет роль направляющей груп-
различных прекурсоров. Эта тенденция справед-
пы, обеспечивающей региоселективность палла-
лива и для соответствующих реакций с участием
дирования и кросс-сочетания, после чего триазо-
триазолопиридинов. Тем не менее, недавно было
льный цикл раскрывается для генерации металло-
опубликовано несколько работ, демонстрирующих
карбеноида.
уникальный потенциал Pd катализаторов для раз-
В 2019 г. Pd-катализируемая CH-активация
вития этой химии.
триазолопиридинов была объединена с окисли-
Использование бикаталитической системы на
тельным разложением диазоформы до кетона (схе-
основе соединений Pd(II) и Ni(II) позволило раз-
ма 59) [78]. Реакция протекает на воздухе в при-
работать эффективный метод синтеза 2-винилпи-
сутствии 10% Pd(OAc)2 и 2 экв Ag2CO3 в толуоле
ридинов в результате кросс-сочетания триазоло-
при температуре 120°C и позволяет получать целе-
пиридинов с арилбромидами (схема 56) [76, 77].
вые 2-ацил-6-арилпиридины с выходами 26-85%.
Продукт окислительного присоединения ArPdBr
Окисление диазогруппы не требует присутствия
реагирует с диазоформой триазолопиридина с об-
Pd и, согласно предположению авторов, протека-
разованием палладиевого карбеноида. Далее про-
ет через промежуточное образование карбенового
исходит миграционное внедрения карбена по свя-
комплекса Ag.
зи Ar-Pd, после чего алкильный комплекс претер-
Необычное превращение было обнаружено
певает β-гидридное элиминирование, приводящее
при нагревании триазолопиридинов в уксусном
к конечному продукту. Ацетат никеля, согласно
ангидриде в присутствии 3% Pd(Ph3P)4 и 1.5 экв
предположению авторов, выполняет роль кислоты
фенилиодозоацетата (схема 60) [42]. В результате
Льюиса, необходимой для связывания с пиридино-
данной реакции происходит формальное внедре-
вым атомом азота и смещения таутомерного рав-
ние металлокарбеноида в связь C-O, приводящее
новесия в сторону диазоиминной формы.
к одновременному ацетилированию и ацетокси-
Интересно отметить, что реакция с участием
лированию субстрата. Предложенный механизм
7-метокситриазолопиридина приводит к изомер-
включает промежуточное образование оксоние-
ному продукту сочетания (схема 57). В этом случае
вого илида, претерпевающего перегруппировку с
субстрат более склонен к переходу в диазоформу и
миграцией ацильной группы.
поэтому успевает разложиться с образованием ал-
В 2021 г. палладиевый катализ был успешно
кена, который далее вступает в реакцию Хека.
применен для эффективной сборки полицикличе-
В отсутствие Ni(OAc)2, а также при одновре-
ской системы пиридоизохинолинонов из триазо-
менном использовании более сильного основа-
лопиридинов и 2-(псевдо)галогенбензальдегидов
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1109
Схема 56
N N
5% Pd(Cy3P)2Cl2
Ar
R2
10% Ni(OAc)2∙4H2O
N
N
R2
+ ArBr
3
K2CO3, PhMe
R1
R
(2 экв)
R1
130°C, 24 ч
R3
50-92%
R1 = H, Cl, F, Me, Ph, CF3, OMe, CO2Et;
R2 = H, Me, Ph; R3 = H, Me.
B:
ArX
Pd(0)
N
N N
HPdX
ArPdX
[Ni]
N2
Ar
H
N
PdX
X
N N2
Pd
Ar
[Ni]
N
N Ar
Схема 57
5% Pd(Cy3P)2Cl2
Ar
O
10% Ni(OAc)2·4H2
N
+ ArBr
N
N
K2CO3, PhMe
N N
(2 экв)
130°C, 24 ч
OMe
OMe
OMe
75-85%
Схема 58
N N
Ar1Br (1.1 экв)
N N
Ar2Br (2 экв)
5% Pd(Cy3P)2Cl2
10% Ni(OAc)2·4H2O
N
Ar1
N
Ar1
N
Ar2
t-BuOK, PhMe
KHCO3
130°C, 1.5 ч
130°C, 24 ч
50-87%
Схема 59
N N
10% Pd(OAc)2
N N
O
2 экв Ag2CO3
N
Ar1
Ar2
N
Ar1
Ar2
N
+ Ar2X
Ar1
O2 (воздух)
(2 экв)
PhMe, 120°C, 12 ч
26-85%
X = I, Br, Cl.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1110
КОТОВЩИКОВ и др.
Схема 60
O O
N N
3% Pd(Ph3P)4
O
1.5 экв PhI(OAc)2
R1
N
R2
R1
N
Ac2O, 120°C, 24 ч
R2
58-71%
O O
[Pd]
Ac2O
O
R1
N
R2
-[Pd]
R1
N
R2
R1 = H, Ar;
R2 = Ph, 4-ClC6H4.
(схема 61) [79]. Наибольшую активность проде-
КАТАЛИЗАТОРЫ НА ОСНОВЕ
монстрировала каталитическая система на основе
ДРУГИХ МЕТАЛЛОВ
комплекса Pd(dppf)Cl2 в присутствии дополни-
Помимо комплексов Rh, Cu и Pd, образовывать
тельного бидентатного фосфина DPEphos. В ка-
карбеноиды при действии триазолопиридинов
честве основных строительных блоков использо-
способны и соединения некоторых других метал-
ваны трифлаты доступных салициловых альдеги-
лов. На настоящий момент известно лишь неболь-
дов, а также 2-бромбензальдегиды. Отмечено, что
шое число примеров подобных реакций, сведения
среди триазолопиридинов подходящими субстра-
о которых представлены в данном разделе.
тами являются лишь не имеющие заместителей в 3
В 2018 г. в качестве нового катализатора для
положении. Представленный механизм включает
перехвата диазоформы триазолопиридинов иссле-
стадии окислительного присоединения, образова-
дован порфириновый комплекс Co(II) (схема 63)
ния карбенового комплекса и миграционного вне-
[80]. Известно, что подобные кобальтовые катали-
дрения карбена. Дальнейшая циклизация может
заторы демонстрируют необычную реакционную
происходить по одному из двух альтернативных
способность и при действии диазосоединений
путей. Первый вариант (путь A) предполагает CH-
превращаются в карбеноиды, проявляющие свой-
активацию альдегидной группы и промежуточное
ства свободных радикалов [81, 82]. Использование
образование ацильного комплекса Pd. Второй ме-
Co(TPP) дало возможность разработать one-pot
ханизм (путь B) основан на изомеризации, приво-
процесс, объединяющий синтез триазолопири-
дящей к разрушению ароматичности пиридиново-
динов и последующее их превращение в индо-
го кольца, после чего азот присоединяется по кар-
лизины по реакции с терминальными ацетилена-
бонильной группе.
ми. Генерация триазолопиридинов происходит
Вышеописанный Pd-катализируемый подход
в результате взаимодействия тозилгидразина и
распространен также и на триазоло[5,1-a]изохино-
2-пиридилзамещенных альдегидов или кетонов
лины (схема 62) [79]. Это позволило разработать
в присутствии Cs2CO3 в бензоле при температу-
новый метод синтеза ряда алкалоидов протобер-
ре 80-100°C. Стоит отметить, что комплексы Rh
бериновой группы, среди которых 8-оксипсевдо-
и Cu, ранее предложенные в качестве катализато-
пальматин и 8-оксипсевдоэпиберберин. Стоит от-
ров для аналогичного синтеза индолизинов, ока-
метить, что в этом случае аннелирование удалось
зались неэффективны в данном one-pot процессе.
осуществить при использовании более доступного
Предложенный механизм основан на взаимодей-
катализатора Pd(Ph3P)4.
ствии генерируемого in situ (2-пиридил)диазоме-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1111
Схема 61
O
R1
R2
5% Pd(dppf)Cl2
R1
R2
CHO
7.5% DPEphos
N
+
N
N
N
K2CO3, диоксан
130°C, 4.5-7.5 ч
X
23-85%
X = OTf, Cl, Br, I.
O
CHO
Pd(0)
N
N
B:
X
N
N
B:
O
CHO
H OPdX
PdX
PdX
N
N
HX
N2
2-Py
O
N
2
O
Pd
CHO
PdX
N
2-Py
путь А
PdX
N
CHO PdX
N
путь B
тана с Co(TPP) и образованием комплекса Co(III),
нов (схема 64) [80]. Возможности данного под-
проявляющего радикальный характер. Далее про-
хода продемонстрированы на примере реакций с
исходит присоединение к алкину, после чего ви-
участием стиролов и ряда электронодефицитных
олефинов. Во всех случаях наблюдается преиму-
нильный радикал претерпевает циклизацию, давая
щественное образование транс-изомеров (dr от
конечный продукт.
79:21 до >99:1), при этом наиболее высокая диа-
Аналогичные условия оказались пригодны и
стереоселективность характерна для циклопропа-
для циклопропанирования терминальных алке-
нирования винилсульфонов.
Схема 62
N
N
O
N
RO
1. 10% Pd(Ph3P)4, 15% Ph3P,
N
RO
CHO
K2CO3, PhMe, 140°C
+
2. 10% Pd/C, HCO2NH4,
RO
RO
Br
MeOH, 90°C
MeO
OMe
OMe
OMe
R = Me (59%), 8-оксипсевдопальматин;
R,R = CH2 (49%), 8-оксипсевдоэпиберберин.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1112
КОТОВЩИКОВ и др.
Схема 63
R2
R1
R2
TsNHNH2 (1.2 экв)
R2
R1
5% Co (TPP)
+
R3
O
CsCO3, PhH
N
N
80-100°C, 12 ч
N
N
(1-2 экв)
N
R3
59-97%
R1 = H, Br, Me, Ph; R2 = H, Me, Ar, CO2Et;
R3 = алкил, t-Bu, Ar, 2-Py, циклопропил.
R
CoII
N
Ph
Ph
(TPP)
N
N2
N
N2
N
CoII
N
R
N
N
N
Ph
Ph
CoIII
CoIII
Co(TPP)
(TPP)
(TPP)
R
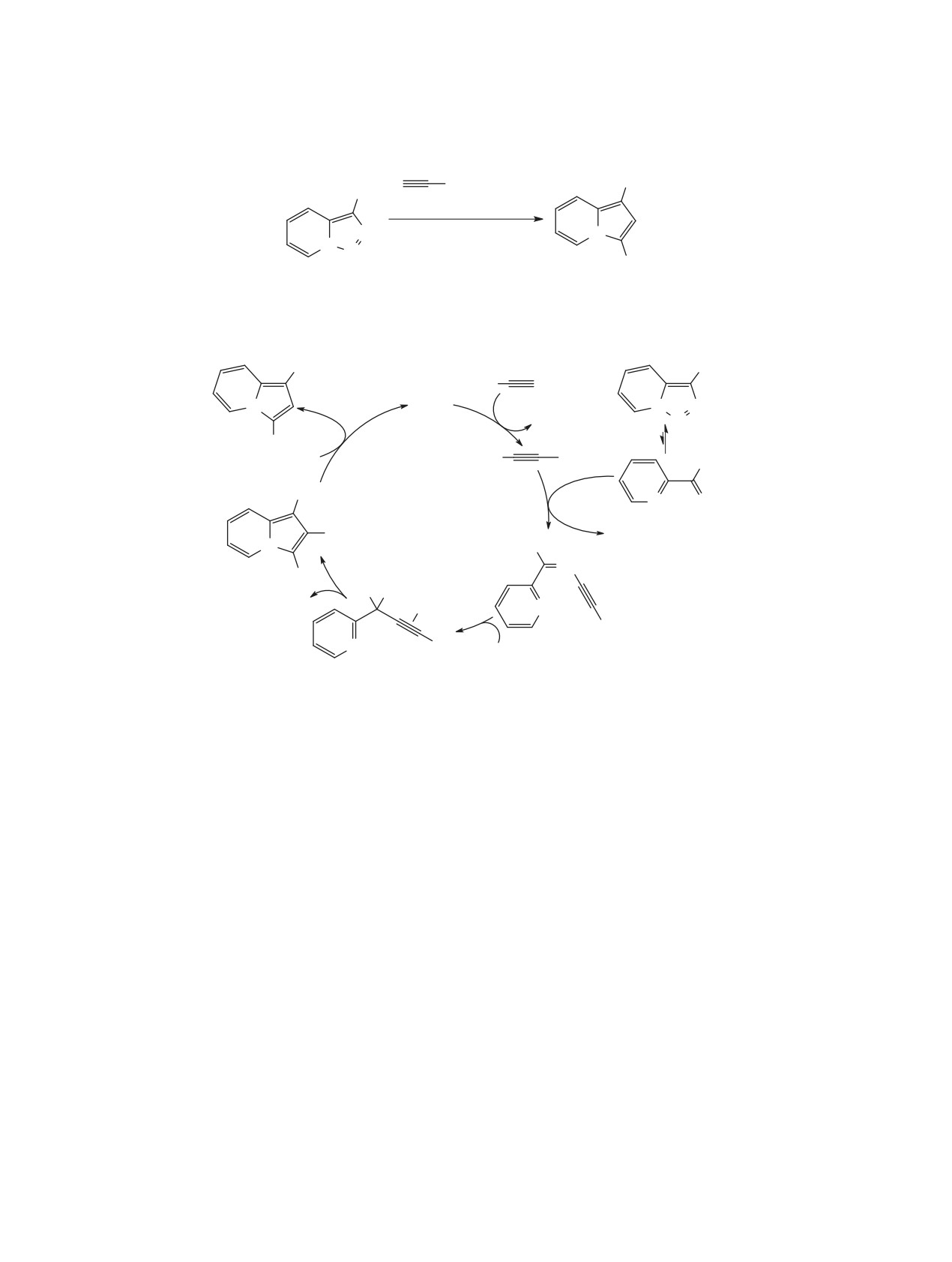
В 2020 г. катализатор Co(TPP) позволил ввести
Уникальная реакционная способность 3-арил-
во взаимодействие с триазолопиридинами новый
триазолопиридинов по отношению к ряду
тип реакционных партнеров, содержащих атом
электронообогащенных ароматических систем
серы [83]. Так, при действии избытка изотиоциана-
была обнаружена при катализе 20% In(OTf)3 в
тов предложен новый подход к иминозамещенным
присутствии
2 экв трифторуксусной кислоты
тиазолопиридинам (схема 65). Метод применим к
при температуре 130°C в дихлорбензоле (схе-
широкому кругу изотиоцианатов, полученных из
ма 66) [84]. Данная реакция позволяет конст-
анилинов, алифатических аминов, а также эфи-
руировать каркас пиридо[1,2-a]индола с одно-
ров природных аминокислот, однако приведенные
временным введением арильной группы. Метод
примеры триазолопиридинов ограничены суб-
применим для β-нафтола и его метилового эфи-
стратами, содержащими в 3-м положении слож-
ра, антрацена и 1,3,5-триметоксибензола, приво-
ноэфирную группу. Подход распространен также
дя к целевым гетероциклам с выходами от уме-
и на синтез оксо-тиазолопиридинов при исполь-
ренных до высоких (40-93%). Предполагается,
зовании эфира ксантогената, претерпевающего в
что одним из интермедиатов реакции является
условиях реакции элиминирование по Чугаеву и
карбеновый комплекс индия, а образование свя-
выступающего прекурсором газообразного карбо-
зи C-N происходит в результате аза-циклизации
нилсульфида (OCS).
Назарова.
Схема 64
R1
TsNHNH2 (1.2 экв)
R1
5% Co(TPP)
O
+
R2
R2
Cs2CO3, PhH
N
80°C, 12 ч
N
(1 экв)
70-97%
R1 = H, Br; R2 = Ar, C(O)Ph, CO2Et, SO2Ar.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1113
Схема 65
2
S
CO2R
CO2R2
CO2R2
S
3
(5 экв)
R
C
(5 экв)
EtO
SEt
N
X
X
X
S
S
N
12% Co(TPP), PhMe
8-12% Co(TPP), DCE
N
N
N
120°C, 24-36 ч
N
120°C, 14 ч
1
R1
R
O
R1
N
R3
36-58%
45-88%
X = CH, N; R1 = H, Cl, Br, Me; R2 = Me, Et; R3 = алкил, Ar.
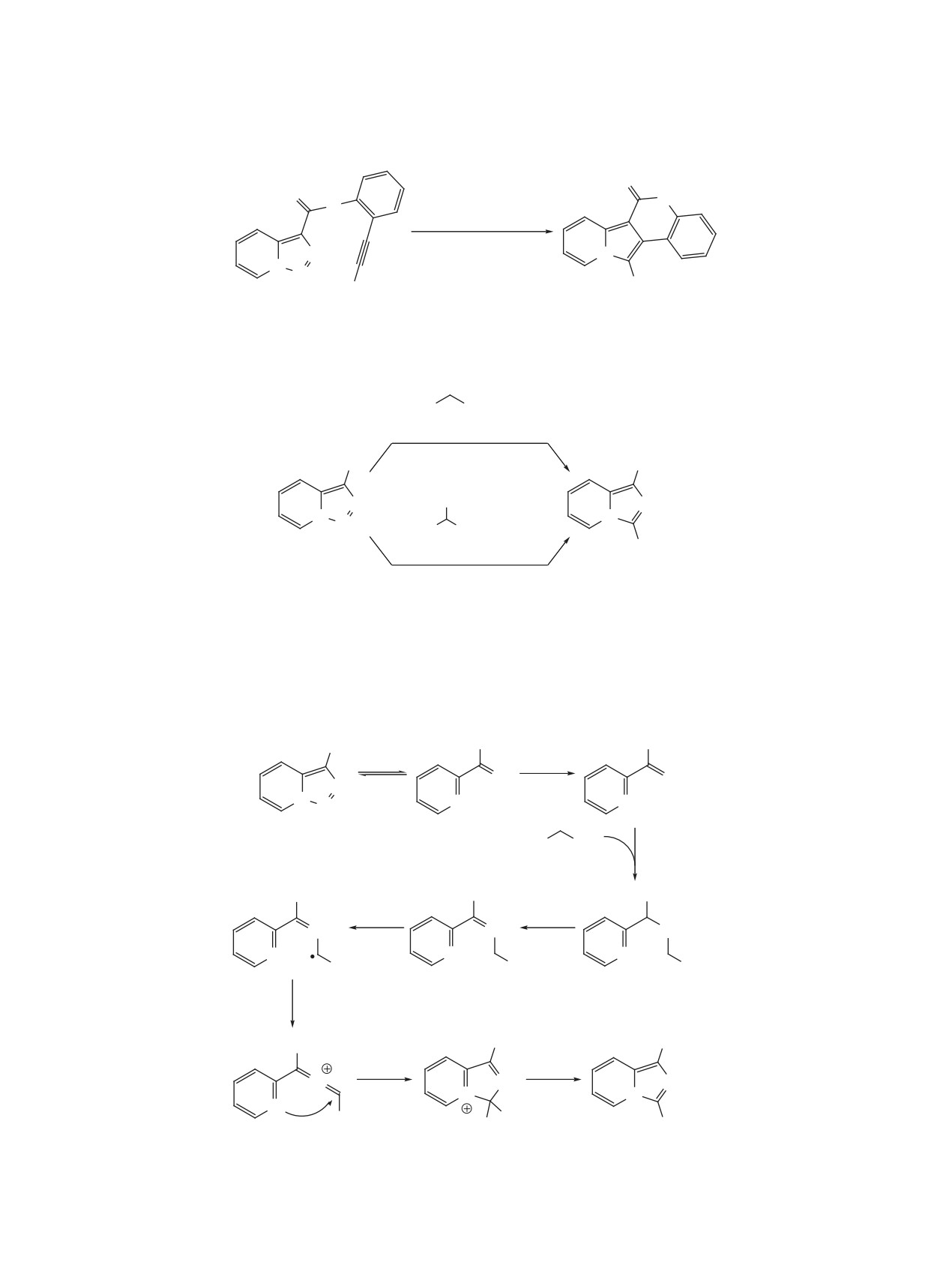
В 2020 г. предложен новый подход к пиридилза-
КАТАЛИТИЧЕСКИЕ РЕАКЦИИ
мещенным инденам, основанный на внутримоле-
ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
кулярной циклизации триазолопиридинов, содер-
БЕЗ ИСПОЛЬЗОВАНИЯ МЕТАЛЛОВ
жащих в 3 положении стирольный фрагмент (схе-
На протяжении многих лет было известно, что
ма 67) [85]. Реакция протекает в присутствии 5%
триазолопиридины способны вступать в реакции
AgOMs и 1 экв уксусной кислоты и представляет
с раскрытием цикла при действии кислот. Тем не
собой формальное внедрение пиридилкарбена в
менее, описанные примеры подобных реакций
винильную C-H связь. Метод успешно использо-
ограничивались простейшими превращениями, в
ван для получения широкой серии инденов с вы-
частности, образованием 2-пиколилацетатов при
сокими выходами вплоть до 98%. Обязательным
кипячении в уксусной кислоте. Лишь недавно уда-
требованием к структуре субстратов является
лось показать, что кислоты Льюиса и Бренстеда
наличие активирующего электроноакцепторного
можно эффективно использовать для активации
заместителя в 7 положении триазолопиридина.
триазолопиридинов в реакциях, которые ранее
Ключевыми стадиями механизма, подтвержден-
осуществлялись только при действии катализато-
ного квантово-механическими расчетами, явля-
ров на основе переходных металлов.
ются образование карбенового комплекса серебра
и карбоциклизация, приводящая к образованию
В 2016 г. продемонстрирована эффективность
пятичленного цикла и временному нарушению
эфирата трехфтористого бора в качестве катали-
ароматичности. Авторы полагают, что завершаю-
затора в реакции триазолопиридинов с нитрилами
щая стадия переноса протона осуществляется при
(схема 68) [86]. Помимо очевидной большей до-
катализе AgOMs с участием следовых количеств
ступности по сравнению с весьма дорогими роди-
воды, присутствующих в реакционной среде.
евыми катализаторами, другим выгодным отличи-
Схема 66
R1
2
R
N N
20% In(OTf)3
R1
N
TFA (2 экв)
N
+ ArH
R2
DCB
(1.5 экв)
130°C, 5 ч
Ar
40-93%
R1 = H, Ph, 3-MeC6H4, 4-t-BuC6H4; R2 = H, Cl.
R3
MeO
OMe
OR4
Ar =
,
,
R5
OMe
R3 = H, Br, OMe; R4, R5 = H, Me.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1114
КОТОВЩИКОВ и др.
Схема 67
R2
R2
R3
R3
5% AgOMs
R1
R
1
N N
AcOH (1 экв)
N
N
PhMe, 120°C, 2 ч
R4
R4
59-98%
R1
R2
R2
[Ag]
H
R3
N
[Ag]
R1
N
R3
R1 = Br, Cl, OMe; R2, R3 = H, Me, Ph, Ar, тиенил;
R4 = H, Me, Ph, F, Cl, Br, OMe, SMe, CO2Me.
Схема 68
Ar
Ar
RCN (1.2 экв)
25% BF3·OEt2
N
N
DCE-DCB
120°C, 16 ч
N
N N
R
43-99%
Ar = Ph, 4-ClC6H4; R = Ar, Het, алкил.
ем данного метода является применимость к суб-
аналогичной реакции с нитрилами при исполь-
стратам, не имеющим активирующей акцепторной
зовании стехиометрических количеств кислоты
группы в 7-м положении. Несмотря на достаточно
Бренстеда (схема 69) [87]. Так, показана эффек-
жесткие условия, метод пригоден для проведения
тивность синтеза имидазоизохинолинов в присут-
реакции 3-арилтриазолопиридинов с разнообраз-
ствии 1.5 экв TfOH и большого избытка нитрила
ными нитрилами алифатических, бензойных и
(10 экв). Помимо этого, при действии сильных
тиофенкарбоновых кислот, приводя к имидазопи-
протонных кислот (TfOH, HBF4) триазолоизо-
ридинам с выходами от умеренных до почти коли-
хинолины выступают в качестве алкилирующих
чественных (43-99%).
реагентов в реакции Фриделя-Крафтса с рядом
В 2020 г. на примере триазолоизохинолинов
наиболее реакционноспособных ароматических
продемонстрирована возможность осуществления
и гетероароматических систем (схема 70), однако
Схема 69
R
RCN (10 экв)
N N
N
TfOH (1.5 экв)
X
X
N
DCE, 100°C, 4.5-15 ч
N
X
X
53-87%
X = H, OMe; R = Ph, Me, Pr.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1115
Схема 70
Nu
N N
Ar
N
N
N
NuH (3 экв)
ArH (30 экв)
TfOH (1.5 экв)
HBF4·OEt2 (1.5 экв)
DCE
DCE
100°C, 2.5-8 ч
150°C, 2.5-6.5 ч
X
X
X
X
X
X
OMe
OMe
OMe
28-99%
18-80%
X = H, OMe.
NuH = спирты, PhOH, тиолы,
(смесь региоизомеров)
карбазол, 1,2,4-триазол.
ArH = 1,2-(MeO)2C6H4,
MeOPh, нафталин, тиофен.
Схема 71
O
R2
R2
R4
R4
O
TsOH (2 экв)
1
AIBN (0.5 экв)
R
+
R1
N
DCE, 140°C
N
N
N
N
N
N N
R3
R3
30-74%
R1 = H, 5,6-Me, 5,6-Br; R2 = OMe, OEt, Ph;
R3 = Ar, Het, Bn; R4 = H, 5-Br, 5-Ph, 6-Cl.
эти процессы, как правило, характеризуются до-
теля на стадии ароматизации гетероциклической
вольно низкой региоселективностью. Более гладко
системы. Метод неплохо работает при наличии
в аналогичных условиях протекает алкилирование
карбонильного заместителя в 3-м положении три-
O- и S-нуклеофилов, среди которых спирты, фенол
азолопиридина, однако не пригоден для 3-циано- и
и тиолы. Авторы отмечают, что наличие электро-
3-метилзамещенных субстратов.
нодонорных метоксигрупп в изохинолиновом кар-
В 2019 г. предложен метод получения 2-пико-
касе является необходимым для успешного проте-
лиламинов из триазолопиридинов, не требующий
кания данных реакций.
использования переходных металлов [89]. Реакция
В условиях кислотной активации триазоло-
протекает при 165°C в диоксане в присутствии
пиридинов при действии 2 экв TsOH предложен
воды и каталитических количеств TBAB (схе-
необычный метод аннелирования индолизино-
ма 72). Процесс основан на промежуточном пре-
вого фрагмента к 7-азаиндолу (схема 71) [88].
вращении диазоформы в соответствующий бро-
Необходимым компонентом реакционной смеси
мид, который далее вступает в нуклеофильное за-
является AIBN, который выполняет роль окисли-
мещение при действии амина. С помощью данного
Схема 72
R2
20% TBAB
R2
R2
1
3
R
R
R4
H2O (25 экв)
R1
R1
R4
+
N
Br
N
H
диоксан, 165°C
N
(2 экв)
N
N R3
N N
35-92%
R1 = H, 5,6-Me, 6,7-Br; R2 = H, Me, Ph, CO2Me, CO2H;
R3R4NH = ArNH2, BnNH2, морфолин.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1116
КОТОВЩИКОВ и др.
подхода проведено алкилирование очень широкой
КОНФЛИКТ ИНТЕРЕСОВ
серии анилинов с выходами от умеренных до вы-
Авторы заявляют об отсутствии конфликта ин-
соких (35-92%). В случае алифатических аминов,
тересов.
в частности, морфолина и бензиламина, метод по-
СПИСОК ЛИТЕРАТУРЫ
казывает довольно низкую эффективность (выхо-
ды 35-40%).
1.
Ford A., Miel H., Ring A., Slattery C.N., Maguire A.R.,
McKervey M.A. Chem. Rev. 2015, 115, 9981-10080.
ЗАКЛЮЧЕНИЕ
doi 10.1021/acs.chemrev.5b00121
В последние годы наблюдается заметный
2.
Doyle M.P., Duffy R., Ratnikov M., Zhou L. Chem.
всплеск интереса к химии [1,2,3]триазоло[1,5-a]-
Rev. 2010, 110, 704-724. doi 10.1021/cr900239n
пиридинов, вызванный способностью этих со-
3.
Gillingham D., Fei N. Chem. Soc. Rev. 2013, 42, 4918-
единений претерпевать спонтанное электро-
4931. doi 10.1039/C3CS35496B
циклическое раскрытие. Благодаря этому свой-
4.
Zhang Z., Wang J. Tetrahedron. 2008, 64, 6577-6605.
doi 10.1016/j.tet.2008.04.074
ству, данные гетероциклы выступают удобными
предшественниками таутомерных диазоиминов и
5.
Davies H.M.L., Alford J.S. Chem. Soc. Rev. 2014, 43,
5151-5162. doi 10.1039/C4CS00072B
соответствующих металлокарбеноидов в каскад-
6.
Anbarasan P., Yadagiri D., Rajasekar S. Synthesis.
ных превращениях. С помощью катализаторов
2014, 46, 3004-3023. doi 10.1055/s-0034-1379303
на основе Rh, Cu, Pd, Co и некоторых других
7.
Bakulev V., Dehaen W., Beryozkina T. Top. Heterocycl.
металлов предложено множество эффективных
Chem. 2015, 40, 1-49. doi 10.1007/7081_2014_131
подходов для трансформации триазоло[1,5-a]пи-
8.
Jiang Y., Sun R., Tang X.-Y., Shi M. Chem. Eur. J.
ридинов в разнообразные функционализирован-
2016, 22, 17910-17924. doi 10.1002/chem.201601703
ные азагетероциклы. Ряд реакций удается осуще-
9.
Li Y., Yang H., Zhai H. Chem. Eur. J. 2018, 24, 12757-
ствить и без использования переходных метал-
12766. doi 10.1002/chem.201800689
лов при действии кислот Льюиса или Бренстеда
10.
Li W., Zhang J. Chem. Eur. J. 2020, 26, 11931-11945.
либо при инициировании видимым светом.
doi 10.1002/chem.202000674
Синтетическая методология, рассмотренная в на-
11.
L’Abbe G., Van Stappen P., Toppet S. Tetrahedron. 1985,
стоящем обзоре, имеет значительные перспекти-
41, 4621-4631. doi 10.1016/S0040-4020(01)82357-7
вы для развития и, учитывая доступность триазо-
12.
L’Abbé G., Luyten I., Vercauteren K., Dehaen W. Bull.
ло[1,5-a]пиридинов, должна найти более широкое
Soc. Chim. Belg. 1993, 102, 683-684. doi 10.1002/
практическое применение в ближайшем буду-
bscb.19931021010
щем.
13.
Kotovshchikov Y.N., Latyshev G.V., Navasar-
dyan M.A., Erzunov D.A., Beletskaya I.P., Luka-
ФОНДОВАЯ ПОДДЕРЖКА
shev N.V. Org. Lett. 2018, 20, 4467-4470. doi 10.1021/
Работа выполнена при финансовой поддержке
acs.orglett.8b01755
Российского Научного Фонда (проект № 19-73-
14.
Kotovshchikov Y.N., Latyshev G.V., Kirillova E.A.,
00184).
Moskalenko U.D., Lukashev N.V., Beletskaya I.P.
J. Org. Chem. 2020, 85, 9015-9028. doi 10.1021/
ИНФОРМАЦИЯ ОБ АВТОРАХ
acs.joc.0c00931
Котовщиков Юрий Николаевич, ORCID: http://
15.
Gevondian G.A., Kotovshchikov Y.N., Latyshev G.V.,
Lukashev N.V., Beletskaya I.P. J. Org. Chem. 2021, 86,
orcid.org/0000-0003-2103-5985
5639-5650. doi 10.1021/acs.joc.1c00115
Волошкин Владислав Александрович, ORCID:
16.
Yadagiri D., Rivas M., Gevorgyan V. J. Org. Chem.
2020, 85, 11030-11046. doi 10.1021/acs.joc.0c01652
17.
Filippov I.P., Titov G.D., Rostovskii N.V. Synthesis.
Латышев Геннадий Владимирович, ORCID:
2020, 52, 3564-3576. doi 10.1055/s-0040-1707254
18.
Abarca B., Ballesteros R., Elmasnaouy M. Tetrahed-
Белецкая Ирина Петровна, ORCID: http://
ron. 1998, 54, 15287-15292. doi 10.1016/S0040-
orcid.org/0000-0001-9705-1434
4020(98)00955-7
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1117
19.
Zimmerman H.E., Ignatchenko A. J. Org. Chem. 1999,
38.
Adam R., Abarca B., Ballesteros R. Synthesis. 2017,
64, 6635-6645. doi 10.1021/jo990323h
49, 5059-5066. doi 10.1055/s-0036-1588525
20.
Frick J.J., Ly C.Q., Schwarz J.B. Synthesis. 2015, 47,
39.
Abarca B., Ballesteros R., Blanco F., Bouillon A.,
2593-2598. doi 10.1055/s-0034-1379932
Collot V., Domınguez J.-R., Lancelot J.-C., Rault S.
21.
Mine S., Kawamura S., Nakagawa K. Synth. Commun.
Tetrahedron.
2004,
60,
4887-4893. doi
10.1016/
1976, 6, 69-74. doi 10.1080/00397917608072611
j.tet.2004.03.083
22.
Prakash O., Gujral H.K., Rani N., Singh S.P.
40.
Abarca B., Aucejo R., Ballesteros R., Blanco F., García-
Synth. Commun. 2000, 30, 417-425. doi 10.1080/
España E. Tetrahedron Lett. 2006, 47, 8101-8103. doi
00397910008087337
10.1016/j.tetlet.2006.09.051
23.
Hirayama T., Ueda S., Okada T., Tsurue N., Okuda K.,
41.
Liu S., Sawicki J., Driver T.G. Org. Lett. 2012, 14,
Nagasawa H. Chem. Eur. J. 2014, 20, 4156-4162. doi
3744-3747. doi 10.1021/ol301606y
10.1002/chem.201302997
42.
Rawat D., Kumar R., Adimurthy S. Eur. J. Org. Chem.
24.
Xu P., Xu H.-C. ChemElectroChem. 2019, 6, 4177-
2019, 2019, 7874-7879. doi 10.1002/ejoc.201901748
4179. doi 10.1002/celc.201900080
43.
Tennant G., Vevers R.J.S. J. Chem. Soc., Chem.
25.
Boyer J., Goebel N. J. Org. Chem. 1960, 25, 304-305.
Commun. 1974, 671b-672. doi 10.1039/C3974000671B
doi 10.1021/jo01072a634
44.
L’abbé G., Godts F., Toppet S. J. Chem. Soc., Chem.
26.
Shang Z.-H., Zhang Z.-X., Weng W.-Z., Wang Y.-F.,
Commun. 1985, 589-590. doi 10.1039/C39850000589
Cheng T.-W., Zhang Q.-Y., Song L.-Q., Shao T.-Q.,
45.
Aylward N., Winter H.-W., Eckhardt U., Wentrup C.
Liu K.-X., Zhu, Y.-P. Adv. Synth. Catal. 2021, 363,
J. Org. Chem. 2016, 81, 667-672. doi 10.1021/acs.
490-496. doi 10.1002/adsc.202001052
joc.5b02639
27.
Regitz M. Angew. Chem. Int. Ed. 1965, 4, 431. doi
46.
Abarca B., Alkorta I., Ballesteros R., Blanco F.,
10.1002/anie.196504311
Chadlaoui M., Elguero J., Mojarrad F. Org. Biomol.
28.
Cai Y.-M., Zhang X., An C., Yang Y.-F., Liu W.,
Chem. 2005, 3, 3905-3910. doi 10.1039/B510535H
Gao W.-X., Huang X.-B., Zhou Y.-B., Liu M.-C.,
47.
Boyer J.H., Wolford L.T. J. Am. Chem. Soc. 1958, 80,
Wu H.-Y. Org. Chem. Front. 2019, 6, 1481-1484. doi
2741-2743. doi 10.1021/ja01544a040
10.1039/C9QO00071B
48.
Jones G., Mouat D.J., Tonkinson D.J. J. Chem. Soc.
29.
Abarca-González B. J. Enzyme Inhib. Med. Chem. 2002,
Perkin 1. 1985, 2719-2723. doi 10.1039/P19850002719
17, 359-367. doi 10.1080/1475636021000005622
49.
Wentrup C. Tetrahedron. 1974, 30, 1301-1311. doi
30.
Jones G. Adv. Heterocycl. Chem. 2002, 83, 1-70. doi
10.1016/S0040-4020(01)97303-X
10.1016/S0065-2725(02)83003-3
50.
Wentrup C. Helv. Chim. Acta. 1978, 61, 1755-1764.
31.
Jones G., Abarca B. Adv. Heterocycl. Chem. 2010, 100,
doi 10.1002/hlca.19780610522
195-252. doi 10.1016/S0065-2725(10)10007-5
51.
Adam R., Alom S., Abarca B., Ballesteros R.
32.
Jones G., Sliskovic D.R. Tetrahedron Lett. 1980, 21,
Tetrahedron.
2016,
72,
8436-8441. doi
10.1016/
4529-4530. doi 10.1016/S0040-4039(00)74542-4
j.tet.2016.11.006
33.
Blanco F., Alkorta I., Elguero J., Cruz V., Abarca B.,
52.
Kuhn A., Plüg C., Wentrup C. J. Am. Chem. Soc. 2000,
Ballesteros R. Tetrahedron, 2008, 64, 11150-11158.
122, 1945-1948. doi 10.1021/ja993859t
doi 10.1016/j.tet.2008.09.064
53.
Plüg C., Kuhn A., Wentrup C. J. Chem. Soc. Perkin 1.
34.
Abarca B., Ballesteros R., Mojarred F., Jones G.,
2002, 1366-1368. doi 10.1039/B202523J
Mouat D.J. J. Chem. Soc. Perkin 1. 1987, 1865-1868.
54.
Dong C., Wang X., Pei Z., Shen R. Org. Lett. 2019, 21,
doi 10.1039/P19870001865
4148-4152. doi 10.1021/acs.orglett.9b01334
35.
Bentabed-Ababsa G., Blanco F., Derdour A., Mon-
55.
Kuzaj M., Lüerssen H., Wentrup C. Angew. Chem. Int.
gin F., Trécourt F., Quéguiner G., Ballesteros R., Abar-
Ed. 1986, 25, 480-482. doi 10.1002/anie.198604801
ca B. J. Org. Chem. 2009, 74, 163-169. doi 10.1021/
jo801675h
56.
Tomioka H., Ichikawa N., Komatsu K. J. Am. Chem.
Soc. 1993, 115, 8621-8626. doi 10.1021/ja00072a015
36.
Jones G., Mouat D.J., Pitman M.A., Lunt E., Lyth-
goe D.J. Tetrahedron. 1995, 51, 10969-10978. doi
57.
Zhang Z., Yadagiri D., Gevorgyan V. Chem. Sci. 2019,
10.1016/0040-4020(95)00652-O
10, 8399-8404. doi 10.1039/C9SC02448D
37.
Chiassai L., Adam R., Drechslerová M., Balleste-
58.
Chuprakov S., Hwang F.W., Gevorgyan V. Angew.
ros R., Abarca B. J. Fluor. Chem. 2014, 164, 44-50.
Chem. Int. Ed. 2007, 46, 4757-4759. doi 10.1002/
doi 10.1016/j.jfluchem.2014.05.001
anie.200700804
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1118
КОТОВЩИКОВ и др.
59.
Chuprakov S., Gevorgyan V. Org. Lett. 2007, 9, 4463-
75.
Shen R., Dong C., Yang J., Han L. Adv. Synth. Catal.
4466. doi 10.1021/ol702084f
2018, 360, 4252-4258. doi 10.1002/adsc.201800909
60.
Wang C., Zhou Y., Bao X. J. Org. Chem. 2017, 82,
76.
Moon Y., Kwon S., Kang D., Im H., Hong S. Adv.
3751-3759. doi 10.1021/acs.joc.7b00204
Synth. Catal.
2016,
358,
958-964. doi
10.1002/
adsc.201500967
61.
Kim H., Kim S., Kim J., Son J.-Y., Baek Y., Um K.,
Lee P.H. Org. Lett. 2017, 19, 5677-5680. doi 10.1021/
77.
AbuSalim D.I., Hong S., Baik M.-H. Chem. Asian J.
acs.orglett.7b02826
2018, 13, 2505-2510. doi 10.1002/asia.201800498
62.
Shi Y., Gulevich A.V., Gevorgyan V. Angew. Chem.
78.
Joshi A., Semwal R., Suresh E., Adimurthy S. Chem.
Int. Ed.
2014,
53,
14191-14195. doi
10.1002/
Commun.
2019,
55,
10888-10891. doi
10.1039/
anie.201408335
C9CC05953A
63.
Lv X., Yang H., Shi T., Xing D., Xu X., Hu W. Adv.
79.
Xin L., Wan W., Yu Y., Wan Q., Ma L., Huang X.
Synth. Catal. 2019, 361, 1265-1270. doi 10.1002/
ACS Catal.
2021,
11,
1570-1577. doi
10.1021/
adsc.201801497
acscatal.0c05156
64.
Dequina H.J., Eshon J., Raskopf W.T., Fernández I.,
80.
Roy S., Das S.K., Chattopadhyay B. Angew. Chem. Int.
Schomaker J.M. Org. Lett. 2020, 22, 3637-3641. doi
Ed. 2018, 57, 2238-2243. doi 10.1002/anie.201711209
10.1021/acs.orglett.0c01124
81.
Dzik W.I., Xu X., Zhang X.P., Reek J.N.H., de Bruin B.
65.
Filippov I.P., Novikov M.S., Khlebnikov A.F., Ros-
J. Am. Chem. Soc. 2010, 132, 10891-10902. doi
tovskii N.V. Eur. J. Org. Chem. 2020, 2020, 2904-
10.1021/ja103768r
2913. doi 10.1002/ejoc.202000210
82.
Lu H., Dzik W.I., Xu X., Wojtas L., de Bruin B.,
66.
Xu G., Shao Y., Tang S., Chen Q., Sun J. Org. Lett.
Zhang X.P. J. Am. Chem. Soc. 2011, 133, 8518-8521.
2020, 22, 9303-9307. doi 10.1021/acs.orglett.0c03533
doi 10.1021/ja203434c
67.
Kim J.H., Gensch T., Zhao D., Stegemann L., Stras-
83.
Zhang Z., Gevorgyan V. Org. Lett. 2020, 22, 8500-
sert C.A., Glorius F. Angew. Chem. Int. Ed. 2015, 54,
8504. doi 10.1021/acs.orglett.0c03099
10975-10979. doi 10.1002/anie.201504757
84.
Rawat D., Ravi C., Joshi A., Suresh E., Jana K., Gangu-
68.
Zhao D., Kim J.H., Stegemann L., Strassert C.A.,
ly B., Adimurthy S. Org. Lett. 2019, 21, 2043-2047.
Glorius F. Angew. Chem. Int. Ed. 2015, 54, 4508-4511.
doi 10.1021/acs.orglett.9b00180
doi 10.1002/anie.201411994
85.
Wang H., Cai S., Ai W., Xu X., Li B., Wang B. Org. Lett.
69.
Jeon W.H., Son J.-Y., Kim J.E., Lee P.H. Org. Lett.
2020, 22, 7255-7260. doi 10.1021/acs.orglett.0c02586
2016, 18, 3498-3501. doi 10.1021/acs.orglett.6b01750
86.
Joshi A., Mohan D.C., Adimurthy S. J. Org. Chem.
70.
Dong Y., Chen J., Cui Y., Bao L., Xu H. Org. Lett.
2016, 81, 9461-9469. doi 10.1021/acs.joc.6b01742
2020, 22, 772-775. doi 10.1021/acs.orglett.9b03904
87.
Opsomer T., Van Hoof M., D’Angelo A., Dehaen W.
71.
Xu H.-B., Zhu Y.-Y., Dong L. J. Org. Chem. 2019, 84,
Org. Lett.
2020,
22,
3596-3600. doi
10.1021/
16286-16292. doi 10.1021/acs.joc.9b02468
acs.orglett.0c01069
72.
Helan V., Gulevich A.V., Gevorgyan V. Chem. Sci.
88.
Zhang G.-T., Zhang J., Xu Y.-J., Dong L. Eur. J.
2015, 6, 1928-1931. doi 10.1039/C4SC03358B
Org. Chem. 2018, 2018, 4197-4201. doi 10.1002/
73.
Shi Y., Gevorgyan V. Chem. Commun. 2015, 51,
ejoc.201800764
17166-17169. doi 10.1039/C5CC07598J
89.
Lamaa D., Lin H.-P., Bzeih T., Retailleau P., Alami M.,
74.
Joshi A., Mohan D.C., Adimurthy S. Org. Lett. 2016,
Hamze A. Eur. J. Org. Chem. 2019, 2019, 2602-2611.
18, 464-467. doi 10.1021/acs.orglett.5b03509
doi 10.1002/ejoc.201801803
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
КАСКАДНЫЕ ТР
АНСФОРМАЦИИ С УЧАСТИЕМ [1,2,3]ТРИАЗОЛО[1,5-a]ПИРИДИНОВ
1119
Cascade Transformations of [1,2,3]Triazolo[1,5-a]pyridines
Serving as Convenient Precursors of Diazo Compounds
and Metal Carbenes
Y. N. Kotovshchikov*, V. A. Voloshkin, G. V. Latyshev, N. V. Lukashev, and I. P. Beletskaya
M.V. Lomonosov Moscow State University, Chemistry Department, Leninskiye Gory, 1/3, Moscow, 119991 Russia
*e-mail: kotovshchikov@org.chem.msu.ru
Received April 10, 2020; revised April 19, 2020; accepted April 25, 2020
The review is devoted to the use of [1,2,3]triazolo[1,5-a]pyridines as precursors of tautomeric 2-(diazomethyl)-
pyridines. This methodology represents a convenient tool for the synthesis of various types of nitrogen-con-
taining heterocycles. Both non-catalytic transformations and cascade reactions involving metal carbenes, which
have been intensively studied in recent years, are considered. Major approaches for the preparation of [1,2,3]-
triazolo[1,5-a]pyridines are also summarized in the review.
Keywords: triazoles, diazo compounds, carbenoids, tautomerism, heterocycles
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021