ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 8, с. 1120-1131
УДК 547.1′:541.67
ПОЛЯРНОСТЬ И КОНФОРМАЦИОННЫЙ
АНАЛИЗ ТРИ(1-НАФТИЛ)ФОСФИНА,
ТРИ(2-НАФТИЛ)ФОСФИНА И ИХ ХАЛЬКОГЕНИДОВ
© 2021 г. А. А. Кузнецоваa, Д. В. Чачковb, Н. А. Белогорловаc, В. А. Куимовc,
С. Ф. Малышеваc, Я. А. Верещагинаa, *
a ФГАОУ ВО «Казанский (Приволжский) федеральный университет», Россия, 420008 Казань, ул. Кремлевская, 18
*e-mail: yavereshchagina@yahoo.com
b Казанское отделение Межведомственного суперкомпьютерного центра Российской академии наук - филиал
Федерального государственного учреждения
«Федеральный научный центр «Научно-исследовательский институт системных исследований РАН»,
Россия, 420111 Казань, ул. Лобачевского, 2/31
c ФГБУН «Иркутский институт химии им. А.Е. Фаворского СО РАН», Россия, 664033 Иркутск, ул. Фаворского, 1
Поступила в редакцию: 16.03.2021 г.
После доработки 27.03.2021 г.
Принята к публикации 30.03.2021 г.
Методами дипольных моментов, ИК спектроскопии и квантовой химии DFT B3PW91/6-311++G(df,p)
определена полярность и установлено строение три[1-(или 2-)нафтил]фосфинов и их халькогенидов.
В растворе для три(1-нафтил)фосфина предпочтителен единственный конформер с гош,гош,гош-ори-
ентацией заместителей у атома фосфора; три(2-нафтил)фосфин и их халькогениды существуют в виде
нескольких находящихся в конформационном равновесии форм с пропеллерным расположением заме-
стителей и цис- или гош-ориентацией связей Csp2-Csp2 и P=X (X = НЭП, O, S, Se).
Ключевые слова: три(1-нафтил)фосфин, три(2-нафтил)фосфин, фосфинхалькогениды, дипольные
моменты, конформационный анализ, ИК спектроскопия, DFT расчеты
DOI: 10.31857/S0514749221080036
ВВЕДЕНИЕ
нов в кристаллическом состоянии [13-15] или в
составе комплексов, в которых эти фосфины вы-
В последнее время возрастает интерес к третич-
ступают как лиганды [2, 11-13, 16, 17]. Несмотря
ным фосфинам с объемными ароматическими за-
на значительное число триарилфосфинов, исполь-
местителями, используемым для дизайна металло-
зуемых для создания металлокомплексов, описаны
комплексов. Комплексы, содержащие три(1-наф-
лишь единичные соединения, включающие три-
тил)фосфин в качестве лиганда, выступают в роли
нафтилзамещенные фосфинхалькогениды, напри-
катализаторов [1-9] и проявляют более высокую
мер, сэндвичевый биядерный комплекс рения(I) с
каталитическую активность по сравнению с ком-
2 молекулами три(1-нафтил)фосфиноксида [13].
плексами, содержащими трифенилфосфин [1, 2].
Координационные соединения Cu(I) с три(1-наф-
Напротив, сведения о строении в растворе со-
тил)фосфиновыми лигандами проявляют лю-
единений трех- и четырехкоординированного фос-
минесцентные свойства [2]. Комплексы Au(I) с
фора, содержащих объёмные полициклические, в
три(1-нафтил)фосфином обладают люминесцент-
том числе 1-нафтильные и 2-нафтильные, замести-
ными свойствами [10, 11] и противоопухолевой
тели и связи P=X (X = O, S, Se), крайне ограни-
активностью [12]. В литературных источниках
чены. В то же время данные о конформационных
описано строение тринафтилзамещенных фосфи-
свойствах таких соединений совершенно необхо-
1120
ПОЛЯРНОСТЬ И КОНФОРМАЦИОННЫЙ АНАЛИЗ ТРИ(1-НАФТИЛ)ФОСФИНА
1121
X
X
P
P
2
8
1
1
3
9
7
2
9
4
6
3
8
10
10
5
4
5
7
6
Х = НЭП (1), O (2), S (3), Se (4).
Х = НЭП (5), O (6), S (7), Se (8).
Рис. 1. Структуры соединений 1-8
димы для изучения их физико-химических харак-
6-311++G(df,p). Полученные результаты представ-
теристик и реакционной способности.
ляют эффективную основу для изучения реакци-
онной способности арилзамещенных фосфинов и
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
их халькогенидов.
В настоящей работе с целью выявления осо-
Экспериментальные дипольные моменты
бенностей строения, в том числе влияния распо-
три(1-нафтил)фосфина (1), три(1-нафтил)фосфи-
ложения объемных нафтильных заместителей,
мы впервые определили полярность три(1-наф-
ноксида (2), три(1-нафтил)фосфинсульфида (3),
тил)- и три(2-нафтил)фосфинов и их халькогени-
три(1-нафтил)фосфинселенида (4), три(2-нафтил)-
дов и исследовали их пространственное строение
фосфина
(5), три(2-нафтил)фосфиноксида
(6),
в растворе методами дипольных моментов, ИК
три(2-нафтил)фосфинсульфида (7), три(2-нафтил)-
спектроскопии и квантовой химии DFT B3PW91/
фосфинселенида (8) в растворах бензола, 1,4-ди-
Таблица 1. Коэффициенты расчетных уравнений, ориентационные поляризации и экспериментальные дипольные
моменты соединений 1-8
Соединение
Растворитель
α
γ
Рор, см3
μ, Д
1
Тетрахлорметан
2.527
1.321
50.104
1.56
2
Диоксан
6.639
0.738
413.420
4.47
Бензол
6.883
0.490
534.000
5.08
3
Диоксан
7.515
0.774
411.690
4.46
Бензол
5.074
0.386
433.119
4.58
4
Диоксан
6.871
0.547
510.105
4.97
5
Бензол
1.027
0.616
31.326
1.23
Бензол
6.549
0.490
487.830
4.86
6
Диоксан
8.433
0.730
538.335
5.10
Бензол
4.738
0.671
339.324
4.05
7
Диоксан
6.063
1.033
360.610
4.18
Бензол
7.308
0.593
620.295
5.48
8
Диоксан
10.485
0.709
789.581
6.18
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1122
КУЗНЕЦОВА и др.
моменты (табл. 2, 3). Возникновение конформе-
ров обусловлено внутренним вращением молекул
относительно связей Р-Csp2 (арил), приводящем
к различному расположению нафтильных ради-
калов относительно группы P=X (X = НЭП, O, S,
Se). Процентное содержание конформеров в рав-
новесной смеси было оценено на основе энергий
Гиббса, полученных квантово-химическими рас-
чётами.
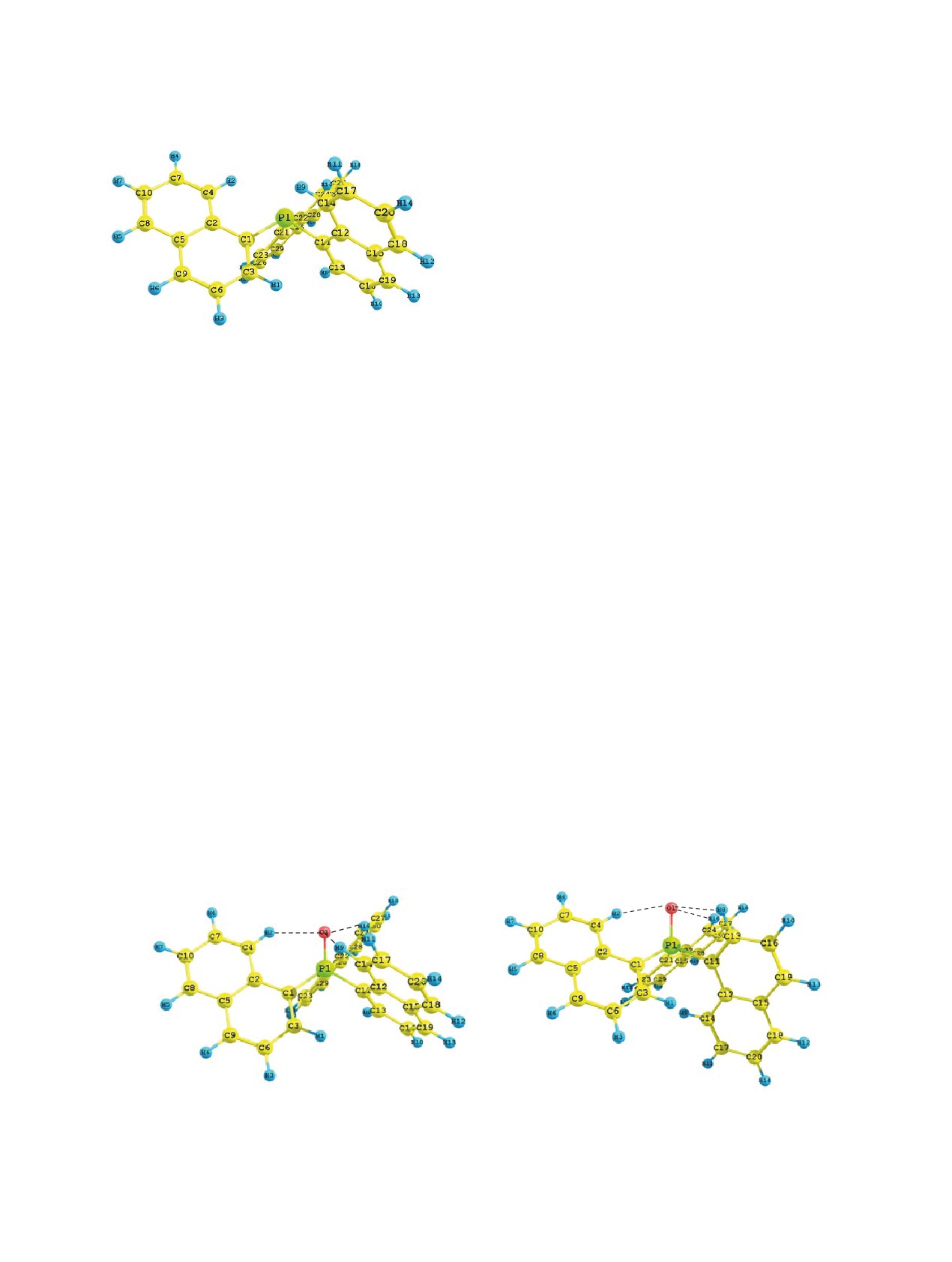
1a
Согласно теоретическим расчётам, для
Рис. 2. Предпочтительный конформер соединения 1
три(1-нафтил)фосфина (1) найден единственный
по данным DFT B3PW91/6-311++G(df,p)
предпочтительный конформер 1а (табл. 2), в ко-
тором атом фосфора пирамидален, нафтильные
оксана или тетрахлорметана определены с помо-
заместители расположены подобно пропеллеру и
щью второго метода Дебая (табл. 1).
гош,гош,гош-ориентированы относительно груп-
Полярность фосфинов 1 и 5 невелика, что ха-
пы Р-НЭП (рис. 2). Двугранные углы между осью
рактерно для соединений трёхкоординированного
P-НЭП и связями Csp2-Csp2 одинаковы и состав-
фосфора, тогда как полярность фосфинхалькоге-
ляют 42°. Полученные данные согласуются с ли-
нидов 2-4 и 6-8 достаточно высока и соответству-
тературными сведениями о строении молекулы
ет диапазону значений для соединений четырёх-
фосфина 1 в кристалле [14, 15].
координированного фосфора с двойными связями
Для соединения 1 зарегистрированы ИК спек-
фосфор-халькоген (Р=О, P=S, P=Sе) [18].
тры в кристаллическом состоянии и в растворе
Теоретический конформационный анализ
хлороформа. При переходе от жидкого образца к
фосфинов и их халькогенидов 1-8 осуществлен
твёрдому не происходит «вымораживания» полос
с помощью квантово-химических расчетов мето-
поглощения, что свидетельствует о реализации в
дом теории дифференциала плотности B3PW91/
растворе только одного конформера.
6-311++G(df,p), который хорошо себя зарекомен-
довал в исследовании строения подобных фосфо-
Введение фосфорильной группы в фосфинок-
рорганических соединений [19]. Для каждого из
сид 2 приводит к увеличению количества предпоч-
соединений 1-8 были найдены предпочтительные
тительных конформеров до 2 (табл. 2), в которых
конформеры (приведены для соединений 1, 2, 5
атом фосфора пирамидален, нафтильные замести-
и 7 на рис. 2-5, для соединений 3, 4, 6 и 8 - на
тели имеют пропеллерное расположение (рис. 3).
рис. 1П-4П, доп. материалы), рассчитаны их от-
Конформеры 2a и 2b отличаются пространствен-
носительные энергии и теоретические дипольные
ной ориентацией заместителей: в симметричной
2a
2b
Рис. 3. Предпочтительные конформеры соединения 2 по данным DFT B3PW91/6-311++G(df,p)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ПОЛЯРНОСТЬ И КОНФОРМАЦИОННЫЙ АНАЛИЗ ТРИ(1-НАФТИЛ)ФОСФИНА
1123
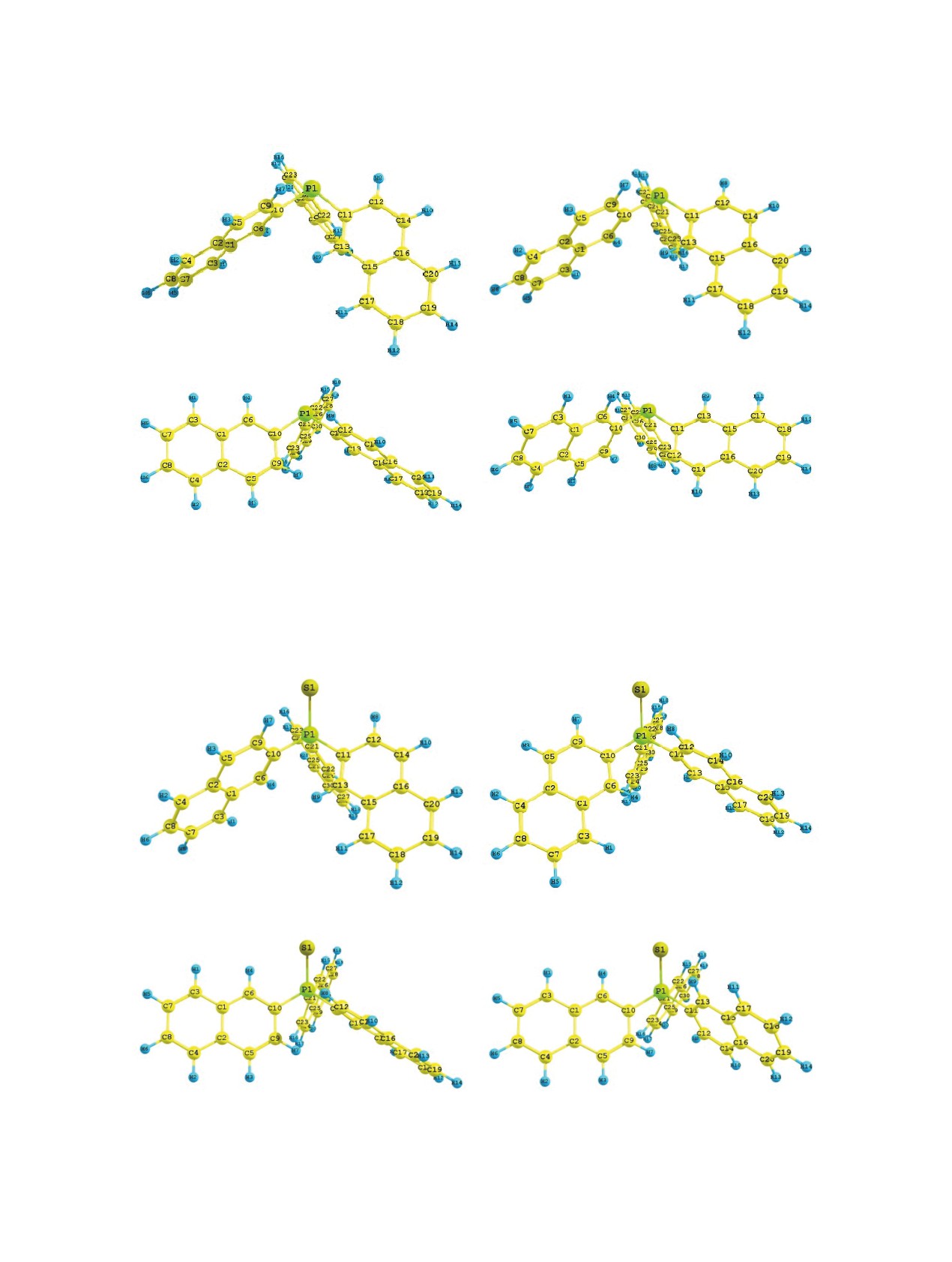
5a
5b
5c
5d
Рис. 4. Предпочтительные конформеры соединения 5 по данным DFT B3PW91/6-311++G(df,p)
форме 2a, обладающей нулевой относительной
ном конформере 2b наблюдается разворот одного
энергией, нафтильные заместители гош-ориенти-
из нафтильных радикалов в противоположную
рованы относительно связи P=O (двугранные углы
сторону от группы Р=О, и заместители у атома
O1=P1-C1-C2, O1=P1-C11-C12 и O1=P1-C21-C22
фосфора (а именно связи Csp2-Csp2 нафтильных
имеют одинаковые значения 44°). В менее выгод-
радикалов) имеют гош,цис,гош-ориентацию отно-
7a
7b
7c
7d
Рис. 5. Предпочтительные конформеры соединения 7 по данным DFT B3PW91/6-311++G(df,p)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1124
КУЗНЕЦОВА и др.
Таблица 2. Относительные энергии, энергии Гиббса, теоретические и вычисленные дипольные моменты, процент-
ное содержание и некоторые геометрические параметры предпочтительных конформеров соединений 1-4
X···H9
Конформер
ΔE, кДж/моль
ΔG, кДж/моль
μтеор, Д
μ
, Д
n, %
X···H2, Å
X···H16, Å
выч
(H8*), Å
1a
0.0
0.0
1.06
1.34
100.0
2a
0.0
0.0
3.56
4.28
97.2
2.322
2.323
2.322
2b
7.3
8.8
3.86
4.06
2.8
2.368
2.325*
2.489
3a
0.0
0.0
4.23
4.63
74.6
2.708
2.707
2.707
3b
1.5
2.7
4.61
4.46
25.4
2.773
2.567*
2.862
4a
0.0
0.0
4.40
4.66
60.7
2.798
2.799
2.800
4b
0.4
1.1
4.81
4.51
39.3
2.867
2.641*
2.951
сительно связи Р=О (двугранные углы O1=P1-C1-
фосфинсульфида 3 существуют 2 предпочтитель-
C2 47°, O1=P1-C11-C13 14.5° и O1=P1-C21-C22 55°).
ных конформера (табл. 2), характеризующихся
пирамидальным строением атома фосфора и про-
Расстояние между одним из атомов водорода
пеллерным расположением заместителей отно-
каждого нафтильного заместителя и атомом кис-
сительно связи P=S (рис. 1П, доп. материалы). В
лорода фосфорильной группы в ротамерах 2a,
симметричном конформере 3a с нулевой относи-
b свидетельствует о возможном возникновении
тельной энергией нафтильные заместители гош,-
слабых внутримолекулярных взаимодействий
гош,гош-ориентированы относительно связи P=S
Сsp2-H···O=P (табл. 2). Конформер 2a соответству-
(двугранные углы S1=P1-C1-C2, S1=P1-C11-C12 и
ет структуре три(1-нафтил)фосфиноксида в кри-
S1=P1-C21-C22 имеют одинаковые значения 50°).
сталле [13], по данным РСА значения двугранных
Так же, как и в случае фосфиноксида 2, формы 3a
углов O=P-Csp2-Csp2 составляют 42°, 43° и 47°,
и 3b отличаются расположением одного нафтиль-
расстояния Сsp2-H···O=P равны 2.45-2.46 Å.
ного радикала, конденсированное кольцо которого
В ИК спектрах образцов три(1-нафтил)фосфи-
развёрнуто в противоположную сторону от связи
ноксида (2) в кристалле и растворе в хлористом
P=S. В конформере 3b связи Csp2-Csp2 гош,цис,-
метилене количество полос поглощения (νP=O
гош-ориентированы относительно группы P=S
1160 см-1) не меняется, что может свидетельство-
(двугранные углы S1=P1-C1-C2 54°, S1=P1-C11-
вать о его конформационной однородности. По
C12 12° и S1=P1-C21-C22 61°). Теоретические рас-
данным квантово-химических расчётов частоты
стояния между одним из атомов водорода каждого
валентных колебаний связи P=O в конформерах
нафтильного фрагмента и атомом серы тиофос-
2а и 2b близки между собой - 1184 и 1187 см-1,
форильной группы (табл. 2) свидетельствуют о
что делает эти формы практически неразличи-
возможном возникновении внутримолекулярных
мыми в ИК спектрах. Вероятно, именно поэтому
водородных контактов.
в экспериментальных ИК спектрах соединения 2
Согласно теоретическим расчётам, для три-
признаков конформационной неоднородности не
(1-нафтил)фосфинселенида
(4) также найде-
наблюдается. Анализ экспериментальных и теоре-
ны 2 предпочтительных конформера, отличаю-
тических данных для фосфиноксида 2 свидетель-
щихся ориентацией нафтильных заместителей
ствует о практическом ананкомерном равновесии
(табл. 2, рис. 2П, доп. материалы). Как и в слу-
с преобладанием конформера 2a.
чае фосфиноксида 2 и фосфинсульфида 3, в кон-
Замена фосфорильной группы на тиофосфо-
формере 4a, обладающем нулевой относительной
рильную в соединении 3 не приводит к измене-
энергией, реализуется гош,гош,гош-ориентация
нию количества предпочтительных конформеров.
нафтильных групп относительно связи P=Se (дву-
Согласно квантово-химическим расчётам, для
гранные углы Se1=P1-C1-C2, Se1=P1-C11-C12 и
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ПОЛЯРНОСТЬ И КОНФОРМАЦИОННЫЙ АНАЛИЗ ТРИ(1-НАФТИЛ)ФОСФИНА
1125
Se1=P1-C21-C22 имеют одинаковые значения 50°)
тил)фосфинов 5-8 по сравнению с три(1-нафтил)-
(табл. 2). Изменение ориентации одного из за-
фосфинами 1-4, и мы провели сопоставительный
местителей, проявляющееся в повороте второго
анализ данных для этих соединений.
кольца нафтильного фрагмента в противополож-
Для три(2-нафтил)фосфина
(5) с помощью
ную сторону от селенофосфорильной группы,
квантово-химических расчётов найдены 4 энер-
приводит к увеличению энергии конформера 4b
гетически предпочтительных конформера 5a-d
(табл. 2), связи Csp2-Csp2 гош,цис,гош-ориенти-
(табл. 3, рис. 4), в которых атом фосфора пирами-
рованы относительно группы P=Se (двугран-
дален, а нафтильные заместители расположены
ные углы Se1=P1-C1-C2 55°, Se1=P1-C11-C13 11°
в виде пропеллера. В отличие от три(1-нафтил)-
и Se1=P1-C21-C22 62°). Следует отметить, что
фосфина (1), в симметричном конформере 5a
в конформерах 4a и 4b возможно возникнове-
гош,гош,гош-ориентированные нафтильные заме-
ние контактов между одним из атомов водорода
стители развёрнуты в противоположную от НЭП
каждого из нафтильных заместителей и атомом
сторону (двугранные углы между осью P-НЭП и
селена группы P=Se (табл. 2). Подобные внутри-
связями Csp2-Csp2 одинаковы и равны -42°). В кон-
молекулярные взаимодействия C-H···Se наблю-
формере 5b два заместителя сохраняют гош-распо-
дались, например, в кристаллах трис(4-метилфе-
ложение, а третий - цис-ориентирован относитель-
нил)фосфинселенида [20], а также в молекулах
но НЭП (двугранные углы НЭП-P-C10-C6 -45°,
S-этилдифенэтилфосфиноселенотиоата [19].
НЭП-P-C11-C13 -48° и НЭП-P-C21-C22 -28°).
Изменение положения замещения нафтиль-
В конформере 5c нафтильные заместители гош,-
ных радикалов у атома фосфора могло повлиять
гош,гош-ориентированы (двугранные углы между
на конформационные характеристики три(2-наф-
осью Р-НЭП и связями Csp2-Csp2 равны 34°, 30° и
Таблица 3. Относительные энергии, энергии Гиббса, теоретические и вычисленные дипольные моменты и процент-
ное содержание предпочтительных конформеров соединений 5-8
Конформер
ΔE, кДж/моль
ΔG, кДж/моль
μтеор, Д
μвыч, Д
n, %
5a
0.0
0.0
1.65
1.28
39.4
5b
1.1
0.8
1.52
1.32
28.1
5c
2.5
2.1
1.42
1.35
17.0
5d
5.0
2.3
1.35
1.31
15.5
6a
0.0
0.0
4.87
4.05
43.7
6b
0.2
1.2
4.48
4.09
26.5
6c
0.6
1.9
4.07
4.12
20.1
6d
2.1
3.7
3.67
4.14
9.8
7a
0.0
0.0
5.54
4.56
41.3
7b
0.6
0.7
5.12
4.55
31.4
7c
1.8
2.2
4.76
4.54
16.9
7d
4.4
3.4
4.51
4.55
10.4
8a
0.0
0.0
5.71
4.61
38.5
8b
0.7
0.2
5.29
4.62
36.2
8c
2.0
2.2
4.93
4.60
15.9
8d
5.0
3.5
4.70
4.61
9.4
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1126
КУЗНЕЦОВА и др.
54°). В симметричном конформере 5d заместители
конформере 7c - цис,гош,цис (двугранные углы
гош,гош,гош-ориентированы относительно НЭП
S1=P1-C10-C6 28°, S1=P1-C11-C12 57° и S1=P1-
(двугранные углы между осью Р-НЭП и связями
C21-C22 21°). Конформер 7d с наибольшей энер-
Csp2-Csp2 одинаковы и составляют 39°).
гией характеризуется гош,гош,гош-расположени-
ем нафтильных заместителей относительно связи
При введении фосфорильной группы в соеди-
P=S (двугранные углы S=P-Csp2-Csp2 одинаковы и
нение 6 количество предпочтительных конформе-
равны 33°).
ров не меняется: согласно теоретическим расчё-
там найдены 4 конформера 6a-d (табл. 3, рис. 3П,
В конформерах 7b, c, d возможны слабые вну-
доп. материалы), в которых атом фосфора пирами-
тримолекулярные взаимодействия между одним
дален, 2-нафтильные заместители расположены
из атомов водорода одной или двух нафтильных
в виде пропеллера. В конформере 6a нафтильные
групп и атомом серы (7b: S···H15 2.820 Å; 7c:
заместители (а именно связи Csp2-Csp2) гош,гош,-
S···H4 2.875 Å, S···H15 2.800 Å; 7d: S···H4 2.918 Å,
гош-ориентированы относительно связи P=O (дву-
S···H9 2.920 Å и S···H15 2.918 Å).
гранные углы O=P-Csp2-Csp2 составляют -35°).
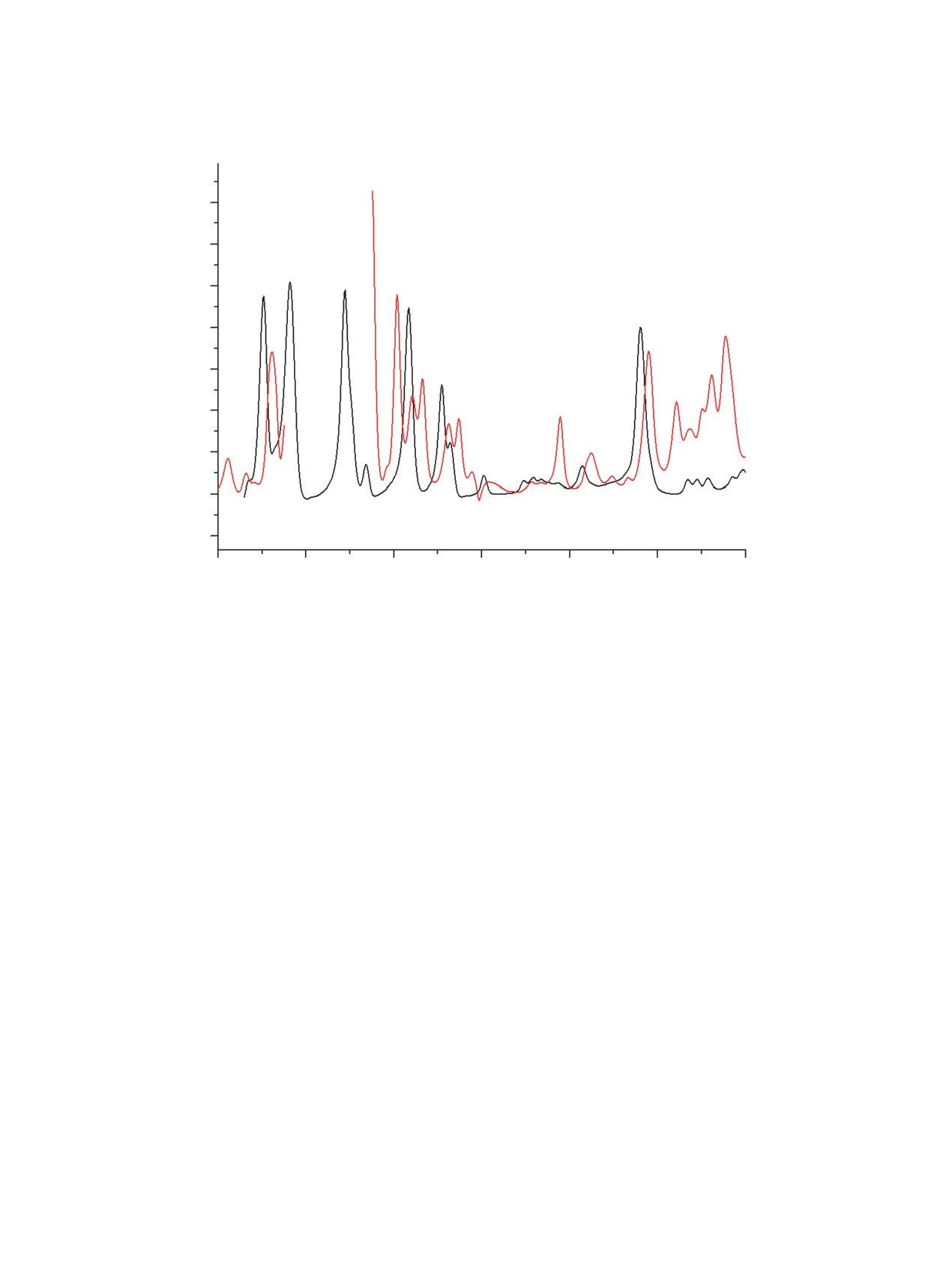
При сравнении ИК спектров три(2-нафтил)фос-
Для формы 6b наблюдается гош,гош,цис-располо-
финсульфида (7) в кристалле и растворе в хлори-
жение заместителей относительно фосфорильной
стом метилене обнаружены признаки конформаци-
связи (двугранные углы O1=P1-C10-C6 33°, O1=P1-
онного равновесия: количество полос поглощения
C11-C13 50° и O1=P1-C21-C22 18°). В конформере
увеличивается при переходе от твёрдого состояния
6c реализуется цис,цис,гош-ориентация замести-
к раствору (рис. 6). В спектре раствора соединения
телей относительно связи Р=О (двугранные углы
7 проявляются 3 полосы 803, 821 и 833 см-1 (не-
O1=P1-C10-C6 -20°, O1=P1-C11-C13 -13° и O1=P1-
плоские деформационные колебания связей C-H в
C21-C22 -62°), а в конформере 6d все 3 замести-
1,3,4-замещённых ароматических системах), тогда
теля цис-ориентированы относительно связи Р=О
как в спектре кристалла - только одна полоса при
(двугранные углы между связями Р=О и Csp2-Csp2
817 см-1. В теоретических спектрах конформеров
имеют одинаковые значения 26°). Значения тео-
7a-d наблюдаются соответствующие колебания
ретического дипольного момента конформера
в интервале 834-839 см-1. Экспериментальные и
6a, имеющего нулевую относительную энергию,
симулированные частоты валентных колебаний
и экспериментального момента фосфиноксида
группы P=S близки и составляют 682 (в кристал-
6, определенного в бензоле, практически равны
ле), 702 (7a), 694 (7b), 701 (7c) и 698 (7d) см-1.
(табл. 1, 3).
Для фосфинселенида 8, как и для фосфинок-
Согласно квантово-химическим расчётам, для
сида 6 и фосфинсульфида 7, предпочтительны 4
фосфинсульфида 7 найдено 4 энергетически пред-
конформера 8a-d (табл. 3), в которых атом фосфо-
почтительных конформера 7a-d (табл. 3), по стро-
ра пирамидален, нафтильные заместители распо-
ению аналогичных конформерам фосфиноксида
ложены подобно пропеллеру относительно связи
6. Для всех форм наблюдается пирамидальное
P=Se. В конформере 8a с нулевой относительной
строение и пропеллерная ориентация нафтильных
энергией реализуется гош,гош,гош-ориентация за-
групп относительно связи P=S (рис. 3П, доп. ма-
местителей (двугранные углы между связями P=Se
териалы). Симметричный конформер 7a с нулевой
и Csp2-Csp2 совпадают и равны -40°). В конформере
относительной энергией характеризуется гош,-
8b заместители гош,гош,цис-ориентированы (дву-
гош,гош-ориентацией заместителей по отноше-
гранные углы: Sе1=P1-C10-C9 42°, Sе1=P1-C11-C12
нию к связи P=S (двугранные углы S=P-Csp2-Csp2
51° и Sе1=P1-C21-C22 22°), в форме 8c - цис,цис,-
равны -40°), при этом конденсированные кольца
гош-конфигурация относительно связи P=Se (дву-
направлены в противоположную сторону от тио-
гранные углы: Sе1=P1-C10-C6 -29°, Sе1=P1-C11-
фосфорильной группы. В форме 7b нафтильные
C13 -20° и Sе1=P1-C21-C23 -58°). В симметричном
радикалы гош,гош,цис-расположены относитель-
конформере 8d все 3 заместителя ориентированы
но связи P=S (двугранные углы S1=P1-C10-C9
гош относительно связи P=Se (двугранные углы
40°, S1=P1-C11-C12 51° и S1=P1-C21-C22 22°), а в
Se=P-Csp2-Csp2 равны 34°).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ПОЛЯРНОСТЬ И КОНФОРМАЦИОННЫЙ АНАЛИЗ ТРИ(1-НАФТИЛ)ФОСФИНА
1127
D
3.5
3.0
2.5
2.0
1.5
1.0
1
0.5
2
0.0
-0.5
600
700
800
900
1000
1100
1200
Волновое число, см-1
Рис. 6. ИК спектры три(2-нафтил)фосфинсульфида (7) в растворе CH2Cl2 (1) и в кристалле (2)
Во всех конформерах фосфинселенида 8 воз-
взаимодействия между атомом водорода каждого
можно образование слабых внутримолекулярных
нафтильного заместителя и атомом кислорода,
контактов между ближайшим атомом водорода
серы или селена соответствующих групп. В рас-
нафтильной группы и атомом селена (8a: Se···H7
творе для три(2-нафтил)замещённых фосфина 5
3.085 Å, Se···H8 3.084 Å, Se···H16 3.082 Å; 8b:
и его халькогенидов 6-8 реализуется равновесие
Se···H15 2.894 Å, Se···H7 3.101 Å; 8c: Se···H4 2.952
4 конформеров, заместители в которых гош- или
Å, Se···H9 2.867 Å; 8d: Se···H4 2.996 Å, Se···H9
транс-ориентированы по отношению к связи P=X
2.997 Å, Se···H15 2.992 Å).
(X = НЭП, O, S, Se). В молекулах соединений 7 и
8 возможно возникновение внутримолекулярных
Сопоставление величин экспериментальных и
контактов между атомом водорода одного из заме-
вычисленных согласно векторно-аддитивной схе-
стителей и атомом серы или селена.
ме дипольных моментов и результатов теоретиче-
ских расчётов позволило нам сделать ряд выводов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экспериментальные и теоретические дипольные
Спектры ЯМР 1Н, 13C, 31Р получены на спек-
моменты соединений 1-8 находятся в хорошем со-
трометрах Bruker DPX
400 и Bruker AV-400
гласии. В растворе три(1-нафтил)фосфин (1) суще-
(400.13, 101.61, 376.50 и 161.98 MГц соответ-
ствует в виде одного конформера с гош,гош,гош-
ственно), внутренний стандарт - ГМДС (1Н, 13C),
ориентированными заместителями относительно
внешний стандарт - 85%-ная H3PO4 (31P).
НЭП атома фосфора, а три(1-нафтил)замещённые
ИК спектры получены на Фурье-спектрометре
фосфинхалькогениды 2-4 - в виде равновесия 2
Bruker Vertex 70.
конформеров, имеющих гош- или цис-ориента-
цию заместителей у атома фосфора относительно
Экспериментальные дипольные моменты
связи P=X (X = O, S, Se). В молекулах соедине-
определены с помощью второго метода Дебая.
ний 2-4 возможны слабые внутримолекулярные
Диэлектрическая проницаемость растворов со-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1128
КУЗНЕЦОВА и др.
единений 1-4 в бензоле и 1,4-диоксане определены
синтезировали из фосфинов 1 и 5 и элементной
на приборе BI-870 (Brookhaven Instruments
серы или селена в хлористом метилене при
Corporation) при 25°C, точность измерения ±0.01.
комнатной температуре.
Показатели преломления растворов определяли
Три(1-нафтил)фосфинсульфид (3). Порошок
с помощью рефрактометра RA-500 (Kyoto
желтого цвета, т.пл. 232-234°C (бензол). Спектр
Electronics), точность измерения ±0.0001.
ЯМР 1H (CDCl3), δ, м.д.: 7.32 д.д (3H, H3, 3JРН 8.0,
Три(1-нафтил)- и три(2-нафтил)фосфины 1 и
3JНН 7.1 Гц), 7.36 т (3H, H6, 3J6-5 = 3J6-7 = 7.1 Гц),
5 синтезировали из красного фосфора и 1-наф-
7.46 д.д (3H, H7, 3J7-6 7.1, 3J7-8 7.1 Гц), 7.87 уш.с
тил- и 2-нафтилфторидов в сверхосновной сис-
(3H, H2), 7.89 д (3H, H8, 3J8-7 8.0 Гц), 8.02 д (3Н, H4,
теме КОН-NМР (N-метилпирролидон) по модер-
3J4-5 8.4 Гц), 8.73 уш.с (3Н, Н5). Спектр ЯМР 13C
низированной методике [21].
(CDCl3), δ, м.д.: 124.14 д (С3, 3JPС 14.7 Гц), 125.90
(С7), 126.07 (С6), 127.43 д (С5, 4JPС 4.3 Гц), 127.34
Три(1-нафтил)- и три(2-нафтил)фосфиноксиды
д (С1, 1JPС 82.3 Гц), 128.70 (С8), 132.55 д (С10, 3JPС
2 и 6 получали окислением фосфинов 1 и 5
8.6 Гц), 133.02 д (С4, 4JPС 1.7 Гц), 133.66 д (С2, 2JPС
перекисью водорода в диоксане (50°C, 1 ч).
9.9 Гц), 133.89 д (С9, 2JPС 9.1 Гц). Спектр ЯМР 31P
Три(1-нафтил)фосфиноксид (2). Порошок бе-
(CDCl3), δ, м.д.: 42.50. Вычислено, %: С 81.06; Н
лого цвета, т.пл. 335-336°C (толуол). Спектр ЯМР
4.76; Р 6.97; S 7.21. C30H21PS. Найдено, %: С 81.25;
1H (ДМСО-d6), δ, м.д.: 7.12 д.д (3H, H2, 3JРН 15.8,
Н 4.59; Р 6.79; S 7.12.
3J2-3 6.8 Гц), 7.44 д.д (3H, H3, 3J3-2 6.8, 3J3-4 8.0 Гц),
Три(2-нафтил)фосфинсульфид (7). Порошок
7.52 д.д (3H, H6, 3J6-5 8.3, 3J6-7 7.1 Гц), 7.61 д.д
светло-бежевого цвета, т.пл. 250-251°C (гексан).
(3H, H7, 3J7-6 7.1, 3J7-8 7.9 Гц), 8.09 д (3H, H8, 3J8-7
Спектр ЯМР 1H (CDCl3), δ, м.д.: 7.53 д.д (3H, H7,
7.9 Гц), 8.20 д (3Н, H4, 3J4-5 8.0 Гц), 8.78 д (3Н, Н5,
3J7-8 7.6, 3J7-6 7.2 Гц), 7.60 д.д (3H, H6, 3J6-7 7.2,
3J5-4 8.0 Гц). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.:
3J6-5 7.6 Гц), 7.82-7.93 м (12H, H3,4,5,8), 8.39 д (3H,
124.30 д (С3, 3JPС 14.0 Гц), 126.18 (С7), 126.67 (С6),
H1,3JPH 15.5 Гц). Спектр ЯМР 13C (CDCl3), δ, м.д.:
127.03 д (С5, 4JPС 4.7 Гц), 128.67 (С8), 128.53 д (С1,
126.96 (C7), 127.21 д (C3, 2JPC 11.2 Гц), 127.74 (C5),
1JPС 101.9 Гц), 132.76 д (С2, 2JPС 11.9 Гц), 132.89 д
128.29 (C6), 128.44 д (C4, 3JPC 12.3 Гц), 129.00
(С4, 4JPС 2.6 Гц), 133.46 д (С10, 3JPС 14.4 Гц), 133.47
(C8), 129.89 д (C2, 1JPC 85.9 Гц), 132.41 д (C9, 3JPC
д (С9, 2JPС 2.2 Гц). Спектр ЯМР 31P (CDCl3), δ,
14.0 Гц), 134.13 д (C1, 2JPC 10.7 Гц), 134.47 д (C10,
м.д.: 40.94. Вычислено, %: С 84.10; Н 4.94; Р 7.23.
4JPC 2.5 Гц). Спектр ЯМР 31P (CDCl3), δ, м.д.:
C30H21PO. Найдено, %: С 84.25; Н 4.89; Р 6.99.
44.34. Вычислено, %: С 81.06; Н 4.76; Р 6.97; S
Три(2-нафтил)фосфиноксид (6). Порошок бе-
7.21. C30H21PS. Найдено, %: С 81.17; Н 4.67; Р
жевого цвета, т.пл. 237-239°C (гексан). Спектр
6.86; S 7.63.
ЯМР 1H (CDCl3), δ, м.д.: 7.52 д.д (3H, H7, 3J7-8 7.7,
Три(1-нафтил)фосфинселенид (4). Порошок
3J7-6 7.5 Гц), 7.58 д.д (3H, H6, 3J6-7 7.5, 3J6-5 7.2 Гц),
светло-желтого цвета, т.пл. 274-275°C (гексан).
7.75 д.д.д (3H, H3, 3J3-4 8.6, 3JPH 10.2, 4J3-1 1.5 Гц),
Спектр ЯМР 1H (CDCl3), δ, м.д.: 7.35 и 7.39 м
7.86 д (3H, H5, 3J5-6 7.2 Гц), 7.88 д (3H, H8, 3J8-7
(3H, H3,6), 7.45 д.д (3H, H7, 3J7-8 7.7, 3J7-6 6.8 Гц),
7.7 Гц), 7.92 д.д (3H, H4, 3J4-3 8.6, 4JPH 2.7 Гц), 8.38
7.88 д (3H, H8, 3J8-7 7.7 Гц), 7.94 уш.с (3H, H2),
д (3H, H1, 3JPH 13.9 Гц). Спектр ЯМР 13C (CDCl3),
8.01 д (3H, H4, 3J4-5 7.8 Гц), 8.78 уш.с (3H, H5).
δ, м.д.: 126.87 д (C3, 2JPC 10.6 Гц), 126.89 (C7),
Спектр ЯМР 13C (CDCl3), δ, м.д.: 124.59 д (C3, 2JPC
127.77 (C5), 128.22 (C6), 128.34 д (C4, 3JPC 11.9 Гц),
14.8 Гц), 126.31 (С6), 126.42 (С7), 126.53 д (C1, 1JPC
128.90 (C8), 129.61 д (C2, 1JPC 104.8 Гц), 132.39 д
73.7 Гц), 128.09 (C5), 128.38 (C6), 128.99 д (C8, 3JPC
(C9, 3JPC 13.4 Гц), 134.07 д (C1, 2JPC 9.4 Гц), 134.68
1.4 Гц), 133.12 д (C9, 3JPC 8.2 Гц), 133.43 д (C4,
д (C10, 4JPC 2.3 Гц). Спектр ЯМР 31P (CDCl3), δ,
4JPC 3.0 Гц), 134.42 д (C10, 2JPC 9.0 Гц), 134.52 д
м.д.: 28.71. Вычислено, %: С 84.10; Н 4.94; Р 7.23.
(C2, 2JPC 9.9 Гц). Спектр ЯМР 31P (CDCl3), δ, м.д.:
C30H21PO. Найдено, %: С 84.02; Н 4.92; Р 7.05.
25.65. Вычислено, %: С 73.32; Н 4.31; Р 6.30; Se
Ряд три(1-нафтил)- и три(2-нафтил)фосфин-
16.07. C30H21PSe. Найдено, %: С 73.29; Н 4.25; Р
сульфидов 3 и 7 и -фосфинселенидов 4 и
8
6.16; Se 15.87.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ПОЛЯРНОСТЬ И КОНФОРМАЦИОННЫЙ АНАЛИЗ ТРИ(1-НАФТИЛ)ФОСФИНА
1129
Три(2-нафтил)фосфинселенид (8). Порошок
[18]}, m(Р=>S)
3.29 Д
{вычислен из μэксп
светло-бежевого цвета, т.пл. 256-257°C (гексан).
(C6H5)3Р=S [18]}, m(Р=>Se) 3.34 Д {вычислен из
Спектр ЯМР 1H (CDCl3), δ, м.д.: 7.53 д.д (3H, H7,
μэксп (C6H5)3Р=Se [24]}.
3J7-8 8.1, 3J7-6 6.8 Гц), 7.60 д.д (3H, H6, 3J6-7 = 3J6-5
Квантово-химические расчеты выполнены при
6.8 Гц), 7.84 д (3H, H8, 3J8-7 8.1 Гц), 7.87 д.д.д
помощи программы Gaussian 09 [25]. Соответствие
(3H, H3, 3J3-4 8.6, 3JPH 9.2, 4J3-1 1.7 Гц), 7.89 д (3H,
найденных стационарных точек энергетическим
H5, 3J5-6 6.8 Гц), 7.92 д.д (3H, H4, 3J4-3 8.6, 4JPH
минимумам доказывали методом расчета вторых
3.3 Гц), 8.38 д (3H, H1, 3JPH 15.8 Гц). Спектр ЯМР
производных по координатам атомов. Все равно-
13C (CDCl3), δ, м.д.: 127.03 (C7), 127.49 д (C3, 2JPC
весные структуры, соответствующие точкам ми-
11.3 Гц), 127.74 (C5), 128.39 (C6), 128.48 д (C4,
нимума на поверхностях потенциальной энергии,
3JPC 12.3 Гц), 128.70 д (C2, 1JPC 77.4 Гц), 129.00
имеют только положительные значения частот.
(C8), 132.38 д (C9, 3JPC 14.1 Гц), 134.47 д (C10, 4JPC
ВЫВОДЫ
2.7 Гц), 134.58 д (C1, 2JPC 10.9 Гц). Спектр ЯМР 31P
(CDCl3), δ, м.д.: 36.47 (s + d satellites, 1JPSe 728.9 Гц).
Таким образом, впервые определена поляр-
Вычислено, %: С 73.32; Н 4.31; Р 6.30; Se 16.07.
ность три(1-нафтил)фосфина, три(2-нафтил)фос-
C30H21PSe. Найдено, %: С 73.19; Н 4.35; Р 6.22; Se
фина и их халькогенидов, величины экспери-
15.93.
ментальных дипольных моментов согласуются
с известными данными для соединений трех- и
Экспериментальные дипольные моменты были
четырехкоординированного фосфора с аромати-
вычислены по формуле, выведенной из уравнения
ческими заместителями и двойными связями фос-
Дебая [22]:
фор-халькоген (халькоген = кислород, сера, селен)
µ = 0.01283√PopT.
[1]
[18]. Сравнительный анализ экспериментальных и
теоретических результатов для фосфинов и фос-
Ориентационные поляризации были рассчи-
финхалькогенидов 1-8 показал, что положение
таны на основе экспериментальных значений ди-
замещения нафтильных радикалов у атома фос-
электрической проницаемости и показателя пре-
фора влияет на их конформационные свойства:
ломления по формуле Гуггенгейма-Смита [22]:
в растворе для соединений с 1-нафтильными за-
M
3α
3γ
местителями реализуется меньшее количество
Pop =
,
[2]
d
(ε0 + 2)2 (n20 + 2)2
предпочтительных конформеров, чем в случае
2-нафтилзамещённых, что можно объяснить отно-
сительно меньшей свободой вращения 1-нафтиль-
где М - молекулярная масса вещества, d - плот-
ных заместителей. В наиболее предпочтительных
ность растворителя, ɛ0 и n0 - диэлектрическая
конформерах (ΔE = 0 кДж/моль) соединений 5-8
проницаемость и показатель преломления раство-
конденсированные кольца 2-нафтильных замести-
рителя соответственно, α и γ - тангенсы углов на-
телей развернуты в противоположную сторону
клона прямых на графиках ɛi - ωi и ni2 - ωi соот-
от группы P=Х (Х = НЭП, O, S, Se) в отличие от
ветственно, ɛi, ni и ωi - диэлектрическая проница-
три(1-нафтил)замещенных фосфина и его халько-
емость, показатель преломления и массовая доля
генидов 1-4. Три(1-нафтил)фосфин (1) существует
растворенного вещества i-раствора.
в растворе в виде единственного симметричного
Для вычисления дипольных моментов кон-
конформера с гош-ориентированными замести-
формеров фосфинов и их халькогенидов 1-8 по
телями, тогда как три(2-нафтил)фосфин (5) и их
векторно-аддитивной схеме были использованы
халькогениды 2-4 и 6-8 - в виде нескольких на-
геометрические параметры из результатов кван-
ходящихся в конформационном равновесии форм
тово-химических расчётов и следующие момен-
с пропеллерным расположением заместителей,
ты связей и групп: m(Csp2→Р) 0.39 Д {вычислен
имеющих незаслоненную гош- или заслоненную
из μэксп (C6H5)3Р [18]}, m(H → Сsp2) 0.70 Д [23],
цис-ориентацию относительно связи P=Х (Х =
m(Р=>О) 2.94 Д {вычислен из μэксп (C6H5)3Р=O
НЭП, O, S, Se).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1130
КУЗНЕЦОВА и др.
БЛАГОДАРНОСТИ
3.
Qin C., Wu H., Cheng J., Chen X., Liu M., Zhang W.,
Su W., Ding J. J. Org. Chem. 2007, 72, 4102-4107. doi
Расчеты проведены на суперкомпьютере МВС-
10.1021/jo070267h
10П Межведомственного суперкомпьютерного
4.
Zhao H., Cheng M., Zhang T., Cai M. J. Orga-
центра Российской академии наук.
nomet. Chem.
2015,
777,
50-56. doi
10.1016/
j.jorganchem.2014.11.020
Регистрация
ИК спектров проведена
5.
Desroches J., Tremblay A., Paquin J.-F. Org. Biomol.
Климовицким А.Е. (Химический институт им.
Chem. 2016, 14, 8764-8780. doi 10.1039/c6ob01663d
А.М. Бутлерова, Казанский федеральный универ-
ситет).
6.
Hoen R., Tiemersma-Wegman T., Procuranti B.,
Lefort L., de Vries J.G., Minnaard A.J., Feringa B.L.
ФОНДОВАЯ ПОДДЕРЖКА
Org. Biomol. Chem. 2007, 5, 267-275. doi 10.1039/
b615131k
Работа выполнена при финансовой поддержке
7.
Dabbawala A.A., Jasra R.V., Bajaj H.C. Catal. Commun.
Российского фонда фундаментальных исследова-
2011, 12, 403-407. doi 10.1016/j.catcom.2010.10.026
ний (проект № 20-03-00119).
8.
Onodera G., Hachisuka R., Noguchi T., Miura H.,
КОНФЛИКТ ИНТЕРЕСОВ
Hashimoto T., Takeuchi R. Tetrahedron Lett. 2014, 55,
310-313. doi 10.1016/j.tetlet.2013.10.085
Авторы заявляют об отсутствии конфликта ин-
9.
Elard M., Denis J., Ferreira M., Bricout H., Landy D.,
тересов.
Tilloy S., Monflier E. Catal. Today. 2015, 247, 47-54.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
doi 10.1016/j.cattod.2014.06.002
10.
de Aquino A., Caparros F.J., Aullon G., Ward J.S.,
Дополнительные материалы доступны на
Rissanen K., Jung Y., Choi H., Lima J.C., Rodrí-
guez L. Chem. Eur. J. 2021, 27, 1810-1820. doi
ИНФОРМАЦИЯ ОБ АВТОРАХ
10.1002/chem.202004051
11.
Hobbollahi E., List M., Redhammer G., Zabel M.,
Кузнецова Анастасия Андреевна, ORCID: http://
Monkowius U. Inorg. Chem. Commun. 2016, 65, 24-
orcid.org/0000-0002-6736-0698
27. doi 10.1016/j.inoche.2016.01.009
Чачков Денис Владимирович, ORCID: http://
12.
Svahn N., Moro A.J., Roma-Rodridues C., Puttred-
orcid.org/0000-0002-0073-3672
dy R., Rissanen K., Baptista P.V., Fernandes A.R., Li-
ma J.C., Rodriguez L. Chem. Eur. J. 2018, 24, 14654-
Белогорлова Наталия Алексеевна, ORCID:
14667. doi 10.1002/chem.201802547
13.
Arumugam R., Shankar B., Arumuganathan T.,
Sathiyendiran M. J. Organomet. Chem. 2021, 933,
Куимов Владимир Анатольевич, ORCID: http://
121657. doi 10.1016/j.jorganchem.2020.121657
orcid.org/0000-0001-8230-0266
14.
Davis W.L., Muller A. Acta Cryst. 2012, 68, o3484. doi
Малышева Светалан Филипповна, ORCID:
10.1107/S1600536812048234
15.
Govdi A.I., Vasilevsky S.F., Malysheva S.F., Kazhe-
va O.N., Dyachenko O.A., Kuimov V.A. Heteroatom
Верещагина Яна Александровна, ORCID: http://
Chem. 2018, 29, e21443. doi 10.1002/hc.21443
orcid.org/0000-0002-8259-8143
16.
Meijboom R. Acta Crystallogr., Sect. E. 2011, 67,
СПИСОК ЛИТЕРАТУРЫ
m1438. doi 10.1107/S1600536811038505
1. Dabbawala A.A., Bajaj H.C., Rao G.V.S., Abdi S.H.R.
17.
Ogutu H., Meijboom R. Acta Crystallogr., Sect. E.
Appl. Catal. A: Gen. 2012, 419, 185-193. doi 10.1016/
2012, 68, m394. doi 10.1107/S1600536812008148
j.apcata.2012.01.027
18.
Ишмаева Э.А., Тимошева А.П., Тимошева Н.В.,
Верещагина Я.А. Справочник по дипольным момен-
2. Artem’ev A.V., Kuimov V.A., Matveeva E.A.,
там фосфорорганических соединений. Казань: Изд-
Bagryanskaya I.Yu., Govdi A.I., Vasilevsky S.F.,
во Казанского университета, 1998.
Rakhmanova M.I., Samultsev D.O., Gusarova N.K.,
Trofimov B.A. Inorg. Chem. Commun. 2017, 86, 94-
19.
Vereshchagina Y.A., Khanafieva R.R., Chachkov D.V.,
97. doi 10.1016/j.inoche.2017.09.008
Ishmaeva E.A., Malysheva S.F., Gusarova N.K.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ПОЛЯРНОСТЬ И КОНФОРМАЦИОННЫЙ АНАЛИЗ ТРИ(1-НАФТИЛ)ФОСФИНА
1131
Trofimov B.A. Pure Appl. Chem. 2017, 89, 393-401.
llam J.M., Iyengar S.S., Tomasi J., Barone V., Mennuc-
doi 10.1515/pac-2016-0802
ci B., Cossi M., Scalmani G., Rega N., Petersson G.A.,
20. Muller A. Acta Crystallogr., Sect. E. 2011, 67, o45. doi
Nakatsuji H., Hada M., Ehara M., Toyota K., Fuku-
10.1107/S1600536810050567
da R., Hasegawa J., Ishida M., Nakajima T., Hon-
21. Malysheva S.F., Kuimov V.A., Belogorlova N.A.,
da Y., Kitao O., Nakai H., Klene M., Li X., Knox J.E.,
Albanov A.I., Gusarova N.K., Trofimov B.A. Eur.
Hratchian H.P., Cross J.B., Adamo C., Jaramillo J.,
J. Org. Chem.
2019,
6240-6245. doi
10.1002/
Gomperts R., Stratmann R.E., Yazyev O., Austin A.J.,
ejoc.201901005
Cammi R., Pomelli C., Ochterski J.W., Ayala P.Y.,
22. Минкин В.И., Осипов О.А., Жданов Ю.А. Диполь-
Morokuma K., Voth G.A., Salvador P., Dannen-
ные моменты в органической химии. Л.: Химия,
berg J.J., Zakrzewski V.G., Dapprich S., Daniels A.D.,
1968.
Strain M.C., Farkas O., Malick D.K., Rabuck A.D.,
23. Грибов Л.А., Попов Е.М. Докл. АН СССР. 1962, 145,
Raghavachari K., Foresman J.B., Ortiz J.V., Cui Q.,
761-763.
Baboul A.G., Clifford S., Cioslowski J., Stefa-
24. Lux F., Paetzold R., Danel J., Sobczyk L. J. Chem. Soc.,
nov B.B., Liu G., Liashenko A., Piskorz P., Komaro-
Faraday Trans. 2. 1975, 71, 1610-1617. doi 10.1039/
mi I., Martin R.L., Fox D.J., Keith T., Al-Laham M.A.,
F29757101610
Peng C.Y., Nanayakkara A., Challacombe M.,
25. Frisch M.J., Trucks G.W., Schlegel H.B., Scuse-
Gill P.M.W., Johnson B., Chen W., Wong M.W.,
ria G.E., Robb M.A., Cheeseman J.R., Montgome-
Gonzalez C., Pople J.A. Gaussian 09. Pittsburgh:
ry J.A. Jr., Vreven T., Kudin K.N., Burant J.C., Mi-
Gaussian Inc. 2009.
Polarity and Conformational Analysis
of Tri(1-naphtyl)phosphine, Tri(2-naphtyl)phosphine,
and Their Chalcogenides
A. A. Kuznetsovaa, D. V. Chachkovb, N. A. Belogorlovac, V. A. Kuimovc,
S. F. Malyshevac, and Ya. A. Vereshchaginaa, *
a Kazan Federal University, ul. Kremlevskaya, 18, Kazan, 420008 Russia
*e-mail: yavereshchagina@yahoo.com
b Kazan Department of Joint Supercomputer Center of Russian Academy of Sciences - Branch
of Federal State Institution “Scientific Research Institute for System Analysis of the RAS”,
ul. Lobachevskogo, 2/31, Kazan, 420111 Russia
c A.E. Favorsky Institute of Chemistry, Siberian Branch of Russian Academy of Sciences,
ul. Favorskogo, 1, Irkutsk, 664033 Russia
Received March 16, 2021; revised March 27, 2021; accepted March 30, 2021
The polarities and the structures of tri(1-naphthyl)- and tri(2-naphthyl)phosphines and their chalcogenides
were determined by the methods of dipole moments, IR spectroscopy and quantum chemistry DFT B3P-
W91/6-311++G(df, p). In solution, a single conformer with gauche,gauche,gauche-orientation of substituents at
the phosphorus atom is preferred for tri(1-naphthyl)phosphine; tri(2-naphthyl)phosphine and their chalcogenides
exist as a conformational equilibrium of several forms with a propeller arrangement of substituents and cis- or
gauche-orientation of the Csp2-Csp2 bonds and the P=X group (X = LP, O, S, Se).
Keywords: tri(1-naphthyl)phosphine, tri(2-naphthyl)phosphine, phosphine chalcogenides, dipole moments,
conformational analysis, IR spectroscopy, DFT calculations
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021