ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 8, с. 1132-1145
УДК 547.539.1
ВЗАИМОДЕЙСТВИЕ ПЕРФТОРБЕНЗОЦИКЛОБУТЕНА
С ИЗОМЕРНЫМИ ТЕТРАФТОРБЕНЗОЛАМИ
В СРЕДЕ SbF5
© 2021 г. Т. В. Меженковаa, *, В. В. Комаровa, b, В. М. Карповa, В. Р. Синяковa,
Я. В. Зоновa, В. И. Красновa
a ФГБУН «Новосибирский институт органической химии им. Н.Н. Ворожцова СО РАН»,
Россия, 630090 Новосибирск, просп. Академика Лаврентьева, 9
*e-mail: mtv@nioch.nsc.ru
b ФГАОУ ВО «Новосибирский национальный исследовательский государственный университет»,
Россия, 630090 Новосибирск, ул. Пирогова, 2
Поступила в редакцию 10.03.2021 г.
После доработки 21.03.2021 г.
Принята к публикации 23.03.2021 г.
При взаимодействии перфторбензоциклобутена (1 моль) с изомерными тетрафторбензолами (2 моль)
в среде SbF5 после обработки реакционных смесей HF образуются соответствующие 1,2-бис(тетра-
фторфенил)перфторбензоциклобутены, а после гидролиза реакционных смесей - (3,4,5,6-тетрафторбен-
зол-1,2-диил)бис[(тетрафторфенил)метаноны]. Наряду с ними, в реакциях с 1,2,4,5- и 1,2,3,4-тетрафтор-
бензолами получаются 4,5,6,7-тетрафтор-1,3,3-трис(тетрафторфенил)-1,3-дигидро-2-бензофуран-1-олы,
а при взаимодействии с 1,2,3,4-тетрафторбензолом образуется также {2-[бис(2,3,4,5-тетрафторфенил)-
метил]-3,4,5,6-тетрафторфенил}(2,3,4,5-тетрафторфенил)метанон.
Ключевые слова: перфторбензоциклобутен, тетрафторбензол, катион, скелетные превращения, пяти-
фтористая сурьма
DOI: 10.31857/S0514749221080048
ВВЕДЕНИЕ
цикла. В реакции с 1,2,3,5-тетрафторбензолом
получаются соединения, отвечающие раскрытию
Известно, что в перфтор-1-фенил-1,2-диэтил-
четырехчленного кольца, а при взаимодействии
бензоциклобутене, образующемся в реакции пер-
с 1,2,3,4-тетрафторбензолом, наряду с продук-
фтор-1,2-диэтилбензоциклобутена с C6F5H в при-
том раскрытия четырехчленного кольца, образу-
сутствии пятифтористой сурьмы, наряду с харак-
ется перфтор-9,10-диэтил-9,10-дигидроантрацен
терным для перфторалкилбензоциклобутенов ка-
и его 9-гидроксипроизводное [3]. При взаимо-
тионоидным раскрытием четырехчленного цикла,
действии перфторбензоциклобутена (1) с избыт-
происходит необычное расширение пентафтор-
ком пентафторбензола в SbF5 и последующей
бензольного кольца до семичленного цикла [1, 2].
обработке реакционной смеси водой получается
Направление катионоидных скелетных превраще-
перфтор-1,3,3-трифенил-1,3-дигидро-2-бензофу-
ний продуктов арилирования перфтор-1,2-диэтил-
ран-1-ол в результате скелетных превращений
бензоциклобутена тетрафторбензолами зависит
образующегося в реакции перфтор-1,1,2-трифе-
от строения тетрафторбензола. Так, взаимодей-
нилбензоциклобутена, а также продукты гидроли-
ствие с 1,2,4,5-тетрафторбензолом в среде SbF5
за последнего [4]. С целью исследования взаимо-
приводит к образованию продуктов расширения
действия перфторбензоциклобутена (1) с другими
тетрафторфенильного кольца до семичленного
полифторбензолами в настоящей работе изучена
1132
ВЗАИМОДЕЙСТВИЕ ПЕРФТОРБЕНЗОЦИКЛОБУТЕНА С ИЗОМЕРНЫМИ ТЕТР
АФТОРБЕНЗОЛАМИ
1133
его реакция с тетрафторбензолами в присутствии
дит к образованию (3,4,5,6-тетрафторбензол-1,2-
SbF5.
диил)-бис[(2,3,4,6-тетрафторфенил)метанона] (5).
Кроме того, обнаружено незначительное количе-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ство
4,5,6,7-тетрафтор-1,3-бис(2,3,4,6-тетрафтор-
Установлено, что при взаимодействии соедине-
фенил)-2-бензофурана (6) (схема 1).
ния 1 с 1,2,3,5-тетрафторбензолом (2) (соотноше-
При обработке реакционной смеси, получен-
ние соединений 1:2 = 1:1) в среде SbF5 при 26°С с
ной в аналогичных условиях из соединений 1 и 2,
последующим гидролизом реакционной смеси об-
реагентом Ола (HF-Ру), a затем водой образуется
разуется
1-(2,3,4,6-тетрафторфенил)перфторбен-
смесь
1-(2,3,4,6-тетрафторфенил)перфторбензо-
зоциклобутен-1-ол (3). В отдельном эксперименте
циклобутена
(7) и
1,2-бис(2,3,4,6-тетрафторфе-
показано, что из соединения 1 и тетрафторбензола
2 в SbF5 генерируется 7-(2,3,4,6-тетрафторфенил)-
нил)перфторбензоциклобутена (8) в виде смеси
перфторбицикло[4.2.0]окта-1,3,5-триен-7-ильный
цис,транс-изомеров (схема 1).
катион (4), гидролиз которого приводит к спирту
В реакции соединения 1 с 1,2,4,5-тетрафтор-
3 (схема 1).
бензолом (9) (1:9 = 1:1) в пятифтористой сурьме
Нагревание соединения 1 с тетрафторбензолом
при 26°С с последующим гидролизом образую-
2 (в соотношении 1:2) в SbF5 при 50-55°С с после-
щейся смеси получается 1-(2,3,5,6-тетрафторфе-
дующим гидролизом реакционной смеси приво-
нил)перфторбензоциклобутен-1-ол (10). В отдель-
Схема 1
3'
4'
H
2'
F
H
6'
5'
O
5'
1. 2 (2 моль), SbF5, 50-55°C, 30 ч
3
4
6'
2
F
4'
3
2. H2O
4
5
F
2'
3'
+
F
2
O
5
1
6
F
6
1
7
O
H
F
H
5
6
4'
H
H
3'
H
5'
1. SbF5, 26°C, 3 ч
F
2'
F
6'
2. H2O
6
H2O
SbF5
F
F
+
1 + 2
F
5
OH
SO2ClF
1
+
F
F
H
F
F
4
2
1
2
3
3
4
4'
H
3'
5'
H
F
1. 2 (2 моль), SbF5, 50-55°C, 30 ч
2'
6'
2. HF-Py
F
6
3. H2O
5
1
+
F
F
4
2
F
F
3
F
H
7
8
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1134
МЕЖЕНКОВА и др.
Схема 2
H
H
6'
5'
F
O
F
1. 9 (2 моль), SbF5, 50-55°C, 30 ч
3
4'
F
H
4
2
2. H2O
4
5
3
10
+
F
2'
3'
+
F
O
5
1
1
6
F
H
6
7
HO
O
F
H
12
13
H
H
H
4'
1. SbF5, 26°C, 3 ч
3'
5'
2. H2O
F
H2O
F
SbF5
F
2'
6'
1 + 9
F
F
+
6
SO2ClF
5
OH
+
1
F
F
F
F
H
4
2
1
9
H
10
11
4'
3'
5'
H
F
1. 9 (2 моль), SbF5, 50-55°C, 30 ч
2'
6'
6
2. HF-Py
5
1
3. H2O
F
10
+
+
F
F
4
2
3
F
F
F
H
14
15
ном эксперименте показано, что из соединения
1-(2,3,5,6-тетрафторфенил)перфторбензоциклоб-
1 и тетрафторбензола 9 в SbF5 генерируется 7-
утен (14) и 1,2-бис(2,3,5,6-тетрафторфенил)пер-
(2,3,5,6-тетрафторфенил)перфторбицикло[4.2.0]-
фторбензоциклобутен
(15), а также спирт
10
окта-1,3,5-триен-7-ильный катион (11), гидролиз
(схема 2).
которого дает гидроксипроизводное 10 (схема 2).
При взаимодействии соединения 1 с эквимоляр-
Нагревание соединения 1 с двукратным коли-
ным количеством 1,2,3,4-тетрафторбензола (16) в
чеством тетрафторбензола 9 в SbF5 при 50-55°С
среде SbF5 при 26°С с последующим гидролизом
с последующим гидролизом реакционной смеси
реакционной смеси образуется 1-(2,3,4,5-тетраф-
приводит к образованию (3,4,5,6-тетрафторбен-
торфенил)перфторбензоциклобутен-1-ол
(17). В
зол-1,2-диил)бис[(2,3,5,6-тетрафторфенил)мета-
отдельном эксперименте показано, что из соедине-
нона] (12), наряду с 4,5,6,7-тетрафтор-1,3,3-трис-
ния 1 и тетрафторбензола 16 в SbF5 генерируется 7-
(2,3,5,6-тетрафторфенил)-1,3-дигидро-2-бензофу-
(2,3,4,5-тетрафторфенил)перфторбицикло[4.2.0]-
ран-1-олом (13) и спиртом 10 (схема 2).
окта-1,3,5-триен-7-ильный катион (18), гидролиз
которого приводит к спирту 17 (схема 3).
При обработке реакционной смеси, получен-
ной в аналогичных условиях из соединений 1
Нагревание соединения 1 с тетрафторбензо-
и 9, реагентом Ола, a затем водой образуются
лом 16 (1:16 = 1:2) в SbF5 при 50-55°С с после-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ВЗАИМОДЕЙСТВИЕ ПЕРФТОРБЕНЗОЦИКЛОБУТЕНА С ИЗОМЕРНЫМИ ТЕТР
АФТОРБЕНЗОЛАМИ
1135
Схема 3
3"
3"
3'''
F
F
3''
H
F
6'
5'
O
H
H
1. 16 (2 моль), SbF5, 50-55°C, 30 ч
3
3
4
F
2
F
4'
2
3a
2. H2O
4
4
2a
H
H
5
3
17
+
F
2'
3'
+
F
3'
+
F
O
1
H
5
5
1a
6
1
1
7a
F
F
1'
6
6
1'
7
O
O
HO
3'
F
H
H
H
19
20
21
4'
3'
5'
H
1. SbF5, 26°C, 3 ч
F
F
6'
2. H2O
2'
H2O
SbF5
H
6
F
F
+
H
H
1 + 16
5
SO
F
OH
+
2ClF
1
F
F
F
F
4
2
3
1
16
17
18
4'
3'''
3'
5'
F
3''
F
1. 16 (2 моль), SbF5, 50-55°C, 30 ч
2'
6'
2. HF-Py
6
H
F
F
H
6
3. H2O
5
1
H
+
+
5
1
F
F
4
2
F
F
2
H
F
F
4
3
H
3
1'
F
3'
H
F
22
23
24
дующим гидролизом реакционной смеси приво-
Прежде чем приступить к обсуждению путей
дит к образованию (3,4,5,6-тетрафторбензол-1,2-
образования соединений, представленных на схе-
диил)бис[(2,3,4,5-тетрафторфенил)метанона] (19),
мах 1-3, следует отметить, что реакционные смеси,
получающиеся при взаимодействии соединения 1
наряду с
{2-[бис(2,3,4,5-тетрафторфенил)ме-
с двукратным количеством тетрафторбензолов 2,
тил]-3,4,5,6-тетрафторфенил}(2,3,4,5-тетрафтор-
9, 16 в среде SbF5, представляют собой полутвер-
фенил)метаноном
(20)
и
4,5,6,7-тетрафтор-
дую вязкую массу. По этой причине гидролиз про-
1,3,3-трис(2,3,4,5-тетрафторфенил)-1,3-дигидро-
исходит на границе раздела реакционной массы и
2-бензофуран-1-олом (21) и спиртом 17 (схема 3).
воды, из-за чего в приграничном слое могут проте-
При обработке реакционной смеси, получен-
кать дополнительные превращения с участием как
ной в аналогичных условиях из соединений 1 и
компонентов реакционной смеси (SbF5, HF), так и
16, реагентом Ола, a затем водой образуется смесь
H2O. При этом возможны местные перегревы.
1-(2,3,4,5-тетрафторфенил)перфторбензоциклоб-
Протекание реакции соединения 1 с тетрафтор-
утена (22), 1,2-бис(2,3,4,5-тетрафторфенил)перф-
бензолом 2 может быть представлено схемой 4.
торбензоциклобутена (23) (смесь цис,транс-изо-
Образующийся вначале катион 4 при взаимодей-
меров), наряду с 1,1,2-трис(2,3,4,5-тетрафторфе-
ствии с тетрафторбензолом 2, по-видимому, дает
нил)перфторбензоциклобутеном (24) (схема 3).
1,1-диарилбензоциклобутен A. Затем из соедине-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1136
МЕЖЕНКОВА и др.
Схема 4
C6F4H
C6F4H C6F4H
C6F4H
H
C6F4H C6F4
SbF5
+
2
HF
+
1 + 2
F
F
F
8
-
F
F
–
F
–F
-H+
-F
+
F
–H+
F
C6F4H
4
A
B
C
H2O
-H+
C6F4H
C6F4H
C6F4H
OH
SbF5
OH
6
F
O
F
F
+
-
–H+
-F
F
C6F4H
C
C6F4H
6F4H
F
E
D
H
C6F4
C6F4H
F C6F4H
+
C
SbF5
SbF5
F
H2O
F
F
O
F
O
F
5
–
+
–SbF
-F
+
–H
3
O
C
–HF
C6F4H
C6F4H
C6F4H
G
H
I
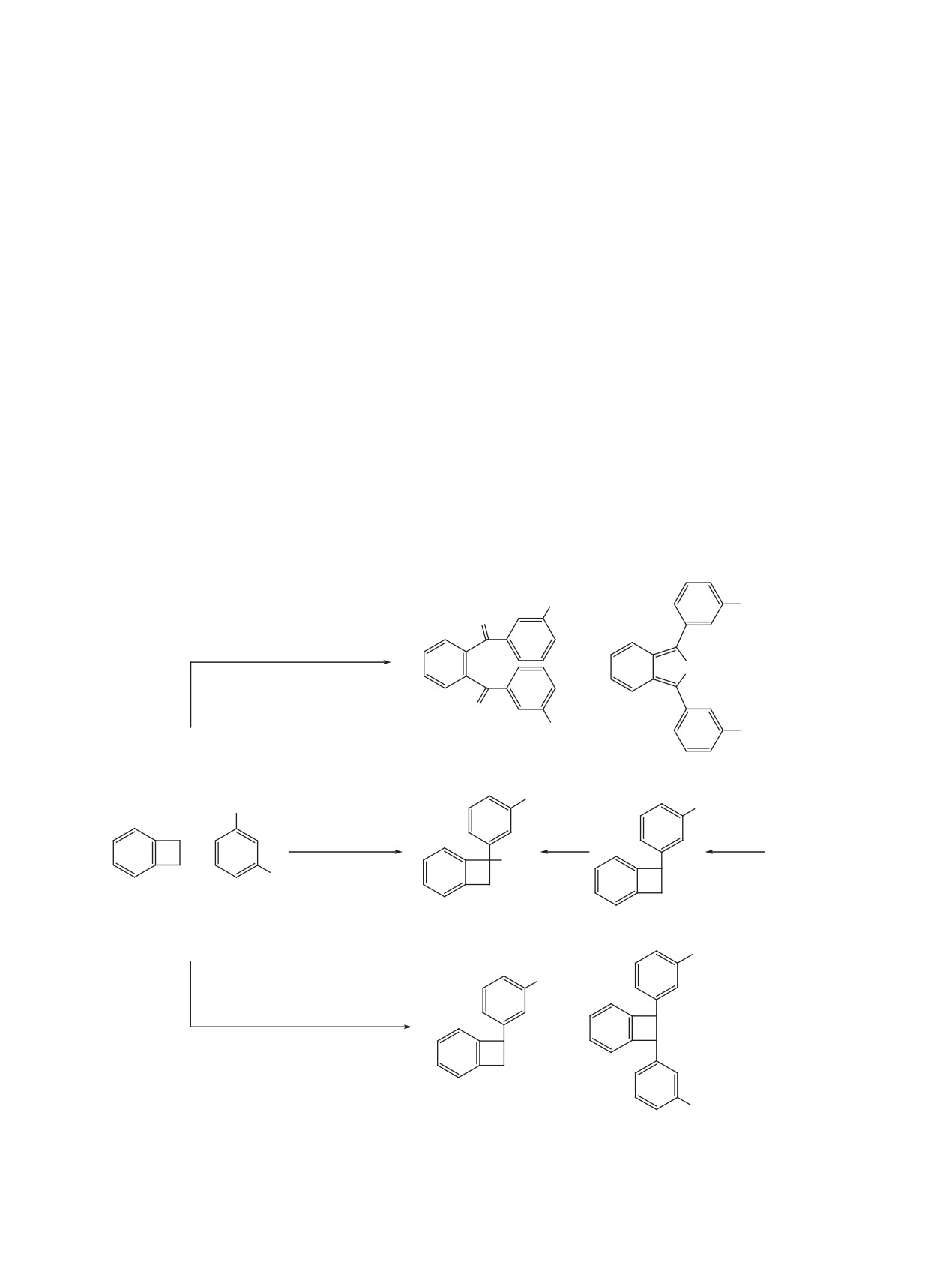
ния A генерируется катион B, который в результа-
быть представлено аналогичной схемой. Кроме
те 1,2-сдвига тетрафторфенильной группы изоме-
того, не исключен и другой путь превращения со-
ризуется в катион C. При обработке реакционной
единений 15 и 23 в дикетоны 12 и 19 при обра-
смеси HF катион C превращается в соединение 8
ботке реакционных смесей водой. Можно пола-
(схема 4).
гать, что, например, в случае соединения 15 про-
тонирование приводит к катиону J, который изо-
При обработке реакционной смеси водой кати-
меризуется с раскрытием четырехчленного цикла
он C, по-видимому, сначала дает гидроксипроиз-
в катион K (схема 5) аналогично тому, как это
водное D, а из него, в свою очередь, под действием
рассматривалось нами ранее для полифторалкил-
SbF5 получается катион E. Внутримолекулярная
бензоциклобутенов и перфтор-1-(2-этилфенил)- и
атака зарядовым центром атома кислорода в кати-
перфтор-1-(4-этилфенил)бензоциклобутенов
[5,
оне E с последующим элиминированием протона
6, 7]. Затем катион K присоединяет анион фтора
приводит к эпоксиду F. Это соединение изомери-
с образованием соединения L. Фторирование по-
зуется в 2-бензофуран 6, из которого в результате
следнего приводит к соединению M и затем, по-
фторирования образуется дигидро-2-бензофуран
G и затем после отщепления аниона фтора - ка-
сле гидролиза, к дикетону 12. Превращение диа-
тион H. Раскрытие пятичленного цикла в послед-
рилбензоциклобутена 23 в дикетон 19 может быть
представлено аналогичной схемой.
нем приводит сначала к катиону I, а после взаимо-
действия с водой - к дикетону 5. Подобная схема
Дигидробензофуранол
13, по-видимому, по-
рассматривалась нами ранее для объяснения обра-
лучается в результате подобных превращений
зования перфтор-1,2-дифенилбензоциклобутена и
триарилбензоциклобутена N, образующегося в
его превращения в перфтор[1,2-фениленбис(фе-
реакции соединения 1 с тетрафторбензолом 9 (схе-
нилметанон)] в реакции соединения 1 с избытком
ма 6). Так, после протонирования соединения N,
пентафторбензола в SbF5 [4].
затем раскрытия четырехчленного цикла и присо-
Образование дикетонов 12 и 19 в реакциях со-
единения аниона фтора получится соединение O.
единения 1 с тетрафторбензолами 9 и 16 может
Фторирование последнего приведет к соединению
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ВЗАИМОДЕЙСТВИЕ ПЕРФТОРБЕНЗОЦИКЛОБУТЕНА С ИЗОМЕРНЫМИ ТЕТР
АФТОРБЕНЗОЛАМИ
1137
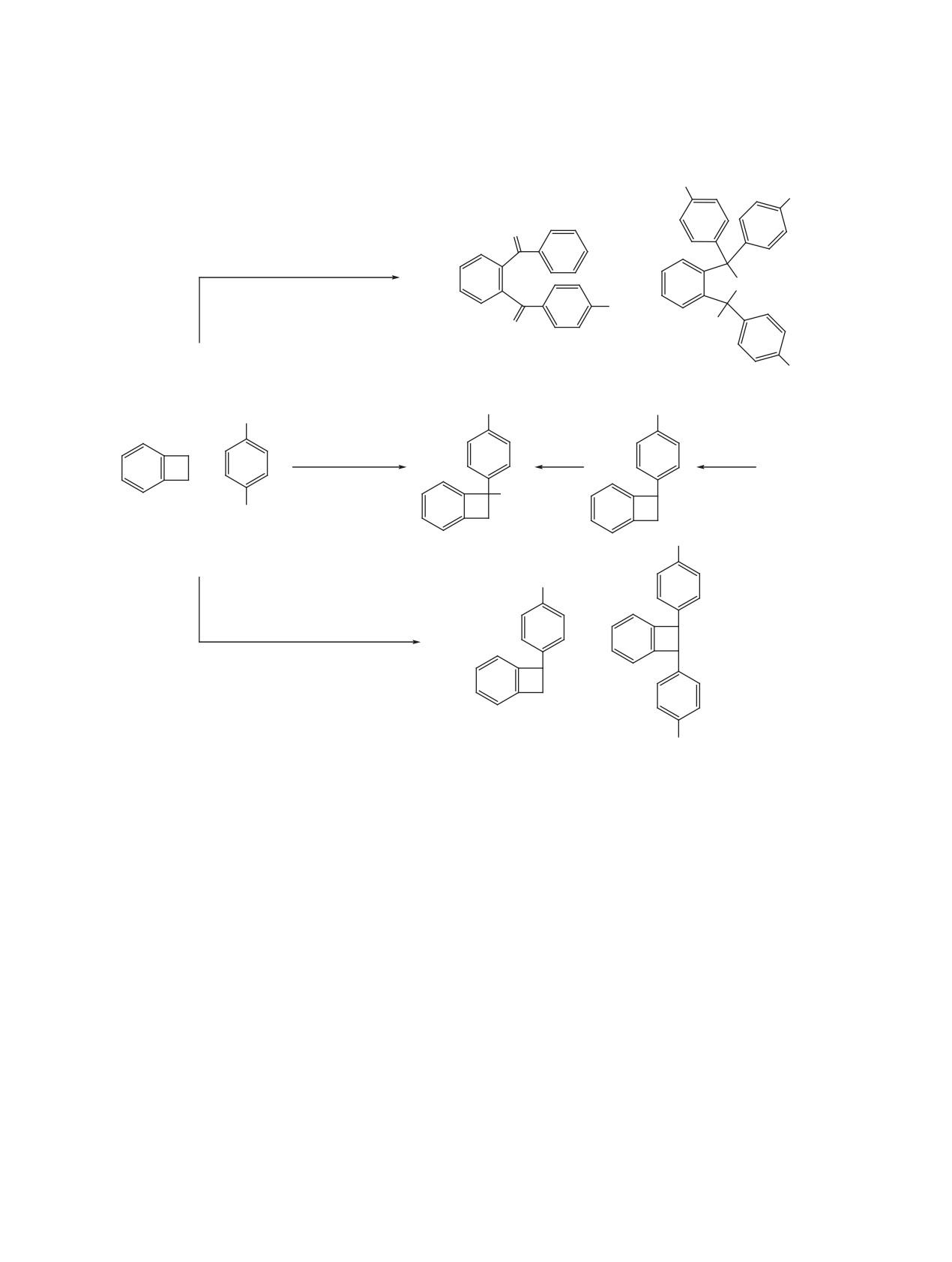
Схема 5
H H
H H
H H
C6F4H
F
F
F
CF2
-
H+
F
[2F]
SbF5-H2O
15
F
12
+
-HF
-HF
F
F
CF2
F
F
F
F
+
C6F4H
CF
CF2
C
6F4H
C6F4H
C6F4H
J
K
L
M
P и затем после гидролиза - к кетоспирту Q, ко-
фенил-2-бензофурана [8]. При анализе спектров
торый изомеризуется в дигидробензофуранол 13
ЯМР 19F соединений 3, 5, 7, 8, 10, 12-15, 17, 19,
(схема 6).
22 проводили сравнение со спектрами соответ-
ствующих перфторированных аналогов
[4,
8].
Превращение триарилбензоциклобутена 24 в
цис,транс-Конфигурация
1,2-бис(тетрафторфе-
дигидробензофуранол 21 может быть представле-
нил)перфторбензоциклобутенам 8, 15, 23 при-
но аналогичной схемой. При этом соединение R,
писана по аналогии с перфтор-1-метил-2-фенил-
наряду с фторированием, по-видимому, может изо-
бензоциклобутеном, в спектре ЯМР 19F которого
меризоваться в соединение S, при гидролизе кото-
сигнал третичного атома фтора, находящегося в
рого получается кетон 20. Превращение соедине-
цис-положении по отношению к соседней пентаф-
ния R в изомер S протекает, вероятно, с участием
торфенильной группе, расположен в более слабом
HF через шестичленное переходное состояние TS.
поле, чем в спектре изомера, в котором атом фто-
Ступенчатое протекание процесса за счет присо-
ра находится в транс-положении по отношению к
единения протона к соединению R и затем отще-
группе C6F5 [9].
пления Н+ из узла СН2 с образованием изомера S
представляется менее вероятным. Действительно,
Строение катионов 4, 11, 18 установлено на ос-
в таком случае для реакции соединения 1 с тетраф-
новании сравнительного анализа их спектров ЯМР
торбензолом 9 также следовало бы ожидать присо-
19F со спектром перфтор-7-фенилбицикло[4.2.0]-
единения протона к соединению О с последующим
окта-1,3,5-триен-7-ильного катиона
(25)
[10] и
отщеплением Н+ из узла СН2, приводящего в ко-
подтверждено структурой продуктов гидроли-
нечном итоге к {2-[бис(2,3,5,6-тетрафторфенил)-
за - спиртов 3, 10, 17. В спектрах катионов сигна-
метил]-3,4,5,6-тетрафторфенил}(2,3,5,6-тетраф-
лы атомов фтора смещены в слабое поле по срав-
торфенил)метанону, который в реакционной сме-
нению с аналогичными сигналами предшествен-
си не обнаружен.
ников. Причем наибольшее смещение относитель-
но предшественника (ΔδF) претерпевают сигналы
Состав и строение соединений установле-
атомов F2,4,2',4',6', находящихся в пара,орто-поло-
ны на основании данных элементного анализа,
жениях к катионному центру (см. рисунок).
масс-спектрометрии высокого разрешения и спек-
троскопии ЯМР 19F, а для соединений 20 и 21 - и
Значения констант спин-спинового взаимодей-
методом ЯМР 13С. Наличие сигнала атома угле-
ствия (КССВ) между ядрами фтора, находящи-
рода карбонильной группы в спектре ЯМР 13С
мися в резонансных (зарядовых) положениях ка-
(183.6 м.д. в CDCl3) соединения 20 подтверждает
тионов, возрастают по сравнению со значениями
его строение и отвергает альтернативную структу-
аналогичных констант в предшественниках. Эти
ру 4,5,6,7-тетрафтор-1,1,3-трис(2,3,4,5-тетрафтор-
особенности спектров ионов 4, 11, 18, 25, являю-
фенил)-1,3-дигидро-2-бензофурана. Строение со-
щихся катионами бензильного типа, согласуются
единения 6 установлено в результате сравнения
с таковыми для полифторбензильных катионов,
его спектра ЯМР 19F со спектром перфтор-1,3-ди-
для которых величины ΔδF и КССВ связывают с
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1138
МЕЖЕНКОВА и др.
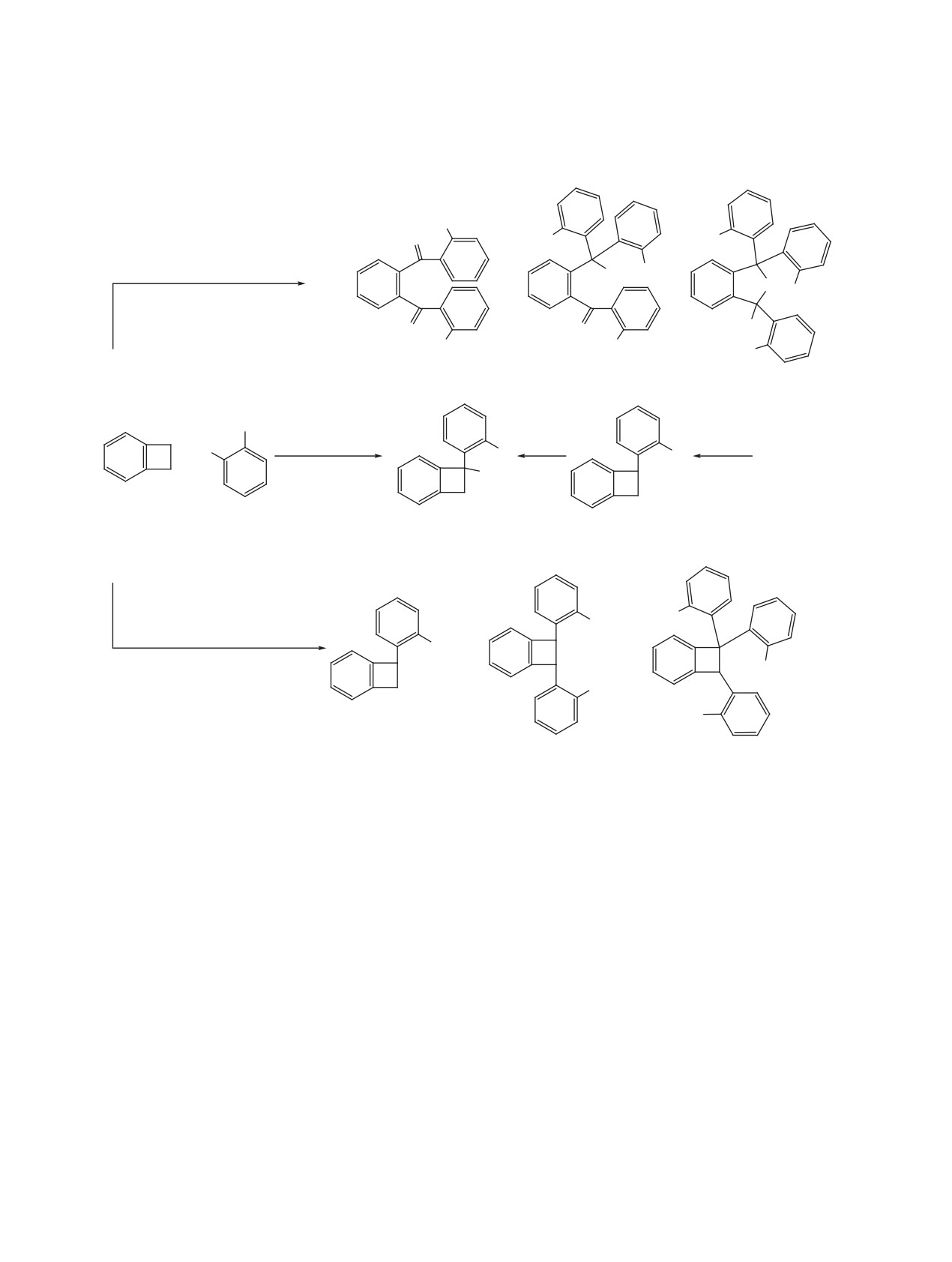
Схема 6
1 + 9
SbF5
H H
H
H
F
F
F
HC
6F4
H+, F-
[2F]
-HF
F
C6F4H
F
F
C6F4H
F
F
C6F4H
CF2
CF2
C6F4H
C6F4H
N
O
P
H
F
HC6F4 C6F4H
SbF5-H2O
F
O
-HF
OH
F
C6F4H
HO C6F4H
CO
C6F4H
Q
13
≠
H
F
H
F
F
H
H
H
-
H+, F
F
H
F
H
24
+
H
+
C6F4H
H
C6F4H
C6F4H
F
F
F
F
CF2
CF2
CF2
C6F4H
C6F4H
C6F4H
R
TS
S
SbF5-H2O
S
20
-HF
участием атомов фтора в распределении заряда и
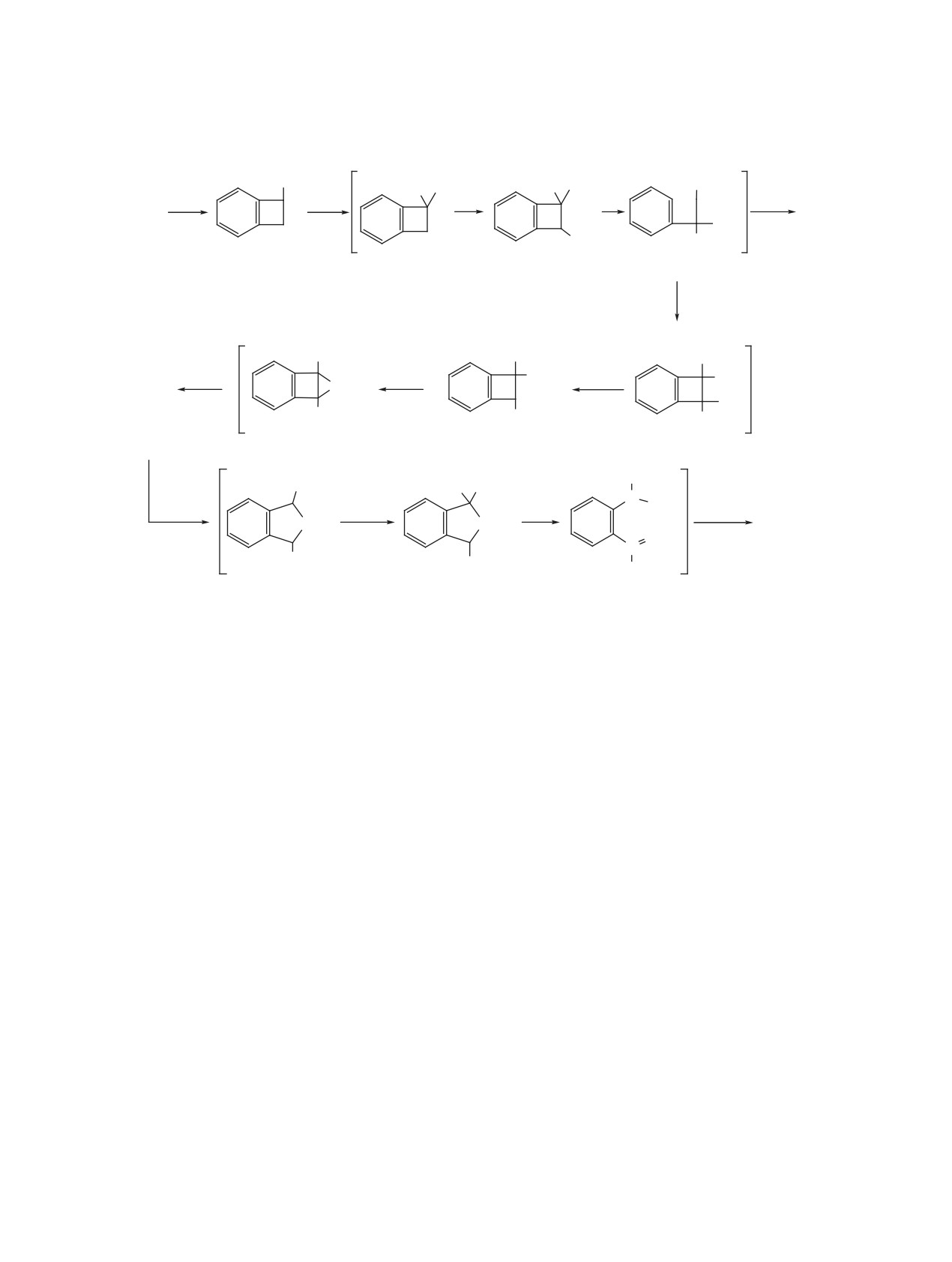
которых ΔδF-4 составляет 50.2 (4a и 4b), 52.1 (18a)
в сопряжении [11]. При этом большая по величи-
и 53.7 (18b) м.д.. Для катионов 25, 11 и перфтор-
не константа J2,2' 140-165 Гц (J2,6' < 5 Гц) свиде-
бицикло[4.2.0]окта-1,3,5-триен-7-ильного катиона
тельствует о пространственной близости взаимо-
(26) [12] ΔδF-4 составляет 55.5, 59.4 и 83.2 м.д. со-
действующих ядер или, другими словами, о малом
ответственно. Приведенные величины ΔδF-4 пока-
угле поворота групп C6F4Н и C6F5 в катионах 4, 11,
зывают, что степень участия групп C6F4Н, C6F5 и
18b, 25. Из-за затрудненного вращения тетрафтор-
атома F в положении 1 рассматриваемых катионов
фенильной группы катион 4 существует в виде 2
ротамеров 4a,4b в равном соотношении, а катион
в распределении заряда уменьшается в ряду кати-
18 - ротамеров 18a, 18b в соотношении 4:1, для
онов 4a, b > 18a > 18b > 25 > 11 > 26.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ВЗАИМОДЕЙСТВИЕ ПЕРФТОРБЕНЗОЦИКЛОБУТЕНА С ИЗОМЕРНЫМИ ТЕТР
АФТОРБЕНЗОЛАМИ
1139
H
4'
H
3'
4'
3'
3'
4'
5'
2'
F
5'
2'
F
H
2'
F
5'
2
6'
6'
+
+
3
6'
1
+
F
F
F
F
4
F
F
6
5
4a
4b
11
3'
4'
3'
4'
2'
2
F
F
5'
2'
F
5'
F
H
+
3
1
6'
F
F
6'
+
+
+
4
6
H
F
F
F
F
F
F
5
18a
18b
25
26
Нумерация атомов в катионах для описания спектров ЯМР 19F
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Взаимодействие перфторбензоциклобутена
(1) с 1,2,3,5-тетрафторбензолом (2). а. Соедине-
1,2,3,4-Тетрафторбензол (97%), 1,2,3,5-тетра-
ние 1 (0.92 г, 3.71 ммоль) растворяли в 4.03 г
фторбензол (97%), 1,2,4,5-тетрафторбензол (98%)
(18.59 ммоль) SbF5, добавляли 0.61 г (4.07 ммоль)
получены из АО НПО «ПИМ-ИНВЕСТ», Москва.
соединения 2, перемешивали, выдерживали при
Перфторбензоциклобутен (99%), т.кип. 117-118°С,
26°С в течение 3 ч. Смесь охлаждали до 0°С, пере-
получен по методике [13]. Пятифтористая сурьма
носили в воду со льдом, экстрагировали CHCl3, ор-
и фтористый водород - промышленные продук-
ты. Пятифтористую сурьму перед употреблением
ганический слой сушили MgSO4, отгоняли CHCl3.
дважды перегоняли, т.кип. 143-143.5°С.
Получали 1.31 г смеси, содержащей, по данным
ГЖХ и ЯМР 19F, 96% соединения 3 (выход 90.2%).
Спектры ЯМР 19F растворов солей катионов в
Из этой смеси с помощью колоночной хроматогра-
SbF5-SO2ClF и спектры ЯМР 19F и 1Н соединений
фии на силикагеле (элюент - CH2Cl2) выделяли
в CDCl3 записывали на приборе Bruker AV-300
1.05 г индивидуального соединения 3.
(282.4 и 300 МГц), спектры ЯМР 13С соедине-
ний 20, 21 в CDCl3 - на приборе Bruker AV 600
1-(2,3,4,6-Тетрафторфенил)перфторбензоци-
(150.9 МГц). Сдвиги приведены в слабое поле от
клобутен-1-ол (3). Вязкая жидкость. Спектр ЯМР
C6F6 (19F) и ТМС (1Н,13С), внутренний стандарт -
1Н, δ, м.д.: 3.69 (1Н, OН), 6.87 т.д (1Н, Н5', J 10.0,
C6F6, SO2ClF (262.8 м.д. от C6F6), CHCl3 (7.24 м.д.
6.0 Гц). Спектр ЯМР 19F, δ, м.д.: -1.4 т.д.д (1F, F3'),
от ТМС) и CDCl3 (76.9 м.д. от ТМС), нумера-
16.0 д.д.д (1F, F4), 18.7 д.д.д (1F, F5), 26.2 д.д.д (1F,
ция атомов в соединениях приведена на схемах.
F3), 27.8 м (1F, F2'), 28.7 д.т.д.д (1F, F6), 33.7 д.д.д.д
Элементный состав соединений определяли с по-
(1F, F4'), 45.4 м (1F, F6'), 65.4 (1F, FA2) и 55.5 (1F,
мощью масс-спектрометрии высокого разреше-
FB2); JAB 198.0, J34 20.0, J35 7.0, J36 24.0, J45 18.0,
ния на приборе Thermo Electron Corporation DFS.
J46 8.0, J56 19.0, J62' 20.0, J66' 20, J2'3' 21, J2'4' 8.0, J3'4'
Состав реакционных смесей устанавливали на ос-
21.0, J3'5' 6.0, J3'6' 11.0, J4'5' 10.0, J4'6' 3.5, J5'6' 10.0 Гц.
новании данных ЯМР 19F и ГЖХ. Анализ методом
Найдено, %: C 45.02; Н 0.67; F 50.14. Масс-спектр,
ГЖХ проводили на хроматографе ЛХМ-72 (СССР)
m/z: 375.9939 [М]+. C14H2F10О. Вычислено, %: C
в режиме программирования температуры от 50 до
44.70; Н 0.54; F 50.51. М 375.9941.
270°С, колонка 4000×4 мм, с фазой СКТФТ-50 на
Chromosorb W (15:100), газ-носитель - гелий, ско-
б. К раствору соединения 1 (0.075 г, 0.30 ммоль)
рость 60 мл/мин.
в SbF5 (1.3 г, 6.0 ммоль), помещенному в ампулу
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1140
МЕЖЕНКОВА и др.
ЯМР, добавляли соединение 2 (0.045 г, 0.30 ммоль),
4,5,6,7-Тетрафтор-1,3-бис(2,3,4,6-тетрафтор-
перемешивали, выдерживали при 22°С 4 ч, затем
фенил)-2-бензофуран (6). Спектр ЯМР 19F, δ, м.д.:
добавляли SO2ClF (0.27 г) при -10°С, записывали
-1.5 д.д.д.д (2F, F3'), 5.1 м (2F, F5,6), 11.4 м (2F, F4,7),
спектр ЯМР 19F при 20°С. Спектр содержал сигна-
30.7 м (2F, F2'), 34.7 д.д.д.д (2F, F4'), 48.0 м (2F, F6');
лы катиона 4 (конформеры 4а и 4b в соотношении
J
21.5, J2'4' 8.0, J3'4' 21.5, J3'5' 6.0, J3'6' 11.0, J4'5'
2'3'
50:50) в отсутствие сигналов соединения 7.
10.0, J4'6' 3.5 Гц. Масс-спектр, m/z: 485.9908 [М]+.
C20H2F12O. М 485.9909.
7-(2,3,4,6-Тетрафторфенил)перфторбицик-
ло[4.2.0]окта-1,3,5-триен-7-ильный катион (4),
г. Смесь 0.49 г (1.98 ммоль) соединения 1,
конформер 4а. Спектр ЯМР 19F, δ (Δδ), м.д.: 10.9
0.60 г
(4.00 ммоль) соединения
2 и
3.46 г
(11.8) м (1F, F5'), 34.0 (7.1) м (1F, F5), 34.7 (15.0) м
(15.96 ммоль) SbF5 нагревали в запаянной стек-
(1F, F3), 64.1 (34.8) м (1F, F6'), 65.1 (34.5) д.м (1F,
лянной ампуле при 50-55°С 30 ч, охлаждали до
F2), 69.3 (50.2) м (1F, F4), 83.9 (21.5) м (2F, F6), 91.4
0°С, переносили в НF-Py (6 мл) при 0-20°С, пе-
(44.7) д.м (1F, F2'), 98.7 (62.3) м (1F, F4'); J22' 163 Гц.
ремешивали при 25°С 1 ч, охлаждали до 0°С, пе-
Конформер 4b. Спектр ЯМР 19F, δ (Δδ), м.д.: 10.3
реносили в воду со льдом, экстрагировали CHCl3,
(11.2) м (1F, F3'), 34.0 (7.1) м (1F, F5), 34.7 (15.0) м
органический слой сушили MgSO4, отгоняли
(1F, F3), 63.8 (34.5) д.м (1F, F2'), 65.1 (34.5) д.м (1F,
CHCl3 и остатки соединения 2. Получали 0.87 г
F2), 69.3 (50.2) м (1F, F4), 83.7 (21.3) м (2F, F6), 92.4
смеси, содержащей, по данным ГЖХ и ЯМР 19F,
(45.7) м (1F, F6'), 99.1 (62.7) м (1F, F4'); J22' 163.0 Гц.
33% соединения 7 (выход 38.4%) и 59% смеси
транс- и цис-8 (82:18, выход 51%). Из этой смеси
Раствор выливали в воду со льдом, экстрагиро-
с помощью колоночной хроматографии на силика-
вали CHCl3, экстракт сушили MgSO4, раствори-
геле (элюент - гексан) выделяли 0.17 г соединения
тель отгоняли. Получили 0.08 г продукта, содер-
7, 0.32 г соединения транс-8 и 0.08 г соединения
жащего, по данным ГЖХ и ЯМР 19F, 84% соеди-
цис-8.
нения 3.
1-(2,3,4,6-Тетрафторфенил)перфторбензоци-
в. Смесь 0.55 г (2.22 ммоль) соединения 1, 0.67 г
клобутен (7). Вязкая жидкость. Спектр ЯМР 1Н, δ,
(4.47 ммоль) соединения 2 и 3.88 г (17.9 ммоль)
м.д.: 6.91 т.д (Н5', J 10.0, 6.0 Гц). Спектр ЯМР 19F,
SbF5 нагревали в запаянной стеклянной ампуле
δ, м.д.: -0.9 т.д.д (1F, F3'), 19.1 д.д.д.д (1F, F4), 19.7
при 50-55°С 30 ч, охлаждали до 0°С, переносили в
д.д.д (1F, F5), 26.9 д.д.д (1F, F3), 29.3 м (1F, F2'), 30.6
воду со льдом (100 мл) при перемешивании, добав-
д.т.д.д (1F, F6), 32.9 м (1F, F1), 36.4 д.д.д.д.д (1F,
ляли конц. НСl (10 мл), экстрагировали CHCl3, ор-
F4'), 46.7 м (1F, F6'), 67.1 (1F, FA2) и 57.7 (1F, FB2); JAB
ганический слой сушили MgSO4, отгоняли CHCl3.
200.0, J14 5.0, J14' 5.0, J34 20.0, J35 8.0, J36 24.0, J45
Получали 1.12 г смеси, содержащей, по данным
18.0, J46 9.0, J56 19.0, J62' 21.0, J66' 21, J2'3' 21.0, J2'4'
ГЖХ и ЯМР 19F, 92% соединения 5 (выход 92.5%)
9.0, J3'4' 21.0, J3'5' 6.0, J3'6' 11.0, J4'5' 10.0, J4'6' 4.0, J5'6'
и 3% (выход 3%) соединения 6. Из этой смеси с
10.0 Гц. Масс-спектр, m/z: 377.9899 [М]+. C14HF11.
помощью колоночной хроматографии на силика-
М 377.9897.
геле (элюент - CCl4, затем CHCl3) выделяли 0.02 г
соединения 6 и 0.73 г соединения 5.
транс-1,2-Бис(2,3,4,6-тетрафторфенил)пер-
фторбензоциклобутен (транс-8). Т.пл. 64-65°С
(3,4,5,6-Тетрафторбензол-1,2-диил)бис-
после возгонки в вакууме (120°C, 1 мм рт.ст.).
[(2,3,4,6-тетрафторфенил)метанон]
(5).
Т.пл.
Спектр ЯМР 1Н, δ, м.д.: 6.87 м (Н5'). Спектр ЯМР
106-107.3°С (гексан-СН2Сl2). Спектр ЯМР 1Н, δ,
19F, δ, м.д.: -1.2 м (2F, F3'), 17.0 м (2F, F4,5), 25.7
м.д.: 6.87 т.д (Н5', J 10.0, 6.0 Гц). Спектр ЯМР 19F,
м (2F, F3,6), 29.9 м (2F, F1,2), 30.8 м (2F, F2'), 34.9
δ, м.д.: -0.7 д.д.д.д (2F, F3'), 14.9 м (2F, F4,5), 23.8 м
м (2F, F4'), 48.8 м (2F, F6'). Найдено, %: C 47.15;
(2F, F3,6), 29.6 д.д (2F, F2'), 39.7 д.д.д.д (2F, F4'), 48.0
Н 0.58; F 52.39. Масс-спектр, m/z: 507.9932 [М]+.
д.д.д (2F, F6'); J2'3' 21.0, J2'4' 11.0, J3'4' 21.0, J3'5' 6.0,
C20H2F14. Вычислено, %: C 47.27; Н 0.40; F 52.34,
J3'6' 11.0, J4'5' 10.0, J4'6' 6.0, J5'6' 10.0 Гц. Найдено,
М 507.9928.
%: C 47.77; Н 0.43. Масс-спектр, m/z: 501.9852
[М]+. C20H2F12O2. Вычислено, %: C 47.83; Н 0.40.
цис-1,2-Бис(2,3,4,6-тетрафторфенил)пер-
М 501.9858.
фторбензоциклобутен (цис-8). Т.пл.
99-100°С
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ВЗАИМОДЕЙСТВИЕ ПЕРФТОРБЕНЗОЦИКЛОБУТЕНА С ИЗОМЕРНЫМИ ТЕТР
АФТОРБЕНЗОЛАМИ
1141
(гексан). Спектр ЯМР 1Н, δ, м.д.: 6.69 м (Н5').
щего, по данным ГЖХ и ЯМР 19F, 86% соединения
Спектр ЯМР 19F, δ, м.д.: -0.3 м (2F, F3'), 16.9 м (2F,
10.
F4,5), 24.1 м (2F, F1,2), 25.6 м (2F, F3,6), 31.0 м (2F,
в. Смесь 0.60 г (2.42 ммоль) соединения 1, 0.73 г
F2'), 35.9 м (2F, F4'), 49.3 м (2F, F6'). Масс-спектр,
(4.87 ммоль) соединения 9 и 4.22 г (19.46 ммоль)
m/z: 507.9926 [М]+. C20H2F14. М 507.9928.
SbF5 нагревали в запаянной стеклянной ампуле
Взаимодействие перфторбензоциклобутена
при 50-55°С 30 ч, охлаждали до 0°С, переносили в
(1) с 1,2,4,5-тетрафторбензолом (9). а. Соедине-
воду со льдом (100 мл) при перемешивании, добав-
ние 1 (1.01 г, 4.07 ммоль) растворяли в 4.40 г
ляли конц. НСl (10 мл), экстрагировали CHCl3, ор-
(20.30 ммоль) SbF5, добавляли 0.67 г (4.47 ммоль)
ганический слой сушили MgSO4, отгоняли CHCl3.
соединения 9, перемешивали, выдерживали при
Получали 1.27 г смеси, содержащей, по данным
26°С 3 ч. Смесь охлаждали до 0°С, переносили
ГЖХ и ЯМР 19F, соединения 10 (31%, выход 43%),
в воду со льдом, экстрагировали CHCl3, органи-
12 (15%, выход 15.7%) и 13 (33%, выход 26.6%).
ческий слой сушили MgSO4, отгоняли CHCl3.
Из этой смеси с помощью колоночной хроматогра-
Получали 1.28 г смеси, содержащей, по дан-
фии на силикагеле (элюент - CCl4, затем CHCl3)
ным ГЖХ и ЯМР 19F, 96% соединения 10 (выход
выделяли 0.17 г соединения 12, 0.08 г соединения
80.3%). Из этой смеси с помощью колоночной
13 и 0.19 г соединения 10.
хроматографии на силикагеле (элюент - CH2Cl2)
(3,4,5,6-Тетрафторбензол-1,2-диил)бис-
выделяли 0.98 г индивидуального соединения 10.
[(2,3,5,6-тетрафторфенил)метанон]
(12). Т.пл.
1-(2,3,5,6-Тетрафторфенил)перфторбензо-
134.8-136°С (после возгонки). Спектр ЯМР 1Н, δ,
циклобутен-1-ол (10). Вязкая жидкость. Спектр
м.д.: 7.28 т.т (Н4' J 9.0, 7.0 Гц). Спектр ЯМР 19F,
ЯМР 1Н, δ, м.д.: 7.18 т.т (1Н, Н4', J 9.5, 7.5 Гц), 3.70
δ, м.д.: 15.9 м (2F, F4,5), 20.7 м (4F, F2',6'), 24.4 м
(1Н, OН). Спектр ЯМР 19F, δ, м.д.: 16.2 д.д.д (1F,
(2F, F3,6), 25.3 м (4F, F3',5'). Найдено, %: C 47.83;
F4), 18.9 д.д.д (1F, F5), 19.4 м (2F, F2',6'), 24.4 м (2F,
Н 0.35; F 45.69. Масс-спектр, m/z: 501.9860 [М]+.
F3',5'), 26.3 д.д.д (1F, F3), 28.6 д.т.д.д (1F, F6), 65.5
C20H2F12O2. Вычислено, %: C 47.83; Н 0.40; F
(1F, FA2) и 55.9 (1F, FB2); JAB 198.0, J34 20.0, J35 7.0,
45.40. М 501.9858.
J36 24.0, J45 18.0, J46 8.0, J56 19.0, J62'(6') 20.0 Гц.
4,5,6,7-Тетрафтор-1,3,3-трис(2,3,5,6-тетра-
Найдено, %: C 44.91; Н 0.60; F 50.44. Масс-спектр,
фторфенил)-1,3-дигидро-2-бензофуран-1-ол
m/z: 375.9944 [М]+. C14H2F10О. Вычислено, %: C
(13). Спектр ЯМР 1Н, δ, м.д.: 4.46 м (1Н, ОН), 7.06
44.70; Н 0.54; F 50.51. М 375.9941.
F, δ, м.д.: 11.1
м (1Н), 7.15 м (2Н). Спектр ЯМР 19
б. К раствору соединения 1 (0.08 г, 0.32 ммоль)
м, 11.6 м (2F, F5,6), 19.9 м, 20.7 м (2F, F4,7), 20.1 м
в SbF5 (1.41 г, 6.50 ммоль) добавляли соединение
(2F), 21.0 м (2F), 21.9 м (2F), 24.2 м (2F), 24.3 м
9 (0.05 г, 0.33 ммоль), перемешивали, выдержива-
(2F), 24.7 м (2F),. Масс-спектр, m/z: 651.9955 [М]+.
ли при 22°С 3 ч, затем добавляли SO2ClF (0.33 г)
C26H4F16O2. М 651.9950.
при -10°С, записывали спектр ЯМР 19F при 20°С.
г. Смесь 0.60 г (2.25 ммоль) соединения 1, 0.68 г
Спектр содержал сигналы катиона 11 в отсутствие
(4.51 ммоль) соединения 9 и 3.91 г (18.04 ммоль)
сигналов соединения 14.
нагревали в запаянной стеклянной ампуле
SbF5
7-(2,3,5,6-Тетрафторфенил)перфторбицик-
при 50-55°С 30 ч, охлаждали до 0°С, переноси-
ло[4.2.0]окта-1,3,5-триен-7-ильный катион (11).
ли в НF-Py (6 мл) при 0-20°С, перемешивали при
Спектр ЯМР 19F, δ (Δδ), м.д.: 35.2 (10.3) м (2F,
25°С 1 ч, охлаждали до 0°С, переносили в воду со
F3',5'), 36.2 (9.2) м (1F, F5), 36.4 (16.5) м (1F, F3),
льдом, экстрагировали CHCl3, органический слой
56.6 (35.7) д.м (1F, F2'), 57.9 (37.0) м (1F, F6'), 69.7
сушили MgSO4, отгоняли CHCl3 и остатки соеди-
(38.9) д.м (1F, F2), 78.8 (59.4) м (1F, F4), 85.9 (23.1)
нения 9. Получали 0.94 г смеси, содержащей, по
м (2F, F6); J22' 160.0 Гц.
данным ГЖХ и ЯМР 19F, соединения 14 (58%, вы-
Раствор выливали в воду со льдом, экстрагиро-
ход 64.1%), 10 (12%, выход 13.4%), 15 (11%, выход
вали CHCl3, экстракт сушили MgSO4, раствори-
9%). Из этой смеси с помощью колоночной хро-
тель отгоняли. Получали 0.10 г продукта, содержа-
матографии на силикагеле (элюент - гексан, затем
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1142
МЕЖЕНКОВА и др.
CCl4) выделяли 0.25 г соединения 14 и 0.04 г со-
16 (0.05 г, 0.33 ммоль), перемешивали, выдержива-
единения транс-15.
ли при 22°С 3 ч, затем добавляли SO2ClF (0.33 г)
при -10°С, записывали спектр ЯМР 19F при 20°С.
1-(2,3,5,6-Тетрафторфенил)перфторбензоци-
Спектр содержал сигналы катиона 18 (конформе-
клобутен (14). Вязкая жидкость. Спектр ЯМР 1Н,
ры а и b в соотношении 80:20) в отсутствие сигна-
δ, м.д.: 7.27 т.т (Н4', J 9, 7.5 Гц). Спектр ЯМР 19F,
лов соединения 22.
δ, м.д.: 19.4 д.д.д.д (1F, F4), 19.9 д.д.д (1F, F5), 20.9
м (2F, F2',6'), 24.9 м (2F, F3',5'), 27.0 д.д.д (1F, F3),
7-(2,3,4,5-Тетрафторфенил)перфторбицик-
30.8 д.т.д.д (1F, F6), 32.0 м (1F, F1), 67.3 (1F, FA2) и
ло[4.2.0]окта-1,3,5-триен-7-ильный катион (18).
58.3 (1F, FB2); JAB 200.0, J14 5.0, J34 19.0, J35 7.5, J36
Конформер 18a. Спектр ЯМР 19F, δ (Δδ), м.д.: 18.9
24.0, J45 18.0, J46 9.0, J56 19.0, J62'(6') 20.0 Гц. Масс-
(9.6) м (1F, F5'), 35.2 (14.4) м (1F, F3), 37.6 (12.4) м
спектр, m/z: 377.9899 [М]+. C14HF11. М 377.9897.
(1F, F3'), 40.2 (11.4) м (1F, F5), 59.8 (32.5) м (1F, F2),
69.1 (43.1) м (1F, F6'), 71.8 (62.5) м (1F, F4'), 71.8
транс-1,2-бис(2,3,5,6-Тетрафторфенил)пер-
(52.1) м (1F, F4), 84.4 (22.3) м (2F, F6). Конформер
фторбензоциклобутен (транс-15). Вязкая жид-
18b. Спектр ЯМР 19F, δ (Δδ), м.д.: 19.3 (10.0) м (1F,
кость. Спектр ЯМР 1Н, δ, м.д.: 7.25 м (Н4'). Спектр
F3'), 35.2 (16.5) м (1F, F3), 36.5 (11.3) м (1F, F5'), 38.5
ЯМР 19F, δ, м.д.: 17.5 м (2F, F4,5), 22.2 м (4F, F2',6'),
(9.7) м (1F, F5), 65.4 (38.1) д.м (1F, F2), 67.9 (41.9)
24.5 м (4F, F3',5'), 26.0 м (2F, F3,6), 29.7 м (2F, F1,2).
д.м (1F, F2'), 70.6 (61.3) м (1F, F4'), 73.4 (53.7) м (1F,
Масс-спектр, m/z:
507.9925
[М]+. C20H2F14. М
F4), 83.3 (21.2) м (2F, F6); J22' 139.0 Гц.
507.9927.
Раствор выливали в воду со льдом, экстрагиро-
Взаимодействие перфторбензоциклобутена
вали CHCl3, экстракт сушили MgSO4, раствори-
(1) с 1,2,3,4-тетрафторбензолом (16). а. Соеди-
тель отгоняли. Получали 0.11 г продукта, содержа-
нение 1 (0.62 г, 2.50 ммоль) растворяли в 3.02 г
щего, по данным ГЖХ и ЯМР 19F, 87% соединения
(13.93 ммоль) SbF5, добавляли 0.41 г (2.73 ммоль)
17.
соединения 16, перемешивали, выдерживали при
27°С 3 ч. Смесь охлаждали до 0°С, переносили
в. Смесь
0.53 г
(2.14 ммоль) соединения
в воду со льдом, экстрагировали CHCl3, органи-
1, 0.65 г (4.33 ммоль) соединения 16 и 3.71 г
ческий слой сушили MgSO4, отгоняли CHCl3.
(17.11 ммоль) SbF5 нагревали в запаянной сте-
Получали 0.77 г смеси, содержащей, по дан-
клянной ампуле при 50-55°С 30 ч, охлаждали до
ным ГЖХ и ЯМР 19F, 95% соединения 17 (выход
0°С, переносили в воду со льдом (100 мл) при пе-
77.8%). Из этой смеси с помощью колоночной
ремешивании, добавляли конц. НСl (10 мл), экс-
хроматографии на силикагеле (элюент - CH2Cl2)
трагировали CHCl3, органический слой сушили
выделяли 0.57 г индивидуального соединения 17.
MgSO4, отгоняли CHCl3. Получали 0.95 г смеси,
1-(2,3,4,5-Тетрафторфенил)перфторбензо-
содержащей, по данным ГЖХ и ЯМР 19F, соедине-
циклобутен-1-ол (17). Вязкая жидкость. Спектр
ния 17 (26%, выход 30.7%), 19 (34%, выход 30.1%),
ЯМР 1Н, δ, м.д.: 3.58 (1Н, OН), 7.08 д.д.д.д (1Н,
20 (26%, выход 18.1%) и 21 (8%, выход 5.4%). Из
Н6', J 10.0, 8.0, 6.0, 3.0 Гц). Спектр ЯМР 19F, δ, м.д.:
этой смеси с помощью колоночной хроматографии
8.0 т.т (1F, F3'), 9.4 д.д.д.д (1F, F4'), 16.1 д.д.д (1F,
на силикагеле (элюент - CCl4, затем CHCl3) выде-
F4), 19.3 д.д.д (1F, F5), 22.8 м (1F, F2'), 24.0 д.д.д.д
ляли 0.22 г соединения 20, 0.16 г соединения 19,
(1F, F5'), 25.1 д.д.д (1F, F6), 27.8 д.д.д (1F, F3), 63.0
0.04 г соединения 21 и 0.19 г соединения 17.
(1F, FA2) и 57.2 (1F, FB2); JAB 199.0, J34 20.0, J35 8.0,
(3,4,5,6-Тетрафторбензол-1,2-диил)бис-
J36 24.0, J45 18.0, J46 6.0, J56 20.0, J2'3' 20.0, J2'4' 5.0,
[(2,3,4,5-тетрафторфенил)метанон]
(19). Т.пл.
J2'5' 13.0, J2'6' 6.0, J3'4' 20.0, J3'5' ~ J3'6' ~ 3.0, J4'5' 21.0,
91.2-92.5°С (гексан-СН2Сl2). Спектр ЯМР 1Н, δ,
J4'6' 8.0, J5'6' 10.0 Гц. Найдено, %: C 44.46; Н 0.62; F
м.д.: 7.47 д.д.д.д (2Н, Н6', J 10.0, 8.0, 6.0, 3.0 Гц).
50.54. Масс-спектр, m/z: 375.9937 [М]+. C14H2F10О.
Спектр ЯМР 19F, δ, м.д.: 9.3 д.д.т (2F, F3'), 14.4 м
Вычислено, %: C 44.70; Н 0.54; F 50.51. М 375.9941.
(2F, F4,5), 17.8 т.д.д (2F, F4'), 24.3 м (2F, F2'), 24.4
б. К раствору соединения 1 (0.08 г, 0.32 ммоль)
м (2F, F3,6), 25.8 д.д.д.д (2F, F5'); J2'3' 21.0, J2'4' 9.0,
в SbF5 (1.42 г, 6.55 ммоль) добавляли соединение
J2'5'
13.0, J2'6' 6.0, J3'4' 19.0, J3'5' ~ J3'6' ~ 3.0, J4'5'
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ВЗАИМОДЕЙСТВИЕ ПЕРФТОРБЕНЗОЦИКЛОБУТЕНА С ИЗОМЕРНЫМИ ТЕТР
АФТОРБЕНЗОЛАМИ
1143
21.0, J4'6' 8.0, J5'6' 10.0 Гц. Найдено, %: C 47.93;
смеси, содержащей, по данным ГЖХ и ЯМР 19F,
Н 0.44; F 45.51. Масс-спектр, m/z: 501.9856 [М]+.
соединения 22 (17%, выход 22.7%), 23 (40%, выход
C20H2F12O2. Вычислено, %: C 47.83; Н 0.40; F
39.7%, транс- и цис-изомеры в соотношении 67:33
45.40. М 501.9858.
соответственно) и 24 (33%, выход 26.1%). Из этой
смеси с помощью колоночной хроматографии на
{2-[Бис(2,3,4,5-тетрафторфенил)метил]-
силикагеле (элюент - гексан) выделяли 0.08 г со-
3,4,5,6-тетрафторфенил}(2,3,4,5-тетрафторфе-
единения 22, 0.09 г транс-изомера соединения 23,
нил)метанон
(20). Т.пл.
131.5-133°С (гексан-
0.11 г смеси транс- и цис-изомеров соединения 23
СН2Сl2). Спектр ЯМР 1Н, δ, м.д.: 5.96 с (1Н, Н2а),
(60:40), 0.03 г смеси транс- и цис-изомеров соеди-
6.62 м (2Н, Н6''), 7.42 д.д.д.д (1Н, Н6', J 10.0, 8.0,
нения 23 (45:55) и 0.07 г соединения 24.
6.0, 2.0 Гц). Спектр ЯМР 13С, δ, м.д.: 35.9 (С2а),
1-(2,3,4,5-Тетрафторфенил)перфторбензоци-
112.0 д (С6', 2JСF 21.0 Гц), 112.2 д (2С, C6'', 2JСF
клобутен (22). Вязкая жидкость. Спектр ЯМР 1Н,
21.0 Гц), 120.5 м (С1'), 121.3 м (2С, C1''), 121.8 д
δ, м.д.: 7.07 м (1Н, Н6'). Спектр ЯМР 19F, δ, м.д.: 9.3
(С1 или С2, 2JСF 11.0 Гц), 124.4 д (С1 или С2, 2JСF
т.т (1F, F3'), 12.2 д.д.т.д (1F, F4'), 19.7 д.д.д.д (1F, F4),
16.0 Гц), 140-149 д.м (16С-F, 1JСF 248.0-267.0 Гц),
20.8 д.д.д (1F, F5), 23.9 м (1F, F2'), 25.2 д.д.д.д (1F,
183.6 (С1а). Спектр ЯМР 19F, δ, м.д.: 7.7 д.д.д.д (2F,
F5'), 26.0 м (1F, F1), 27.3 д.д.д (1F, F6), 28.8 д.д.д (1F,
F4''), 7.9 д.д (2F, F3''), 9.8 д.д.д.д (1F, F3'), 10.1 д.д.д
F3), 64.9 (1F, FA2) и 59.2 (1F, FB2); JAB 200.0, J14 4.0,
(1F, F5), 13.5 д.д.д (1F, F4), 19.6 д.д.д.д (1F, F4'), 22.1
J14' 3.0, J34 20.0, J35 8.0, J36 24.0, J45 18.0, J46 8.0, J56
м (2F, F2''), 22.8 д.д.д (1F, F6), 24.5 д.д.д (2F, F5''),
20.0, J2'3' 20.0, J2'4' ~ J4'6' ~ 7.0, J2'5' 12.0, J3'4' 20.0,
25.0 м (1F, F2'), 26.4 д.д.д.д (1F, F5'), 27.0 д.д.д (1F,
J
~ J3'6' ~ 3.0, J4'5' 21.0, J5'6' 10.0 Гц. Масс-спектр,
F3); J34 21.0, J35 5.0, J36 11.0, J45 20.0, J46 5.0, J56
3'5'
m/z: 377.9902 [М]+. C14HF11. М 377.9897.
22.5, J2'3' 21.0, J2'4' 10.0, J2'5' 13.0, J2'6' 6.0, J3'4' 19.0,
1,2-Бис(2,3,4,5-тетрафторфенил)перфторбен-
J3'5' 4.0, J3'6' 2.0, J4'5' 21.0, J4'6' 8.0, J5'6' 10.0, J2''3''
20.0, J2''4'' 4.0, J2''5'' 11.0, J3''4'' 20.0, J4''5'' 20.0, J4''6''
зоциклобутен (23), изомер транс-23. Т.пл. 106.1-
7.0, J5''6'' 11.0 Гц. Масс-спектр, m/z: 635.9998 [М]+.
107.1°С (СНСl3). Спектр ЯМР 1Н, δ, м.д.: 7.13 м
C26H4F16O. М 636.0001.
(2Н, Н6'). Спектр ЯМР 19F, δ, м.д.: 8.7 т (2F, F3'),
11.5 т.т (2F, F4'), 18.6 м (2F, F4,5), 24.4 м (2F, F2'),
4,5,6,7-Тетрафтор-1,3,3-трис(2,3,4,5-тетра-
24.9 д.д.д (2F, F5'), 26.2 м (2F, F3,6), 28.4 м (2F, F1,2);
фторфенил)-1,3-дигидро-2-бензофуран-1-ол
J2'3' 20.0, J2'4' 7.0, J2'5' 14.0, J3'4' 20.0, J4'5' 20.0, J4'6'
(21). Спектр ЯМР 1Н, δ, м.д.: 3.85 м (1Н, ОН), 6.88
7.0, J5'6' 10.0 Гц. Масс-спектр, m/z: 507.9930 [М]+.
м (1Н), 7.02 м (1Н), 7.28 м (1Н). Спектр ЯМР 13С,
C20H2F14. М 507.9928. Изомер цис-23. Спектр
δ, м.д.: 88.0 (С3), 105.0 (С1), 109.8 д, 110.0 д, 110.2 д
ЯМР 1Н (из спектра смеси цис,транс-изомеров),
(С6',6'',6''', 2JСF 22.0 Гц), 122.6 (С1'',1'''), 123.9 д, 124.1
δ, м.д.: 7.13 м (2Н, Н6'). Спектр ЯМР 19F (из спек-
д (С3а,7а, 2JСF 15.0 Гц), 124.8 (С1'), 140-148 д.м
тра смеси цис,транс-изомеров), δ, м.д: 26.4 м (2F,
(16С-F, 1JСF 250.0-260.0 Гц). Спектр ЯМР 19F, δ,
F3,6), 26.0 д.д.д (2F, F5'), 24.9 м (2F, F2'), 24.6 м (2F,
м.д.: 8.7 м, 9.0 м, 9.3 м (3F, F3',3'',3'''), 9.8 м, 9.9 м,
F1,2), 18.6 м (2F, F4,5), 12.6 д.д.д.д (2F, F4'), 9.4 д.д
10.5 м (3F, F4',4'',4'''), 13.9 м, 14.1 м (2F, F5,6), 20.7
(2F, F3'); J2'3' 20.0, J2'4' 7.0, J2'5' 13.0, J3'4' 20.0, J4'5'
м (1F, F7), 24.2 м (1F, F4), 24.4 м 24.8 м, 25.0 м
21.0, J4'6' 7.0, J5'6' 10.0 Гц. Масс-спектр, m/z (смесь
(3F, F5',5'',5'''), 22.3 м, 25.1 м, 26.1 м (3F, F2',2'',2''').
транс- и цис-изомеров): 507.9930 [М]+. C20H2F14.
Масс-спектр, m/z: 651.9947 [М]+. C26H4F16O2. М
М 507.9928.
651.9950.
1,1,2-Трис(2,3,4,5-тетрафторфенил)перфтор-
г. Смесь 0.52 г (2.10 ммоль) соединения 1, 0.63 г
бензоциклобутен (24). Спектр ЯМР 1Н, δ, м.д.:
(4.20 ммоль) соединения 16 и 3.66 г (16.88 ммоль)
6.79 м (1Н), 7.13 м (1Н), 7.30 м (1Н). Спектр ЯМР
SbF5 нагревали в запаянной стеклянной ампуле при
19F, δ, м.д.: 8.8 м, 8.9 м (2F, F3'',3'''), 9.5 м (1F, F3'),
50-55°С 30 ч, охлаждали до 0°С, переносили в НF-
9.4 м, 10.9 м (2F, F4'',4'''), 12.4 м (1F, F4'), 14.5 м (1F,
Py (6 мл) при 0-20°С, перемешивали при 25°С в те-
F4), 17.8 м (1F, F5), 23.7 м (1F, F2), 24.8 м (1F, F5'),
чение 1 ч, охлаждали до 0°С, переносили в воду со
26.0 м (2F, F5'',5'''), 25.7 м, 27.7 м, 27.9 м, 28.4 м, 28.5
льдом, экстрагировали CHCl3, органический слой
м (5F, F3,6,2',2'',2'''). Масс-спектр, m/z: 637.9954 [М]+.
сушили MgSO4, отгоняли CHCl3. Получали 1.06 г
C26H3F17. М 637.9958.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1144
МЕЖЕНКОВА и др.
ВЫВОДЫ
Russ. J. Org. Chem. 2020, 56, 434-440.] doi 10.1134/
S1070428020030112
При взаимодействии перфторбензоциклобу-
4.
Меженкова Т.В., Синяков В.Р., Карпов В.М., Зо-
тена с изомерными тетрафторбензолами в среде
нов Я.В., Гатилов Ю.В., Платонов В.Е. ЖОрХ.
SbF5 получаются перфторбензоциклобутены с од-
2018, 54, 546-553. [Mezhenkova T.V., Sinyakov V.R.,
ной, двумя и тремя тетрафторфенильными груп-
Karpov V.M., Zonov Ya.V., Gatilov Yu.V., Platonov V.E.
пами. В процессе обработки реакционных смесей
Russ. J. Org. Chem. 2018, 54, 545-553.] doi10.1134/
водой происходят скелетные превращения бис- и
S107042801804005X
трис(тетрафторфенил)перфторбензоциклобутенов
5.
Карпов В.М., Меженкова Т.В., Платонов В.Е. Изв.
с образованием кетонов и полифтор-2-бензофура-
АН СССР. Сер. хим. 1990, 1114-1120. [Karpov V.M.,
нов. Направление скелетных превращений зависит
Mezhenkova T.V., Platonov V.E. Bull. Acad. Sci. USSR.
от расположения атома водорода в тетрафторфе-
Div. Chem. Sci. 1990, 39, 1000-1004.]
нильной группе бензоциклобутена. Обсуждаются
пути протекания реакций.
6.
Карпов В.М., Меженкова Т.В., Платонов В.Е. Изв.
АН СССР. Сер. хим. 1992, 1419-1424. [Karpov V.M.,
БЛАГОДАРНОСТИ
Mezhenkova T.V., Platonov V.E. Bull. Russ. Acad. Sci.
Авторы выражают благодарность Химическому
Chem. Sci. 1992, 41, 1110-1114.]
исследовательскому центру коллективного пользо-
7.
Karpov V.M., Mezhenkova T.V., Platonov V.E.,
вания СО РАН за проведение спектральных и ана-
Sinyakov V.R. J. Fluor. Chem. 2002, 117, 73-81. doi
литических измерений.
10.1016/S0022-1139(02)00196-3
ИНФОРМАЦИЯ ОБ АВТОРАХ
8.
Sakamoto Y., Suzuki T. J. Org. Chem. 2017, 82, 8111-
8116. doi 10.1021/acs.joc.7b01383
Меженкова Татьяна Владимировна, ORCID:
9.
Синяков В.Р., Меженкова Т.В., Карпов В.М., Пла-
тонов В.Е., Рыбалова Т.В., Гатилов Ю.В. ЖОрХ.
Комаров Владислав Владимирович, ORCID:
2003, 39, 886-891. [Sinyakov V.R., Mezhenkova T.V.,
Karpov V.M., Platonov V.E., Rybalova T.V., Gati-
lov Yu.V. Russ. J. Org. Chem. 2003, 39, 837-842.] doi
Зонов Ярослав Викторович, ORCID: http://
10.1023/B:RUJO.0000003162.41792.ad
orcid.org/0000-0003-0267-4976
10.
Карпов В.М., Меженкова Т.В., Платонов В.Е., Си-
КОНФЛИКТ ИНТЕРЕСОВ
няков В.Р., Щеголева Л.Н. ЖОрХ. 2002, 38, 1210-
Авторы заявляют об отсутствии конфликта ин-
1217. [Karpov V.M., Mezhenkova T.V., Platonov V.E.,
тересов.
Sinyakov V.R., Shchegoleva L.N. Russ. J. Org. Chem.
2002, 38, 1158-1165.] doi 10.1023/A:1020901526459
СПИСОК ЛИТЕРАТУРЫ
11.
Pozdnyakovich Yu.V., Shteingarts V.D. J. Fluorine
1. Mezhenkova T.V., Sinyakov V.R., Karpov V.M.,
Chem.
1974,
4,
283-296. doi
10.1016/S0022-
Platonov V.E., Rybalova T.V., Gatilov Yu.V.
1139(00)80865-9
J. Fluorine Chem. 2008, 129, 64-67. doi 10.1016/
12.
Береговая И.В., Карпов В.М., Меженкова Т.В., Пла-
j.jfluchem.2007.09.005
тонов В.Е., Чуйков И.П. ЖОрХ. 2012, 48, 525-530.
2. Меженкова Т.В., Синяков В.Р., Карпов В.М., Пла-
[Beregovaya I.V., Karpov V.M., Mezhenkova T.V.,
тонов В.Е. ЖОрХ. 2012, 48, 531-537. [Mezhenko-
Platonov V.E., Chuikov I.P. Russ. J. Org. Chem. 2012,
va T.V., Sinyakov V.R., Karpov V.M., Platonov V.E.
48, 523-528.] doi 10.1134/S1070428012040100
Russ. J. Org. Chem. 2012, 48, 529-535.] doi 10.1134/
S1070428012040112
13.
Платонов В.Е., Сенченко Т.В., Якобсон Г.Г. ЖОрХ.
3. Меженкова Т.В., Синяков В.Р., Карпов В.М., Зо-
1976, 12, 816-821. [Platonov V.E, Senchenko T.V.,
нов Я.В. ЖОрХ. 2020, 56, 422-429. [Mezhenko-
Yakobson G.G. J. Org. Chem. USSR. 1976, 12, 818-
va T.V., Sinyakov V.R., Karpov V.M., Zonov Ya.V.
823.]
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ВЗАИМОДЕЙСТВИЕ ПЕРФТОРБЕНЗОЦИКЛОБУТЕНА С ИЗОМЕРНЫМИ ТЕТР
АФТОРБЕНЗОЛАМИ
1145
Interaction of Perfluorobenzocyclobutene with Isomeric
Tetrafluorobenzenes in SbF5 Medium
T. V. Mezhenkovaa, *, V. V. Komarova, b, V. M. Karpova, V. R. Sinyakova,
Ya. V. Zonova, and V. I. Krasnova
a Vorozhtsov Novosibirsk Institute of Organic Chemistry, Siberian Branch, Russian Academy of Sciences,
prosp. Akademika Lavrent’eva, 9, Novosibirsk, 630090 Russia
*e-mail: mtv@nioch.nsc.ru
b Novosibirsk State University, ul. Pirogova 2, Novosibirsk, 630090 Russia
Received March 10, 2021; revised March 21, 2021; accepted March 23, 2021
The reactions of perfluorobenzocyclobutene (1 mol) with isomeric tetrafluorobenzenes (2 mol) in SbF5 medium
and further treatment of the reaction mixtures with HF lead to 1,2-bis(tetrafluorophenyl)perfluorobenzocy-
clobutenes. When the reaction mixtures are treated with water (3,4,5,6-tetrafluorobenzene-1,2-diyl)bis[(tetrafluo-
rophenyl)methanones] are obtained. Along with them, the reactions with 1,2,4,5- and 1,2,3,4-tetrafluorobenzenes
give 4,5,6,7-tetrafluoro-1,3,3-tris(tetrafluorophenyl)-1,3-dihydro-2-benzofuran-1-ols, and in the reaction with
1,2,3,4-tetrafluorobenzene, {2-[bis(2,3,4,5-tetrafluorophenyl)methyl]-3,4,5,6-tetrafluorophenyl}(2,3,4,5-tetra-
fluorophenyl)methanone is also formed.
Keywords: perfluorobenzocyclobutene, tetrafluorobenzene, cation, skeletal transformations, antimony penta-
fluoride
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021