ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 8, с. 1146-1153
УДК 547.841:541.63
СТРОЕНИЕ И КОНФОРМАЦИОННЫЙ АНАЛИЗ
5,5-БИС(БРОММЕТИЛ)-2-(4-ДИМЕТИЛАМИНОФЕНИЛ)-
1,3-ДИОКСАНА
© 2021 г. Ш. Ю. Хажиевa, М. А. Хусаиновb, Р. А. Халиковc, В. А. Катаевc,
Т. В. Тюмкинаd, Е. С. Мещеряковаd, Л. М. Халиловd, В. В. Кузнецовb, e, *
a ОАО АНК Башнефть, Россия, 450077 Уфа, ул. К. Маркса, 30
b ФГБОУ ВО «Уфимский государственный нефтяной технический университет»,
Россия, 450062 Уфа, ул. Космонавтов, 1
c ФГБОУ ВО «Башкирский государственный медицинский университет
Министерства здравоохранения Российской Федерации», Россия, 450008 Уфа, ул. Ленина, 3
d Институт нефтехимии и катализа РАН- обособленное структурное подразделение
ФГБНУ «Уфимского федерального исследовательского центра РАН»,
Россия, 450075 Уфа, пр. Октября, 141
e ФГБОУ ВО «Уфимский государственный авиационный технический университет»,
Россия, 450008 Уфа, ул. К. Маркса, 12
*e-mail: kuzmaggy@mail.ru
Поступила в редакцию 25.03.2021 г.
После доработки 10.04.2021 г.
Принята к публикации 12.04.2021 г.
С помощью спектроскопии ЯМР 1Н, 13С и данных рентгеноструктурного анализа исследовано стро-
ение 5,5-бис(бромметил)-2-(4-диметиламинофенил)-1,3-диоксана - перспективного реагента тонкого
органического синтеза и потенциального бактерицидного препарата. Его молекулы в кристаллическом
состоянии и в растворе пребывают в конформации кресло с экваториальным ароматическим заместите-
лем. В рамках DFT метода PBE/3ξ установлены маршрут конформационных превращений и значения
потенциальных барьеров внутреннего вращения ароматической и N(CH3)2 групп для изолированной
молекулы и раствора хлороформа (кластерная модель). Сделан вывод об относительно небольшом (до
4) числе молекул растворителя в ближайшей сольватной оболочке исследуемого 1,3-диоксана.
Ключевые слова: 1,3-диоксан, рентгеноструктурный анализ, ЯМР, конформер, кластерная модель,
компьютерное моделирование
DOI: 10.31857/S051474922108005X
ВВЕДЕНИЕ
ных вступать в реакции нуклеофильного замеще-
ния [11]. Показано [12-14], что молекулы фор-
Замещенные 1,3-диоксаны относятся к клас-
малей
5,5-бис(галогенметил)-1,3-диоксанов при
сическим объектам конформационного анализа
комнатной температуре характеризуются быстрой
[1, 2], используются в качестве реагентов тонкого
в шкале времени ЯМР интерконверсией цикла. В
органического синтеза [3-8], а также для созда-
случае 2-замещенных аналогов реализуется кон-
ния новых перспективных лекарственных соеди-
формация кресло с экваториальным заместителем
нений, в частности, галоген- и азотсодержащих
у атома С2 кольца [15-17]. Совокупность струк-
аналогов [9, 10]. Помимо этого, 5,5-бис(галоген-
турных особенностей, химических свойств и со-
метил)-1,3-диоксаны содержат 2 дополнительных
става (наличие в молекуле 1,3-диоксана атомов
реакционных центра - атомы галогенов, способ-
галогенов и азота) позволяет считать такие со-
1146
СТРОЕНИЕ И КОНФОРМАЦИОННЫЙ АНАЛИЗ
1147
Схема 1
BrH2C
O
H
C
BrH2C
O
C6H4N(CH3)2
1
единения перспективными для решения задач кон-
заместителей, соответствующее, согласно данным
формационного анализа и создания объектов с вы-
квантово-химических расчетов, минимуму энер-
сокой биологической активностью. В этой связи
гии по сравнению с альтернативными конфор-
настоящая работа посвящена изучению строения
мациями связей углерод-галоген в замещающих
и конформационных превращений неописанного
группах у атома С5 1,3-диоксанового цикла [19].
ранее
5,5-бис(бромметил)-2-(4-диметиламинофе-
Помимо этого, ароматический заместитель при
нил)-1,3-диоксана (1) (схема 1) с помощью мето-
атоме С2 кольца почти копланарен гетероатомной
да ЯМР на ядрах 1H, 13С, рентгеноструктурного
плоскости диоксана 1, значение межплоскостного
анализа (РСА) и апробированного для соединений
угла между фрагментом С11-О4-О2-С15 и аромати-
этого класса [2] DFT-метода PBE/3ζ (программ-
ческим кольцом составляет 20.1(3)°. Заместитель
ное обеспечение ПРИРОДА [18]), а также иссле-
N(CH3)2 характеризуется планарной конфигураци-
дованию влияния числа молекул растворителя на
ей атома азота (сумма валентных углов составля-
относительные энергии минимумов и переходных
ет 360°) и ожидаемо копланарен ароматическому
состояний на поверхности потенциальной энергии
кольцу, торсионный угол С16-N3-С6-С9 составля-
(ППЭ) данного соединения (кластерная модель).
ет 2.2(13)°.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты экспериментов ЯМР
1Н и
13С
(табл. 2) в растворе CDCl3 по данным 1D и 2D
Образец диоксана
1 получен конденсацией
спектроскопии с использованием режимов
2,2-бис(бромметил)-1,3-пропандиола с п-диметил-
NOESY, COSYHH и HSQC свидетельствуют о
аминобензальдегидом (схема 2).
пребывании молекул ацеталя 1 при комнатной
Было проведено рентгеноструктурное иссле-
температуре в конформации кресло. На это указы-
дование кристаллов
1. Кристаллографические
вает диастереотопный характер метиленовых про-
данные приведены в экспериментальной части, а
тонов при магнитно эквивалентных углеродных
диоксан 1 зарегистрирован в Кембриджской базе
атомах С4 и С6 гетероциклического кольца (Δδ
структурных данных под № СCDC 2064773.
0.4 м.д.), проявляющихся в спектре ЯМР 1Н в виде
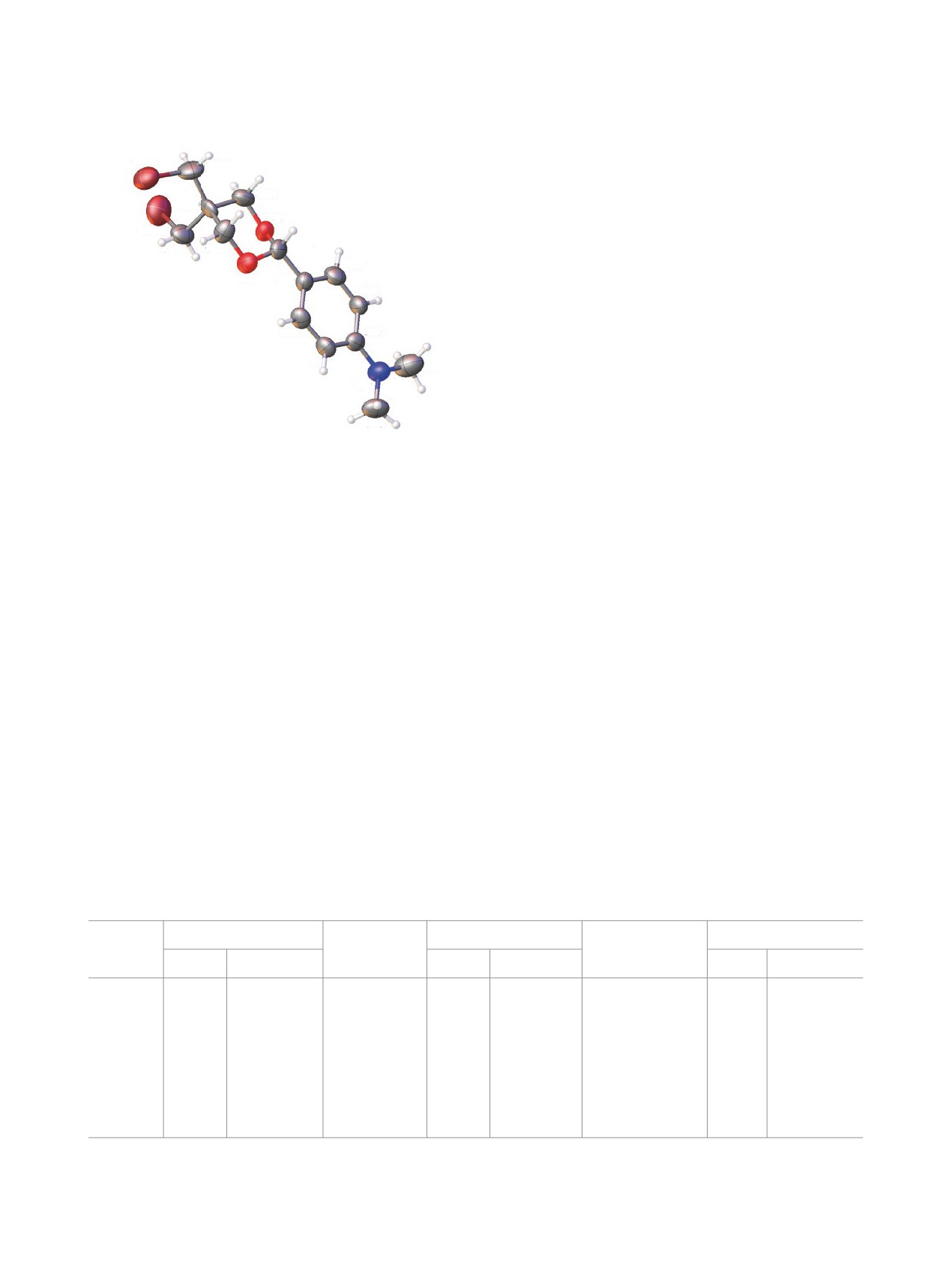
Установлено, что структура молекулы ацеталя 1
2 дублетов с геминальной константой 2J - 11.6 Гц.
отвечает конформации кресло. При этом молекулы
Метиленовые протоны бромметильных заместите-
исследуемого соединения формируют орторомби-
лей при атоме С5 кольца магнитно неэквивалент-
ческие кристаллы с пространственной группой Рbca
ны (Δδ 0.7 м.д.); при этом на основании NOESY
(рис. 1). Для гетероатомной части гетероцикличе-
эксперимента установлено, что сигнал протонов
ского кольца характерны ожидаемые длины связей
аксиальной СН2Br группы проявляется в более
С-О (1.418-1.425 Å) и значения валентных углов,
слабом поле (табл. 2). Сигнал наиболее слабо-
близкие к 110-112°. Торсионные углы также от-
польного углеродного атома гетероциклического
вечают значениям, наблюдаемым в конформации
кольца в спектре ЯМР 13С принадлежит атому С2
кресло (табл. 1) [2, 15-17]. Необходимо отметить
(102.3 м.д.); в спектре HSQC он коррелирует с сиг-
характерное гош-расположение бромметильных
налом протона На при 5.4 м.д.
Схема 2
BrH
2C
OH
H
H+
+
O
1
-H2O
BrH2C
OH
C6H4N(CH3)2
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1148
ХАЖИЕВ и др.
Основное отличие данных расчета экваториаль-
Br1
C0AA
ной формы кресло диоксана 1 от результатов рент-
C15
геноструктурных измерений связано с конформа-
C14
O2
цией ароматического заместителя. В кристалли-
Br2
ческом состоянии, как отмечалось выше, он почти
C12
C17
C11
копланарен гетероатомной плоскости 1,3-диок-
C10
санового кольца; аналогичная картина наблюда-
O4
C7
C1
ется для 2-фенил- [16] и 2,2-дифенил-1,3-диокса-
нов с 5,5-дибромметильной группировкой [14]; в
C6
C5
5,5-бис(бромметил)-2-(4-метоксифенил)-1,3-диок-
C2
C9
сане ароматическая группа в кристалле, напротив,
N3
ориентирована перпендикулярно соответствую-
C16
щей гетероатомной плоскости [15]. Однако рас-
четные данные как для изолированной молекулы
Рис. 1. Молекула соединения 1 в представлении ато-
диоксана 1, так и для кластеров с растворителем,
мов эллипсоидами тепловых колебаний (р = 50%)
указывают на преимущественно ортогональную
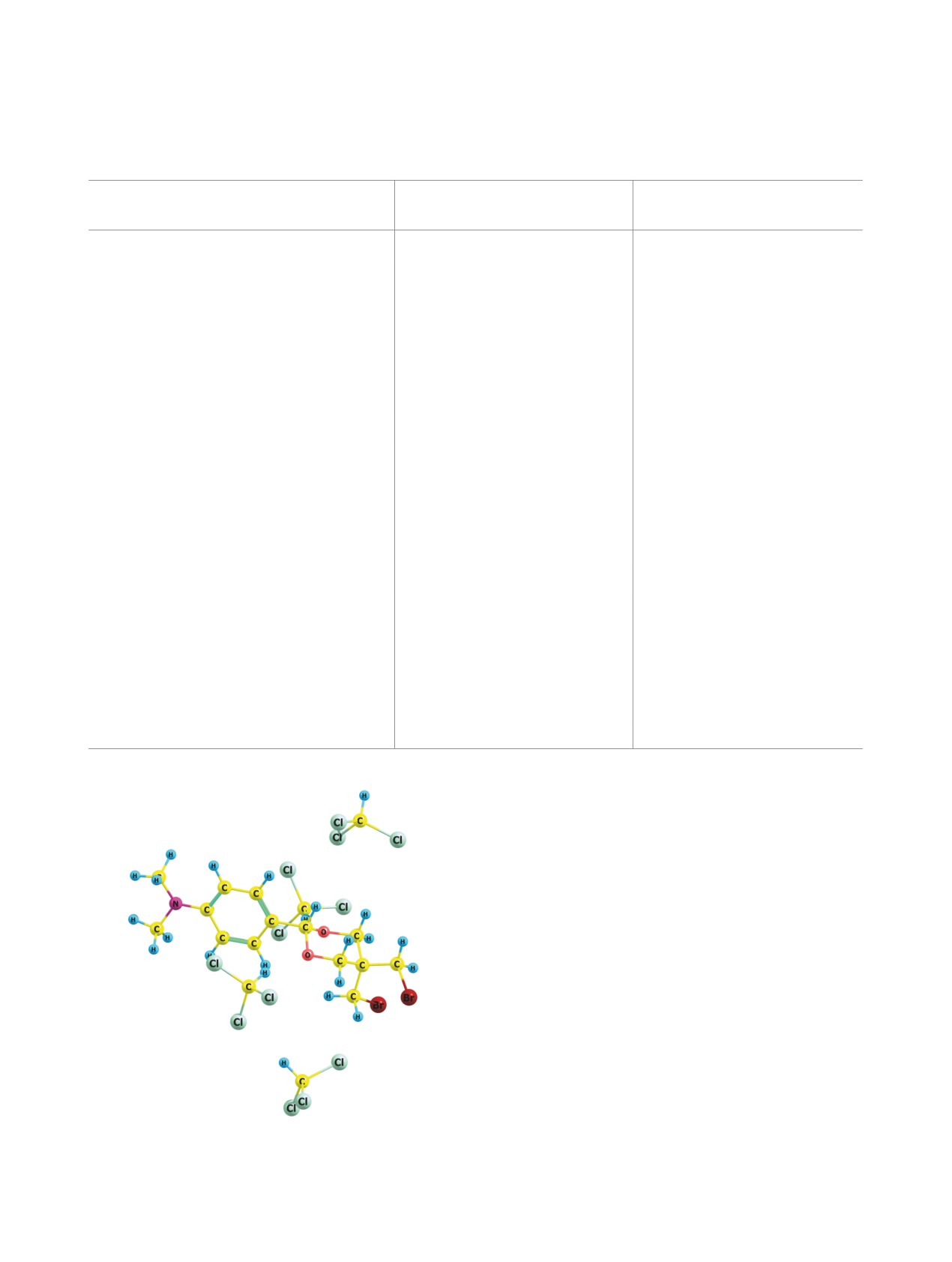
Полученные результаты подтверждаются дан-
ориентацию ароматического заместителя в форме
ными конформационного анализа диоксана 1 в
Ке с невысоким барьером внутреннего вращения
рамках расчетного приближения PBE/3ζ.
(табл. 3). Связанный с этим характер ППЭ анало-
гичен подробно описанному [16] для фенильной
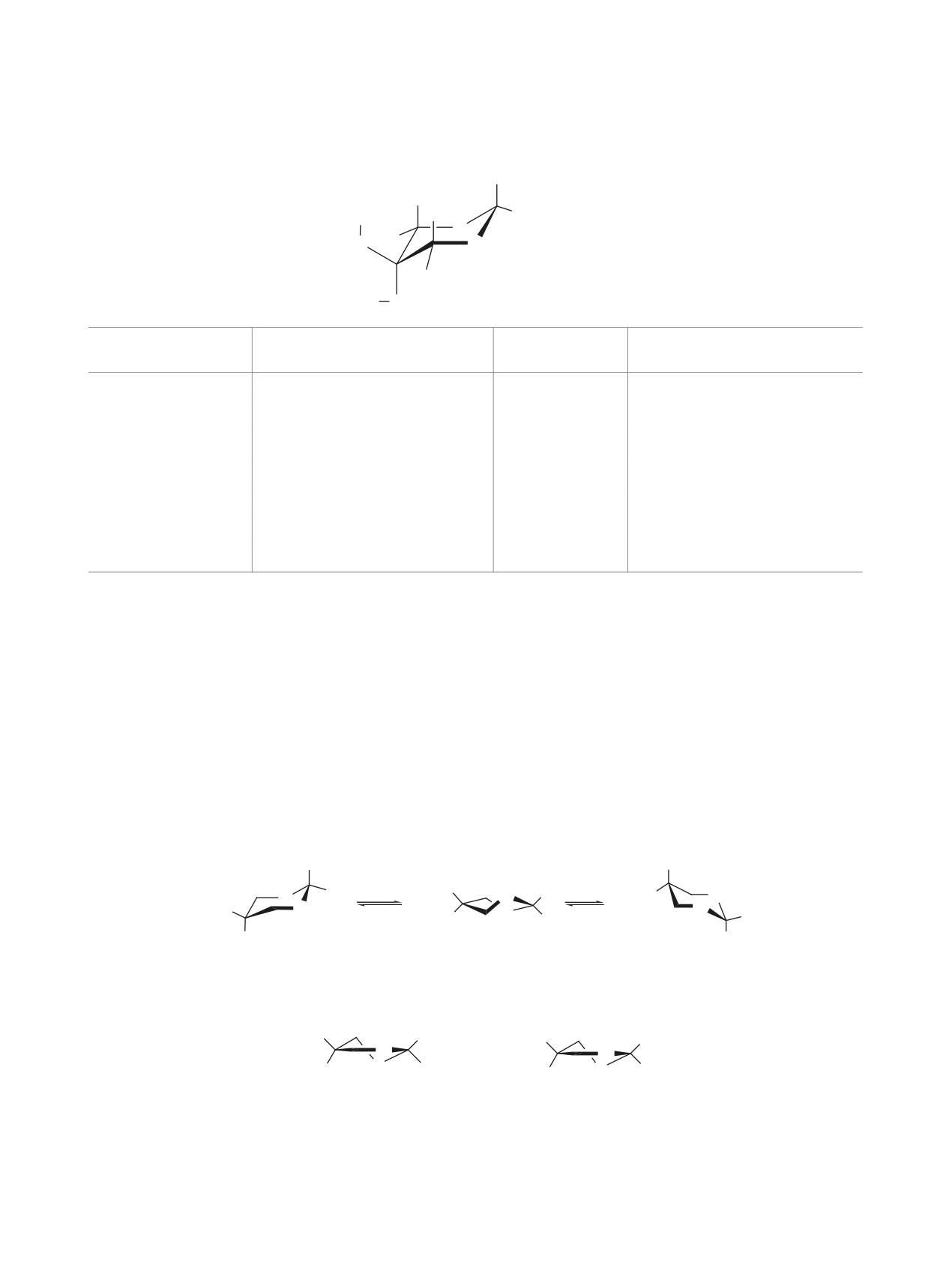
На ППЭ этого соединения выявлены миниму-
группы, а оптимизированная система 1(Ке)@4
мы, отвечающие экваториальному и аксиальному
CHCl3 представлена на рис. 2.
конформерам кресло, Ке и Ка, и 2,5-твист-форме
(2,5-Т), из которых первый выступает главным, а
Для дополнительной оценки адекватности ис-
пользуемого расчетного приближения нами ис-
также переходные состояния ПС-1 и ПС-2, соот-
следованы конформационные характеристики
ветствующие конформациям полукресло (схема 3).
молекулы N,N-диметиланилина, выступающей
Расчетные значения длин связей, а также валент-
структурным фрагментом диоксана 1. Расчетное
ных и торсионных углов для конформера Ке близ-
значение барьера вращения вокруг C-N связи
ки значениям рентгеноструктурного эксперимента
(5.8 ккал/моль) соответствует экспериментальной
(табл. 1).
величине, установленной методом спектроско-
Относительные энергии всех форм, отвечаю-
пии ЯМР 1Н (5.1±1.0 ккал/моль [20]); при этом
щих стационарным точкам на ППЭ для изолиро-
минимуму энергии, как свидетельствуют данные
ванной молекулы диоксана 1, а также для класте-
газовой электронографии [1, 21], отвечает фор-
ров с растворителем, представлены в табл. 3.
ма с ортогональной ориентацией неподеленной
Таблица 1. Избранные длины связей, валентные и торсионные углы в молекуле диоксана 1 (данные расчета приве-
дены для изолированной молекулы в вакууме, конформер экваториального кресла, Ке, PBE/3ζ)
Длина связи, Å
φ, град
τ, град
Валентный
Связь
Торсионный угол
угол
расчет
эксперимент
расчет
эксперимент
расчет
эксперимент
Br2-C17
1.987
1.954(9)
O2-C12-O4
110.3
110.0(7)
С12-О4-С11-С14
58.7
57.4(9)
O2-C12
1.428
1.418(9)
C12-O4-C11
110.9
111.9(6)
С12-О2-С15-С14
-59.6
-58.8(9)
O2-C15
1.428
1.425(10)
C12-O2-C15
110.9
110.2(6)
С11-О4-С12-О2
-62.0
-63.7(8)
O4-C12
1.433
1.418(9)
O4-C11-C14
111.9
110.2(6)
С15-О2-С12-О4
62.5
62.9(8)
O4-C11
1.428
1.425(9)
O2-C15-C14
111.6
112.5(7)
С11-С14-С15-О2
52.8
51.4(9)
C7-C12
1.500
1.497(11)
C11-C14-C15
105.7
107.7(8)
С15-С14-С11-О4
-52.6
-49.9(8)
N3-C6
1.389
1.372(10)
Br2-C17-C14
114.2
114.7(6)
C11-С14-С17-Br2
61.4
62.5(9)
N3-C2
1.456
1.438(10)
C2-N3-C16
117.1
118.8(8)
С16-N3-С6-С9
13.1
2.2(13)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
СТРОЕНИЕ И КОНФОРМАЦИОННЫЙ АНАЛИЗ
1149
Таблица 2. Данные спектроскопии ЯМР 1Н и 13С диоксана 1 (в CDCl3)
Ha
HA
2
H
C6H4N(CH3)2
Br
6
A
O
HB
H2C
O
8
4
5
HB
Br
CH2
7
Протон
ЯМР 1Н, δ, м.д.a
С атом
ЯМР 13С, δ, м.д.
На
5.4
C2
102.8
НА
3.9-3.8 д (2J 11.6 Гц)
C4, C6
71.9
НВ
4.3-4.2 д (2J 11.6 Гц)
C5
37.4
СН2Br (a)
4.0 c
C7
36.3
СН2Br (e)
3.3 c
C8
34.7
(CH3)2N
3.0
Саром
113.2-151.3
C6H4
6.7 д; 7.4 д (2J 8.7 Гц)
(CH3)2N
40.6
a с - синглет, д - дублет
электронной пары атома азота относительно пло-
сумма соответствующих валентных углов состав-
скости бензольного кольца, а переходному состоя-
ляет 354.5°, а торсионный угол Саром-Саром-N-C
нию - конформация с n-электронной парой, лежа-
равен 13.7°.
щей в плоскости ароматического цикла. Расчетные
Аналогичны - конформационные свойства это-
длины связей Саром-N (1.393 Å) и N-CH3 (1.455 Å)
го заместителя и в диоксане 1 (табл. 3).
близки установленным методом газовой электро-
нографии: 1.396(14) и 1.460(12) Å [21]. Следует
Ближайший минимум к форме Ке для изоли-
также отметить слабо выраженную пирамидаль-
рованной молекулы диоксана 1 - конформер Ка,
ность атома азота: согласно результатам расчета
а для кластеров с растворителем - 2,5-Т. При этом
Схема 3
Минимумы
H
CH2Br
ПС-1
BrH2C
Ar
ПС-2
O
Ar
O
BrH2C
O
BrH
O
O
2C
O
H
BrH2C
H
CH2Br
Ar
Ke
2,5-T
Ka
Переходные состояния
BrH2C
H
BrH2C
Ar
O
O
O
Ar
O
BrH2C
BrH2C
H
ПС-1
ПС-2
Ar = C6H4nN(CH3)2.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1150
ХАЖИЕВ и др.
Таблица 3. Энергетические параметры конформационных превращений молекул диоксана 1 и N,N-диметиланилина
по данным PBE/3ζ
Соединение
ΔG0298, (ΔG≠298), ккал/мольа
ΔS0298, (ΔS≠298), кал/моль∙Kа
Изолированная молекула 1:
Ке (Ar планарный)
0.65
-1.49
Ка
3.57
-3.57
2,5-Т
4.09
0.46
ПС-1
(9.77)
(-1.62)
ПС-2
(11.10)
(-3.10)
Барьер вращения С-Ar (Кe)
(2.23)
(-8.42)
Барьер вращения С-Ar (Ка)
(6.00)
(-7.94)
Барьер вращения С-N(Me)2 (Кe)
(6.60)
(-5.58)
1@4 CHCl3:
Ка
4.83
-2.77
2,5-Т
4.26
3.58
ПС-1
(9.12)
(1.35)
ПС-2
(14.60)
(1.31)
Барьер вращения С-Ar (Кe)
(2.51)
(-2.68)
Барьер вращения С-N(Me)2 (Кe)
(7.20)
(-5.56)
1@8 CHCl3:
Ка
5.87
-7.60
2,5-Т
5.26
-4.35
ПС-1
(10.81)
(-5.39)
ПС-2
(14.64)
(-10.23)
Барьер вращения С-Ar (Кe)
(3.34)
(-5.68)
Барьер вращения С-N(Me)2 (Кe)
(7.94)
(-5.87)
N,N-Диметиланилин
(5.81)
(-5.64)
а В случае диоксана 1 - относительно формы Ке
различия в энергии с формой Ке возрастают с уве-
личением числа молекул растворителя в класте-
ре; параллельно растет и главный потенциальный
барьер конформационных превращений диокса-
на 1 (ПС-2), а также барьеры внутреннего вра-
щения ароматического кольца и N(CH3)2 группы
(табл. 3). Ранее нами было показано, что вероятное
число молекул растворителя в кластере с молекула-
ми насыщенных гетероциклов - 1,3-диоксанов [14,
22], тетрагидро-1,3-оксазинов [23] и 1,3,2-диокса-
боринанов [24] - в обычных условиях не должно
превышать 10. В данном случае эксперименталь-
ные значения барьеров интерконверсии замещен-
ных 1,3-диоксанов (ΔG≠298 8-11 ккал/моль [1]) и
внутреннего вращения N(CH3)2 группы в N,N-
диметиланилиновом фрагменте
(5-6 ккал/моль
Рис. 2. Кластер: диоксан 1(Ке)@4CHCl3
[20]) дают основание при сопоставлении с резуль-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
СТРОЕНИЕ И КОНФОРМАЦИОННЫЙ АНАЛИЗ
1151
татами расчета предположить, что число молекул
углов. Значения потенциальных барьеров установ-
хлороформа в ближайшей сольватной оболочке
лены с помощью процедуры поиска переходных
диоксана 1 не должно превышать 4.
состояний в рамках программного обеспечения
ПРИРОДА. Принадлежность стационарных то-
Следует также отметить отсутствие на ППЭ
чек ППЭ к переходному состоянию подтверждали
промежуточного минимума - 1,4-твист - харак-
наличием одной мнимой частоты в соответствую-
терного для равновесия молекул незамещенного, а
щем гессиане, а к минимуму - отсутствием мни-
также 2-, 4- , 5-, 2,5- и 4,4-замещенных 1,3-диок-
мых частот. Модельные кластеры формировали
санов [2].
последовательным добавлением молекул раство-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
рителя в окрестность исследуемого 1,3-диоксана
с помощью программных средств HyperChem, по-
Cпектры ЯМР получены на спектрометре
сле чего полученную систему оптимизировали в
Bruker Avance 400 (ФРГ) с рабочими частотами
рамках PBE/3ζ.
400.13 (1H) и 100.62 (13С) МГц (раствор в CDCl3);
внутренний стандарт - сигнал растворителя.
5,5-бис(Бромметил)-2(4-диметиламинофе-
нил)-1,3-диоксан
(1).
Эквимолярную смесь
РСА проведен на автоматическом четырех-
(0.02 моль, 5.24 г) 2,2-бис(бромметил)-1,3-про-
кружном дифрактометре XCalibur Eos (США)
пандиола (Sigma-Aldrich) и 2.38 г п-диметилами-
(графитовый монохроматор, MoKα-излучение, λ =
нобензальдегида в 50 мл бензола в присутствии
0.71073 Å, w-сканирование, 2θmax = 62°). Сбор и
0.1 г п-толуолсульфокислоты (ПТСК) кипятили
обработка данных произведены с помощью про-
с обратным холодильником до прекращения вы-
граммы CrysAlisPro Oxford Diffraction Ltd., версия
деления воды в ловушке Дина-Старка, промыва-
1.171.36.20. Структуры расшифрованы прямым
ли 5% раствором гидрокарбоната натрия (10 мл),
методом и уточнены полноматричным методом
затем водой (2×10 мл), растворитель отгоняли, а
наименьших квадратов в анизотропном прибли-
остаток дважды перекристаллизовывали из 95%
жении для неводородных атомов. Атомы водоро-
EtOH. Выход 4.88 г (62%). т.пл. 145.5-146.5°С.
да локализованы в разностном синтезе Фурье и
уточнены изотропно. Расчеты выполняли по про-
ВЫВОДЫ
грамме SHELX97
[25]. Кристаллографические
Методами рентгеноструктурного анализа и
данные и детали рентгеноструктурного экспери-
спектроскопии ЯМР установлено, что молеку-
мента: Т 293(2) K; кристаллическая система - ор-
лы
5,5-бис(бромметил)-2-(4-диметиламинофе-
торомбическая; пространственная группа Pbca; па-
нил)-1,3-диоксана пребывают в конформации
раметры ячейки а 12.941(2) Å, b 9.9881(17) Å, c
кресло с экваториальным заместителем у атома С2
23.858(6) Å; β 90 град, V 3083.7(10) Å3, Z 8; ρвыч
кольца. Маршрут конформационных превращений
1.694 мг/мм3, μ 5.255 мм-1, F(000) 1568.0; область
в растворе хлороформа, выявленный с помощью
сканирования по θ 4.644-58.694 град; область ин-
DFT приближения PBE/3ξ (кластерная модель),
декса отражений -16 ≤ h ≤ 17, -11 ≤ k ≤ 13, -12 ≤
включает помимо экваториального кресла (глав-
l ≤ 29; независимых отражений 3601 (Rint 0.1255),
ный минимум на поверхности потенциальной
GOOF 0.932; для отражений с Ihkl > 2σ(I) R1 0.0272,
энергии) локальные минимумы 2,5-твист-формы
wR2 0.1451; для всех отражений R1 0.2321, wR2
и аксиального кресла, а также переходные состо-
0.2123; ∆ρmin/ρmax 0.53/-0.64 eÅ-3.
яния, отвечающие формам полукресла. Показано,
Первоначальную оптимизацию геометрии кон-
что число молекул растворителя в ближайшей
формера кресло ацеталя 1 осуществляли в рамках
сольватной оболочке исследуемого 1,3-диоксана
программного обеспечения HyperChem 8.0 (метод
не превышает четырех.
АМ1) [26], и далее - с помощью метода PBE/3ζ
БЛАГОДАРНОСТИ
(ПРИРОДА [18]). Моделирование интерконверсии
цикла и внутреннего вращения ароматического и
Структурные исследования диоксана 1 прове-
диметиламинового заместителей проводили мето-
дены в Центре коллективного пользования «Аги-
дом сканирования соответствующих торсионных
дель» при Институте нефтехимии и катализа РАН.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1152
ХАЖИЕВ и др.
КОНФЛИКТ ИНТЕРЕСОВ
9.
Franchini S., Sorbi C., Linciano P., Camevale G.,
Tait A., Ronsisvalle S., Buccioni M., Del Bello F.,
Авторы заявляют об отсутствии конфликта ин-
Cilia A., Pironal L., Denora N., Iacobazzi R.M.,
тересов.
Brasili L. Eur. J. Med. Chem. 2019, 176, 310-325. doi
10.1016/j.ejmech.2019.05.024
ИНФОРМАЦИЯ ОБ АВТОРАХ
10.
Тугарова А.В., Казакова А.Н., Камнев А.А., Злот-
Хажиев Шамиль Юрьевич, ORCID: http://
ский С.С. ЖОХ. 2014, 84, 1652-1655. [Tugaro-
orcid.org/0000-0003-1040-8475
va A.V., Kazakova A.N., Kamnev A.A., Zlotskij S.S.
Хусаинов Марат Абзалович, ORCID: http://
Russ. J. Gen. Chem. 2014, 84, 1930-1933.] doi
10.1134/S1070363214100119
orcid.org/0000-0003-4498-2598
11.
Курмаева Е.С., Чалова О.Б., Чистоедова Г.И., Ла-
Халиков Рустам Ахтямьянович, ORCID: http://
пука Л.Ф., Киладзе Т.К., Кантор Е.А., Рахманку-
orcid.org/0000-0003-2926-3309
лов Д.Л. ЖОрХ. 1985, 21, 131-135.
Катаев Валерий Алексеевич, ORCID: http://
12.
Бочкор С.А., Лапука Л.Ф., Курмаева Е.С., Чало-
orcid.org/0000-0001-8351-0601
ва О.Б., Злотский С.С., Рахманкулов Д.Л. ХГС.
1987, 607-608. [Bochkor S.A., Lapuka L.F., Kurmae-
Тюмкина Татьяна Викторовна, ORCID: http://
va E.S., Chalova O.B., Zlotskii S.S., Rakhmankul-
orcid.org/0000-0001-8127-9135
ov D.L. Chem. Heterocycl. Compd. 1987, 23, 500-
502.] doi 10.1007/BF00476374
Мещерякова Екатерина Сергеевна, ORCID:
13.
Хажиев Ш.Ю., Хусаинов М.А., Кантор Е.А. ЖОХ.
2011,
81,
155-156.
[Khazhiev Sh.Yu., Khusai-
Халилов Леонард Мухибович, ORCID: http://
nov M.A., Kantor E.A. Russ. J. Gen. Chem. 2011, 81,
orcid.org/0000-0002-2095-9097
153-154.] doi 10.1134/S1070363211010282
Кузнецов Валерий Владимирович, ORCID:
14.
Хажиев Ш.Ю., Хусаинов М.А., Халиков Р.А., Ка-
таев В.А., Тюмкина Т.В., Мещерякова Е.С., Ха-
лилов Л.М., Кузнецов В.В. ЖОрХ. 2020, 56, 9-15.
СПИСОК ЛИТЕРАТУРЫ
[Khazhiev Sh.Yu., Khusainov M.A., Khalikov R.A.,
Kataev V.A., Tyumkina T.V., Meshcheryakova E.S.,
1. Внутреннее вращение молекул. Ред. В.Дж. Ор-
Khalilov L.M., Kuznetsov V.V. Russ. J. Org. Chem.
вилл-Томас. М.: Мир, 1977.
2020, 56, 1-6.] doi 10.1134/S1070428020010017
2. Кузнецов В.В. ЖОрХ.
2014,
50,
1247-1265.
15.
Хажиев Ш.Ю., Хусаинов М.А., Халиков Р.А.,
[Kuznetsov V.V. Russ. J. Org. Chem. 2014, 50, 1227-
Тюмкина Т.В., Мещерякова Е.С., Халилов Л.М.,
1246.] doi 10.1134/S1070428014090012
Кузнецов В.В. ЖОрХ. 2018, 54, 1069-1072. [Kha-
3. Рахманкулов Д.Л., Караханов Р.А., Злотский С.С.,
zhiev Sh.Yu., Khusainov M.A., Khalikov R.A.,
Кантор Е.А., Имашев У.Б., Сыркин А.М. Итоги
Tyumkina T.V., Meshcheryakova E.S., Khalilov L.M.,
науки и техники. Технология органических ве-
Kuznetsov V.V. Russ. J. Org. Chem. 2018, 54, 1076-
ществ. М.: ВИНИТИ, 1979, 5, 6-248.
1079.] doi 10.1134/S1070428018070175
4. Кузнецов В.В. ХГС. 2006, 643-654. [Kuznetsov V.V.
16.
Хажиев Ш.Ю., Хусаинов М.А., Халиков Р.А., Тюм-
Chem. Heterocycl. Compd. 2006, 42, 559-569.] doi
кина Т.В., Мещерякова Е.С., Халилов Л.М., Кузне-
10.1007/s10593-006-0127-x
цов В.В. ЖОХ. 2018, 88, 369-374. [Khazhiev Sh.Yu.,
5. Кузнецов В.В. Изв. АН. Сер. хим. 2005, 1499-1507.
Khusainov M.A., Khalikov R.A., Tyumkina T.V.,
[Kuznetsov V.V. Russ. Chem. Bull. Int. Ed. 2005, 54,
Meshcheryakova E.S., Khalilov L.M., Kuznetsov V.V.
1543-1551.] doi 10.1007/s11172-006-0001-0
Russ. J. Gen. Chem. 2018, 88, 397-402.] doi 10.1134/
6. Janssens J., Risseeuw M.D.P., Eycken J.V., Calen-
S1070363218030040
bergh S.V. Eur. J. Org. Chem. 2018, 2018, 6405-
17.
Хажиев Ш.Ю., Хусаинов М.А., Халиков Р.А., Тюм-
6431. doi 10.1002/ejoc.201801245
кина Т.В., Мещерякова Е.С., Халилов Л.М., Кузне-
7. Cooksey J., Gunn A., Philip J. Kocienski P.J., Kuhl A.,
цов В.В. ЖОХ. 2019, 89, 197-201. [Khazhiev Sh.Yu.,
Uppal S., Christopher J.A., Bell R. Org. Biomol. Chem.
Khusainov M.A., Khalikov R.A., Tyumkina T.V.,
2004, 2, 1719-1731. doi 10.1039/B400242C
Meshcheryakova E.S., Khalilov L.M., Kuznetsov V.V.
8. Sinz C.J., Rychnovsky S.D. Top. Curr. Chem. 2001,
Russ. J. Gen. Chem. 2019, 89, 199-203.] doi 10.1134/
216, 50-93. doi 10.1007/3-540-44726-1_2
S0044460X19020057
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
СТРОЕНИЕ И КОНФОРМАЦИОННЫЙ АНАЛИЗ
1153
18. Лайков Д.Н., Устынюк Ю.А. Изв. РАН. Сер. хим.
22. Раскильдина Г.З., Спирихин Л.В., Злотский С.С.,
2005, 804-810. [Laikov D.N., Ustynyuk Yu.A. Russ.
Кузнецов В.В. ЖОрХ. 2019, 55, 601-607. [Raskildi-
Chem. Bull. Int. Ed. 2005, 54, 820-826.] doi 10.1007/
na G.Z., Spirikhin L.V., Zlotskij S.S., Kuznetsov V.V.
s11172-005-0329-x
Russ. J. Org. Chem. 2019, 55, 502-507.] doi 10.1134/
S1070428019040146
19. Хажиев Ш.Ю., Хусаинов М.А., Кантор Е.А. ЖОрХ.
23. Кузнецов В.В. ЖСХ. 2018, 59, 1425-1430. [Kuzne-
2011,
47,
454-456.
[Khazhiev Sh.Yu., Khusai-
tsov V.V. Russ. J. Struct. Chem. 2018, 59, 1374-1380.]
nov M.A., Kantor E.A. Russ. J. Org. Chem. 2011, 47,
doi 10.1134/S0022476618060173
450-452.] doi 10.1134/ S1070428011030225
24. Валиахметова О.Ю., Кузнецов В.В. ЖОрХ. 2021,
20. Mackenzie R.K., MacNicol D.D. J. Chem. Soc. D.
57, 29-34. [Valiakhmetova O.Yu., Kuznetsov V.V.
1970, 1299-1300. doi 10.1039/C29700001299
Russ. J. Org. Chem. 2021, 57, 20-24.] doi 10.1134/
21. Новиков В.П., Самдал С., Вилков Л.В. ЖОХ.
S1070428021010036
2004, 74, 1348-1354. [Novikov V.P., Samdal S., Vil-
25. Sheldrick G.M. Acta Crystallogr., Sect. A. 2008, 64,
kov L.V. Russ. J. Gen. Chem. 2004, 74, 1247-1253.]
112-122. doi 10.1107/S0108767307043930
doi 10.1007/s11176-005-0146-9
Structure and Conformational Analysis
of 5,5-Bis(bromomethyl)-2(4-dimethylaminophenyl)-1,3-dioxane
Sh. Yu. Khazhieva, M. A. Khusainovb, R. A. Khalikovc, V. A. Kataevc,
T. V. Tyumkinad, E. S. Mesheryakovad, L. M. Khalilovd, and V. V. Kuznetsovb, e, *
a OAO ANK Bashneft, ul. K. Marksa, 30, Ufa, 450077 Russia
b Ufa State Petroleum Technological University, ul. Kosmonavtov, 1, Ufa, 450062 Russia
c Bashkirian State Medical University, ul. Lenina, 3, Ufa, 450008 Russia
d Institute of Petrochemistry and Catalysis of Russian academy of Science, pr. Oktyabrya, 141, Ufa, 450075 Russia
e Ufa State Aviation Technical University, ul. K. Marksa, 12, Ufa, 450008 Russia
*e-mail: kuzmaggy@mail.ru
Received March 25, 2021; revised April 10, 2021; accepted April 12, 2021
The structure of 5,5-bis(bromomethyl)-2(4-dimethylaminophenyl)-1,3-dioxane - a promising reagent for fine
organic synthesis and a potential bactericidal compound - was investigated using NMR 1Н, 13С and X-ray data.
Molecules of this compound in crystalline phase and in solution have a chair form with equatorial orientation of
aromatic substituent. The rout of conformational transformations and the potential barriers of internal rotation
of aromatic and N(CH3)2 groups for isolated molecule and chloroform solution (cluster model) were established
by the computer simulation using DFT approach PBE/3ξ. A conclusion was made about relatively small (up to
four) number of solvent molecules in the nearest solvation shell of the investigated 1,3-dioxane.
Keywords: 1,3-dioxane, X-ray analysis, NMR, conformer, cluster model, computer simulation
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021