ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 8, с. 1154-1160
УДК 546.47 + 547.466.33-318 + 547.642 + 547.592.12 + 547.564.4 + 547.415.3
ВЗАИМОДЕЙСТВИЕ 2-
И 4-(АРИЛМЕТИЛИДЕНАМИНО)ФЕНОЛОВ
С МЕТИЛ-1-БРОМЦИКЛОГЕКСАНКАРБОКСИЛАТОМ
И ЦИНКОМ
© 2021 г. Е. А. Никифорова*, Д. В. Байбародских, Д. П. Зверев,
М. В. Дмитриев,
Н. Ф. Кириллов
ФГАОУ ВО «Пермский государственный национальный исследовательский университет»,
Россия, 614990 Пермь, ул. Букирева, 15
*e-mail: vikro@ya.ru
Поступила в редакцию 22.03.2021 г.
После доработки 29.03.2021 г.
Принята к публикации 31.03.2021 г.
2-(и 4-)(Арилметилиденамино)фенолы взаимодействуют с реактивом Реформатского, полученным из
метилового эфира 1-бромциклогексанкарбоновой кислоты и цинка, с образованием 3-арил-2-[2-(или
4-)гидроксифенил]-2-азаспиро[3.5]нонан-1-онов. Образование последних происходит посредством вну-
тримолекулярной циклизации первоначальных продуктов присоединения цинкорганического реагента
в результате нуклеофильной атаки атома азота на карбонильный атом углерода сложноэфирной группы.
Структура продуктов установлена методом рентгеноструктурного анализа.
Ключевые слова: реакция Реформатского, 1-бромциклоалканкарбоксилаты, 1-бромциклогексанкарбок-
силат, спирогетероциклы, азетидин-2-оны, β-лактамы, основания Шиффа, аминофенол
DOI: 10.31857/S0514749221080061
ВВЕДЕНИЕ
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Реактивы Реформатского взаимодействуют с
Как показали наши исследования, реактив
основаниями Шиффа с образованием азетиди-
Реформатского 1 присоединяется к двойной угле-
нонов [1, 2], которые обладают биологической
род-азотной связи 2-(арилметилиденамино)фено-
активностью
[3]. Карбоциклические реактивы
лов 2a-f с образованием промежуточных соедине-
Реформатского в тех же условиях образуют спиро-
ний 3a-f, которые в ходе реакции вследствие ну-
азетидиноны [4, 5]. Спироазетидиноны, в том чис-
клеофильной атаки атома азота на карбонильный
ле содержащие гидроксифенильный заместитель,
атом углерода сложноэфирной группы самопроиз-
также проявляют различные виды биологической
вольно циклизуются с выделением бромцинкмети-
активности [6, 7].
лата и образованием промежуточных соединений
4a-f, дающих после гидролиза спироазетидиноны
С целью получения новых потенциально био-
с 2-гидроксифенильными фрагментами, а именно
логически активных соединений нами было изу-
3-арил-2-(2-гидроксифенил)-2-азаспиро[3.5]но-
чено взаимодействие реактива Реформатского 1,
нан-1-оны 5a-f (схема 1).
полученного из метилового эфира 1-бромцикло-
гексанкарбоновой кислоты и цинка, с основания-
Циклизация за счет атаки фенолятного атома
ми Шиффа 2 и 6 на основе о- и п-аминофенолов,
кислорода на карбонильный атом углерода слож-
соответственно.
ноэфирной группы с образованием гетероцикли-
1154
ЗАИМОДЕЙСТВИЕ 2- И 4-(АРИЛМЕТИЛИДЕНАМИНО)ФЕНОЛОВ
1155
Схема 1
Ar
N
OH
O
OZnBr
Br
Zn
5a-f
COOMe
OMe
H2O/H+
-Zn(OH)Br
1
OH
Ar
1 (2 экв)
Ar
Ar
N
N
OZnBr
OZnBr
N
-MeOZnBr
–
COOMe
ZnBr
OMe
O
O
2a-f
3a-f
4a-f
-MeOZnBr
BrZn
H
Ar
Ar
N
N
H2O/H+
-Zn(OH)Br
O
O
O
O
4A
5A
2a-f, 3a-f, 4a-f, Ar = Ph (а), 4-FC6H4 (b), 3-ClC6H4 (c), 3-BrC6H4 (d),
4-Me2NC6H4 (e), 3,4-(OCH2O)C6H3 (f).
ческих продуктов 4A и далее 5A представляется
наличием внутримолекулярной водородной связи
маловероятной из-за большей нуклеофильности
между атомом водорода фенольной гидроксиль-
атома азота по сравнению с фенолятным атомом
ной группы и атомом кислорода карбонильной
кислорода. Продукты, образующиеся посредством
группы. В спектрах ЯМР 1Н наиболее характер-
такой циклизации, не обнаружены.
ны - синглеты протонов азетидионовых циклов в
области 4.76-4.86 м.д. и протонов гидроксильных
Образование в результате реакции продуктов
5 подтверждено данными ИК и ЯМР 1Н спектро-
групп в области 9.87-10.08 м.д.
скопии. В ИК спектрах синтезированных соедине-
Для окончательного установления структуры
ний присутствуют полосы поглощения в области
синтезированных соединений было проведено
1710-1694 см-1, принадлежащие карбонильным
рентгеноструктурное исследование соединения
группам азетидиноновых циклов, а также в обла-
5а, которое подтвердило наши выводы относи-
сти 3391-3155 см-1, принадлежащие гидроксиль-
тельно структуры данного соединения (рис. 1).
ным группам. Несколько более низкая частота по-
лос поглощения лактамных карбонильных групп
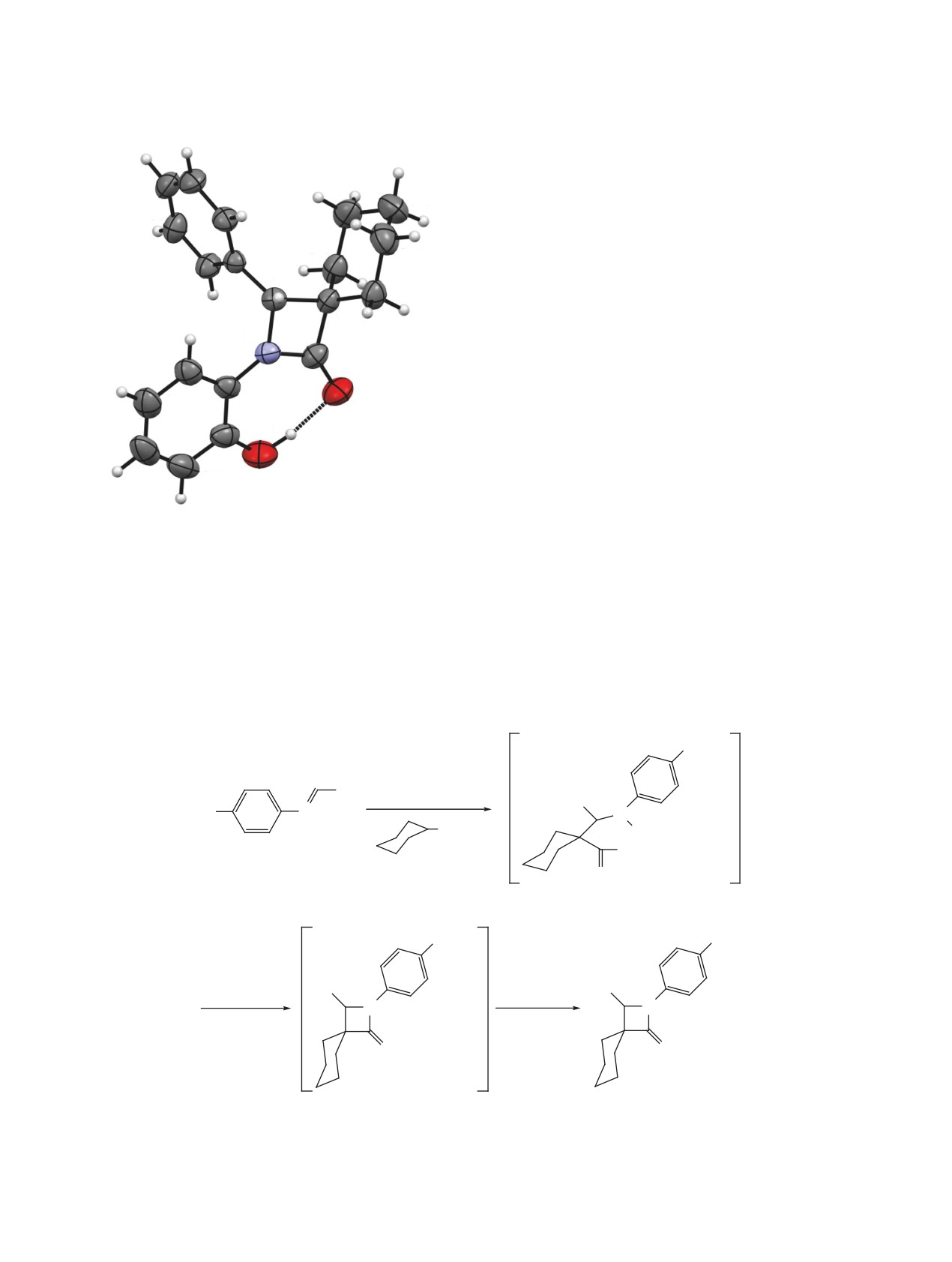
Соединение
5а кристаллизуется в центро-
по сравнению с таковой для ранее описанных
симметричной пространственной группе ром-
близких по структуре соединений [4, 5] связана с
бической сингонии. Циклогексановый цикл на-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1156
НИКИФОРОВА и др.
лекулярной водородной связи (ВВС) O1-H1∙∙∙O2 с
C7
C8
параметрами O1-H1 0.96(3), H1∙∙∙O2 1.67(3), O1∙∙∙O2
C9
C17
C18
2.621(2) Å, угол O1H1O2 170(3)°. Значимые укоро-
C6
ченные межмолекулярные контакты в кристалле
не наблюдаются.
C4
C16
C19
Подобным же образом при взаимодействии ре-
3
C
20
C5
C
активов Реформатского с 4-(арилметилиденами-
но)фенолами 6a-d через интермедиаты 7-8 идет
C2
образование спироазетидинонов с 4-гидроксифе-
1
N
C15
C1
нильными фрагментами, а именно 3-арил-2-(4-ги-
дроксифенил)-2-азаспиро[3.5]нонан-1-онов
9a-d
O2
C10
(схема 2).
C14
C11
В ИК спектрах полученных продуктов
9
O1
C13
имеются полосы поглощения в области 1711-
C12
1699 см-1, которые соответствуют карбонильной
группе β-лактамного фрагмента, и полосы погло-
щения гидроксильной группы в области 3394-
Рис. 1. Общий вид молекулы соединения 5a по дан-
3182 см-1. В спектрах ЯМР 1H присутствуют син-
ным рентгеноструктурного анализа (РСА) в тепловых
эллипсоидах 50% вероятности
глеты с химическими сдвигами 4.66-4.70 м.д., ко-
торые принадлежат протонам групп СН, и широ-
ходится в характерной конформации кресло, азе-
кие синглеты в области 5.25-5.76 м.д., принадле-
тидиноновый цикл - плоский в пределах 0.02 Å.
жащие протонам групп ОН. Частота поглощения
Гидроксифенильный заместитель развернут под
лактамных карбонильных групп в ИК спектрах и
углом 8.9° к азетидиноновому циклу, что позволяет
форма сигналов, соответствующих протонам фе-
ему участвовать в образовании прочной внутримо-
нольных гидроксильных групп, в спектрах ЯМР
Схема 2
OZnBr
Ar
1 (2 экв)
Ar
HO
N
N
-
COOMe
ZnBr
OMe
O
6a-d
7a-d
OZnBr
OH
Ar
Ar
H2O/H+
N
N
–MeOZnBr
-Zn(OH)Br
O
O
8a-d
9a-d
6a-d, 7a-d, 8a-d, 9a-d, Ar = 4-FC6H4 (a), 3-ClC6H4 (b), 4-BrC6H4 (c), 3,4-(CH3O)2C6H3 (d).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ЗАИМОДЕЙСТВИЕ 2- И 4-(АРИЛМЕТИЛИДЕНАМИНО)ФЕНОЛОВ
1157
1H объясняются существованием между данными
1
F
группами в соединениях 9 межмолекулярных во-
дородных связей.
C7
C6
5
C
Было проведено рентгеноструктурное исследо-
11
C
вание соединения 9a, структура представлена на
C8
C12
рис. 2.
C9
C4
C10
3
C
Соединение 9а кристаллизуется в центросим-
метричной пространственной группе моноклин-
C16
N1
C13
ной сингонии. Геометрия молекул соединений 9а
C17
C2
C14
и 5a весьма близка. В соединении 9а азетидиноно-
C1
C18
C15
вый цикл - плоский в пределах 0.01 Å, циклогекса-
C20
O1
новый цикл находится в конформации кресло, как
O2
C19
и в соединении 5а. п-Гидроксифенильный заме-
Рис. 2. Общий вид молекулы соединения 9a по дан-
ститель развернут под несколько большим углом
ным РСА в тепловых эллипсоидах 50% вероятности
(12.7°) к азетидиноновому циклу. Расположение
гидроксильной группы в пара-положении не по-
приближении для всех неводородных атомов с ис-
зволяет ей участвовать в образовании ВВС с кар-
пользованием программы SHELXL [10] с графи-
бонильной группой. При этом в кристалле воз-
ческим интерфейсом OLEX2 [11]. Атомы водоро-
никают межмолекулярные водородные связи O2-
да групп OH уточнены независимо в изотропном
H2∙∙∙O1 [x, 1.5-y, -0.5+z] с карбонильными груп-
приближении. При уточнении остальных атомов
пами соседних молекул: O2-H2 0.93(4), H2∙∙∙O1
водорода использована модель наездника.
1.86(4), O1∙∙∙O2 2.768(3) Å, угол O2H2O1 163(3)°.
Соединение
5a:
сингония
кристалла
Исследована анальгетическая активность сое-
(C20H21NO2, M
307.38) ромбическая, про-
динения 5a и установлено, что оно проявляет ак-
странственная группа Pbca, a
10.352(2) Å, b
тивность, превышающую таковую для препарата
16.529(4) Å, c 19.005(6) Å, V 3251.8(14) Å3, Z 8, dвыч
сравнения метамизола натрия.
1.256 г/см3, μ 0.081 мм-1. Окончательные параме-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
тры уточнения: R1 0.0533 [для 2534 отражений с
Температуры плавления измерены на прибо-
I > 2σ(I)], wR2 0.1401 (для всех 3862 независимых
ре MP-70 фирмы Mettler Toledo (Швейцария). ИК
отражений), S 1.022.
спектры синтезированных соединений сняты в ва-
Соединение
9a:
сингония
кристалла
зелиновом масле на Фурье-спектрометре Spectrum
(C20H20FNO2, M 325.37) моноклинная, простран-
Two фирмы PerkinElmer (США). Спектры ЯМР
ственная группа P21/с, a 9.965(4) Å, b 9.651(3) Å, c
1H и 13C сняты на спектрометре Bruker Avance III
17.833(7) Å, β 105.01(4)°, V 1656.5(11) Å3, Z 4, dвыч
HD 400 (Швейцария) [рабочая частота 400 (1Н) и
1.305 г/см3, μ 0.091 мм-1. Окончательные параме-
100 (13С) МГц] в CDCl3, внутренний стандарт -
тры уточнения: R1 0.0635 [для 2104 отражений с
ГМДС. Элементный анализ выполнен на анализа-
I > 2σ(I)], wR2 0.1946 (для всех 3885 независимых
торе vario MICRO cube (Германия).
отражений), S 1.061.
РСА соединений 5a и 9a выполнен на монокри-
Результаты
РСА зарегистрированы в
стальном дифрактометре Xcalibur Ruby (Agilent,
Кембриджском центре кристаллографических дан-
США) с ССD-детектором по стандартной методи-
ных под номерами CCDC 2091032 (5a), 2091036
ке (MoKα-излучение, 295(2) K, ω-сканирование с
(9a) и могут быть запрошены по адресу: www.
шагом 1°). Поглощение учтено эмпирически с ис-
ccdc.cam.ac.uk/data_request/cif
пользованием алгоритма SCALE3 ABSPACK [8].
Структуры расшифрованы с помощью программы
Исходный метиловый эфир 1-бромциклогек-
SHELXS [9] и уточнены полноматричным мето-
санкарбоновой кислоты синтезировали после-
дом наименьших квадратов по F2 в анизотропном
довательным взаимодействием циклогексанкар-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1158
НИКИФОРОВА и др.
боновой кислоты с тионилхлоридом, бромом и
161.59, 164.05 (Cаром), 172.79 (СО). Найдено, %: С
метанолом по ранее описанным методикам [12].
73.98; H 6.27; N 4.36. C20H20FNO2. Вычислено, %:
2-(4-)(Арилметилиденамино)фенолы 2 и 6 полу-
С 73.83; H 6.20; N 4.30.
чали взаимодействием о- или п-аминофенолов, со-
2-(2-Гидроксифенил)-3-(3-хлорфенил)-2-
ответственно, с ароматическими альдегидами по
азаспиро[3.5]нонан-1-он (5c). Выход 1.35 г (79%),
известной методике [13]. Все исходные соедине-
т.пл. 149-150°С. ИК спектр, ν, см-1: 3195 (OH), 1705
ния были синтезированы из коммерчески доступ-
(С=О). Спектр ЯМР 1Н, δ, м.д.: 1.14-2.14 м [10H,
ных реагентов (Acros Organics, Alfa Aesar, Sigma
(CH2)5], 4.80 с (1Н, CH), 6.41 д (1H, 2-HOC6H4, J
Aldrich, ВЕКТОН).
8.8 Гц), 6.61-6.66 м (1Hаром), 7.00-7.03 м (2Hаром),
3-Арил-2-(2-гидроксифенил)-2-азаспиро-
7.11 д (1Hаром, J 6.8 Гц), 7.24-7.27 м (1Hаром),
[3.5]нонан-1-оны 5a-f и 3-арил-2-(4-гидрокси-
7.30-7.33 м (2Hаром), 9.88 с (1H, ОH). Спектр ЯМР
фенил)-2-азаспиро[3.5]нонан-1-оны
9a-d (об-
13С, δ, м.д.: 22.28, 23.43, 25.20, 27.89, 33.67, 57.00
щая методика). Смесь 3 г измельченного в мел-
(Cциклогексан); 65.87 (СН); 117.88, 119.28, 119.77,
кую стружку цинка, каталитического количества
125.32, 126.74, 127.39, 128.89, 130.21, 135.02,
сулемы, 20 мл безводного толуола, 2 мл ГМФТА,
136.63, 148.05 (Cаром); 172.68 (СО). Найдено, %: С
2.65 г (12 ммоль) метилового эфира 1-бромцикло-
70.43; H 5.78; N 4.05. C20H20ClNO2. Вычислено, %:
гексанкарбоновой кислоты и 5 ммоль основания
С 70.27; H 5.90; N 4.10.
Шиффа (2 или 6) кипятили 4 ч, охлаждали, ги-
дролизовали 5%-ной уксусной кислотой, органи-
3-(3-Бромфенил)-2-(2-гидроксифенил)-
ческий слой отделяли, из водного слоя продукты
2-азаспиро[3.5]нонан-1-он (5d). Выход 1.43 г
реакции дважды экстрагировали этилацетатом.
(74%), т.пл. 168-170°С. ИК спектр, ν, см-1: 3155
После высушивания экстракта безводным сульфа-
(OH), 1707 (С=О). Спектр ЯМР 1Н, δ, м.д.: 1.14-
том натрия растворители отгоняли и продукт пере-
2.12 м [10H, (CH2)5], 4.79 с (1Н, CH), 6.41 д (1H,
кристаллизовывали из этилацетата.
2-HOC6H4, J 8.4 Гц), 6.60-6.66 м (1H, 2-HOC6H4),
6.99-7.05 м (2H, 2-HOC6H4), 7.15 д, 7.22 т, 7.40 с,
2-(2-Гидроксифенил)-3-фенил-2-азаспи-
7.46 д (4H, 3-BrC6H4, J 7.6 Гц), 9.87 с (1H, ОH).
ро[3.5]нонан-1-он (5a). Выход 1.21 г (79%), т.пл.
Спектр ЯМР 13С, δ, м.д.: 22.30, 23.44, 25.21, 27.93,
167-168°С. ИК спектр, ν, см-1: 3391 (OH), 1699
33.68,
57.03 (Cциклогексан),
65.81 (СН),
117.88,
(С=О). Спектр ЯМР 1Н, δ, м.д.: 1.10-2.12 м [10H,
119.29,
119.78,
123.09,
125.31,
125.76,
126.76,
(CH2)5], 4.86 с (1Н, CH), 6.43-7.38 м (9Hаром),
130.31,
130.47,
131.85,
136.89,
148.05 (Cаром),
9.98 с (1H, ОH). Спектр ЯМР 13С, δ, м.д.: 22.18,
172.68 (СО). Найдено, %: С 62.28; H 5.28; Br 20.47;
23.45, 25.27, 27.79, 33.68, 56.74 (Cциклогексан), 66.58
N 3.70. C20H20BrNO2. Вычислено, %: С 62.19; H
(СН); 118.14, 119.12, 119.64, 125.57, 126.53, 127.30,
5.22; Br 20.69; N 3.63.
128.57, 128.85, 134.27, 148.11 (Cаром), 172.97 (СО).
Найдено, %: С 78.02; H 6.95; N 4.64. C20H21NO2.
2-(2-Гидроксифенил)-3-(4-диметиламино-
Вычислено, %: С 78.15; H 6.89; N 4.56.
фенил)-2-азаспиро[3.5]нонан-1-он
(5e). Выход
1.03 г (59%), т.пл. 131-132°С. ИК спектр, ν, см-1:
2-(2-Гидроксифенил)-3-(4-фторфенил)-2-аза-
3379 (OH), 1710 (С=О). Спектр ЯМР 1Н, δ, м.д.:
спиро[3.5]нонан-1-он (5b). Выход 1.04 г (64%),
1.08-2.08 м [10H, (CH2)5], 2.95 с (6H, Me2N), 4.78 с
т.пл. 127-128°С. ИК спектр, ν, см-1: 3381 (OH),
1698 (С=О). Спектр ЯМР 1Н, δ, м.д.: 1.08-2.12
(1Н, CH), 6.49 д (1H, 2-HOC6H4, J 8.4 Гц), 6.57-6.64
м (1H, 2-HOC6H4), 6.97-7.01 м (2H, 2-HOC6H4),
м [10H, (CH2)5], 4.85 с (1Н, CH), 6.42 д (1H,
2-HOC6H4, J 8.4 Гц), 6.59-6.66 м (1H, 2-HOC6H4),
6.70 д, 7.10 д (4H, 4-Me2NC6H4, J 8.8 Гц), 10.08 с
7.00-7.02 м (2H, 2-HOC6H4), 7.05 т (2H, 4-FC6H4,
(1H, ОH). Спектр ЯМР 13С, δ, м.д.: 22.19, 23.42,
J 8.4 Гц), 7.23 д.д (2H, 4-FC6H4, J 8.4, 5.2 Гц),
25.30, 27.68, 33.51, 56.56 (Cциклогексан), 40.56 (Me),
9.92 с (1H, ОH). Спектр ЯМР 13С, δ, м.д.: 22.16,
66.54 (СН), 112.56, 118.37, 118.86, 119.57, 125.72,
23.39, 25.18, 27.75, 33.54, 56,75 (Cциклогексан), 65.84
126.26, 128.20, 148.13, 150.35 (Cаром), 173.27 (СО).
(СН), 115.83, 116.05, 118.01, 119.17, 119.67, 125.32,
Найдено, %: С 75.52; H 7.41; N 8.06. C22H26N2O2.
126.63,
128.88,
128.97,
130.00,
130.03,
148.11,
Вычислено, %: С 75.40; H 7.48; N 7.99.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ЗАИМОДЕЙСТВИЕ 2- И 4-(АРИЛМЕТИЛИДЕНАМИНО)ФЕНОЛОВ
1159
3-(Бензо[d][1,3]диоксол-5-ил)-2-(2-гидрокси-
(CH2)5], 4.68 с (1Н, CH), 5.66 уш.с (1H, ОH), 6.75 д,
фенил)-2-азаспиро[3.5]нонан-1-он
(5f). Выход
7.13 д (4H, 4-HOC6H4, J 9.0 Гц), 7.12 д, 7.48 д (4H,
1.41 г (80%), т.пл. 171-172°С. ИК спектр, ν, см-1:
4-BrC6H4, J 8.4 Гц). Спектр ЯМР 13С, δ, м.д.: 22.27,
3390 (OH), 1694 (С=О). Спектр ЯМР 1Н, δ, м.д.:
23.60, 25.27, 27.65, 33.50, 59.89 (Cциклогексан), 66.21
1.13-2.09 м [10H, (CH2)5], 4.76 с (1Н, CH), 5.95
(СН), 116.08, 118.82, 122.23, 129.04, 130.99, 131.93,
д.д (2H, ОСН2O, J 5.6, 1.6 Гц), 6.47 д, 6.70 с, 6.72
134.64, 152.62 (Cаром), 171.06 (СО). Найдено, %:
д [3H, 3,4-(ОСН2O)C6H3, J 8.0 Гц], 6.62-6.66 м
С 62.05; H 5.11; Br 20.33; N 3.56. C20H20BrNO2.
(1H, 2-HOC6H4), 6.73 д.д (1H, 2-HOC6H4, J 8.0,
Вычислено, %: С 62.19; H 5.22; Br 20.69; N 3.63.
1.6 Гц), 6.98-7.03 м (2H, 2-HOC6H4), 9.94 с (1H,
2-(4-Гидроксифенил)-3-(3,4-диметокси-
ОH). Спектр ЯМР 13С, δ, м.д.: 22.25, 23.40, 25.26,
фенил)-2-азаспиро[3.5]нонан-1-он
(9d). Выход
27.63, 33.57, 56,76 (Cциклогексан), 66.40 (СН), 101.47
1.01 г (55%), т.пл. 171-172°С. ИК спектр, ν, см-1:
(OCH2O), 107.45, 108.63, 118.10, 119.08, 119.63,
3182 (OH), 1699 (С=О). Спектр ЯМР 1Н, δ, м.д.:
120.93, 125.49, 126.52, 128.00, 147.96, 148.10,
1.00-2.05 м [10H, (CH2)5], 3.77 с (3Н, МеО), 3.85 с
148.27 (Cаром), 172.95 (СО). Найдено, %: С 71.63;
(3Н, МеО), 4.66 с (1Н, CH), 5.76 уш.с (1H, ОH), 6.72
H 5.94; N 4.07. C21H21NO4. Вычислено, %: С 71.78;
с, 6.81 д, 6.84 д [3H, 3,4-(МеО)2C6H3, J 8.4 Гц], 6.73
H 6.02; N 3.99.
д, 7.16 д (4H, 4-HOC6H4, J 8.8 Гц). Спектр ЯМР
13С, δ, м.д.: 22.30, 23.61, 25.32, 27.54, 33.47, 59.65
2-(4-Гидроксифенил)-3-(4-фторфенил)-
2-азаспиро[3.5]нонан-1-он
(9a). Выход
1.06 г
(Cциклогексан), 56.03 (МеО), 56.18 (МеО),
66.72
(65%), т.пл. 214-215°С. ИК спектр, ν, см-1: 3312
(СН), 110.61, 111.51, 115.93, 118.88, 120.07, 127.94,
131.11, 149.05, 149.22, 152.72 (Cаром), 171.51 (СО).
(OH), 1707 (С=О). Спектр ЯМР 1Н, δ, м.д.: 1.00-
Найдено, %: С 71.78; H 6.77; N 3.78. C22H25NO4.
2.09 м [10H, (CH2)5], 4.70 с (1Н, CH), 5.66 уш.с
(1H, ОH), 6.73 д, 7.16 д (4H, 4-HOC6H4, J 8.8 Гц),
Вычислено, %: С 71.91; H 6.86; N 3.81.
7.04 т (2H, 4-FC6H4, J 8.4 Гц), 7.22 д.д (2H,
ВЫВОДЫ
4-FC6H4, J 8.4, 5.2 Гц). Спектр ЯМР 13С, δ, м.д.:
Взаимодействие оснований Шиффа на основе
22.30, 23.64, 25.37, 27.73, 33.57, 59.93 (Cциклогексан),
о- и п-аминофенолов с реактивом Реформатского,
66.12 (СН), 115.67, 115.88, 115.97, 118.79, 128.93,
полученным из метилового эфира 1-бромцикло-
129.01, 131.34, 131.37, 131.55, 152.07, 161.49,
гексанкарбоновой кислоты и цинка, происходит с
163.94 (Cаром), 170.93 (СО). Найдено, %: С 73.67; H
образованием спироазетидин-2-онов, содержащих
6.29; N 4.41. C20H20FNO2. Вычислено, %: С 73.83;
гидроксифенильные заместители. Структура про-
H 6.20; N 4.30.
дуктов исследована методом РСА. Проведено ис-
2-(4-Гидроксифенил)-3-(3-хлорфенил)-2-
следование анальгетической активности соедине-
азаспиро[3.5]нонан-1-он (9b). Выход 1.20 г (70%),
ния 5а и установлено, что оно проявляет анальге-
т.пл. 173-174°С. ИК спектр, ν, см-1: 3333 (OH),
тическую активность, превосходящую активность
1711 (С=О). Спектр ЯМР 1Н, δ, м.д.: 1.00-2.10 м
препарата сравнения.
[10H, (CH2)5], 4.68 с (1Н, CH), 5.25 уш.с (1H, ОH),
ФОНДОВАЯ ПОДДЕРЖКА
6.76 д, 7.14 д (4H, 4-HOC6H4, J 8.8 Гц), 7.14 д, 7.26
Работа выполнена при финансовой поддержке
д, 7.27 т, 7.29 с (4H, 3-ClC6H4, J 8.8 Гц). Спектр
Правительства Пермского края.
ЯМР 13С, δ, м.д.: 22.29, 23.59, 25.26, 27.68, 33.54,
60.00 (Cциклогексан), 66.17 (СН), 116.11, 118.82,
КОНФЛИКТ ИНТЕРЕСОВ
125.47, 127.44, 128.53, 130.02, 130.93, 134.81,
Авторы заявляют об отсутствии конфликта ин-
137.81, 152.71 (Cаром), 171.05 (СО). Найдено, %: С
тересов.
70.41; H 5.77; N 3.98. C20H20ClNO2. Вычислено, %:
ИНФОРМАЦИЯ ОБ АВТОРАХ
С 70.27; H 5.90; N 4.10.
Никифорова Елена Александровна, ORCID:
3-(4-Бромфенил)-2-(4-гидроксифенил)-2-
азаспиро[3.5]нонан-1-он (9c). Выход 1.04 г (54%),
т.пл. 174-175°С. ИК спектр, ν, см-1: 3394 (OH), 1711
Байбародских Даниил Владимирович, ORCID:
(С=О). Спектр ЯМР 1Н, δ, м.д.: 0.98-2.09 м [10H,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1160
НИКИФОРОВА и др.
Зверев Дмитрий Павлович, ORCID: http://
Kirillov N.F. Russ. J. Org. Chem. 2007, 43, 1632-
orcid.org/0000-0002-6060-7678
1634.] doi 10.1134/S1070428007110085
6. Bari S.S., Bhalla A. Heterocyclic Scaffolds I. Topics in
Дмитриев Максим Викторович, ORCID: http://
Heterocyclic Chemistry, Berlin, Heidelberg: Springer.
orcid.org/0000-0002-8817-0543
2010, 22, 49-99. doi 10.1007/7081_2009_8
Кириллов Николай Федорович, ORCID: http://
7. Singh G.S., D’hooghe M., De Kimpe N. Tetrahedron.
orcid.org/0000-0001-6149-6829
2011, 67, 1989-2012. doi 10.1016/j.tet.2011.01.013
СПИСОК ЛИТЕРАТУРЫ
8. CrysAlisPro, Agilent Technologies, Version 1.171.37.33
1. Gilman H., Speeter M. J. Am. Chem. Soc. 1943, 65,
(release 27-03-2014 CrysAlis171.NET).
2255-2256. doi 10.1021/ja01251a503
9. Sheldrick G.M. Acta Crystallogr., Sect. A. 2008, 64,
2. Dardoize F., Moreau J.-L., Gaudemar M. C. R. Acad.
112-122. doi 10.1107/S0108767307043930
Sci., Ser. C. 1969, 268. 2228-2230.
10. Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
3. Mehta P.D., Sengar N.P.S., Pathak A.K. Eur. J.
3-8. doi 10.1107/S2053229614024218
Med. Chem.
2010,
45,
5541-5560. doi
10.1016/
11. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
j.ejmech.2010.09.035
ward J.A.K., Puschmann H. J. Appl. Crystallogr. 2009,
4. Кириллов Н.Ф., Щепин В.В. ЖОХ. 2005, 75, 629-
42, 339-341. doi 10.1107/S0021889808042726
631. [Kirillov N.F., Shchepin V.V. Russ. J. Gen. Chem.
2005, 75, 590-592.] doi 10.1007/s11176-005-0277-z
12. Beilst. 4 Autl. Bd. 9, 9.
5. Щепин В.В., Мелехин В.С., Кириллов Н.Ф. ЖОрХ.
13. Tauer E., Grellmann K.H. J. Org. Chem. 1981, 46,
2007, 43, 1637-1639. [Shchepin V.V., Melekhin V.S.,
4252-4258. doi 10.1021/jo00334a029
Reaction of 2- and 4-(Arylmethylimino)phenols
with Methyl 1-Bromocyclohexanecarboxylate and Zinc
E. A. Nikiforova*, D. V. Baibarodskikh, D. P. Zverev, M. V. Dmitriev, and N. F. Kirillov
Perm State National Research University, ul. Bukireva, 15, Perm, 614990 Russia
*e-mail: vikro@ya.ru
Received March 22, 2021; revised March 29, 2021; accepted March 31, 2021
2- and 4-(Arylmethylideneamino)phenols react with Reformatsky reagent, obtained from methyl ester of 1-bro-
mocyclohexanecarboxylic acid and zinc, to form 3-aryl-2-(2-(or 4-)hydroxyphenyl)-2-azaspiro[3.5]nonane-1-
ones. The formation of the latter occurs through the intramolecular cyclization of products of the initial addition
of the organozinc reagent as a result of the nucleophilic attack of the nitrogen atom on the carbonyl carbon atom
of the ester group. Structures of the products were confirmed by X-ray diffraction.
Keywords: Reformatsky reaction, 1-bromocycloalkanecarboxylates, 1-bromocyclohexanecarboxylate, spiro-
heterocycles, azetidin-2-ones, β-lactams, Schiff bases, aminophenol
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021