ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 8, с. 1170-1176
УДК 547.831.738
СИНТЕЗ И ПРЕВРАЩЕНИЯ БЕНЗ-ЗАМЕЩЕННЫХ
4-[2-МЕТИЛ-4-(МЕТИЛТИО)ХИНОЛИН-3-ИЛ]БУТАН-
2-ОНОВ
© 2021 г. И. Л. Алексанян*, Л. П. Амбарцумян
Ереванский государственный университет, Армения, 375025 Ереван, ул. Алека Манукяна, 1
*e-mail: ialeksanyan@ysu.am
Поступила в редакцию 10.04.2021 г.
После доработки 20.04.2021 г.
Принята к публикации 22.04.2021 г.
Осуществлен синтез новых гетарилхинолинов, содержащих тиазолидиновые и дигидротиазольные
кольца, на основе замещенных в бензольном кольце 2-{4-[2-метил-4-(метилтио)хинолин-3-ил]бутан-2-
илиден}гидразинокарботиоамидов. Изучено также взаимодействие последнего и его меркаптоаналога
с солянокислым фенилгидразином. В результате реакции в одном случае получаются замещенные в
бензольном кольце 2-метил-3-[(2-метил-1H-индол-3-ил)метил]-4-(метилтио)хинолины, а во втором слу-
чае - 4-[2-метил-4-(этилтио)хинолин-3-ил]бутан-2-оны. Последние также получены взаимодействием
4-(4-меркапто-2-метилхинолин-3-ил)бутан-2-онов с этиловым спиртом в присутствии серной кислоты.
Kлючевые слова: хинолин, тиазолидин, дигидротиазол, гидразинокарботиоамид, карбогидразид,
метилйодид, бромацетофенон, этиловый эфир бромуксусной кислоты, солянокислый фенилгидразин,
тиосемикарбазид, метилтиохинолин
DOI: 10.31857/S0514749221080085
ВВЕДЕНИЕ
тероциклических фрагментов, однин из которых -
хинолин [14], в настоящей работе синтезированы
За последнее десятилетие гетероциклические
новые производные тиазолидиновых, дигидроти-
соединения серы и азота привлекают все большее
азолиновых и индолилзамещенных хинолинов на
внимание, так как входят в состав лекарственных
базе замещенных в бензольном кольце 2-{4-[2-ме-
препаратов и алкалоидов [1-3]. Среди таких серо-
тил-4-(метилтио)хинолин-3-ил]бутан-2-илиден}-
азотсодержащих гетероциклов производные хи-
нолина представляют собой важный класс соеди-
гидразинокарботиоамидов 3а-с. Для синтеза ос-
нений, обладающих разнообразными видами био-
новных исходных соединений проведена реакция
логической активности. Эти соединения обладают
4-(4-меркато-2-метилхинолин-3-ил)бутан-2-онов
противомалярийными [4, 5], противоопухолевыми
1а-с с метилйодидом при перемешивании в тече-
[6, 7], антибактериальными [8, 9], антигельминт-
ние 1 дня при комнатной температуре в этаноле в
ными [10], противовирусными [11, 12], противо-
присутствии этилата натрия в соотношении 1:1.2,
грибковыми [9], противовоспалительными [13],
которая приводит к получению замещенных в
анальгетическими, кардиотоническими свойства-
бензольном кольце 4-[2-метил-4-(метилтио)хино-
ми, улучшают репродуктивную функцию и др.
лин-3-ил]бутан-2-онов 2а-с.
[14].
Взаимодействие полученных бутанонов 2а-с
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
с тиосемикарбазидом при кипячении в среде эта-
Принимая во внимание высокий фармакологи-
нола в соотношении 1:1 почти с количественным
ческий потенциал соединений, состоящих из 2 ге-
выходом приводит к получению соответствующих
1170
СИНТЕЗ И ПРЕВР
АЩЕНИЯ БЕНЗ-ЗАМЕЩЕННЫХ
1171
Схема 1
SH
O
SCH3
O
CH3I
CH3
CH3
R
R
N CH3
N CH3
1a-c
2a-c
H
S
N NH
2
SCH3
N
H2N
NHNH2
S
CH3
R
N CH3
3a-c
R = H (a), 6-CH3 (b), 6-Br (c).
тиосемикарбазонов 3а-с в виде син- и анти-изо-
реакции образуются замещенные в бензольном
меров в соотношении 1:3 (схема 1).
кольце
2-метил-3-[(2-метил-1H-индол-3-ил)ме-
тил]-4-(метилтио)хинолины 6а-с (схема 3).
Соединения 3a-с конденсируются с этиловым
эфиром монобромуксусной кислоты и бромацето-
Описанная реакция изучена также в ряду
феноном в присутствии ацетата натрия при кипя-
меркаптоаналогов
1а-c исходных бутанонов.
чении в среде этанола с замыканием 4-тиазолиди-
Интересно, что в этом случае индолилхинолины не
нонового и 2-фенилтиазолидинонового циклов и
образуются. Реакция протекает по этилированию
образованием хинолилзамещенных тиазолидино-
меркаптогруппы и приводит к образованию соот-
нов 4а-с и тиазолидинов 5а-с (схема 2).
ветствующих этилтиопроизводных 7а-с, которые,
С учетом функциональных возможностей по-
по всей вероятности, не подвергаются дальней-
лученных 4-[2-метил-4-(метилтио)хинолин-3-ил]-
шей индолизации. Чтобы доказать, что происхо-
бутан-2-онов и с целью получения новых индолил-
дит только алкилирование меркаптогруппы, нами
хинолинов изучена реакция бутанонов с соляно-
была проведена реакция меркаптобутанонов 1а-c
кислым фенилгидразином в присутствии серной
с этанолом в присутствии серной кислоты. Как и
кислоты в этаноле. Установлено, что в результате
ожидалось, реакция приводит к получению одних
Схема 2
SCH3
CH3
Br COOC2H5
N
N
NH
R
O
S
N CH3
4a-c
3a-c
O
SCH3
CH3
CH2Br
N
N
NH
R
S
N CH3
5a-c
R = H (a), 6-CH3 (b), 6-Br (c).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1172
АЛЕКСАНЯН, АМБАРЦУМЯН
Схема 3
SCH3
2a-c
NH
R
CH3
N CH3
6a-c
R = H (a), 6-CH3 (b), 6-Br (c).
и тех же 4-[2-метил-4-(этилтио)хинолин-3-ил]бу-
толуол, 1:3). Найдено, %: С 69.70; Н 6.48; N 5.26; S
тан-2-онов 7а-с (схема 4).
12.20. C15H17NOS. Вычислено, %: С 69.50; Н 6.56;
N 5.40; S 12.36.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
4-[2,6-Диметил-4-(метилтио)хинолин-3-ил]-
Спектры ЯМР 1Н регистрировали на приборе
бутан-2-он (2b). Получен из 2.59 г соединения 1b.
Varian Mercury-300 (Германия) в ДМСО-d6-ССl4
Выход 2.32 г (85%), т.пл. 117-118°С, Rf 0.66 (эта-
(1:3). Ход реакции и чистоту полученных соеди-
нол-толуол, 1:3). Найдено, %: С 70.48; Н 6.73; N
нений контролировали методом ТСХ на пластинах
5.11; S 11.54. C16H19NOS. Вычислено, %: С 70.33;
AlUGRAM® XtraSIL G UV254 (Германия) (проя-
Н 6.96; N 5.13; S 11.72.
витель - пары йода). Все реакции были проведе-
ны в свежеперегнанных растворителях, а реакти-
4-[6-Бром-2-метил-4-(метилтио)хинолин-
вы приобретены через Merck KGaA (Дармштадт,
3-ил]бутан-2-он (2с). Получен из 3.24 г соеди-
Германия) и/или филиалы.
нения 1c. Выход 3.04 г (90%), т.пл. 115-116°С,
Rf 0.61 (этанол-толуол, 1:3). Спектр ЯМР 1Н, δ,
Замещенные в бензольном кольце 4-[2-ме-
м.д.: 2.04 с (3H, O=C-CH3), 2.45 с (3H, N=C-CH3),
тил-4-(метилтио)хинолин-3-ил]бутан-2-оны
2.51 м (2H, CH2), 2.70 с (3H, SCH3), 3.36-3.42 м
2a-с (общая методика). K алкоголяту натрия,
полученному из 0.23 г (10 ммоль) натрия и 40 мл
(2H, CH2), 7.78-7.82 м (2Hаром), 7.74 д (1Hаром, J
абсолютного этилового спирта, прибавляли
2.2 Гц). Найдено, %: С 53.41; Н 4.61; N 4.02; S 9.52;
10 ммоль соединения 1а-с [15] и перемешивали
Br 23.48. C15H16NBrOS. Вычислено, %: С 53.25; Н
0.5 ч, затем прибавляли 0.76 мл (1.7 г, 12 ммоль)
4.73; N 4.14; S 9.47; Br 23.67.
йодистого метила и при комнатной температу-
Замещенные в бензольном кольце 2-{4-[2-ме-
ре перемешивали 1 сут, затем нагревали 15 мин.
тил-4-(метилтио)хинолин-3-ил]бутан-2-или-
После охлаждения прибавляли воду, полученные
ден}гидразинокарботиоамиды
3a-с получали
осадки отфильтровывали и перекристаллизовыва-
аналогично методике [16]. Смесь 5 ммоль соеди-
ли из смеси этанол-вода.
нения 2а-с, 20 мл этанола и 0.455 г (5 ммоль) тио-
4-[2-Метил-4-(метилтио)хинолин-3-ил]бу-
семикарбазида кипятили 3 ч при перемешивании.
тан-2-он (2a). Получен из 2.45 г соединения 1a.
После охлаждения полученный осадок отфильтро-
Выход 2.30 г (89%), т.пл. 92-93°С, Rf 0.67 (этанол-
вывали и промывали этанолом.
Схема 4
SCH2CH3
O
a.
HCl
NHNH2
1a-c
CH3
б. C2H5OH/H2SO4
R
N CH3
7a-c
R = H (a), 6-CH3 (b), 6-Br (c).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
СИНТЕЗ И ПРЕВР
АЩЕНИЯ БЕНЗ-ЗАМЕЩЕННЫХ
1173
2-{4-[2-Метил-4-(метилтио)хинолин-3-ил]-
4-он (4b). Получен из 0.35 г соединения 3b. Выход
бутан-2-илиден}гидразинокарботиоамид
(3a).
0.38 г (98%), т.пл. 247-248°С, Rf 0.57 (этанол-
Получен из 1.30 г соединения 2a. Выход 1.49 г
толуол, 1:3). Спектр ЯМР 1Н, δ, м.д.: 2.06 с (3H,
(90%), т.пл. 186-187°С, Rf 0.60 (этанол-толуол,
CH3), 2.40 с (3H, CH3), 2.51 с (3H, CH3), 2.54-2.67
1:3). Спектр ЯМР 1Н, δ, м.д. (смесь двух син- и
м (2H, CH2), 2.73 с (3H, SCH3), 3.31-3.45 м (2H,
анти-изомеров, 1:3): 2.03 и 2.08 с (2.25H и 0.75H,
CH2), 3.69 с (2H, SCH2), 7.53 д.д (1Hаром, J 8.5,
CH3), 2.40-2.47 м (2H, CH2), 2.49 и 2.54 с (2.25H и
1.9 Гц), 7.82 д (1Hаром, J 8.5 Гц), 8.14 с (1Hаром),
0.75H, CH3), 2.68 с (3H, S-CH3), 2.72-2.81 и 2.87-
11.57 с (1H, NH). Найдено, %: С 59.17; Н 5.89; N
2.96 м (0.5H и 1.5H, CH2), 7.07-7.18 м (1Hаром),
14.69; S 16.72. C19H22N4OS2. Вычислено, %: С
7.26-7.40 м (3H, 2Hаром и NH2), 7.61-7.72 м
59.06; Н 5.70; N 14.51; S 16.58.
(1Hаром), 7.83 м (1H, NH2), 11.60 и 12.15 с (0.75H и
2-{{4-[6-Бром-2-метил-4-(метилтио)хино-
0.25H, NH). Найдено, %: С 57.71; Н 5.87; N 16.68;
лин-3-ил]бутан-2-илиден}гидразино}тиазоли-
S 19.42. C16H20N4S2. Вычислено, %: С 57.83; Н
дин-4-он (4с). Получен из 0.411 г соединения 3c.
6.02; N 16.87; S 19.28.
0.58 (эта-
Выход 0.42 г (94%), т.пл. 261-262°С, Rf
2-{4-[2,6-Диметил-4-(метилтио)хинолин-
нол-толуол, 1:3). Спектр ЯМР 1Н, δ, м.д.: 2.08 с
3-ил]бутан-2-илиден}гидразинокарботиоамид
(3H, CH3), 2.40 с (3H, CH3), 2.50 д.т (2H, CH2, J
(3b). Получен из 1.37 г соединения 2b. Выход
3.7, 1.8 Гц), 2.69-2.79 м (5H, CH2CH3), 3.65 с
1.61 г (93%), т.пл. 223-224°С, Rf 0.59 (этанол-то-
(2H, SCH2), 7.79-7.86 м (2Hаром), 8.50 д (1Hаром, J
луол, 1:3). Найдено, %: С 57.71; Н 5.87; N 16.68; S
2.1 Гц), 11.52 с (1H, NH). Найдено, %: С 47.76; Н
19.42. C17H22N4S2. Вычислено, %: С 58.96; Н 6.36;
4.37; N 12.29; S 14.02. C18H19N4OS2Br. Вычислено,
N 16.18; S 18.50.
%: С 47.89; Н 4.21; N 12.42; S 14.19.
2-{4-[6-Бром-2-метил-4-(метилтио)хинолин-
Замещенные в бензольном кольце 2-{[4-[2-ме-
3-ил]бутан-2-илиден}гидразинокарботиоамид
тил-4-(метилтио)хинолин-3-ил]бутан-2-или-
(3с). Получен из 1.69 г соединения 2c. Выход
ден]гидразино}-4-фенил-2,3-дигидротиазолы
1.80 г (88%), т.пл. 226-227°С, Rf 0.58 (этанол-то-
5a-с получали аналогично методике [16]. Смесь
луол, 1:3). Найдено, %: С 57.71; Н 5.87; N 16.68;
1 ммоль соединения 3а-с, 10 мл абсолютного эта-
Br 22.16; S 19.42. C16H19N4BrS2. Вычислено, %: С
нола, 0.246 г (3 ммоль) безводного ацетата натрия
46.72; Н 4.62; N 13.62; Br 19.46; S 15.57.
и 0.199 г (1 ммоль) бромацетофенона кипятили
Замещенные в бензольном кольце
2-{{4-
6-7 ч при перемешивании. После охлаждения по-
[2-метил-4-(метилтио)хинолин-3-ил]бутан-2-
лученные осадки отфильтровывали, промывали
илиден}гидразино}тиазолидин-4-оны 4a-с по-
этанолом и сушили.
лучали аналогично методике [16]. Смесь 1 ммоль
соединения 3а-с, 10 мл абсолютного этанола,
2-{[4-[2-Метил-4-(метилтио)хинолин-3-ил]-
0.246 г (3 ммоль) безводного ацетата натрия и
бутан-2-илиден]гидразино}-4-фенил-2,3-диги-
0.22 г (0.15 мл, 1.3 моль) этилового эфира бро-
дротиазол (5a). Получен из 0.33 г соединения 3a.
муксусной кислоты кипятили 4-5 ч при переме-
Выход 0.38 г (89%), т.пл. 91-92°C, Rf 0.65 (этанол-
шивании. После охлаждения полученные осадки
ксилол, 1:3). Найдено, %: С 66.84; Н 5.36; N 12.79;
отфильтровывали, промывали этанолом и сушили.
S 14.98. C24H24N4S2. Вычислено, %: С 66.67; Н
5.56; N 12.96; S 14.81.
2-{{4-[2-Метил-4-(метилтио)хинолин-3-ил]-
бутан-2-илиден}гидразино}тиазолидин-4-он
2-{[4-[2,6-Диметил-4-(метилтио)хинолин-
(4a). Получен из 0.33 г соединения 3a. Выход
3-ил]бутан-2-илиден]гидразино}-4-фенил-
0.34 г (91%), т.пл.188-189°С, Rf 0.59 (этанол-то-
2,3-дигидротиазол (5b). Получен из 0.35 г со-
луол, 1:3). Найдено, %: С 58.18; Н 5.51; N 15.23;
единения 3b. Выход 0.43 г (97%), т.пл. 86-87°C, Rf
S 17.38. C18H20N4OS2. Вычислено, %: С 58.06; Н
0.64 (этанол-ксилол, 1:3). Спектр ЯМР 1Н, δ, м.д.:
5.38; N 15.05; S 17.20.
2.05 с (3H, CH3), 2.45 с (3H, CH3), 2.54 с (3H, CH3),
2-{{4-[2,6-Диметил-4-(метилтио)хинолин-
2.61-2.69 м (2H, CH2), 2.80 с (2H, SCH3), 3.40-3.48
3-ил]бутан-2-или-ден}гидразино}тиазолидин-
м (2H, CH2), 7.40 с (1H, =CHS), 7.47 т.т (1Hаром,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1174
АЛЕКСАНЯН, АМБАРЦУМЯН
пара-C6H5 J 7.3, 2.1 Гц), 7.51-7.54 м (2Hаром,
2,6-Диметил-3-[(2-метил-1H-индол-3-ил)-
мета-C6H5),
7.80-7.87 м
(2Hаром, орто-C6H5),
метил]-4-(метилтио)хинолин (6b). Получен из
7.89 д.д (1Hаром, J 8.8, 2.2 Гц), 7.96 д (1Hаром, J
0.27 г соединения 2b. Выход 0.33 г (95%), т.пл.
8.8 Гц), 8.50 д (1Hаром, J 2.2 Гц), 11.78 уш.с (1H,
225-226°C, Rf 0.69 (этанол-ксилол, 1:3). Спектр
NH), 7.15-7.24 м (3Hаром), 7.29-7.36 м (2Hаром),
ЯМР 1Н, δ, м.д.: 2.16 с (3H, CH3), 2.35 с (3H, CH3),
7.40 и 7.47 уш.с (0.75H и 0.25Hаром), 7.76-7.82 м
2.48 с (3H, CH3), 2.56 с (3H, CH3), 4.64 с (2H, CH2),
(2Hаром), 10.46 и 11.29 уш.с (0.75H и 0.25H, OH),
6.68-6.74 м (1Hаром), 6.79-6.94 м (1Hаром), 7.20 д
11.46 и 12.05 уш.с (0.75H и 0.25H, NH). Найдено,
(1Hаром, J 8.0 Гц), 7.51-7.58 м (1Hаром), 7.83 д.д
%: С 67.15; Н 5.97; N 12.29; S 14.12. C25H26N4S2.
(1Hаром, J 8.5, 2.6 Гц), 8.25 с (1Hаром), 10.76 уш.с
(1H, NH). Найдено, %: С 76.46; Н 6.25; N 8.21; S
Вычислено, %: С 67.26; Н 5.83; N 12.56; S 14.35.
S. Вычислено, %: С 76.30; Н 6.36; N
9.08. C22H22N2
2-{[4-[6-Бром-2-метил-4-(метилтио)хинолин-
8.09; S 9.25.
3-ил]бутан-2-илиден]гидразино}-4-фенил-
6-Бром-2-метил-3-[(2-метил-1H-индол-3-ил)-
2,3-дигидротиазол (5с). Получен из 0.411 г со-
метил]-4-(метилтио)хинолин (6с). Получен из
единения 3c. Выход 0.47 г (92%), т.пл. 95-96°C, Rf
0.34 г соединения 2c. Выход 0.38 г (92%), т.пл.
0.69 (этанол-ксилол, 1:3). Спектр ЯМР 1Н, δ, м.д.:
195-196°C, Rf 0.63 (этанол-ксилол, 1:3). Найдено,
2.04 с (3H, CH3), 2.42 с (3H, CH3), 2.51-2.58 м (2H,
%: С 61.47; Н 4.47; N 6.93; S 7.65. C21H19N2SBr.
CH2), 2.75 с (2H, SCH3), 3.36-3.42 м (2H, CH2), 7.22
Вычислено, %: С 61.31; Н 4.62; N 6.81; S 7.79.
с (1H, =CHS), 7.28 т.т (1Hаром, пара-C6H5, J 7.3,
2.1 Гц), 7.36-7.42 м (2Hаром, мета-C6H5), 7.81-
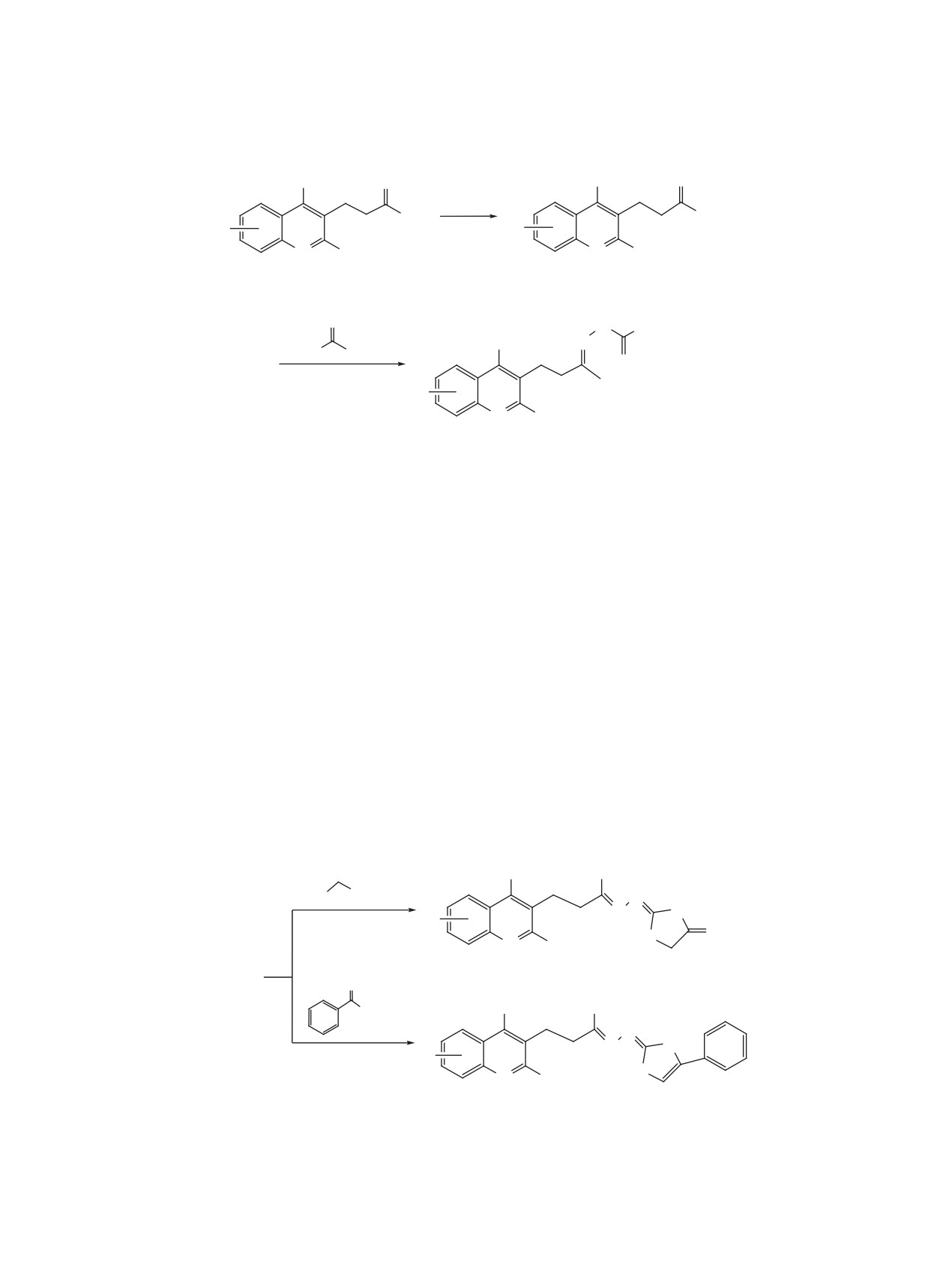
Замещенные в бензольном кольце 4-[2-ме-
7.88 м (2Hаром, орто-C6H5), 7.84 д.д (1Hаром, J 8.8,
тил-4-(этилтилтио)хинолин-3-ил]бутан-2-оны
2.2 Гц), 7.90 д (1Hаром, J 8.8 Гц), 8.52 д (1Hаром,
7a-с. а. Смесь 1 ммоль соединения 1а-с, 8 мл эта-
J 2.2 Гц), 10.78 уш.с (1H, NH), Спектр ЯМР 13C,
нола, 0.1 мл конц. H2SO4 и 0.19 г (13 ммоль) соля-
δ, м.д.: 16.8 (CH3), 19.6 (CH3), 24.0 (CH3), 28.3
нокислого фенилгидразина кипятили 12-14 ч при
(CH2), 38.0 (CH2), 103.4 (CH), 119.9, 125.4 (2, CH),
перемешивании. После охлаждения разбавляли
127.3 (CH), 127.7 (CH), 128.5 (2, CH), 129.0, 131.4
водой, кислый раствор фильтровали и подщелачи-
(CH), 131.8 (CH), 134.9, 139.1, 141.3, 144.8, 150.8,
вали (pH 7.1-7.5). Полученные осадки отфильтро-
158.9, 170.0. Найдено, %: С 56.51; Н 4.37; N 10.79;
вывали, промывали водой, перекристаллизовыва-
S 12.78. C24H23N4S2Br. Вычислено, %: С 56.36; Н
ли из смеси спирт-вода и сушили.
4.50; N 10.96; S 12.52.
б. Смесь 1 ммоль соединения 1а-с, 8 мл этанола
Замещенные в бензольном кольце 2-метил-
и 0.1 мл конц. H2SO4 кипятили 12-14 ч при пере-
3-[(2-метил-1H-индол-3-ил)метил]-4-(метил-
мешивании. После охлаждения разбавляли водой,
тио)хинолины 6a-с. Смесь 1 ммоль соединения
кислый раствор фильтровали и подщелачивали
2а-с, 8 мл этанола, 0.1 мл конц. H2SO4 и 0.19 г
(pH 7.1-7.5). Полученные осадки отфильтровыва-
ли, промывали водой, перекристаллизовывали из
(13 ммоль) солянокислого фенилгидразина кипя-
смеси спирт-вода и сушили. Полученные по ме-
тили 12-14 ч при перемешивании. После охлаж-
тодикам а и б образцы соединения 7а, b не давали
дения разбавляли водой, кислый раствор фильтро-
депресии температуры плавления.
вали и подщелачивали (pH 7.1-7.5). Полученные
осадки отфильтровывали, промывали водой, пере-
4-[2-Метил-4-(этилтилтио)хинолин-3-ил]-
кристаллизовывали из смеси спирт-вода и суши-
бутан-2-он (7a). Получен из 0.25 г соединения
ли.
1a. Выход (а) 0.22 г (82%), (б) 0.21 г (80%), т.пл.
83-84°C, Rf 0.54 (этанол-ксилол, 1:3). Найдено,
2-Метил-3-[(2-метил-1H-индол-3-ил)метил]-
%: С 70.46; Н 6.87; N 5.29; S 11.58. C16H19NOS.
4-(метилтио)хинолин (6a). Получен из 0.26 г со-
Вычислено, %: С 70.33; Н 6.96; N 5.13; S 11.72.
единения 2a. Выход 0.30 г (90%), т.пл. 178-179°C,
Rf 0.56 (этанол-ксилол, 1:2). Найдено, %: С 75.76;
4-[2,6-Диметил-4-(этилтилтио)хинолин-
Н 6.17; N 8.29; S 9.77. C21H20N2S. Вычислено, %:
3-ил]бутан-2-он (7b). Получен из 0.26 г соедине-
С 75.90; Н 6.02; N 8.43; S 9.64.
ния 1b. Выход (а) 0.24 г (84%), (б) 0.26 г (92%),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
СИНТЕЗ И ПРЕВР
АЩЕНИЯ БЕНЗ-ЗАМЕЩЕННЫХ
1175
т.пл.
112-113°C, Rf
0.63 (этанол-ксилол,
1:2).
ИНФОРМАЦИЯ ОБ АВТОРАХ
Спектр ЯМР 1Н, δ, м.д.: 1.03 т (3H, SCH2CH3, J
Алексанян Искуи Левоновна, ORCID: http://
7.0 Гц), 1.75 с (3H, CH3), 2.07 д.д.д (1H, CH2, J
orcid.org/0000-0002-4039-2323
13.6, 11.8, 5.7 Гц), 2.27-2.47 м (1H, CH2), 2.50 с
(3H, CH3), 2.58 с (3H, CH3), 2.91-3.07 м (2H, CH2),
Амбарцумян Лилит Папиновна, ORCID: http://
3.55-3.76 м (2H, SCH2CH3), 7.50 д.д (1Hаром, J 8.5,
orcid.org/0000-0003-1210-0052
1.7 Гц), 7.65-7.83 м (2Hаром), Спектр ЯМР 13C, δ,
СПИСОК ЛИТЕРАТУРЫ
м.д.: 15.1; 21.2; 22.7; 23.3; 26.6; 35.8; 38.7; 58.0;
83.6; 121.1; 124.0; 124.1; 128.5; 130.5; 134.8; 138.0;
1.
Bayat M., Safari F., Nasri Sh., Hosseini F.S. Monatsh
Chem. 2019, 150, 703-710. doi 10.1007/s00706-018-
143.1; 156.2. Найдено, %: С 71.67; Н 7.47; N 4.73; S
2337-1
11.29. C17H21NOS. Вычислено, %: С 71.80; Н 7.32;
N 4.88; S 11.15.
2.
Kerru N., Gummidi L., Maddila S., Gangu K.K.,
Jonnalagadda S.B. Molecules. 2020, 25, 1909. doi
4-[6-Бром-2-метил-4-(этилтилтио)хинолин-
10.3390/molecules25081909
3-ил]бутан-2-он (7с). Получен из 0.32 г соедине-
3.
Mekheimer R.A., Al-Sheikh M.A., Medrasib H.Y.,
ния 1c. Выход (а) 0.28 г (79%), (б) 0.31 г (88%), т.пл.
Sadek K.U. RSC Adv. 2020, 10, 19867-19935. doi
141-142°C, Rf 0.57 (этанол-ксилол, 1:3). Найдено,
10.1039/D0RA02786C
%: С 54.71; Н 5.27; N 3.83; S 9.21. C16H18NOSBr.
4.
Pandeya S., Agarwalb P., Srivastavab S., Kumarb S.R.,
Вычислено, %: С 54.54; Н 5.11; N 3.98; S 9.09.
Purib S.K., Vermac P., Saxenac J.K., Sharmad A.,
Lald J., Chauhana P. J. Med. Chem. 2013, 66, 69-81.
ВЫВОДЫ
doi 10.1016/j.ejmech.2013.05.023
Разработаны способы получения замещенных
5.
Kumar S., Bawa S., Drabu S., Panda B.P. Med. Chem.
в бензольном кольце 2-{{4-[2-метил-4-(метилтио)-
Res. 2011, 20, 1340-1348. doi 10.1007/s00044-010-
хинолин-3-ил]бутан-2-илиден}гидразинo}тиазо-
9463-6
лидин-4-ионов и 2-{[4-[2-метил-4-(метилтио)хи-
6.
Akhtar J., Khan A.A., Ali Z., Haider R., Shahar M.Y.
нолин-3-ил]бутан-2-илиден]гидразино}-4-фе-
Eur. J. Med. Chem. 2017, 125, 143-189. doi 10.1016/
j.ejmech.2016.09.023
нил-2,3-дигидротиазолoв, на основе гетероцикли-
зации замещенных в бензольном кольце 2-{4-[2-ме-
7.
Dorababu A. ChemistrySelect. 2020, 5, 13902-13915.
тил-4-(метилтио)хинолин-3-ил]бутан-2-илиден}-
doi 10.1002/slct.202003888
гидразинкарботиоамидов с этиловым эфиром бро-
8.
Zeleke D., Eswaramoorthy R., Belay Z., Melaku Y.
муксусной кислоты и бромацетофеноном.
J. Chem. 2020, ID 1324096, 1-16. doi 10.1155/
2020/1324096
Установлено, что взаимодействие замещенных
9.
Bazine I., Bendjedid S., Boukhari A. Arch. Pharm.
в бензольном кольце 2-{4-[2-метил-4-(метилтио)-
2020, e2000291, 1-14. doi 10.1002/ardp.202000291
хинолин-3-ил]бутан-2-илиден}гидразинокарбо-
10.
Rossiter S., Peron S.J., Whitfield P.J., Jones K. Bioorg.
тиоамидов и его меркаптоаналога с солянокис-
Med. Chem. Lett. 2005, 15, 4806-4808. doi 10.1016/
лым фенилгидразином в первом случае приводит
j.bmcl.2005.07.044
к получению замещенных в бензольном кольце
11.
de la Guardia C., Stephens D.E., Dang H.T., Quija-
2-метил-3-[(2-метил-1H-индол-3-ил)метил]-4-(ме-
da M., Larionov O.V., Lleonart R. Molecules. 2018, 23,
тилтио)хинолинов, а во втором случае - 4-[2-ме
672. doi 10.3390/molecules23030672
тил-4-(этилтио)хинолин-3-ил]бутан-2-онов. Пос-
12.
Zemtsova M.N., Zimichev A.V., Trakhtenberg P.L.
ледние также получены взаимодействием 4-(4-
Klimochkin Yu.N., Leonova M.V., Balakhnin S.M.,
меркапто-2-метилхинолин-3-ил)бутан-2-онов
с
Bormotov N.I., Serova O.A., Belanov E.F. Pharm
этиловым спиртом в присутствии серной кислоты.
Chem. J. 2011, 45, 267-269. doi 10.1007/s11094-011-
0613-z
КОНФЛИКТ ИНТЕРЕСОВ
13.
Douadi K., Chafaa S., Douadi T., Al-Noaimi M., Kaa-
Авторы заявляют об отсутствии конфликта ин-
bi I. J. Mol. Struct. 2020, 1217, 128305. doi 10.1016/
тересов.
j.molstruc.2020.128305
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1176
АЛЕКСАНЯН, АМБАРЦУМЯН
14. Pathak A.D., Singh D. Int. J. Pharm. Sci. Res. 2016, 7,
16. Алексаняан И.Л., Амбарцуян Л.П. ЖОрХ. 2015,
1. doi 10.13040/IJPSR.0975-8232.7
51, 1062-1065. [Aleksanyan I.L., Ambartsumyan L.P.
15. Гюльбудагян Л.В., Ван Нгок Хыонг, Дургарян В.Г.
Russ. J. Org. Chem. 2015, 51, 1046-1049.] doi 10.1134/
Арм. хим. ж. 1976, ХХIХ, 629-631.
S1070428015070301
Preparation and Conversetion of Benz-Substituted
4-[2-methyl-4-(methylthio)quinolin-3-yl]butan-2-ones
I. L. Aleqsanyan* and L. P. Hambardzumyan
Yerevan State Uniwesity, ul. Aleka Manukyana, 1, Yerevan, 375025 Armenia
*e-mail: ialeksanyan@ysu.am
Received April 10, 2021; revised April 20, 2021; accepted April 22, 2021
Synthesis of new hetarylquinolines containing thiazolidine and dihydrothiazole rings based on substituted in
the benzene ring 2-{4-[2-methyl-4-(methylthio)quinolin-3-yl]butan-2-ylidene}-hydrazinocarbothioamides. The
interaction of the latter and its mercapto analogue with phenylhydrazine hydrochloric acid was also studied. In
the first case, as a result of the reaction substituted in the benzene 2-methyl-3-[(2-methyl-1H-indol-3-yl)me-
thyl]-4-(methylthio)quinolines ring are obtained, and in the second case 4-[2-methyl-4-(ethylthio)quinolin-3-yl]-
butan-2-ones. The latter are also obtained by the interaction of 4-(4-mercapto-2-methyl-quinolin-3-yl) butan-
2-ones with ethyl alcohol in the presence of sulfuric acid.
Keywords: quinoline, thiazolidine, dihydrothiazole, hydrazinocarbothioamide, carbohydrazide, methyl iodide,
bromoacetophenone, ethyl bromoacetic acid, phenylhydrazine hydrochloric acid, thiosemicarbazide, methyl-
thioquinol
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021