ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 8, с. 1185-1192
УДК 547.569.1
ЭЛЕКТРОСИНТЕЗ гем-БИСТИОЕНАМИНОВ
ИЗ ВИНИЛАЗИДОВ И ТИОЛОВ
© 2021 г. О. М. Мулинаa, *, М. М. Доронинa, В. А. Костягинаb, Г. П. Тимофеевc
a ФГБУН Институт органической химии им. Н.Д. Зелинского Российской академии наук,
Россия, 119991 Москва, Ленинский просп., 47
b ФГБОУ ВО «Российский химико-технологический университет им. Д.И. Менделеева»,
Россия, 125047 Москва, Миусская пл., 9
c ФГБОУ ВО «Юго-Западный государственный университет», Россия, 305040 Курск, ул. 50 лет Октября, 94
*e-mail: mulya@ioc.ac.ru
Поступила в редакцию 30.03.2021 г.
После доработки 11.04.2021 г.
Принята к публикации 12.04.2021 г.
Осуществлен электросинтез гем-бистиоенаминов из винилазидов и тиолов; процесс проводят в неразде-
ленной электрохимической ячейке с использованием платиновых электродов в растворе ДМСО-MeCN
при плотности тока 20 мА/см2. Иодид аммония выступает в качестве фонового электролита и редокс
катализатора. Выходы продуктов находятся в диапазоне 32-58%.
Ключевые слова: окисление, электросинтез, енамины, винилазиды, тиолы
DOI: 10.31857/S0514749221080103
ВВЕДЕНИЕ
циклизацию [14, 15] или отщеплять атом водоро-
да от других соединений [16-18]. Ранее было по-
Тетразамещенные двойные связи - важный
казано, что присоединение тиильных радикалов,
структурный фрагмент в органической химии,
генерирующихся из тиолов в аэробных условиях,
присутствующий во множестве природных ве-
к винилазидам приводит к образованию смеси
ществ [1, 2] и лекарственных препаратов [3, 4].
тио-замещенных иминов и енаминов, которые при
Однако по причине их стерической загруженно-
хроматографии на силикагеле гидролизуются в со-
сти, универсальные методы синтеза соединений с
ответствующие кетоны [19]. В настоящей работе
тетразамещенными двойными связями ограничен-
обнаружено, что взаимодействие винилазидов и
ны. Особое место среди таких структур занимают
тиолов в электрохимических условиях с использо-
гем-бисзамещенные алкены [5]: они - удобные
ванием иодида аммония в качестве фонового элек-
билдинг-блоки в синтезе полиненасыщенных со-
тролита и редокс катализатора позволяет получать
единений [6], гетероциклов [7], функционализи-
гем-бистиолированные енамины, содержащие в
рованных карбоновых кислот [8] и других ценных
своей структуре одновременно тетразамещенную
веществ [9, 10].
двойную связь и N-незамещенный енаминовый
Винилазиды - уникальные соединения по своей
фрагмент (схема 1). Процесс протекает в гальва-
реакционной способности [11]. В частности, по-
ностатическом режиме в конструктивно простой
сле присоединения свободных радикалов по двой-
неразделенной электрохимической ячейке, снаб-
ной связи винилазидов протекает элиминирование
женной платиновыми электродами.
молекулярного азота с образованием иминильного
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
радикала, который затем может димеризоваться
[12], перехватываться другим свободным ради-
На основании нашего предыдущего опыта по
калом
[13], претерпевать внутримолекулярную
исследованию электрохимических реакций с уча-
1185
1186
МУЛИНА и др.
Схема 1. Реакции винилазидов и тиолов под действием окислителей
Предыдущая работа:
N3
NH2
O
O2
NH
SiO2
+
R2SH
+
SR2
SR2
PhH
SR2
R1
R1
R1
R1
Настоящее исследование:
Электролиз
NH2
N3
(I = const)
SR2
+
R2SH
R1
NH4I
R1
ДМСО-MeCN
SR2
стием тиолов [20] и винилазидов [17], были выбра-
рителя на эффективность электросинтеза (опы-
ны условия для проведения реакции между (1-ази-
ты 9-12) показало, что наилучшие результаты
довинил)бензолом 1a и тиофенолом 2a в элек-
достигаются при использовании смеси ДМСО-
трохимических условиях: использование NH4I в
MeCN (опыт 12). Изменением соотношения ком-
качестве фонового электролита и редокс катали-
понентов смеси ДМСО-MeCN удалось достичь
затора и смеси ДМСО-ТГФ в качестве раствори-
наибольшего выхода продукта 3a (опыт 13, 65%).
теля (табл. 1, опыт 1). В этом опыте образовалось
Оптимальные условия электросинтеза гем-бисти-
значительное количество гем-бистиоенамина 3a.
оенамина 3a: проведение процесса на платиновых
Образование подобных продуктов двойного при-
электродах с использованием 1 экв NH4I в каче-
соединения к двойной связи винилазида ранее
стве фонового электролита и редокс катализатора,
описано не было.
смеси ДМСО-MeCN в соотношении 1:3 в качестве
растворителя и 3 F/моль 1a пропущенного элек-
Далее была проведена оптимизация условий
тричества (табл. 1, опыт 13).
этого превращения на примере взаимодействия
(1-азидовинил)бензола 1a и тиофенола 2a, при-
В найденных оптимальных условиях был син-
водящего к 1-фенил-2,2-бис(фенилтио)этенамину
тезирован ряд гем-бистиоенаминов 3 (табл. 2).
3a. Данные по влиянию природы электролита и
Различные ароматические винилазиды 1 и тиолы
его количества, природы растворителя, количества
2 успешно вступают в обнаруженную реакцию.
пропущенного электричества и плотности тока,
Наличие метокси-группы в п-положении арома-
а также материала электродов суммированы в
тического ядра тиола 2b и атома хлора в м-поло-
табл. 1.
жении ароматического ядра тиола 2e привело к
значительному снижению выхода продуктов элек-
Постепенное увеличение количества пропуска-
тросинтеза 3b и 3e. В остальных случаях выходы
емого электричества с 1.1 F/моль 1a до 3 F/моль 1a
гем-бистиоенаминов 3 находились в диапазоне
привело к росту выхода продукта 3a с 22% до 47%
44-58%.
(опыты 1-3). Именно при пропускании 3 F/моль 1a
электричества была достигнута полная конверсия
На основании литературных и полученных экс-
исходного винилазида 1a. Снижение плотности
периментальных данных предложен возможный
тока в 2 раза не привело к увеличению выхода 3a
механизм образования гем-бистиоенамина 3a из
(опыт 4). Использование электролитов, отличных
винилазида 1a и тиофенола 2a в электрохимиче-
от иодида аммония (опыты 5, 6), также не увели-
ских условиях (схема 2). Процесс начинается с
чило выход целевого соединения. В результате
анодного окисления иодид-аниона до иода [21,
снижения количества NH4I с 1 экв до 0.5 экв вы-
22]. Взаимодействие иода с тиофенолом 2a приво-
ход 3a упал до 33% (опыт 7). Замена электродов
дит к сульфенил иодиду A [23, 24], который под-
из графита и нержавеющей стали на платиновые
вергается гомолитическому разрыву связи S-I с
позволила получить продукт 3a с выходом 55%
образованием тиильного радикала B. На следую-
(опыт 8). Исследование влияния природы раство-
щей стадии происходит присоединение радикала
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ЭЛЕКТРОСИНТЕЗ гем-БИСТИОЕНАМИНОВ ИЗ ВИНИЛАЗИДОВ И ТИОЛОВ
1187
Таблица 1. Оптимизация условий электросинтеза гем-бистиоенамина 3aa
Электролиз
NH2
N3
(I = const)
SPh
+ PhSH
Ph
Электролит
Ph
Растворитель
SPh
1a
2a
3a
Электролит
Количество электричества,
№
Растворитель
Анод-Катодb
Выход 3a, %c
(моль/моль 1a)
F/моль 1a
1
NH4I (1)
ДМСО-ТГФ
1.1
C-Fe
22
2
NH4I (1)
ДМСО-ТГФ
2
C-Fe
42
3
NH4I (1)
ДМСО-ТГФ
3
C-Fe
47
4d
NH4I (1)
ДМСО-ТГФ
3
C-Fe
36
5
KI (1)
ДМСО-ТГФ
3
C-Fe
34
6
NH4Br (1)
ДМСО-ТГФ
3
C-Fe
8
7
NH4I (0.5)
ДМСО-ТГФ
3
C-Fe
33
8
NH4I (1)
ДМСО-ТГФ
3
Pt-Pt
55
9
NH4I (1)
ДМСО
3
Pt-Pt
40
10
NH4I (1)
ДМСО-диоксан
3
Pt-Pt
36
11
NH4I (1)
ДМСО-MeOH
3
Pt-Pt
34
12
NH4I (1)
ДМСО-MeCN
3
Pt-Pt
58
13e
NH4I (1)
ДМСО-MeCN
3
Pt-Pt
65 (58)
а Общие условия реакции: к раствору тиофенола 2a (2.5 экв, 275 мг) и электролита (0.5-1 экв) в 20 мл смеси ДМСО-органический
растворитель (1:1) или ДМСО при перемешивании добавляли (1-азидовинил)бензол 1a (1 ммоль, 1 экв, 145 мг). При перемеши-
вании пропускали электрический ток [I = const (60 мА), j = 20 мА/см2]
b C - графит, Fe - нержавеющая сталь, Pt - платина
c Выход определен с использованием 1H ЯМР-спектроскопии (1,4-динитробензол в качестве внутреннего стандарта), выход на
выделенный продукт указан в скобках
d Опыт проводился при плотности тока j = 10 мА/см2
e Опыт проводился в 20 мл смеси ДМСО-MeCN в соотношении (1:3)
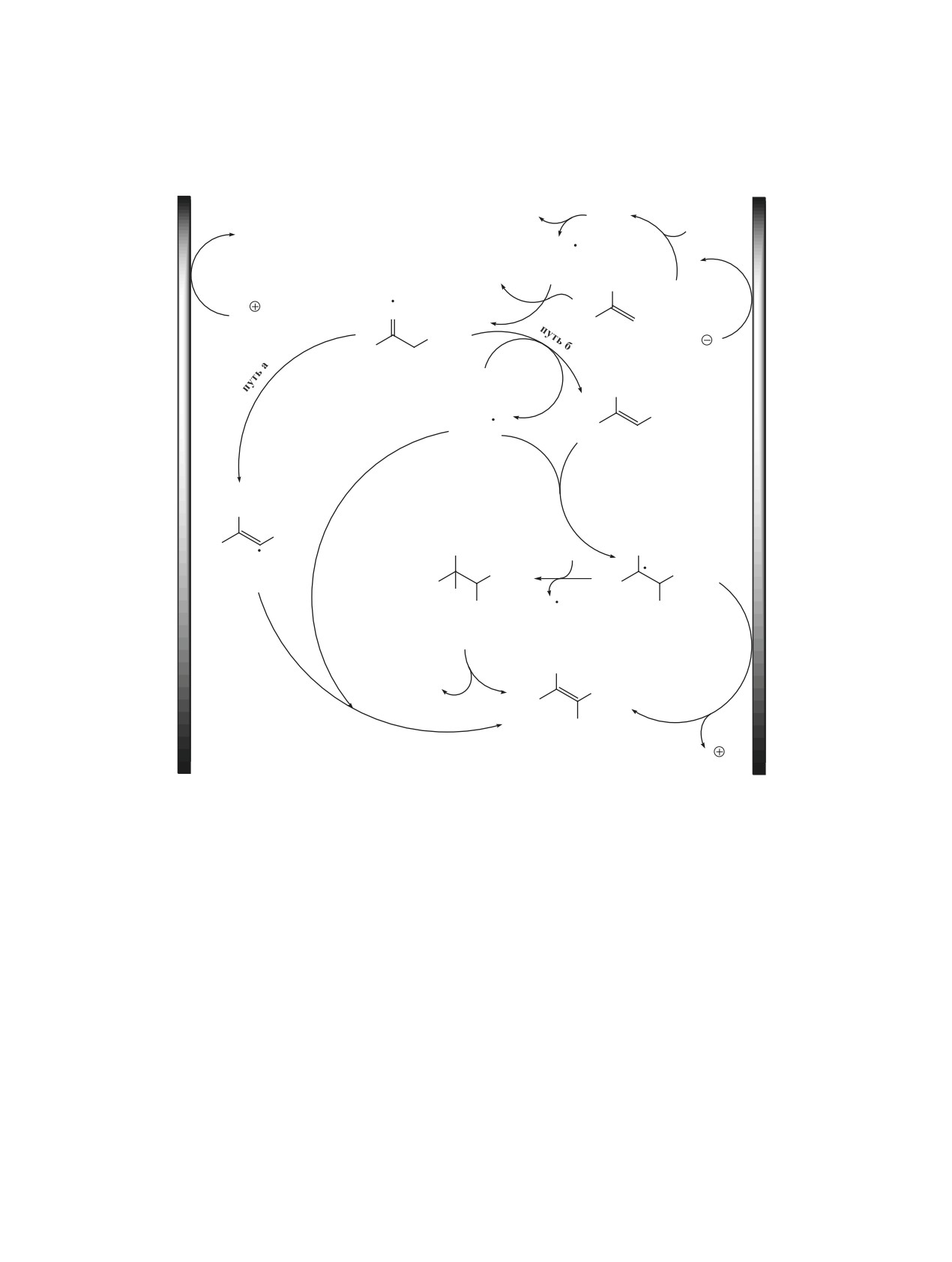
B по двойной связи винилазида 1a, сопровождаю-
последующим отщеплением молекулы HI от обра-
щееся элиминированием молекулы N2, в результа-
зующегося интермедиата G.
те чего генерируется иминильный радикал C [25].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образование конечного продукта 3a из радикала
Спектры ЯМР регистрировали на спектро-
C возможно по двум путям. Путь а предполагает
метрах Bruker AW-300
(300.13 МГц для
1Н,
1,3-водородный сдвиг, приводящий к образова-
75.4 МГц для 13С) в растворителе CDCl3, химиче-
нию C-центрированного винильного радикала D,
ские сдвиги приведены в м.д. по шкале δ относи-
с последующей рекомбинацией радикалов B и D.
тельно ТМС. ТСХ-анализ проводили с использова-
По маршруту б происходит отрыв атома водоро-
нием хроматографических пластинок ALUGRAM
да радикалом C от тиофенола 1a с образованием
Xtra SIL G/UV-254. Для хроматографии применяли
енамина E и тиильного радикала B, взаимодей-
силикагель (0.060-0.200 мм, 60 А, CAS 7631-86-9).
ствие которых на следующей стадии приводит к
Температуры плавления определяли с использова-
C-центрированному радикалу F. Конечный про-
нием нагревательного столика Кофлера. Тиолы 2,
дукт 3a образуется из радикала F посредством
NH4I, NH4Br, KI, ДМСО, ТГФ, MeOH, MeCN, ди-
последовательного анодного окисления и депро-
оксан, этилацетат (ЭА), петролейный эфир (40/70,
тонирования или в результате его иодирования с
ПЭ), NEt3, Na2SO4 были приобретены у коммерче-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1188
МУЛИНА и др.
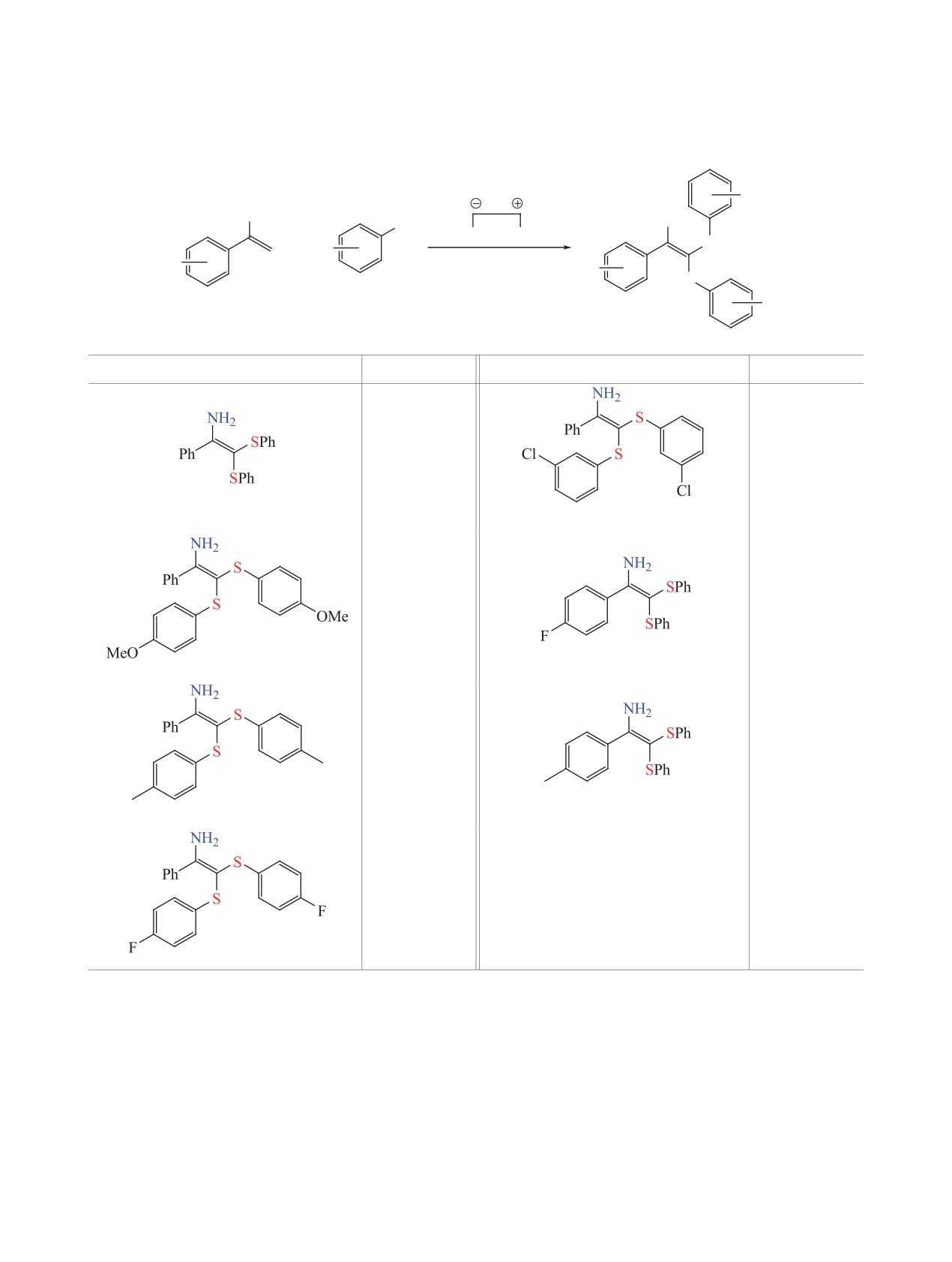
Таблица 2. Электросинтез гем-бистиоенаминов 3 из винилазидов 1 и тиолов 2a,b
R2
N3
NH2
SH
Pt
Pt
+
R2
S
R1
ДМСО-MeCN
R1
NH4I, 3 F/моль 1
S
j = 20 мА/см2
R2
1a-c
2a-e
3a-g
Соединение
Выход, %
Соединение
Выход, %
58
33
3a
3e
32
44
3b
3f
51
50
3c
3g
50
3d
a Общие условия реакции: к раствору тиола 2 (2.5 экв) и NH4I (1 экв, 145 мг) в 20 мл смеси ДМСО-MeCN (1:3) при перемешива-
нии добавляли винилазид 1 (1 ммоль, 1 экв). При перемешивании пропускали электрический ток [I = const (60 мА), j = 20 мА/см2]
b Выход на выделенный продукт
ских поставщиков и использовались без предвари-
из (1-азидовинил)бензола 1a и тиофенола 2a
тельной очистки. Винилазиды 1 были синтезиро-
(табл. 1). а. в неразделенной электрохимической
ваны по литературной методике [18].
ячейке к раствору тиофенола 2a (2.5 экв, 2.5 ммоль,
Оптимизация условий реакции электросин-
275 мг) и электролита (0.5-1 экв, 0.5-1 ммоль) в
теза
1-фенил-2,2-бис(фенилтио)этенамина
3a
20 мл ДМСО или смеси ДМСО-органический
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ЭЛЕКТРОСИНТЕЗ гем-БИСТИОЕНАМИНОВ ИЗ ВИНИЛАЗИДОВ И ТИОЛОВ
1189
Схема 2. Возможные пути образования гем-бистиоенамина 3a из винилазида 1a и тиола 2a
Катод
Анод
HI
PhSI
PhSH
H2
A
2a
PhS
I2
N2
B
N3
N
H
Ph
SPh
1a
Ph
2I
С
PhSH
NH2
2a
1,3-водородный
сдвиг
SPh
PhS
Ph
B
E
NH2
SPh
Ph
NH2
I
2
NH2
D
SPh
SPh
Ph
Ph
I
SPh
I
SPh
G
F
NH2
HI
SPh
Ph
SPh
3a
H
растворитель (1:1) при перемешивании добавляли
платиновыми электродами, к раствору тиола 2
(1-азидовинил)бензол 1a (1 экв, 1 ммоль, 145 мг).
(2.5 экв, 2.5 ммоль) и NH4I (1 экв, 1 ммоль, 145 мг)
При перемешивании пропускали электрический
в 20 мл смеси ДМСО-MeCN (1:3) при перемеши-
ток [I = const (60 мА), j = 20 мА/см2]. По окон-
вании добавляли винилазид 1 (1 экв, 1 ммоль). При
чании реакции смесь разбавляли 1М раствором
перемешивании пропускали электрический ток
Na2S2O3 (15 мл) и водой (35 мл), затем промывали
[I = const (60 мА), j = 20 мА/см2]. По окончании
ЭА (5×10 мл). Объединенный органический слой
реакции смесь разбавляли 1М раствором Na2S2O3
промывали водой (10 мл) и насыщенным водным
(15 мл) и водой (35 мл), затем промывали ЭА
раствором NaCl (10 мл), сушили над Na2SO4 и
(5×10 мл). Объединенный органический слой про-
фильтровали. Растворитель удаляли в вакууме (10-
мывали водой (10 мл) и насыщенным водным рас-
15 мм рт.ст.) при комнатной температуре. Выход
твором NaCl (10 мл), сушили над Na2SO4 и филь-
продукта
3a определяли с использованием 1H
тровали. Растворитель удаляли в вакууме (10-
ЯМР-спектроскопии (1,4-динитробензол в каче-
15 мм рт.ст.) при комнатной температуре. Целевые
стве внутреннего стандарта).
продукты 3a-g выделяли хроматографией на SiO2
Синтез гем-бистиоенаминов 3a-g из винил-
с использованием элюента ПЭ-ЭА с увеличением
азидов 1a-c и тиолов 2a-e (табл. 2). б. В нераз-
доли последнего от 5 до 20 объемных процентов и
деленной электрохимической ячейке, снабженной
добавлением 2% NEt3.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1190
МУЛИНА и др.
1-Фенил-2,2-бис(фенилтио)этенамин
(3a)
136.7, 138.2, 141.6, 163.5. Масс-спектр (ESI), m/z:
[26]. Желтый порошок, т.пл. 135-137°С. Выход
401.9939 [M - H]-. [С20Н1345Cl2NS2]-. М 401.9929.
195 мг (58%), Rf 0.33 (ПЭ-ЭА, 10:1). Спектр ЯМР
1-(4-Фторфенил)-2,2-бис(фенилтио)этен-
1H (CDCl3), δ, м.д.: 5.10 уш.с (2H), 7.08-7.21 м
амин (3f) [26]. Светло-желтый порошок, т.пл. 144-
(4H), 7.24-7.26 м (2H), 7.29-7.31 м (4H), 7.33-7.39
146°С. Выход 156 мг (44%), Rf 0.50 (ПЭ-ЭА, 5:1).
м (3H), 7.48-7.52 м (2H). Спектр ЯМР 13C (CDCl3),
Спектр ЯМР 1H (CDCl3), δ, м.д.: 5.07 уш.с (2H),
δ, м.д.: 85.7, 124.8, 125.4, 126.1, 126.4, 127.8, 128.2,
7.03 т (2H, J 8.8 Гц), 7.10-7.19 м (4H), 7.24-7.33
128.7, 129.0, 129.4, 136.2, 137.2, 139.4, 162.3.
м (6H), 7.48 д.д (2H, J 8.8, 5.8 Гц). Спектр ЯМР
2,2-Бис(4-метоксифенилтио)-1-фенилэтен-
13C (CDCl3), δ, м.д.: 86.4, 115.2 д (J 21.6 Гц), 125.0,
амин (3b) [26]. Желтый порошок, т.пл. 73-75°С.
125.5, 126.0, 126.6, 128.8, 129.0, 129.7 д (J 8.3 Гц),
Выход 126 мг (32%), Rf 0.31 (ПЭ-ЭА, 5:1). Спектр
133.1 д (J 3.3 Гц), 136.1, 139.2, 161.1, 163.2 д (J
ЯМР 1H (CDCl3), δ, м.д.: 3.77 с (3H), 3.79 с (3H),
249.2 Гц).
5.00 уш.с (2H), 6.77-6.87 м (4H), 7.09-7.14 м (2H),
2,2-Бис(фенилтио)-1-п-толилэтенамин
(3f)
7.23-7.28 м (2H), 7.34-7.40 м (3H), 7.46-7.51 м
[26]. Желтый порошок, т.пл. 115-117°С. Выход
(2H). Спектр ЯМР 13C (CDCl3), δ, м.д.: 55.3, 55.4,
175 мг (50%), Rf 0.34 (ПЭ-ЭА, 10:1). Спектр ЯМР
90.5, 114.4, 114.7, 126.9, 128.1, 128.2, 129.1, 129.1,
1H (CDCl3), δ, м.д.: 2.37 с (3H), 5.09 уш.с (2H),
129.5, 129.7, 137.6, 158.0, 158.3, 159.7.
7.09-7.22 м (6H), 7.25 д (2H, J 7.1 Гц), 7.29-7.31 м
1-Фенил-2,2-бис(п-толилтио)этенамин
(3c)
(4H), 7.40 д (2H, J 8.1 Гц). Спектр ЯМР 13C (CDCl3),
[26]. Желтый порошок, т.пл. 113-115°С. Выход
δ, м.д.: 21.3, 85.2, 124.8, 125.3, 126.0, 126.3, 127.7,
185 мг (51%), Rf 0.37 (ПЭ-ЭА, 10:1). Спектр ЯМР
128.7, 128.9, 129.0, 134.3, 136.3, 139.4, 139.6,
1H (CDCl3), δ, м.д.: 2.31 с (3H), 2.33 с (3H), 5.05
162.4.
уш.с (2H), 7.06-7.13 м (6H), 7.21 д (2H, J 8.1 Гц),
ВЫВОДЫ
7.33-7.41 м (3H), 7.49-7.52 м (2H). Спектр ЯМР
13C (CDCl3), δ, м.д.: 20.9, 21.0, 87.3, 126.4, 126.9,
Обнаружено, что взаимодействие винилазидов
127.9, 128.1, 129.2, 129.5, 129.8, 132.6, 134.6, 135.3,
и тиолов в электрохимических условиях позволя-
135.8, 137.4, 161.3.
ет получать гем-бистиолированные производные
енаминов, содержащие в своей структуре одновре-
2,2-Бис(4-фторфенилтио)-1-фенилэтенамин
менно тетразамещенную двойную связь и фраг-
(3d). Белый порошок, т.пл. 144-146°С. Выход
мент N-незащищенного енамина. Процесс проте-
186 мг (50%), Rf 0.46 (ПЭ-ЭА, 5:1). Спектр ЯМР
кает в гальваностатическом режиме в конструк-
1H (CDCl3), δ, м.д.: 5.09 уш.с (2H), 6.91-7.03 м
тивно простой неразделенной электрохимической
(4H), 7.12 д.д (2H, J 8.8, 5.1 Гц), 7.23-7.28 м (2H),
ячейке, снабженной платиновыми электродами, с
7.33-7.48 м (5H). Спектр ЯМР 13C (CDCl3), δ, м.д.:
использованием иодида аммония в качестве фоно-
87.6, 115.7 д (J 22.0 Гц), 116.1 д (J 22.0 Гц), 127.8,
вого электролита и редокс катализатора. На осно-
128.2, 128.4 д (J 7.7 Гц), 128.9 д (J 7.7 Гц), 129.4,
вании литературных и полученных эксперимен-
131.1 д (J 2.6 Гц), 134.0 д (J 2.6 Гц), 137.1, 160.4 д (J
тальных данных предложен возможный механизм
245.0 Гц), 160.8 д (J 245.0 Гц), 161.6. Масс-спектр
электросинтеза гем-бистиоенаминов из винилази-
(ESI), m/z: 370.0529 [M - H]-. [С20Н14F2NS2]-. M
дов и тиолов.
370.0530.
ФОНДОВАЯ ПОДДЕРЖКА
2,2-Бис(3-хлорфенилтио)-1-фенилэтенамин
(3e). Светло-желтый порошок, т.пл. 108-110°С.
Исследование выполнено при финансовой под-
Выход 133 мг (33%), Rf 0.46 (ПЭ-ЭА, 5:1). Спектр
держке Российского Фонда Фундаментальных
ЯМР 1H (CDCl3), δ, м.д.: 5.21 уш.с (2H), 7.04-7.12 м
Исследований (грант № 19-29-08027).
(2H), 7.14-7.22 м (5H), 7.27-7.28 м (1H), 7.36-7.44
ИНФОРМАЦИЯ ОБ АВТОРАХ
м (3H), 7.48-7.51 м (2H). Спектр ЯМР 13C (CDCl3),
δ, м.д.: 83.6, 124.1, 124.5, 125.1, 125.6, 125.7, 126.0,
Мулина Ольга Михайловна, ORCID: http://
127.6, 128.4, 129.7, 129.7, 130.1, 134.7, 135.0,
orcid.org/0000-0003-0149-4914
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
ЭЛЕКТРОСИНТЕЗ гем-БИСТИОЕНАМИНОВ ИЗ ВИНИЛАЗИДОВ И ТИОЛОВ
1191
КОНФЛИКТ ИНТЕРЕСОВ
Synth. Catal. 2020, 362, 3864-3871. doi 10.1002/
adsc.202000618
Авторы заявляют об отсутствии конфликта ин-
14.
Mao L.L., Quan L.X., Zhu X.H., Ji C.B., Zhou A.X.,
тересов.
Chen F.Y., Zheng D.G. Synlett. 2019, 30, 955-960. doi
СПИСОК ЛИТЕРАТУРЫ
10.1055/s-0037-1611758
1.
Arnone A., Cardillo R., Di Modugno V., Nasini G.
15.
Li G., Kong X., Liang Q., Lin L., Yu K., Xu B.,
J. Chem. Soc. Perkin Trans. 1. 1989, 1995-2000. doi
Chen Q. Eur. J. Org. Chem. 2020, 2020, 6135-6145.
10.1039/p19890001995
doi 10.1002/ejoc.202001059
2.
Stallard M.O., Fenical W., Kittredge J.S. Tetrahed-
16.
Ning Y., Zhao X.F., Wu Y.B., Bi X. Org. Lett. 2017, 19,
ron.
1978,
34,
2077-2081. doi
10.1016/0040-
6240-6243. doi 10.1021/acs.orglett.7b03204
4020(78)89006-1
17.
Mulina O.M., Zhironkina N.V., Paveliev S.A.,
3.
Scott L.J., Lamb H.M. Drugs. 1999, 58, 499-505. doi
10.2165/00003495-199958030-00016
Demchuk D.V., Terent’ev A.O. Org. Lett. 2020, 22,
1818-1824. doi 10.1021/acs.orglett.0c00139
4.
Buckley M.M., Goa K.L. Drugs. 1989, 37, 451-490.
doi 10.2165/00003495-198937040-00004
18.
Mulina O.M., Ilovaisky A.I., Opatz T., Terent’ev A.O.
5.
Chelucci G. Chem. Rev. 2012, 112, 1344-1462. doi
Tetrahedron Lett. 2021, 64, 152737. doi 10.1016/
10.1021/cr200165q
j.tetlet.2020.152737
6.
Pawluć P., Hreczycho G., Suchecki A., Kubicki M.,
19.
Montevecchi P.C., Navacchia M.L., Spagnolo P. J. Org.
Marciniec B. Tetrahedron. 2009, 65, 5497-5502. doi
Chem. 1997, 62, 5846-5848. doi 10.1021/jo970691q
10.1016/j.tet.2009.01.113
20.
Terent’ev A.O., Mulina O.M., Ilovaisky A.I., Kokore-
7.
Zhang X., Liu C., Deng Y., Cao S. Org. Biomol. Chem.
kin V.A., Nikishin G.I. Mendeleev Commun. 2019, 29,
2020, 18, 7540-7544. doi 10.1039/d0ob01821j
80-82. doi 10.1016/j.mencom.2019.01.027
8.
Yoo W.J., Kondo J., Rodriguez-Santamaria J.A.,
21.
Liu K., Song C., Lei A. Org. Biomol. Chem. 2018, 16,
Nguyen T.V.Q., Kobayashi S. Angew. Chem. Int. Ed.
2019, 58, 6772-6775. doi 10.1002/anie.201902779
2375-2387. doi 10.1039/C8OB00063H
9.
Kumar N., Eghbarieh N., Stein T., Shames A.I.,
22.
Tang H.T., Jia J.S., Pan Y.M. Org. Biomol. Chem. 2020,
Masarwa A. Chem. Eur. J. 2020, 26, 5360-5364. doi
18, 5315-5333. doi 10.1039/d0ob01008a
10.1002/chem.202000603
23.
Martins G.M., Meirinho A.G., Ahmed N., Braga A.L.,
10.
Zubkov M.O., Kosobokov M.D., Levin V.V., Kokore-
Mendes S.R. ChemElectroChem. 2019, 6, 5928-5940.
kin V.A., Korlyukov A.A., Hu J., Dilman A.D. Chem.
doi 10.1002/celc.201901525
Sci. 2020, 11, 737-741. doi 10.1039/c9sc04643g
24.
Pramanik M., Choudhuri K., Mal P. Org. Biomol.
11.
Fu J., Zanoni G., Anderson E.A., Bi X. Chem. Soc. Rev.
Chem. 2020, 18, 8771-8792. doi 10.1039/d0ob01741h
2017, 46, 7208-7228. doi 10.1039/c7cs00017k
25.
Hayashi H., Kaga A., Chiba S. J. Org. Chem. 2017, 82,
12.
Wang Y.F., Lonca G.H., Chiba S. Angew. Chem. Int.
Ed. 2014, 53, 1067-1071. doi 10.1002/anie.201307846
11981-11989. doi 10.1021/acs.joc.7b02455
13.
Paveliev S.A., Churakov A.I., Alimkhanova L.S.,
26.
Ni J., Mao X., Zhang A. Adv. Synth. Catal. 2019, 361,
Segida O.O., Nikishin G.I., Terent’ev A.O. Ad.
2004-2008. doi 10.1002/adsc.201900035
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1192
МУЛИНА и др.
Electrosynthesis of gem-Bisthioenamines
from Vinylazides and Thiols
O. M. Mulinaa, *, M. M. Doronina, V. A. Kostyaginab, and G. P. Timofeevc
a N.D. Zelinsky Institute of Organic Chemistry RAS, Leninsky prosp. 47, Moscow, 119991 Russia
b D.I. Mendeleev University of Chemical Technology of Russia, Miusskaya pl., 9, Moscow, 125047 Russia
c Southwest State University, ul. 50 Let Oktyabrya, 94, Kursk, 305040 Russia
*e-mail: mulya@ioc.ac.ru
Received March 30, 2021; revised April 11, 2021; accepted April 12, 2021
Electrosynthesis of gem-bisthioenamines from vinyl azides and thiols was performed. The reaction proceeds
in undivided electrochemical cell equipped with platinum electrodes in DMSO-MeCN solution using NH4I as
the supporting electrolyte and redox catalyst and current density of 20 mA/cm2. Yields of the target products
are 32-58%.
Keywords: oxidation, electrosynthesis, enamines, vinyl azides, thiols
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021