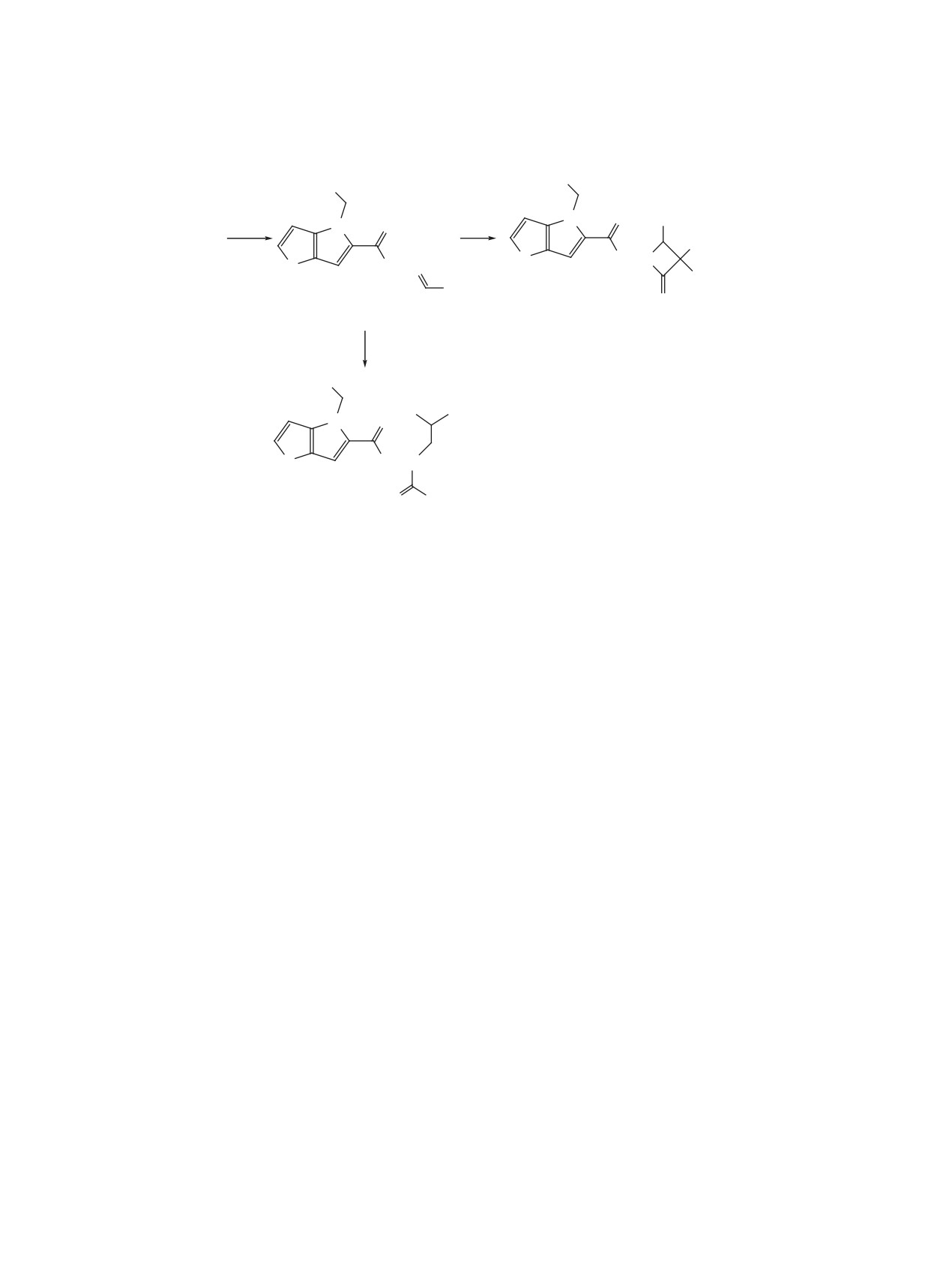ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 9, с. 1314-1321
УДК 547.759.6
СИНТЕЗ ПРОИЗВОДНЫХ 4-БЕНЗИЛТИЕНО-
[3,2-b]ПИРРОЛА, НЕСУЩИЕ ОСТАТКИ
1,3,4-ОКСАДИАЗОЛА И АЗЕТИДИНОНА
© 2021 г. С. А. Торосян, З. Ф. Нуриахметова, Н. С. Востриков, Ф. А. Гималова*
Уфимский Институт химии - обособленное структурное подразделение
ФГБНУ «Уфимского федерального исследовательского центра РАН»,
Россия, 450054 Уфа, просп. Октября, 69
*e-mail: fangim@anrb.ru; fanuza_gimalova@mail.ru
Поступила в редакцию 28.04.2021 г.
После доработки 10.05.2021 г.
Принята к публикации 12.05.2021 г.
Превращениями в гидразидной части 4-бензилтиено[3,2-b]пиррол-5-карбоновой кислоты получены
δ-связанные с фрагментом 4-бензил[3,2-b]пиррол-5-ила бисгетероциклы и производные гидразида лак-
тамной природы.
Ключевые слова: 4-бензилтиено[3,2-b]пиррол-5-карбоновая кислота, гидразид, 1,3,4-оксадиазолы,
азетидиноны, синтез
DOI: 10.31857/S051474922109010X
ВВЕДЕНИЕ
частности, соединений 2-4, 6, 10-13 (схемы 1 и 2).
Последние, содержащие в структуре 2 активные
Многие производные четырех- и пятичленных
фармакофорные субъединицы, представляют ин-
азотсодержащих гетероциклических соединений,
терес, с одной стороны, как новые потенциально
в частности, 1,3,4-оксадиазолов, 1,2,4-триазолов,
биологически активные гетероциклы [7-11], и, с
азетидинонов, обладают высокой биологической
другой стороны, как синтетически привлекатель-
активностью: антибактериальной, фунгицидной,
ные базисные структуры для последующего более
противовоспалительной, противораковой, обезбо-
«глубокого» модифицирования.
ливающей, гипогликемической, противомалярий-
ной, противотуберкулезной и др. [1-5]. Несмотря
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
на большое разнообразие имеющихся лекарствен-
В синтезе бисгетероциклов, в основном, ис-
ных препаратов, проблема поиска новых высо-
пользованы известные методы и реакции [12, 13].
коэффективных и малотоксичных соединений
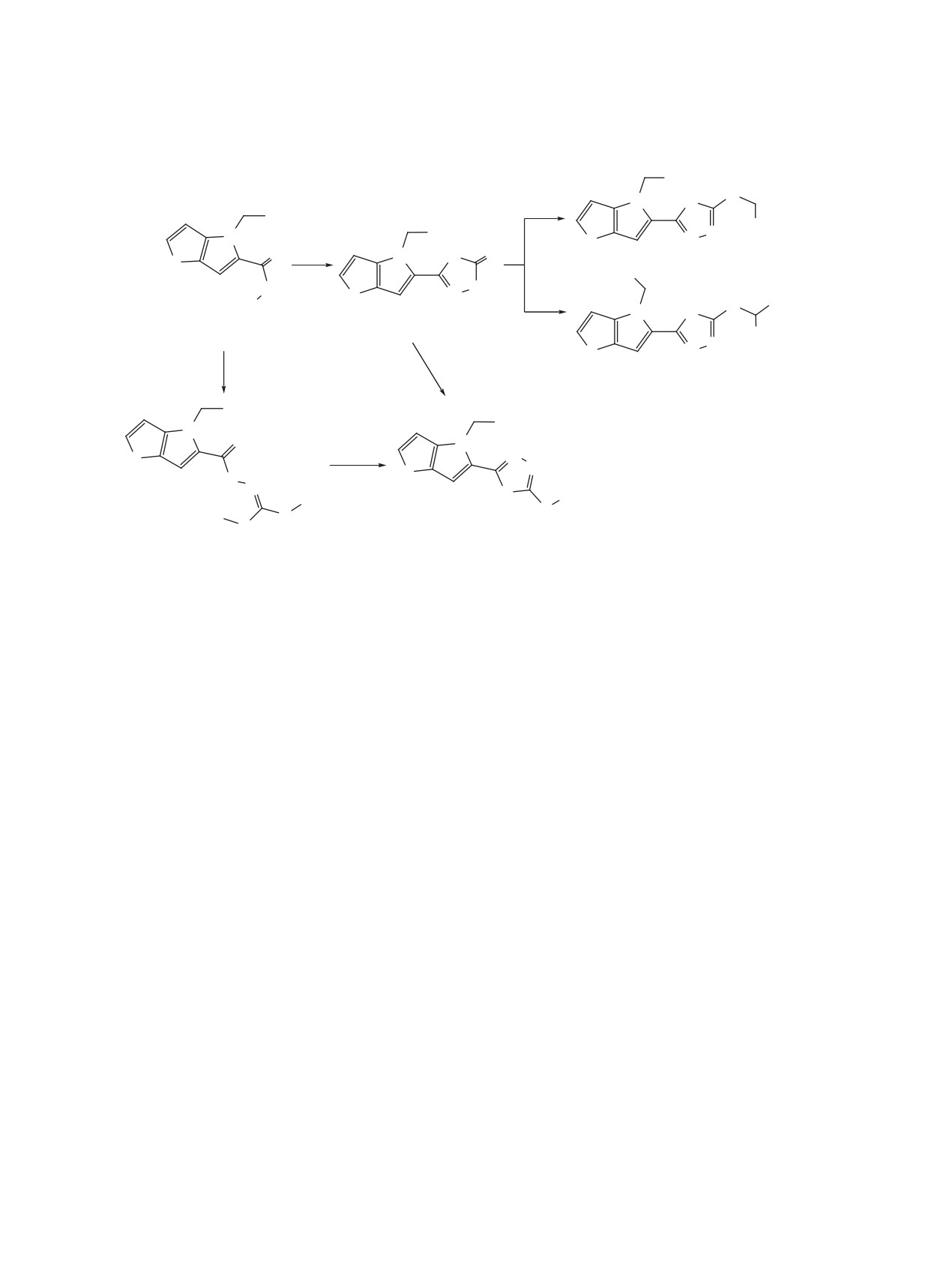
Так, внутримолекулярная ω-циклизация в гидра-
остается актуальной. Это обусловлено снижением
зиде 1 гладко протекает в среде водный KOH-
эффективности лекарственных препаратов из-за
CS2, последующей обработкой образующегося
появления резистентных форм микроорганизмов,
соединения 2 метиловым эфиром бромуксусной
наличием побочного действия, а также ограничен-
кислоты получают производное 1,3,4-оксадиазола
ным сроком годности лекарственных форм.
3. Таутомер тиона 2 реагирует с дихлоруксусной
В данной работе на примере гидразида 4-бен-
кислотой в системе КОН/Ме2СО-Н2О, приводя с
зилтиено[3,2-b]пиррол-5-карбоновой кислоты (1)
хорошим выходом к кислоте 4. Проведение реак-
[6] продемонстрированы примеры построения
ции гидразида 1 с CS2 в этаноле и присутствии во-
структур δ-связанных бисгетероциклов тополо-
дного раствора KOH и последующая обработка ре-
гии тиенопиррол/1,3,4-оксадиазол и азетидинон, в
акционной массы MeI дает соединение 5, которое
1314
СИНТЕЗ ПРОИЗВОДНЫХ 4-БЕНЗИЛТИЕНО[3,2-b]ПИРРОЛА
1315
Схема 1
Ph
N
O S
b
Ph
54%
CO2Me
Ph
N
S
N N
O
a
N
O S
S
3
Ph
83%
NH
S
N NH
c
CO2H
H2N
S
N
O
1
2
Cl
S
N N
e
d
4
Ph
Ph
N
O
N
N
S
N
S
-CH3SH
HN N
O
CH
CH3
3
S
H3C
S
S
5
6
Реагенты и условия: a. CS2, KOH (водн.)-EtOH, кипячение; b. BrCH2CO2Me, K2CO3, Me2CO;
c. Cl2CHCO2H, KOH, Me2СO-H2O; d. CS2, КОН, EtOH-H2O, 0°C → rt;
затем CH3I, е. CH3I, K2CO3, Me2CO.
легко циклизуется в оксадиазольное производное
(Япония) (шприцевой ввод раствора образца в
6. Соединение 5 удалось выделить в чистом виде
CHCl3-MeCN при расходе 0.1 мл/мин, элюент
повторной хроматографией смеси с производным
MeCN-H2O, 95:5, в режиме регистрации положи-
6. В свою очередь оксадиазол 6 получен в индиви-
тельных и отрицательных ионов при потенциале
дуальном виде взаимодействием тиона 2 с MeI в
игольчатого ионизирующего электрода 4.5 кВ;
присутствии K2CO3 в ацетоне (схема 1).
температура капилляра интерфейса 250°С, напря-
жение на капилляре интерфейса 5 В). Элементный
Серия азетидиноновых производных
10-12
анализ выполнен на CHNS-анализаторе EURO
получена реакцией [2+2]-циклоприсоединения к
EA-2000 (Италия). Контроль за ходом реакций
полученным взаимодействием гидразида 1 с ук-
осуществлен методом ТСХ на пластинах Сорбфил
сусным альдегидом или фурфуролом гидразонам
(Россия), проявление раствором анисового альде-
7 и 9 [14] соответствующих хлоркетенов, генери-
гида и серной кислоты в этаноле с последующим
руемых из хлор- или дихлорацетилхлоридов дей-
нагреванием при 120-150°С. Продукты выделены
ствием диизопропилэтиламина (DIPEA) (схема 2).
В случае же гидразона 8 реакция с дихлоркетеном
методом колоночной хроматографии на силика-
геле фирмы Macherey-Nagel (Германия) (30-60 г
привела к ациклическому соединению 13.
адсорбента на 1 г вещества). Для колоночной хро-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
матографии использовали свежеперегнанные рас-
ИК спектры зарегистрированы на спектрофо-
творители.
тометре IR Prestige-21 Shimadzu (Япония) в тон-
4-Бензил-N'-[(1E)-2-(2-фурил)пропилиден]-4H-
ком слое. Спектры ЯМР 1Н и 13С зарегистриро-
тиено[3,2-b]пиррол-5-карбогидразид (9) получен
ваны на спектрометрах Bruker AM-300 (300 МГц)
согласно [14].
и Bruker Avance-500 (Германия) (500 и 125 МГц
соответственно), внутренний стандарт - ТМС.
5-(4-Бензил-4H-тиено[3,2-b]пиррол-5-ил)-
Масс-спектры (ХИ, вода) зарегистрированы на
1,3,4-оксадиазол-2(3H)-тион
(2).
К раство-
масс-спектрометре Shimadzu LCMS-2010EV
ру 50 мг (0.185 ммоль) гидразида
1 и 35 мг
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 9 2021
1316
ТОРОСЯН и др.
Схема 2
Ph
Ph
N
O R
g
N
O
h
1
X
91%
S
HN N
S
HN N
Cl
R
O
7-9
10-12
h
Ph
N
O
S
HN N
O CCl2
13
7, R = CH3; 8, R = i-Pr; 9, R = 2-фурил; 10, X = H, R = CH3; 11, X = Cl, R = CH3; 12, X = Cl, R = 2-фурил.
Реагенты и условия: g. CH3CHO, изомасляный альдегид или фурфурол, EtOH, кипячение;
h. Cl2CHCOCl или ClCH2COCl, DIPEA, CHCl3.
(0.461 ммоль) сероуглерода в 10 мл этанола до-
Метил-2-[5-((4-бензил-4H-тиено[3,2-b]пир-
бавляли раствор 16 мг (0.276 ммоль) KOH в
рол-5-ил)-1,3,4-оксадиазол-2-ил)тио]ацетат
(3).
0.5 мл воды. Реакционную массу кипятили при пе-
К раствору 30 мг (0.096 ммоль) тиона 2 и 16 мг
ремешивании ~ 2 ч (контроль по ТСХ, элюент -
(0.105 ммоль) метилбромацетата в 10 мл ацетона
CHCl3-MeOH, 30:1). После окончания реакции
при перемешивании добавляли 66 мг (0.479 ммоль)
K2CO3, реакционную массу кипятили с обратным
массу подкисляли 5% HCl, экстрагировали CHCl3
холодильником 48 ч (до израсходования исходного
(3×15 мл). Объединенные органические слои су-
соединения, контроль методом ТСХ). Затем массу
шили MgSO4, растворитель упаривали. Продукт
охлаждали до комнатной температуры, добавляли
выделяли колоночной хроматографией на колонке
15 мл дистиллированной воды, массу экстрагиро-
с SiO2 (элюент - петролейный эфир-этилацетат,
вали CH2Cl2 (3×15 мл). Объединенные органиче-
3:1). Выход 48 мг (83%). Кристаллы бледно-жел-
ские слои сушили MgSO4, отфильтровывали, рас-
того цвета, т.пл. 207-208°С. ИК спектр, ν, см-1:
творитель упаривали. Продукт выделяли колоноч-
3112, 3099, 1620, 1612, 1512, 1462, 1456, 1444,
ной хроматографией на SiO2 (элюент - петролей-
1412, 1377, 1306, 1177, 1159, 1086, 1068, 972, 962,
ный эфир-этилацетат, 3:1). Выход 20.5 мг (55%).
935, 723, 700. Спектр ЯМР 1Н (500 МГц, CDCl3), δ,
Бесцветные кристаллы, т.пл.
145-147°С. ИК
м.д.: 5.80 с (2Н, CH2Ph), 7.10 д (1Н, Н3', J 5.4 Гц),
спектр, ν, см-1: 1731, 1602, 1482, 1453, 1446, 1426,
7.18 д (2Наром, J 7.5 Гц), 7.24-7.30 м (3Наром), 7.28
1378, 1356, 1307, 1279, 1207, 1155, 1097, 995, 785,
с (1Н, Н6'), 7.49 д (1Н, Н2', J 5.4 Гц). Спектр ЯМР
731, 725, 706. Спектр ЯМР 1Н (500 МГц, CDCl3),
13С (125 МГц, CDCl3), δ, м.д.: 50.32 (NCH2), 106.77
δ, м.д.: 3.79 с (3Н, OCH3), 4.07 c (2H, SCH2), 5.85 с
(C6'), 111.03 (C3'), 120.19 (C6a'), 123.66 (C5'), 126.81
(2Н, CH2Ph), 6.83 д (1Н, Н3', J 5.3 Гц), 7.10 с (1Н,
(Cаром), 127.50 (Cаром), 128.59 (Cаром), 129.50 (C2'),
Н6'), 7.16 д (2Наром, J 7.0 Гц), 7.21-7.28 м (4H,
137.64 (Cаром), 145.51 (C3a'), 155.91 (С5), 177.00
Наром, Н2'). Спектр ЯМР 13С (125 МГц, CDCl3),
(C=S). Масс-спектр (ХИ, 250°С), m/z (Iотн, %): 314
δ, м.д.: 34.13 (SCH2), 50.88 (OMe), 53.20 (NCH2),
(13) [M + H]+, 312 (100) [M - H]-. C15H11N3OS2.
106.25 (C6'), 110.74 (C3'), 121.00 (C6a'), 123.82 (C5'),
Mвыч 313.0344.
127.00 (Cаром), 127.60 (Cаром), 128.66 (Cаром, C2'),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 9 2021
СИНТЕЗ ПРОИЗВОДНЫХ 4-БЕНЗИЛТИЕНО[3,2-b]ПИРРОЛА
1317
137.04 (Cаром), 145.00 (C3a'), 160.77 (С2''), 161.16
Диметил-2-[(4-бензил-4H-тиено[3,2-b]пир-
(C5''), 167.94 (C=O). Масс-спектр (ХИ, 250°С), m/z
рол-5-ил)карбонил]дитиогидразонокарбонат
(Iотн, %): 386 (100) [M + H]+. C18H15N3O3S2. Mвыч
(5) выделен из смеси с оксадиазолом 6 повторной
385.0555.
колоночной хроматографией на SiO2. Спектр ЯМР
[5-(4-Бензил-4H-тиено[3,2-b]пиррол-5-ил)-
1Н (500 МГц, CDCl3), δ, м.д.: 2.55 c (3H, CH3), 2.56
1,3,4-оксадиазол-2-илтио]-2-хлоруксусная кис-
c (3H, CH3), 5.81 с (2Н, CH2Ph), 6.85 д (1Н, Н3', J
лота (4). К раствору 30 мг (0.096 ммоль) тиона 2
5.3 Гц), 7.21 с (1H, Н6'), 7.19-7.23 м (2Наром),
и 12 мг (0.096 ммоль) дихлоруксусной кислоты в
7.25-7.28 м (4H, Наром, Н2'), 9.42 уш.с (1H, NH).
10 мл смеси ацетон-вода (2:1) при перемешива-
Спектр ЯМР 13С (125 МГц, CDCl3), δ, м.д.: 15.19
нии добавляли 16 мг (0.288 ммоль) KOН, реакци-
(CH3), 16.07 (CH3), 50.52 (NCH2), 110.85 (C3', C6'),
онную массу кипятили с обратным холодильником
122.45 (C5', C6a'), 127.09 (Cаром), 127.37 (Cаром),
48 ч (до израсходования исходного соединения,
128.57 (Cаром), 128.66 (C2'), 137.98 (Cаром), 145.02
контроль методом ТСХ). Затем массу охлаждали
(C3a'), 156.02 (С-SMe), 161.60 (C=O). Масс-спектр
до комнатной температуры, добавляли 15-20 мл
(ХИ, 250°С), m/z (Iотн, %): 376 (71) [M + H]+.
раствора HCl (до pH ~ 2.0-3.0), массу экстраги-
C17H17N3OS3. Mвыч 375.0534.
ровали CH2Cl2 (3×15 мл). Объединенные органи-
4-Бензил-5-(5-метилтио-1,3,4-оксадиазол-2-
ческие слои сушили MgSO4, отфильтровывали,
ил)-4H-тиено[3,2-b]пиррол (6). К раствору 0.17 г
растворитель упаривали. Продукт выделяли коло-
(0.543 ммоль) тиона 2 и 85 мг (0.597 ммоль) мети-
ночной хроматографией на SiO2 (элюент - хлоро-
ла йодистого в 20 мл ацетона при перемешивании
форм-метанол, 50:1). Выход 21 мг (54%). Светло-
добавляли 0.11 г (0.815 ммоль) K2CO3, реакцион-
желтые кристаллы, т.пл. 180-182°С. ИК спектр,
ную массу кипятили с обратным холодильником
ν, см-1: 1724, 1596, 1479, 1454, 1430, 1356, 1268,
20 ч (до израсходования исходного соединения,
1221, 1161, 1074, 958, 944, 840, 783, 756, 709, 696.
контроль методом ТСХ). Затем массу охлажда-
Спектр ЯМР 1Н (500 МГц, CDCl3), δ, м.д.: 5.07 c
ли до комнатной температуры, добавляли 15 мл
(1H, CHCl), 5.85 с (2Н, CH2Ph), 6.83 д (1Н, Н3', J
дистиллированной воды, массу экстрагировали
5.4 Гц), 7.11 с (1Н, Н6'), 7.16 д (2Наром, J 6.9 Гц),
CH2Cl2 (3×15 мл). Объединенные органические
7.21-7.29 м
(4H, Наром, Н2'). Спектр ЯМР 13С
слои сушили MgSO4, отфильтровывали, раство-
(125 МГц, CDCl3), δ, м.д.: 50.93 (NCH2), 68.18
ритель упаривали. Продукт выделяли колоночной
(CHCl), 106.47 (C6'), 110.70 (C3'), 120.85 (C6a'),
хроматографией на SiO2 (элюент - петролейный
123.87 (C5'), 126.96 (Cаром), 127.63 (Cаром), 128.69
эфир-этилацетат, 3:1). Выход 0.13 г (73%). Бледно-
(Cаром, C2'), 128.82 (C3'), 137.15 (Cаром),
145.13
желтые кристаллы, т.пл. 117-118°С. ИК спектр,
(C3a'), 161.08 (С2''), 161.16 (C5''), 167.80 (C=O).
ν, см-1: 2954, 2925, 2854, 1600, 1585, 1481, 1456,
Найдено, %: C 50.65; H 2.86; Cl 8.58, N 10.11; S
1442, 1377, 1359, 1263, 1222, 1165, 1094, 1075, 982,
16.01. C17H12ClN3O3S2. Вычислено, %: C 50.31; H
965, 946, 842, 757, 724, 705, 665. Спектр ЯМР 1Н
2.98; Cl 8.73; N 10.35; S 15.80.
(500 МГц, CDCl3), δ, м.д.: 2.74 c (3H, CH3), 5.91 с
Взаимодействие гидразида 1 с CS2 и метилом
(2Н, CH2Ph), 6.85 д (1Н, Н3, J 5.3 Гц), 7.10 с (1H,
йодистым. К раствору 0.22 г (0.812 ммоль) гидра-
Н6), 7.17 д (2Наром, J 7.0 Гц), 7.22-7.28 м (4H, Наром,
зида 1 и 0.31 г. (4.059 ммоль) сероуглерода в эта-
Н2). Спектр ЯМР 13С (125 МГц, CDCl3), δ, м.д.:
ноле добавляли раствор 70 мг (1.218 ммоль) KOH
14.65 (CH3), 50.89 (NCH2), 105.94 (C6), 110.74 (C3),
в 1 мл воды. Реакционную массу перемешивали
121.24 (C6a), 123.73 (C5), 127.05 (Cаром), 127.58
4 ч при 0°С, затем 24 ч при комнатной температу-
(Cаром), 128.40 (C2), 128.65 (Cаром), 137.29 (Cаром),
ре. Затем добавляли раствор 0.23 г (1.624 ммоль)
144.86 (C3a), 160.48 (С5'), 163.39 (C2'). Масс-спектр
CH3I в этаноле и перемешивали 6 ч. По оконча-
(ХИ, 250°С), m/z (Iотн, %): 328 (100) [M + Н]+.
нии реакции (контроль методом ТСХ) раствори-
C16H13N3OS2. Mвыч 327.05.
тель упаривали, продукты выделяли колоночной
хроматографией на SiO2 (элюент - петролейный
4-Бензил-N'-[(1E)-2-этилиден]-4H-тиено-
эфир-этилацетат, 3:1). Выход 0.145 мг смеси со-
[3,2-b]пиррол-5-карбогидразид (7). К раствору
единений 5 и 6 в соотношении ~ 6:5.
160 мг (0.590 ммоль) гидразида 1 в 15 мл этанола
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 9 2021
1318
ТОРОСЯН и др.
при перемешивании добавляли 26 мг (0.590 ммоль)
(DIPEA). Реакционную массу кипятили с обрат-
ацетальдегида, реакционную массу кипятили с об-
ным холодильником до израсходования исходного
ратным холодильником до израсходования исход-
соединения (контроль методом ТСХ). Затем мас-
ного соединения (контроль методом ТСХ). Затем
су охлаждали до комнатной температуры, упари-
массу охлаждали до комнатной температуры, упа-
вали растворитель, остаток очищали колоночной
ривали растворитель, остаток очищали перекри-
хроматографией на SiO2 (элюент - петролей-
сталлизацией (ацетон-петролейный эфир). Выход
ный эфир-этилацетат, 5:1). Выход 60 мг (51%).
соединения 0.16 г (91%), масло желтоватого цвета,
Бесцветные кристаллы, т.пл.
115-117°С. ИК
которое сразу использовали на следующей стадии
спектр, ν, см-1: 1678, 1628, 1534, 1497, 1474, 1449,
получения соединения 10. ИК спектр, ν, см-1: 3230,
1434, 1379, 1356, 1320, 1262, 1237, 1213, 1185,
3100, 1700, 1642, 1560, 1522, 1496, 1456, 1391,
1087, 1076, 1047, 1029, 909, 888, 818, 796, 731, 723.
1346, 1299, 1250, 1224, 1203, 1185, 1100, 1063,
Спектр ЯМР 1Н (300 МГц, CDCl3), δ, м.д.: 1.68 д
1028, 883, 838, 816, 783, 748, 719, 697, 668. Спектр
(3Н, CH3, J 5.4 Гц), 5.67 д.д (2Н, CH2Ph, J 16.2 Гц),
ЯМР 1Н (500 МГц, CDCl3), δ, м.д.: 1.93 д (6Н, CH3,
6.22 к (1H, CH, J 5.4 Гц), 6.39 с (1Н, СНCl), 6.87 д
J 5.3 Гц), 5.87 с (2Н, CH2Ph), 7.13 д (1Н, Н3', J
(1Н, Н3, J 5.3 Гц), 7.11 с (1Н, Н6), 7.10 д (2Наром, J
8.7 Гц), 7.26-7.34 м (4H, Наром, Н2). Спектр ЯМР
5.3 Гц), 7.21-7.28 м (6H, Наром, Н6'), 7.40 д (1Н, Н2',
J 5.4 Гц), 7.66 к (1Н, =CH, J 5.3 Гц), 10.50 уш.с (1Н,
13С (125 МГц, CDCl3), δ, м.д.: 19.20 (СН3), 51.10
(NCH2), 64.04 (CH), 88.95 (CHCl), 108.16 (C6),
NH). Масс-спектр (ХИ, 250°С), m/z (Iотн, %): 298
111.37 (C3), 120.94 (C6a), 123.32 (C5), 126.20 (Cаром),
(100) [M + H]+. C16H15N3OS. Mвыч 297.0936.
), 129.54 (C2), 137.35
127.66 (Cаром), 128.84 (Cаром
4-Бензил-N'-[(1E)-2-метилпропилиден]-4H-
(Cаром), 145.99 (C3a), 151.64 (С=O), 158.86 (C=O).
тиено[3,2-b]пиррол-5-карбогидразид (8) получен
Масс-спектр (ХИ, 250°С), m/z (Iотн, %): 374 (100)
аналогично соединению 7 из 94 мг (0.347 ммоль)
[M + H]+, 338 (90) [M - Cl]+ (90). C18H16ClN3O2S.
гидразида 1 и 25 мг (0.347 ммоль) изомасляного
Mвыч 373.0652.
альдегида. После обработки очищали перекри-
4-Бензил-N-(3,3-дихлор-2-метил-4-оксо-
сталлизацией из смеси ацетон-петролейный эфир
азетидин-1-ил)-4H-тиено[3,2-b]пиррол-5-кар-
(1:1). Кристаллы белого цвета, т.пл. 170-172°С.
боксамид (11). К раствору 0.16 г (0.539 ммоль) ги-
Выход 90 мг (82%). ИК спектр, ν, см-1: 3230, 3100,
дразона 7 и 0.26 г (0.162 ммоль) дихлорацетилхло-
1700, 1642, 1560, 1522, 1496, 1456, 1391, 1346,
рида в 10 мл хлороформа при перемешивании до-
1299, 1250, 1224, 1203, 1185, 1100, 1063, 1028,
бавляли 0.21 г (1.616 ммоль) DIPEA. Реакционную
883, 838, 816, 783, 748, 719, 697, 668. Спектр ЯМР
массу кипятили с обратным холодильником до
1Н (500 МГц, CDCl3), δ, м.д.: 1.09 д (6Н, CH3, J
израсходования исходного соединения (контроль
6.8 Гц), 2.52-2.55 м (1H, CH), 5.87 с (2Н, CH2Ph),
методом ТСХ). Затем массу охлаждали до комнат-
7.09 с (1Н, Н6'), 7.11 д (1Н, Н3', J 5.3 Гц), 7.20-7.27
ной температуры, упаривали растворитель, оста-
м (5Наром), 7.40 д (1Н, Н2', J 5.3 Гц), 7.59 уш.с (1Н,
ток очищали колоночной хроматографией на SiO2
NH), 7.76 с (1Н, =СН). Спектр ЯМР 13С (125 МГц,
(элюент - петролейный эфир-этилацетат, 5:1).
CDCl3), δ, м.д.: 19.17 (CH3), 31.37 (СН), 49.73
Выход 0.15 г (68%). Желтое маслообразное веще-
(NCH2), 111.12 (C3', C6'), 121.50 (C6a'), 122.00 (C5'),
ство. ИК спектр, ν, см-1: 1683, 1679, 1629, 1533,
127.08 (Cаром), 127.14 (Cаром), 128.35 (Cаром), 128.30
1496, 1475, 1449, 1435, 1379, 1265, 1212, 1194,
(C2'), 138.50 (Cаром), 144.60 (C3a'), 158.00 (C=O).
1185, 1047, 818, 796, 733, 724. Спектр ЯМР 1Н
Масс-спектр (ХИ, 250°С), m/z (Iотн, %): 326 (100)
(500 МГц, CDCl3), δ, м.д.: 1.63 д (3Н, CH3, J 5.4 Гц),
[M + H]+. C18H19N3OS. Mвыч 325.1249.
5.83 д (2Н, CH2Ph, J 8.6 Гц), 6.32 к (1Н, CH, J
4-Бензил-N-(3-хлор-2-метил-4-оксоазетидин-
5.4 Гц), 6.81 с (1Н, Н6), 7.14 д (1Н, Н3, J 5.4 Гц),
1-ил)-4H-тиено[3,2-b]пиррол-5-карбоксамид
7.18-7.25 м (3Наром), 7.29-7.32 м (2Наром), 7.51
(10). К раствору 90 мг (0.303 ммоль) гидразо-
д (1Н, Н2, J 5.4 Гц). Спектр ЯМР 13С (125 МГц,
на 7 и 61 мг (0.606 ммоль) хлорацетилхлорида в
CDCl3), δ, м.д.: 18.41 (СН3), 50.53 (NCH2), 64.62
10 мл хлороформа при перемешивании добав-
(CH), 88.95 (CCl2), 107.71 (C6), 111.0 (C3), 121.11
ляли 78 мг (6.06 ммоль) диизопропилэтиламина
(C6a), 123.15 (C5), 126.64 (Cаром), 127.32 (Cаром),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 9 2021
СИНТЕЗ ПРОИЗВОДНЫХ 4-БЕНЗИЛТИЕНО[3,2-b]ПИРРОЛА
1319
128.55 (Cаром), 129.43 (C2), 138.17 (Cаром), 146.06
(С4фурил), 111.72 (C3фурил), 120.70 (C6a),
123.25
(C3a), 151.36 (С=O), 158.56 (C=O). Масс-спектр
(C5), 126.74 (Cаром), 127.40 (Cаром), 128.60 (Cаром),
(ХИ, 250°С), m/z (Iотн, %): 408 (100) [M + H]+.
129.69 (C2), 138.09 (Cаром), 144.73 (С5фурил), 146.20
C18H15Cl2N3O2S. Mвыч 407.0262.
(C3a), 151.25 (С2фурил), 158.71 (C=O), 164.40 (С=О).
Масс-спектр (ХИ, 250°С), m/z (Iотн, %): 460 (461,
4-Бензил-N'-(дихлорацетил)-N'-изобутил-
462) (76) [M + H]+, 391 (30) [M - 2Cl]+, 332 (333,
4H-тиено[3,2-b]пиррол-5-карбогидразид (13) по-
332) (100). C21H15Cl2N3O3S. Mвыч 459.0211.
лучен по аналогичной для соединения 11 методи-
ке из 50 мг (0.154 ммоль) соединения 8 и 45 мг
ВЫВОДЫ
(0.615 ммоль) дихлорацетилхлорида с добавлени-
На основе гидразида 4-бензилтиено[3,2-b]пир-
ем 39 мг (0.615 ммоль) DIPEA. Выход 67 мг (52%).
рол-5-карбоновой кислоты получены δ-связанные
Бесцветное маслообразное вещество. ИК спектр,
с фрагментом 4-бензил[3,2-b]пиррол-5-ила бисге-
ν, см-1: 1684, 1631, 1532, 1496, 1474, 1449, 1438,
тероциклы и производные лактамной природы.
1393, 1370, 1357, 1263, 1212, 1194, 1178, 1087,
Полученные соединения 3, 4, 6 и 10-12 исследует-
1028, 979, 920, 802, 783, 735, 722. Спектр ЯМР
ся на предмет обнаружения противотуберкулезной
1Н (500 МГц, CDCl3), δ, м.д.: 0.82 д (3Н, CH3, J
и антибактериальной активностей.
6.8 Гц), 1.07 д (3Н, CH3, J 7.0 Гц), 1.26-1.36 м (2Н,
БЛАГОДАРНОСТИ
СН2), 2.37-2.43 м (1Н, СНMe), 5.83 c (2Н, CH2Ph),
6.14 д (1Н, CHCl2, J 2.5 Гц), 6.87 с (1Н, Н6), 7.18 д
Анализы выполнены на оборудовании ЦКП
(1Н, Н3, J 5.3 Гц), 7.16-7.17 м (2Наром), 7.23-7.25
«Химия» УфИХ УФИЦ РАН.
м (1Наром), 7.28-7.31 м (2Наром), 7.51 д (1Н, Н2',
ФОНДОВАЯ ПОДДЕРЖКА
J 5.4 Гц). Спектр ЯМР 13С (125 МГц, CDCl3), δ,
м.д.: 13.05 (CH3), 16.07 (CH3), 30.93 (CH), 50.52
Работа выполнена по теме
№ AAAA-
(CH2Ph), 64.78 (CH2), 94.89 (CHCl2), 107.75 (C6),
A20-120012090021-4 госзадания и при финансо-
111.02 (C3), 120.90 (C6a), 123.15 (C5),
126.58
вой поддержке Российского фонда фундаменталь-
(Cаром), 127.30 (Cаром), 128.52 (Cаром), 129.47 (C2),
ных исследований (проект № 19-33-90113).
138.17 (Cаром), 146.14 (C3a), 152.10 (C=O), 159.23
ИНФОРМАЦИЯ ОБ АВТОРАХ
(С=О). Масс-спектр (ХИ, 250°С), m/z (Iотн, %): 438
Торосян Седа Арамовна, ORCID: http://
(439, 440) (100) [M + H]+. C20H21Cl2N3O2S. Mвыч
orcid.org/0000-0002-9555-7228
437.0732.
Нуриахметова Зоя Фазлиахметовна, ORCID:
4-Бензил-N-[3,3-дихлор-2-(2-фурил)-4-оксо-
азетидин-1-ил]-4H-тиено[3,2-b]пиррол-5-кар-
боксамид (12) получен аналогично соединению
Востриков Николай Сергеевич, ORCID: http://
11 из 0.13 г (0.372 ммоль) соединения 9 [14] и
orcid.org/0000-0003-1782-8675
0.22 г (1.477 ммоль) дихлорацетилхлорида с ис-
Гималова Фануза Арслановна, ORCID: http://
пользованием 0.19 г (1.487 ммоль) DIPEA. Выход
orcid.org/0000-0002-5176-1227
0.1 г (59%). Желтое маслообразное вещество. ИК
спектр, ν, см-1: 1761, 1694, 1631, 1595, 1532, 1496,
КОНФЛИКТ ИНТЕРЕСОВ
1472, 1448, 1436, 1370, 1302, 1259, 1211, 1179,
Авторы заявляют об отсутствии конфликта ин-
1088, 1014, 974, 927, 806, 751, 730, 724. Спектр
тересов.
ЯМР 1Н (300 МГц, CDCl3), δ, м.д.: 5.85 д (2Н,
СПИСОК ЛИТЕРАТУРЫ
CH2Ph), 5.86 с (1Н, H2'), 6.49 д.д (1Н, Н4фурил, J
1.5, 3.1 Гц), 6.76 д (1H, Н3фурил, J 3.3 Гц), 6.89 c
1. Farghaly A.-R., Haider N., Lee D.-H. J. Heterocycl.
(1Н, Н6), 7.15 д (1Н, Н3, J 5.4 Гц), 7.18 д (1Наром, J
Chem. 2012, 49, 799-805. doi 10.1002/jhet.864
6.3 Гц), 7.26-7.34 м (4Наром), 7.50 д (1Н, Н2, J
2. Schlecker R., Thieme P.C. Tetrahedron. 1988, 44,
5.4 Гц), 7.62 c (1H, Н5фурил). Спектр ЯМР 13С
3289-3294. doi 10.1016/S0040-4020(01)85962-7
(125 МГц, CDCl3), δ, м.д.: 50.80 (NCH2), 64.65
3. Nagalakshmi G. Indian J. Pharm. Sci. 2008, 70, 49-55.
(C2'), 84.17 (CCl2), 108.00 (C6), 110.86 (C3), 111.02
doi 10.4103/0250-474X.40331
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 9 2021
1320
ТОРОСЯН и др.
4. Xiao H., Li P., Hu J., Li R., Wu L., Guo D. Appl.
10. Mullican M.D., Wilsonj M.W., Connor D.T., Kost-
Biochem. Biotechnol.
2014,
172,
2188-2196. doi
lan C.R., Schrier D.J., Dyer R.D. J. Med. Chem. 1993,
10.1007/s12010-013-0657-5.
36, 1090-1099. doi 10.1021/jm00060a017
5. Moulin A., Bibian M., Blayo A.-L., El Habnouni S.,
11. Berks A.H. Tetrahedron. 1996, 52, 331-375. doi
Martinez J., Fehrentz J.-A. Chem. Rev. 2010, 110,
1809-1827. doi 10.1021/cr900107r
10.1016/0040-4020(95)00842-X
6. Торосян С.А., Нуриахметова З.Ф., Гималова Ф.А.,
12. Агекян A.A., Мкрян Г.Г., Паносян Г.А., Сафа-
Мифтахов М.С. ЖОрХ. 2020, 56, 1369-1375. doi
рян А.С., Аракелян А.Г., Степанян Г.М. ЖОрХ.
10.1134/S1070428020090079
2020, 56, 283-289. doi 10.1134/S1070428020020177
7. Banday M.R., Mattoo R.H., Rauf A. J. Chem. Sci.
2010, 122, 177-182. doi 10.1007/s12039-010-0019-6
13. Abdel-Aziz H.A., Hamdy N.A., Farag A.M.,
8. Jin L., Chen J., Song B., Chen Z., Yang S., Li Q.,
Fakhr I.M.I. J. Chin. Chem. Soc. 2007, 54, 1573-
Hu D., Xu R. Bioorg. Med. Chem. Lett. 2006, 16,
1582. doi 10.1002/JCCS.200700222
5036-5040. doi 10.1016/j.bmcl.2006.07.048
14. Торосян С.А., Нуриахметова З.Ф., Гималова Ф.А.,
9. Dolman S.J., Gosselin F., O’Shea P.D., Davies I.W.
Мифтахов М.С. ЖОрХ. 2021, 57, 115-120. doi
J. Org. Chem. 2006, 71, 9548-9551. doi 10.1021/
jo0618730
10.31857/S0514749221010134
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 9 2021
СИНТЕЗ ПРОИЗВОДНЫХ 4-БЕНЗИЛТИЕНО[3,2-b]ПИРРОЛА
1321
Synthesis of 4-Benzylthieno[3,2-b]pyrrol Derivatives
with Fragments of 1,3,4-Oxadiazol and Azetidinone
S. A. Torosyan, Z. F. Nuriakhmetova, N. S. Vostrikov, and F. A. Gimalova*
Ufa Institute of Chemistry, Ufa Federal Research Centre of the Russian Academy of Sciences,
prosp. Oktyabrya, 69, Ufa, 450054 Russia
*e-mail: fangim@anrb.ru; fanuza_gimalova@mail.ru
Received April 28, 2021; revised May 10, 2021; accepted May 12, 2021
The transformations in the hydrazide moiety of 4-benzylthieno[3,2-b]pyrrole-5-carbohydrazide lead to the
δ-linked with the 4-benzylthieno[3,2-b]pyrrol-5-yle fragment bis-heterocycles and lactam derivatives.
Keywords: 4-benzyl-4H-thieno[3,2-b]pyrrole-5-carboxylic acid, hydrazides, 1,3,4-oxadiazols, azetidinone,
synthesis
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 9 2021