ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 1, с. 36-50
УДК 547.31:542.913:577.181
РЕАКЦИЯ ФИШЕРА В СИНТЕЗЕ НОВЫХ
ТРИТЕРПЕНОВЫХ ИНДОЛОВ ФУЗИДАНОВОГО РЯДА
© 2022 г. E. В. Салимова*, Л. В. Парфенова
Институт нефтехимии и катализа РАН- обособленное структурное подразделение
ФГБНУ «Уфимского федерального исследовательского центра РАН»,
Россия, 450075 Уфа, просп. Октября, 141
*e-mail: salimovaev@mail.ru
Поступила в редакцию 02.08.2021 г.
После доработки 22.08.2021 г.
Принята к публикации 26.08.2021 г.
Реакция 3,11-диоксопроизводных фузидовой кислоты и ее эфиров с фенилгидразином в условиях реакции
Фишера проходила с высокой хемоселективностью по положению 3 молекулы с образованием индолов
фузидановых тритерпеноидов. Вовлечение в реакцию 3-хлорфенилгидразинов в аналогичных условиях
приводило к получению смеси 2 изомеров: 6-хлор- и 4-хлорпроизводных в соотношении 3:2. В результате
взаимодействия фузидановых кетонов с 2,4-динитрофенилгидразином были выделены гидразонпроизво-
дные фузиданового ряда. В ходе изучения биологической активности полученных соединений выявлены
производные, обладающие высокой антибактериальной активностью в отношении Staphylococcus aureus
(MRSA) с минимальной ингибирующей концентрацией ≤ 0.25 мкг/мл.
Ключевые слова: тритерпеноиды, фузидовая кислота, бензиловый эфир, пропаргиловый эфир, реакция
Фишера, индолы, гидразоны
DOI: 10.31857/S0514749222010037
ВВЕДЕНИЕ
митомицин (продуцируется культурой грибов
Streptomyces caespitosus) [20], эллиптицин (алка-
Индольное ядро является структурным элемен-
лоид деревьев видов Ochrosia elliptica и Rauvolfia
том многих лекарственных средств, агрохимика-
sandwicensis) [21] и нортопсентины (продуценты
тов, современных функциональных материалов и
губок Spongosorites ruetzleri) [22] обладают высо-
биологически активных природных молекул [1].
кой противоопухолевой активностью.
Данный гетероцикл входит в структуру более чем
3000 природных соединений и 40 лекарственных
Реакция Фишера является простым и удобным
препаратов [2, 3]. Благодаря своим свойствам,
синтетическим методом получения индолов из
производные индола нашли широкое применение
арилгидразинов и альдегидов или кетонов в при-
в медицинской практике как эффективные пре-
сутствии кислот (протонных и Льюиса) [23-25]. В
параты с разнообразной фармакологической ак-
настоящей работе мы осуществили синтез индо-
тивностью, в том числе противоопухолевой [4-7]
лов в условиях реакции Фишера, используя в каче-
(например, «Brivanib» [8], PF-06840003 (IPD) [9] и
стве карбонильной компоненты 3,11-диоксопроиз-
«Rucaparib» [10]), противовирусной [11], противо-
водные эфиров фузидовой кислоты.
воспалительной (например, индометацин) [12-14],
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
антидепрессантной [15], антигипертензивной [16],
антибактериальной [17] и др. [18, 19]. Некоторые
Синтез 3,11-диоксопроизводных фузиданового
встречающиеся в природе индолы также обла-
ряда был осуществлен в 2 стадии: взаимодействи-
дают биологической активностью. Например,
ем фузидовой кислоты 1 с алкил- или арилгалоге-
36
РЕАКЦИЯ ФИШЕР
А В СИНТЕЗЕ НОВЫХ ТРИТЕРПЕНОВЫХ ИНДОЛОВ
37
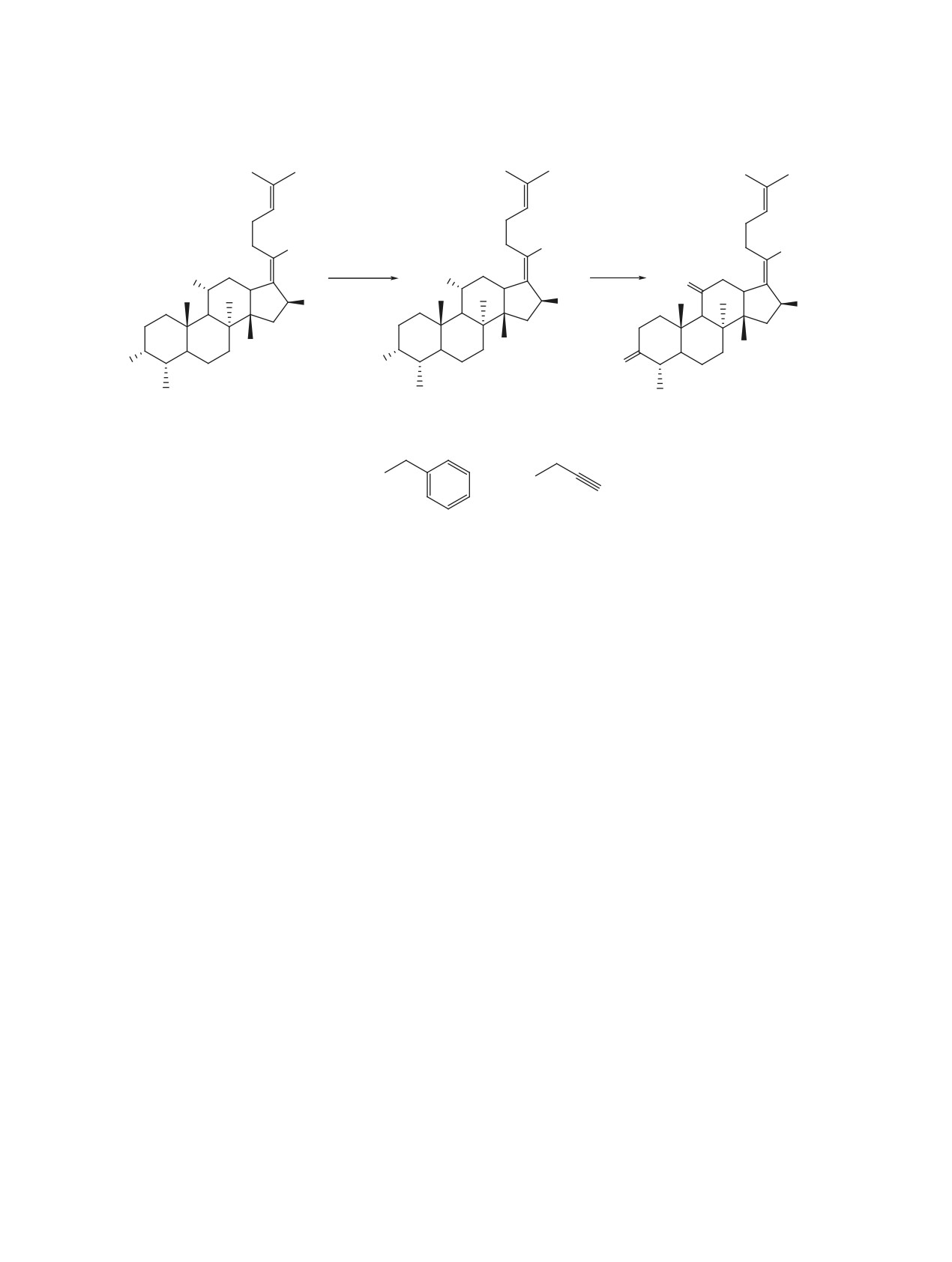
Схема 1
CO2H
CO2R
CO2R
R-Hal
CrO3
HO
HO
O
(CH3)2CO
AcOH
OAc
OAc
OAc
HO
HO
O
1
2-4, 97-99%
5-7, 78-95%
Hal = I, Br.
1'
3'
2'
4'
1'
R = Me (2, 5);
(3, 6);
2'
(4, 7).
7'
5'
3'
6'
нидами (йодметан, пропаргил- или бензилбромид)
HMBC коррелирует с атомами С-2, С-3, С-4, С-1'',
и последующим окислением полученных тритер-
С-2'', С-3'', что однозначно доказывает образование
пеновых эфиров 2-4 хромовым ангидридом в ук-
индольного цикла. В спектре ЯМР 13С индолов
сусной кислоте, в результате чего выделили дике-
8-13, помимо сигналов ароматических углерод-
тоны фузиданового ряда 5-7 с выходами 78-95%
ных атомов, регистрируются сигналы атомов С-2
(схема 1).
и С-3 двойной связи в интервале δС 110.30-110.49
и 136.39-138.29 м.д., соответственно, в зависимо-
Диоксопроизводные 5-7 вовлекали во взаи-
сти от молекулы.
модействие с 3 эквивалентами фенилгидразина в
среде ледяной уксусной кислоты при кипячении.
При вовлечении в реакцию Фишера 3,11-диок-
В результате реакции получали 11-оксоиндолза-
сопроизводного фузидовой кислоты 14, помимо
образования индольного цикла, параллельно про-
мещенные производные 8-10 с выходами 80-85%.
исходит гидролиз 16-ацетоксигруппы до гидрок-
Реакция проходила хемоселективно по кетогруппе
сильной и последующая циклизация карбоксиль-
в положении 3 молекулы, 11-кето-функция в реак-
ной функции при С-21 с вновь образовавшейся
цию циклизации не вступала. Взаимодействие со-
гидроксильной группой при С-16, в результате
единений 5-7 с 3-хлорфенилгидразином в анало-
которой образуется лактонный цикл. После выде-
гичных условиях приводило к получению смеси 2
ления и очистки реакционной массы с помощью
изомеров: 6-хлор- и 4-хлориндолфузиданов 11-13
колоночной хроматографии были выделены ин-
с преимущественным образованием первого (со-
долы 15, 16 с выходами 75 и 78%, соответственно
отношение 3:2) с суммарными выходами от 75 до
(схема 3). Подтверждением прошедших превраще-
82% (схема 2).
ний является тот факт, что в спектре ЯМР 1Н со-
Присутствие индольного фрагмента в молеку-
единений 15 и 16 отсутствуют сигналы метильной
ле подтверждается наличием сигналов протонов и
группы ацетатной функции при δ 1.98 м.д., а так-
углеродных атомов бензольного кольца в спектрах
же наблюдается сдвиг сигнала протона при С-16
ЯМР 1Н и 13С соединений 8-13, а также сигнала
в более сильное поле по сравнению с исходным
протонов NH-группы, который регистрируется
соединением. Кроме того, образование лактонного
в виде уширенного синглета в области δH 7.80-
кольца приводит к сдвигу сигналов С-16 и С-21 в
7.99 м.д., в зависимости от структуры тритерпено-
спектре ЯМР 13С в более слабое поле (δС 81.65 и
вого остова. Протон NH-группы в спектрах 1H-13C
175.85 м.д. для соединения 15; 81.61 и 175.80 м.д.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
38
САЛИМОВА, ПАРФЕНОВА
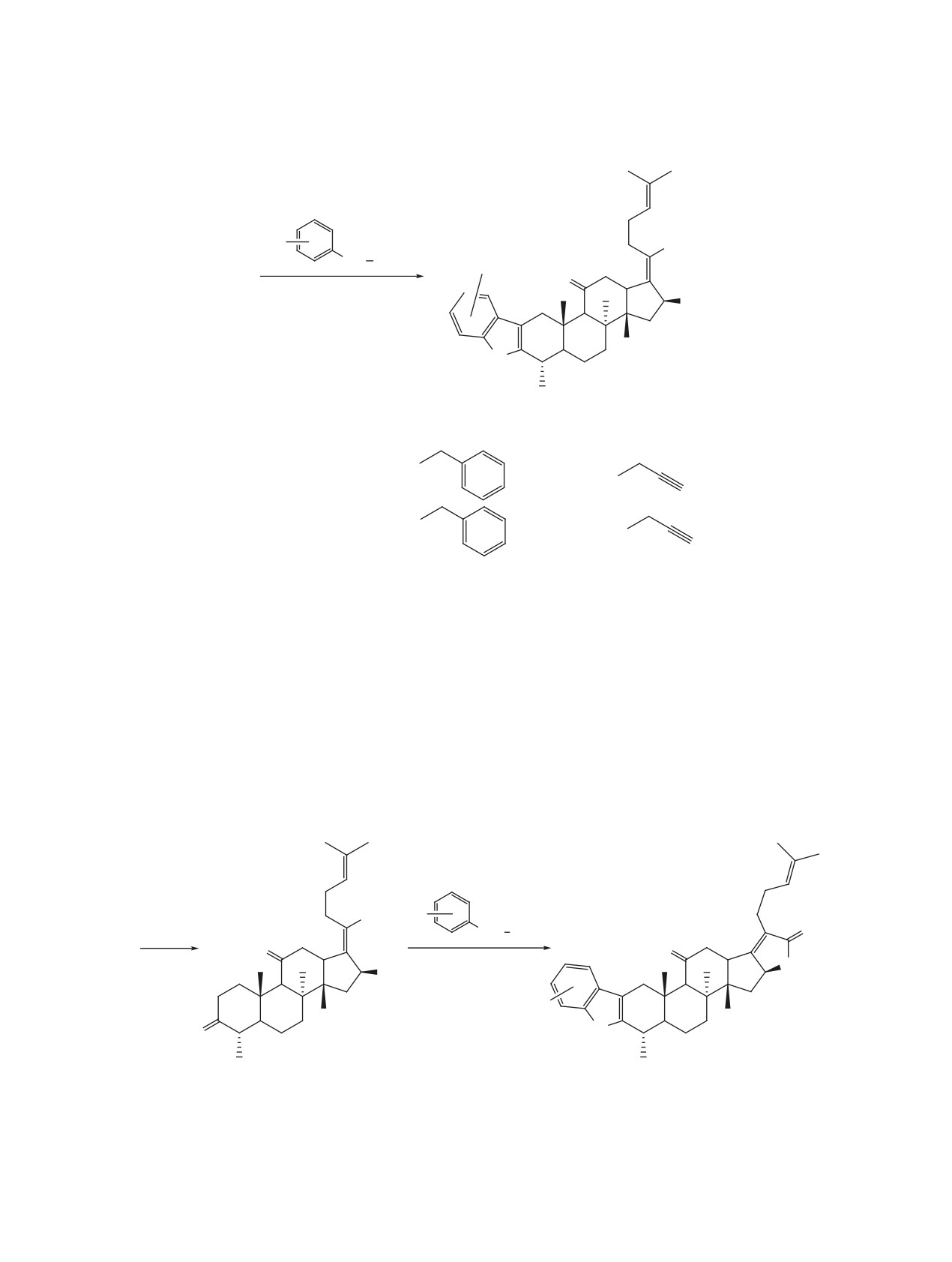
Схема 2
R1
CO2R
NH
NH2
R1
5-7
O
AcOH
5''
6''
OAc
R1 = H, 3-Cl.
4''
1''
3''
2''
N
H
8-10, 80-85%
11-13, 75-82%
6-Cl : 4-Cl = 3 : 2
R1 = H, R = Me (8); R1 = H, R =
(9); R1 = H, R =
(10);
R1 = Cl, R = Me (11); R1 = Cl, R =
(12); R1 = Cl, R =
(13).
для соединения 16) по сравнению с таковыми в ис-
фузидановых тритерпеноидов 17-20 с выходами
ходном соединении 14 (δС 74.15 и 174.25 м.д.). В
80-87% (схема 4). В спектрах ЯМР 13С соедине-
спектрах HMBC соединений 15 и 16 присутствуют
ний 17-20 регистрируются сигналы атома С-3,
кросс-пики между протоном при С-16 и карбок-
связанного двойной связью с атомом азота, при δС
сильным углеродом С-21, что также указывает на
166.54-166.65 м.д. 3(Z)-Конфигурация получен-
образование лактонного цикла.
ных гидразонпроизводных 17-20 была установле-
При вовлечении 3,11-дикетонов 5-7 и 14 в ре-
на на основании спектров NOESY, в которых на-
акцию Фишера с 2,4-динитрофенилгидразином
блюдались кросс-пики между протоном при атоме
образование индольного цикла не происходило. В
азота гидразонового фрагмента и протонами СН3-
результате были выделены гидразонпроизводные
группы в положении 28 молекулы.
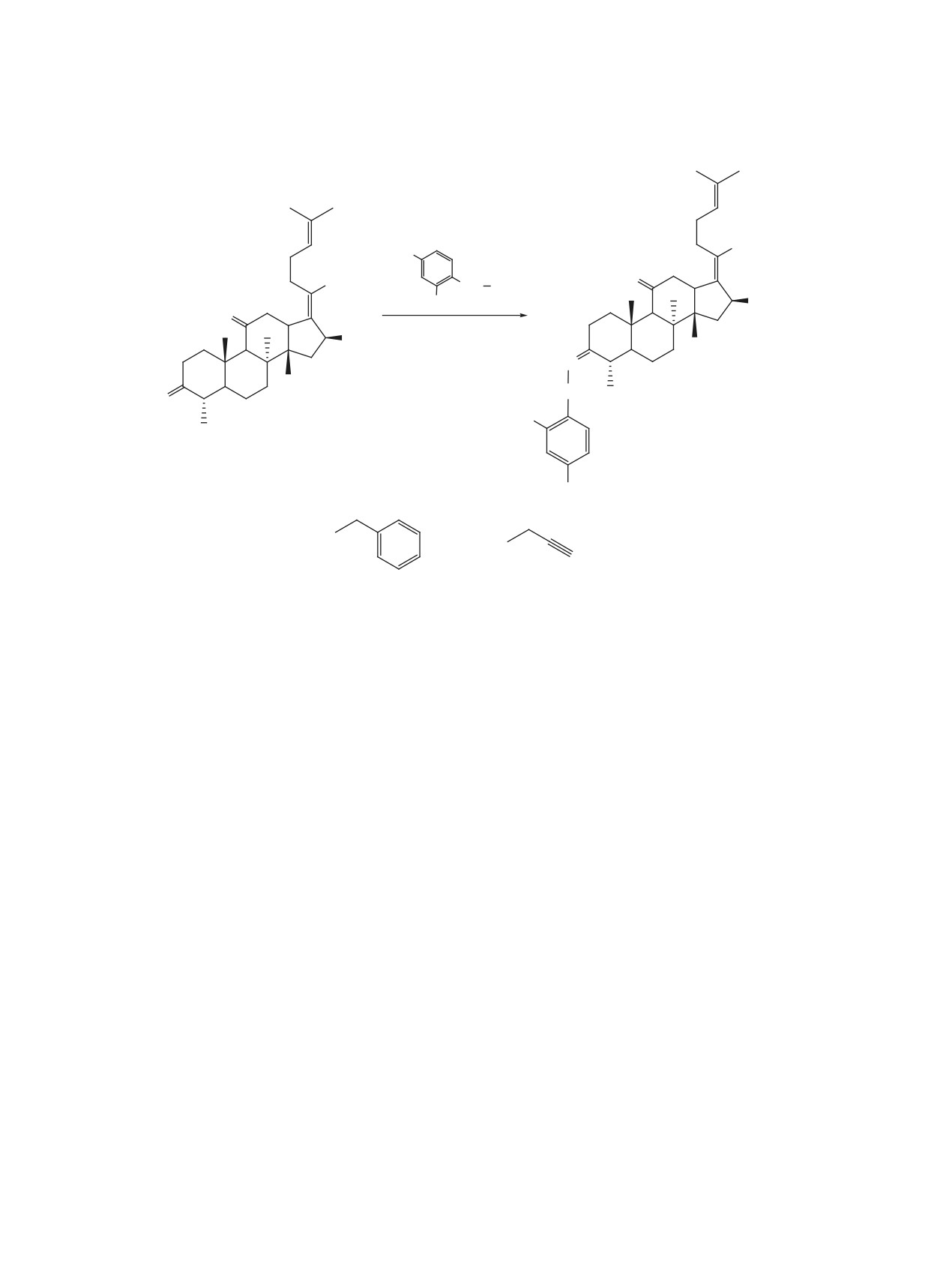
Схема 3
CO2H
R
O
CrO3
NH NH2
1
O
O
21
AcOH
AcOH
O
OAc
16
R = H, 3-Cl.
R
N
O
H
14
15, 16, 75-78%
R = H (15);
R = Cl (16).
6-Cl : 4-Cl = 3 : 2
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
РЕАКЦИЯ ФИШЕР
А В СИНТЕЗЕ НОВЫХ ТРИТЕРПЕНОВЫХ ИНДОЛОВ
39
Схема 4
CO2R
O2N
O
CO2R
NH NH2
O2N
OAc
O
AcOH
OAc
N
NH
28
O
1''
O2N
2''
6''
3''
5''
4''
NO2
5-7, 14
17-20, 80-87%
R = Me (5, 17); R =
(6, 18); R =
(7, 19); R = H (14, 20).
Была изучена антибактериальная активность
двумерные спектры ЯМР (COSY, HSQC, HMBC,
in vitro полученных соединений в Университете
NOESY) регистрировали с использованием стан-
молекулярной биологии Квинсленда (Австралия)
дартных импульсных последовательностей. Тем-
на 5 бактериальных штаммах: Escherichia coli,
пературу плавления определяли на приборе Stuart
Klebsiella pneumoniae, Acinetobacter baumannii,
SMP3 (Германия). Оптические углы измеряли на
Pseudomonas aeruginosa и Staphylococcus aureus
поляриметре Perkin-Elmer 341 (Германия). Масс-
(MRSA), а также 2 штаммах грибков: Candida
спектры MALDI TOF/TOF получали на спектроме-
albicans и Cryptococcus neoformans. Результаты
тре Bruker Autoflex TM III Smartbeam (Германия)
биологического скрининга показали, что индол-
с использованием матрицы 3-(4-гидрокси-3,5-ди-
производные 8 и 15 [26], а также пропаргиловый
метоксифенил)проп-2-еновой кислоты (синапи-
эфир 4 в концентрации 0.25 мкг/мл ингибирова-
новая кислота). ТСХ осуществляли на пластинах
ли рост более 80% грамположительных бактерий
Сорбфил (ЗАО Сорбполимер, Россия), исполь-
Staphylococcus aureus (MRSA), что сопоставимо
зуя систему растворителей хлороформ-метанол,
с антибактериальным действием фузидовой кис-
40:1. Вещества обнаруживали 10%-ным раство-
лоты. Гемолитическая активность соединений 4,
ром серной кислоты с последующим нагревани-
8 и 15 в 1.5 раза оказалась ниже данного показа-
ем при 100-120°С в течение 2-3 мин. Для коло-
теля нативного антибиотика, а токсичность была
ночной хроматографии использовали силикагель
сравнима с токсичностью фузидовой кислоты (см.
(фракция 50-160 мкм, ЗАО Сорбполимер, Россия).
таблицу).
Использовали коммерчески доступные реагенты:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
йодметан (Sigma-Aldrich), бензилбомид, пропар-
гилбромид, фенилгидразин, 3-хлорфенилгидразин
Спектры ЯМР 1Н и 13С регистрировали на спек-
и 2,4-динитрофенилгидразин (Acros Organics).
трометре Bruker Avance 400 (Германия) [400.13
(1H), 100.62 (13C) МГц] и на спектрометре Bruker
Соединения 2-4 (общая методика). К смеси
Avance II 500 HD Ascend (Германия) [500.17 (1H),
0.5 г (0.95 ммоль) фузидовой кислоты 1 и 0.19 г
125.78 (13C) МГц]. Образцы были приготовлены
(0.72 ммоль) свежепрокаленного K2CO3 в 30 мл
в стандартных ампулах диаметром 5 мм. Одно- и
сухого ацетона добавляли по каплям 0.95 ммоль
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
40
САЛИМОВА, ПАРФЕНОВА
Антибактериальная, цитотоксическая и гемолитическая активность производных 4, 8, 15 и фузидовой кислоты
Антибактериальная активность
Цитотоксическая активность
Гемолитическая активность
Соединение
Staphylococcus aureus
HEK293 (ATCC CRL-1573)
MIC, мкг/млa
Dmax, %b
CC50, мкг/млc
Dmax, %
HC50, мкг/млd
Dmax, %
≤0.25
88.2
>32
43.7
>32
6.3
4
≤0.25
81.2
>32
48.4
>32
7.0
≤0.25
100.2
>32
7.8
>32
2.1
8
≤0.25
101.3
>32
14.6
>32
2.3
≤0.25
100.7
26.7
60.5
>32
2.7
15
≤0.25
98.7
>32
65.3
>32
2.1
≤0.25
97.7
>32
25.1
>32
10.0
ФК
≤0.25
99.2
>32
41.1
>32
9.7
Ванкомицин
1
100
-
-
-
-
Тамоксифен
-
9
50
-
-
Мелиттин
-
-
-
8.5
50
a MIC (минимальная ингибирующая концентрация) - наименьшая концентрация, при которой было обнаружено полное ингиби-
рование бактерий. Соединения классифицированы как активные при MIC ≤ 16 мкг/мл в любой реплике (n = 2 на разных план-
шетах)
b Dmax - максимальная доля ингибирования
c СС50 - концентрация исследуемого вещества, при которой происходит гибель 50% клеточной линии эмбриональных почек че-
ловека HEK293 (ATCC CRL-1573)
d HC50 - концентрация исследуемого вещества, вызывающая 50% гемолиз эритроцитов
соответствующего алкил- или арилгалогенида
(3Н, Н27), 1.54-1.68 м (1Н, Н6), 1.64 с (3Н, Н26),
(0.14 г иодметана, 0.16 г бензилбромида или 0.11 г
1.68-1.79 м (1Н, Н7), 1.70-1.78 м (1Н, Н2), 1.77-
пропаргилбромида). Реакционную массу кипятили
1.89 м (1Н, Н12), 1.81-1.90 м (1Н, Н1), 1.94 с [3Н,
2 ч, затем охлаждали. Смесь выливали в ледяную
О-С(О)СН3], 1.98-2.07 м (1Н, Н2), 2.05-2.19 м
воду, выпавший осадок отфильтровывали, промы-
(1Н, Н4), 2.11-2.26 м (1Н, Н15, 2Н, Н23), 2.32 д (1Н,
вали на фильтре 50 мл H2O и сушили на воздухе.
Н12, J 12.5 Гц), 2.40-2.69 м (2Н, Н22), 3.05 д (1Н,
Н13, J 11.5 Гц), 3.70-3.76 м (1Н, Н3), 4.30-4.36 м
Метил-(2Z)-2-[(3α,4α,8α,11α,14β,16β)-16-(аце-
(1Н, Н11), 4.94 д (1Н, Н1', J 12.3 Гц), 5.08 т (1Н,
тилокси)-3,11-дигидрокси-4,8,10,14-тетраме-
Н24, J 6.2 Гц), 5.22 д (1Н, Н1', J 12.3 Гц), 5.89 д (1Н,
тилгонан-17-илиден]-6-метилгепт-5-еноат
(2).
Н16, J 8.5 Гц), 7.29-7.42 м (5H, H-Ar). Спектр ЯМР
Выход
0.49 г
(97%), порошок белого цвета,
13С (CDCl3), δ, м.д.: 15.98 (С28), 17.71 (С27), 17.80
т.пл. 152-154°С, [α]D20 -10 (c 0.93, CHCl3). Спек-
(С18), 20.90 (С6), 20.96 [О-С(О)СН3], 23.08 (С19),
тральные характеристики приведены в [27].
23.87 (С30), 25.71 (С26), 28.43 (С2), 29.03 (С23),
Бензил-(2Z)-2-[(3α,4α,8α,11α,14β,16β)-16-
29.92 (С22), 30.15 (С1), 32.07 (С7), 35.56 (С12), 35.86
(ацетилокси)-3,11-дигидрокси-4,8,10,14-тетра-
(С4), 36.45 (С5), 36.92 (С10), 39.00 (С15), 39.46 (С8),
метилгонан-17-илиден]-6-метилгепт-5-еноат
43.99 (С13), 48.68 (С14), 49.30 (С9), 66.35 (С1'), 68.23
(3). Выход 0.57 г (98%), порошок белого цвета,
(С11), 71.41 (С3), 74.45 (С16), 123.09 (С24), 128.23
т.пл. 97-99°C, [α]D20 -15 (c 0.97, CHCl3). Спектр
(С5'), 128.47 (С4', С6'), 128.55 (С3', С7'), 130.30 (С20),
ЯМР 1Н (CDCl3), δ, м.д.: 0.92 д (3Н, Н28, J 6.8
132.50 (С25), 135.80 (С2'), 148.55 (С17), 169.96 (С21),
Гц), 0.93 с (3Н, Н18), 0.98 с (3Н, Н19), 1.03-1.15 м
170.45 [О-С(О)СН3]. Масс-спектр (MALDI TOF/
(1Н, Н6), 1.07-1.19 м (1Н, Н7), 1.30 д (1Н, Н15, J
TOF), m/z (Iотн, %): 629 (16) [М + Na]+, 645 (100)
14.5 Гц), 1.38 с (3Н, Н30), 1.46-1.54 м (1Н, Н1),
[M + K]+. Вычислено, %: С 75.21; Н 8.97. С38Н54O6.
1.49-1.61 м (1Н, Н5), 1.52-1.59 м (1Н, Н9), 1.53 с
Найдено, %: С 75.24; Н 8.96.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
РЕАКЦИЯ ФИШЕР
А В СИНТЕЗЕ НОВЫХ ТРИТЕРПЕНОВЫХ ИНДОЛОВ
41
Проп-2-ин-1-ил-(2Z)-2-[(3α,4α,8α,11α,14β,-
(c 1.62, CHCl3). Спектральные характеристики
16β)-16-(ацетилокси)-3,11-дигидрокси-4,8,10,14-
приведены в [27].
тетраметилгонан-17-илиден]-6-метилгепт-5-
Бензил-(2Z)-2-[(4α,8α,14β,16β)-16-(ацетил-
еноат (4). Выход 0.53 г (99%), порошок белого
окси)-4,8,10,14-тетраметил-3,11-диоксогонан-
цвета, т.пл. 118-120°С, [α]D20 -13 (c 0.93, CHCl3).
17-илиден]-6-метилгепт-5-еноат
(6).
Получен
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.91 с (3Н, Н18),
из 1.14 г (1.88 ммоль) соединения 3. Выход 0.77 г
0.92 д (3Н, Н28, J 7.1 Гц), 0.98 с (3Н, Н19), 0.99-1.17
(78%), порошок белого цвета, т.пл. 101-103°C,
м (1Н, Н6), 1.05-1.19 м (1Н, Н7), 1.26-1.39 м (1Н,
[α]D20 +68 (c 0.98, CHCl3). Спектр ЯМР 1Н (CDCl3),
Н15), 1.38 с (3Н, Н30), 1.45-1.61 м (1Н, Н5), 1.50
δ, м.д.: 0.96 д (3Н, Н28, J 6.5 Гц), 0.97 (3Н, Н19),
д (1Н, Н1, J 12.1 Гц), 1.51-1.59 м (1Н, Н9), 1.53-
1.01-1.13 м (1Н, Н6), 1.09-1.21 м (1Н, Н7), 1.13 с
1.71 м (1Н, Н6), 1.61 с (3Н, Н27), 1.63-1.78 м (1Н,
(3Н, Н18), 1.35 д (1Н, Н15, J 14.5 Гц), 1.41-1.57 м
Н7), 1.65-1.79 м (1Н, Н2), 1.68 с (3Н, Н26), 1.76-
(1Н, Н6), 1.44 с (3Н, Н27), 1.54 с (3Н, Н26), 1.73 т (1Н,
1.88 м (1Н, Н12), 1.80-1.93 м (1Н, Н2), 1.98 с [3Н,
Н5, J 12.1 Гц), 1.85 с [3Н, О-С(О)СН3], 1.86-1.95
О-С(О)СН3], 2.02-2.24 м (2Н, Н23), 2.03-2.16 м
м (1Н, Н1), 1.88-2.05 м (2Н, Н23), 1.92-2.04 м (1Н,
(1Н, Н4), 2.09-2.21 м (1Н, Н1), 2.14-2.26 м (1Н,
Н7), 2.03-2.16 м (1Н, Н15), 2.06-2.15 м (1Н, Н4),
Н15), 2.32 д (1Н, Н12, J 13.0 Гц), 2.40-2.72 м (2Н,
2.22-2.34 м (1Н, Н2), 2.26-2.40 м (2Н, Н22), 2.35-
Н22), 2.43-2.51 м (1Н, Н3'), 3.06 д (1Н, Н13, J
2.45 м (1Н, Н2), 2.54 с (1Н, Н9), 2.58-2.66 м (1Н,
11.5 Гц), 3.68-3.77 м (1Н, Н3), 4.29-4.38 м (1Н,
Н12), 2.60-2.70 м (1Н, Н1), 2.77-2.86 м (1Н, Н12,
Н11), 4.60 д.д (1Н, Н1', J 1.3, 15.5 Гц), 4.71 д.д (1Н,
1Н, Н13), 4.88 д (1Н, Н1', J 12.3 Гц), 4.97 т (1Н, Н24,
Н1', J 1.3, 15.5 Гц), 5.10 т (1Н, Н24, J 6.5 Гц), 5.86
J 6.5 Гц), 5.13 д (1Н, Н1', J 12.3 Гц), 5.85 д (1Н, Н16,
д (1Н, Н16, J 8.5 Гц). Спектр ЯМР 13С (CDCl3), δ,
J 8.5 Гц), 7.18-7.30 м (5H, H-Ar). Спектр ЯМР 13С
м.д.: 15.96 (С28), 17.77 (С27), 17.79 (С18), 20.87 (С6),
(CDCl3), δ, м.д.: 13.99 (С28), 16.90 (С18), 17.63 (С27),
21.08 [О-С(О)СН3], 23.04 (С19), 23.88 (С30), 25.74
20.75 [О-С(О)СН3], 21.12 (С6), 22.34 (С19), 23.83
(С26), 28.36 (С23), 28.92 (С22), 29.88 (С2), 30.12 (С1),
(С30), 25.65 (С26), 27.88 (С23), 28.95 (С22), 32.33
32.06 (С7), 35.54 (С12), 35.88 (С4), 36.42 (С5), 36.89
(С1), 33.21 (С7), 36.49 (С10), 36.60 (С2), 38.01 (С15),
(С10), 38.99 (С15), 39.45 (С8), 44.19 (С13), 48.67
40.65 (С8), 44.32 (С12), 44.67 (С4), 46.07 (С5), 46.66
(С14), 49.28 (С9), 51.71 (С1'), 68.21 (С11), 71.42 (С3),
(С13), 48.56 (С14), 58.10 (С9), 66.41 (С1'), 74.00 (С16),
74.40 (С16), 74.87 (С2'), 77.62 (С3'), 122.98 (С24),
122.60 (С24), 128.27 (С5'), 128.47 (С4', С6'), 128.51
129.57 (С20), 132.69 (С25), 149.79 (С17),
169.07
(С3', С7'), 131.51 (С20), 132.77 (С25), 135.54 (С2'),
(С21), 170.33 [О-С(О)СН3]. Масс-спектр (MALDI
145.82 (С17), 168.98 (С21), 169.99 [О-С(О)СН3],
TOF/TOF), m/z (Iотн, %): 577 (64) [М + Na]+, 593
209.40 (С11), 215.15 (С3). Масс-спектр (MALDI
(100) [M + K]+. Вычислено, %: С 73.61; Н 9.08.
TOF/TOF), m/z (Iотн, %): 625 (100) [М + Na]+, 641
С34Н50O6. Найдено, %: С 73.57; Н 9.06.
(78) [M + K]+. Вычислено, %: С 75.71; Н 8.36.
Соединения 5-7, 14 (общая методика). К рас-
С38Н50O6. Найдено, %: С 75.74; Н 8.35.
твору 1.88 ммоль фузидовой кислоты 1 или ее со-
Проп-2-ин-1-ил-(2Z)-2-[(4α,8α,14β,16β)-16-
ответствующего эфира 2-4 в 20 мл уксусной кис-
(ацетилокси)-4,8,10,14-тетраметил-3,11-диоксо-
лоты добавляли 0.6 г (6 ммоль) хромового анги-
гонан-17-илиден]-6-метилгепт-5-еноат (7). По-
дрида. Смесь перемешивали при комнатной тем-
лучен из 1.04 г (1.88 ммоль) соединения 4. Выход
пературе 30 мин и выливали в воду. Реакционную
0.93 г (90%), порошок белого цвета, т.пл. 115-
массу экстрагировали этилацетатом, промывали
117°С, [α]D20 +70 (с 1.12, CHCl3). Спектр ЯМР 1Н
водой и сушили над CaCl2. Растворитель упарива-
(CDCl3), δ, м.д.: 1.05 с (3Н, Н19), 1.06 д (3Н, Н28,
ли при пониженном давлении.
J 6.8 Гц), 1.10-1.22 м (1Н, Н6), 1.12-1.27 м (1Н,
Метил-(2Z)-2-[(4α,8α,14β,16β)-16-(ацетил-
Н7), 1.15 с (3Н, Н30), 1.19 с (3Н, Н18), 1.45 д (1Н,
окси)-4,8,10,14-тетраметил-3,11-диоксогонан-
Н15, J 14.0 Гц), 1.55-1.68 м (1Н, Н6), 1.59 с (3Н,
17-илиден]-6-метилгепт-5-еноат (5). Получен из
Н27), 1.66 с (3Н, Н26), 1.81 т (1Н, Н5, J 11.5 Гц),
1 г (1.88 ммоль) соединения 2. Выход 0.94 г (95%),
1.89-2.07 м (1Н, Н2), 1.99-2.07 м (1Н, Н7), 2.00-
порошок белого цвета, т.пл. 125-127°С, [α]D20 +74
2.16 м (2Н, Н23), 2.01 с [3Н, О-С(О)СН3], 2.11-2.23
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
42
САЛИМОВА, ПАРФЕНОВА
м (1Н, Н15), 2.17-2.32 м (1Н, Н4), 2.25-2.44 м (2Н,
Н]+, 535 (50) [M + Na]+. Вычислено, %: С 72.62; Н
Н22), 2.34-2.44 м (1Н, Н1), 2.44-2.52 м (1Н, Н3'),
8.65. С31Н44O6. Найдено, %: С 72.56; Н 8.68.
2.45-2.56 м (1Н, Н1), 2.61 с (1Н, Н9), 2.64-2.76 м
Соединения 8-13, 15-20 (общая методика). К
(1Н, Н12), 2.67-2.79 м (1Н, Н2), 2.86-3.07 м (1Н,
раствору 0.83 ммоль соответствующего дикетона
Н12), 2.90 т (1Н, Н13, J 13.0 Гц), 4.61 д (1Н, Н1',
5-7 или 14 в 10 мл ледяной уксусной кислоты до-
J 15.3 Гц), 4.72 д (1Н, Н1', J 15.3 Гц), 5.02-5.09 м
бавляли 0.27 г (2.49 ммоль) фенилгидразина или
(1Н, Н24), 5.89 д (1Н, Н16, J 6.5 Гц). Спектр ЯМР
0.35 г (2.49 ммоль) 3-хлорфенилгидразина или
13С (CDCl3), δ, м.д.: 14.06 (С28), 16.99 (С18), 17.75
0.49 г (2.49 ммоль) 2,4-динитрофенилгидразина.
(С27), 20.99 [О-С(О)СН3], 21.17 (С6), 23.93 (С30),
Смесь нагревали при 118°С в течение 2 ч, затем
24.44 (С19), 25.72 (С26), 27.85 (С23), 28.95 (С22),
реакционную массу охлаждали до комнатной
32.37 (С2), 33.28 (С7), 36.57 (С10), 36.69 (С1), 38.09
температуры и разбавляли 30 мл ледяной воды.
(С15), 40.72 (С8), 44.39 (С12), 44.77 (С4), 46.19 (С5),
Выпавший осадок фильтровали, промывали на
46.85 (С13), 48.62 (С14), 51.89 (С1'), 58.24 (С9), 74.06
фильтре 100 мл H2O и сушили на воздухе. Сырой
(С16), 75.13 (С2'), 77.28 (С3'), 122.45 (С24), 131.04
продукт очищали колоночной хроматографией
(С20), 133.18 (С25), 146.76 (С17), 168.29 (С21),
на силикагеле, элюируя смесью 2:1 петролейный
170.09
[О-С(О)СН3], 209.52 (С11), 215.59 (С3).
эфир-EtOAc.
Масс-спектр (MALDI TOF/TOF), m/z (Iотн, %): 553
(83) [М + 3Н]+, 589 (100) [M + K]+. Вычислено, %:
Метил-(2Z)-2-{(2S,3αS,3βS,6S,12αS)-2-(аце-
С 74.15; Н 8.42. С34Н46O6. Найдено, %: С 74.05; Н
тилокси)-3α,3β,6,12α-тетраметил-13-оксо-3,3α,-
8.44.
3β,4,5,5α,6,7,12,12α,12β,13,14,14α-тетрадека-
гидроциклопента[5,6]нафто[2,1-b]карбазол-
(2Z)-2-[(4α,8α,14β,16β)-16-(Ацетилокси)-4,8,-
1(2H)-илиден}-6-метилгепт-5-еноат (8). Получен
10,14-тетраметил-3,11-диоксогонан-17-илиден]-
из 0.44 г (0.83 ммоль) соединения 5. Выход 0.46 г
6-метилгепт-5-еновая кислота (14). Получен из
(81%), коричневый порошок, т.пл.
185-187°С,
0.97 г (1.88 ммоль) соединения 1. Выход 0.86 г
[α]D20 +78° (c 0.92, CHCl3). Спектральные характе-
(87%), порошок белого цвета, т.пл. 136-138°С,
ристики приведены в [26].
[α]D20 +92 (с 1.01, CHCl3). Спектр ЯМР 1Н (CDCl3),
δ, м.д.: 1.06 с (3Н, Н19), 1.08 д (3Н, Н28, J 6.6 Гц),
Бензил-(2Z)-2-{(2S,3αS,3βS,6S,12αS)-2-(аце-
1.11-1.19 м (1Н, Н6), 1.16 с (3Н, Н30), 1.18-1.30
тилокси)-3α,3β,6,12α-тетраметил-13-оксо-3,3α,-
м (1Н, Н7), 1.21 с (3Н, Н18), 1.47 д (1Н, Н15, J
3β,4,5,5α,6,7,12,12α,12β,13,14,14α-тетрадека-
14.4 Гц), 1.54-1.64 м (1Н, Н6), 1.60 с (3Н, Н27),
гидроциклопента[5,6]нафто[2,1-b]карбазол-
1.67 с (3Н, Н26), 1.82 т (1Н, Н5, J 12.1 Гц), 1.96-
1(2H)-илиден}-6-метилгепт-5-еноат (9). Получен
2.06 м (1Н, Н2), 2.00-2.12 м (1Н, Н7), 2.02 с [3Н,
из 0.5 г (0.83 ммоль) соединения 6. Выход 0.45 г
О-С(О)СН3], 2.09-2.17 м (2Н, Н23), 2.15-2.26 м
(80%), коричневый порошок, т.пл.
155-157°C,
(1Н, Н15), 2.17-2.28 м (1Н, Н4), 2.33-2.53 м (2Н,
[α]D20 +72° (c
1.03, CHCl3). Спектр ЯМР
1Н
Н22), 2.34-2.45 м (1Н, Н1), 2.45-2.56 м (1Н, Н1),
(CDCl3), δ, м.д.: 1.04 с (3Н, Н19), 1.13-1.25 м (1Н,
2.62 с (1Н, Н9), 2.66-2.76 м (1Н, Н12), 2.71-2.79 м
Н6), 1.18-1.29 м (1Н, Н7), 1.21 с (3Н, Н30), 1.26 с
(1Н, Н2), 2.86-2.94 м (1Н, Н13), 2.88-2.97 м (1Н,
(3Н, Н18), 1.32 д (3Н, Н28, J 6.5 Гц), 1.49 д (1Н, Н15,
Н12), 5.09 т (1Н, Н24, J 7.1 Гц), 5.93 д (1Н, Н16, J
J 14.5 Гц), 1.57 с (3Н, Н27), 1.68 с (3Н, Н26), 1.71-
8.3 Гц). Спектр ЯМР 13С (CDCl3), δ, м.д.: 14.08
1.80 м (1Н, Н6), 1.77 т (1Н, Н5, J 10.5 Гц), 1.99 с
(С28), 17.02 (С18), 17.75 (С27), 20.51 [О-С(О)СН3],
[3Н, О-С(О)СН3], 1.99-2.19 м (2Н, Н23), 2.06-2.15
21.18 (С6), 22.48 (С19), 23.94 (С30), 25.69 (С26),
м (1Н, Н7), 2.17-2.33 м (1Н, Н15), 2.35-2.51 м (2Н,
27.98 (С23), 28.75 (С22), 32.38 (С2), 33.28 (С7),
Н22), 2.61-2.70 (1Н, Н4), 2.67-2.82 м (1Н, Н12), 2.71
36.58 (С10), 36.67 (С1), 38.04 (С15), 40.73 (С8), 44.35
с (1Н, Н9), 2.81 д (1Н, Н1, J 15.5 Гц), 2.92-3.05 м
(С12), 44.78 (С4), 46.18 (С5), 47.02 (С13), 48.65 (С14),
(1Н, Н12), 2.97 д (1Н, Н13, J 10.2 Гц), 3.77 д (1Н, Н1,
58.24 (С9), 74.15 (С16), 122.45 (С24), 130.87 (С20),
J 15.5 Гц), 4.99 д.д (1Н, Н1', J 6.0, 12.0 Гц), 5.10 т
133.19 (С25), 148.15 (С17), 170.32 [О-С(О)СН3],
(1Н, Н24, J 6.5 Гц), 5.25 д.д (1Н, Н1', J 6.0, 12.0 Гц),
174.25 (С21), 209.55 (С11), 215.95 (С3). Масс-спектр
5.98 д (1Н, Н16, J 8.1 Гц), 7.10 т (1Н, Н5'', J 7.5 Гц),
(MALDI TOF/TOF), m/z (Iотн, %): 513 (100) [М +
7.15 т (1Н, Н4'', J 7.5 Гц), 7.31-7.46 м (5H, H-Ar),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
РЕАКЦИЯ ФИШЕР
А В СИНТЕЗЕ НОВЫХ ТРИТЕРПЕНОВЫХ ИНДОЛОВ
43
7.32 д (1Н, Н3'', J 7.5 Гц), 7.55 д (1Н, Н6'', J 7.5 Гц),
131.05 (С20), 133.23 (С25), 136.07 (С2''), 137.45 (С3),
7.83 уш.с (1H, NH). Спектр ЯМР 13С (CDCl3), δ,
147.19 (С17), 168.39 (С21), 170.19 [О-С(О)СН3],
м.д.: 16.99 (С18), 17.18 (С28), 17.74 (С27), 20.64 (С6),
210.00 (С11). Масс-спектр (MALDI TOF/TOF),
20.87 [О-С(О)СН3], 20.92 (С19), 24.22 (С30), 25.72
m/z (Iотн, %): 623 (100) [М]+, 624 (90) [M + Н]+.
(С26), 27.95 (С23), 29.13 (С22), 29.80 (С4), 30.95 (С1),
Вычислено, %: С 77.01; Н 7.92; N 2.25. С40Н49NO5.
33.87 (С7), 37.27 (С10), 38.17 (С15), 40.55 (С8), 44.61
Найдено, %: С 76.96; Н 7.94; N 2.26.
(С12), 46.59 (С13), 47.41 (С5), 48.74 (С14), 57.65
Метил-(2Z)-2-{(2S,3αS,3βS,6S,12αS)-2-(аце-
(С9), 66.59 (С1'), 74.30 (С16), 110.40 (С3''), 110.48
тилокси)-11-хлор-3α,3β,6,12α-тетраметил-13-
(С2), 118.21 (С6''), 119.13 (С5''), 121.09 (С4''), 122.60
оксо-3,3α,3β,4,5,5α,6,7,12,12α,12β,13,14,14α-те-
(С24), 128.41 (С5'), 128.50 (С1''), 128.58 (С4', С6'),
традекагидроциклопента[5,6]нафто[2,1-b]кар-
128.62 (С3', С7'), 131.76 (С20), 133.06 (С25), 135.56
базол-1(2H)-илиден}-6-метилгепт-5-еноат
(11).
(С2'), 136.08 (С2''), 137.46 (С3), 146.02 (С17), 169.26
Получен из 0.44 г (0.83 ммоль) соединения 5.
(С21),
170.33
[О-С(О)СН3], 210.12 (С11). Масс-
Смесь 6-Cl- и 4-Cl-изомеров = 3:2, выход 0.45 г
спектр (MALDI TOF/TOF), m/z (Iотн, %): 676 (100)
(75%), коричневый порошок, т.пл.
165-167°C,
[M + Н]+. Вычислено, %: С 78.19; Н 7.90; N 2.07.
[α]D20 +65° (c 0.87, CHCl3).
С44Н53NO5. Найдено, %: С 78.15; Н 7.92; N 2.08.
6-Хлор-изомер 11. Спектр ЯМР 1Н (CDCl3),
Проп-2-ин-1-ил-(2Z)-2-[(2S,3αS,3βS,6S,12αS)-
δ, м.д.: 1.00 с (3Н, Н19), 1.12-1.25 м (1Н, Н6),
2-(ацетилокси)-3α,3β,6,12α-тетраметил-13-
1.16-1.31 м (1Н, Н7), 1.20 с (3Н, Н30), 1.24 с (3Н,
оксо-3,3α,3β,4,5,5α,6,7,12,12α,12β,13,14,14α-тет-
Н18), 1.30 д (3Н, Н28, J 6.5 Гц), 1.46 д (1Н, Н15, J
радекагидроциклопента[5,6]нафто[2,1-b]кар-
14.5 Гц), 1.63 с (3Н, Н27), 1.67-1.81 м (1Н, Н6),
базол-1(2H)-илиден]-6-метилгепт-5-еноат
(10).
1.68-1.82 м (1Н, Н5), 1.70 с (3Н, Н26), 1.96-2.18
Получен из 0.46 г (0.83 ммоль) соединения 7.
м (2Н, Н23), 2.04 с [3Н, О-С(О)СН3], 2.05-2.16 м
Выход 0.48 г (85%), коричневый порошок, т.пл.
(1Н, Н7), 2.15-2.27 м (1Н, Н15), 2.34-2.56 м (2Н,
148-150°C, [α]D20 +52° (c 1.12, CHCl3). Спектр ЯМР
Н22), 2.57-2.68 м (1Н, Н4), 2.62-2.82 м (1Н, Н12),
1Н (CDCl3), δ, м.д.: 1.04 с (3Н, Н19), 1.13-1.28 м
2.69 с (1Н, Н9), 2.77 д (1Н, Н1, J 14.0 Гц), 2.91-3.05
(1Н, Н6), 1.19-1.30 м (1Н, Н7), 1.22 с (3Н, Н30), 1.25
м (2Н, Н12, Н13), 3.65-3.77 м (1Н, Н1), 3.69 с (3Н,
с (3Н, Н18), 1.32 д (3Н, Н28, J 6.5 Гц), 1.50 д (1Н,
COOCH3), 5.05-5.13 м (1Н, Н24), 5.93 д (1Н, Н16,
Н15, J 14.5 Гц), 1.65 с (3Н, Н27), 1.70-1.84 м (1Н,
J 8.2 Гц), 6.94-7.03 м (1Н, Н4''), 7.05 д (1Н, Н5'', J
Н6), 1.72 с (3Н, Н26), 1.74-1.89 м (1Н, Н5), 1.99-
7.8 Гц), 7.18 д (1Н, Н3'', J 7.8 Гц), 7.99 уш.с (1Н,
2.21 м (2Н, Н23), 2.05 с [3Н, О-С(О)СН3], 2.06-
NH). Спектр ЯМР 13С (CDCl3), δ, м.д.: 16.94 (С18),
2.16 м (1Н, Н7), 2.22 д.д (1Н, Н15, J 8.5, 14.5 Гц),
17.09 (С28), 17.77 (С27), 20.59 (С6), 20.83 (С19), 20.97
2.41-2.49 м (2Н, Н22), 2.42-2.55 м (1Н, Н3'),
[О-С(О)СН3], 24.22 (С30), 25.76 (С26), 27.87 (С23),
2.62-2.70 м (1Н, Н4), 2.66-2.83 м (1Н, Н12), 2.71
29.02 (С22), 29.81 (С4), 30.86 (С1), 33.85 (С7), 37.20
с (1Н, Н9), 2.81 д (1Н, Н1, J 15.7 Гц), 2.93-3.06 м
(С10), 38.19 (С15), 40.55 (С8), 44.59 (С12), 46.53
(1Н, Н12), 2.94-3.10 м (1Н, Н13), 3.77 д (1Н, Н1, J
(С13), 47.34 (С5), 48.73 (С14), 51.59 (COOCH3),
15.7 Гц), 4.65 д (1Н, Н1', J 16.1 Гц), 4.76 д (1Н, Н1',
57.58 (С9), 74.27 (С16), 109.06 (С3''), 110.54 (С2),
J 16.1 Гц), 5.13 т (1Н, Н24, J 6.5 Гц), 5.95 д (1Н, Н16,
119.83 (С5''), 121.49 (С4''), 122. 58 (С24), 126.04 (C-
J 8.2 Гц), 7.10 т (1Н, Н5'', J 7.5 Гц), 7.15 т (1Н, Н4'', J
Cl), 127.12 (С1''), 131.82 (С20), 133.10 (С25), 137.25
7.5 Гц), 7.32 д (1Н, Н3'', J 7.5 Гц), 7.55 д (1Н, Н6'', J
(С2''), 138.51 (С3), 145.63 (С17), 170.06 (С21), 170.30
7.5 Гц), 7.83 уш.с (1H, NH). Спектр ЯМР 13С
[О-С(О)СН3], 210.13 (С11).
(CDCl3), δ, м.д.: 17.02 (С18), 17.17 (С28), 17.81 (С27),
20.63 (С6), 20.87 (С19), 21.06 [О-С(О)СН3], 24.21
4-Хлор-изомер 11. Спектр ЯМР 1Н (CDCl3), δ,
(С30), 25.77 (С26), 27.91 (С23), 29.04 (С22), 29.79
м.д.: 1.02 с (3Н, Н19), 1.22 с (3Н, Н30), 1.61 с (3Н,
(С4), 30.95 (С1), 33.86 (С7), 37.27 (С10), 38.18 (С15),
Н27), 1.69 с (3Н, Н26), 2.68 с (1Н, Н9), 3.00 д (1Н,
40.54 (С8), 44.59 (С12), 46.75 (С13), 47.41 (С5), 48.74
Н1, J 17.2 Гц), 4.24 д (1Н, Н1, J 17.2 Гц), 7.05 д
(С14), 51.91 (С1'), 57.64 (С9), 74.26 (С16), 75.12 (С2'),
(1Н, Н5'', J 8.0 Гц), 7.28 с (1Н, Н3''), 7.41 д (1Н, Н6'',
77.41 (С3'), 110.32 (С2), 110.40 (С3''), 118.21 (С6''),
J 8.0 Гц), 8.06 уш.с (1Н, NH). Спектр ЯМР 13С
119.14 (С5''), 121.11 (С4''), 122.51 (С24), 128.49 (С1''),
(CDCl3), δ, м.д.: 17.79 (С27), 20.57 (С6), 25.73 (С26),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
44
САЛИМОВА, ПАРФЕНОВА
27.96 (С23), 29.06 (С22), 29.77 (С4), 32.82 (С1), 33.79
4-Хлор-изомер 12. Спектр ЯМР 1Н (CDCl3), δ,
(С7), 37.18 (С10), 40.51 (С8), 44.48 (С12), 46.57 (С13),
м.д.: 1.03 с (3Н, Н19), 1.23 с (3Н, Н30), 1.56 с (3Н,
48.74 (С14), 51.56 (COOCH3), 57.66 (С9), 74.32
Н27), 1.67 с (3Н, Н26), 2.97-3.05 м (1Н, Н1), 4.24 д
(С16), 110.04 (С3''), 110.46 (С2), 118.97 (C6''), 119.63
(1Н, Н1, J 16.5 Гц), 6.99 д (1Н, Н5'', J 8.5 Гц), 7.28 с
(С5''), 125.74 (С1''), 126.72 (С-Cl), 131.86 (С20),
(1Н, Н3''), 7.39 д (1Н, Н6'', J 8.5 Гц), 7.90 уш.с (1Н,
133.07 (С25), 136.44 (С2''), 138.29 (С3), 145.65 (С17),
NH). Спектр ЯМР 13С (CDCl3), δ, м.д.: 17.75 (С27),
209.79 (С11). Масс-спектр (MALDI TOF/TOF), m/z
24.31 (С30), 25.71 (С26), 28.02 (С23), 29.16 (С22),
(Iотн, %): 633 (99) [М - Н]+, 656 (100) [M + Na - Н]+,
29.79 (С4), 32.80 (С1), 33.77 (С7), 40.51 (С8), 40.51
672 (65) [M + K - Н]+. Вычислено, %: С 71.96; Н
(С12), 46.57 (С13), 48.75 (С14), 57.66 (С9), 74.31
7.63; N 2.21; Cl 5.59. С38Н48ClNO5. Найдено, %: С
(С16), 110.37 (С3''), 110.57 (С2), 119.00 (C6''), 119.90
72.01; Н 7.61; N 2.20; Cl 5.57.
(С5''), 126.10 (С1''), 127.36 (С-Cl), 131.83 (С20),
133.02 (С25), 137.20 (С2''), 138.42 (С3), 145.95 (С17),
Бензил-(2Z)-2-{(2S,3αS,3βS,6S,12αS)-2-(аце-
210.09 (С11). Масс-спектр (MALDI TOF/TOF), m/z
тилокси)-11-хлор-3α,3β,6,12α-тетраметил-13-
(Iотн, %): 711 (100) [M + H]+, 733 (64) [M + Na]+,
оксо-3,3α,3β,4,5,5α,6,7,12,12α,12β,13,14,14α-те-
749 (66) [M + K]+. Вычислено, %: C 74.40; H 7.38;
традекагидроциклопента[5,6]нафто[2,1-b]кар-
N 1.97; Cl 4.99. C44H52ClNO5. Найдено, %: C 74.23;
базол-1(2H)-илиден}-6-метилгепт-5-еноат
(12).
H 7.40; N 1.98; Cl 4.97.
Получен из 0.5 г (0.83 ммоль) соединения 6. Смесь
6-Cl- и 4-Cl-изомеров = 3:2, выход 0.48 г (82%), ко-
Проп-2-ин-1-ил-(2Z)-2-{(2S,3αS,3βS,6S,12αS)-
ричневый порошок, т.пл. 143-145°C, [α]D20 +75° (c
2-(ацетилокси)-11-хлор-3α,3β,6,12α-тетра-
1.19, CHCl3).
метил-13-оксо-3,3α,3β,4,5,5α,6,7,12,12α,12β,13,-
14,14α-тетрадекагидроциклопента[5,6]наф-
6-Хлор-изомер 12. Спектр ЯМР 1Н (CDCl3),
то[2,1-b]карбазол-1(2H)-илиден}-6-метилгепт-
δ, м.д.: 1.01 с (3Н, Н19), 1.14-1.24 м (1Н, Н6),
5-еноат (13). Получен из 0.46 г (0.83 ммоль) со-
1.18-1.27 м (1Н, Н7), 1.20 с (3Н, Н30), 1.25 с (3Н,
единения 7. Смесь 6-Cl- и 4-Cl-изомеров = 3:2,
Н18), 1.31 д (3Н, Н28, J 7.5 Гц), 1.49 д (1Н, Н15, J
выход 0.48 г (80%), коричневый порошок, т.пл.
14.0 Гц), 1.55 с (3Н, Н27), 1.66 с (3Н, Н26), 1.70-
147-149°C, [α]D20 +64° (c 1.08, CHCl3).
1.79 м (1Н, Н6), 1.74 т (1Н, Н5, J 5.5 Гц), 1.98-2.22
м (2Н, Н23), 1.99 с [3Н, О-С(О)СН3], 2.06-2.16 м
6-Хлор-изомер 13. Спектр ЯМР 1Н (CDCl3), δ,
(1Н, Н7), 2.17-2.29 м (1Н, Н15), 2.34-2.57 м (2Н,
м.д.: 1.01 с (3Н, Н19), 1.14-1.25 м (1Н, Н6), 1.18-
Н22), 2.59-2.70 м (1Н, Н4), 2.69-2.81 м (1Н, Н12),
1.28 м (1Н, Н7), 1.21 с (3Н, Н18), 1.25 с (3Н, Н30),
2.70 с (1Н, Н9), 2.77 д (1Н, Н1, J 15.0 Гц), 2.91-3.06
1.31 д (3Н, Н28, J 6.5 Гц), 1.50 д (1Н, Н15, J 14.0 Гц),
м (1Н, Н12, 1Н, Н13), 3.73 д (1Н, Н1, J 15.0 Гц), 4.98
1.64 с (3Н, Н27), 1.67-1.79 м (1Н, Н6), 1.69-1.80 м
д (1Н, Н1', J 12.3 Гц), 5.09 т (1Н, Н24, J 6.5 Гц), 5.24
(1Н, Н5), 1.71 с (3Н, Н26), 2.03-2.25 м (2Н, Н23), 2.05
д (1Н, Н1', J 12.3 Гц), 5.97 д (1Н, Н16, J 8.0 Гц),
с [3Н, О-С(О)СН3], 2.05-2.16 м (1Н, Н7), 2.17-2.32
6.94-7.10 м (1Н, Н4''), 7.06 д (1Н, Н5'', J 8.5 Гц), 7.18
м (1Н, Н15), 2.36-2.57 м (2Н, Н22), 2.47-2.53 м (1Н,
д (1Н, Н3'', J 7.5 Гц), 7.21-7.48 м (5H, H-Ar), 7.81
Н3'), 2.60-2.71 м (1Н, Н4), 2.67-2.83 м (1Н, Н12),
уш.с (1Н, NH). Спектр ЯМР 13С (CDCl3), δ, м.д.:
2.70 с (1Н, Н9), 2.78 д (1Н, Н1, J 15.0 Гц), 2.93-3.06
17.00 (С28), 17.08 (С18), 17.73 (С27), 20.59 (С6), 20.82
м (1Н, Н13), 2.94-3.09 м (1Н, Н12), 3.73 д (1Н, Н1, J
(С19), 20.91 [О-С(О)СН3], 24.22 (С30), 25.68 (С26),
15.0 Гц), 4.65 д (1Н, Н1', J 15.7 Гц), 4.75 д (1Н, Н1',
27.92 (С23), 29.12 (С22), 29.74 (С4), 30.83 (С1), 33.83
J 15.7 Гц), 5.11 д (1Н, Н24, J 8.2 Гц), 5.95 д (1Н, Н16,
(С7), 37.20 (С10), 38.16 (С15), 40.55 (С12), 40.56 (С8),
J 7.5 Гц), 6.97-7.04 м (1Н, Н4''), 7.03 д (1Н, Н5'', J
46.53 (С13), 47.30 (С5), 48.72 (С14), 57.58 (С9), 66.59
7.2 Гц), 7.19 д (1Н, Н3'', J 7.2 Гц), 7.80 уш.с (1Н,
(С1'), 74.26 (С16), 108.99 (С3''), 110.49 (С2), 119.72
NH). Спектр ЯМР 13С (CDCl3), δ, м.д.: 17.01 (С28),
(С5''), 121.54 (С4''), 122.58 (С24), 125.76 (С1''), 126.82
17.20 (С18), 17.79 (С27), 20.59 (С6), 20.82 (С19), 21.05
(С-Cl), 128.40 (С5'), 128.58 (С4', С6'), 128.62 (С3',
[О-С(О)СН3], 24.22 (С30), 25.73 (С26), 27.89 (С23),
С7'), 131.80 (С20), 133.06 (С25), 135.54 (С2'), 136.39
29.03 (С22), 29.75 (С4), 30.84 (С1), 33.76 (С7), 37.20
(С2''), 138.19 (С3), 145.91 (С17), 169.24 (С21), 170.32
(С10), 38.17 (С15), 40.49 (С8), 44.47 (С12), 46.74
[О-С(О)СН3], 209.76 (С11).
(С13), 47.29 (С5), 48.73 (С14), 51.89 (С1'), 57.58 (С9),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
РЕАКЦИЯ ФИШЕР
А В СИНТЕЗЕ НОВЫХ ТРИТЕРПЕНОВЫХ ИНДОЛОВ
45
74.22 (С16), 75.10 (С2'), 77.38 (С3'), 109.00 (С3'''),
м (2Н, Н23), 2.26-2.40 м (1Н, Н15), 2.36-2.46 м (2Н,
110.49 (С2), 119.74 (С5''), 121.57 (С4''), 122.49 (С24),
Н22), 2.61 с (1Н, Н9), 2.62-2.72 м (1Н, Н4), 2.73-2.93
125.75 (С1''), 126.10 (С-Cl), 131.08 (С20), 133.21
м (2Н, Н12), 2.79 д (1Н, Н1, J 15.5 Гц), 3.33-3.43 м
(С25), 136.39 (С3), 137.20 (С2''), 147.09 (С17), 168.37
(1Н, Н13), 3.74 д (1Н, Н1, J 15.5 Гц), 5.03 д (1Н, Н16,
(С21), 170.17 [О-С(О)СН3], 209.63 (С11).
J 14.5 Гц), 5.09-5.15 м (1Н, Н24), 6.98-7.05 м (1Н,
Н4''), 7.07 д (1Н, Н5'', J 8.0 Гц), 7.17 д (1Н, Н3'', J
4-Хлор-изомер 13. Спектр ЯМР 1Н (CDCl3), δ,
8.0 Гц), 7.79 уш.с (1Н, NH). Спектр ЯМР 13С
м.д.: 1.04 с (3Н, Н19), 1.24 с (3Н, Н30), 1.63 с (3Н,
(CDCl3), δ, м.д.: 17.10 (С28), 17.82 (С27),
19.72
Н27), 1.70 с (3Н, Н26), 2.69 с (1Н, Н9), 3.01 д (1Н,
(С18), 20.27 (С6), 20.56 (С19), 24.12 (С22), 25.68
Н1, J 16.0 Гц), 4.24 д (1Н, Н1, J 16.0 Гц), 7.07 д (1Н,
(С30), 25.77 (С26), 27.15 (С23), 29.74 (С4), 30.65
Н5'', J 8.3 Гц), 7.28 с (1Н, Н3''), 7.43 д (1Н, Н6'', J
(С1), 33.55 (С7), 33.73 (С15), 37.40 (С10), 40.36 (С12),
8.3 Гц), 7.89 уш.с (1Н, NH). Спектр ЯМР 13С
40.71 (С13), 41.55 (С8), 47.40 (С5), 54.49 (С14), 58.54
(CDCl3), δ, м.д.: 17.08 (С28), 24.31 (С30), 25.70 (С26),
(С9), 81.51 (С16), 109.04 (С3''), 110.35 (С2), 119.80
27.99 (С23), 29.07 (С22), 29.78 (С4), 32.81 (С1), 33.82
(С5''), 121.65 (С4''), 122.82 (С24), 124.35 (С20), 124.45
(С7), 40.54 (С8), 44.58 (С12), 48.74 (С14), 51.91 (С1'),
(С1''), 126.94 (С-Cl), 133.33 (С25), 136.40 (С2''),
57.65 (С9), 74.27 (С16), 110.38 (С3''), 110.57 (С2),
138.08 (С3), 166.77 (С17), 175.80 (С21), 208.08 (С11).
119.01 (С6''), 119.91 (С5''), 126.84 (С1''), 127.12 (С-
Cl), 131.12 (С20), 133.24 (С25), 138.17 (С2''), 138.40
4-Хлор-изомер 16. Спектр ЯМР 1Н (CDCl3), δ,
(С3), 147.13 (С17), 168.39 (С21), 209.97 (С11). Масс-
м.д.: 1.04 с (3Н, Н19), 1.40 с (3Н, Н30), 2.59 с (1Н,
спектр (MALDI TOF/TOF), m/z (Iотн, %): 657 (100)
Н9), 2.98 д (1Н, Н1, J 16.3 Гц), 4.24 д (1Н, Н1, J
[М - Н]+, 680 (72) [M + Na - Н]+, 696 (75) [M +
16.3 Гц), 7.04 д (1Н, Н5'', J 8.5 Гц), 7.30 с (1Н,
K - Н]+. Вычислено, %: C 72.98; H 7.35; N 2.13; Cl
Н3''), 7.43 д (1Н, Н6'', J 8.5 Гц), 7.88 уш.с (1Н, NH).
5.39. C40H48ClNO5. Найдено, %: C 72.92; H 7.38; N
Спектр ЯМР 13С (CDCl3), δ, м.д.: 17.22 (С28), 20.31
2.14; Cl 5.41.
(С6), 25.72 (С30), 29.79 (С4), 32.61 (С1), 33.61 (С7),
40.50 (С12), 40.79 (С13), 41.60 (С8), 46.65 (С5), 58.60
(3αS,4αS,4βS,7S,13αS)-4α,4β,7,13α-Тетраме-
(С9), 81.64 (С16), 110.60 (С2), 118.98 (С6''), 119.95
тил-1-(4-метилпент-3-ен-1-ил)-3α,4,4α,4β,5,6,-
(С5''), 122.84 (С24), 126.94 (С1''), 127.06 (С-Cl),
6α,7,8,13,13α,13β,15,15α-тетрадекагидрофуро-
137.19 (С2''), 138.33 (С3), 166.90 (С17), 175.85 (С21),
[3'',2'':3',4']циклопента[1',2':5,6]нафто[2,1-b]-
208.48 (С11). Масс-спектр (MALDI TOF/TOF), m/z
карбазол-2,14-дион
(15). Получен из
0.43 г
(Iотн, %): 561 (100) [М + Н]+, 583 (84) [M + Na]+,
(0.83 ммоль) соединения 14. Выход 0.43 г (75%),
599 (45) [M + K]+. Вычислено, %: C 75.04; H 7.56;
т.пл. 194-196°С, [α]D20 +31° (c 0.86, CHCl3). Спек-
N 2.50; Cl 6.33. C35H42ClNO3. Найдено, %: C 75.09;
тральные характеристики приведены в [26].
H 7.54; N 2.49; Cl 6.34.
(3αS,4αS,4βS,7S,13αS)-12-Хлор-4α,4β,7,13α-
Метил-(2Z)-2-{(4α,8α,14β,16β)-16-(ацетил-
тетраметил-1-(4-метилпент-3-ен-1-ил)-3α,4,4α,
окси)-3-[(2,4-динитрофенил)гидразон]-4,8,10,-
4β,5,6,6α,7,8,13,13α,13β,15,15α-тетрадекаги-
14-тетраметил-11-оксогонан-17-илиден}-6-ме-
дрофуро[3'',2'':3',4']циклопента[1',2':5,6]наф-
тилгепт-5-еноат
(17).
Получен из
0.44 г
то[2,1-b]карбазол-2,14-дион
(16). Получен из
(0.83 ммоль) соединения 5. Выход 0.57 г (85%),
0.43 г (0.83 ммоль) соединения 14. Смесь 6-Cl- и
красный порошок, т.пл. 133-135°C, [α]D20 +87° (c
4-Cl-изомеров = 3:2, выход 0.43 г (78%), коричне-
1.45, CHCl3). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.86
вый порошок, т.пл. 138-140°C, [α]D20 +45° (c 0.99,
с (3Н, Н19), 1.09-1.26 м (1Н, Н6), 1.15 с (3Н, Н30),
CHCl3).
1.16-1.32 м (1Н, Н7), 1.20 с (3Н, Н18), 1.22 д (3Н,
6-Хлор-изомер 16. Спектр ЯМР 1Н (CDCl3), δ,
Н28, J 7.5 Гц), 1.37-1.56 м (1Н, Н15), 1.54-1.72 м
м.д.: 1.01 с (3Н, Н19), 1.15 с (3Н, Н18), 1.27-1.35 м
(1Н, Н6), 1.59 с (3Н, Н27), 1.66 с (3Н, Н26), 1.84-
(1Н, Н6), 1.29-1.37 м (1Н, Н7), 1.32 д (3Н, Н28, J
1.94 м (1Н, Н5), 1.97-2.17 м (2Н, Н23), 1.98-2.18 м
6.5 Гц), 1.37 с (3Н, Н30), 1.49 д.д (1Н, Н15, J 3.5,
(2Н, Н1, Н7), 2.02 с [3Н, О-С(О)СН3], 2.13-2.29 м
14.5 Гц), 1.63 с (3Н, Н27), 1.72 с (3Н, Н26), 1.72-
(1Н, Н15), 2.30-2.47 м (2Н, Н22), 2.39-2.48 м (1Н,
1.85 м (2Н, Н5, Н6), 2.04-2.11 м (1Н, Н7), 2.23-2.32
Н4), 2.43-2.56 м (1Н, Н2), 2.46-2.63 м (1Н, Н1),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
46
САЛИМОВА, ПАРФЕНОВА
2.52 с (1Н, Н9), 2.53-2.79 м (1Н, Н12), 2.57-2.73 м
(С5’), 128.56 (С4', С6'), 128.62 (С3', С7'), 128.93 (С2''),
(1Н, Н2), 2.80-3.04 м (1Н, Н12), 2.91 т (1Н, Н13, J
130.02 (С5''), 131.91 (С20), 133.05 (С25), 135.49 (С2'),
12.5 Гц), 3.67 с (3Н, COOCH3), 5.06 т (1Н, Н24, J
137.63 (С4''), 145.13 (С1''), 145.54 (С17), 166.59 (С3),
6.5 Гц), 5.90 т (1Н, Н16, J 6.5 Гц), 7.99 д (1Н, Н6'', J
169.15 (С21), 170.29 [О-С(О)СН3], 209.42 (С11).
8.8 Гц), 8.30 д (1Н, Н5'', J 8.8 Гц), 9.11 с (1Н, Н3''),
Масс-спектр (MALDI TOF/TOF), m/z (Iотн, %):
11.18 уш.с (1Н, NH). Спектр ЯМР 13С (CDCl3), δ,
602 (100) [M - Ar(NO2)2NH + H]+, 693 (45) [М -
м.д.: 13.52 (С28), 16.98 (С18), 17.73 (С27), 20.77 (С6),
2NO2 + H]+. Вычислено, %: C 67.50; H 6.95; N 7.16.
20.91 [О-С(О)СН3], 24.11 (С30), 24.46 (С19), 25.71
C44H54N4O9. Найдено, %: C 67.44; H 6.97; N 7.19.
(С26), 27.85 (С23), 28.09 (С2), 28.96 (С22), 32.86 (С1),
Проп-2-ин-1-ил-(2Z)-2-{(4α,8α,14β,16β)-16-
33.44 (С7), 33.92 (С4), 35.71 (С10), 38.07 (С15), 40.83
(ацетилокси)-3-[(2,4-динитрофенил)гидразон]-
(С8), 44.18 (С12), 44.65 (С5), 46.60 (С13), 48.50 (С14),
4,8,10,14-тетраметил-11-оксогонан-17-илиден}-
51.58 (COOCH3), 58.67 (С9), 74.10 (С16), 116.37
6-метилгепт-5-еноат
(19). Получен из
0.46 г
(С6''), 122.53 (С24), 123.54 (С3''), 128.91 (С2''), 130.01
(0.83 ммоль) соединения 7. Выход 0.58 г (87%),
(С5''), 131.93 (С20), 133.07 (С25), 137.59 (С4''),
красный порошок, т.пл. 118-120°C, [α]D20 +69° (c
145.13 (С1''), 145.38 (С17), 166.65 (С3), 169.97 (С21),
0.57, CHCl3). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.87
170.25
[О-С(О)СН3], 209.45 (С11). Масс-спектр
с (3Н, Н19), 1.08-1.24 м (1Н, Н6), 1.16 с (3Н, Н30),
(MALDI TOF/TOF), m/z (Iотн, %): 526 (100) [M -
1.19-1.33 м (1Н, Н7), 1.22 с (3Н, Н18), 1.23 д (3Н,
Ar(NO2)2NH + H]+, 661 (21) [М - NO2 + H]+. Вы-
Н28, J 7.5 Гц), 1.43-1.59 м (1Н, Н15), 1.50-1.76 м
числено, %: C 64.57; H 7.13; N 7.93. C38H50N4O9.
(1Н, Н6), 1.60 с (3Н, Н27), 1.68 с (3Н, Н26), 1.80-
Найдено, %: C 64.62; H 7.10; N 7.91.
, J 11.3 Гц), 1.97-
2.50 м (2Н, Н1), 1.92 т (1Н, Н5
Бензил-(2Z)-2-{(4α,8α,14β,16β)-16-(ацетил-
2.17 м (2Н, Н23), 2.01-2.19 м (1Н, Н7), 2.03 с [3Н,
окси)-3-[(2,4-динитрофенил)гидразон]-4,8,10,-
О-С(О)СН3], 2.16-2.32 м (1Н, Н15), 2.35-2.70 м
14-тетраметил-11-оксогонан-17-илиден}-6-ме-
(2Н, Н22, 2Н, Н2), 2.40-2.49 м (1Н, Н4), 2.48-2.51
тилгепт-5-еноат (18). Получен из 0.5 г (0.83 ммоль)
м (1Н, Н3'), 2.49 с (1Н, Н9), 2.56-2.84 м (1Н, Н12),
соединения 6. Выход 0.53 г (82%), красный поро-
2.88-2.98 м (1Н, Н12), 2.93 т (1Н, Н13, J 13.5 Гц),
шок, т.пл. 123-125°C, [α]D20 +79° (c 1.23, CHCl3).
4.64 д (1Н, Н1', J 15.0 Гц), 4.74 д (1Н, Н1', J 15.0 Гц),
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.87 с (3Н, Н19),
5.09 т (1Н, Н24, J 6.1 Гц), 5.92 д (1Н, Н16, J 6.5 Гц),
1.12-1.24 м (1Н, Н6), 1.19 с (3Н, Н30), 1.19-1.31 м
8.00 д (1Н, Н6'', J 8.5 Гц), 8.31 д (1Н, Н5'', J 8.5 Гц),
(1Н, Н7), 1.22 с (3Н, Н18), 1.24 д (3Н, Н28, J 9.2 Гц),
9.13 с (1Н, Н3''), 11.20 уш.с (1H, NH). Спектр ЯМР
1.39-1.52 м (1Н, Н15), 1.54 с (3Н, Н27), 1.62-1.72
13С (CDCl3), δ, м.д.: 13.53 (С28), 17.06 (С18), 17.76
м (1Н, Н6), 1.65 с (3Н, Н26), 1.85-1.96 м (1Н, Н5),
(С27), 20.78 (С6), 21.02 [О-С(О)СН3], 24.11 (С30),
1.96-2.25 м (2Н, Н23), 1.97 с [3Н, О-С(О)СН3],
24.47 (С19), 25.72 (С26), 27.88 (С23), 28.09 (С2), 28.97
2.03-2.18 м (2Н, Н1, Н7), 2.14-2.26 м (1Н, Н15),
(С22), 32.86 (С1), 33.42 (С7), 33.93 (С4), 35.72 (С10),
2.30-2.47 м (2Н, Н2), 2.39-2.49 м (1Н, Н4), 2.46-
38.06 (С15), 40.73 (С8), 44.18 (С12), 44.65 (С5), 46.21
2.73 м (2Н, Н22, 1Н, Н1), 2.53 с (1Н, Н9), 2.61-2.75
(С13), 48.51 (С14), 51.92 (С1'), 58.68 (С9), 74.08 (С16),
м (1Н, Н12), 2.85-2.98 м (1Н, Н12), 2.91 т (1Н, Н13,
75.13 (С3'), 76.92 (С2'), 116.30 (С6''), 122.43 (С24),
J 14.2 Гц), 4.98 д (1Н, Н1', J 12.0 Гц), 5.05 т (1Н,
123.56 (С3''), 128.93 (С2''), 130.03 (С5''), 131.19 (С20),
Н24, J 6.9 Гц), 5.23 д (1Н, Н1', J 12.0 Гц), 5.94 т
133.23 (С25), 137.62 (С4''), 145.14 (С1''), 146.71 (С17),
(1Н, Н16, J 7.5 Гц), 7.31-7.41 м (5Н, Н-Ar), 8.00 д
166.58 (С3), 168.32 (С21),
170.17
[О-С(О)СН3],
(1Н, Н6'', J 9.5 Гц), 8.31 д (1Н, Н5'', J 9.5 Гц), 9.13
209.32 (С11). Масс-спектр (MALDI TOF/TOF), m/z
с (1Н, Н3''), 11.20 уш.с (1Н, NH). Спектр ЯМР 13С
(Iотн, %): 536 (100) [M - Ar(NO2)2NH + H]+, 686
(CDCl3), δ, м.д.: 13.53 (С28), 17.05 (С18),
17.70
(75) [М - NO2 + H]+. Вычислено, %: С 65.74; Н
(С27), 20.79 (С6), 20.87 [О-С(О)СН3], 24.12 (С30),
6.90; N 7.67. С40Н50N4O9. Найдено, %: С 65.79; Н
24.46 (С19), 25.68 (С26), 27.92 (С23), 29.07 (С22),
6.88; N 7.63.
29.70 (С2), 32.86 (С1), 33.43 (С7), 33.93 (С4), 35.71
(С10), 38.06 (С15), 40.74 (С8), 44.19 (С12), 44.65 (С5),
(2Z)-2-{(4α,8α,14β,16β)-16-(Ацетилокси)-3-
46.67 (С13), 48.50 (С14), 58.69 (С9), 66.60 (С1'), 74.12
[(2,4-динитрофенил)гидразон]-4,8,10,14-тетра-
(С16), 116.37 (С6''), 122.53 (С24), 123.55 (С3''), 128.41
метил-11-оксогонан-17-илиден}-6-метилгепт-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
РЕАКЦИЯ ФИШЕР
А В СИНТЕЗЕ НОВЫХ ТРИТЕРПЕНОВЫХ ИНДОЛОВ
47
5-еновая кислота
(20). Получена из
0.43 г
развитие исследуемых бактерий и грибков. Доля
(0.83 ммоль) соединения 14. Выход 0.54 г (80%),
ингибирования роста рассчитана для каждой лун-
красный порошок, т.пл. 178-180°C, [α]D20 +95° (c
ки с использованием отрицательного контроля
1.23, CHCl3). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.86
(только среда) и положительного контроля (бакте-
с (3Н, Н19), 1.08-1.39 м (1Н, Н6), 1.16 с (3Н, Н30),
рии без ингибиторов). Все тесты продублированы.
1.17-1.36 м (1Н, Н7), 1.23 д (3Н, Н28, J 7.2 Гц), 1.25
Оценка антибактериальной активности сое-
с (3Н, Н18), 1.43-1.69 м (1Н, Н15), 1.52-1.78 м (1Н,
динений 1-20. Антибактериальный скрининг про-
Н6), 1.60 с (3Н, Н27), 1.67 с (3Н, Н26), 1.78-1.97 м
водили методом серийных разведений. Образцы
(1Н, Н5), 1.86-1.99 м (1Н, Н1), 1.99-2.24 м (1Н,
готовили в ДМСО в тестовой концентрации
Н7), 2.02 с [3Н, О-С(О)СН3], 2.12-2.30 м (1Н, Н15),
32 мкг/мл. Все бактерии культивировали в кати-
2.31-2.60 м (2Н, Н2, 2Н, Н23), 2.37-2.49 м (1Н, Н4),
он-сбалансированном бульоне Мюллера-Хинтона
2.47-2.62 м (1Н, Н1), 2.48 с (1Н, Н9), 2.57-2.73
при 37°С в течение ночи. Образец каждой культу-
м (2Н, Н22), 2.64-2.82 м (1Н, Н12), 2.87-3.04 м
ры затем разбавляли в 40 раз и инкубировали при
(1Н, Н12), 2.95-3.07 м (1Н, Н13), 5.09 т (1Н, Н24, J
37°С в течение 1.5-3 ч. Полученные культуры до-
7.1 Гц), 5.94 д (1Н, Н16, J 7.5 Гц), 7.99 д (1Н, Н6'', J
бавляли в каждую лунку 384-луночного планше-
8.5 Гц), 8.30 д (1Н, Н5'', J 8.5 Гц), 9.11 с (1Н, Н3''),
та, содержащую исследуемый образец (плотность
11.19 уш.с (1H, NH). Спектр ЯМР 13С (CDCl3),
клеток 5×105 КОЕ/мл, общий объем 50 мкл). Все
δ, м.д.: 13.52 (С28), 17.46 (С18), 17.77 (С27), 20.56
планшеты накрывали и инкубировали при 37°С
[О-С(О)СН3], 20.77 (С6), 24.13 (С30), 24.44 (С19),
в течение 18 ч без встряхивания. Ингибирование
25.70 (С26), 27.99 (С23), 28.08 (С22), 29.69 (С2),
роста бактерий определяли измерением поглоще-
32.79 (С1), 33.29 (С7), 33.93 (С4), 35.71 (С10), 38.05
ния при 600 нм с использованием монохромного
(С15), 40.81 (С8), 43.86 (С12), 44.52 (С5), 46.08 (С13),
микропланшетного ридера Tecan M1000 Pro. Долю
48.60 (С14), 58.78 (С9), 74.13 (С16), 116.37 (С6''),
ингибирования роста рассчитывали для каждой
122.51 (С24), 123.54 (С3''), 128.92 (С2''), 130.01 (С5''),
лунки с использованием отрицательного контро-
131.10 (С20), 133.15 (С25), 137.60 (С4''), 145.13 (С1''),
ля (только для среды) и положительного контроля
147.73 (С17), 166.54 (С3),
170.43
[О-С(О)СН3],
(бактерии без ингибиторов) на том же планшете.
172.98 (С21), 209.36 (С11). Масс-спектр (MALDI
Образцы со значением ингибирования выше 80%
TOF/TOF), m/z (Iотн, %): 693 (100) [М + Н]+, 715
для обеих реплик классифицировали как активные
(91) [M + Na]+. Вычислено, %: С 64.15; Н 6.98; N
вещества. Образцы с показателями ингибирования
8.09. С37Н48N4O9. Найдено, %: С 64.12; Н 7.00; N
от 50 до 80% для обеих реплик классифицировали
8.11.
как частично активные.
Биологическая активность соединений 1-20.
Минимальную ингибирующую концентра-
Противомикробный скрининг in vitro проводили
цию (MIC, мкг/мл) определяли в соответствии с
в Университете Квинсленда (Австралия) в рам-
рекомендациями Института клинических и лабо-
ках программы «Сообщества по исследованию
антимикробных препаратов» [The Community for
мую низкую концентрацию, при которой наблюда-
Antimicrobial Drug Discovery (CO-ADD)], финан-
лось полное ингибирование бактерий или грибков.
сируемой Wellcome Trust (Великобритания) на 5
Полное ингибирование роста было определено
бактериальных штаммах: Escherichia coli (ATCC
при ≤ 20% роста (или > 80% ингибирования).
25922), Klebsiella pneumoniae (ATCC 700603), Aci-
Тесты проводили в двойном повторе. Макси-
netobacter baumannii (ATCC 19606), Pseudomonas
мальный процент ингибирования роста обознача-
aeruginosa (ATCC 27853) и Staphylococcus aureus
ли как Dmax. Соединения классифицировали как
(ATCC
43300). Противогрибковую активность
активные при MIC ≤ 16 мкг/мл в любой реплике
определяли на 2 грибковых штаммах: Candida
(n = 2 на разных планшетах).
albicans (ATCC 90028) и Cryptococcus neoformans
(ATCC 208821) [28]. Для испытаний использовали
Цитотоксическая активность (СС50, мкг/мл) -
растворы соединений 1-20 в ДМСО. Растворитель
концентрация исследуемого соединения, при кото-
ДМСО не оказывает негативного воздействия на
рой происходила гибель 50% клеток линии эмбри-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
48
САЛИМОВА, ПАРФЕНОВА
ональных почек человека HEK293. Максимальная
на стадии образования гидразонпроизводных фу-
доля цитотоксичности обозначалась как Dmax.
зидановых тритерпеноидов. Изучена антибакте-
Соединение считалось токсичным при CC50 ≤
риальная активность полученных соединений и
32 мкг/мл. Кроме того, образцы были отмечены
установлено, что пропаргиловый эфир 4, а также
как частично цитотоксичные, если Dmax ≥ 50%
индольные аналоги 8 и 15 проявляют противоми-
даже при CC50 выше максимальной тестируемой
кробное действие, сравнимое с противомикроб-
концентрации.
ным действием фузидовой кислоты.
Гемолитическая активность (HC50, мкг/мл) -
БЛАГОДАРНОСТИ
концентрация исследуемого вещества, вызываю-
Противомикробный скрининг in vitro соедине-
щая 50% гемолиз эритроцитов. Максимальную
ний 1-20 проводился по программе CO-ADD (The
долю гемолиза обозначали как Dmax. Низкое зна-
Community for Antimicrobial Drug Discovery), фи-
чение Dmax при НС50 > 32 мкг/мл (максимально
нансируемой Wellcome Trust (Великобритания) и
испытанная концентрация) указывала на образцы
Университетом Квинсленда (Австралия). Струк-
без гемолитической активности. Образцы, обла-
турные исследования проведены в Региональном
дающие гемолитической активностью, были оха-
Центре коллективного пользования
«Агидель»
рактеризованы при НС50 ≤ 32 мкг/мл. Кроме того,
УФИЦ РАН, Отделение - Институт нефтехимии и
образцы были помечены как частично гемолити-
катализа УФИЦ РАН.
ческие, если Dmax ≥ 50% даже при HC50 выше мак-
ФОНДОВАЯ ПОДДЕРЖКА
симальной тестируемой концентрации.
Работа выполнена в рамках госзадания
Колистин и ванкомицин использовали в каче-
№ AAAA-A19-119022290012-3.
стве положительных стандартов при скрининге
ингибирования грамотрицательных и грамполо-
ИНФОРМАЦИЯ ОБ АВТОРАХ
жительных бактерий, соответственно. Флуконазол
Салимова Елена Викторовна, ORCID: http://
использовали в качестве стандартного фунги-
doi.org/0000-0002-4328-5080
цидного средства в экспериментах по определе-
нию противогрибковой активности в отношении
Парфенова Людмила Вячеславовна, ORCID:
C. albicans и C. neoformans. Тамоксифен и мелит-
тин использовали в качестве положительных стан-
КОНФЛИКТ ИНТЕРЕСОВ
дартов при проверке цитотоксической и гемоли-
Авторы заявляют об отсутствии конфликта ин-
тической активности, соответственно. Методики
тересов.
тестирования противомикробной, фунгицидной,
цитотоксической и гемолитической активности
СПИСОК ЛИТЕРАТУРЫ
in vitro соединений приведены на сайте http://
1. Sundberg R.J. Indoles. Charlottesville: Elsevier Ltd.
1996. doi 10.1016/B978-0-12-676945-6.X5019-4
ЗАКЛЮЧЕНИЕ
2. Austin J.F., MacMillan D.W.C. J. Am. Chem. Soc.
2002, 124, 1172-1173. doi 10.1021/ja017255c
Осуществлен синтез индолов фузидановых
3. Wan Y.C., Li Y.H., Yan C.X., Yan M., Tang Z.L.
тритерпеноидов по реакции Фишера на основе
Eur. J. Med. Chem. 2019, 183, 111691. doi 10.1016/
3,11-диоксоаналогов фузидовой кислоты и ее ме-
j.ejmech.2019.111691
тилового, бензилового и пропаргилового эфиров.
4. Wang Q., Arnst K.E., Wang Y., Kumar G., Ma D.,
Установлено, что реакция циклизации проходит с
White S.W., Miller D.D., Li W., Li W. J. Med.
высокой хемоселективностью по положению 3 мо-
Chem.
2019,
62,
6734-6750. doi
10.1021/
лекулы, тогда как 11-кето-функция во взаимодей-
acs.jmedchem.9b00706
ствие не вступает. Показано, что при вовлечении
5. Hansen K.Ø., Andersen J.H., Bayer A., Pandey S.K.,
в реакцию Фишера 2,4-динитрофенилгидразина
Lorentzen M., Jørgensen K.B., Sydnes M.O., Gut-
внутримолекулярной конденсации в индольный
tormsen Y., Baumann M., Koch U., Klebl B., Eick-
цикл не происходит, и реакция останавливается
hoff J., Haug B.E., Isaksson J., Hansen E.H.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
РЕАКЦИЯ ФИШЕР
А В СИНТЕЗЕ НОВЫХ ТРИТЕРПЕНОВЫХ ИНДОЛОВ
49
J. Med. Chem. 2019, 62, 10167-10181. doi 10.1021/
17.
Zhou L.M., Kong F.D., Fan P., Ma Q.Y., Xie Q.Y.,
acs.jmedchem.9b01006
Li J.H., Zheng H.Z., Zheng Z.H., Yuan J.Z., Dai H.F.,
6.
Chio C.-M., Huang Y.-C., Chou Y.-C., Hsu F.-C.,
Luo Q.Q., Zhao Y.X. J. Nat. Prod. 2019, 82, 2638-2644.
Lai Y.-B., Yu C.-S. ACS. Med. Chem. Lett. 2020, 11,
doi 10.1021/acs.jnatprod.9b00620
589-596. doi 10.1021/acsmedchemlett.0c00064
18.
Findlay A., Foot J.S., Buson A., Deodhar M., Jarnic-
7.
Zidar N., Secci D., Tomasič T., Mašič L.P., Kikelj D.,
ki A.G., Hansbro P.M., Liu G., Schilter H., Tur-
Passarella D., Argaez A.N., Hyeraci M., Via L.D. ACS.
ner C.I., Zhou W., Jarolimek W. J. Med. Chem. 2019,
Med. Chem. Lett. 2020, 11, 691-697. doi 10.1021/
62, 9874-9889. doi 10.1021/acs.jmedchem.9b01283
acsmedchemlett.9b00557
19.
Norwood IV V.M., Brice-Tutt A.C., Eans S.O., Sta-
8.
Chadha N., Silakari O. Eur. J. Med. Chem. 2017, 134,
cy H.M., Shi G., Ratnayake R., Rocca J.R., Ab-
159-184. doi 10.1016/j.ejmech.2017.04.003
boud K.A., Li C., Luesch H., McLaughlin J.P., Hui-
9.
Ihnen M., zu Eulenburg C., Kolarova T., Qi J.W.,
gens III R.W. J. Med. Chem. 2020, 63, 5119-5138. doi
Manivong K., Chalukya M., Dering J., Anderson L.,
10.1021/acs.jmedchem.9b01924
Ginther C., Meuter A. Mol. Cancer Ther. 2013, 12,
20.
Allen Jr. G.R., Pidacks C., Weiss M.J. J. Am. Chem.
1002-1015. doi 10.1158/1535-7163.MCT-12-0813
Soc. 1966, 11, 2536-2544. doi 10.1021/ja00963a032
10.
Pham K.N., Lewis-Ballester A., Yeh S.R. J. Am.
Chem. Soc. 2019, 141, 18771-18779. doi 10.1021/
21.
Garbett N.C., Graves D.E. Curr. Med. Chem.
jacs.9b08871
Anti-Cancer Agents.
2004,
4,
149-172. doi
10.2174/1568011043482070
11.
McGowan D.C., Balemans W., Embrechts W., Motte M.,
Keown J.R., Buyck C., Corbera J., Funes M., More-
22.
Gu X.H., Wan X.Z., Jaing B. Bioorg. Med. Chem.
no L., Cooymans L., Tahri A., Eymard J., Stoops B.,
Lett.
1999,
9,
569-572. doi
10.1016/S0960-
Strijbos R., den Berg J.V., Fodor E., Grimes J.M.,
894X(99)00037-2
Koul A., Jonckers T.H.M., Raboisson P., Guillemont J.
23.
Fischer E., Jourdan F. Chem. Ber. 1883, 16, 2241-
J. Med. Chem. 2019, 62, 9680-9690. doi 10.1021/
2245. doi 10.1002/cber.188301602141
acs.jmedchem.9b01091
24.
Porcheddu A., Mura M.G., De Luca L., Pizzetti M.,
12.
Garai S., Kulkarni P.M., Schaffer P.C., Leo L.M.,
Taddei M. Org. Lett. 2012, 14, 6112-6115. doi 10.1021/
Brandt A.L., Zagzoog A., Black T., Lin X., Hurst D. P.,
ol3030956
Janero D.R., Abood M.E., Zimmowitch A., Straiker A.,
Pertwee R.G., Kelly M., Szczesniak A.M., Denovan-
25.
Park J., Kim D.H., Das T., Cho C.G. Org. Lett. 2016,
Wright E.M., Makie K., Hohmann A.G., Rggio P.H.,
18, 5098-5101. doi 10.1021/acs.orglett.6b02541
Laprairie R.B., Thakur G.A. J. Med. Chem. 2020, 63,
26.
Салимова Е.В., Магафурова А.А., Третьякова Е.В.,
542-568. doi 10.1021/acs.jmedchem.9b01142
Куковинец О.С., Парфёнова Л.В. ХГС. 2020, 56,
13.
Amaradhi R., Banik A., Mohammed S., Patro V.,
800-804. [Salimova E.V., Magafurova A.A., Tret’ya-
Rojas A., Wang W., Motati D.R., Dingledine R.,
kova E.V., Kukovinets O.S., Parfenova L.V. Chem.
Ganesh T. J. Med. Chem. 2020, 63, 1032-1050. doi
Heterocycl. Compd. 2020, 56, 800-804.] doi 10.1007/
10.1021/acs.jmedchem.9b01218
s10593-020-02733-
14.
Baqi Y., Phillaiyar, T., Abdelrahman A., Kaufmann O.,
27.
Салимова Е.В., Мамаев А.Г., Третьякова Е.В., Ку-
Alshaibani S., Rafehi M., Ghasimi S., Akari R., Rit-
ковинец О.С., Мавзютов А.Р., Швец К.Ю., Пар-
ter K., Simon K., Spinrath A., Kostenis E., Zhao Q.,
фенова Л.В. ЖОрХ. 2018, 54, 1395-1402. [Salimo-
Köse M., Namasivayam V., Müller C.E. J. Med.
Chem.
2018,
61,
8136-8154. doi
10.1021/
va E.V., Mamaev A.G., Tretyakova E.V., Kukovi-
acs.jmedchem.7b01768
nets O.S., Mavzyutov A.R., Shvets K.Yu., Parfeno-
va L.V. Russ. J. Org. Chem. 2018, 54, 1411-1418.] doi
15.
Baird-Lambert J., Davis P.A., Taylor K.M. Clin. Exp.
10.1134/S1070428018090245
Pharmacol. Physiol. 1982, 9, 203-212. doi 10.1111/
j.1440-1681.1982.tb00798.x
28.
Blaskovich M.A., Zuegg J., Elliott A.G., Cooper M.A.
16.
Group P.C. The Lancet. 2001, 358, 1033-1041. doi
ACS Infect. Dis. 2015, 1, 285-287. doi 10.1021/
10.1016/S0140-6736(01)06178-5
acsinfecdis.5b00044
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
50
САЛИМОВА, ПАРФЕНОВА
Fischer Reaction in the Synthesis
of New Fusidane Triterpene Indoles
E. V. Salimova* and L. V. Parfenova
Institute of Petrochemistry and Catalysis of Russian Academy of Sciences, prosp. Oktyabrya, 141, Ufa, 450075 Russia
*e-mail: salimovaev@mail.ru
Received August 2, 2021; revised August 22, 2021; accepted August 26, 2021
The reaction of 3,11-dioxo derivatives of fusidic acid and its esters with phenylhydrazine under the conditions of
the Fischer reaction proceeded with high chemoselectivity at the 3-oxo group of the molecule with the formation
of of fusidane indoles. The involvement of 3-chlorophenyl hydrazine in the reaction provides a mixture of two
isomers: 6-chloro- and 4-chloro derivatives in a ratio of 3:2. As a result of the interaction of fusidane ketones
with 2,4-dinitrophenylhydrazine, the fusidane hydrazones were isolated. In the course of studying the biological
activity of the obtained compounds, derivatives that show high antibacterial activity against Staphylococcus
aureus (MRSA) with a minimum inhibitory concentration of ≤0.25 μg/ml were found.
Keywords: triterpenoids, fusidic acid, benzyl ether, propargyl ether, Fisher reaction, indoles, hydrazones
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022