ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 1, с. 51-60
УДК 547.431
СИНТЕЗ ПРОИЗВОДНЫХ 2-ОКСААДАМАНТАНА
© 2022 г. Е. А. Ивлеваa, *, В. В. Клепиковa, Ю. Э. Хатмуллинаa,
В. Б. Рыбаковb, Ю. Н. Климочкинa
a ФГБОУ ВО «Самарский государственный технический университет»,
Россия, 443100 Самара, ул. Молодогвардейская, 244
b ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»,
Россия, 119991 Москва, Ленинские горы, 1, стр. 3
*e-mail: ivleva.ea@samgtu.ru
Поступила в редакцию 19.07.2021 г.
После доработки 11.08.2021 г.
Принята к публикации 14.08.2021 г.
Изучены превращения 1,3-дихлорпроизводных адамантана в дымящей азотной кислоте, приводящие к
смеси продуктов 2-оксаадамантановой структуры. Изучены особенности строения полученных 2-окса-
адамантанов с помощью 2D ЯМР спектроскопии и РСА. Полученные соединения могут быть исполь-
зованы в направленном конструировании веществ высокой степени молекулярной сложности с целью
изучения биологической активности.
Ключевые слова: 2-оксаадамантан, дымящая азотная кислота, трансаннулярная циклизация, фрагмен-
тация Гроба
DOI: 10.31857/S0514749222010049
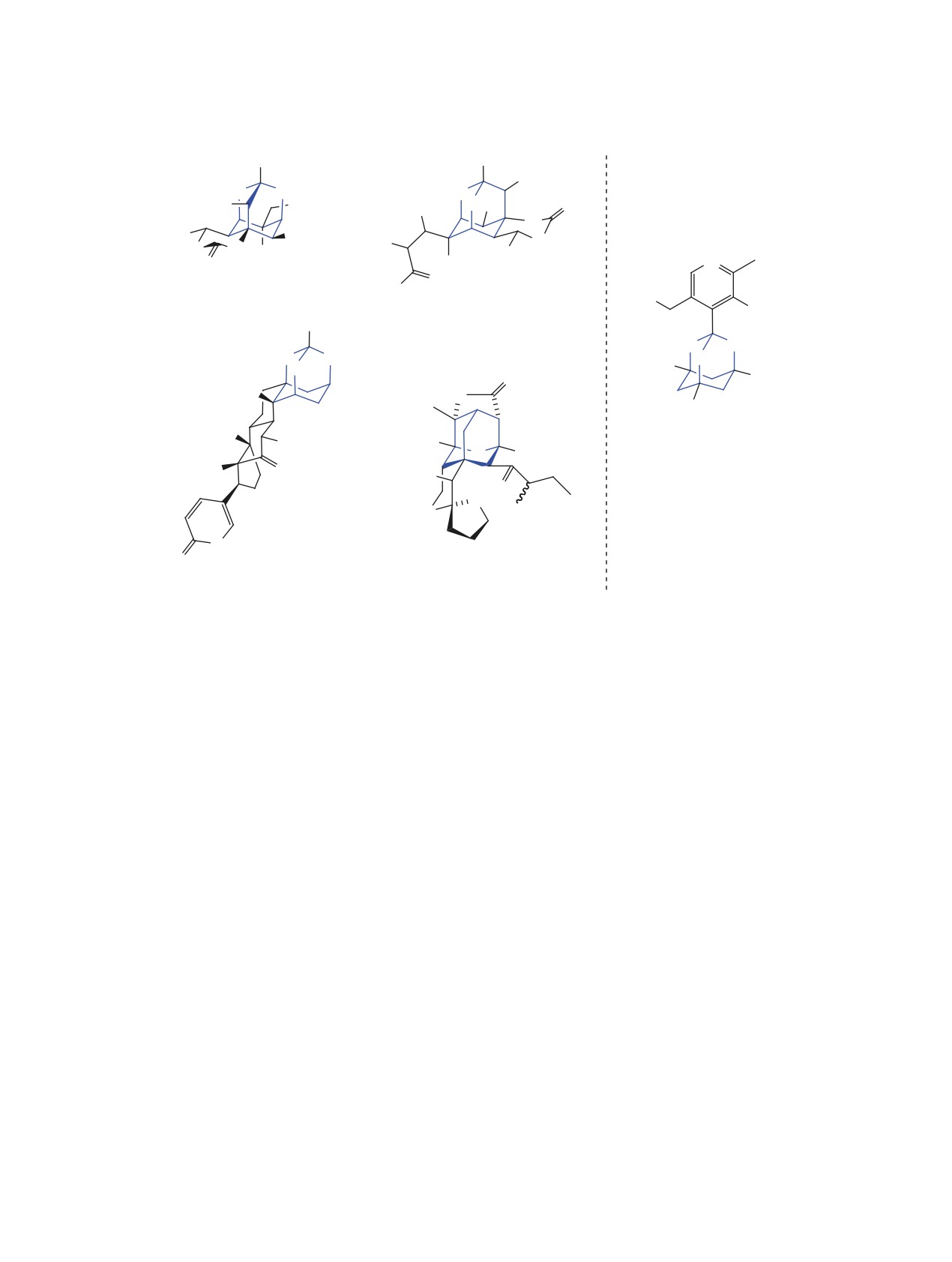
ВВЕДЕНИЕ
получены конформационно жесткие краун-эфиры,
некоторые из которых проявляют сравнимую с из-
Полициклические гетерокаркасные структуры,
вестными краун-эфирами (15-краун-5, 18-краун-6)
содержащие фрагменты оксаадамантана и олиго-
селективность связывания с ионами щелочных ме-
оксаадамантанов, встречаются в природных со-
таллов [11, 12].
единениях. Примерами таких соединений (рис. 1)
являются тетродотоксин - один из самых токсич-
Существует две стратегии к построению систе-
ных небелковых ядов, выделенный из рыб отряда
мы 2-оксаадамантана, первая из которых включает
трансаннулярные циклизации в ряду производных
Tetraodontiformes, чирикитотоксин - небелковый
бицикло[3.3.1]нонана [13]. Ряд соединений 2-ок-
яд, выделенный из жабы Atelopus chiriquiensis,
саадамантановой структуры был получен посред-
дайгремонтианин - выделен из тропических цве-
ством циклизации производных бицикло[3.3.1]-
тов Kalanchoe daigremontiana, фусидилактон С -
нонена-2, содержащих заместитель в положении
обладает противогрибковой активностью [1] в от-
эндо-7 [14-21]. Другой метод синтеза производных
ношении Eurotium repens и Fusarium oxysporum.
2-оксаадамантана - циклизация с участием экзо-
Среди олигооксаадамантанов синтетического про-
циклических связей. Широко используемыми суб-
исхождения можно выделить триоксаадамантан-
стратами для данного типа превращений являются
триолы (тривиальное название бананины), пока-
бицикло[3.3.1]нонан-3,7-дион и 7-метиленбици-
завшие высокую эффективность в ингибировании
кло[3.3.1]нонан-3-он. Идея этого превращения
геликазы nsp13 коронавирусов [2-4] (рис. 1).
заключается в промежуточном образовании эндо-
Соединения, содержащие фрагмент оксаада-
функциональных производных бицикло[3.3.1]но-
мантана, нашли свое применение в синтезе био-
нана, способных к трансаннулярной циклизации
логически активных веществ [5-10]. На их основе
через вторую кратную связь. По данному методу
51
52
ИВЛЕВА и др.
OH
OH
OH
O O
HO
OH
OO OH
NH
HO
N
HO
OH
H
H2N
N
HN
N
OH
HO
H
H
OH
N
HN
O
HO
HO
Тетродотоксин
Чирикитотоксин
OH
CH3
O O
O O
O
O
HO
O
OH
OHC
O
HO
HO
Бананин
OH
HO
O
OH
H3C
O
HO
O
O
O
O
O
Дайгремонтианин
Фусидилактон С
Рис. 1. Примеры природных соединений, содержащих фрагменты оксаадамантанов в структурах
получен ряд 1-замещенных и 1,3-дизамещенных
Таким образом, существующие подходы к по-
2-оксаадамантанов [5, 8, 9, 12, 22-33].
лучению 2-оксаадамантана и его производных в
основном заключаются в использовании соеди-
Вторая стратегия включает окислительные
нений бицикло[3.3.1]нонана в качестве исходных
трансформации полициклических каркасных
субстратов. Этот путь сложен, поскольку синтез
структур. Она основывается на расщеплении со-
исходных бициклических структур во многих слу-
единений оксагомоадамантана, образующихся
чаях достаточно трудоемок. Общим недостатком
из 2-замещенных адамантанов. Окисление 2-ме-
обеих стратегий в некоторых случаях является
тил-2-адамантанола и
2-фенил-2-адамантанола
использование дорогостоящих реагентов и раство-
в системе Pb(OAc)4/I2 приводит к производным
рителей. В связи с этим возникает необходимость
оксагомоадамантана, последующее кислотное
поиска легкодоступных субстратов и реагентов,
расщепление которых дает соединения 2-окса-
позволяющих получить целевые 2-оксаадаманта-
адамантановой структуры [34-36]. Похожий тип
ны за одну синтетическую операцию. В качестве
превращений может быть проведен с использова-
таких субстратов могут быть рассмотрены 1,3-ди-
нием 2-адамантанона и 2-адамантанола в качестве
галогенадамантаны, поскольку они являются син-
исходных субстратов и m-CPBA в качестве окис-
тетически доступными соединениями для получе-
лителя [37-39]. В 1996 г. был опубликован новый
ния различных функциональных производных.
подход к синтезу 2-оксаадамантана [40], который
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
заключался в перегруппировке пероксиэфира, об-
разующегося in situ из 2-метил-2-адамантанола
Ранее было установлено, что в реакции
под действием трифторнадуксусной кислоты по
1,3-дихлорадамантана с дымящей азотной кис-
механизму реакции Криге [41]. Позднее данная ре-
лотой, в том числе в присутствии уксусного ан-
акция была реализована на трифторацетате 2-ме-
гидрида, происходит нитролиз с образованием
тил-2-адамантанола [42] и высших диамантоидах
3-хлор-1-адамантилнитрата и 1,3-динитроксиада-
[43].
мантана [44, 45]. Изменение условий реакции (от-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
СИНТЕЗ ПРОИЗВОДНЫХ 2-ОКСААДАМАНТАНА
53
Схема 1
OH
OH
Cl
OH
HNO3
O
O
O
Cl
+
Me
+
Cl
Cl
Me
Me
20-25°C
Me
Cl
3 ч
Me
Me
Me
Me Cl Cl
Cl
1
2
3
4
сутствие Ac2O, комнатная температура) приводит
В масс-спектре хлорида 2 имеется пик молекуляр-
к образованию смеси продуктов 2-оксаадаманта-
ного иона (m/z 230).
новой структуры. Реакцию проводили с исполь-
В спектре ЯМР 1Н соединения 3 протоны ме-
зованием 5,7-диметил-1,3-дихлорадамантана (1) в
тильных групп проявляются в виде двух синглетов
качестве исходного субстрата (схема 1).
при 0.97 и 1.07 м.д. соответственно. Уширенный
По данным ГЖХ содержание продуктов 2, 3
синглет при 3.19 м.д. соответствует протону ги-
и 4 после 3 ч выдерживания реакционной сме-
дроксильной группы. Протоны хлорметильной
си составляет 66.1, 32.6 и 1.3% соответствен-
группы резонируют в виде двух дублетов при 3.52
но. Полученную смесь продуктов разделяли
и 3.73 м.д. с КССВ 11.7 Гц. Сигнал метинового
флэш-хроматографией. В индивидуальном виде
протона проявляется при 3.96 м.д. в виде сингле-
удалось выделить соединения 2 и 3.
та. В спектре ЯМР 13С четвертичный сигнал атома
углерода, связанный с ОН группой, проявляется
С помощью спектров 1Н-13С HMBC и 1Н-13С
при 95.8 м.д. Сигналы метильных групп проявля-
HSQC определили структуру продуктов 2 и 3. В
ются в области сильного поля при 26.7 и 28.8 м.д.
спектре ЯМР 1Н соединения 2 протоны метильных
соответственно. Сигнал метинового атома угле-
групп проявляются в виде синглета при 0.96 м.д.
рода проявляется при 66.0 м.д. В спектре 1Н-13С
Синглет при 2.70 м.д. соответствует атому водо-
HMBC (рис. 4) для метинового протона (3.96 м.д.)
рода ОН группы, а синглет при 3.44 м.д. принад-
наблюдаются корреляции с атомами С3, С10, С5,
лежит атомам водорода хлорметильной группы.
С6 (78.4, 37.2, 37.4, 42.0 м.д.) и атомом углерода
Сигнал четвертичного атома углерода, связан-
хлорметильной группы (49.8 м.д.). Протон хлор-
ного с ОН группой, проявляется при 96.5 м.д. В
метильной группы при 3.52 м.д. взаимодействует
спектре 1Н-13С HMBC для протонов хлорметиль-
с атомами С3 и С4 (78.4 и 66.0 м.д. соответствен-
ной группы наблюдаются корреляции с атома-
но). Отсутствуют корреляции с атомом углерода
ми С4,10 и С3 (42.8 и 76.4 м.д. соответственно)
(рис. 2). Для однозначного подтверждения струк-
С1 (95.8 м.д.). В масс-спектре дихлорида 3 име-
туры были выращены монокристаллы соединения
2 из петролейного эфира, и проведен РСА (рис. 3).
OH
1
2
8
O
9
Cl
Me
7
3
10
5
6
4
H
Me
H
Рис. 2. Дальние взаимодействия некоторых атомов во-
Рис. 3. Молекулярная структура соединения 2 в пред-
дорода и углерода в спектре 1H-13C HMBC соедине-
ставлении неводородных атомов эллипсоидами тепло-
ния 2
вых колебаний с 30%-ной вероятностью [46]
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
54
ИВЛЕВА и др.
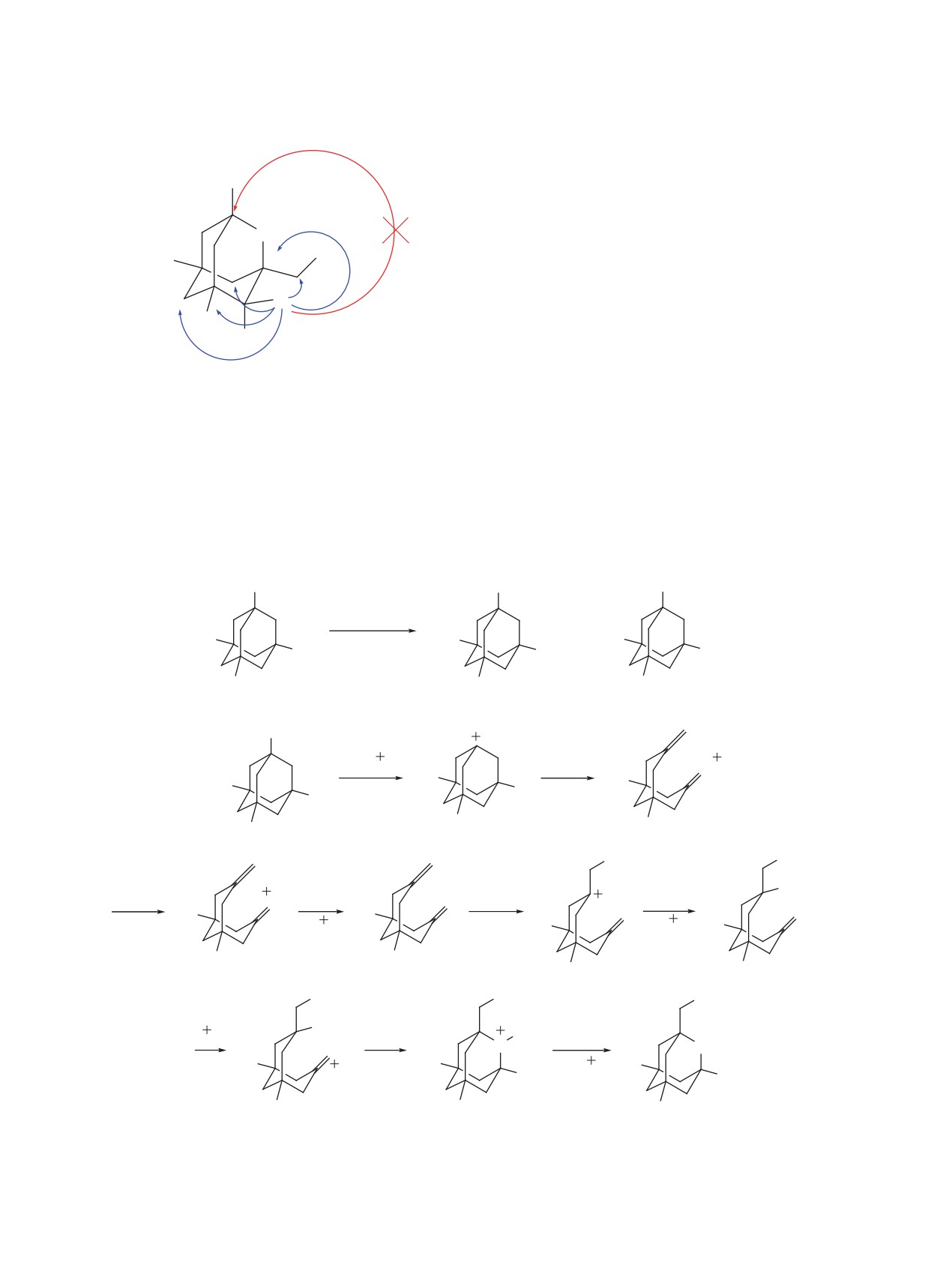
метил-1,3-динитроксиадамантана (6) [44]: через
10 мин после начала реакции. Содержание 2-окса-
OH
адамантанов 2, 3 и 4 по данным ГЖХ составило
1
9.3, 4.8 и 0.6% соответственно, а нитроксипроиз-
8
O
2
водных - 85.3%. Перекристаллизацией получен-
9
Cl
Me
7
ной смеси из метанола был выделен 5,7-диме-
3
10
тил-1,3-динитроксиадамантан (6), что подтверж-
6
5
H
дено спектрами ЯМР 1Н и 13С.
4
Me
Мы предполагаем, что 5 протонируется по
Cl
ONO2-группе, что сопровождается отщеплением
Рис. 4. Дальние взаимодействия некоторых атомов во-
молекулы азотной кислоты и образованием кар-
дорода и углерода в спектре 1H-13C HMBC соедине-
бокатиона А, который подвергается фрагментации
ния 3
Гроба [47] и через ряд промежуточных превра-
щений приводит к
7-метиленбицикло[3.3.1]но-
ется малоинтенсивный пик молекулярного иона
нан-3-ону (В). Присоединение высвободившегося
(m/z 264).
хлора к В, реакция с HNO3, последующая тран-
Реакция протекает через образование 5,7-ди-
саннулярная циклизация и отщепление катиона
метил-3-хлор-1-адамантилнитрата
(5) и
5,7-ди-
нитрония приводят к продукту 2 (схема 2).
Схема 2
Cl
ONO2
ONO2
HNO3
Me
20-25°C
Me
+ Me
Cl
Cl
ONO2
10 мин
Me
Me
Me
1
5
6
ONO2
Cl
H Me
Me
Me
-HNO3
Cl
Cl
Me
Me
Me
5
A
Cl
Cl
ONO2
H2O
Cl2
HNO3
OH
O
Me
Me
O
O
-HCl
-Cl-
Me
-H
Me
-H
Me
Me
Me
Me
B
Cl
Cl
Cl
ONO
2
NO2
H
O
O
OH
Me
Me
Me
-NO2
OH
OH
Me
Me
Me
2
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
СИНТЕЗ ПРОИЗВОДНЫХ 2-ОКСААДАМАНТАНА
55
Схема 3
O
OH
O
O
OH
H+
Cl2
O
Cl
Cl
Me
Cl
Cl
Me
Me
Me
-H2O
-Cl-
Me
Me
Me
Me
Cl
2
C
D
E
O
OH
OH
ONO2
HNO3
H+
O
O
Me
Cl
Cl
Cl
E
Me
Me
-H+
-NO
+
2
Me
Me
Me
Cl
Cl
Cl
Cl
3
4
Спирт 2, вероятно существующий в реакцион-
дихлорида 3 и трихлорида 4. Однако это отража-
ной смеси в равновесии со своей раскрытой фор-
ется на выходе продуктов, что связано с парал-
мой С, через стадию дегидратации с образованием
лельным протеканием более глубоких окисли-
бициклононенового производного D подвергает-
тельных трансформаций в условиях реакции. Так,
ся электрофильной атаке хлором, возникающим
при непродолжительном кипячении реакционной
за счет окисления хлорид иона дымящей азотной
смеси наряду с продуктами 3 и 4 было зафикси-
кислотой, с образованием катиона E, присоеди-
ровано образование 1-хлорметил-5,7-диметил-3-
нение нитрат-аниона к которому с последующей
оксо-2-оксабицикло[3.3.1]нонан-7-карбальдегида
циклизацией приводит к образованию дихлорида
(7). Строение соединения 7 было подтверждено
3. Аналогичная последовательность превращений
данными 1H, 13C и 2D ЯМР спектроскопии.
способствует дальнейшему образованию трихло-
В спектре ЯМР 13С имеются сигналы четвер-
рида 4 из дихлорида 3 (схема 3).
тичных атомов углерода, отвечающих карбониль-
Строение кетоспирта C позволяет предполо-
ным группам при 169.4 и 202.9 м.д. соответствен-
жить альтернативный механизм включения второ-
но. В спектре 1Н-13С HMBC отчетливо наблюда-
го атома хлора в структуру 2 - через его енольную
ется корреляция протонов (2.17 и 2.44 м.д.) при С4
форму. Однако данные спектра 1H-13C HMBC со-
(42.5 м.д.) и атома углерода С3 (169.4 м.д.), а также
единения 3 позволяют однозначно доказать поло-
протона (9.36 м.д.) альдегидной группы с атомом
жение второго атома: как было упомянуто выше,
углерода С7 (45.4 м.д.), который, в свою очередь,
отсутствуют корреляции протона при атоме угле-
находит взаимодействие с протонами одной из ме-
рода С4 с атомом С1 (рис. 4).
O
Предложенный нами механизм превращения
H
исходного субстрата 1 в продукты 2-оксаадаман-
4
3
2
тановой природы 2-4 объясняет невозможность
H
O
CHO
селективного получения 2, т.к. его образование из
5
1
Cl
Me
промежуточного нитроксипроизводного 5 и даль-
6
9
H
7
H
нейшее превращение в дихлорид 3 - параллельно
10
8
протекающие процессы. С другой стороны, более
Me
длительное выдерживание реакционной массы, в
H
H
том числе при повышенной температуре (40°С),
Рис. 5. Дальние взаимодействия некоторых атомов во-
позволяет практически полностью сместить со-
дорода и углерода в спектре 1H-13C HMBC соедине-
отношение продуктов в сторону образования
ния 7
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
56
ИВЛЕВА и др.
Схема 4
OH
OH
Cl
OH
O
HNO3
O
O
+
Cl
+
Cl
20-25°C
Cl
Cl
1.5 ч
Cl
Cl
Cl
8
9
10
11
тильных групп (1.09 м.д.) и протонами при С6 и С8
лий. Флэш-хроматографию проводили на приборе
(рис. 5). Имеют место и другие корреляции, гово-
BUCHI Reveleris X2 (Швейцария), адсорбент - си-
рящие в пользу предложенной структуры.
ликагель (25-40 мкм, 12 г), скорость потока МФ
20 мл/мин.
В аналогичных условиях была получена смесь
продуктов 2-оксаадамантанового строения 9-11
Температуры плавления определены капил-
из 1,3-дихлорадамантана (8), которую не удалось
лярным методом на приборе MPM-H2 90-264V/
разделить ни с помощью флэш-хроматографии,
AC (Германия), не корректировались. Элементный
ни перекристаллизацией (схема 4). Выдерживание
анализ выполнен на элементном анализаторе
реакционной смеси в течение 24 ч позволило вы-
EuroVector 3000 EA (Италия) с использованием в
делить смесь продуктов, в которой преобладал
качестве стандарта L-цистина. Чистота соедине-
3-хлорметил-4-хлор-1-гидрокси-2-оксаадамантан
ний ≥ 96.0%.
(10) - 81% по данным ГЖХ. Перекристаллизацией
1,3-Дихлор-5,7-диметиладамантан (1) полу-
из CCl4 был выделен продукт 10 в индивидуаль-
чен по методике [48].
ном виде.
Взаимодействие 1 с дымящей азотной кис-
В спектре ЯМР 1Н метиновый протон, связан-
лотой. К раствору 0.5 г (2.14 ммоль) 1,3-ди-
ный с атомом хлора, проявляется в виде сингле-
хлор-5,7-диметиладамантана (1) в 0.5 мл хло-
та при 4.33 м.д. Атомы водорода хлорметильной
ристого метилена в течение 5 мин при переме-
группы проявляются в виде двух дублетов при
шивании при комнатной температуре добавляли
3.49 и 3.64 м.д. с КССВ 11.6 Гц. В спектре ЯМР
2.2 мл (0.054 моль) дымящей азотной кислоты.
13С продукта 10 сигнал третичного атома углеро-
Реакционную смесь выдерживали в течение 3 ч,
да, связанного с хлором, проявляется при 60.5 м.д.,
выливали на измельченный лед и экстрагировали
сигнал четвертичного атома углерода, связанного
хлористым метиленом (4×10 мл). Объединенные
с ОН группой, проявляется при 94.8 м.д.
органические экстракты последовательно про-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
мывали раствором бисульфита натрия (2×10 мл),
ИК спектры регистрировались на спектрометре
10%-ным водным раствором NaOH (1×10 мл) и во-
Shimadzu IR Affinity-1 (Япония). Спектры ЯМР
дой. После этого экстракты сушили над Na2SO4,
1Н и 13C зарегистрированы на спектрометре JEOL
растворитель упаривали в вакууме. По данным
NMR-ECX400 (Япония) (400, 100 МГц, соответ-
ГЖХ содержание продуктов составило:
(2)
-
ственно), внутренний стандарт ТМС. Химические
66.1%; (3) - 32.6%; (4) - 1.3%. Полученную смесь
сдвиги сигналов определены в шкале δ, м.д.
разделяли на флэш-хроматографе с применени-
Масс-спектры зарегистрированы на спектрометре
ем градиентного элюирования в системе хлоро-
Finnigan Trace DSQ (США) с энергией ионизирую-
форм-этанол (6 мин: 0% этанола; 3 мин: 0→3%
щих электронов 70 эВ. Изучение количественного
этанола; 3 мин: 3→12% этанола), скорость потока
состава смесей проводили на газовом хроматогра-
МФ 20 мл/мин. После разделения были получены:
фе «Thermo Scientific Focus GC» (США). Кварцевая
3-хлорметил-5,7-диметил-2-оксаадамантанол-1
колонка DB-5: 30 м×0.32 мм. Температура колон-
(2). Выход 0.17 г (35%). Бесцветные кристаллы,
ки 80°С до 340°С (скорость нагрева 20°С/мин).
т.пл. 82.5-84°С (гексан). ИК спектр, ν, см-1: 3425
Температура испарителя 250°С. Газ-носитель - ге-
(OH), 2945, 2922, 2864, 2845 (СН). Спектр ЯМР 1Н
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
СИНТЕЗ ПРОИЗВОДНЫХ 2-ОКСААДАМАНТАНА
57
(СDCl3), δ, м.д.: 0.96 с (6Н, 2СН3), 1.20-1.21 м (2Н,
вакууме, остаток перекристаллизовывали из ме-
Н6,6'), 1.25-1.40 м (6Н, Н4,4', Н10,10', Н8,8'), 1.45-1.49
танола. Выход 45%, бесцветные кристаллы, т.пл.
м (2Н, Н9,9'), 2.70 с (1Н, ОН), 3.45 с (2Н, СН2Сl).
43-45°С (лит. т.пл. 43-45°С [49]).
Спектр ЯМР 13С (СDCl3), δ, м.д.: 29.2 (2СН3),
1-Хлорметил-5,7-диметил-3-оксо-2-окса-
33.3 (С5,7), 42.8 (С4,10), 47.1 (С8,9), 48.3 (С6), 51.8
бицикло[3.3.1]нонан-7-карбальдегид (7) полу-
(СН2Сl), 76.4 (С3), 96.6 (С1). Масс-спектр, m/z (Iотн,
чен в результате выдерживания 1.5 г (0.006 моль)
%): 230 (20) [M]+, 232 (6) [M + 2]+, 215 (4), 195 (2),
дихлорида 1 в 30 мл (0.72 моль) дымящей азотной
194 (4), 181 (100), 138 (50). Найдено, %: С 62.56; Н
кислоты в течение 4 сут с последующим кипячени-
8.20. С12Н19ClО2. Вычислено, %: С 62.47; Н 8.30.
ем реакционной массы в течение 20 мин и разделе-
анти-3-Хлорметил-4-хлор-5,7-диметил-2-
нием полученной смеси продуктов на флэш-хро-
оксаадамантанол-1 (3). Выход 0.1 г (18%). Бес-
матографе в системе четыреххлористый углерод-
цветные кристаллы, т.пл. 92-94°С. ИК спектр,
МТБЭ. Выход 0.2 г (12%). Бесцветные кристаллы.
ν, см-1: 3412 (OH), 2947, 2924, 2868, 2848 (СН).
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.02 с (3Н, СН3),
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.97 с (3Н, СН3),
1.09 с (3Н, СН3), 1.12-1.18 м (1Н, Н9'), 1.60-1.72
1.04 с (3Н, СН3), 1.02-1.06 м (1Н, Н6), 1.15 д (1Н,
м (3Н, Н6', Н6, Н8'), 2.17 д.д (1Н, Н4, 2J 19.0, 4J
H10, 2J 13.1 Гц), 1.42-1.53 м (2Н, Н8,8'), 1.67-1.72
1.8 Гц), 2.35 д.т (1Н, Н9, 2J 14.0, 4J 2.0 Гц), 2.45 д.т
м (3Н, Н6, Н9,9'), 1.76 д (1Н, H10', 2J 13.1 Гц), 3.19
(1Н, Н8, 2J 14.6, 4J 2.0 Гц), 2.53 д.д (1Н, Н4', 2J 19.0,
уш.с (1Н, ОН), 3.52 д (1Н, СН2Сl, 2J 11.7 Гц), 3.73
4J 2.5 Гц), 3.58 к (2Н, СН2Сl, 2J 11.6 Гц), 9.36 с (1Н,
д (1Н, СН2Сl, 2J 11.7 Гц), 3.96 с (1Н, Н4). Спектр
СНО), 9.37 с (1Н, СНО). Спектр ЯМР 13С (CDCl3),
ЯМР 13С (CDCl3), δ, м.д.: 26.7 (СН3), 28.8 (СН3),
δ, м.д.: 25.2 (СH3), 30.5 (С5), 30.8 (СH3), 39.7 (С6),
32.7 (С7), 37.2 (С10), 37.4 (С5), 42.0 (С6), 46.8 (С8),
41.6 (C8), 42.0 (С9), 42.5 (С4), 45.4 (С7), 50.6 (С10),
48.6 (С9), 49.8 (СН2Сl), 66.0 (С4), 78.4 (С3), 95.8
82.0 (С1), 169.4 (С3), 202.9 (СHO). Найдено, %: С
(С1). Масс-спектр, m/z (Iотн, %): 268 (1) [M + 4]+,
58.97; Н 6.92. С12Н17ClО3. Вычислено, %: С 58.90;
266 (3) [M + 2]+, 264 (6) [M]+, 253 (1), 251 (6), 249
Н 7.00.
(9), 206 (12), 204 (18) 159 (24), 137 (34), 105 (52),
Взаимодействие
1,3-дихлорадамантана
(8)
93 (64), 91 (100), 77 (78). Найдено, %: С 54.44;
с дымящей азотной кислотой. К раствору 0.5 г
Н 6.76. С12Н18Cl2О2. Вычислено, %: С 54.35; Н
(2.5 ммоль) 1,3-дихлорадамантана (8) в 0.5 мл
6.84.
хлористого метилена в течение 5 мин при пере-
Смесь 3 и анти-анти-3-хлорметил-4,10-ди-
мешивании при комнатной температуре добавля-
хлор-5,7-диметил-2-оксаадамантанола-1
(4).
ли 2.5 мл (0.06 моль) дымящей азотной кислоты.
Соотношение продуктов 3 и 4 по данным ГЖХ со-
Реакционную смесь выдерживали в течение 1.5 ч,
ставляет 5.5:1. Масс-спектр 4, m/z (Iотн, %): 302 (2)
выливали на измельченный лед и экстрагировали
[M + 4]+, 300 (4) [M + 2]+, 298 (7) [M]+, 265 (8), 263
хлористым метиленом (4×10 мл). Объединенные
(8), 241 (60), 91 (100), 77 (84).
органические экстракты последовательно промы-
5,7-Диметил-1,3-динитроксиадамантан (6). К
вали раствором бисульфита натрия (2×10 мл), 10%-
раствору 0.5 г (2.14 ммоль) 1,3-дихлор-5,7-диме-
ным водным раствором NaOH (1×10 мл) и водой.
тиладамантана (1) в 0.5 мл хлористого метилена в
После этого экстракты сушили над Na2SO4, раство-
течение 5 мин при перемешивании при комнатной
ритель упаривали в вакууме. Остаток разделяли на
температуре добавляли 2.2 мл (0.054 моль) дымя-
флэш-хроматографе с применением градиентного
щей азотной кислоты. Реакционную смесь выдер-
элюирования в системе хлористый метилен - эта-
живали в течение 10 мин, выливали на измельчен-
нол (7 мин: 0% этанола; 4 мин: 0→4% этанола;
ный лед и экстрагировали хлористым метиленом
2 мин: 4→10% этанола; 1.5 мин: 10→20% этанола),
(4×10 мл). Объединенные органические экстракты
скорость потока МФ 20 мл/мин. После разделения
последовательно промывали раствором бисульфи-
получили: смесь 3-хлорметил-2-оксаадаманта-
та натрия (2×10 мл), 10%-ным водным раствором
нола-1 (9), анти-3-хлорметил-4-хлор-2-оксаада-
NaOH (1×10 мл) и водой. После этого экстракты
мантанола-1 (10). Соотношение продуктов 9 и 10
сушили над Na2SO4, растворитель упаривали в
по данным ГЖХ составляет 3:1. Масс-спектр 9,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
58
ИВЛЕВА и др.
m/z (Iотн, %): 204 (7) [M + 2]+, 202 (30) [M]+, 167
проведены с использованием программного ком-
(30), 166 (76), 124 (100), 107 (88). Масс-спектр 10,
плекса SHELX [50]. Изображение молекулы по-
m/z (Iотн, %): 238 (8) [M + 2]+, 236 (20) [M]+, 203
лучено с использованием программы ORTEP [51].
(12), 201 (58), 200 (38), 165 (56).
Структурные параметры соединения 2 депониро-
ваны в Кембриджском банке структурных данных
Смесь анти-3-хлорметил-4-хлор-2-оксаада-
(депонент CCDC 1833287 [46]).
мантанола-1 (10), анти-анти-3-хлорметил-4,10-
дихлор-2-оксаадамантанола-1 (11). Соотношение
ЗАКЛЮЧЕНИЕ
продуктов 9 и 10 по данным ГЖХ составляет 1:2.
Предложен новый метод получения новых про-
Масс-спектр 11, m/z (Iотн, %): 274 (2) [M + 4]+, 272
изводных 2-оксаадамантанового ряда, заключаю-
(<2) [M + 2]+, 270 (4) [M]+, 239 (4), 237 (20), 235
щийся во взаимодействии 1,3-дихлорпроизводных
(28), 200 (6), 199 (20).
адамантана с дымящей азотной кислотой. В ходе
реакции протекает нитролиз исходных дигало-
анти-3-Хлорметил-4-хлор-2-оксаадаманта-
генпроизводных с образованием соответствующих
нол-1 (10). К раствору 1 г (5 ммоль) 1,3-дихлора-
нитроксипроизводных, которые затем претерпева-
дамантана (7) в 0.5 мл хлористого метилена в те-
ют структурные трансформации каркаса, включа-
чение 5 мин при перемешивании при комнатной
ющие фрагментацию Гроба и трансаннулярные
температуре добавляли 5 мл (0.12 моль) дымящей
циклизации. Полученные соединения могут быть
азотной кислоты. Реакционную смесь выдер-
использованы в качестве исходных субстратов в
живали в течение 24 ч, выливали на измельчен-
синтезе веществ с широким спектром биологиче-
ный лед и экстрагировали хлористым метиленом
ской активности.
(4×10 мл). Объединенные органические экстракты
последовательно промывали раствором бисульфи-
БЛАГОДАРНОСТИ
та натрия (2×10 мл), 10%-ным водным раствором
Работа выполнена с использованием научно-
NaOH (1×10 мл) и водой. После этого экстракты
го оборудования центра коллективного пользова-
сушили над Na2SO4, растворитель упаривали в
ния СамГТУ «Исследование физико-химических
вакууме. Остаток перекристаллизовывали из че-
свойств веществ и материалов», а также дифрак-
тыреххлористого углерода. Выход 0.46 г (40%).
тометра Stoe STADI VARI Pilatus100K, приобре-
Бесцветные кристаллы, т.пл. 121-123°C. Спектр
тенного по программе развития МГУ.
ЯМР 1Н (CDCl3), δ, м.д.: 1.53 т (2Н, СН, 2J 13.6 Гц),
ФОНДОВАЯ ПОДДЕРЖКА
1.74-1.87 м (2Н, СН), 1.98 с (2Н, СН), 2.35-2.44 м
(2Н, СН), 2.99 уш.с (1Н, ОН), 3.49 д (1Н, СН2Сl,
Синтез соединений выполнен при финансовой
2J 11.6 Гц), 3.64 д (1Н, СН2Сl, 2J 11.6 Гц), 4.33 с
поддержке Российского научного фонда (проект
№ 20-73-00250). Исследование спектральных ха-
(1Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 28.0
рактеристик выполнено при финансовой поддерж-
(СН2), 28.4 (СН), 30.9 (СН2), 36.3 (СН), 40.9 (СН2),
ке Минобрнауки РФ в рамках проектной части го-
42.8 (СН2), 49.8 (СН2), 60.5 (СН), 77.3 (Счетв), 94.8
сударственного задания № 0778-2020-0005.
(Счетв). Найдено, %: С 50.74; Н 5.88. С10Н14Cl2О2.
Вычислено, %: С 50.65; Н 5.95.
ИНФОРМАЦИЯ ОБ АВТОРАХ
Рентгеноструктурное исследование соедине-
Ивлева Елена Александровна, ORCID: http://
ния 2. Кристаллы продукта 2, пригодные для РСА,
doi.org/0000-0001-5778-860X
выращены из петролейного эфира путем медлен-
Рыбаков Виктор Борисович, ORCID: http://
ного испарения при комнатной температуре.
doi.org/0000-0002-6720-0619
Рентгеноструктурное исследование монокри-
Климочкин Юрий Николаевич, ORCID: http://
сталла соединения 2 проведено на дифрактометре
doi.org/0000-0002-7335-4040
Stoe STADI VARI Pilatus-100K (CuKα-излучение).
КОНФЛИКТ ИНТЕРЕСОВ
Структура расшифрована прямым методом и уточ-
нена полноматричным МНК в анизотропном при-
Авторы заявляют об отсутствии конфликта ин-
ближении для неводородных атомов. Все расчеты
тересов.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
СИНТЕЗ ПРОИЗВОДНЫХ 2-ОКСААДАМАНТАНА
59
СПИСОК ЛИТЕРАТУРЫ
J. Organomet. Chem.
1985,
292,
93-104. doi
10.1016/0022-328X(85)87325-3
1.
Krohn K., Biele C., Drogies K.H., Steingröver K.,
17.
Moon S., Wright D.G., Schwartz A.L. J. Org. Chem.
Aust H.J., Draeger S., Schulz B. Eur. J. Org.
1976, 41, 1899-1903. doi 10.1021/jo00873a003
Chem. 2002, 2002, 2331-2336. doi 10.1002/1099-
0690(200207)2002:14<2331::AID-EJOC2331>
18.
Yokoshima S., Ishikawa M., Beniyama Y., Fukuyama T.
3.0.CO;2-P
Chem. Pharm. Bull. 2016, 64, 1528-1531. doi 10.1248/
cpb.c16-00507
2.
Kesel A.J. Bioorg. Med. Chem. 2003, 11, 4599-4613.
doi 10.1016/S0968-0896(03)00500-5
19.
Djaidi D., Leung I.S.H., Bishop R., Craig D.C., Scud-
der M.L. J. Chem. Soc., Perkin Trans. 1. 2000, 2037-
3.
Adedeji A.O., Sarafianos S.G. Curr. Opin. Virology.
2042. doi 10.1039/b002544p
2014, 8, 45-53. doi 10.1016/j.coviro.2014.06.002
20.
Dixon D.D., Sethumadhavan D., Benneche T., Ba-
4.
Kesel A.J. Anti-Infect. Agents Med. Chem. 2006, 5,
naag A.R., Tius M.A., Thakur G.A., Bowman A.,
161-174.
Wood J.T., Makriyannis A. J. Med. Chem. 2010, 53,
5.
Duque M.D., Camps P., Profire L., Montaner S., Váz-
5656-5666. doi 10.1021/jm100390h
quez S., Sureda F.X., Mallol J., López-Querol M.,
21.
Krishnamurthy V.V., Fort Jr. R.C. J. Org. Chem. 1981,
Naesens L., De Clercq E., Prathalingam S.R., Kel-
46, 1388-1393. doi 10.1021/jo00320a033
ly J.M. Bioorg. Med. Chem. 2009, 17, 3198-3206. doi
10.1016/j.bmc.2009.02.007
22.
Benneche T., Tius M.A. Tetrahedron Lett. 2016, 57,
3150-3151. doi 10.1016/j.tetlet.2016.06.027
6.
Leiva R., Gazzarrini S., Esplugas R., Moroni A.,
Naesens L., Sureda F.X., Vázquez S. Tetrahedron Lett.
23.
Stetter H., Gärtner J., Tacke P. Сhem. Ber. 1966, 99,
2015, 56, 1272-1275. doi 10.1016/j.tetlet.2015.01.160
1435-1438. doi 10.1002/cber.19660990502
7.
Codony S., Pujol E., Pizarro J., Feixas F., Valverde E.,
24.
Yeh V.S.C., Kurukulasuriya R., Madar D., Patel J.R.,
Loza M.I., Brea J.M., Saez E., Oyarzabal J., Pineda-
Fung S., Monzon K., Chiou W., Wang J., Jacobson P.,
Lucena A., Perez B., Perez C., Rodríguez-Franco M.I.,
Sham H.L., Link J.T. Bioorg. Med. Chem. Lett. 2006,
Leiva R., Osuna S., Morisseau C., Hammock B.D.,
16, 5408-5413. doi 10.1016/j.bmcl.2006.07.062
Vazquez-Carrera M., Vazquez S. J. Med. Chem. 2020,
25.
Camps P., Gomez E., Munoz-Torrero D., Font-Bar-
63, 9237-9257. doi 10.1021/acs.jmedchem.0c00310
dia M., Solans X. Tetrahedron. 2003, 59, 4143-4151.
8.
Ronco C., Jean L., Renard P.Y. Tetrahedron Lett. 2010,
doi 10.1016/S0040-4020(03)00577-5
66, 7399-7404. doi 10.1016/j.tet.2010.07.021
26.
Meyer W.P., Martin J.C. J. Am. Chem. Soc. 1976. 98,
9.
Ronco C., Foucault R., Gillon E., Bohn P., Nachon F.,
1231-1241. doi 10.1021/ja00421a030
Jean L., Renard P.Y. ChemMedChem. 2011, 6, 876-
27.
Quast H., Witzel M., Peters E.M., Peters K., von
888. doi 10.1002/cmdc.201000523
Schnering H.G. Liebigs Ann. 1995. 1995, 725-738. doi
10.
Ho T.C., Tius M.A., Nikas S.P., Tran N.K., Tong F.,
10.1002/jlac.1995199505108
Zhou H., Zvonok N., Makriyannis A. Bioorg.
28.
Camps P., El Achab R., Görbig D.M., Morral J.,
Med. Chem. Lett. 2021, 38, 127882. doi 10.1016/
Muñoz-Torrero D., Badia A., Baños J.E., Vivas N.M.,
j.bmcl.2021.127882
Barril X., Orozco M., Luque F.J. J. Med. Chem. 1999.
11.
Mlinarić-Majerski K., Kragol G. Tetrahedron. 2001,
42, 3227-3242. doi 10.1021/jm980620z
57, 449-457. doi 10.1016/S0040-4020(00)01013-9
29.
Kubilius R., Bagdžiūnas G., Butkus E. Tetrahedron Lett.
12.
Marchand A.P., Kumar K.A., McKim A.S.
2011, 52, 346-348. doi 10.1016/j.tetlet.2010.11.067
Tetrahedron.
1997,
53,
3467-3474. doi
10.1016/
30.
Mlinarić-Majerski K., Kragol G., Ramljak T.Š. Synlett.
S0040-4020(97)00075-6
2008, 2008, 405-409. doi 10.1055/s-2008-1032054
13.
Аверина Н.В., Зефиров Н.С. Усп. хим.
1976,
31.
Camps P., El Achab R., Font-Bardia M., Gorbig D.,
45, 1077-1101. [Averina N.V., Zefirov N.S. Russ.
Morral J., Mufioz-Torrero D., Solans X., Simon M.
Chem. Rev.
1976,
45,
544-556.] doi
10.1070/
Tetrahedron. 1996, 52, 5867-5880. doi 10.1016/0040-
RC1976v045n06ABEH002680
4020(96)00217-7
14.
Liu J.H., Kovacic P. J. Org. Chem. 1973, 38, 3462-
32.
Степанов Ф.Н., Уточка Т.Н., Юрченко А.Г. ЖОрХ.
3466. doi 10.1021/jo00960a004
1972, 8, 1183-1186.
15.
Subramaniam R., Fort Jr R.C. J. Org. Chem. 1984, 49,
33.
Степанов Ф.Н., Уточка Т.Н., Юрченко А.Г.,
2891-2896. doi 10.1021/jo00190a010
Исаев С.Д. ЖОрХ. 1974, 10, 59-62.
16.
Bubnov Y.N., Grandberg A.I., Grigorian M.S., Kise-
34.
Black R.M., Gill G.B. J. Chem. Soc. D. 1971, 3, 172-
lev V.G., Struchkova M.I., Mikhailov B.M.
173. doi 10.1039/C29710000172
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
60
ИВЛЕВА и др.
35. Black R.M., Gill G.B. J. Chem. Soc., Perkin Trans. 1.
45. Климочкин Ю.Н., Ивлева Е.А., Скоморохов М.Ю.
1980, 410-418. doi 10.1039/P19800000410
ЖОрХ. 2020, 56, 1344-1352. [Klimochkin Yu.N., Ivle-
36. Marchand A.P., Kumar V.S., Hariprakasha H.K. J. Org.
va E.A., Skomorokhov M.Yu. Russ. J. Org. Chem. 2020,
Chem. 2001, 66, 2072-2077. doi 10.1021/jo001611c
56, 1525-1531.] doi 10.1134/S1070428020090043
37. Black R.M., Gill G.B., Hands D. J. Chem. Soc.,
46. Rybakov V.B., Klepikov V.V., Ivleva E.A., Klimoch-
Chem. Commun. 1972, 6, 311-312. doi 10.1039/
kin Y.N. CCDC
1833287: Experimental Crystal
C39720000311
Structure Determination. CSD Commun. 2018. doi
38. Suginome H., Yamada S. Tetrahedron Lett. 1984, 25,
10.5517/ccdc.csd.cc1zjp9h
3995-3998. doi 10.1016/0040-4039(84)80049-0
47. Grob C.A., Baumann W. Helv. Chim. Acta. 1955, 38,
39. Suginome H., Yamada S. Synthesis. 1986. 1986, 741-
594-610. doi 10.1002/hlca.19550380306
743. doi 10.1055/s-1986-31761.
48. Лерман Б.М., Арефьева З.Я., Кузыев А.Р., Толсти-
40. Krasutsky P.A., Kolomitsin I.V., Carlson R.M.,
ков Г.А. Изв. АН. СССР. Сер. хим. 1971, 20, 894.
Jones Jr M. Tetrahedron Lett. 1996, 37, 5673-5674.
[Lerman B.M., Aref’eva Z.Yu., Kuzyev A.R., Tolsti-
doi 10.1016/0040-4039(96)01202-6
kov G.A. Russ. Chem. Bull. 1971, 20, 820.] doi
41. Criegee R. Chem. Ber. 1945, 77, 722-726.
10.1007/BF00853945
42. Krasutsky P.A., Kolomitsyn I.V., Kiprof P., Carl-
49. Моисеев И.К., Багрий Е.И., Климочкин Ю.Н., Дол-
son R.M., Fokin A.A. J. Org. Chem. 2000, 65, 3926-
гополова Т.Н., Трахтенберг П.Л., Земцова М.Н. Изв.
3933. doi 10.1021/jo991745u
АН. СССР. Сер. хим. 1985, 9, 2141-2143. [Moise-
43. Fokin A.A., Zhuk T.S., Pashenko A.E., Dral P.O.,
ev I.K., Bagrii E.I., Klimochkin Yu.N., Dolgopolo-
Gunchenko P.A., Dahl J.E.P., Carlson R.M.K.,
va T.N., Zemtsova M.N., Trakhtenberg P.L. Russ. Chem.
Koso T.V., Serafin M., Schreiner P.R. Org. Lett. 2009,
Bull. 1985, 9, 1980-1982.] doi 10.1007/BF00953950
11, 3068-3071. doi 10.1021/ol901089h
50. Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
44. Климочкин Ю.Н., Ивлева Е.А., Моисеев И.К.
3-8. doi 10.1107/S2053229614024218
ЖОрХ. 2020, 56, 1353-1362. [Klimochkin Yu.N.,
Ivleva E.A., Moiseev I.K. Russ. J. Org. Chem. 2020,
51. Farrugia L.J. J. Appl. Crystallogr. 2012, 45, 849-854.
56, 1532-1539.] doi 10.1134/S1070428020090055
doi 10.1107/S0021889812029111
Synthesis of 2-Oxaadamantane Derivatives
E. A. Ivlevaa, *, V. V. Klepikova, Yu. E. Khatmullinaa, V. B. Rybakovb, and Yu. N. Klimochkina
a Samara State Technical University, ul. Molodogvardeiskaya, 244, Samara, 443100 Russia
b Lomonosov Moscow State University, Leninskie gory 1/3, Moscow, 119991 Russia
*e-mail: ivleva.ea@samgtu.ru
Received July 19, 2021; revised August 11, 2021; accepted August 14, 2021
The reaction of 1,3-dichloroadamantanes with fuming nitric acid gave the mixture of 2-oxaadamantane deriva-
tives. The structural features of new compounds are investigated using 2D NMR spectroscopy and XRD analysis.
The obtained compounds can be used in the directed synthesis of substances with high molecular complexity
for studying of biological activity.
Keywords: 2-oxaadamantane, fuming nitric acid, transannular cyclization, Grob fragmentation
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022