ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 1, с. 61-68
УДК 547.518 + 547
СИНТЕЗ 1,3-ДИ(3-R-1-АДАМАНТИЛ)АЦЕТОНОВ
© 2022 г. В. В. Ковалев*, Э. А. Шокова
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»,
Россия, 119991 Москва, Ленинские горы, 1, стр. 3
*e-mail: kovalev@petrol.chem.msu.ru
Поступила в редакцию 16.07.2021 г.
После доработки 10.08.2021 г.
Принята к публикации 12.08.2021 г.
Разработаны методы синтеза симметричных 1,3-ди(3-R-1-адамантил)ацетонов [R = ОН, арен, гетероарен,
NHCOR1, NHC(S)NH2] на основе реакции CF3SO3H/(CF3CO)2O-катализируемого самоацилирования
3-гидрокси-1-адамантилуксусной кислоты.
Ключевые слова: 1,3-ди(3-R-1-адамантил)ацетоны, 3-гидрокси-1-адамантилуксуная кислота, самоаци-
лирование, трифторметансульфоновая кислота, трифторуксусный ангидрид, трифторуксусная кислота
DOI: 10.31857/S0514749222010050
ВВЕДЕНИЕ
собствует енолизации и усиливает ацилирующую
способность ацилтрифторацетатов.
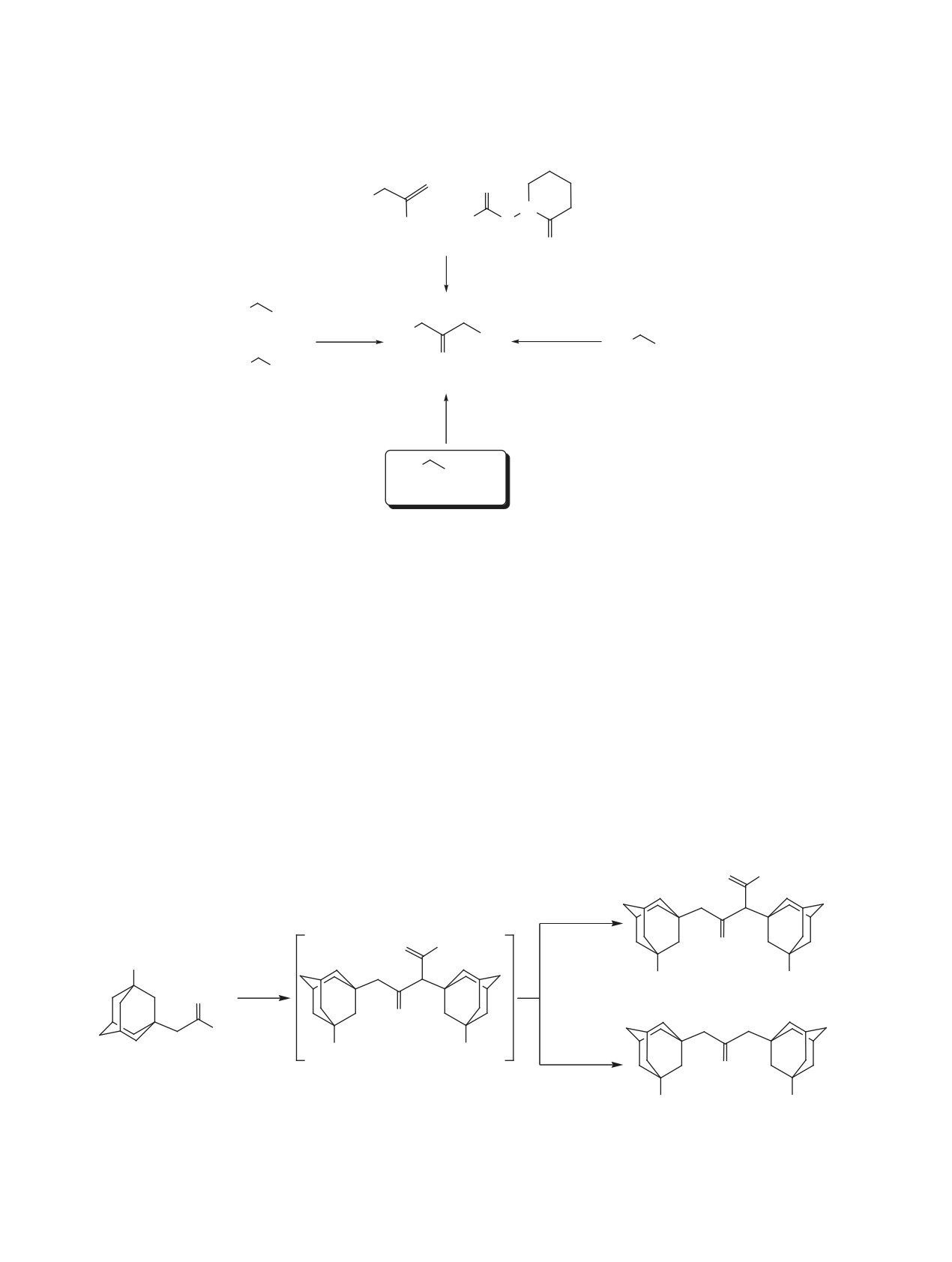
Симметричные 1,3-ди-(трет-алкил)ацетоны -
ключевые соединения в синтезе стерически нагру-
Предложенный путь синтеза 1,3-ди(1-адаман-
женных олефинов [1] и 1,2-диалкилциклопропе-
тил)ацетона значительно проще, чем обычно ис-
нонов [2, 3], широко используемых при получении
пользуемая для этих целей реакция Гриньяра хло-
циклопропениевых солей и винилциклопропенов
рангидрида 1-адамантилуксусной кислоты с со-
[4]. Ранее нами было показано [5], что CF3SO3H-
ответствующим алкиламагний галогенидом [7], а
катализируемое самоацилирование трет-бутил- и
также самокондесация этилового эфира 1-адаман-
1-адамантилуксусных кислот в среде трифторук-
тилуксусной кислоты [2] или радикальное присо-
сусного ангидрида, является удобным методом син-
единение N-(1-адамантоилокси)пиридин-2-тиона
теза 2,4-ди-трет-алкил-β-кетокислот и их произ-
к 3-(1-адамантил)-2-нитропрепену [8] (схема 2).
водных (схема 1). При декарбоксилировании полу-
Причем, TfOH/TFAA-активированное самоацили-
ченных β-кетокислот с высоким выходом были по-
рование 1-адамантилуксусной кислоты 1 позволя-
лучены симметричные 1,3-диалкилацетоны. Три-
ет получать с высоким выходом 1,3-ди(1-адаман-
фторуксусный ангидрид (TFAA), используемый
тил)ацетон 2 без выделения промежуточно образу-
в качестве среды и активатора, легко образует с
ющейся 2,4-ди(1-адамантил)-β-кетокислоты.
карбоновыми кислотами ацилтрифторацетаты,
которые являются хорошими ацилирующими реа-
Целью этой работы явилось изучение возмож-
гентами [6], а присутствие CF3SO3H (TfOH) спо-
ности синтеза неизвестных ранее функционально
Схема 1
R
OH
1. TfOH/TFAA, ∆
H2O, ∆
Nu
R
R
R
R
для Nu = OH
2. NuH
O
O
O O
R = 1-адамантил, t-Bu; NuH = H2O, ROH, R'R''NH.
61
62
КОВАЛЕВ, ШОКОВА
Схема 2
O
Ad
N
NO2
+ Ad O
S
hν
40%
Ad COCl
Et2
BuLi, Cy2NH
O Ad
Ad
+
Ad COOEt
82%
87%
O
Ad MgCl
2
1. TfOH/TFAA, ∆;
90%
2. H2O, ∆
Ad COOH
1
Ad - 1-адамантил,
Cy - циклогексил.
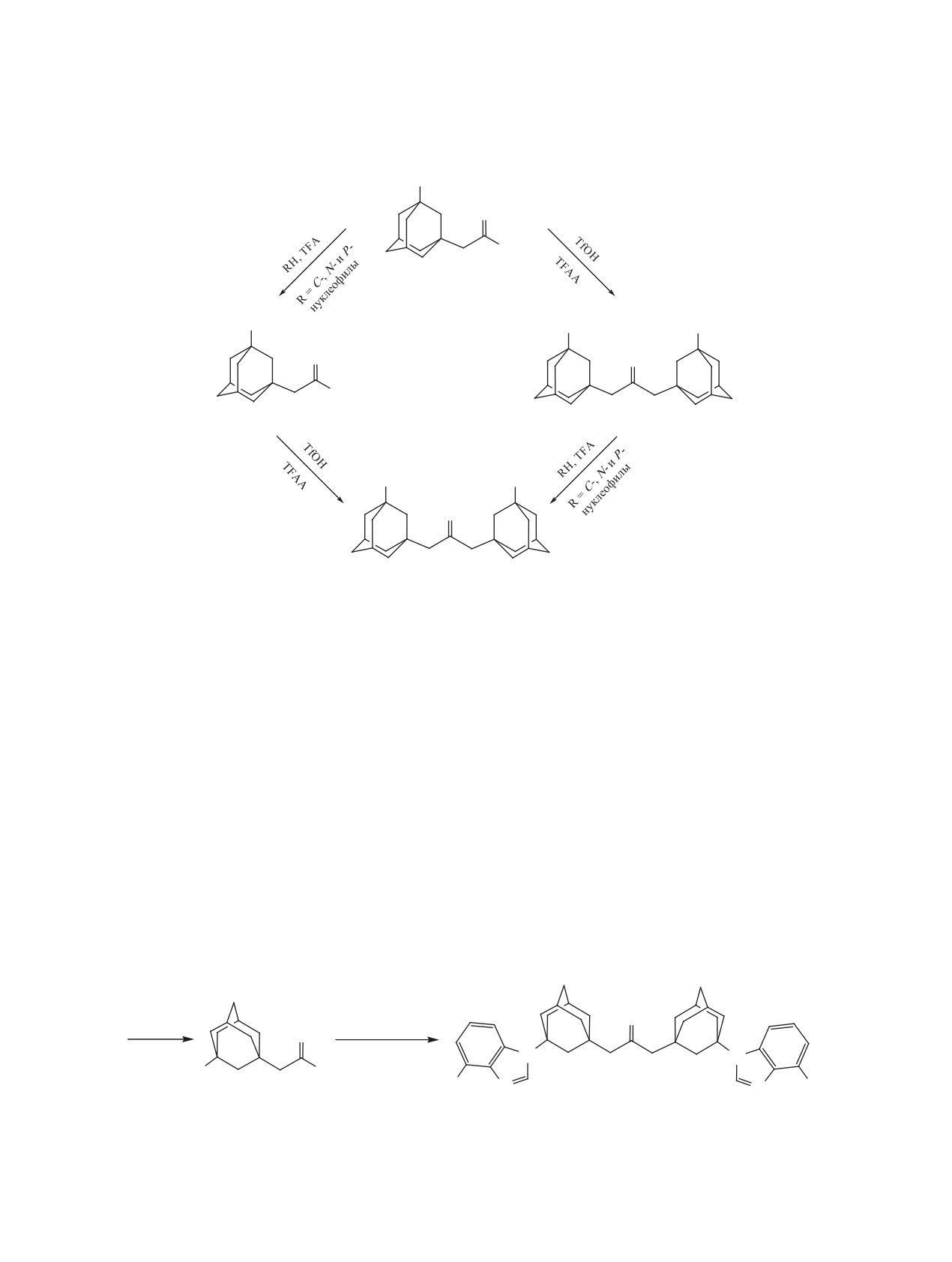
замещенных 1,3-ди-(3-R-1-адамантил)ацетонов, на
ном или водой, с последующим декарбоксилиро-
основе реакций CF3SO3H/(CF3CO)2O-катализи-
ванием, приводит к N-бензиламиду 2,4-ди(3-гид-
руемого самоацилирования
3-R-1-адамантилук-
рокси-1-адамантил)ацетоуксусной кислоты
4 и
сусных кислот.
1,3-ди(3-гидрокси-1-адамантил)ацетону
5, соот-
ветственно.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как мы показали ранее [9-11], 1-гидрокса-
Прежде всего была изучена возможность само-
дамантаны и другие третичные спирты в среде
ацилирования
3-гидрокси-1-адамантилуксусной
трифторуксусной кислоты (TFA) эффективно ал-
кислоты 3. Оказалось, что при кипячении кислоты
килируют C-, N- и P-нуклеофилы. Комбинация
3 в растворе TfOH/TFAA происходит образование
этого метода с возможностью самоацилирования
продукта самоацилирования - смешанного анги-
3-R-1-адамантилуксусных кислот позволяет осу-
дрида А (схема 3), обработка которого бензилами-
ществить два следующих подхода для получения
Схема 3
O
NHCH2Ph
1. PhCH2NH2
2. HO-
O
OC(O)CF
3
O
OH
OH
OH
TfOH
O
4, 76%
TFAA
O
OH
OAcF
OAcF
H2O, ∆
3
A
O
–CO2
OH
OH
5, 72%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
СИНТЕЗ 1,3-ДИ(3-R-1-АДАМАНТИЛ)АЦЕТОНОВ
63
Схема 4
OH
O
OH
3
R
OH
OH
O
O
OH
6
5
R
R
O
7
функционально замещенных 1,3-ди(3-R-1-адаман-
1-адамантилуксуные кислоты
6а-с (схема
5).
тил)ацетонов 7 (схема 4). Адамантилированием
Оказалось, что из кислот 6а-с в условиях CF3SO3H/
3-гидрокси-1 адамантилуксусной кислотой 3 раз-
(CF3CO)2O-активированного самоацилирования
личных нуклеофилов в трифторуксусной кислоте
с последующим декарбоксилированием только
могут быть получены функционально замещен-
из 3-(9-аденил)-1-адамантилуксусной кислоты 6а
ные 3-R-1-адамантилуксусные кислоты 6, TfOH/
был получен с умеренным выходом целевой функ-
TFAA-активированное самоацилированием ко-
ционально замещенный адамантилацетон 7а. В
торых должно приводить к целевым ацетонам 7.
остальных случаях образуются трудноразделимые
Другой путь заключается в синтезе из кислоты 3
смеси продуктов реакции.
диола 5, при адамантилирование которым различ-
Успешным для получение функционально за-
ных нуклеофилов также будут образовываться ди-
мещенных ацетонов 7 оказалось адамантилиро-
адамантилацетоны 7.
вание диолом 5 в среде трифторуксусной кислоты
Из 3-гидрокси-1-адантилуксусной кислоты
3
С- и N-нуклеофилов (схема 6). Бис-аденин содер-
кипячением в трифторуксусной кислоте с адени-
жащий ацетон 7а получается в этих условиях с
ном, урацилом и тиомочевиной были получены
гораздо более высоким выходом чем в результате
соответствующие функционально замещенные
самоацилирования
3-(9-аденил)-1-адамантилук-
Схема 5
O
XH/TFA
1. TfOH/TFAA
O
3
2. H2O, ∆
N
N
X
OH
H2N
N
N
NH2
6a-c
7a, 46%
6a, X = 9-аденин; 6b, X = 5-урацилил; 6c, X = NH2C(S)NH.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
64
КОВАЛЕВ, ШОКОВА
Схема 6
NH2CONH2
RH
O
O
5
TFA, ∆
TFA/TfOH, ∆
H2N
NH2
R
R
7a-g
7a, R = 9-аденил, 90%; 7b, R = 4-t-BuC6H4, 58%; 7c, R = 4-HOC6H4, 47%;
7d, R = 3,4-Me2C6H3, 95%; 7e, R = NHC(O)(3-Py); 7f, R = 5-барбитурил, 61%;
7g, R = NHC(S)NH2, 63%.
сусной кислоты 6а (90 vs 46%). Нагревание диола
1,3-Ди(1-адамантил)ацетон (2). Раствор 1-ада-
5 с трет-бутилбензолом, фенолом и о-ксилолом
мантилуксусной кислоты (0.194 мг, 1 ммоль),
дает соответствующие бис-арены 7b-d. В реакции
трифторуксусного ангидрида (0.75 мл, 5 ммоль)
с никотинамидом, барбитуровой кислотой и тио-
и CF3SO3H (132 мкл, 1.5 ммоль) в 1 мл CH2Cl2
мочевиной были получены бис-никотинамид 7е,
нагревали 3 ч при 60°С. Реакционную смесь упа-
бис-барбитурат 7а и бис-тиоуреидопроизводное
ривали при пониженном давлении, к остатку до-
7g. Известно [12], что адамантилирование моче-
бавили нас. раствор NaHCO3 до pH 8 и нагревали
вины гидроксиадамантанами в трифторуксусной
4 ч при 80°С. Выпавший после охлаждения смеси
кислоте в присутствии каталитических количеств
осадок отфильтровывали, растворяли в CH2Cl2 и
трифторметансульфоновой кислоты (TfOH) со-
профильтровывали через тонкий слой SiO2. Выход
провождается расщеплением уреидной группы и
145 мг (90%), белое твердое вещество, т.пл. 237-
образованием аминоадамантанов, в нашем случае
240°С, (235-240°С [5]).
в при адамантилировании мочевины спиртом 5
N-Бензиламид
2,4-ди(3-гидрокси-1-адаман-
образовалась трудноразделимая смесь продуктов
тил)ацетоуксусной кислоты (4). Раствор 3-ги-
реакции.
дрокси-1-адамантилуксусной кислоты 3 (210 мг,
Строение полученных соединений было доказа-
1 ммоль) в 2 мл 2.5% раствора TfOH в трифтор-
но данными спектров ЯМР 1H и 13C и элементного
уксусном ангидриде нагревали 2 ч при 60°С.
анализа. В спектрах ЯМР 1Н и 13С диадамантила-
Реакционную смесь упаривали при пониженном
цетонов 7 наблюдаются характерные сигналы ато-
давлении, остаток растворяли в 2 мл абсолютно-
мов 1H и 13С фрагмента СН2СОСН2 при δ ~2.1-2.3
го CH2Cl2 и к полученному раствору при охлаж-
и 56-59 м.д. для метиленовой групп и 208-210 м.д.
дении прибавляли раствор бензиламина (0.21 мл,
для карбонильного фрагмента, соответственно.
2 ммоль) и триэтиламина (0.28 мл, 2 ммоль) в 3 мл
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
абсолютного CH2Cl2. Через 12 ч растворитель от-
Спектры ЯМР 1H (400 МГц) и 13C (100 МГц)
гоняли, к остатку добавляли 1N NaOH (до рН ~10),
были зарегистрированы на спектрометре Bruker
смесь перемешивали еще 2 ч при комнатной тем-
Avance 400 (США) в CDCl3 и ДМСО-d6. Хими-
пературе и экстрагировали CH2Cl2. Остаток, выде-
ческие сдвиги измеряли в шкале δ (м.д.) отно-
ленный из экстракта, хроматографировали на SiO2
сительно сигналов растворителя (CDCl3: 7.26 и
(элюент CH2Cl2-MeOH, 98:2, v/v). Выход 190 мг
77.16 м.д.; ДМСО-d6: 2.50 и 39.52 м.д., соответ-
(77%), белое твердое вещество, т.пл. 133-135°C, Rf
ственно). ТСХ-анализ проводили на пластинках
0.40 (СHCl3-EtOH, 9:1). Спектр ЯМР 1H (400 МГц,
Merck DC Alufolien Kieselgel 60 F254, проявитель -
CDCl3), δ, м.д.: 1.35-1.70 м (24H), 2.10 уш.с (2H),
УФ (254 нм). Для препаративной колоночной хро-
2.12-2.25 м (3H), 2.46 д (1H, AdCH2, J 14.0 Гц),
матографии был использован силикагель Merck
3.42 с (1H, AdCH), 4.30 д.д (1H, PhCH2, J 14.7,
Kieselgel 40/60. Использованные в работе 3-R-1-
5.3 Гц), 4.50 д.д (1H, PhCH2, J 14.7, 5.3 Гц), 7.18-
адамантилуксусные кислоты были получены по
7.28 м (5H, Ph), 7.33 т (1Н, NH, J 5.3 Гц). Спектр
известным методикам: 3-гидрокси-1-адамантилук-
ЯМР 13С (100 МГц, CDCl3), δ, м.д.: 30.3, 30.3, 30.4,
сусная кислота (3) [13] и 3-(5-урацилил)-1-адаман-
30.5, 34.8, 35.3, 37.2, 38.9, 39.2, 40.9, 41.1, 43.4
тилуксусная кислота (6b) [12].
(NHCH2), 44.0, 44.2, 48.0, 49.8, 59.5 (AdCH2), 68.2,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
СИНТЕЗ 1,3-ДИ(3-R-1-АДАМАНТИЛ)АЦЕТОНОВ
65
68.5, 79.9 (AdCH), 127.4, 127.7, 128.6, 138.2, 165.6
7 ч при 80-85°С. Реакционную смесь разлагали во-
(CONH), 211.5 (CO). Найдено, %: C 75.45; H 8.71,
дой, выпавший осадок отфильтровали, промывали
N 2.66. C31H41NO4. Вычислено, %: C 75.73; H 8.41;
водой, диэтиловым эфиров и высушивали. Выход
N 2.85. M 491.66
210 мг (78%), т.пл. 168-170°C, Rf 0.35 (СHCl3-
EtOH, 6:1). Спектр ЯМР 1H (400 МГц, acetone-d6),
1,3-Ди(3-гидрокси-1-адамантил)ацетон
(5).
δ, м.д.: 1.62-1.75 м (6Н), 2.04-2.16 м (6Н), 2.22
Смесь 3-гидрокси-1-адамантилуксусной кислоты
уш.с (2H), 5.76 уш.с (2H), 8.30 уш.с (1H), 11.57
3 (210 мг, 1 ммоль), трифторуксусного ангидрида
уш.с (1H). Спектр ЯМР 13С (100 МГц, CDCl3), δ,
(0.70 мл, 5 ммоль) и CH2Cl2 (1 мл) перемешива-
м.д.: 30.0, 34.1, 34.4, 39.5, 42.2, 46.3, 47.2, 53.3,
ли 15 мин при комнатной температуре, затем до-
166.2, 171.1. Найдено, %: C 58.30; H 7.71; N 10.22.
бавляли TfOH (132 мкл, 1.5 ммоль) и полученный
C13H20N2O2S. Вычислено, %: C 58.18; H 7.51; N
раствор нагревали 3 часа при 60°С. Реакционную
10.44. M 268.38.
смесь упаривали при пониженном давлении, к
остатку добавляли 1.5 мл воды и 3 мл 3 N раствора
1,3-Ди[3-(6-аминопурин-9-ил)-1-адамантил]-
NaOH и нагревали 2 ч при 80°С. Выпавший после
ацетон (7a). a. Раствор 3-(6-аминопуринил-9)-1-
охлаждения осадок отфильтровывали, промыва-
адамантилуксусной кислоты 6а (130 мг,0.4 ммоль)
ли водой и высушивали. Выход 170 мг (95%), се-
в 2 мл трифторуксусного ангидрида перемешива-
рый порошок, т. пл. 270-273°С. Спектр ЯМР 1H
ли 15 мин при комнатной температуре, затем до-
(400 МГц, CDCl3), δ, м.д.: 1.50-1.54 м (12Н), 1.56
бавляли CF3SO3H (88 мкл, 1 ммоль) и полученный
уш.с (4H), 1.59-1.68 м (8Н), 2.16 уш.с (4H), 2.19
раствор нагревали 6 ч при 60°С. Реакционную
с (4Н, СН2СОСН2). Спектр ЯМР 13С (100 МГц,
смесь разлагали водой, нагревали в течении 8 ч
CDCl3), δ, м.д.: 30.1, 34.8, 36.3, 40.5, 44.0, 49.5, 56.8
при 80°С и нейтрализовали насыщенным раство-
(СН2СO), 68.3, 209.5 (CO). Найдено, %: C 76.75; H
ром NaHCO3 до pH 7. Через 12 ч образовавшийся
9.71. C23H34O3. Вычислено, %: C 77.05; H 9.56. M
осадок отфильтровывали, промывали метанолом и
358.25.
высушивали. Выход 55 мг (46%), белое твердое ве-
щество, т. пл. > 300°С, Rf 0.25 (СHCl3-EtOH, 9:1).
3-(6-Аминопуринил-9)-1-адамантилуксусная
кислота
(6а).
3-Гидрокси-1-адамантил уксус-
b. Смесь диола 3 (100 мг, 0.28 ммоль), адени-
ную кислоту 3 (210 мг, 1 ммоль), аденин (142 мг,
на (130 мкл, 1 ммоль), CF3CO2H (1 мл, 13 ммоль)
1.05 ммоль) и TFA (1.5 мл, 20 ммоль) нагревали
и TfOH (23 мкл, 0.25 ммоль) нагревали 10 ч при
в течение 12 ч при 105±5°С. Реакционную смесь
110±5°С. Реакционную смесь упаривали при по-
разлагали водой и нейтрализовали до рН 7 конц.
ниженном давлении и разлагали водой. Образо-
водным раствором NH3, осадок отфильтровывали,
вавшийся осадок отфильтровали, высушивали,
промывали водой, диэтиловым эфиром и высу-
растворяли в CH2Cl2 и профильтровали через
шивали. Выход 270 г (82%), белое твердое веще-
тонкий слой SiO2. Выход 150 мг (90%). Спектр
ство, т.пл. 175-177°C, Rf 0.20 (СHCl3-EtOH, 9:1,
ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.: 1.55-1.65
v/v). Спектр ЯМР 1H (400 МГц, DMSO-d6), δ, м.д.:
м (12H), 2.19-2.32 м (20H), 7.12 уш.с (4H, NH2),
1.68-1.55 м (6H), 2.09 с (2H), 2.23 уш.с (6H), 2.39-
8.07 с (2H, CHPur), 8.09 с (2H, CHPur). Спектр ЯМР
2.36 м (2H), 8.35 с (1H, CHPur), 8.36 с (1H, CHPur),
13С (100 МГц, ДМСО-d6), δ, м.д.: 29.1, 34.9, 35.0,
8.61 уш.с (2H, NH2). Спектр ЯМР 13С (100 МГц,
40.2, 45.2, 56.2, 57.7 (CH2СO), 120.1, 149.6, 151.5,
ДМСО-d6), δ, м.д.: 29.0, 34.1, 34.7, 40.0, 45.2, 47.3
156.3, 209.3 (CO). Найдено, %: C 66.33; H 6.68; N
(CH2COOH), 59.0, 119.6, 140.2, 146.0, 148.8, 152.3,
23.38. C33H40N10O. Вычислено, %: C 66.87; H 6.80;
172.2 (COОН). Найдено, %: C 62.05; H 6.75; N
N 23.63. M 592.75.
21.10. C17H21N5O2. Вычислено, %: C 62.37, H 6.47,
1,3-Ди[3-(4-трет-бутилфенил)-1-адамантил]-
N 21.39. М 327.38.
ацетон (7b). Смесь диола 3 (107 мг, 0.3 ммоль),
3-Тиоуреидо-1-адамантилуксусная кислота
трет-бутилбензола (160 мкл, 1 ммоль) и TFA
(6c). 3-Гидрокси-1- адамантилуксусную кислоту 3
(1 мл, 13 ммоль) нагревали 3 ч при 75°С. Реак-
(210 мг, 1 ммоль), тиомочевину (152 мг, 2 ммоль)
ционную смесь упаривали при пониженном дав-
и TFA (0.75 мл, 10 ммоль) нагревали в течение
лении и разлагали водой. Образовавшийся осадок
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
66
КОВАЛЕВ, ШОКОВА
отфильтровывали, промывали водой, высушивали,
1,3-Ди[3-(3-никотинамидо)-1-адамантил]-
растворяли в CH2Cl2 и профильтровали через тон-
ацетон (7e). Диол 3 (107 мг, 0.3 ммоль), никотина-
кий слой SiO2. Выход 170 мг (96%), белое твер-
мид (146 мг, 1.2 ммоль) и TFA (0.75 мл, 10 ммоль)
дое вещество, т.пл. 130-132°C, Rf 0.80 (СHCl3).
нагревали 12 ч при 100±5°С. Реакционную смесь
Спектр ЯМР 1H (400 МГц, CDCl3), δ, м.д.: 1.38 с
после охлаждения разлагали водой и экстраги-
(18Н, t-Bu), 1.64-1.72 м (12H), 1.82 уш.с (4H), 1.92
ровали CH2Cl2. Остаток (200 мг), после отгонки
уш.с (6H), 2.22 уш.с (4H), 2.28 с (4H, CH2CO), 7.34
растворителя, хроматографировали на SiO2 (элю-
д (4Н, J 8.0 Гц), 7.40 д (4Н, J 8.0 Гц). Спектр ЯМР
ент CH2Cl2-MeOH, 97:3). Выход 120 мг (71%),
13С (100 МГц, CDCl3), δ, м.д.: 28.9, 31.1 [С(СН3)3],
белое твердое вещество, т.пл. 155-157°C, Rf 0.30
33.9, 34.3, 35.6, 36.2, 41.2, 42.0, 48.0, 58.0 (CH2CO),
(СHCl3-EtOH, 9:1 v/v). Спектр ЯМР 1H (400 МГц,
124.1, 124.6, 147.1, 147.9, 209.9 (CO). Найдено, %:
ацетон-d6), δ, м.д.: 1.62-1.70 м (12H), 2.04-2.18
C 87.83; H 9.53. C43H58O. Вычислено, %: C 87.40;
м (16H, CH2Ad), 2.28 с (4H, COCH2),7.65 д.д (2Н,
H 9.89. M 590.92.
J 8.0, 4.0 Гц), 8.39 д (2Н, J 8.0 Гц), 8.78 д (2Н, J
1,3-Ди[3-(4-гидроксифенил)-1-адамантил]-
4.0 Гц), 9.08 уш.с (2Н). Спектр ЯМР 13С (100 МГц,
ацетон (7c). Смесь диола 3 (107 мг, 0.3 ммоль), фе-
ацетон-d6), δ, м.д.: 29.2, 34.6, 35.1, 39.9, 40.6, 45.0,
нола (112 мг, 1.2 ммоль) и TFA (0.75 мл, 10 ммоль)
52.6, 58.3 (CH2CO), 124.2, 132.6, 138.0, 145.2,
нагревали 9 ч при 100±5°С. Реакционную смесь
147.8, 162.9, 208.3 (CO). Найдено, %: C 74.35; H
после охлаждения разлагали водой, образовав-
7.53; N 9.49. C35H42N4O3. Вычислено, %: C 74.18;
шийся осадок отфильтровывали, промывали во-
H 7.47; N 9.89. M 566.73.
дой, высушивали и хроматографировали на SiO2
1,3-Ди{3-[пиримидин-2,4,6(1H,3H,5H)-три-
(элюент CH2Cl2-MeOH,
98:2). Выход
120 мг
он-5-ил]-1-адамантил}ацетон (7f). Раствор ди-
(78%), серое твердое вещество, т.пл. 147-150°C, Rf
ола 3 (70 мг, 0.2 ммоль) и барбитуровой кислоты
0.45 (СHCl3-EtOH, 9:1). Спектр ЯМР 1H (400 МГц,
(77 мг, 0.6 ммоль) в 2 мл 2%-го раствора TfOH
CDCl3 + CF3CO2D), δ, м.д.: 1.64-1.72 м (16H),
в TFA нагревали в течение 7 ч при 95±5°С.
1.78-1.86 м (8H), 2.19 уш.с (4H), 2.37 с (CH2CO),
Реакционную смесь после охлаждения разлагали
6.85 д (4Н, J 8.0 Гц), 7.21 д (4Н, J 8.0 Гц). Спектр
водой, образовавшийся осадок отфильтровыва-
ЯМР 13С (100 МГц, CDCl3 + CF3CO2D), δ, м.д.:
ли, промывали водой, метанолом и высушивали.
28.7, 35.0, 36.0, 41.3, 41.8, 48.0, 58.5 (CH2CO),
Выход 70 мг (61%), белое твердое вещество, т.пл.
114.6, 125. 7, 143.2, 151.6, 217.9 (CO). Найдено, %:
271-273°C. Спектр ЯМР 1H (400 МГц, ДМСО-d6),
C 82.73; H 8.53. C35H42O3. Вычислено, %: C 82.31;
δ, м.д.: 1.35-1.60 м (24H), 2.00 уш.с (4H), 2.12 уш.с
H 8.29. M 510.71.
(4H, COCH2), 2.72 с (2H, CH), 11.10 уш.с (4H, NH).
1,3-Ди[3-(3,4-диметилфенил)-1-адамантил]-
Спектр ЯМР 13С (100 МГц, ДМСО-d6), δ, м.д.:
ацетон (7d). Смесь диола 3 (72 мг, 0.2 ммоль),
28.5, 34.1, 35.2, 38.4, 39.2, 40.5, 44.4, 56.7 (CH2CO),
о-ксилола (61 мкл, 0.5 ммоль) и TFA (1 мл,
61.0 (CH), 151.48, 168.59, 209.3 (CO). Найдено, %:
13 ммоль) нагревали 8 ч при 95±5°С. Реакционную
C 64.63; H 6.53; N 9.33. C31H38N4O7. Вычислено,
смесь упаривали при пониженном давлении и раз-
%: C 64.34; H 6.62; N 9.68. M 578.66.
лагали водой, образовавшийся осадок отфильтро-
1,3-Ди[3-тиоуреидо-1-адамантил]ацетон (7g).
вали, промывали водой, метанолом и высушива-
ли. Выход 100 мг (93%), белое твердое вещество,
Диол 3 (107 мг, 0.3 ммоль), тиомочевина (152 мг,
т.пл. 106-108°C, Rf 0.80 (СHCl3). Спектр ЯМР 1H
2 ммоль) и TFA (0.75 мл, 10 ммоль) нагревали в
(400 МГц, CDCl3), δ, м.д.: 1.62-1.76 м (16H), 1.85
течении 12 ч при 100±5°С. Реакционную смесь
уш.с (8H, CHAd), 2.17 уш.с (4H, CHAd), 2.25 уш.с
после охлаждения разлагали водой, образовав-
(8H), 2.28 уш.с (6H, CH3), 7.06-7.16 м (6H). Спектр
шийся осадок отфильтровали, промывали водой и
ЯМР 13С (100 МГц, CDCl3), δ, м.д.: 19.2 (CH3), 20.0
высушивали. Выход 140 мг (98%), белое твердое
(CH3), 29.2, 34.7, 35.9, 36.5, 41.6, 42.4, 48.3, 58.4
вещество, т.пл. 128-130°C, Rf 0.33 (СHCl3-EtOH,
(CH2CO), 122.2, 126.2, 129.4, 133.7, 136.0, 148.1,
2:1, v/v). Спектр ЯМР 1H (400 МГц, ДМСО-d6 +
210.8 (CO). Найдено, %: C 87.83; H 9.53.C39H50O.
CF3CO2D), δ, м.д.: 1.50-1.60 м (12H), 1.87-1.97
Вычислено, %: C 87.59; H 9.42. M 534.81.
м (12H), 2.10 уш.с (4H), 2.22 уш.с (4H, CH2CO).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
СИНТЕЗ 1,3-ДИ(3-R-1-АДАМАНТИЛ)АЦЕТОНОВ
67
Спектр ЯМР 13С (100 МГц, ДМСО-d6 + CF3CO2D),
СПИСОК ЛИТЕРАТУРЫ
δ, м.д.: 29.8, 34.2, 35.6, 39.6, 42.5, 47.2, 53.4, 55.8
1.
Ionkin A.S., Marshall W.J., Fish B.M. Org. Lett.
(CH2CO), 164.3, 209.1 (CO). Найдено, %: C 63.05;
2008, 10, 2303-2305. doi 10.1021/ol800808g
H 8.33; N 11.59. C25H38N4OS2. Вычислено, %: C
2.
Stetter H., Becker G. Liebigs Ann. Chem. 1976, 1992-
63.25; H 8.07; N 11.80. M 474.73.
1996. doi 10.1002/jlac.197619760728
ЗАКЛЮЧЕНИЕ
3.
Ciabattoni J., Nathan E.C., Feiring A.E., Kociens-
Показано, что TfOH/TFAA-активированное
ki P.J. Org. Synth. 1974, 54, 97-100. doi 10.15227/
самоацилирование 3-гидрокси-1-адамантилуксус-
orgsyn.054.0097
ной кислоты 3 с последующим использованием
4.
Komatsu K., Kitagawa T. Chem. Rev. 2003, 103, 1371-
полученного
1,3-(3-гидрокси-1-адамантил)ацето-
1428. doi 10.1021/cr010011q
на 5 в реакциях адамантилирования С- и N-нук-
5.
Kovalev V., Shokova E., Shmailov A., Vatsouro I.,
леофилов в среде трифторуксусной кислоты яв-
Tafeenko V. Eur. J. Org. Chem. 2010, 3754-3761. doi
ляется эффективным методом синтеза симме-
10.1002/ejoc.201000312
тричных функционально замещенных 1,3-(3-R-1-
6.
Pal S., Khan M.A., Bindi P., Dubey P.K. Beilstein J.
адамантил)ацетонов 7a-g [R = арен, гетероарен,
Org. Chem. 2007, 3, 35. doi 10.1186/1860-5397-3-35
NHCOR1, NHC(S)NH2].
7.
Schulenberg J.W. Пат. 3728388 (1973). США. Chem.
ФОНДОВАЯ ПОДДЕРЖКА
Abstr. 1973, 79, 315732.
Работа выполнена в рамках государственного
8.
Barton D.H.R., Togo H., Zard S.Z. Tetrahedron. 1985,
задания «Нефтехимия и катализ. Рациональное
41, 5507-5516. doi 10.1016/S0040-4020(01)91351-1
использование углеродсодержащего сырья»,
9.
Khomich A.N., Shokova E.A., Kovalev V.V. Synlett.
№ 121031300092-6.
1994, 1027-1028. doi 10.1055/s-1994-23073
ИНФОРМАЦИЯ ОБ АВТОРАХ
10.
Shokova E., Mousoulou T., Lyzikov Yi., Kovalev V.
Synthesis. 1997, 1034-1040. doi 10.1055/s-1997-1304
Ковалев Владимир Васильевич, ORCID: http://
doi.org/0000-0003-4473-1107
11.
Erochina E., Shokova E., Lyzikov Yi., Kovalev V.
Synthesis. 1995, 851-854. doi 10.1055/s-1995-3999
Шокова Эльвира Александровна, ORCID: http://
12.
Shmailov A., Alimbarova L., Shokova E., Tafeenko V.,
doi.org/0000-0003-3065-637X
Vatsouro I., Kovalev V. Tetrahedron. 2010, 66, 3058-
КОНФЛИКТ ИНТЕРЕСОВ
3064. doi 10.1016/j.tet.2010.02.043
Авторы заявляют об отсутствии конфликта ин-
13.
Bott K. Chem. Ber. 1968, 101, 564-573. doi 10.1002/
тересов.
cber.19681010225
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
68
КОВАЛЕВ, ШОКОВА
Synthesis of 1,3-Di(3-R-1-adamantyl)acetones
V. V. Kovalev* and E. A. Shokova
Lomonosov Moscow State University, Leninskie gory, 1/3, Moscow, 119991 Russia
*e-mail: kovalev@petrol.chem.msu.ru
Received July 16, 2021; revised August 10, 2021; accepted August 12, 2021
The synthesis of symmetric 1,3-di(3-R-1-adamantyl)acetones [R = OH, arene, heteroarene, NHCOR1,
NHC(S)NH2] was carried out on the basis of the reaction CF3SO3H/(CF3CO)2O-catalyzed self-acylation 3-hy-
droxy-1-adamantylacetic acid.
Keywords: 1,3-di(3-R-1-adamantyl)acetones, 3-hydroxy-1-adamantylacetic acid, selfacylation, triflic acid,
anhydride, trifluoroacetic acid
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022