ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 1, с. 89-95
УДК 547.288.4 + 547.781
5,5'-ДИАРИЛЗАМЕЩЕННЫЕ 1,1'-ДИГИДРОКСИ-
2,2'-БИСИМИДАЗОЛЫ: РЕАКЦИЯ
С ТРИМЕТИЛФОСФИТОМ
© 2022 г. В. И. Краснов, И. А. Оськина*, А. Я. Тихонов
ФГБУН «Новосибирский институт органической химии им. Н.Н. Ворожцова СО РАН»,
Россия, 630090 Новосибирск, просп. Академика Лаврентьева, 9
*е-mail: oi@nioch.nsc.ru
Поступила в редакцию 26.07.2021 г.
После доработки 11.08.2021 г.
Принята к публикации 13.08.2021 г.
При взаимодействии 5,5'-диарилзамещенных 1,1'-дигидрокси-2,2'-бисимидазолов с (CH3O)3P образуются
соответствующие 5,5'-диарил-2,2'-бисимидазолил-1-олы и 5,5'-диарил-2,2'-бисимидазолы, содержащие
метильную группу у атома азота имидазольного кольца. Методы корреляционной спектроскопии (1H-1H
COSY, 1H-13C HSQC, 1H-13C HMBC, 1H-1H NOESY) использованы для установления структуры син-
тезированных соединений.
Ключевые слова: 5,5'-диарилзамещенные-1,1'-дигидрокси-2,2'-бисимидазолы, 2,2'-бисимидазолы,
восстановление
DOI: 10.31857/S0514749222010098
ВВЕДЕНИЕ
с хорошими выходами [2]. Чтобы расширить круг
реагентов, которые могут быть использованы для
1,1'-Дигидрокси-2,2'-бисимидазолы являются
восстановления арилзамещенных 1,1'-дигидрок-
синтетическими интермедиатами для синтеза
си-2,2'-бисимидазолов, в настоящей работе мы
2,2'-бисимидазолов [1, 2]. В свою очередь, 2,2'-
изучили взаимодействие 5,5'-диарилзамещенных
бисимидазолы составляют важную группу про-
1,1'-дигидрокси-2,2'-бисимидазолов с (CH3O)3P.
изводных имидазола и представляют интерес в
качестве исходных соединений для синтеза ши-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
рокого круга производных с ценными практи-
Нами была исследована реакция арилзамещен-
ческими свойствами [3-7]. Для восстановления
ных
1,1'-дигидрокси-2,2'-бисимидазолов
1а-с с
N-гидрокси-группы в имидазолах может быть ис-
триметилфосфитом при нагревании в диметил-
пользован большой набор реагентов [8-15], а вос-
формамиде. Как оказалось, при взаимодействии
становление
1,1'-дигидрокси-2,2'-бисимидазолов
соединений 1a-c с триметилфосфитом образуется
пока еще мало изучено [1, 2].
смесь соединений 2a-c и 3a-c с выходами 22-68%
Ранее при восстановлении арилзамещенных
и 2-13%, соответственно (схема 1).
1,1'-дигидрокси-2,2'-бисимидазолов
трифенил-
фосфином мы получили соответствующие арил-
Соединения строения
2a-c образуются с
замещенные 2,2'-бисимидазолы [1]. Также нами
большим выходом, чем соединения
3а-с и
было показано, что восстановление алкилзаме-
представляют собой продукт восстановления
щенных 1,1'-дигидрокси-2,2'-бисимидазолов три-
N-гидрокси-группы в одном из имидазольных
метилфосфитом приводит к образованию соответ-
колец. Соединения строения 3a-c образуются с
ствующих алкилзамещенных 2,2'-бисимидазолов
меньшим выходом, в них восстанавливаются обе
89
90
КРАСНОВ и др.
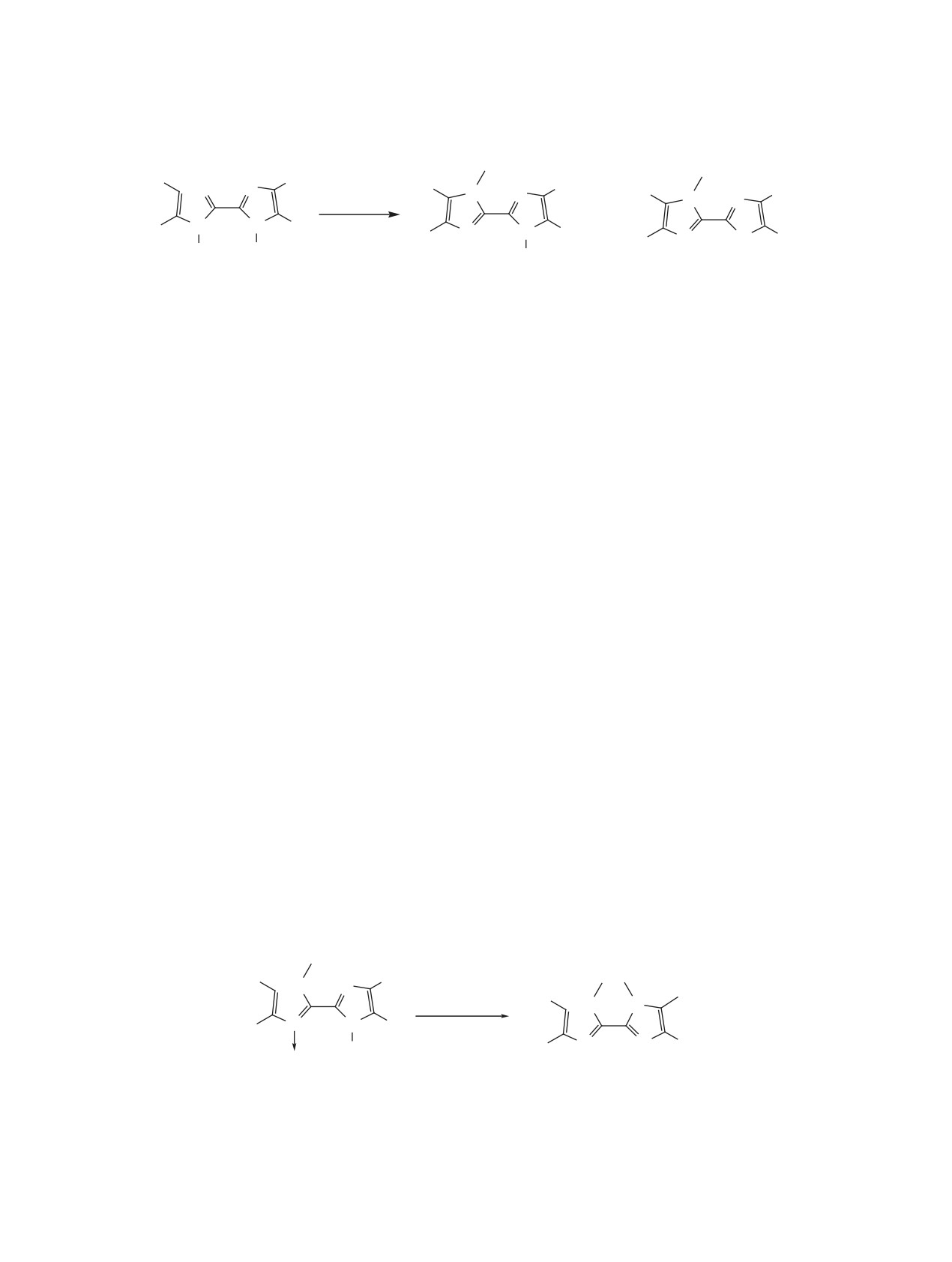
Схема 1
Me
Me N
N
Me
Me
N N
Me
Me
P(OMe)3
N
N
+
R
N
N
R
ДМФА
R
N
N
R
R
N
N
R
OH OH
H
OH
1a-c
2a-c
3a-c
2a, 68%
3a, 5%
2b, 29%
3b, 13%
2c, 22%
3c, 2%
R = тиофен-2-ил (a); R = Ph (b); R= п-MeOC6H4 (c).
N-гидрокси-группы. Каждое из полученных сое-
реляционной спектроскопии ЯМР: 1H-1H COSY,
динений содержит метильную группу у атома азо-
1H-13C HSQC и 1H-13C HMBC. Для определения
та в положении 3 одного из имидазольных колец.
взаимного расположения заместителей в имидазо-
Соединения 4а, b, которые являются продуктами
льных кольцах применяли метод 1H-1H NOESY.
метилирования по атому азота имидазольного
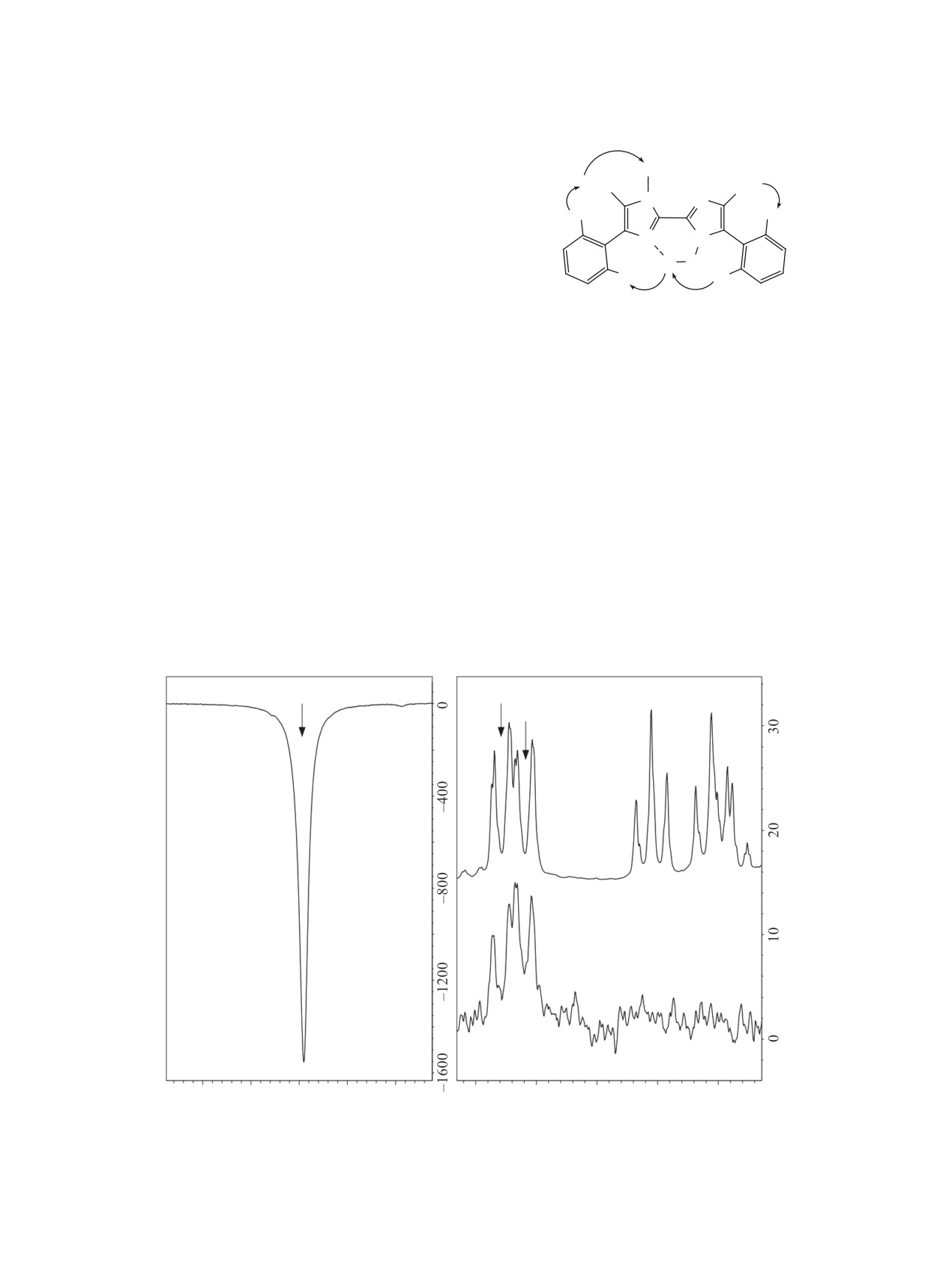
Пространственные взаимодействия, соот-
кольца соответствущих арилзамещенных 1,1'-ди-
ветствующие наблюдаемым кросспикам ЯЭО в
гидрокси-2,2'-бисимидазолов [1], реагируют с три-
спектре NOESY, иллюстрируются на примере со-
метилфосфитом с образованием симметричных
единения 2b на рис. 1. Взаимодействие протонов
5,5'-диарил-2,2'-(3,3'-N-метил)-бисимидазолов 5a,
метильной группы в положении 4', как с протона-
b (схема 2).
ми метильной группы в положении 3', так и с про-
тонами в орто-положении соседней фенильной
Очевидно, что и при взаимодействии соедине-
группы позволяет сделать однозначные отнесения
ний 4a, b с триметилфосфитом наряду с восста-
сигналов CH3-групп в положениях 4 и 4' и сигна-
новлением N-гидрокси-группы происходит мети-
лов протонов в орто-положениях двух арильных
лирование по атому азота в положении 3 имида-
заместителей.
зольного кольца с образованием соединений 5а, b.
По-видимому, алкилирующим агентом является
Важным обстоятельством для подтверждения
триметилфосфат [16], образующийся в ходе реак-
строения соединений 2а-с является определе-
ции из триметилфосфита.
ние относительного пространственного положе-
ния протона, связанного с гетероатомом. Для со-
Все синтезированные соединения были охарак-
единения 2b выполнен 1D-NOESY эксперимент
теризованы с использованием ЯМР 1H и 13C спек-
с использованием селективной рефокусировки
троскопии, масс-спектрометрии высокого разре-
cигнала слабопольного протона (17.2 м.д.) сфор-
шения, ИК-спектроскопии, температуры плавле-
мованным импульсом. Данным методом полу-
ния.
чен сигнал ЯЭО с достаточным разрешением
Для соединений 2а-с с целью установления
(рис. 2). Результат 1D-NOESY указывает на вза-
структуры использованы методы двумерной кор-
имодействие через пространство слабопольного
Схема 2
Me
Me N
N
Me
P(OMe)3
Me N
N
R
N
N
R
ДМФА
N
N
R
OH
R
O
4a, b
5a, b
5a, 53%
5b, 20%
R = тиофен-2-ил (a); R = Ph (b).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
5,5'-ДИАРИЛЗАМЕЩЕННЫЕ 1,1'-ДИГИДРОКСИ-2,2'-БИСИМИДАЗОЛЫ
91
протона с орто-расположенными протонами в
обеих фенильных группах, что следует ожидать
CH3
H3C
3
CH3
для геометрии молекулы с водородной связью
1'
5'
N
N
4
между атомом азота в положении 1' и гидроксиль-
H
2'
2
H
4'
3'
1
5
ной группой у атома азота в положении 1.
N
N
Отнесение сигналов в спектрах ЯМР
1H и
H
O
H
H
13C соединений 2а-с выполнено с использова-
2b
нием гомоядерных и гетероядерных корреляций.
Наиболее принципиальные для отнесения сигна-
Рис. 1. Пространственные взаимодействия некоторых
протонов в спектрах NOESY соединения 2b
лов гетероядерные корелляции, наблюдаемые в
спектре HMBC, изображены на рис. 3.
ДМСО-d6 на приборах Bruker AV-400 (рабочие ча-
Химические сдвиги сигналов атомов углерода
стоты 400.1 и 100.6 МГц соответственно), AV-300
имидазольного остова соединений 2а-с, а также
(300.1 и 75.5 МГц), DRX-500 (500.1 и 125.8 МГц).
связанных с ним метильных групп (см. таблицу)
Калибровка спектров осуществлялась: в спектрах
имеют близкие значения для одних и тех же поло-
ЯМР 1Н - по остаточным сигналам протонов в
жений, за исключением положений 5 и 5' (атомы
дейтерированном растворителе (7.24 м.д. для рас-
углерода, связанные с варьируемым арильным за-
творов в CDCl3, 2.50 м.д. - ДМСО-d6), в спектрах
местителем), что подтверждает сходство структу-
ЯМР 13С - по сигналам дейтерированного раство-
ры соединений 2а-с.
рителя (77.16 м.д. - CDCl3, 39.52 м.д. - ДМСО-d6)
[17]. Двумерные спектры ЯМР, а также 1D-NOESY
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
зарегистрированы на приборе Bruker AV-600
ИК спектры зарегистрированы в таблетках KBr
(600.3 МГц для ядер 1Н и 150.9 МГц для ядер
на приборе Bruker Vector-22. Спектры ЯМР 1Н и
13С) с использованием стандартных импульсных
13С зарегистрированы в растворе в CDCl3 или
программ фирмы Bruker (Германия): cosygpqf,
N-OH
5'-Ph (орто-H)
5-Ph (орто-H)
ЯМР 1H
1D-NOESY
1D-NOESY
17.4
17.3
17.2
17.1
17.0 м.д.
7.70
7.65
7.60
7.55
7.50 м.д.
Рис. 2. Рефокусируемый сигнал протона N-OH в 1D-NOESY спектре и сигналы протонов фенильных групп в 1D-NOESY
и спектрах ЯМР 1H соединения 2а
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
92
КРАСНОВ и др.
CH3
CH3
H3C
CH3
H
CH3
3C
N
N
N
N
S
N
N
S
H
N
N
H
H
O
H
O
H
H
H
H
R
R
R = H, OMe.
2a
2b, c
Рис. 3. Дальние взаимодействия ядер некоторых атомов водорода и углерода в спектрах 1H-13C HMBC соединений 2а-с
noesyph, hsqcetgp, hmbcgpndqf и selnogp (с исполь-
бежевые кристаллы, т.пл. 237.6°C (с разл.). ИК
зованием 180-градусного селективного Гауссового
спектр, ν, см-1: 1651, 1608, 1579, 1506, 1444, 1404,
импульса Gauss1.1000 длительностью 5 мс). Время
1358, 1302, 1252, 1221, 1178, 1080, 1045, 947, 847,
смешивания для NOESY - 400 мс. Химическая чи-
704. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 2.44 c (3H,
стота растворителей более 99.9%. Температуры
4-Me), 2.51 c (3H, 4'-Me), 4.00 c (3H, 3'-Me), 7.20 д.д
плавления измерены на приборе Mettler Toledo
(1H, 4-Hаром, J 5.1, 3.7 Гц), 7.23 д.д (1H, 4'-Hаром, J
FD-900. Масс-спектры высокого разрешения (EI,
5.1, 3.7 Гц),
7.52 д.д (1H, 3-Hаром, J 3.7, 1.1 Гц),
70 эВ) зарегистрированы на приборе DFS Thermo
7.60 д.д (1H, 3'-Hаром, J 3.7, 1.0 Гц), 7.63-7.64 м
Electron, США. Контроль за ходом реакций и инди-
(1H, 5-Hаром), 7.76 д.д (1H, 5'-Hаром, J 5.1, 1.0 Гц),
видуальностью полученных соединений осущест-
17.2 уш.с (1-OH). Спектр ЯМР 13C (ДМСО-d6), δ,
вляли с помощью ТСХ на пластинах Sorbfil ПТСХ-
м.д.: 10.0 (4'-Me), 15.8 (4-Me), 32.5 (3'-Me), 121.6
АФ-А-УФ, элюент CHCl3. Соединения 1a, b, 4a, b
(5-C),
121.7
(5'-C),
124.9
(2-C),
125.1
(3-Cаром),
были получены по методике [1]. Ацетат 2-(гидрок-
125.8 (5-Cаром), 126.2 (2'-Cаром), 126.2 (4'-C), 127.0
сиамино)-1-(4-метоксифенил)-пропан-1-он окси-
(4'-Cаром), 127.2 (4-Cаром), 127.4 (3'-Cаром), 127.4
ма был получен по методике [18].
(2'-C), 127.8 (5'-Cаром), 129.1 (2-Cаром), 133.6 (4-C).
Масс-спектр, m/z: 356.0760 [M]+. С17H16N4OS2. M
Получение соединений 2a-с, 3a-с, 5a, b (об-
356.0757.
щая методика). К раствору бисимидазола 1a, b
или соединения 4b в 1 мл сухого ДМФА при-
3',4,4'-Триметил-5,5'-дифенил-1H,1'H-[2,2'-
бавляли раствор триметилфосфита в 1 мл сухо-
бисимидазол]-1-ол (2b). 0.31 ммоль 1b, 1.27 ммоль
го ДМФА, смесь реагентов нагревали при 110°С
триметилфосфита. Выход 0.032 г (29%), белый
в течение 14 ч. После охлаждения реакционную
порошок, т.пл. 177-178°C. ИК спектр, ν, см-1:
смесь разбавляли 5 мл Н2О, экстрагировали CHCl3
1622, 1599, 1576, 1491, 1443, 1416, 1352, 1298,
(3×3 мл), промывали водой (3×5 мл), экстракт су-
1281, 1203, 1180, 1107, 1070, 1016, 953, 916, 762,
шили MgSO4. Остаток после упаривания раство-
698, 604. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.:
рителя хроматографировали (пластины с SiO2,
2.35 c (3H, 4-Me), 2.40 c (3H, 4'-Me), 4.02 c (3H,
элюент CHCl3).
3'-Me), 7.36-7.39 м (1H, 4-HPh), 7.46-7.49 м (1H,
3',4,4'-Триметил-5,5'-(тиофен-2-ил)-1H,1'H-
4'-HPh), 7.48-7.51 м (2H, 3,5-HPh), 7.53-7.56 м (2H,
[2,2'-бисимидазол]-1-ол
(2a).
0.2 ммоль
1a,
3',5'-HPh), 7.64-7.66 м (2H, 2,6-HPh), 7.66-7.68 м
0.8 ммоль триметилфосфита. Выход 0.05 г (68%),
(2H, 2',6'-HPh), 17.2 уш.с (1-OH). Спектр ЯМР 13C
Химические сдвиги в спектрах ЯМР 13С имидазольного остова соединений 2а-са
Соединение
2
2'
4
4'
5
5'
3'-CH3
4-CH3
4'-CH3
2a
124.9
127.4
133.5
126.2
121.6
121.7
32.5
15.8
10.0
2b
125.3
127.8
133.9
126.8
125.8
126.1
32.4
14.9
9.4
2c
125.3
129.0
134.1
124.4
126.8
127.8
32.5
15.0
9.8
а 2a, 2b - растворы в ДМСО-d6, 2c - раствор в CDCl3
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
5,5'-ДИАРИЛЗАМЕЩЕННЫЕ 1,1'-ДИГИДРОКСИ-2,2'-БИСИМИДАЗОЛЫ
93
(ДМСО-d6), δ, м.д.: 9.4 (4'-Me), 14.9 (4-Me), 32.4
Спектр ЯМР 13C (CDCl3), δ, м.д.: 10.2, 11.5, 32.7,
(3'-Me), 125.3 (2-C), 125.8 (5-C), 125.9 (1'-CPh),
126.2, 126.4, 126.6, 127.2, 127.6, 128.6, 128.8, 133.5,
126.1 (5'-C), 126.8 (4'-C), 127.5 (4-CPh), 127.8 (2'-C),
137.3. Масс-спектр, m/z: 328.1683 [M]+. С21H20N4.
128.2 (1-CPh), 128.4 (2,6-CPh), 128.4 (3,5-CPh), 128.5
M 328.1681.
(3',5'-CPh), 128.8 (4'-CPh), 129.5 (2',6'-CPh),
133.9
3,4,4'-Триметил-5,5'-(4-метоксифенил)-
(4-C). Масс-спектр, m/z: 344.1632 [M]+. С21H20N4O.
1H,1'H-2,2'-бисимидазол
(3c).
0.52 ммоль
1c,
M 344.1638.
1.55 ммоль триметилфосфита. Выход 0.004 г (2%),
3',4,4'-Триметил-5,5'-(4-метоксифенил)-
белый порошок, т.пл. 178-179°C. ИК спектр, ν,
1H,1'H-[2,2'-бисимидазол]-1-ол (2с). 0.52 ммоль
см-1: 1610, 1510, 1464, 1443, 1296, 1250, 1176,
1c, 1.55 ммоль триметилфосфита. Выход 0.046 г
1034, 1022, 835. Спектр ЯМР 1H (CDCl3), δ, м.д.:
(22%), бежевый порошок, т.пл.
96-97°C. ИК
2.43 c (3H, Me), 2.48 c (3H, Me), 3.83 c (3H, MeО),
спектр, ν, см-1: 1610, 1510, 1462, 1441, 1394, 1292,
4.26 c (3H, Me), 6.95-6.99 м (4Hаром), 7.59-7.70
1250, 1176, 1022, 833. Спектр ЯМР 1H (СDCl3),
м (4Hаром), 12.7 уш.с (1-NH). Спектр ЯМР 13C
δ, м.д.: 2.32 c (3H, 4'-Me), 2.36 c (3H, 4-Me), 3.81
(CDCl3), δ, м.д.: 9.7, 11.4, 33.7, 55.6, 55.6, 114.4,
c (3H, OMe), 3.98 c (3H, 3'-Me), 6.96-6.97 м (2H,
114.9, 119.0, 122.7, 123.4, 125.1, 128.2, 129.4, 129.6,
3,5-Hаром), 6.97-6.99 м (2H, 3',5'-Hаром), 7.51-7.52
133.2, 134.2, 138.5, 158.7, 159.6. Масс-спектр, m/z:
м (2H, 2',6'-Hаром), 7.55-7.57 м (2H, 2,6-Hаром), 12.8
388.1894 [M]+. С23H24O2N4. M 388.1890.
уш.с (1-OH). Спектр ЯМР 13C (СDCl3), δ, м.д.:
1,1',5,5'-Тетраметил-4,4'-дитиофен-2-ил-
9.8 (4'-Me), 15.0 (4-Me), 32.5 (3'-Me), 55.4 (COMe),
1H,1'H-2,2'-бисимидазол (5a). 0.05 ммоль 4a,
55.4 (COMe), 113.9 (3,5-Cаром), 114.2 (3',5'-Cаром),
0.02 ммоль триметилфосфита. Выход 0.01 г (53%),
118.3 (1'-Cаром), 121.2 (1-Cаром), 124.4 (4'-C), 125.3
бежевый порошок, т.пл. 170°C (с разл.). ИК спектр,
(2-C), 126.8 (5-C), 127.8 (5'-C), 129.0 (2'-C), 130.3
ν, см-1: 1732, 1464, 1446, 1392, 1365, 1288, 1122,
(2,6-Cаром), 131.2 (2',6'-Cаром), 134.1 (4-C), 159.1
1074, 1049, 1039, 681. Спектр ЯМР 1H (CDCl3), δ,
(4-Cаром),
160.1
(4'-Cаром). Масс-спектр, m/z:
м.д.: 2.46 c (6H, 2Me), 3.99 c (3H, Me), 7.04-7.08
404.1843 [M]+. С23H24N4O3. M 404.1835.
м (2Hаром), 7.19-7.22 м (4Hаром). Спектр ЯМР 13C
(CDCl3), δ, м.д.: 10.1, 32.3, 122.4, 123.4, 125.1,
3,4,4'-Триметил-5,5'-ди(тиофен-2-ил)-1H,-
125.4, 127.5, 128.4, 137.4, 139.0. Масс-спектр, m/z:
1'H-2,2'-бисимидазол
(3a).
0.56 ммоль
1a,
354.0967 [M]+. С18H18N4S2. M 354.0961.
1.67 ммоль триметилфосфита. Выход 0.01 г (5%),
бежевый порошок, разл. без плавл. ИК спектр,
1,1',5,5'-Тетраметил-4,4'-дифенил-1H,1'H-
ν, см-1: 1587, 1527, 1490, 1443, 1389, 1367, 1072,
2,2'-бисимидазол (5b). 0.22 ммоль 4b, 0.67 ммоль
844, 708, 759, 696. Спектр ЯМР 1H (СDCl3), δ, м.д.:
триметилфосфита. Выход 0.015 г (20%), бежевый
2.26 c (3H, Me), 2.46 c (3H, Me), 4.18 c (3H, Me),
порошок, т.пл. 215-217°C. ИК спектр, ν, см-1: 1726,
7.01-7.05 м (2Hаром), 7.13-7.21 м (3Hаром), 7.24-
1603, 1491, 1450, 1400, 1354, 1074, 1049, 1012,
7.27 м (1Hаром), 12.4 уш.с (1-NH). Спектр ЯМР 13C
769, 698. Спектр ЯМР 1H (CDCl3), δ, м.д.: 2.45 c
(СDCl3), δ, м.д.: 10.2, 10.9, 32.6, 122.1, 123.2, 123.8,
(6H, 2Me), 4.0 c (3H, Me), 7.23-7.29 м (2Hаром),
124.1, 126.0, 127.6, 127.7, 131.3, 133.1, 136.6, 136.8,
7.38-7.42 м (4Hаром), 7.67-7.73 м (4Hаром). Спектр
137.5, 138.8. Масс-спектр, m/z:
340.0811
[M]+.
ЯМР 13C (CDCl3), δ, м.д.: 10.5, 32.5, 125.6, 126.4,
С17H16N4S2. M 340.0808.
127.3, 128.5, 135.6, 137.0, 137.8. Масс-спектр, m/z:
341.1764 [M - H]+. С22H21N4. [M - H] 341.1754.
3,4,4'-Триметил-5,5'-дифенил-1H,1'H-2,2'-
бисимидазол (3b). 0.31 ммоль 1b, 1.27 ммоль
Получение N,N'-Бис-[1-гидроксиимино-1-(4-
триметилфосфита. Выход 0.013 г (13%), белый по-
метоксифенил)пропан-2-ил]этандиимин N,N'-
рошок, т.пл. 222-223°C. ИК спектр, ν, см-1: 1603,
диоксида. Раствор 0.99 г (5.55 ммоль) 40% водно-
1581, 1498, 1443, 1402, 1394, 1363, 1072, 1016, 953,
го раствора глиоксаля в 20 мл воды прибавляли по
775, 759, 703. Спектр ЯМР 1H (CDCl3), δ, м.д.: 2.41
каплям к суспензии 11.1 ммоль ацетата 2-(гидрок-
c (3H, Me), 2.44 c (3H, Me), 4.22 c (3H, Me), 7.24-
сиамино)-1-(4-метоксифенил)-пропан-1-он окси-
7.32 м (2Hаром), 7.35-7.46 м (4Hаром), 7.60-7.67 м
ма в 10 мл метанола при 0-5°C в течение 30 мин.
(2Hаром), 7.67-7.79 м (2Hаром), 11.5 уш.с (1-NH).
Реакционную смесь перемешивали 4 ч при 0-5°C
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
94
КРАСНОВ и др.
и оставляли без перемешивания на 16 ч. Выпав-
Оськина Ирина Александровна, ORCID: http://
ший осадок отфильтровывали, промывали водой
orcid.org/0000-0001-5788-0182
(3×10 мл), сушили. Выход 1.28 г (52%), белый по-
Тихонов Алексей Яковлевич, ORCID: http://
рошок, т.пл. 186-187°С. ИК спектр, ν, см-1: 1608,
orcid.org/0000-0002-6391-4366
1514, 1460, 1309, 1252, 1186, 1165, 1039, 1009, 984,
818. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.25 д (6H,
КОНФЛИКТ ИНТЕРЕСОВ
2Me, J 7.0 Гц), 3.79 c (6H, 2MeO), 4.15 к (2H, 2СН,
Авторы заявляют об отсутствии конфликта ин-
J 7.0 Гц), 6.98 д (4Hаром, J 8.2 Гц ), 7.58 д (4Hаром, J
тересов.
8.2 Гц), 8.97 c (2H, 2CH), 4.78 c (2H, 2OH). Спектр
СПИСОК ЛИТЕРАТУРЫ
ЯМР 13C (ДМСО-d6), δ, м.д.: 19.5, 54.6, 55.5, 82.2,
114.4, 126.9, 127.4, 157.4, 160.7. Масс-спектр, m/z:
1.
Оськина И.А., Тихонов А.Я. ЖОрХ. 2020, 56,
442.1847 [M]+. С22H26N4O6. M 442.1849.
1534-1539. [Os’kina I.A., Tikhonov A.Ya. Russ. J.
Org. Chem. 2020, 56, 1716-1719.] doi 10.31857/
5,5'-Бис(4-метоксифенил)-4,4'-диметил-
S0514749220100079
1H,1Н'-2,2'-бисимидазол-1,1’-диол (1c). Раствор
2.
Оськина И.А., Тихонов А.Я. ЖОрХ. 2020, 56,
0.86 ммоль N,N'-бис-[1-гидроксиимино-1-(4-ме-
303-306. [Os’kina I.A., Tikhonov A.Ya. Russ. J.
токсифенил)пропан-2-ил]этандиимин
N,N'-ди-
Org. Chem.
2020,
56,
339-342.] doi
10.31857/
оксида в 20 мл AcOH кипятили 7 ч и упаривали.
S0514749220020214
Реакционную смесь после охлаждения до комн.
3.
Shen H.-Q., Wu B., Xie H.-P., Zhou Y.-G. Org. Lett.
темп. разбавляли 10 мл воды и обрабатывали во-
2019, 21, 2712-2717. doi 10.1021/acs.orglett.9b00687
дным аммиаком до pH ~ 8.0. Осадок отфильтро-
4.
Matsumoto S., Watanabe M., Akazome M. Org. Lett.
вывали, промывали водой, сушили, хроматографи-
2018, 20, 3613-3617. doi 10.1021/acs.orglett.8b01376
ровали (SiO2, элюент CHCl3). Выход соединения
5.
Xiao J.-C., Shreeve J.M. J. Org. Chem. 2005, 70,
0.47 г (60%), бежевый порошок, т.пл. 142-143°С.
3072-3078. doi 10.1021/jo0501083
ИК спектр, ν, см-1: 1612, 1516, 1502, 1292, 1254,
6.
Casas J.S., Castineiras A., Parajo Y., Sanchez A.,
1178, 1022, 829. Спектр ЯМР 1H (ДМСО-d6), δ,
Sanchez-Gonzalez A., Sordo J. Polyhedron. 2005, 24,
м.д.: 2.31 c (6H, 2Me), 3.79 c (6H, 2MeО), 7.05 д
1196-1202. doi 10.1016/j.poly.2005.04.008
(4Н, J 7.4 Гц), 7.59 д (4Hаром, J 7.4 Гц). Спектр ЯМР
7.
Murata T., Nakasuji K., Morita Y. Eur. J. Org. Chem.
13C (ДМСО-d6), δ, м.д.: 12.7, 55.2, 114.0, 119.7,
2012, 4123-4129. doi 10.1002/ejoc.201200426
125.92, 126.3, 128.5, 130.1, 159.0. Масс-спектр, m/z:
8.
Van Hirschheydt T., Voss E. Пат. 20050085473 (2005).
406.1636 [M]+. С22H22N4O4. M 406.1639.
США. C.A. 2005, 142, 411373.
ЗАКЛЮЧЕНИЕ
9.
Semones M., Feng Y., Johnson N., Adams J.L., Wink-
Восстановление 5,5'-диарилзамещенных 1,1'-
ler J., Hansbury M. Bioorg. Med. Chem. Lett. 2007,
дигидрокси-2,2'-бисимидазолов триметилфосфи-
17, 4756-4760. doi:10.1016/j.bmcl.2007.06
том сопровождается метилированием по ато-
10.
Kim D.-K., Lee Y.-I., Lee Y.W., Dewang P.M.,
му азота в положении 3 одного из имидазоль-
Sheen Y.Y., Kim Y.W., Park H.-J., Yoo J., Lee H.S.,
ных колец. Основным продуктом реакции яв-
Kim Y.-K. Bioorg. Med. Chem. 2010, 18, 4459-4467.
doi 10.1016/j.bmc.2010.04.071
ляется
3-N-метилимидазол, содержащий
1-N-
гидроксигруппу в соседнем имидазольном кольце.
11.
Nikitina P.A., Kuz’mina L.G., Perevalov V.P., Tkach I.I.
Tetrahedron.
2013,
69,
3249-3256. doi
10.1016/
БЛАГОДАРНОСТИ
j.tet.2013.02.039
Авторы выражают благодарность Химическому
12.
Arvanitis A.G., Rodgers J.D., Combs A.P., Sparks R.B.,
сервисному центру коллективного пользования
Robinson D.J., Fridman J.S., Vaddi K. Междунар. Пат.
СО РАН за проведение спектральных и аналити-
WO 2007038215 (2007). C.A. 2007, 146, 401967.
ческих измерений.
13.
Liverton N.J., Butcher J.W., Claiborne C.F., Clare-
mon D.A., Libby B.E., Nguyen K.T., Pitzenber-
ИНФОРМАЦИЯ ОБ АВТОРАХ
ger S.M., Selnick H.G., Smith G.R., Tebben A., Vac-
Краснов Вячеслав Иванович, ORCID: http://
ca J.P., Varga S.L., Agarwal L., Dancheck K., For-
orcid.org/0000-0002-5387-8365
syth A.J., Fletcher D.S., Frantz B., Hanlon W.A., Har-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022
5,5'-ДИАРИЛЗАМЕЩЕННЫЕ 1,1'-ДИГИДРОКСИ-2,2'-БИСИМИДАЗОЛЫ
95
per C.F., Hofsess S.J., Kostura M., Lin J., Luell S.,
16. Кузьменко И.И., Бобков В.Н., Зволинская Т.В. ЖОХ.
O’Neill E.A., Orevillo C.J., Pang M., Parsons J.,
1989, 59, 1751-1755. [Kuz’menko I.I., Bobkov V.N.,
Rolando A., Sahly Y., Visco D.M., O’Keefe S.J. J. Med.
Zvolinskaya T.V. Russ. J. Gen. Chem. 1989, 59, 1557-
Chem. 1999, 42, 2180-2190. doi 10.1021/jm9805236
1561.]
14. Горностаев Л.М., Вигант М.В., Каргина О.И., Куз-
17. Fulmer G.R., Miller A.J.M., Sherden N.H., Gott-
нецова А.С., Халявина Ю.Г., Лаврикова Т.И. ЖОрХ.
lieb H.E., Nudelman A., Stoltz B.M., Goldberg K.I.
2013, 49, 1354-1357. [Gornostaev L.M., Vigant M.V.,
Organometallics. 2010, 29, 2176-2179. doi 10.1021/
Kargina O.I., Kuznetsova A.S., Khalyavina Yu.G.,
om100106e
Lavrikova T.I. Russ. J. Org. Chem. 2013, 49, 1369-
1472.] doi 10.1134/S1070428013090194
18. Николаенкова Е.Б., Тихонов А.Я., Грищенко С.Ю.
ХГС. 2019, 55, 142-146. [Nikolaenkova E.B., Tikho-
15. Николаенкова Е.Б., Оськина И.А., Тихонов А.Я.
ЖОрХ. 2017, 53, 1851-853. [Nikolaenkova E.B.,
nov A.Y., Grishchenko S.Y. Chem. Heterocycl. Compd.
Os’kina I.A., Tikhonov A.Y. Russ. J. Org. Chem. 2017,
2019, 55, 142-146.] doi 10.1007/s10593-019-02430-
53, 1887-1889.] doi 10.1134/S1070428017120193
8
5,5'-Diaryl 1,1'-Dihydroxy-2,2'-biimidazoles:
Reaction with Trimethyl Phosphite
V. I. Krasnov, I. A. Os’kina*, and A. Ya. Tikhonov
N.N. Vorozhtsov Novosibirsk Institute of Organic Chemistry of the Siberian Branch of Russian Academy of Science,
prosp. Akademika Lavrentieva, 9, Novosibirsk, 630090 Russia
*е-mail: oi@nioch.nsc.ru
Received July 26, 2021; revised August 11, 2021; accepted August 13, 2021
5,5'-Diaryl-1,1'-dihydroxy-2,2'-biimidazolyl-1-oles and 5,5'-diaryl-2,2'-biimidazoles containing CH3 group
under 3-N-atom of imidazole ring were formed under interaction of 5,5'-diaryl substituted 1,1'-dihydroxy-2,2'-
biimidazoles with (CH3O)3P. Correlation spectroscopy methods (1H-1H COSY, 1H-13C HSQC, 1H-13C HMBC,
1H-1H NOESY) were used to confirm the structure of synthesized compounds.
Keywords: 5,5'-diaryl 1,1'-dihydroxy-2,2'-biimidazoles, 2,2'-biimidazoles, reduction
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 1 2022