ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 2, с. 200-209
УДК 547 493
ПРИМЕНЕНИЕ БЕНЗОИЛЬНОЙ О-ЗАЩИТНОЙ
ГРУППЫ ПРИ СИНТЕЗЕ
α,β-ДЕГИДРОТИРОЗИНСОДЕРЖАЩИХ
АМИДОВ И ИМИДАЗОЛОНОВ
© 2022 г. В. О. Топузянa, А. А. Оганнесяна, А. Т. Макичяна, b, *,
Л. С. Унанянb, Л. Х. Галстянc
a Научно-технологический центр органической и фармацевтической химии НАН РА,
Армения, 0014 Ереван, просп. Азатутян, 26
b ГОУ ВПО Российско-Армянский университет, Армения, 0051 Ереван, ул. Овсепа Эмина, 123
c Ереванский государственный университет, Армения, 0025 Ереван, ул. Алека Манукяна, 1
*e-mail: ani.makichyan@rau.am
Поступила в редакцию 23.08.2021 г.
После доработки 19.11.2021 г.
Принята к публикации 22.11.2021 г.
Изучена возможность применения О-бензоильной защитной группы для синтеза как бензиламида N-бен-
зоил-α,β-дегидротирозина, так и соответствующего 5-имидазолона. Отмечено, что реакция 4-(4-бензои-
локсибензилиден)-5(4Н)-оксазолона с бензиламином протекает с сохранением О-бензоильной защитной
группы. Последняя удаляется с помощью 2-(диметиламино)-1-этиламином или 3-(диметиламино)-1-про-
пиламином. В случае же циклизации бензиламида N,О-дибензоил-α,β-дегидротирозина в (Z)-3-бен-
зил-5-(4-гидроксибензилиден)-2-фенил-3,5-дигидро-4H-имидазол-4-он с помощью 1,1,1,3,3,3-гекса-
метилдисилазана наблюдается расщепление О-бензоильной защиты. Изучены антирадикальные и
антихолинэстеразные действия синтезированных соединений.
Ключевые слова: O-защитная группа, α,β-дегидроаминокислота, 5(4Н)-оксазолон, имидазол-4-он,
амиды, антирадикальная активность, антихолинэстеразная активность
DOI: 10.31857/S0514749222020112
ВВЕДЕНИЕ
в качестве О-защиты α,β-дегидротирозиново-
го остатка применялись ацетильная [1-3] или
Производные α,β-дегидроаминокислот пред-
трет-бутилдиметилсилильная [1, 4-6] группы. В
ставляют интерес как синтетические предшествен-
ники для синтеза различных классов соединений,
работах [7, 8] описаны методы удаления метиль-
так и как физиологически активные соединения.
ной группы из метокси производного ХЗФБ. По
В этом ряду особое место занимают производные
данным [9], где синтез производных ХЗФБ осу-
дегидроаминокислот, содержащие остаток α,β-де-
ществлен 2+3 циклоконденсацией арилиденими-
гидротирозина. Настоящая работа посвящена изы-
нов и илидов, не применялась защита фенольной
сканию метода синтеза бензиламида N-бензоил-
гидроксильной группы.
α,β-дегидротирозина и его циклического аналога -
Нами изучена возможность применения
4-[(1-бензил-5-оксо-2-фенил-1,5-дигидро-4Н-ими-
дазол-4-илиден)метил]фенилбензоата как анало-
О-бензоильной защитной группы для синтеза как
га хромофора зеленого флуоресцирующего белка
бензиламида N-бензоил-α,β-дегидротирозина, так
(ХЗФБ). Ранее при синтезе производных ХЗФБ
и соответствующего имидазол-4-она.
200
ПРИМЕНЕНИЕ БЕНЗОИЛЬНОЙ О-ЗАЩИТНОЙ ГРУППЫ
201
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Удаление О-бензоильной защитной группы из
бензиламида 2 осуществлен с помощью 3-(диме-
Синтез бензиламида N,О-дибензоил-α,β-де-
тиламино)-1-пропиламина (ДМАПА) или 2-(ди-
гидротирозина (2) осуществлен взаимодействием
метиламино)-1-этиламина (ДМАЭА) при комнат-
4-[5-оксо-2-фенилоксазол-4(5Н)-илиден]фенил-
ной температуре в ацетонитриле в течение 24 ч.
бензоата (1) с бензиламином при комнатной тем-
На примере синтеза бензиламида N-бензоил-α,β-
пературе в диметилформамиде (схема 1). При этом
дегидротирозина 3 установлено, что при примене-
установлено, что при соотношении оксазолона 1 и
нии ДМАЭА для удаления бензоильной О-защиты
бензиламина 1:1 в течение 24 ч выход бензилами-
из амида 2 в течение 8 ч целевой продукт 3 полу-
да 2 составляет 39%, тогда как увеличение коли-
чается с выходом 76%. Увеличение длительности
чества бензиламина до 3 эквивалентов в течение
времени реакции до 24 ч приводит к образованию
3 ч приводит к образованию амида 2 с выходом
амида 3 с выходом 94%. В случае применения
81%. В последнем случае увеличение реакционно-
ДМАПА в течение 24 ч целевой продукт 3 полу-
го времени до 24 ч приводит к 99% образованию
чается с выходом 92%. В последнем случае кипя-
амида 2. В этих условиях О-бензоильная группа
чение реакционной смеси в течение 2.5 ч выход
амида 2 сохраняется.
амида α β-дегидротирозина составляет 78%.
Схема 1
O
O
Ph
NHCH2Ph
HN
HO
3
DMAPA
HMDS
c
O
O
Ph
NHCH2Ph
O
HN
O
H2NCH2Ph
N O
O
Ph
Ph
O
1
O
Ph
2
HMDS
HMDS
b
O
O
O
DMAPA
HO
N NCH2Ph
a
N NCH2Ph
O
Ph
Ph
Ph
4
5
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 2 2022
202
ТОПУЗЯН и др.
Синтез
4-[(1-бензил-5-оксо-2-фенил-1,5-диги-
Из синтезированных соединений
2-5 срав-
дро-4Н-имидазол-4-илиден)метил]фенилбензоата
нительно высокую антирадикальную актив-
(4) осуществлен предложенным нами ранее мето-
ность проявляет бензиламид N-бензоил-α,β-
дом - кипячением смеси амида 2 с 1,1,1,3,3,3-гек-
дегидротирозина (3). Это вещество также обладает
саметилдисилазаном (ГМДС) в диметилформами-
сравнительно высоким ингибирующим свойством
де в течение 0.5 ч [10]. При этом получена смесь
по отношению к ацетилхолинэстеразе (АХЭ). В
имидазолонов 4 и 5. Обработкой реакционной
случае бутирилхолинэстеразы (БуХЭ) сравнитель-
смеси удалось выделить имидазолон 4 с выходом
но высокую ингибируюшую активность проявляет
45%. Однако, в случае удлинения времени ре-
(Z)-4-[(1-бензил-5-оксо-2-фенил-1,5-дигидро-4Н-
акции до 1.5 ч процесс приводит к образованию
имидазол-4-илиден)метил]фениловый эфир бен-
зойной кислоты (4).
имидазол-4-она 5 с выходом 70%. Очевидно, что
при взаимодействии ГМДС и амида 3 протека-
В целом, данные приведенные в табл. 1 показы-
етют две параллельные реакции - циклизация и
вают, что переход от О-бензоильных производных
удаление О-бензоильной защитной группы (метод
(2 и 4) к незащищенным аналогам 3 и 5 приводит
b). Синтез имидазол-4-она 5 нами был осущест-
к увеличению антирадикальной активности. Такое
влен также из соединения 4 с помощью ДМАПА
положение сохраняется в случае антихолинэсте-
с выходом 75% (метод a) или циклизацией бензи-
разных свойств бензиламидов 2 и 3. В случае же
ламида α,β-дегидротирозина 3 с помощью ГМДС
имидазолонов 4 и 5 при изучении антихолинэсте-
(метод c). В последнем случае выход целевого
разной активности наблюдается обратная картина.
продукта 5 составляет 83%.
На основе дескрипторов, рассчитывающие зна-
Исследованы антирадикальные и антихолин-
чения физико-химических и фармакокинетических
эстеразные действия соединений 2-5 (табл. 1).
параметров, при помощи платформ SwissADME
Исследования антирадикальных свойств проводи-
[12] и ADMETsar [13], были получены значения
лись с помощью их реакции со свободным стабиль-
молекулярного веса, число доноров и акцепторов
ным радикалом 2,2'-дифенил-1-пикрилгидразилом
водородных связей (табл. 1S, дополнительные ма-
(ДФПГ•) в среде метанола при температуре 25°С и
териалы). Необходимо отметить, что молекуляр-
соотношении реагентов 1:1. Измерения проводи-
ный вес исследуемых соединений не превышает
лись спектрофотометрическим методом [11]. Для
500 г/моль, что характерно для малых молекул. С
количественной оценки антирадикальной актив-
точки зрения образования донор - акцепторных
ности (АРА%) использовали формулу (1):
связей соединение 5, по сравнению с остальными,
не имеет атомов доноров, при этом показывая на-
A0 - A
1
APA% =
×100,
(1)
личие трех акцепторов. Были рассчитаны значения
A0
топологической площади полярной поверхности
молекулы и липофильности, что является важным
где А0 - оптическая плотность раствора при от-
при процессе предсказания биоактивности.
сутствии ингибитора; А1 - оптическая плотность
раствора на данный момент в присутствии инги-
Рассчитанные фармакокинетические значе-
битора.
ния соединений свидетельствуют, что показатель
Таблица 1. Данные антирадикальных и антихолинэстеразных свойств соединений 2-5
Ингибирование, %
Соединение
ДФПГ•
АХЭ
БуХЭ
2
43.1
63.6
28.7
3
85.1
76.6
40.5
4
6.86
43.0
54.5
5
16.2
37.0
16.1
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 2 2022
ПРИМЕНЕНИЕ БЕНЗОИЛЬНОЙ О-ЗАЩИТНОЙ ГРУППЫ
203
(a)
(b)
TYR337
TYR341
1.67271
TRP86
3.16514
ASP74
3
4
TYR124
2
TRP296
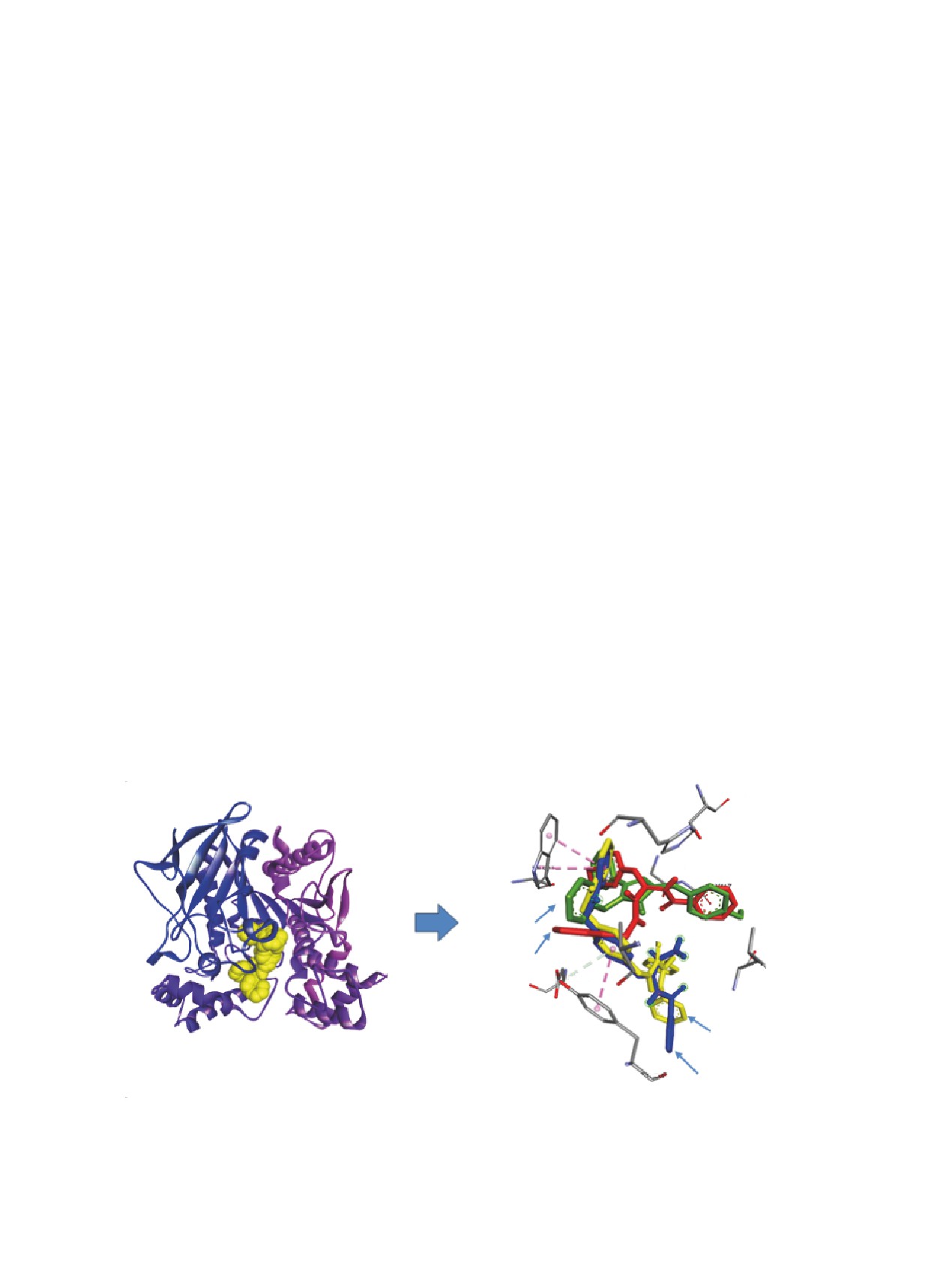
Рис. 1. Взаимодействие соединений 2, 3, 4 с активным центром АХЭ: (a) место связывания исследуемых соединений;
(b) cуперпозиционирование пространственных положений исследуемых лигандов в активном центре мишени
всасываемости через желудочно-кишечный тракт
емые соединения имеют высокое значение коэф-
(ЖКТ) на основе метода оценки проницаемости
фициента биоразложения и не являются пестици-
Эгана [14] имеет высокое значение для всех иссле-
дами, хотя все они могут являться токсичными для
дуемых соединений, что касается перехода через
рыб, а соединение 5 также проявляет токсичность
гематоэнцефалический барьер (ГЭБ), соедине-
к ракообразным.
ние 2 показывает отрицательный результат.
На основе полученных нами результатов мо-
Необходимо отметить, что все соединения соот-
лекулярного докинга было выявлено, что кроме
ветствуют критерию «правила пяти» Липинского
соединения 5 все исследуемые соединения вза-
[15]. Было рассчитано также значение биодоступ-
имодействует с активным центром АХЭ. Были
ности, которое составило 0.55 по шкале Abbot
получены пространственно-энергетические ха-
(ABS) [16]. С точки зрения оценки свойств «соеди-
рактеристики взаимодействия для всех комплек-
нения лидера», все соединения не соответствуют
сов и построены конформационные карты ком-
данному критерию. Был рассчитан также коэффи-
плексообразования. Необходимо отметить, что
циент синтетической доступности.
пространственное расположение соединений в
Одним из важнейших критериев оценки био-
активном центре параллельно оси «кувшина» об-
активности является определение токсичности.
разующий активный центр (рис. 1). В основном,
Нами был произведен прогноз возможной токсич-
преобладает электростатический тип взаимодей-
ности для всех четырех соединений, результаты
ствия. Наблюдаются также гидрофобные взаимо-
которых приведены в табл. 2S (дополнительные
действия с аминокислотными остатками формиру-
материалы). По оценке мутагенности соединение
ющие активный центр белка мишени. Определены
3 имеет положительный результат, а прогноз кан-
также единичные водородные связи при взаи-
церогенности у всех соединений отрицателен. По
модействии. Соединение
2 образует водород-
оценке раздражительности на кожу и глаза у всех
ную связь с Tyr337 и Tyr124 с дистанцией 1.67 и
исследуемых соединений наблюдается отрица-
3.11 Å соответственно. Гидрофобный тип связы-
тельный результат, при этом все они показывают
вания наблюдается с Tyr341, Trp286, Trp86, ко-
умеренную гепатотоксичность.
торые играют важную роль в процессе катализа
Были расчитаны также значения экотоксично-
ацетилхолина. У соединения 3 водородная связь
сти. Результаты свидетельствуют, что все исследу-
наблюдается с Tyr124 и Gln71 с дистанциями 1.87
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 2 2022
204
ТОПУЗЯН и др.
и 2.31 Å соответственно. Гидрофобные взаимодей-
тивном центре. Полученные нами результаты
ствия осуществляются с вовлечением аминокис-
пространственного расположения исследуемых
лотных остатков Tyr341, Trp286.
соединений в активном центре тому подтверж-
дение. Расположение можно распределить на две
Для данного соединения взаимодействие с
группы - соединения 3 и 5 расположены перпен-
Trp86 происходит за счет связи π-акцепторного
дикулярно оси «кувшина» образующий активный
типа. Данный тип связи, в основном, эффективно
центр под углом 117°, тогда как соединения 2 и 4
осуществляется с вовлечением Trp86 в боковых
параллельны оси с наклоном в 15°. С одной сторо-
цепях белка, которая может принимать одну водо-
родную связь [17]. Водородная связь у соединения
ны первая группа по расположению близка к пе-
4 образуется с Tyr72 с дистанцией 2.78 Å. Leu76,
риферийному сайту связывания активного центра
Trp86, Trp286 и Val294 проявляют гидрофобный
БуХЭ, образующегося аминокислотными остатка-
тип взаимодействия. Интересно, что соединения 2
ми Tyr332 и Asp70, которые играют ключевую роль
и 4 связываются с высоко консервативным Asp74,
при связывании лиганда с активном центром [20].
входящий в состав активного центра АХЭ, прояв-
С другой стороны, вплотную к аминокислот-
ляя π-анионный тип связи. Известно, что такой тип
ным остаткам формирующих холинсвязываю-
связи присущ ряду нейротрансмиторов при стаби-
щий карман, в частности, консервативный Trp82
лизации связывания нейромедиаторами [18].
и His438, входящий в «окси анионную дыру»
Полученные результаты для БуХЭ свидетель-
каталитического сайта активного центра БуХЭ.
ствуют, что все четыре соединения 2-5 связывают-
Вторая группа близка к высоко консервативным
ся с активным центром белка (рис. 2). Как в случае
аминокислотам Gly116, Gly117, His438 входящим
с АХЭ, у БуХЭ преобладают электростатические
в «окси анионную дыру» каталитического сайта
силы взаимодействия при комплексообразовании.
активного центра и Leu286 «ацил кармана» [21].
Известно, что активный центр БуХЭ по объ-
У соединения 2 наблюдается единичная гидро-
ёму больше по сравнению с АХЭ и составляет
фобная связь с Trp82, в остальных случаях наблю-
501.91 Å3, тогда как обьем активного центра АХЭ
дается электростатический тип связывания. Та же
равен 302.31 Å3 [19], что дает возможность бо-
картина наблюдается у соединения 4, где кроме
лее свободному расположению лигандов в ак-
Trp82 гидрофобная связь образуется с Ala328.
(a)
(b)
SER198
HIS438
GLY116
TRP82
5
ALA328
3
ASP70
LEU286
4
2
TYR332
Рис. 2. Взаимодействие соединений 2-5 с активным центром БуХЭ: (a) место связывания исследуемых соединений;
(b) суперпозиционирование пространственных положений исследуемых лигандов в активном центре мишени
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 2 2022
ПРИМЕНЕНИЕ БЕНЗОИЛЬНОЙ О-ЗАЩИТНОЙ ГРУППЫ
205
Таблица 2. Рассчитанные значения биофизических параметров комплексообразования исследуемых соединений с
АХЭ и БуХЭ
АХЭ
БуХЭ
Соединение
Энергия связывания
Константа связывания
Энергия связывания
Константа связывания
(ΔG)
(Kc)
(ΔG)
(Kc)
2
-9.22±0.46
5.1×106
-8.94±0.44
3.0×106
3
-9.99±0.49
2.0×107
-9.58±0.47
1.0×107
4
-10.31±0.51
3.3×107
-10.17±0.50
2.6×107
5
-
-
-9.76±0.48
1.0×107
По сравнению с вышеперечисленными соеди-
соединений сняты в вазелиновом масле на спек-
нениям у 3 наблюдается водородная связь с дис-
трометре Specord M-80. Спектры ЯМР 1H и 13C
танцией 2.86 Å между гидроксильной группы 3
растворов соединений в ДМСО-d6 сняты на спек-
и карбоксильной группой Trp82 при угле 91.7°.
трометре Mercury-300 (300 МГц). Элементный
Гидрофобный тип связывания осуществляется с
анализ выполнен на анализаторе EuroEA3000
вовлечением аминокислотных остатков Gly116,
CHNS-O. Определение чистоты полученных со-
Leu286, Phe329, Trp231. В остальных случаях на-
единений осуществлено методом ТСХ (на пла-
блюдается электростатическое взаимодействие.
стинках AlugramXtraSILG/UV) в системе раство-
По сравнению с 3 у соединения 4 водородных свя-
рителей C6H6-MeOH-CH3COOH 5:2:1, проявле-
зей не наблюдается. Взаимодействие, в основном,
ние - УФ лучи.
осуществляется за счет электростатики. У 4 взаи-
(Z)-4-{[5-Оксо-2-фенилоксазол-4(5H)-или-
модействие с Trp82 происходит за счет гидрофоб-
ден]метил} фенилбензоат (1) синтезирован по
ных сил. В табл. 3S (дополнительные материалы)
методу [22].
приведены результаты взаимодействия исследу-
(Z)-4-[2-Бензамидо-3-(бензиламино)-3-оксо-
емых соединений с аминокислотными остатками
проп-1-ен-1-ил] фенилбензоат (2). К суспензии
формирующие активные центры АХЭ и БуХЭ.
1.0 г (0.0027 моль) оксазолона 1 в 10 мл ДМФА
На основе полученных результатов комплек-
добавляли 0.28 мл (0.29 г, 0.0027 моль) бензила-
сообразования были рассчитаны биофизические
мина и перемешивали при комнатной температуре
параметры связывания, которые приведенны в
3 ч. К реакционной смеси добавляли 70 мл сла-
табл. 2.
бокислотный водный раствор соляной кислоты
Обобщая вышесказанное можно констатиро-
(pH ≈ 4), образовавшийся белый осадок отфиль-
вать, что соединение 4 является лидером в иссле-
тровывали, промывали водой до нейтральной pH
дуемой выборке по аффинности как для АХЭ так
и сушили на воздухе. Перекристаллизацию про-
и для БуХЭ, при этом максимальное значение на-
водили из 50% раствора этанола. Выход 81.6%,
блюдается для АХЭ.
т.пл. 178-180°С. Rf 0.70. ИК спектр, ν, см-1: 1636
Необходимо отметить, что соединение 5 прояв-
(СО-амидн.), 1742 (СО-эфирн.), 3242 (NH). Спектр
ляет к БуХЭ специфичность с константой связы-
ЯМР 1H, δ, м.д.: 4.46 д (2H, NCH2, J 6.3 Гц), 7.15-
вания 1.0×107, а 2 имеет наименьшие показатели
7.24 м (2H, C6H4), 7.21 c (1H, CH=C), 7.24-7.41 м
взаимодействия для двух белков мишеней. С точки
(5H, C6H5), 7.42-7.59 м (5H, C6H5), 7.62-7.73 м
зрения конформационного анализа все соединения
(3H, C6H5), 8.00-8.20 м (4H, C6H5, C6H4), 8.48 т
взаимодействуют с аминокислотными остатка-
(1H, NH, J 6.1 Гц), 9.85 c (1H, NH). Спектр ЯМР
ми формирующие все участки активных центров
13C, δ, м.д.: 121.2, 125.9, 126.9, 127.6, 127.6, 127.8,
АХЭ и БуХЭ.
128.1, 128.8, 129.5, 130.2, 130.3, 130.8, 131.9, 133.1,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
133.6, 139.4, 150.1, 163.6, 164.7, 165.5. Найдено, %:
Температуры плавления измерены на приборе
C 75.39; H 5.21; N 6.03. C30H24N2O3. Вычислено,%:
Boetus (Германия). ИК спектры синтезированных
C 75.62; H 5.08; N 5.88.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 2 2022
206
ТОПУЗЯН и др.
При проведении реакции в течение 24 ч выход
(СО-эфирн.). Спектр ЯМР 1Н, δ, м.д.: 4.95 с (2H,
бензиламида 2 составляет 98.0%.
NCH2), 7.08-7.16 м (2Hаром), 7.22-7.32 м (5Hаром),
7.23 с (1Н, СН=C), 7.43-7.57 м (5Hаром), 7.65-7.71
(Z)-3-Бензил-5-(4-гидроксибензилиден)-2-
м (3Наром), 8.15-8.19 м (2Наром). Спектр ЯМР 13C,
фенил-3,5-дигидро-4H-имидазол-4-он (3). К рас-
δ, м.д.: 121.5, 126.1, 126.5, 126.9, 128.0, 128.8,
твору 1 г (0.002 моль) бензиламида 2 в 50 мл аце-
128.9, 129.6, 130.8, 131.6, 133.1, 133.2, 136.3, 138.1,
тонитрила, добавляли 0.22 мл (0.18 г, 0.002 моль)
151.7, 162.1, 163.4, 170.3. Найдено, %: C 78.09; H
2-(диметиламино)-1-этиламина и оставляли на
5.34; N 6.61. C30H22N2O3. Вычислено,%: C 78.59;
24 ч при комнатной температуре. К реакционной
H 4.84; N 6.11.
смеси добавляли 70 мл воды и прикапывали солян-
ной кислоты до pH 3, образовавшийся белый оса-
(Z)-3-Бензил-5-(4-гидроксибензилиден)-2-
док отфильтровывали, промывали водой до ней-
фенил-3,5-дигидро-4Н-имидазол-4-он (5). а. К
тральной pH и сушили на воздухе. Выход 94.6%,
суспензии 0.24 г (0.0005 моль) имидазолона 4 в
т.пл. 110-112°C, Rf 0.79.
10 мл ацетонитрила добавляли 0.13 мл (0.1 г,
0.001 моль) 3-(диметиламино)-1-пропиламина и
При проведении реакции в течение 8 ч выход
кипятили обратным холодильником в течение 3.5 ч.
бензиламида 3 составляет 76.0%.
Затем к реакционной смеси добавляли 60 мл воды,
В случае проведения реакции с применением
подкисляли до pH 3, выпавший осадок отфильтро-
2 эквивалентов 3-(диметиламино)-1-пропиламина
вывали и сушили на воздухе. Выход 75.5%.
в течение 24 ч при комнатной температуре выход
b. К раствору 0.33 г (0.00069 моль) бензила-
бензиламида 3 составляет 92.4%. Проведение же
мида 2 в 10 мл ДМФА добавляли 0.43мл (0.33 г,
реакции с применением 2 экв 3-(диметилами-
0.00207 моль) ГМДС и кипятили в течение 1.5 ч. К
но)-1-пропиламина в течение 2.5 ч при кипячении
реакционной смеси добавляли 50 мл водного рас-
реакционной смеси приводит к образованию бен-
твора соляной кислоты (pH ≈ 4), образовавший-
зиламида 3 с выходом 78.8%. ИК спектр, ν, см-1:
ся осадок отфильтровывали, промывали водой
1630 (СО-амидн.), 3252 (NH), 3445 (ОН). Спектр
до нейтральной pH и сушили на воздухе. Выход
ЯМР 1Н, δ, м.д.: 4.43 д (2H, NCH2, J 6.1 Гц), 6.66-
70.83%.
6.76 м (2Hаром), 7.15-7.21 м (1Наром), 7.22 с (1Н,
CH=C), 7.26-7.31 м (2Hаром), 7.32-7.35 м (2Наром),
c. К раствору 0.24 г (0.00064 моль) бензила-
7.39-7.42 м (2Наром), 7.43-7.55 м (3Наром), 8.02-
мида 3 в 10 мл ДМФА добавляли 0.4 мл (0.31 г,
8.11 м (2Наром), 8.27 т (1H, NH, J 6.05 Гц), 9.42
0.0019 моль) ГМДС и кипятили в течение 1 ч.
с (1H, OH), 9.66 с (1H, NH). Спектр ЯМР 13С, δ,
Реакционную смесь разбавляли 50 мл воды, под-
м.д.: 115.1, 124.8, 125.9, 126.7, 126.9, 127.6, 127.8,
кисляли соляной кислотой до pH ≈ 4, образо-
129.8, 130.7, 130.8, 133.8, 139.6, 157.9, 165.1, 165.4.
вавшийся осадок отфильтровывали, промывали
Найдено, %: C 74.68; H 4.91; N 8.02. C23H20N2O3.
водой до нейтральной pH и сушили на воздухе.
Вычислено, %: C 74.18; H 5.41; N 7.52.
Выход 83.91%, т.пл. 255-258°C. Rf 0.83.ИК спектр,
ν, см-1: 1688 (СО-цикл.); 3317 (ОН). Спектр ЯМР
(Z)-4-[(1-Бензил-5-оксо-2-фенил-1,5-ди-
1Н, δ, м.д.: 4.92 с (2Н, NCH2), 6.78-6.86 м (2H,
гидро-4Н-имидазол-4-илиден)метил] фенило-
Hаром), 7.07-7.15 м (2H, Hаром), 7.11 с (1H, CH=C),
вый эфир бензойной кислоты (4). К раствору
7.17-7.32 м (3H, Hаром), 7.38-7.54 м (3H, Hаром),
1.0 г (0.0021 моль) бензиламида 2 в 10 мл ДМФА
7.63-7.71 м (2H, Hаром), 8.07-8.17 м (2H, Hаром),
добавляли 1.32 мл (1.02 г, 0.0063 моль) ГМДС и
9.81 уш.с (1Н, ОH). Спектр ЯМР 13C, δ, м.д.: 115.5,
кипятили 0.5 ч. К реакционной смеси добавляли
125.1, 126.1, 126.8, 127.9, 128.1, 128.7, 129.3, 130.3,
70 мл слабокислотного водного раствора соляной
134.3, 135.4, 136.6, 159.7, 160.0, 170.2. Найдено, %:
кислоты (pH ≈ 4), образовавшийся осадок отфиль-
C 77.50; H 5.62; N 7.4. C23H18N2O2. Вычислено,%:
тровывали, промывали водой до нейтральной pH
C 77.95; H 5.12; N 7.90.
и сушили на воздухе. Перекристаллизацию про-
водили бензолом. Выход 49.79%, т.пл. 189-190°C.
Определение антирадикальных свойств.
Rf 0.92. ИК спектр, ν, см-1: 1719 (СО-цикл.), 1726
Процесс взаимодействия соединений 2-5 с ДФПГ
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 2 2022
ПРИМЕНЕНИЕ БЕНЗОИЛЬНОЙ О-ЗАЩИТНОЙ ГРУППЫ
207
при 25°С исследовали спектрофотометрически на
пой способ». Статистическая достоверность
спектрофотометре «Specord UV-VIS» (Германия)
результатов докинга обеспечивалась
5-кратной
по изменению оптической плотности ДФПГ во
повторяемостью 20- и начальных конформаций
времени при 520 нм. Исходные концентрации
для каждого соединения с объемом пространст-
ДФПГ• - 0.025×10-5 моль/л, соединений 2-5 -
венного поиска, не превышающей
27000 Å3.
1.25×10-5 моль/л. К 2.0 мл раствора ДФПГ• в абсо-
Значение континума исчислений равно 500.
лютном метаноле добавляли 0.04 мл метанольного
Конформационный анализ исследуемых взаи-
раствора исследуемого вещества и после 40 мин
модействий осуществлялся с использованием про-
измеряли оптическую плотность смеси.
граммы Discovery Studio Visualizer v 19.1.0.18287
Определение антихолинэстеразных свойств.
[28]. Определение физико-химических и фарма-
Антихолинэстеразные свойствa синтезированных
кокинетических параметров для исследуемых со-
соединений определяли с применением метода,
единений проводилось с использованием онлайн
описанного в работе [23]. В исследованиях приме-
платформы SwissADME [12, 29].
няли эритроцитарную АХЭ и плазменную БуХЭ
Компьютерный анализ токсичности иссле-
человека. Измерения проводились в термостатиру-
дуемых соединений проводили с использованием
емой ячейке спектрофотометра «Specord UV-Vis»
программного пакета PeoTOX [30]. Процесс про-
при 412 нм. В опытах реакционная среда в 2.5 мл
гнозирования осуществляется с использованием
конечного объема содержала реагенты в следу-
базы данных RTECS [31], где хранятся соединения
ющих концентрациях: дистиллированная вода -
или фрагменты соединений, входящие в опреде-
1.25 мл, 0.1 М фосфатный буфер - 1мл (pH
ленные классы веществ, проявляющие токсич-
7.6±0.1), 0.005 M раствор 5,5'-дитиобис-(2-нитро-
ность.
бензойная кислота) (ДТНБ) - 0.02 мл, 0.005 М во-
дный раствор ацетилтиохолина (АТХ) - 0.005мл,
Статистический анализ результатов исследова-
водный раствор соответствующего фермента -
ния проводился на основе комплексного примене-
0.02 мл и 0.01 М диметилсульфоксидного рас-
ния стандартных статистических методов, вклю-
твора исследуемого вещества - 0.02 мл. Для кон-
чающих вычисления стандартных отклонений,
трольных опытов раствор, содержащий фермент
средних значений, стандартных средних ошибок.
и ДТНБ, инкубировали 10 мин при 25°С, измеря-
ЗАКЛЮЧЕНИЕ
ли поглощение, после чего добавляли АТХ и по-
Синтезированы бензиламид N-бензоил-α,β-
вторно измеряли поглощение раствора после ин-
дегидротирозины и соответствующий 4-имидазо-
кубирования 20 мин при 25°С. Тестовые опыты
лон. Показана пригодность бензоильной группы
проводили аналогично, изначально в присутствии
при синтезе производных α,β-дегидротирозина.
исследуемого соединения.
Выявлены как антихолинэстеразные, так и антира-
Конструирование молекулярных моделей ис-
дикальные способности бензиламида N-бензоил-
следуемых соединений. Трехмерные молекуляр-
α,β-дегидротирозина и соответствующего 4-ими-
ные модели были получены с помощью програм-
дазолона.
мы ChemOffice версии 13.0 [24]. Минимизация и
ИНФОРМАЦИЯ ОБ АВТОРАХ
стабилизация полученных 3D структур проводи-
ли с использованием силовых полей MM2 [25].
Топузян Виген Оникович, ORCID: http://
Молекулярные модели исследуемых соединений
orcid.org/0000-0002-1721-1993
были сохранены в формате *.PDB и *.SMILES.
Оганнесян Армен Арамович, ORCID: http://
Молекулярные модели исследуемых мишеней
orcid.org/0000-0003-0879-6800
были взяты из базы данных RCSB [26].
Макичян Ани Тиграновна, ORCID: http://
Докинг анализ. Для проведения докинг ана-
orcid.org/0000-0003-0615-2542
лиза использовали программные пакеты AutoDock
Vina и AutoDockTools [27]. Для проведения до-
Унанян Лерник Сурикович, ORCID: http://
кинг анализа использовалась методика
«сле-
orcid.org/0000-0002-6913-0175
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 2 2022
208
ТОПУЗЯН и др.
Галстян Лаура Хореновна, ORCID: http://
13.
Cheng F., Liu C., Jiang J., Lu W., Li W., Liu G.,
orcid.org/0000-0003-0424-2579
Zhou W., Huang J., Tang Y. Plos Comput. Biol. 2012.
doi 10.1371/journal.pcbi.1002503
КОНФЛИКТ ИНТЕРЕСОВ
14.
Egan W.J., Merz K.M. Jr., Baldwin J.J. J. Med. Chem.
Авторы заявляют об отсутствии конфликта ин-
2000, 43, 3867-3877.doi 10.1021/jm000292e
тересов.
15.
Lipinski C. Drug Discov. Today: Technol. 2004, 1, 337.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
doi 10.1016/j.ddtec.2004.11.007
16.
Martin Y.C. J. Med. Chem. 2005, 48, 3164-3170. doi
Дополнительные материалы доступны на
10.1021/jm0492002
17.
Steiner T., Koellner G. J. Mol. Biol. 2001, 305, 535-
СПИСОК ЛИТЕРАТУРЫ
557. doi 10.1006/jmbi.2000.4301
1.
Saito R., Hoshi M., Kato A., Ishikawa C., Komatsu T.
18.
Kumpf R., Dougherty D. Science. 1993, 261, 1708-
Eur. J. Med. Chem. 2017, 125, 965-974. Doi 10.1016/
1710. doi 10.1126/science.8378771
j.ejmech.2016.10.016
19.
Dighe S.N., Deora G.S., De la Mora E., Nachon F.,
2.
Lee C.-Y., Chen Y.-C., Lin H.-C., Jhong Y.,
Chan S., Parat M.O., Ross B.P. J. Med. Chem. 2016,
Chang C.-W., Tsai C.-H., Kao C.-L., Chien T.C.
59, 7683-7689. doi 10.1021/acs.jmedchem.6b00356
Tetrahedron.
2012,
68,
5898-5907. doi
10.1016/
20.
Nachon F., Ehret-Sabatier L., Loew D., Colas C., van
j.tet.2012.04.102
Dorsselaer A., Goeldner M. Biochemistry. 1998, 37,
3.
He X., Bell A.F., Tong P. J. Org. Lett. 2002, 4, 1523-
10507-10513. doi10.1021/bi980536l
1526. doi 10.1021/o10200403
21.
Masson P., Carletti E., Nachon F. Protein Pept. Lett. 2009,
4.
Kojima S., Ohkawa H., Hirano T., Maki S., Niwa H.,
16, 1215-1224. doi 10.2174/092986609789071207
Ohashi M., Inouye S., Tsuji F.I. Tetrahedron Lett. 1998,
22.
Abdel-Galil E., Moawad E.B., El-Mekabaty A.,
39, 5239-5242, doi 10.1016/S0040-4039(98)01031-4
Said G.E. J. Heterocycl. Chem. 2018, 55, 1092-1100.
5.
Bell A.F., He X., Wachter R.M., Tonge P.J. Biochemistry.
doi 10.1002/jhet.3139
2000, 39, 4423-4431. doi 10.1021/bi992675o
23.
Ellman G., Courtney K., Andres V. Jr, Feather-
6.
Niwa H., Inouye S., Hirano T., Matsuno T., Koji-
Stone R. Biochem. Pharm.
1961,
7,
88. doi
ma S., Kubota M., Ohashi M., Tsuji F. PNAS. 1996, 93,
10.1016/0006-2952(61)90145-9
13617-13622. doi10.1073/pnas.93.24.13617
7.
Chuang W.-T., Hsieh C.-C., Lai C.-H., Lai C.-H.,
24.
Narayanaswamy V.K., Rissdörfer М., Odhav B. Int.
Shih C.-W., Chen K.-Y., Hung W.-Y., Hsu Y.-H.,
J. Theor. Appl. Sci. 2013, 5, 43-49.
Chou P.-T. J. Org. Chem. 2011, 76, 8189-8202. doi
25.
Evans M.J., Moore J.S. J. Chem. Educ. 2011, 88, 764-
10.1021/jo2008934
768. doi 10.1021/ed100517g
8.
Chen K.-Y., Cheng Y.-M., Lai C.-H., Hsu C.-C.,
26.
Ho M.-L., Lee G.-H., Chou P.T. J. Am. Chem. Soc.
27.
Trott O., Olson A.J. J. Comput. Chem. 2010, 31, 455.
2007, 129, 4534-4535. doi 10.1021/ja070880i
doi 10.1002/jcc.21334
9.
Baldridge A., Kowalik J., Tolbert L.M. Synthesis. 2010,
28.
BIOVIA D.S. BIOVIA Discovery Studio (2017) R2:
14, 2424-2436. doi 10.1055/S-0029-1218796
A Comprehensive Predictive Science Application for
10.
Топузян В.О., Арутюнян Л.Г., Оганесян А.А. ЖОрХ.
2007, 43, 870-873. [Topuzyan V.O., Arutyunyan L.G.,
discovery-studio-visualizer-download
Oganesyan A.A. Russ. J. Org. Chem. 2007, 43, 868-
29.
871.] doi 10.1134/S1070428007060127
11.
Zhu Q.Y., Hackman R.M., Ensunsa J.L. J. Agric. Food
30.
Chem. 2002, 50, 6929-6934. doi 10.1021/jf0206163
31.
Bajda M., Więckowska A., Hebda M., Guzior N.,
12.
Daina A., Michielin O., Zoete V. Sci. Rep. 2017, 7,
Sotriffer C.A., Malawska B. Int. J. Mol. Sci. 2013,
42717. doi 10.1038/srep42717
14, 5608. doi 10.3390/ijms14035608
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 2 2022
ПРИМЕНЕНИЕ БЕНЗОИЛЬНОЙ О-ЗАЩИТНОЙ ГРУППЫ
209
The Application of a Benzoyl O-Protective Group
in the Synthesis of α,β-Dehydrotyrosine Containing Amides
and Imidazolones
V. O. Topuzyanа, A. A. Ogannesyanа, A. T. Makichyanа, b, *,
L. S. Hunanyanb, and L. Kh. Galstyanc
a Scientific Technological Center of Organic and Pharmaceutical Chemistry of NAS RA,
prosp. Azatutian, 26, Yerevan, 0014 Armenia
b Russian-Armenian University, ul. Hovsepa Emina, 123, Yerevan, 0051 Armenia
c Yerevan State University, ul. Aleka Manukyana, 1, Yerevan, 0025 Armenia
*e-mail: ani.makichyan@rau.am
Received August 23, 2021; revised November 19, 2021; accepted November 22, 2021
The possibility of using the O-benzoyl protecting group for the synthesis of both N-benzoyl-α,β-dehydro-
tyrosinebenzylamide, and the corresponding 4-imidazolone was studied. It is noted that the reaction of
4-(4-benzoyloxybenzylidene)-5(4H)-oxazolone with benzylamine proceeds with the retention of the O-benzoyl
protecting group. The latter is removed with 2-(dimethylamino)-1-ethylamine or 3-(dimethylamino)-1-
propylamine. In the case of the cyclization of benzyl amide of the N,O-dibenzoyl-α,β-dehydrotyrosine to (Z)-3-
benzyl-5-(4-hydroxybenzylidene)-2-phenyl-3,5-dihydro-4H-imidazol-4-one with 1,1,1,3,3,3-hexamethyldisila
zane, the cleavage of O-benzoyl protection. The antiradical and anticholinesterase properties of the synthesized
compounds were studied.
Keywords: O-protective group, α,β-dehydroamino acid, 5(4H)-oxazolone, imidazol-4-one, amides, antiradical
activity, anticholinesterase activity
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 2 2022