ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 3, с. 248-263
УДК 547.316 + 547.326 + 547.824 + 577.112 + 004.942
СИНТЕЗ НОВЫХ 1,4-ДИГИДРОПИРИДИНОВ:
ОПТИМИЗАЦИЯ УСЛОВИЙ СИНТЕЗА И in silico
АНАЛИЗ БИОАКТИВНОСТИ ПОЛУЧЕННЫХ
СОЕДИНЕНИЙ
© 2022 г. И. В. Минееваa, *, Я. В. Фалетровa, b, В. А. Старовойтоваa, b, В. М. Шкуматовa, b
a Белорусский государственный университет, Беларусь, 220047 Минск, просп. Независимости, 4
b НИИ Физико-химических проблем, Белорусский государственный университет,
Беларусь, 220006 Минск, ул. Ленинградская, 14
*e-mail: i.mineyeva@yandex.ru
Поступила в редакцию 30.07.2021 г.
После доработки 10.08.2021 г.
Принята к публикации 14.08.2021 г.
Впервые разработан эффективный метод получения 1,4-дигидропиридинов, содержащих остаток али-
фатических и β-гидроксициклопропановых альдегидов с применением гексагидрата хлорид европия
как катализатора для мультикомпонентной реакции Ганча. Проведена оценка биологических свойств
полученных соединений методами моделирования проницаемости через фосфолипдный бислой и
молекулярного докинга в отношении протеин киназ и цитохромов P450 человека. Опыты по влиянию
1,4-дигидропиридинов на рост дрожжей Yarrowia lipolytica и Saccharomyces cerevisiae показали отсут-
ствие острой токсичности у протестированных соединений.
Ключевые слова: эфиры Ганча, 1,4-дигидропиридины, мультикомпонентные реакции, алифатические
и β-гидроксициклопропановые альдегиды, хлорид европия, хлорид церия, докинг, анализ in silico
DOI: 10.31857/S051474922203003X
ВВЕДЕНИЕ
Эти лекарственные соединения часто получают
с использованием мультикомпонентной реакции
1,4-Дигидропиридины (1) (схема 1) широко
Ганча, под которой традиционно подразумевают
исследовали вследствие их перспективных фар-
образование 1,4-дигидропиридинового цикла 1 в
макологических и биологических свойств
[1].
реакции между ацетоуксусным эфиром (2), арома-
Известно, что ряд соединений этого типа прояв-
тическим альдегидом 3 и любым источником ам-
ляют антитуберкулезные [2, 3], противоопухоле-
миака 4 при нагревании в подходящем растворите-
вые [4], нейротропные [5], антиишемические [6],
ле и катализе протонными или кислотами Льюиса
гепатопротекторные
[7], бронхолитические
[8],
[16-18] (схема 1). Использование мультикомпо-
противовоспалительные [9] или антидиабетиче-
нентных реакций является привлекательным син-
ские свойства [10]. Дигидропиридины являются
тетическим подходом и имеет большое количе-
лекарственными препаратами, относящимися к
ство преимуществ: селективность, эффективное
блокаторам кальциевых каналов и применяются
использование субстратов (atom saving strategy),
экологичность, экономическая эффективность, а
для лечения гипертензии, стенокардии и аритмии
также экспериментальная простота [19].
[11, 12]; некоторые из них применяются как анти-
конвульсанты [13], анальгетики [14], антитромбо-
Реакцию Ганча можно модифицировать путем
тические соединения [15].
замены различных компонент на схожие по при-
248
СИНТЕЗ НОВЫХ 1,4-ДИГИДРОПИРИДИНОВ
249
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
250
МИНЕЕВА и др.
роде соединения, что приводит к возможности
но могут обладать различными биологическими
простого синтеза очень сложных структур [16, 17,
свойствами, поскольку содержат в себе две фарма-
19]. В реакцию Ганча можно вовлекать самые раз-
кофорные группы: 1,4-дигидропиридиновое коль-
нообразные альдегиды 3, такие как ароматические
цо и циклопропановый фрагмент (схема 1).
[20], гетероароматические [21], использование же
Альдегиды 12, 13 являются лабильными соеди-
алифатических альдегидов [22-25] является огра-
нениями, так как они содержат циклопропаноль-
ниченным, вследствие высокой лабильности про-
ное кольцо, которое легко может быть раскрыто
межуточных продуктов и часто низких выходов
в сильнокислых средах, а также при использова-
реакции.
нии сильных кислот Льюиса, им также свойствен-
1,4-Дигидропиридины, содержащие фрагмент
на реакция элиминирования в основных средах
алифатических альдегидов, проявляют широкий
[35]. Эти факты сильно сокращают возможности
спектр биологических свойств и могут найти свое
использования многих катализаторов и раствори-
применение в медицинской практике (схема 1).
телей для мультикомпонентной реакции Ганча с
Например, соединение 5 является антагонистом
алифатическими альдегидами 12 и 13.
аденозиновых рецепторов, ингибитором фактора
Цель работы состояла в поиске новых мягких,
активации тромбоцитов [26, 27]. Эфир 6 проявляет
селективных катализаторов и условий для реакции
противоопухолевые свойства и является ингиби-
Ганча, которые позволят вовлечь в нее алифатиче-
тором протеина 1 мультилекарственной резистент-
ские альдегиды различного строения с высоким
ности (MRP1) [28]. Соединение 7 является ингиби-
выходом, а также оценить биологические свойства
тором α-глюкозиназы дрожжей [29]. Эфир 8 прояв-
полученных 1,4-дигидропиридинов при помощи
ляет антиконвульсантную активность [30]. Эфиры
подходов in silico (проницаемость через мембрану
9 и 10 являются модуляторами P-гликопротеина,
и взаимодействие с белками при помощи докинга).
ответственного за мультилекарственную устойчи-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
вость [22, 31] а также противоопухолевыми пре-
паратами для линии резистентних клеток эпидер-
Синтез эфиров Ганча на основе алифатиче-
миса KB/VJ300 (схема 1). Соединение 11 является
ских альдегидов. Пробные опыты для подбора
ингибитором фермента, расщепляющего белок
оптимальных условий в реакциях Ганча с участи-
бета-сайта амилоида (ВАСЕ-1) и может приме-
ем алифатических альдегидов были проведены с
няться при лечении болезни Альцгеймера [32]. С
применением гексаналя (14), ацетоуксусного эфи-
другой стороны, замещенные циклопропаны мо-
ра (2), и ацетата аммония (15) (схема 2).
гут осуществлять ингибирование ряда ферментов,
Самые мягкие и щадящие условия, в которых
обладают противоопухолевым действием, антими-
проводилась данная реакция, были отобраны из
кробной, противовирусной, противогрибковой и
литературных источников по данной проблема-
другими видами биоактивности [33-36].
тике (опыты 1-5,7, 10), а также были проведены
Таким образом, соединения, которые могут
опыты в ранее не описанных условиях (опыты 6,
быть получены в реакциях Ганча с использовани-
8, 9, 11-21). Результаты этих экспериментов пред-
ем алифатических альдегидов 12-14 потенциаль-
ставлены в табл. 1.
Схема 2
O
H
C5H11
O
C5H11
O
O
O
Растворители и условия
14
из табл. 1
EtO
OEt
EtO
OEt
+
O
O
N
H
NH4OAc
2
2
16
15
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
СИНТЕЗ НОВЫХ 1,4-ДИГИДРОПИРИДИНОВ
251
Таблица 1. Подбор оптимальных условий для реакции Ганча между гексаналем (14) и ацетоуксусным эфиром (2)
Соотношение
Опыт
Катализатор
реагентов
Растворитель
Т, °С
Время, ч
Выход 16, %
(14/2/15)
1
- [37]
1/2/2
H2O
100
6.5
59
2
Bu4NBr (50 мол %) [38]
1/2/2
H2O
МИа
0.17
28
3
I2 (30 мол %) [39]
1/2/1
C2H5OH
20
16
19
4
LiBr (10 мол %) [40]
1/2/1.1
CH3CN
20
6
53
5
Cu(OTf)2 (1 мол %) [41]
1/2/1
CH3CN
20
24
29
6
Cu(OTf)2 (10 мол %)
1/2/1
C2H5OH
20
24
30
7
Sc(OTf)3 (5 мол %) [42]
1/2/1
C2H5OH
20
24
48
8
Sc(OTf)3 (10 мол %)
1/2/1
C2H5OH
20
24
57
9
Zn(OTf)2 (10 мол %)
1/2/1
C2H5OH
20
24
33
10
CeCl3·7H2O (10 мол %) [43]
1/2/1.5
CH3CN
20
24
26
11
CeCl3·7H2O (15 мол %)
1/2/1.2
C2H5OH
78
4
73
12
CeCl3·7H2O (10 мол %)
1/2/1.2
C2H5OH
78
4
77
13
CeCl3·7H2O (5 мол %)
1/2/1.2
C2H5OH
78
2
83
14
EuCl3·6H2O (15 мол %)
1/2/1.2
C2H5OH
78
2
100
15
EuCl3·6H2O (10 мол %)
1/2/1.2
C2H5OH
78
3
78
16
EuCl3·6H2O (5 мол %)
1/2/1.2
C2H5OH
78
3
79
17
YbCl3·6H2O (15 мол %)
1/2/1.2
C2H5OH
78
3
73
18
YbCl3·6H2O (10 мол %)
1/2/1.2
C2H5OH
78
4
78
19
YbCl3·6H2O (5 мол %)
1/2/1.2
C2H5OH
78
4
85
20
YCl3·6H2O (5 мол %)
1/2/1.2
C2H5OH
78
2
59
21
LaCl3·6H2O (5 мол %)
1/2/1.2
C2H5OH
78
2
51
а Микроволновое излучение 400 Вт
Лучшие выходы эфира
16, как видно из
равновесии с ионами аммония, а те, в свою оче-
табл. 1, были в экспериментах с использовани-
редь, в равновесии с твердым ацетатом аммония.
ем переходных металлов и кипячении реакцион-
Увеличение мольной доли катализатора может
ной смеси в этаноле в течение нескольких часов
приводить к уменьшению растворимости в пер-
(опыты 13 и 14), замена этанола на другие раство-
вую очередь аммиака, а также ацетата аммония
рители оказалась неэффективной. В случае при-
в полученном растворе. Снижение концентрации
аммиака должно приводить к уменьшению скоро-
менения катализаторов YbCl3·6H2O и CeCl3·7H2O
сти реакции образования конечного продукта, и
наблюдается увеличение выхода при переходе от
увеличению выхода различных побочных процес-
15 к 10 и 5 мол %. Такую закономерность можно
сов.
объяснить эффектом высаливания неэлектролита
в присутствии растворенных солей. В данной ре-
Далее в мультикомпонентную реакцию Ганча
акции в качестве активной аммиачной компонен-
удалось вовлечь гексаналь (14) и модифицирован-
ты выступает сам аммиак, который находится в
ные 1,3-дикарбонильные соединения, такие как
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
252
МИНЕЕВА и др.
Схема 3
O
O O
O C
5H
11
O
O C5H 11O
OEt
O
EtO
OEt
O
18
17
NH4OAc (15), EtOH
H
C5H11
NH4OAc (15), EtOH
N
H
EuCl3·6H2O (15 мол %)
EuCl3·6H2O (15 мол %)
N
14
97%
67%
H
O
20
19
O O
NH4OAc (15), EtOH
EuCl3·6H2O (15 мол %)
+
85%
OEt
O
17
2
O
C5H 11O
OEt
N
H
21
димедон (17) и этил 5-метил-3-оксогексаноат (18),
ный бислой. Оценка производилась при помощи
в ранее подобранных условиях для синтеза эфира
сервиса PerMM (Permeability of Molecules across
16 (схема 3). Таким образом, были получены но-
Membranes) [45], который позволяет на основании
вые эфиры Ганча 19-21 с умеренным и высоким
3D структуры исследуемой молекулы предсказать
выходом.
проницаемость мембраны для пассивной диффу-
зии этой молекулы.
Уникальные альдегиды 12 и 13, содержащие
В табл. 2 приведены основные параметры, по-
защищенное циклопропанольные кольцо, были
лученные в процессе моделирования для вновь
впервые вовлечены в мультикомпонентную реак-
синтезированных эфиров Ганча. По представлен-
цию Ганча с ацетоуксусным эфиром (2), димедо-
ным данным видно, что логарифмы коэффициен-
ном (17). Для синтеза альдегида 12 полученный
тов проницаемости для моделей трех различных
ранее циклопропанол 21 [44] был защищен ме-
мембран имеют значение превышающее -4.35,
токсиметильной защитной группой, а в промежу-
следовательно, все изучаемые производные спо-
точном эфире удалена диэтилацетальная защита.
собны проникать через мембрану клеток и уча-
Полученный стандартным образом ацетат ци-
ствовать во внутриклеточной регуляции
[45].
клопропанола 22 был трансформирован в альде-
Наибольшая проницаемость спрогнозирована для
гид 13 после удаления диэтилацетальной защиты
соединения 20.
(схема 4). ЕuCl3·6H2O и CeCl3·7H2O являются до-
In silico оценка биологических эффектов ди-
статочно мягкими кислотами Льюиса, что позво-
гидропиридинов методом молекулярного до-
лило их использовать в качестве катализаторов в
кинга. Компьютерное моделирование белок-ли-
реакциях Ганча с лабильными альдегидами 12 и 13
гандных взаимодействий (докинг) является совре-
(схема 4).
менным подходом для предварительной оценки
Исследование проницаемости клеточной
эффективности и пространственных особенностей
мембраны. Для дальнейшего исследования био-
взаимодействия низкомолекулярных соединений
логических свойств новых полученных эфиров
с белками [46]. Среди установленных «классиче-
Ганча была проведена теоретическая оценка про-
ских» белков-мишеней производных дигидропи-
никновения исследуемых веществ в клетку по эф-
ридиов находятся вольтаж-зависимые кальциевые
фективности их пассивной диффузии через липид-
каналы [47]. С другой стороны, в современной ли-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
СИНТЕЗ НОВЫХ 1,4-ДИГИДРОПИРИДИНОВ
253
Схема 4
O
O
OMOM
OEt
OMOM
O
O
O
O
O
O
O OMOM
17
2
EtO
OEt
NH4OAc (15), EtOH
H
NH4OAc (15), EtOH
12
N
N
H
H
23
1. MOMCl, i-Pr2NEt,
22
PhMe, CH2Cl2, 86%
CeCl3·7H2O (5 мол %) 83%
O, 85%
2. ППТС, Me2CO, H2
EuCl3·6H2O (15 мол %) 92%
OEt OH
EtO
21
O
1. AcCl, Py, CH2Cl2, 85%
O, 85%
2. ППТС, Me2CO, H2
OEt
OAc
O
O
O
O
OAc
2
NH4OAc (15), EtOH
EtO
O
H
CeCl3·7H2O (5 мол %) 56%
13
EuCl3·6H2O (15 мол %) 75%
N
H
24
тературе появляются публикации о противорако-
расчета киназ, так как в большинстве случаев они
вых эффектах производных дигидропиридина [48,
показали in silico аффинность к этим белками-ми-
49], а среди белков-мишеней указаны некоторые
шеням, сопоставимую или большую, чем недавно
протеин киназы [50-52]. В дополнение об извест-
опубликованное соединение-лидер [50].
ной роли лекарств-дигидропиридинов в индукции
Расчеты для цитохромов P450 человека и ди-
цитохромов P450 печени, цитохрома P450 3A4
гидропиримидинов 16, 19 и 23 показали, что диа-
в метаболизме нифедипина [53], Недавно были
пазон значений Ebind составил от -10.1 (для пары
опубликованы новые данные о взаимодействии
фермент CYP11A1, структура pdb 3n9z и 19) до
лекарств-дигидропиридинов с человеческим ци-
-6.2 ккал/моль (для пары фермент CYP2A6, струк-
тохромом P450 2J2 [54].
тура pdb 1z10 и 23).
Так, было решено провести докинг синтези-
рованных дигидропиридинов как описано в ра-
Хорошая аффинность (величины Ebind от
боте [55] в отношении пула обозначенных про-
-9.5 ккал/моль и ниже) показана для in silico взаи-
теин киназ (табл. 3) и цитохромов P450 человека
модействия с важными стероид-превращающими
(табл. 4), используя автоматически рассчитыва-
цитохромами P450 (CYP11A1, CYP46A1, CYP51,
емой программой Autodock Vina [56] параметр
CYP19A1) [57], а также P450, участвующими в ме-
энергии взаимодействия (docking score, binding
таболизме лекарств (CYP3A4). Например, модели
energy, Ebind). В научной литературе нет таких
связывания дигидропиридина 19 с ферментами
расчетов для этих пар белок-лиганд.
CYP19 (мишень лекарств для терапии рака молоч-
Из полученных данных можно заключить, что
ной железы) и CYP46 (холестерин-24S гидрокси-
соединения 19 и 23 обладают потенциалом для
лаза, специфическая для центральной нервной си-
экспериментального тестирования взятых для
стемы [58]) показаны на рисунке.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
254
МИНЕЕВА и др.
Таблица 2. Значения теоретически-рассчитанной свободной энергии связывания и коэффициентов проницаемости
соединений 16, 19-24 для различных мембрана
Свободная энергия
Log коэффициента
Log коэффициента
Log коэффициента
Соединение
связывания с
проницаемости (плазмати-
проницаемости
проницаемости (ГЭБ)
мембраной, ккал/моль
ческая мембрана)
(Caco-2)b
16
-4.50
0.60
-2.68
-3.34
19
-4.87
0.54
-2.70
-3.34
20
-7.68
3.66
-1.60
-2.54
21
-5.20
1.45
-2.38
-3.11
22
-4.34
0.82
-2.60
-3.27
23
-4.75
-1.40
-3.39
-3.84
24
-3.55
-1.08
-3.27
-3.76
Глюкоза
0.09
-9.27
-6.16
-5.85
(контроль)
Холестерин
-10.31
5.90
-0.81
-1.97
(контроль)
Нифедипин
-2.86
-2.75
-3.86
-4.18
(контроль)
а pH 7.35, Т 37°С; значения LogP > -4.35 для ГЭБ указывают на способность вещества к пассивному транспорту через соответ-
ствующие мембраны [45]
b данные, относящиеся к мембране клеток калоректальной аденокарциномы человека
За исключением CYP3A4 вновь синтезирован-
Влияние дигидропиридинов на рост дрож-
ный дигидропиридин 19 демонстрировал лучшие
жей Yarrowia lipolytica и S. Cerevisiae. Клетки
дрожжей часто используют как предварительную
параметры взаимодействия, чем недавно опубли-
удобную модель эукариотических клеток для
кованный дигидропиридин с противораковой ак-
оценки токсических эффектов новых соединений
тивностью [50]. Менее аффинное связывание с
[61, 62].
CYP3A4 может рассматриваться как преимуще-
В работе рост биомассы клеток штамма ди-
ство, поскольку этот P450 отвечает за метаболизм
морфных дрожжей Yarrowia lipolytica проводили в
лекарств в печени, т.е. способствует уменьшению
присутствии эфиров Ганча 16 и 19 (табл. 5), содер-
их концентрации. Взаимодействие со стероид-пре-
жащих длинный алкильный хвост и являющими-
вращающими P450 могут быть причиной как не-
ся подходящими субстратами именно для данного
желательных, так и желательных фармакологиче-
вида дрожжей.
ских эффектов потенциальных противораковых
В опытах не наблюдалось значимое подавле-
соединений в зависимости от роли стероидов в
ние роста дрожжей при 24 ч инкубации. Данные
патогенезе конкретных раковых заболеваний. В
результаты могут быть интерпретированы как от-
среднем, для дигидропиридинов 16 и 23 наблюда-
сутствие сильной токсичности этих соединений по
лись большие значения Ebind, т.е. меньшая аффин-
общим для эукариотических клеток (млекопитаю-
ность к цитохромам P450, однако для структуры
щие, дрожжи) механизмам, так и отсутствие вы-
CYP46A1 с кодом PDB 3mdt показана расположе-
раженного антигрибкового действия в отношении
ние циклопропанового фрагмента вблизи железа
данных микроорганизмов.
гема, что может быть причиной инактивации тако-
Были также проведены дополнительные опыты
го фермента [59], с другой стороны, дигидропири-
со штаммом дрожжей S. Cerevisiae в случае эфи-
дины могут инактивировать P450 [60].
ров 22-24, результаты представлены в табл. 6.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
СИНТЕЗ НОВЫХ 1,4-ДИГИДРОПИРИДИНОВ
255
Таблица 3. Значения Ebind (ккал/моль) для in silico взаимодействия синтезированных дигидропиридинов с киназами
человека
БЕЛКИ
PDB
16
19
20
21
22
23
24
Kа
4Y72
-7.5
-7.6b
-7.7
-8.0
-7.2
-7.4
-7.6
-6.8
4YC3
-6.5
-8.4
-6.6
-7.5
-6.3
-8.2
-6.9
-7.9
CDK1/CYCLINB1
5LQF
-7.0
-10.2
-7.7
-8.0
-7.1
-8.8
-7.5
-8.8
/CKS2
6GU6
-5.2
-7.1
-5.3
-6.0
-7.1
-6.7
-6.9
-7.2
6GU7
-6.3
-8.4
-6.7
-6.7
-6.8
-7.7
-7.0
-7.4
6TFY
-6.5
-8.1
-6.3
-7.0
-6.6
-7.3
-6.8
-7.2
EGFR T790M/
V948R
6TFZ
-6.8
-8.5
-6.2
-7.5
-6.1
-7.3
-6.9
-7.3
HER2
6LBX
-4.9
-6.4
-5.0
-5.8
-5.2
-6.6
-5.0
-7.0
DOMAIN IV
HER2
3PP0
-6.6
-7.3
-6.4
-6.6
-6.1
-7.5
-6.6
-7.5
KINASE
DOMAIN
3RCD
-6.2
-8.1
-6.6
-7.7
-5.8
-8.3
-6.3
-7.7
(ERBB2)
VEGFR2
3VNT
-6.4
-7.6
-6.3
-6.4
-6.1
-7.3
-6.2
-8.0
KINASE
4ASD
-6.2
-7.7
-6.3
-6.5
-5.8
-7.2
-6.2
-7.5
6GQP
-6.1
-7.5
-5.8
-6.5
-5.7
-7.1
-6.1
-7.2
DOMAIN
6GQQ
-6.9
-8.8
-5.5
-8.1
-5.6
-8.1
-6.5
-8.4
6XVJ
-6.5
-7.5
-6.2
-6.3
-5.6
-7.5
-5.5
-8.2
6XVK
-5.7
-7.4
-5.7
-6.0
-5.5
-7.0
-5.8
-8.6
а Контроль осуществлен относительно молекулы-лидера из публикации [50]
b Жирным шрифтом обозначены наименьшие значения Ebind для каждой структуры
В данном наборе соединений также ни одно не
лацетат в различных
соотношениях. Выделение
вызывало значимого подавления роста, что свиде-
индивидуальных веществ осуществляли методом
тельствует об отсутствии острой токсичности про-
колоночной хроматографии на силикагеле (70-
тестированных соединений.
230 меш) производства фирмы Merck с использо-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованные в ходе работы реактивы и
растворители имели квалификацию «чистые» и
«чистые для анализа». Очистка и высушивание
растворителей проводились в соответствии с лите-
O
O
ратурными методами. Оценку индивидуальности
синтезируемых веществ и наблюдение за ходом
EtO
OEt
проводимых реакций осуществляли методом тон-
кослойной хроматографии (ТСХ) на пластинках
N
H
«Sorbfil». В качестве элюента были использованы
[50]
смеси растворителей - петролейный эфир и эти-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
256
МИНЕЕВА и др.
Таблица 4. Значения Ebind (ккал/моль) для in silico взаимодействия синтезированных дигидропиридинов с некото-
рыми цитохромами P450 человекаа
БЕЛКИ
PDB
16
19
20
21
23
K
CYP11A1
3n9z
-7.6 H
-10.1 Hb
-7.5
-8.9
-7.5 H
-9.6 H
CYP11A1
3n9y
-7.5 H
-9.7 H
-8.0
-7.7
-6.6 Hc
-8.1 H
CYP11A1
3na0
-7.7 H
-9.6 H
-8.1
-8.9
-8.0 H
-7.9 H
CYP11A1
3na1
-7.7 H
-9.6 H
-7.8
-8.6
-7.8 Hc
-9.2 H
CYP17A1
3ruk
-7.0 H
-8.4 H
-7.2
-7.8
-7.6
-8.9 H
CYP17A1
3swz
-7.1 H
-8.6 H
-7.2
-7.9
-7.3 H
-7.7
CYP17A1
5irq
-7.0 H
-7.5 H
-6.6
-8.2
-6.7
-8.2 H
CYP17A1
6ciz
-7.3 H
-8.1 H
-7.5
-7.9
-7.9 H
-7.7 H
CYP19A1
4gl7
-7.7 H
-9.9 H
-6.9
-7.4
-7.2
-7.8
CYP19A1
5jl7
-5.6
-8.5 H
-6.0
-6.7
-7.6
-8.1
CYP19A1
5jl6
-5.6
-8.2 H
-6.3
-6.9
-7.4
-7.9
CYP19A1
5jl9
-7.4 H
-7.9 H
-5.6
-6.7
-7.2
-7.9
CYP3A4
6bd6
-7.2 H
-10.0 H
-7.7
-8.5
-9.4 H
-10.9 H
CYP3A4
5te8
-7.7 H
-9.7 H
-7.9
-8.3
-8.3 H
-10.5 H
CYP3A4
6ma7
-7.9 H
-10.5 H
-8.2
-8.4
-9.7 H
-10.0 H
CYP3A4
1tqn
-7.3 H
-9.4 H
-8.3
-8.0
-9.6 H
-10.3 H
CYP3A4
3nxu
-7.1 H
-9.1 H
-7.4
-8.5
-9.2 Hc
-10.3 H
CYP46A1
2q9g
-7.5 H
-10.1 H
-8.1
-8.9
-9.5 H
-9.0 H
CYP46A1
3mdt
-7.3 H
-9.9 H
-8.1
-8.7
-9.6 Hc
-9.8 H
CYP46A1
3mdv
-7.5 H
-9.5 H
-8.2
-8.8
-8.6 H
-8.4 H
CYP46A1
4j14
-7.4 H
-9.1 H
-7.6
-8.8
-8.3 H
-8.9 H
CYP51
3ld6
-7.5 H
-10.0 H
-8.3
-9.0
-9.7 H
-10.4 H
CYP51
4uhl
-7.7 H
-9.9 H
-7.6
-8.0
-8.7 H
-9.0 H
CYP51
4uhi
-8.0 H
-9.8 H
-7.5
-7.9
-9.1 H
-8.9 H
CYP51
3jus
-7.2 H
-9.5 H
-7.6
-8.5
-9.8 H
-9.3 H
а Контроль осуществлен относительно молекулы-лидера из публикации [50]
b Жирным шрифтом обозначены наименьшие значения Ebind для каждой структуры; H означает локализацию вблизи гема (не
более 0.4 нм до какого-либо атома лиганда)
c Означает близость атома циклопропанового фрагмента
ванием в качестве элюентов смесей тех же раство-
веществ записаны в пленке на спектрофотометре
рителей. Спектры ЯМР 1H и 13С 5-10% растворов
Bruker FT - IR Alpha. Элементный анализ выпол-
соединений в дейтерохлороформе получены на
нен полумикрометодом. Масс-спектры были по-
приборе Bruker Avance 500 с рабочими частота-
лучены на приборе Agilent 8860 gс System (США)
ми 500 и 125 МГц соответственно. ИК спектры
масс спектрометре с ионизацией электронным
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
СИНТЕЗ НОВЫХ 1,4-ДИГИДРОПИРИДИНОВ
257
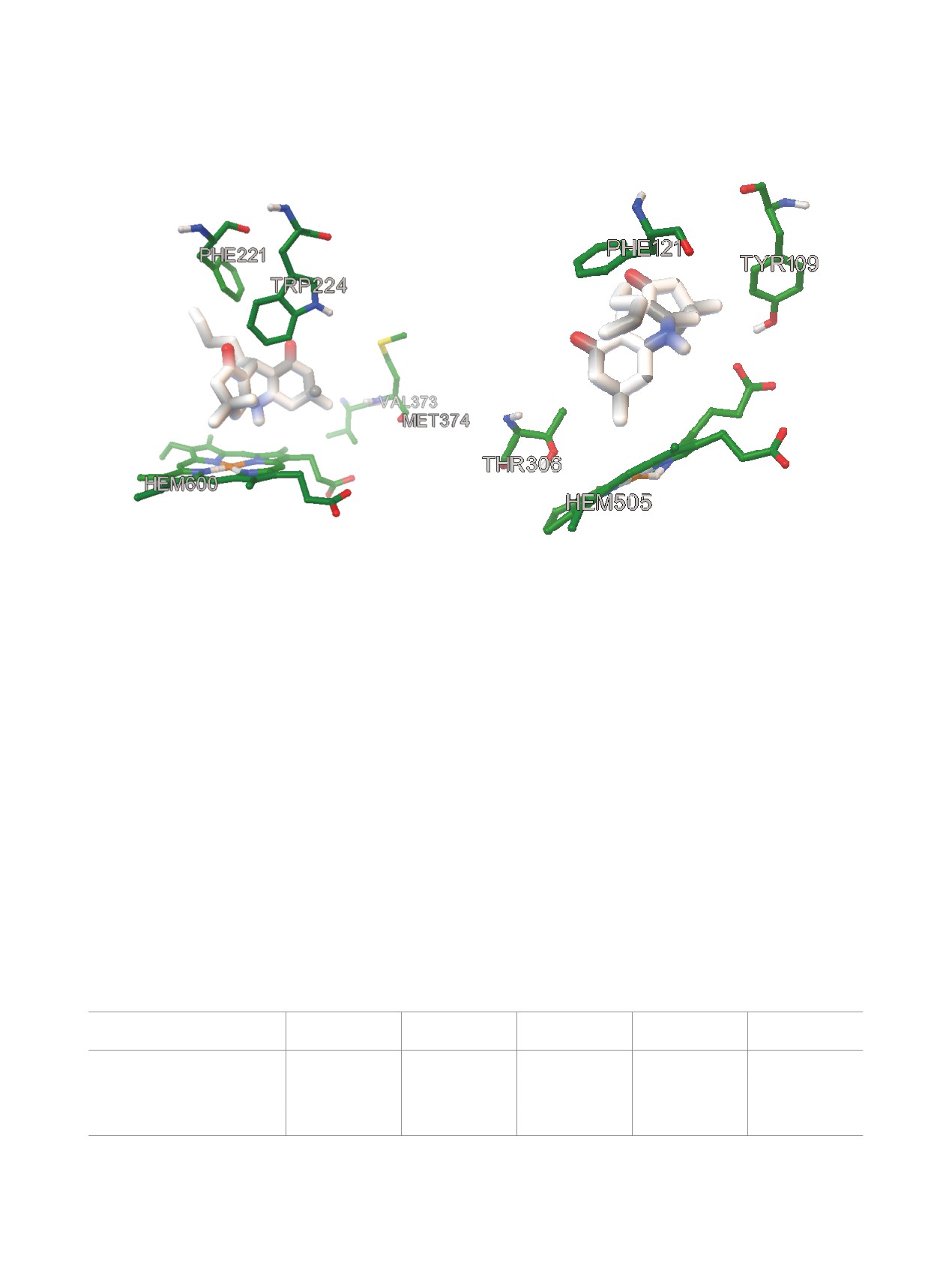
(a)
(b)
Рассчитанные in silico положения соединения 19 в активных центрах стероид-превращающих цитохромов P450 CYP19,
структура PDB 4gl7 (a) и CYP46, структура PDB 2q9g (b)
ударом 70эВ, колонка Agilent 1990 1s-433е, hp-5
аффинности взаимодействия. Визуализацию ком-
ms от -60 до 350°С.
плексов белок-лиганд осуществляли использовали
программу MGL Tools [63]. Анализ проницаемо-
Расчеты и анализ результатов поведены с ис-
сти соединений через фосфолипидные мембраны
пользованием программного пакета AutoDockTools
in silico был проведен согласно [45].
1.5.6 [63] и программы Autodock Vina [56], исполь-
зуя параметры тщательности (exhaustiveness) и
Микробиологические опыты (оценка влияния
число моделей (number of models), равными 12 и 5,
соединения на рост дрожжей) проводили с исполь-
соответственно, в целом как описано в [55]. Файлы
зованием диморфных штаммов дрожжей Yarrowia
с данными о структурах белков были скопирова-
lipolytica и S. Cerevisiae [57]. Рост биомассы клеток
ны с онлайн базы данных PDB (в общей сложно-
проводили при 30°С и 200 оборотов×мин-1 в шей-
сти в работе представлены данные расчетов для
кере-инкубаторе УВТМ (Элион, Россия) с исполь-
16 структур протеин киназ и 25 цитохромов P450
зованием питательных среды YPD 0.4 (1% дрож-
человека). Эффективность связывания оценивали
жевого экстракта, 2% пептона, 0.4% глюкозы).
по автометически рассчитывемому программой
Количество клеток оценивали по поглощению на
Autodock Vina параметру энергии взаимодействия
600 нм (A600, A600 = 1 соотносили с 24×106 клеток
(docking score, binding energy, Ebind) как параметр
[64]. Тестируемые соединения добавляли в виде
Таблица 5. Значения числа клеток дрожжей (в миллионах, округленные до целых), инкубировавшихся с 100 мкМ
соединений 16 и 19
Производное
0 ч
3 ч
6 ч
18 ч
24 ч
16
12
24
67
422
792
19
12
23
58
382
715
контроль
12
17
41
384
792
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
258
МИНЕЕВА и др.
Таблица 6. Значения числа клеток дрожжей (в миллионах, округленные до целых), инкубировавшихся с 100 мкМ
соединений 22-24
Производное
0 ч
3 ч
6 ч
18 ч
24 ч
22
12
34
144
341
425
23
12
31
124
336
421
24
12
26
106
413
515
контроль
12
38
108
322
402
этанольного раствора до концентрации 100 мкМ
твору 0.20 г (2.0 ммоль) гексаналя (14), 0.56 г
и 1% этанола. В контрольный образец добавляли
(4.0 ммоль) димедона (17) и 0.23 г (3.0 ммоль)
1% этанола. Начальное количество клеток соот-
NH4OAc (15) в 2 мл этанола добавляли 0.11 г
ветствовало оптической плотности A600 0.5. Рост
(0.3 ммоль) EuCl3·6H2O и кипятили в течение
осуществляли в течение 24 ч. Для контроля роста
5 ч до полного завершения реакции (контроль по
A600 определяли аликвоты 100 мкл смешивали с
ТСХ). После удаления растворителя при понижен-
900 мкл питательной среды в 0, 3, 6, 18 и 24 ч.
ном давлении, продукт выделяли колоночной хро-
матографией (элюент - смесь петролейного эфира
Диэтил
2,6-диметил-4-пентил-1,4-дигидро-
и EtOAc, 2:1). Выход 0.46 г (67%). ИК спектр, ν,
пиридин-3,5-дикарбоксилат
(16). К раствору
см-1: 3276 сл (N-Н), 3196 сл (N-Н), 1602 с (С=О),
0.20 г (2.0 ммоль) гексаналя (14), 0.52 г (4.0 ммоль)
1480 с (С-О), 1378 с (С-О), 1228 с (С-О), 1141 с
ацетоуксусного эфира (2) и 0.18 г (2.4 ммоль)
(С-О). Спектр ЯМР 1H, δ, м.д.: 0.79 т [3Н,
NH4OAc (15) в 2 мл этанола добавляли 21 мг
(CH2)4CH3, J 6.8 Гц], 1.08 с (6Н, 2ССН3), 1.09 с
(0.1 ммоль) YCl3·6H2O или 37 мг (0.1 ммоль)
(6Н, 2ССН3), 1.12-1.23 м [6Н, СН2(СН2)3СН3],
CeCl3·7H2O или 35 мг (0.1 ммоль) LaCl3·6H2O
1.35-1.45 м [2Н, СН2(СН2)3СН3], 2.24 уш.c (4Н,
или 110 мг (0.3 ммоль) EuCl3·6H2O или 39 мг
СН2C=O), 2.30-2.43 м (4Н, СН2C=), 4.06 т [1Н,
(0.1 ммоль) YbCl3·6H2O и кипятили в течение 2-
CH(CH2)4CH3, J 5.0 Гц], 8.28 уш.c (1Н, NH). Спектр
4 ч до полного завершения реакции (контроль по
ЯМР 13С, δ, м.д.: 14.3, 22.8, 25.1, 27.2 (2C), 27.3
ТСХ). После удаления растворителя при понижен-
(2С), 29.9, 32.4, 32.6 (2С), 35.3, 40.9 (2С), 51.3 (2С),
ном давлении, продукт выделяли колоночной хро-
112.5 (2С), 151.1 (2С), 196.7 (2С). Масс-спектр, m/z
матографией (элюент - смесь петролейного эфи-
(Iотн, %): 273 (20.62), 272 (100.00), 271 (4.74), 216
ра и EtOAc, 40:1). Выходы продукта приведены в
табл. 1. ИК спектр, ν, см-1: 3334 сл (N-Н), 1693 с
(5.57), 215 (13.86), 188 (4.63). Найдено, %: С 79.14;
(С=О), 1650 с (N-Н), 1212 с (С-О), 1084 с (С-О),
Н 9.52. C22H33NO2. Вычислено, %: С 76.92; Н 9.68.
1044 с (С-О), 1023 с (С-О). Спектр ЯМР 1H, δ,
Диэтил
2,6-диизобутил-4-пентил-1,4-дигид-
м.д.: 0.84 т [3Н, (СН2)4СН3, J 7.1 Гц], 1.11-1.26 м
ропиридин-3,5-дикарбоксилат
(20).
Получен
[8Н, (СН2)4СН3], 1.29 т (6Н, OCH2CH3, J 7.1 Гц),
по методике получения эфира 16 с катализом
2.28 c (6Н, CH3С=), 3.92 т [1Н, СН(СН2)4СН3, J
EuCl3·6H2O. Выход 0.79 г (97%). ИК спектр, ν,
5.9 Гц], 4.11-4.23 м (4Н, OCH2CH3), 5.51 c (1Н,
см-1: 3376 сл (N-Н), 1636 с (С=О), 1283 с (С-О),
NH). Спектр ЯМР 13С, δ, м.д.: 14.3, 14.6 (2С), 19.7
1201 с (С-О), 1093 с (С-О). Спектр ЯМР 1H, δ,
(2С), 22.9, 24.8, 32.3, 33.1, 37.0, 59.7 (2С), 103.7
м.д.: 0.81 т [3Н, (CH2)4CH3, J 7.1 Гц], 0.92 д (6Н,
(2С),
144.7
(2С),
168.4
(2С). Масс-спектр, m/z
CH3CHCH3, J 6.7 Гц), 0.93 д (6Н, CH3CHCH3, J
(Iотн, %): 278 (7.18), 253 (17.56), 252 (100.00), 224
6.7 Гц), 1.14-1.39 м [8Н, (СН2)4СН3], 1.27 т (6Н,
(18.43), 196 (27.14), 179 (6.48), 150 (6.94). Найдено,
OCH2CH3, J 7.1 Гц), 1.87-1.95 м (1Н, CH3CHCH3),
%: С 67.51; Н 8.68. C18H29NO4. Вычислено, %: С
2.38 д.д [2H, (CH3)2CHСН2С=, J1 13.5, J2 8.0 Гц],
66.84; Н 9.04.
2.73 д.д [2H, (CH3)2CHСН2С=, J1 13.5, J2 7.1 Гц],
3,3,6,6-Тетраметил-9-пентил-3,4,6,7,9,10-
3.96 т [1Н, CH(CH2)4CH3, J 5.8 Гц], 4.08-4.21 м
гексагидроакридин-1,8(2H,5H)-дион (19). К рас-
(4Н, OCH2CH3), 5.64 уш.c (1Н, NH). Спектр ЯМР
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
СИНТЕЗ НОВЫХ 1,4-ДИГИДРОПИРИДИНОВ
259
13С, δ, м.д.: 13.9, 14.3, 22.2, 22.4, 22.6 (2С), 24.6,
J 5.4 Гц), 3.34 c (3H, OCH3), 3.48-3.57 м (2Н, 2
28.4 (2С), 32.0 (2С), 33.0, 36.5, 41.4 (2С), 59.4 (2С),
СН3СН2О), 3.60-3.69 м (2Н, 2СН3СН2О), 4.68
103.5 (2С), 147.9 (2С), 167.9 (2С). Масс-спектр,
с (2Н, OCH2OCH3), 4.78 т (1Н, OCHO, J 5.4 Гц).
m/z (Iотн, %): 363 (8.13), 362 (5.37), 337 (23.40),
Спектр ЯМР 13С, δ, м.д.: 11.7 (2С), 15.5 (2C), 40.7,
336 (100.00), 308 (6.57), 306 (5.59), 293 (9.51), 280
56.0, 59.3, 62.0 (2C), 96.0, 101.6.
(7.37), 221 (13.21), 43 (4.26). Найдено, %: С 70.91;
К раствору 1.92 г (8.8 ммоль) полученного
Н 10.02. C24H41NO4. Вычислено, %: С 70.72; Н
ранее диэтилацеталя в 48 мл ацетона добавляли
10.14.
0.48 г (1.9 ммоль) ППТС, 19 мл воды и кипяти-
ли в течение 3 ч до полного завершения реак-
Этил
2,7,7-триметил-5-оксо-4-пентил-1,4,5,-
ции (контроль по ТСХ). После удаления ацетона
6,7,8-гексагидрохинолин-3-карбоксилат
(21).
при пониженном давлении, остаток разбавляли
Выход 0.40 г (85%). ИК спектр, ν, см-1: 3277 сл
70 мл CHCl3, промывали насыщенным водным
(N-Н), 3240 сл (N-Н), 1696 с (С=О), 1600 ср
раствором NaHCO3 (35 мл) и сушили Na2SO4.
(N-Н), 1480 с (С-О), 1384 с (С-О), 1273 с (С-О),
После удаления растворителя при пониженном
1215 с (С-О), 1146 с (С-О), 1100 с (С-О). Спектр
давлении продукт выделяли колоночной хрома-
ЯМР 1H, δ, м.д.: 0.74 т [3Н, (CH2)4CH3, J 7.1 Гц],
тографией (элюент - смесь петролейного эфира
1.00 с (3Н, ССН3), 1.08 с (3Н, ССН3), 1.20 т (3Н,
и EtOAc, 40:1). Выход 1.08 г (85%). ИК спектр,
OCH2CH3, J 7.1 Гц), 1.05-1.33 м [8Н, (СН2)4СН3],
ν, см-1: 1709 с (С=О), 1151 с (С-О), 1084 с (С-О),
2.16-2.31 м (4Н, СН2C=O, СН2C=), 2.24 уш.с (3Н,
1031 с (С-О). Спектр ЯМР 1H, δ, м.д.: 0.58-0.67 м
СН3С=), 3.93 т [1Н, CH(CH2)4CH3, J 5.1 Гц], 4.01-
(2Н, CH2циклопроп), 0.93-1.02 м (2Н, CH2циклопроп),
4.15 м (2Н, OCH2CH3), 7.68 уш.c (1Н, NH). Спектр
2.61 с (2Н, ССН2С), 3.29 c (3H, OCH3), 4.66 с (2Н,
ЯМР 13С, δ, м.д.: 13.8, 14.2, 18.0, 22.4, 24.5, 26.7,
OCH2OCH3) 9.85-9.91 м (1Н, СНО). Спектр ЯМР
29.5, 29.8, 31.9, 32.2, 36.2, 40.4, 50.8, 59.3, 104.7,
13С, δ, м.д.: 11.7, 12.2, 50.3, 55.6, 57.9, 96.0, 201.7.
110.3, 144.9, 151.4, 168.0, 196.2. Масс-спектр, m/z
1-(2-Оксоэтил)циклопропилацетат (13). К ох-
(Iотн, %): 263 (18.08), 262 (100.00), 234 (27.84), 178
лажденному до 0°С раствору 17.10 г (98.3 ммоль)
(5.14). Найдено, %: С 72.14; Н 9.26. C20H31NO3.
циклопропанола 22 в 100 мл CH2Cl2 добавляли
Вычислено, %: С 72.04; Н 9.37.
15.5 мл (196.6 ммоль) Py, 0.23 г (1.7 ммоль) DMAP,
1-(2-Оксоэтил)циклопропилметоксиметил
а затем 10.5 мл (147.5 ммоль) AcCl в 20 мл CH2Cl2
(12). К раствору 3.00 г (17.2 ммоль) соединения
и перемешивали 8 ч до полного завершения реак-
22 [44] в 22 мл CH2Cl2 при перемешивании добав-
ции. После обработки водой (100 мл) органиче-
ляли 5.56 г (43 ммоль) i-Pr2NЕt затем по каплям
ский слой отделяли, продукт реакции из водного
раствор 2.1 М (34.8 ммоль) MOMCl в 16.6 мл то-
слоя экстрагировали CH2Cl2 (3×50 мл), объеди-
луола и каталитическое количество Bu4NI. После
ненные органические вытяжки промывали насы-
перемешивания в течение 24 ч до полного завер-
щенным водным раствором NaHCO3 (100 мл) и су-
шения реакции (контроль по ТСХ) реакционную
шили МgSO4. После удаления растворителя оста-
массу обрабатывали насыщенным водным раство-
ток перегоняли при пониженном давлении. Выход
ром NaHCO3 (40 мл). Органический слой отде-
18.05 г (85%), т.кип. 80-85°С при 5-7 мм рт.ст. ИК
ляли, продукт реакции из водного слоя экстраги-
спектр, ν, см-1: 1751 с (С=О), 1228 с (С-О), 1202
ровали CH2Cl2 (3×25 мл), объединенные органи-
с (С-О), 1128 с (С-О), 1063 с (С-О). Спектр ЯМР
ческие вытяжки сушили Na2SO4. После удаления
1H, δ, м.д.: 0.71-0.77 м (2Н, CH2циклопроп), 0.78-
растворителя при пониженном давлении, продукт
0.84 м (2Н, CH2циклопроп), 1.18 т (6Н, 2СН3СН2О, J
выделяли колоночной хроматографией (элюент -
7.1 Гц), 1.96 с (3Н, ОСОСН3), 2.05 д (2Н, СНСН2С,
смесь петролейного эфира и EtOAc, 40:1). Выход
J 5.3 Гц), 3.45-3.52 м (2Н, СН3СН2О), 3.57-3.65
промежуточного соединения 3.23 г (86%). ИК
м (2Н, СН3СН2О), 4.68 т (1Н, OCHO, J 5.3 Гц).
спектр, ν, см-1: 1122 с (С-О), 1075 с (С-О), 1032
Спектр ЯМР 13С, δ, м.д.: 11.6 (2С), 15.3 (2C), 21.3,
38.7, 56.7, 61.3 (2C), 101.2, 170.8.
с (С-О). Спектр ЯМР 1H, δ, м.д.: 0.50-0.55 м (2Н,
CH2циклопроп), 0.79-0.84 м (2Н, CH2циклопроп), 1.19
К раствору 16.00 г (74.1 ммоль) промежуточно-
т (6Н, 2 СН3СН2О, J 7.1 Гц), 1.89 д (2Н, СНСН2С,
го ацетата циклопропанола в 140 мл ацетона до-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
260
МИНЕЕВА и др.
бавляли 3.20 г (12.7 ммоль) ППТС, 3 мл воды и
(2H, CH2циклопроп), 0.64-0.82 м (2H, CH2циклопроп),
кипятили в течение 8 ч до полного завершения ре-
1.06 с (6Н, 2 СН3), 1.09 с (6Н, 2 СН3), 1.65 д (2Н,
акции (контроль по ТСХ). После удаления ацето-
СНСН2С, J 5.4 Гц), 2.17-2.39 м (8Н, 2 СН2C=O и
на при пониженном давлении, остаток разбавляли
2 СН2C=), 3.28 с (3Н, ОCH3), 4.28 т (1Н, СHCH2С,
200 мл CH2Cl2, промывали насыщенным водным
J 5.4 Гц), 4.61 с (2Н, ОСН2ОСН3), 7.17 уш.c (1Н,
раствором NaHCO3 (100 мл) и сушили МgSO4.
NH). Спектр ЯМР 13С, δ, м.д.: 11.9, 25.4 (2С), 28.6
После удаления растворителя остаток перего-
(2С), 28.8 (2С), 32.9, 39.4, 41.4 (2С), 51.3 (2С),
няли при пониженном давлении. Выход 8.94 г
55.8, 58.9, 94.9, 113.0 (2С), 149.9 (2С), 196.2 (2С).
(85%), т.кип. 50-55°С при 5-7 мм рт.ст. ИК
Масс-спектр, m/z (Iотн, %): 342 (8.67), 308 (6.31),
спектр, ν, см-1: 1753 с (С=О), 1733 с (С=О), 1217
286 (8.09), 273 (19.56), 272 (100.00), 271 (25.82),
с (С-О). Спектр ЯМР 1H, δ, м.д.: 0.81-0.85 м (2Н,
256 (14.01), 243 (13.11), 216 (15.74), 215 (77.21),
CH2циклопроп), 0.97-1.01 м (2Н, CH2циклопроп), 1.96
207 (5.47), 188 (5.49), 172 (5.48), 159 (6.61), 144
с (3Н, ОСОСН3), 2.73 с (2Н, ССН2С), 9.81-9.83
(6.46), 131 (9.25), 130 (4.72), 103 (6.18), 91 (4.68),
м (1Н, СНО). Спектр ЯМР 13С, δ, м.д.: 11.4 (2С),
77 (5.26), 55 (5.80), 45 (19.12), 43 (7.74). Найдено,
21.1, 48.6, 54.9, 171.1, 200.2.
%: С 74.14; Н 8.32. C23H33NO4. Вычислено, %: С
71.29; Н 8.58.
Диэтил
4-{[1-(метоксиметокси)циклопро-
пил]метил}-2,6-диметил-1,4-дигидропиридин-
Диэтил 4-[(1-ацетоксициклопропил)метил]-
3,5-дикарбоксилат
(22). Получен по методи-
2,6-диметил-1,4-дигидропиридин-3,5-дикарбок-
ке синтеза эфира 16. Выход 0.61 г (83%) в слу-
силат (24). Получен по методике синтеза эфира 16.
чае катализа CeCl3·7H2O или 0.68 г (92%) в слу-
Выход 0.41 г (56%) в случае катализа CeCl3·7H2O
или 0.55 г (75%) в случае катализа EuCl3·6H2O. ИК
чае катализа EuCl3·6H2O. ИК спектр, ν, см-1:
1718 с (С=О), 1220 с (С-О), 1102 с (С-О), 1035 с
спектр, ν, см-1: 3357 сл (N-Н), 1721 с (С=О), 1684
с (С=О), 1228 с (С-О), 1100 с (С-О). Спектр ЯМР
(С-О). Спектр ЯМР 1H, δ, м.д.: 0.33-0.37 м (2Н,
1H, δ, м.д.: 0.58-0.63 м (2Н, CH2циклопроп), 0.68-
CH2циклопроп), 0.70-0.74 м (2Н, CH2циклопроп), 1.29
0.73 м (2Н, CH2циклопроп), 1.28 т (6Н, 2 CH3CH2O, J
т (6Н, CH3CH2O, J 7.1 Гц), 1.48 д (2Н, СНСН2С,
7.1 Гц), 1.66 д (2Н, СНСН2С, J 6.5 Гц), 1.92 c (3Н,
J 6.6 Гц), 2.26 с (6H, CH3C=), 3.31 с (3H, ОCH3),
ОСОСН3), 2.25 c (6Н, 2 CH3C=), 4.11-4.21 м (5Н,
4.12-4.20 м (4Н, OCH2CH3), 4.27 т (1Н, СHCH2С,
СHCH2С и 2OCH2CH3), 5.95 уш.c (1Н, NH). Спектр
J 6.6 Гц) 4.65 с (2Н, ОСН2ОСН3), 5.72 уш.c (1Н,
ЯМР 13С, δ, м.д.: 12.3 (2С), 14.5 (2С), 19.4 (2С),
NH). Спектр ЯМР 13С, δ, м.д.: 12.2 (2С), 14.5 (2С),
21.6, 31.5, 40.0, 58.4, 59.8 (2С), 103.0 (2С), 145.3
19.3 (2С), 31.6, 40.8, 55.9, 58.4, 59.7 (2С), 94.7,
(2С), 167.9 (2С), 171.4. Масс-спектр, m/z (Iотн, %):
103.5 (2С), 144.7 (2С), 168.1 (2С). Масс-спектр,
253 (14.77), 252 (100.00), 251 (10.11), 224 (14.58),
m/z (Iотн, %): 253 (14.68), 252 (100.00), 251 (19.14),
206 (23.96), 205 (6.66), 196 (24.10), 195 (4.27), 179
224 (13.31), 207 (6.87), 206 (45.43), 205 (12.58), 196
(8.34), 178 (13.63), 151 (7.99), 106 (6.36), 150 (9.98),
(23.69), 195 (8.07), 179 (12.15), 178 (23.74), 177
77 (4.89), 43 (14.26). Найдено, %: С 64.76; Н 7.34.
(7.80), 151 (12.42), 150 (14.18), 106 (9.40), 79 (6.07),
C19H27NO6. Вычислено, %: С 62.45; Н 7.45.
77 (8.33), 63 (5.85), 45 (24.77), 43 (6.76). Найдено,
%: С 63.97; Н 7.80. C19H29NO6. Вычислено, %: С
ЗАКЛЮЧЕНИЕ
62.11; Н 7.96.
Впервые было найдено, что ЕuCl3·6H2O ката-
9-{[1-(Метоксиметокси)циклопропил]ме-
лизирует мультикомпонентную реакцию Ганча
тил}-3,3,6,6-тетраметил-3,4,6,7,9,10-гексаги-
с высокими выходами в случае применения али-
дроакридин-1,8(2H,5H)-дион (23). Получен по
фатических альдегидов, в том числе содержа-
методике синтеза эфира 19. Выход 0.27 г (35%)
щих β-гидроксициклопропанольный фрагмент.
в случае катализа CeCl3·7H2O или 0.38 г (49%) в
Установлено, что соли переходных металлов де-
случае катализа EuCl3·6H2O. ИК спектр, ν, см-1:
монстрируют средние и высокие выходы реакции
3276 сл (N-Н), 3197 сл (N-Н), 1696 с (С=О), 1601
Ганча в случае применения алифатических аль-
ср (N-Н), 1480 с (С-О), 1378 с (С-О), 1227 с (С-О),
дегидов. В ходе проведенной исследовательской
1141 (С-О). Спектр ЯМР 1H, δ, м.д.: 0.26-0.44 м
работы получены новые уникальные 1,4-дигидро-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
СИНТЕЗ НОВЫХ 1,4-ДИГИДРОПИРИДИНОВ
261
пиридины. Впервые проведенный докинг синте-
8.
Suresh T., Swamy S.K., Reddy V.M. Ind. J. Chem.
зированных дигидропиридинов в отношении про-
2007, 46, 115-121.
теин киназ и цитохромов P450 человека показал,
9.
Bahekar S., Shinde D. Acta pharm. 2002, 52, 281-287.
что соединения 19 и 23 обладают потенциалом для
10.
Ogawa A.K., Willoughby C.A., Bergeron R., Ells-
дальнейшего экспериментального тестирования,
worth K.P., Geissler W.M., Myers R.W., Chapman K.T.
так как в большинстве случаев они показали in
Bioorg. Med. Chem. Lett. 2003, 13, 3405-3408. doi
silico аффинность к этим белками-мишеням, сопо-
10.1016/S0960-894X(03)00798-4
ставимую или большую, чем известное соедине-
11.
Triggle D.J. Biochem Pharmacol. 2007, 74, 1-9. doi
ние-лидер [50].
10.1016/j.bcp.2007.01.016
ФОНДОВАЯ ПОДДЕРЖКА
12.
Budriesi R., Ioan P., Locatelli A. J. Med. Chem. 2008,
51, 1592-1600. doi 10.1021/jm070681+
Расчетно-теоретическая часть работы выполне-
13.
Tusell J.M., Barron S., Seratosa J. Brain Res. 1993,
на при поддержке задания ГПНИ № г.р. 20210560.
622, 99-104. doi 10.1016/0006-8993(93)90807-Y
ИНФОРМАЦИЯ ОБ АВТОРАХ
14.
Gullapalli S., Ramarao P. Neuropharmacology. 2002,
Минеева Ирина Владимировна, ORCID: http://
42, 467-475. doi 10.1016/S0028-3908(01)00200-3
orcid.org/0000-0002-6422-1967
15.
Sunkel C.E, De casa Juana M.F., Santos. L. J. Med.
Chem. 1990, 33, 3205-3210. doi 10.1021/jm00174a017
Фалетров Ярослав Вячеславович, ORCID:
16.
Singh K., Arora D., Singh S. Mini-Rev. Med. Chem.
2009, 9, 95-106. doi 10.2174/138955709787001686
Старовойтова
Виктория Александровна,
17.
Swarnalatha G., Prasanthi G., Sirisha N., Madhusudha-
na Chetty C. Int. J. Chem. Tech. Res. 2011, 3, 75-89.
Шкуматов Владимир Макарович, ORCID: http://
18.
Drapak I., Perekhoda L., Tsapko T., Berezniakova N.,
orcid.org/0000-0003-1652-5701
Tsapkoc Y. J. Heterocycl. Chem. 2017, 54, 2117-2128.
doi 10.1002/jhet.2837
КОНФЛИКТ ИНТЕРЕСОВ
19.
Simon C., Constantieux T., Rodriguez J. Eur. J.
Авторы заявляют об отсутствии конфликта ин-
Org. Chem. 2004, 2004, 4957-4980. doi 10.1002/
тересов.
ejoc.200400511
СПИСОК ЛИТЕРАТУРЫ
20.
Hernández-Borja F., Contreras L., López J., Alcaraz Y.,
Cruz D., Estrada-Soto S., Delgado F., Vázquez M.A.
1. Shan R., Velazquez C., Knaus E.E. J. Med. Chem.
Synthesis. 2018, 53, 1020-1026. doi 10.1055/s-0036-
2004, 47, 254-261. doi 10.1021/jm030333h
1591730
2. Kharkar P.S., Desai B., Gaveria H., Varu B., Loriya R.,
Naliapara Y., Kulkarni V.M. J. Med. Chem. 2002, 45,
21.
Zarghi A., Sadeghi H., Fassihi A., Faizi M., Shafiee A.
4858-4867. doi 10.1021/jm020217z
Farmaco. 2003, 58, 1077-1081. doi 10.1016/S0014-
827X(03)00159-9
3. Lentz F., Reiling N., Martins A., Molnár J., Hil-
geroth A. Molecules. 2018, 23, 825. doi 10.3390/
22.
Tasaka S., Ohmori H., Gomi N., Iino, Mayumi M.T.,
molecules23040825
Kiue A., Naito S., Kuwano M. Bioorg. Med. Chem.
Lett.
2001,
11,
275-277. doi
10.1016/S0960-
4. Tsuruo T., Iida H., Nojiri M., Tsukagoshi S., Sakurai Y.
894X(00)00651-X
Cancer Res. 1983, 43, 2905-2910.
23.
Dondoni A., Massi A., Minghini E., Bertolasi V.
5. Poindexter G.S., Bruce M.A., Breitenbucher J.G.,
Helv. Chim. Acta. 2002, 85, 3331-3348. doi 10.1002/
Higgins M.A., Sit S.Y., Romine J.L., Russell J.
Bioorg. Med. Chem. 2004, 12, 507-521. doi 10.1016/
1522-2675(200210)85:10<3331::AID-HLCA3331>
j.bmc.2003.10.016
3.0.CO;2-X
6. Sircar I., Gregor E.K., Anderson K.R., Stephen J.H.,
24.
Dondoni A., Massi A., Minghini E., Sabbatini S.,
Taylor M.D. J. Med. Chem. 1991, 34, 2248-2260. doi
Bertolasi V. J. Org. Chem. 2003, 68, 6172-6183. doi
10.1021/jm00111a047
10.1021/jo0342830
7. Isaac O.D., Zhou X., Schmidt J., Krishna C.A., Kisho-
25.
Wang L.-M., Sheng J., Zhang L., Han J.-W., Fan Z.-Y.,
re V. Bioorg. Med. Chem. 1998, 6, 563-568. doi
Tiana H., Qianb C.-T. Tetrahedron. 2005, 61, 1539-
10.1016/S0968-0896(98)00017-0
1543. doi 10.1016/j.tet.2004.11.079
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
262
МИНЕЕВА и др.
26.
Sunkel C.E., de Casa-Juana M.F., Santos L., Gó-
44.
Минеева И.В., Кулинкович О.Г. ЖOрХ. 2008, 44,
mez M.M., Villarroya M., González-Morales M.A.,
1277-1282. [Mineeva I.V., Kulinkovich O.G. Russ.
Priego J.G., Ortega M.P. J. Med. Chem. 1990, 33,
J. Org. Chem. 2008, 44, 1261-1266.] doi 10.1134/
3205-3210. doi 10.1021/jm00174a017
S1070428008090029
27.
Michiel van Rhee A., Jiang J., Melman N., Olah M.E.,
45.
Lomize A.L., Pogozheva I.D., Mosberg H.I. J. Chem.
Stiles G.L., Jacobson K.A. J. Med. Chem. 1996, 39,
Inf. Model. 2011, 51, 930-946. doi 10.1021/ci200020k
2980-2989. doi 10.1021/jm9600205
46.
Pinz L., Rastelli G. Int. J. Mol. Sci. 2019, 20, 4331. doi
28.
Amgoth S.N., Porika M., Abbagani S., Garlapati A.,
10.3390/ijms20184331
Vanga M.R. Med. Chem. Res. 2012, 22, 147-155. doi
47.
Dalal J., Mohan J.C., Iyengar S.S., Hiremath J.,
10.1007/s00044-012-9994-0
Sathyamurthy I., Bansal S., Dasbiswas A. Int. J.
29.
Niaz H., Kashtoh H., Khan J.A.J., Khan A., Wahab A.,
Hypertension. 2018, 2018, 1-18. ID 8681792. doi
Alam M.T., Khan K.M., Perveen S., Choudhary M.I.
10.1155/2018/8681792
Eur. J. Med. Chem. 2015, 95, 199-209. doi 10.1016/
j.ejmech.2015.03.018
48.
Viradiya D., Mirza S., Shaikh F., Kakadiya R., Ra-
thod A., Jain N., Rawal R., Shah A. Anti-Cancer Agents
30.
Prasanthi G., Prasad K.V.S.R.G., Bharathi K. Eur.
Med. Chem. 2017, 17, 1003-1013. doi 10.2174/187152
J. Med. Chem.
2014,
73,
97-104 doi
10.1016/
0616666161206143251
j.ejmech.2013.12.001
31.
Tanabe H., Tasaka S., Ohmori H., Gomi N., Sasaki Y.,
49.
Mollazadeh S., Shamsara J., Iman M., Hadizadeh F.
Machida T., Iino M., Kiue A., Naito S., Kuwano M.
Recent Pat. Anti-Cancer Drug Discov. 2017, 12, 174-
Bioorg. Med. Chem. 1998, 6, 2219-2227. doi 10.1016/
185. doi 10.2174/1574892812666170126162521
S0968-0896(98)00170-9
50.
Sidhom P.A, El-Bastawissy E., Salama A.A., El-
32.
Choi S.-J., Cho J.-H., Im I., Lee S.-D., Jang J.-Y.,
Moselhy T.F. Bioorg. Chem. 2021, 114, 105054. doi
Oh Y.-M., Jung Y.-K., Jeon E.-S., Kim Y.-C. Eur.
10.1016/j.bioorg.2021.10505410
J. Med. Chem. 2010, 45, 2578-2590. doi 10.1016/
51.
De Donato M., Righino B., Filippetti F., Battaglia A.,
j.ejmech.2010.02.046
Petrillo M., Pirolli D., Gallo D. Sci. Rep. 2018, 8, 1-13.
33.
Salaun J., Bairtr M. Curr. Med. Chem. 1995, 2, 511-
doi 10.1038/s41598-018-34471-y
542.
52.
Mohamed M.F., Ibrahim N.S., Elwahy A.H.M.,
34.
Salaun J. Topic Curr. Chem. 2000, 207, 2-57.
Abdelhamid I.A. Curr. Med. Chem. Anti-Cancer
35.
Ganesh V., Chandrasekaran S. Synthesis. 2016, 48,
Agents. 2018, 18, 2156-2168. doi 10.2174/18715206
4347-4380. doi 10.1055/s-0035-1562530
18666181019095007
36.
Lamberth C. Tetrahedron. 2019, 75, 4365-4383 doi
53.
Sohl C.D, Cheng Q., Guengerich F.P. Nat. Protocols.
10.1016/j.tet.2019.06.043
2009, 4, 1252-1257. doi 10.1038/nprot.2009.122
37.
Tamaddon F., Razmi Z., Jafari A.A. Tetrahedron Lett.
54.
Ikemura N., Yamaori S., Kobayashi C., Kamijo S.,
2010, 51, 1187-1189. doi 10.1016/j.tetlet.2009.12.098
Murayama N., Yamazaki H., Ohmori S. Chem.-Biol.
38.
Salehi H., Guo Q.-X. Synth. Comm. 2004, 34, 4349-
Interac. 2019, 306, 1-9. doi 10.1016/j.cbi.2019.04.005
4357. doi 10.1081/SCC-200039409
55.
Фалетров Я.В., Гилеп К.А., Фальчевская А.С., Хо-
39.
Akbari J.D., Tala S.D., Dhaduk M.F., Joshi H.S. Arkivoc.
рецкий М.С., Панада Я.В., Андриевская Е.В., Ру-
2008, xii, 126-135. doi 10.3998/ark.5550190.0009.c15
дая Е.В., Фролова Н.С., Бжостек А., Плоцинска Р.,
40.
Yadav D.K., Patel R., Srivastava V.P., Watal G.,
Шкуматов В.М. Биомед. хим. 2020, 66, 378-385. doi
Yadav L.D.S. Chin. J. Chem. 2011, 29, 118-122. doi
10.18097/PBMC20206605378
10.1002/cjoc.201190036
56.
Trott O., Olson A.J. J. Comput. Chem. 2010, 31, 455-
41.
Paraskar A.S., Dewkar G.K., Sudalai A. Tetrahedron
461. doi 10.1002/jcc.21334
Lett.
2003,
44,
3305-3308, doi
10.1016/S0040-
57.
Новикова Л.А., Фалетров Я.В., Ковалева И.Е., Ма-
4039(03)00619-1
уерсбергер Ш., Лузиков В.Н., Шкуматов В.М. Усп.
42.
De S.K., Gibbs R.A., Donelson J.L. J. Mol. Catal.
биол. хим. 2009, 49, 159-208.
A Chem.
2006,
256,
309-312. doi
10.1016/
j.molcata.2006.03.079
58.
Petrov A.M., Pikuleva I.A. Neurotherapeutics. 2019,
16, 635-648. doi 10.1007/s13311-019-00731-6
43.
Sabitha G., Arundhathi K. Sudhakar K., Sastry B.S.,
Yadav J.S. Synth. Comm. 2009, 39, 433-442. doi
59.
Zhuo X., Wang Y.Z., Yeung K.S., Zhu J., Huang X.S.,
10.1080/00397910802378399
Parcella K.E., Eastman K.J., Kadow J.F., Mean-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
СИНТЕЗ НОВЫХ 1,4-ДИГИДРОПИРИДИНОВ
263
well N.A., Shu Y.Z., Johnson B.M. Xenobiotica. 2018,
62. van Leeuwen J.S., Vermeulen N.P.E., Vos J.C.
48, 1215-1226. doi 10.1080/00498254.2017.1409915
Curr. Drug Metab.
2012,
13,
1464-1475. doi
10.2174/138920012803762783
60. Katoh M., Nakajima M., Shimada N., Yamazaki H.,
Yokoi T. Eur. J. Clin. Pharmacol. 2000, 55, 843-852.
63. Sanner M.F. J. Mol. Graphics Mod. 1999, 17, 57-61.
doi 10.1007/s002280050706
64. Waché Y., Aguedo M., Choquet A., Gatfield I.L., Ni-
61. Rodriguez C., Shinyashiki M., Froines J., Yu R.C.,
caud J.-M., Belin J.-M. Appl. Environ. Microbiol.
Fukuto J.M., Cho A.K. Toxicology. 2004, 201, 185-
2001, 67, 5700-5704. doi 10.1128/AEM.67.12.5700-
196. doi 10.1016/j.tox.2004.04.016
5704.2001
Synthesis of New 1,4-Dihydropyridines: Optimization
of Synthesis Conditions and in silico Analysis
of the Bioactivity of the Obtained Compounds
I. V. Mineyevaa, *, Y. V. Faletrova, b, V. A. Starovoytovaa, b, and V. M Shkumatova, b
a Belarusian State University, prosp. Nezavisimosti, 4, Minsk, 220030 Belarus
b Research Institute for Physical-Chemical Problems, Belarusian State University,
ul. Leningradskaya, 14, Minsk, 220030 Belarus
*e-mail: i.mineyeva@yandex.ru
Received July 30, 2021; revised August 10, 2021; accepted August 14, 2021
For the first time, an efficient method was developed for the preparation of 1,4-dihydropyridines containing the
remainder of aliphatic and β-hydroxycyclopropane aldehydes using europium chloride hexahydrate as a catalyst
for the multicomponent Hantsch reaction. The biological properties of the obtained compounds were assessed by
modeling the permeability through the phospholipid bilayer and molecular docking for human protein kinases
and cytochromes P450. Experiments on the effect of 1,4-dihydropyridines on the growth of the yeast Yarrowia
lipolytica and Saccharomyces cerevisiae showed the absence of acute toxicity in the tested compounds.
Keywords: multicomponent reactions, 1,4-dihydropyridines, Hantsch ethers, aliphatic and β-hydroxycyclopro-
pane aldehydes, europium chloride, cerium chloride, docking, in silico analysis
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022