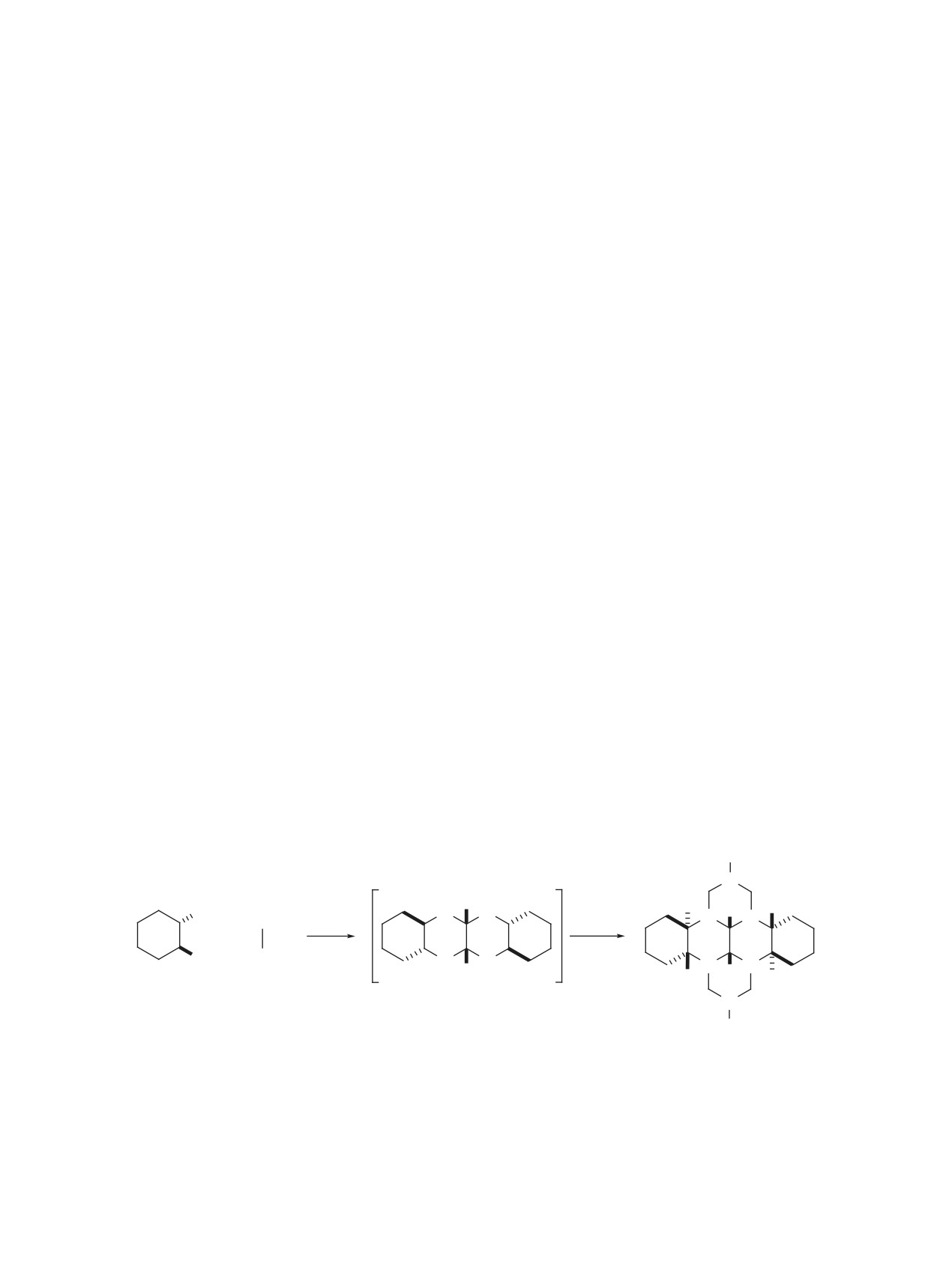ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 3, с. 311-316
УДК 547.87
ОДНОРЕАКТОРНЫЙ СИНТЕЗ
2,9-ДИ(ГАЛОГЕНФЕНИЛ)ЗАМЕЩЕННЫХ ПЕРГИДРО-
ГЕКСААЗАДИБЕНЗОТЕТРАЦЕНОВ
© 2022 г. Е. Б. Рахимова*, В. Ю. Кирсанов,
А. Г. Ибрагимов
Институт нефтехимии и катализа - обособленное структурное подразделение
ФГБНУ «Уфимского федерального исследовательского центра Российской академии наук» (ИНК УФИЦ РАН),
Россия, 450075 Уфа, просп. Октября, 141
*е-mail: rakhimovaelena@mail.ru
Поступила в редакцию 07.09.2021 г.
После доработки 20.09.2021 г.
Принята к публикации 24.09.2021 г.
Разработан однореакторный метод синтеза 2,9-ди(галогенфенил)замещенных (3bR*,7aR*,10bR*,-
14aR*-цис-14c,14d)-октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетраценов реакцией
мультикомпонентной конденсации транс-1,6,7,12-тетраазапергидротетрацена с формальдегидом и га-
логенанилинами под действием катализатора YbCl3·6H2O.
Ключевые слова: катализ, гетероциклизация, формальдегид, галогенанилины, полициклы
DOI: 10.31857/S0514749222030090
ВВЕДЕНИЕ
чительной особенностью синтеза на основе
(±)-транс-1,2-диаминоциклогексана является воз-
Синтез N,N'-дизамещенного гексаазапергидро-
можность получения пергидротетраценов с хи-
дибензотетрацена без обсуждения его стерео-
ральными центрами при атомах углерода C3b,
конфигурации осуществлен циклоконденсацией
C7a, C10b, C14a с относительной конфигурацией
4-аминопиперидина, параформа и тетраазапер-
R*,R*,R*,R* и с цис-сочлением пиперазиновых ко-
гидротетрацена в присутствии сильнокисло-
лец по связи C14c-С14d. В связи с тем, что соедине-
го катионита Lewatit [1]. Диалкилзамещенные
ния, содержащие в своей структуре транс-1,2-ди-
(3bS*,7aR*,10bR*,14aS*)-пергидро-2,3а,7b,9,10a,-
аминоциклогексановый фрагмент, обладают про-
14b-гексаазадибензотетрацены [2] были получе-
тивоопухолевой активностью [4-9] и антипроли-
ны взаимодействием N,N-бис(метоксиметил)-N-
феративным действием [10], целью данной работы
алкиламинов с цис-тетраазапергидротетраценом
стал синтез новых потенциально биологически
под действием катализатора на основе Sm (III)
активных аннелированных полиазаполициклов
или реакцией рециклизации
1,3,5-трициклоал-
пергидротетраценового ряда.
кил-1,3,5-триазинанов с цис-тетраазапергидро-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
тетраценом с участием в качестве катализатора
хлорида никеля (II). Позднее [3, 4] разработан
С учетом ранее полученных результатов
способ однореакторного конструирования N,N'-
в области синтеза дизамещенных (3bR*,7aR*,-
дизамещенных пергидро-2,3а,7b,9,10a,14b-гексаа-
10bR*,14aR*)-пергидро-2,3а,7b,9,10a,14b-гекса-
задибензотетраценов на основе транс-1,6,7,12-те-
азадибензотетраценов [3, 4] мы предположили
траазапергидротетрацена, полученного из
(±)-
возможность однореакторной каталитической
транс-1,2-диаминоциклогексана как эффектив-
конденсации транс-1,6,7,12-тетраазапергидроте-
ного исходного «строительного» субстрата. Отли-
трацена с формальдегидом и галогенанилинами.
311
312
РАХИМОВА и др.
В предварительных экспериментах нами уста-
С целью расширения круга соединений, спо-
новлено, что в отсутствие катализатора реакция
собных вступать в мультикомпонентную ре-
транс-1,6,7,12-тетраазапергидротетрацена
(1) с
акцию конденсации, мы изучили возможность
формальдегидом и о-хлоранилином в мольном
синтеза дибром(фтор)фенилзамещенных пер-
соотношении
1:4:2, соответственно, в услови-
гидро-2,3а,7b,9,10a,14b-гексаазадибензотетра-
ях (MeOH, 20°С, 3 ч) приводит к селективно-
ценов. В оптимальных условиях
(5 мол
%
му образованию
(3bR*,7aR*,10bR*,14aR*-цис-
YbCl3·6Н2О,
20°С,
3 ч, растворитель MeOH)
14c,14d)-2,9-бис(2-хлорфенил)октадекагидро-
транс-1,6,7,12-тетраазапергидротетрацен (1) вза-
1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]-
имодействует с формальдегидом и галогенанили-
тетрацена (2) с выходом не более 20%. Для по-
нами (о-BrC6H4NH2, м-BrC6H4NH2, п-BrC6H4NH2,
вышения выхода целевого полиазаполицикла 2
о-FC6H4NH2, м-FC6H4NH2, п-FC6H4NH2) с селек-
мультикомпонентную конденсацию осуществили
тивным образованием
(3bR*,7aR*,10bR*,14aR*-
под действием катализатора на основе итербия,
цис-14c,14d)-2,9-бис(галогенфенил)октадека
использованного нами ранее в подобных реакциях
гидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо-
гетероциклизации [3, 11]. На примере модельной
[fg,op]тетраценов
(5-10) с выходами
40-76%
реакции транс-1,6,7,12-тетраазапергидротетра-
(схема 1). Следует отметить, что п-галогенанили-
цена (1) с формальдегидом и о-хлоранилином мы
ны (п-ClC6H4NH2, п-BrC6H4NH2, п-FC6H4NH2) яв-
установили, что при использовании 5 мол % ката-
ляются более эффективными аминосубстратами в
лизатора YbCl3·6H2O выход продукта 2 достигает
разработанных условиях мультикомпонентной ре-
61% (схема 1).
акции конденсации и позволяют получать перги-
Повышение концентрации катализатора
дро-2,3а,7b,9,10a,14b-гексаазадибензотетрацены с
YbCl3·6H2O до 10 мол % не приводило к суще-
относительно высокими выходами 69-76%.
ственному увеличению выхода целевого гете-
Вероятный маршрут формирования перги-
роцикла. Выбор MeOH в качестве реакционной
дро-2,3а,7b,9,10a,14b-гексаазадибензотетраценов
среды обусловлен хорошей растворимостью в
нем исходных реагентов. Аналогичный резуль-
включает стадию образования промежуточного
тат получили при замене о-хлорфенильного
тетракис(гидроксиметил)производного [3, 12] как
остатка у атома азота в исходном галогенанили-
продукта взаимодействия транс-1,6,7,12-тетрааза-
не на м- и п-хлорфенильные заместители, при
пергидротетрацена с формальдегидом. Возможно,
этом выход
(3bR*,7aR*,10bR*,14aR*)-пергидро-
в результате координации YbCl3∙6H2O как жесткой
2,3а,7b,9,10a,14b-гексаазадибензотетраценов 3 и 4
кислоты Льюиса с атомом кислорода промежуточ-
составил 49 и 71% соответственно.
ного продукта происходит образование карбокати-
Схема 1
R
2
N
1
3
H
H
H
14
H
H
3a
H
4
NH2
N
N
CHO
N N
i
ii
13
5
14b
14c
2
+
14aR*
3bR*
–4H2O
14d
7aR*
12
10bR*
10a
6
CHO
NH2
N
N
N N
H
H
H
11
H H
7b
H
7
10
8
(±)-trans
1
N
9
+ 4CH2O + 2R-NH2
R
2-10
Реагенты и условия: i, MeOH, 70°C, 3 ч; ii, 5 мол % YbCl3·6H2O, MeOH, 20°C, 3 ч.
2, R = 2-хлорфенил (61%); 3, R = 3-хлорфенил (49%); 4, R = 4-хлорфенил (71%);
5, R = 2-бромфенил (62%); 6, R = 3-бромфенил (40%); 7, R = 4-бромфенил (76%);
8, R = 2-фторфенил (52%); 9, R = 3-фторфенил (46%); 10, R = 4-фторфенил (69%).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
ОДНОРЕАКТОРНЫЙ СИНТЕЗ
313
она. Последующее нуклеофильное присоединение
м.д.: 0.71 уш.с (2Н, СН2, Н4,11), 0.87 д (2Н, СН2,
галогенанилина к карбокатиону приводит к целе-
Н7,14, 2Jab 10.5 Гц), 1.15-1.21 м (4Н, СН2, Н5,6,12,13),
вым аннелированным полиазаполициклам.
1.52-1.74 м
(6Н, СН2, Нb4,5,7,11,12,14; 2Н, СН,
Н7a,14a), 2.08 уш.с (2Н, СН2, Нb6,13), 3.31 уш.с (2Н,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
СН, Н3b,10b), 3.46 д (2Н, СН2, Н1,8, 2Jab 10.5 Гц),
Одномерные спектры ЯМР 1Н и 13С, а также
3.59 уш.с (2Н, СН, Н14c,14d), 4.03 д (2Н, СН2, Н3,10,
двумерные гомо- (COSY) и гетероядерные (HSQC,
2Jab 13.5 Гц), 4.78 д (2Н, СН2, Нb1,8, 2Jba 9.5 Гц),
HMBC) спектры регистрировали на спектроме-
4.95 д (2Н, СН2, Нb3,10; 2Jba 13.0 Гц), 6.94 уш.с (2Н,
тре Bruker Avance 500 (500.17 МГц для ядер 1Н,
СН, Н4',4''), 7.22-7.32 м (4Н, СН, Н3',3'',5',5''), 7.71
125.78 МГц для ядер 13С) или Bruker Avance 400
уш.с (2Н, СН, Н6',6''). Спектр ЯМР 13С (CDCl3),
(400.13 МГц для ядер 1Н, 100.62 МГц для ядер
δ, м.д.: 24.3 (C4,11), 24.5 (C5,12), 27.3 (C6,13), 28.0
13С) в CDCl3 по стандартным методикам фирмы
(С7,14), 55.9 (C3b,10b), 63.3 (C7a,14a), 64.9 (C3,10),
Bruker, внутренний стандарт ТМС. Масс-спектры
71.4 (C1,8), 77.9 (C14c,14d), 121.7 (C6',6''),
123.3
высокого разрешения (HRMS) записаны на при-
(C4',4''), 127.1 (C2',2''), 127.6 (C3',3''), 130.2 (C5',5''),
боре («MaXis impact», Bruker) с использованием
147.7 (C1',1''). Масс-спектр (HRMS), m/z: 553.2605
масс-анализатора (TOF) с ионизацией электрорас-
[M + H]+. C30H39Cl2N6. M 553.2613. Масс-спектр
пылением (ESI). Температуру плавления опреде-
(HRMS), m/z: 575.2435 [M + Na]+. C30H38Cl2N6Na.
ляли на приборе РНМК 80/2617. Использованные
M 575.2433.
в работе реактивы приобретены в компаниях
(3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-
Sigma-Aldrich и Acros Organics.
Бис(3-хлорфенил)октадекагидро-1Н,8Н-
Мультикомпонентная конденсация транс-
2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетра-
1,6,7,12-тетраазапергидротетрацена с форма-
цен (3). Выход 0.27 г (49%), т.пл. 312-314°С, элю-
льдегидом и галогенанилинами (общая мето-
ент - метанол, Rf 0.61. Спектр ЯМР 1H (CDCl3),
дика). В круглодонную колбу, установленную на
δ, м.д.: 0.91-0.98 м (4Н, СН2, Н4,7,11,14), 1.18-1.29
магнитной мешалке, помещали
(±)-транс-ци-
м (4Н, СН2, Н5,6,12,13), 1.63 д (2Н, СН2, Нb4,11, 2Jba
клогексан-1,2-диамин (0.23 г, 2.00 ммоль) в 5 мл
12.0 Гц), 1.73 д (2Н, СН2, Нb5,12, 2Jba 13.0 Гц), 1.80-
МеОН и 40%-ный водный раствор глиоксаля
1.84 м (2Н, СН, Н7a,14a), 1.94 д (2Н, СН2, Нb7,14,
(0.14 г, 1.00 ммоль) в 5 мл МеОН. Смесь переме-
2Jba 9.5 Гц), 2.11 д (2Н, СН2, Нb6,13, 2Jba 10.5 Гц),
шивали при 70°C в течение 3 ч и охлаждали. Затем
3.09-3.13 м (2Н, СН, Н3b,10b), 3.27 д (2Н, СН2,
к транс-1,6,7,12-тетраазапергидротетрацену (1),
Н1,8; 2Jab 10.0 Гц), 3.52 уш.с (2Н, СН, Н14c,14d), 3.94
полученному in situ, добавляли 37%-ный водный
д (2Н, СН2, Н3,10, 2Jab 13.0 Гц), 4.86-4.91 д (4Н,
раствор формальдегида (0.45 мл, 4.00 ммоль) в
СН2, Нb1,3,8,10), 6.83 д (2Н, СН, Н6',6'', 3J 8.0 Гц),
5 мл МеОН и 0.019 г (0.05 ммоль) YbCl3·6H2O.
6.90 д.д (2Н, СН, Н5',5'', 3J 8.0, 8.0 Гц), 6.97 уш.с
Смесь перемешивали 30 мин при комнатной тем-
(2Н, СН, Н2',2''), 7.17 т (2Н, СН, Н4',4'', 3J 8.0 Гц).
пературе (~ 20°C) и добавляли соответствую-
Спектр ЯМР 13С (CDCl3), δ, м.д.: 24.1 (C4,11), 24.5
щий галогенанилин (2.00 ммоль) в 5 мл МеОН.
(C5,12), 27.1 (C6,13), 28.6 (С7,14), 55.1 (C3b,10b), 63.5
Реакционную смесь перемешивали при комнатной
(C7a,14a), 66.3 (C3,10), 69.4 (C1,8), 77.8 (C14c,14d),
температуре в течение 2.5 ч и концентрировали.
115.3 (C5',5''), 117.0 (C2',2''), 120.0 (C6',6''),
130.0
Образующиеся осадки отфильтровывали, дважды
(C4',4''), 134.7 (C3',3''), 150.8 (C1',1''). Масс-спектр
промывали метанолом (2×10 мл) и получали ин-
(HRMS), m/z: 553.2578 [M + H]+. C30H39Cl2N6.
дивидуальные соединения 2-10 в виде порошко-
M 553.2613. Масс-спектр (HRMS), m/z: 575.2437
образных веществ.
[M + Na]+. C30H38Cl2N6Na. M 575.2433.
(3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-
(3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-
Бис(2-хлорфенил)октадекагидро-1Н,8Н-
Бис(4-хлорфенил)октадекагидро-1Н,8Н-
2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетра-
2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетра-
цен (2). Выход 0.34 г (61%), т.пл. 310-312°С, элю-
цен (4). Выход 0.39 г (71%), т.пл. 316-318°С, элю-
ент - метанол, Rf 0.60. Спектр ЯМР 1H (CDCl3), δ,
ент - метанол, Rf 0.61. Спектр ЯМР 1H (CDCl3),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
314
РАХИМОВА и др.
δ, м.д.: 0.87-0.96 м (4Н, СН2, Н4,7,11,14), 1.17-1.26
СН2, Н5,6,12,13), 1.64-1.93 м (6Н, СН2, Нb4,5,7,11,12,14,
м (4Н, СН2, Н5,6,12,13), 1.61 д (2Н, СН2, Нb4,11, 2Jba
2Н, СН, Н7a,14a), 2.11 уш.с (2Н, СН2, Нb6,13), 3.12
10.8 Гц), 1.72 д (2Н, СН2, Нb5,12, 2Jba 11.6 Гц), 1.78-
уш.с (2Н, СН, Н3b,10b), 3.25-3.33 м (2Н, СН2, Н1,8),
1.82 м (2Н, СН, Н7a,14a), 1.90 д (2Н, СН2, Нb7,14, 2Jba
3.51 уш.с (2Н, СН, Н14c,14d), 3.91-3.95 м (2Н, СН2,
9.2 Гц), 2.11 д (2Н, СН2, Нb6,13, 2Jba 9.6 Гц), 3.09-
Н3,10), 4.87-4.90 м (4Н, СН2, Нb1,3,8,10), 6.94-7.11
3.13 м (2Н, СН, Н3b,10b), 3.28 д (2Н, СН2, Н1,8, 2Jab
м (8Н, СН, Н2',2'',4',4'',5',5'',6',6''). Спектр ЯМР 13С
10.8 Гц), 3.51 уш.с (2Н, СН, Н14c,14d), 3.93 д (2Н,
(CDCl3), δ, м.д.: 24.1 (C4,11), 24.5 (C5,12),
27.1
СН2, Н3,10, 2Jab 13.6 Гц), 4.82-4.87 д (4Н, СН2,
(C6,13), 28.6 (С7,14), 55.1 (C3b,10b), 63.5 (C7a,14a), 66.3
Нb1,3,8,10), 6.95 д (4Н, СН, Н2',2'',6',6'', 3J 8.4 Гц), 7.20
(C3,10), 69.4 (C1,8), 77.8 (C14c,14d), 115.8 (C6',6''), 120.0
д (4Н, СН, Н3',3'',5',5'', 3J 8.8 Гц). Спектр ЯМР 13С
(C4',4''), 123.0 (C2',2''), 130.3 (C5',5''). Масс-спектр
(CDCl3), δ, м.д.: 24.2 (C4,11), 24.5 (C5,12), 27.1 (C6,13),
(HRMS), m/z: 643.1577 [M + H]+. C30H39Br2N6.
28.5 (С7,14), 55.2 (C3b,10b), 63.5 (C7a,14a), 66.5 (C3,10),
M 643.1582. Масс-спектр (HRMS), m/z: 665.1400
69.6 (C1,8), 77.9 (C14c,14d), 118.6 (C2',2'',6',6''), 125.1
[M + Na]+. C30H38Br2N6Na. M 665.1402.
(C4',4''), 128.9 (C3',3'',5',5''), 148.4 (C1',1''). Масс-спектр
(3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-
(HRMS), m/z: 553.2569 [M + H]+. C30H39Cl2N6. M
Бис(4-бромфенил)октадекагидро-1Н,8Н-
553.2613. Масс-спектр (HRMS), m/z:
575.2425
2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетра-
[M + Na]+. C30H38Cl2N6Na. M 575.2433.
цен (7). Выход 0.49 г (76%), т.пл. 298-299°С, элю-
(3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-
ент - метанол, Rf 0.61. Спектр ЯМР 1H (CDCl3),
Бис(2-бромфенил)октадекагидро-1Н,8Н-
δ, м.д.: 0.87-0.96 м (4Н, СН2, Н4,7,11,14), 1.17-1.26
2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетра-
м (4Н, СН2, Н5,6,12,13), 1.61 д (2Н, СН2, Нb4,11, 2Jba
цен (5). Выход 0.40 г (62%), т.пл. 302-304°С, элю-
10.8 Гц), 1.72 д (2Н, СН2, Нb5,12, 2Jba 11.2 Гц), 1.77-
ент - метанол, Rf 0.64. Спектр ЯМР 1H (CDCl3), δ,
1.82 м (2Н, СН, Н7a,14a), 1.90 д (2Н, СН2, Нb7,14,
м.д.: 0.69-0.74 м (2Н, СН2, Н4,11), 0.84-0.89 м (2Н,
2Jba 9.6 Гц), 2.10 д (2Н, СН2, Нb6,13, 2Jba 10.0 Гц),
СН2, Н7,14), 1.08-1.27 м (4Н, СН2, Н5,6,12,13), 1.49-
3.07-3.12 м (2Н, СН, Н3b,10b), 3.27 д (2Н, СН2,
1.58 м (4Н, СН2, Нb4,7,11,14), 1.64 д (2Н, СН2, Нb5,12,
Н1,8, 2Jab 10.8 Гц), 3.51 уш.с (2Н, СН, Н14c,14d),
2Jba 12.4 Гц), 1.71-1.76 м (2Н, СН, Н7a,14a), 2.07 д
3.94 д (2Н, СН2, Н3,10, 2Jab 13.6 Гц), 4.82-4.88
(2Н, СН2, Нb6,13, 2Jba 12.8 Гц), 3.32-3.37 м (2Н, СН,
м (4Н, СН2, Нb1,3,8,10), 6.90 д (4Н, СН, Н2',2'',6',6'',
Н3b,10b), 3.45 д (2Н, СН2, Н1,8, 2Jab 10.8 Гц), 3.59
3J 8.8 Гц), 7.33 д (4Н, СН, Н3',3'',5',5'', 3J 8.4 Гц).
уш.с (2Н, СН, Н14c,14d), 4.02 д (2Н, СН2, Н3,10, 2Jab
Спектр ЯМР 13С (CDCl3), δ, м.д.: 24.2 (C4,11), 24.5
14.0 Гц), 4.76 д (2Н, СН2, Нb1,8, 2Jba 10.8 Гц), 4.93
(C5,12), 27.1 (C6,13), 28.5 (С7,14), 55.2 (C3b,10b), 63.5
д (2Н, СН2, Нb3,10, 2Jba 13.6 Гц), 6.88 т (2Н, СН,
(C7a,14a), 66.4 (C3,10), 69.5 (C1,8), 77.9 (C14c,14d),
Н5',5'', 3J 7.6 Гц), 7.26-7.29 м (2Н, СН, Н4',4''), 7.51 д
112.4 (C4',4''), 119.0 (C2',2'',6',6''), 131.8 (C3',3'',5',5''),
(2Н, СН, Н3',3'', 3J 8.0 Гц), 7.73 д (2Н, СН, Н6',6'', 3J
148.8 (C1',1''). Масс-спектр (HRMS), m/z: 643.1585
7.6 Гц). Спектр ЯМР 13С (CDCl3), δ, м.д.: 24.3 (C4,11),
[M + H]+. C30H39Br2N6. M 643.1582. Масс-спектр
24.4 (C5,12), 27.3 (C6,13), 28.0 (С7,14), 55.9 (C3b,10b),
(HRMS), m/z: 665.1421 [M + Na]+. C30H38Br2N6Na.
63.2 (C7a,14a), 65.4 (C3,10), 71.6 (C1,8), 77.8 (C14c,14d),
M 665.1402.
117.9 (C2',2''), 122.2 (C6',6''), 123.9 (C5',5''),
128.2
(3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-
(C4',4''), 133.4 (C3',3''), 149.1 (C1',1''). Масс-спектр
Бис(2-фторфенил)октадекагидро-1Н,8Н-
(HRMS), m/z: 643.1569 [M + H]+. C30H39Br2N6.
2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетра-
M 643.1582. Масс-спектр (HRMS), m/z: 665.1417
цен (8). Выход 0.27 г (52%), т.пл. 290-292°С, элю-
[M + Na]+. C30H38Br2N6Na. M 665.1402.
ент - метанол, Rf 0.65. Спектр ЯМР 1H (CDCl3), δ,
(3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-
м.д.: 0.79-0.82 м (2Н, СН2, Н4,11), 0.89-0.93 м (2Н,
Бис(3-бромфенил)октадекагидро-1Н,8Н-
СН2, Н7,14), 1.16-1.26 м (4Н, СН2, Н5,6,12,13), 1.57
2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетра-
д (2Н, СН2, Нb4,11, 2Jba 11.5 Гц), 1.68 д (2Н, СН2,
цен (6). Выход 0.26 г (40%), т.пл. 306-308°С, элю-
Нb5,12, 2Jba 11.0 Гц), 1.79 уш.с (2Н, СН, Н7a,14a), 1.87
ент - метанол, Rf 0.61. Спектр ЯМР 1H (CDCl3), δ,
д (2Н, СН2, Нb7,14, 2Jba 10.5 Гц), 2.11 д (2Н, СН2,
м.д.: 0.96 уш.с (4Н, СН2, Н4,7,11,14), 1.24-1.28 м (4Н,
Нb6,13, 2Jba 10.0 Гц), 3.25 уш.с (2Н, СН, Н3b,10b), 3.39
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
ОДНОРЕАКТОРНЫЙ СИНТЕЗ
315
д (2Н, СН2, Н1,8, 2Jab 10.0 Гц), 3.57 уш.с (2Н, СН,
9.6 Гц), 3.52 уш.с (2Н, СН, Н14c,14d), 3.92 д (2Н,
Н14c,14d), 3.98 д (2Н, СН2, Н3,10, 2Jab 13.5 Гц), 4.80 д
СН2, Н3,10, 2Jab 12.4 Гц), 4.81 д (4Н, СН2, Нb1,3,8,10,
(2Н, СН2, Нb1,8, 2Jba 10.0 Гц), 4.89 д (2Н, СН2, Нb3,10,
2Jba 9.2 Гц), 6.95-7.01 м (8Н, СН, Н2',2'',3',3'',5',5'',6',6'').
2Jba 13.5 Гц), 6.92 уш.с (2Н, СН, Н4',4''), 6.99-7.06
Спектр ЯМР 13С (CDCl3), δ, м.д.: 24.2 (C4,11), 24.5
м (4Н, СН, Н3',3'',5',5''), 7.37 уш.с (2Н, СН, Н6',6'').
(C5,12), 27.2 (C6,13), 28.4 (С7,14), 55.3 (C3b,10b), 63.5
Спектр ЯМР 13С (CDCl3), δ, м.д.: 24.3 (C4,11), 24.5
(C7a,14a), 67.2 (C3,10), 70.4 (C1,8), 77.9 (C14c,14d),
(C5,12), 27.3 (C6,13), 28.1 (С7,14), 55.8 (C3b,10b), 63.5
115.4 и
115.6 (C3',3'',5',5'', JC-C 20.0 Гц),
119.3
(C7a,14a), 65.6 и 65.7 (C3,10, J 12.5 Гц), 70.5 (C1,8),
(C2',2'',6',6''), 146.3 (C1',1''), 156.2 и 158.6 (C4',4'', JC-F
78.0 (C14c,14d), 115.6 и 115.8 (C3',3'', JC-C 25.0 Гц),
240.0 Гц). Масс-спектр (HRMS), m/z:
521.3250
120.1 (C6',6''), 122.2 и 122.3 (C4',4'', JC-C 12.5 Гц),
[M + H]+. C30H39F2N6. M 521.3204. Масс-спектр
124.6 (C5',5''), 138.1 и 138.2 (C1',1'', JC-C 12.5 Гц),
(HRMS), m/z: 543.3076 [M + Na]+. C30H38Br2N6Na.
154.1 и 156.1 (C2',2'', JC-F 250.0 Гц). Масс-спектр
M 543.3024.
(HRMS), m/z: 521.3209 [M + H]+. C30H39F2N6. M
ЗАКЛЮЧЕНИЕ
521.3204. Масс-спектр (HRMS), m/z:
543.3034
[M + Na]+. C30H38Br2N6Na. M 543.3024.
Катализируемая YbCl3·6Н2О однореакторная
конденсация транс-1,6,7,12-тетраазапергидроте-
(3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-
трацена с формальдегидом и галогенанилинами
Бис(3-фторфенил)октадекагидро-1Н,8Н-
позволяет синтезировать с количественными вы-
2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетра-
ходами новые
(3bR*,7aR*,10bR*,14aR*)-перги-
цен (9). Выход 0.24 г (46%), т.пл. 308-310°С, элю-
дро-2,3а,7b,9,10a,14b-гексаазадибензотетрацены,
ент - метанол, Rf 0.69. Спектр ЯМР 1H (CDCl3),
представляющие интерес в качестве соединений с
δ, м.д.: 0.87-0.97 м (4Н, СН2, Н4,7,11,14), 1.17-1.29
м (4Н, СН2, Н5,6,12,13), 1.62 д (2Н, СН2, Нb4,11, 2Jba
потенциальной биологической активностью.
12.0 Гц), 1.72 д (2Н, СН2, Нb5,12, 2Jba 12.0 Гц), 1.79-
БЛАГОДАРНОСТИ
1.83 м (2Н, СН, Н7a,14a), 1.95 д (2Н, СН2, Нb7,14, 2Jba
12.0 Гц), 2.12 д (2Н, СН2, Нb6,13, 2Jba 12.0 Гц), 3.07-
Структурные исследования соединений про-
ведены в Центре коллективного пользования
3.12 м (2Н, СН, Н3b,10b), 3.28 д (2Н, СН2, Н1,8, 2Jab
8.0 Гц), 3.52 уш.с (2Н, СН, Н14c,14d), 3.96 д (2Н, СН2,
«Агидель» при ИНК УФИЦ РАН. Результаты по-
лучены с использованием оборудования ЦКП
Н3,10, 2Jab 12.0 Гц), 4.86-4.93 м (4Н, СН2, Нb1,3,8,10),
6.54-6.59 м (2Н, СН, Н4',4''), 6.73-6.79 м (4Н, СН,
«Агидель» УФИЦ РАН.
Н2',2'',6',6''), 7.16-7.22 м (2Н, СН, Н5',5'). Спектр ЯМР
ФОНДОВАЯ ПОДДЕРЖКА
13С (CDCl3), δ, м.д.: 24.2 (C4,11), 24.5 (C5,12), 27.1
(C6,13), 28.6 (С7,14), 55.1 (C3b,10b), 63.5 (C7a,14a),
Работа выполнена в соответствии с планами
66.2 (C3,10), 69.3 (C1,8), 77.9 (C14c,14d), 103.9 и
научно-исследовательских работ ИНК УФИЦ
104.2 (C2',2'', JC-C 30.0 Гц), 106.4 и 106.7 (C4',4'', JC-C
РАН по теме «Мультикомпонентные каталитиче-
30.0 Гц), 112.7 (C6',6''), 130.0 и 130.1 (C5',5'', JC-C
ские реакции в синтезе циклических и ацикличе-
10.0 Гц), 151.4 и 151.5 (C1',1'', JC-C 10.0 Гц), 162.4 и
ских гетероатомных соединений» (FMRS-2022-
164.8 (C3',3'', JC-F 240.0 Гц). Масс-спектр (HRMS),
0079, 2022-2024). Результаты получены при фи-
m/z: 521.3212 [M + H]+. C30H39F2N6. M 521.3204.
нансовой поддержке РФ в лице Минобрнауки
России Грантом ФЦП № 2019-05-595-000-058 и
(3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-
Стипендии Президента РФ молодым ученым и
Бис(4-фторфенил)октадекагидро-1Н,8Н-
аспирантам (СП-197.2019.4).
2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетра-
цен (10). Выход 0.36 г (69%), т.пл. 292-294°С, элю-
ИНФОРМАЦИЯ ОБ АВТОРАХ
ент - метанол, Rf 0.64. Спектр ЯМР 1H (CDCl3), δ,
Рахимова Елена Борисовна, ORCID: http://
м.д.: 0.93 уш.с (4Н, СН2, Н4,7,11,14), 1.21 уш.с (4Н,
orcid.org/0000-0002-7908-1354
СН2, Н5,6,12,13), 1.61-1.88 м (6Н, СН2, Нb4,5,7,11,12,14,
2Н, СН, Н7a,14a), 2.09 уш.с (2Н, СН2, Нb6,13), 3.18
Кирсанов Виктор Юрьевич, ORCID: http://
уш.с (2Н, СН, Н3b,10b), 3.28 д (2Н, СН2, Н1,8, 2Jab
orcid.org/0000-0002-0671-6048
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022
316
РАХИМОВА и др.
КОНФЛИКТ ИНТЕРЕСОВ
7. Khokhar A.R., Al-Baker S., Shamsuddin S., Sid-
dik Z.H. J. Med. Chem. 1997, 40, 112-116. doi 10.1021/
Авторы заявляют об отсутствии конфликта ин-
jm960587l
тересов.
8. Morales F., Ramirez A., Morata-Tarifa C., Navar-
CПИСОК ЛИТЕРАТУРЫ
ro S.A., Marchal J.A., Campos J.M., Conejo-Gar-
1. Neumann P., Aumueller A., Trauth H. Пат. 4, 904, 779
cia A. Future Med. Chem. 2017, 9, 293-302. doi
(1990). США.
10.4155/fmc-2016-0212
2. Rakhimova E.B., Kirsanov V.Yu., Mescheryakova E.S.,
Khalilov L.M., Ibragimov A.G., Dzhemilev U.M.
9. Omer K.H., Seliman A.A., Altaf M., Casagrande N.,
Synlett. 2018, 29, 1861-1866. doi 10.1055/s-0037-
Aldinucci D., Altuwaijri S., Isab A.A. Polyhedron.
1610201
2015, 102, 773-781. doi 10.1016/j.poly.2015.10.029
3. Rakhimova E.B., Kirsanov V.Yu., Mescheryakova E.S.,
10. Iwanejko J., Wojaczynska E., Trynda J., Maciejews-
Ibragimov A.G., Dzhemilev U.M. Mendeleev Commun.
ka M., Wietrzyk J., Kochel A., Wojaczynski J.
2020, 30, 308-310. doi 10.1016/j.mencom.2020.05.015
Tetrahedron.
2017,
73,
2276-2282. doi
10.1016/
4. Rakhimova E.B., Kirsanov V.Yu., Tret’yakova E.V.,
j.tet.2017.03.017
Khalilov L.M., Ibragimov A.G., Dzhemileva L.U.,
11. Рахимова Е.Б., Кирсанов В.Ю., Ибрагимов А.Г.,
D’yakonov V.A., Dzhemilev U.M. RSC Adv. 2020, 10,
Джемилев У.М. ЖОрХ.
2018,
54,
1078-1082.
21039-21048. doi 10.1039/D0RA03209C
[Rakhimova E.B., Kirsanov V.Yu., Ibragimov A.G.,
5. Dragoun M., Gunther T., Frias C., Berkessel A., Pro-
Dzhemilev U.M. Russ. J. Org. Chem. 2018, 54, 1085-
kop A. J. Cancer Res. Clinic. Oncol. 2018, 144, 685-
1089.] doi 10.1134/S1070428018070199
695. doi 10.1007/s00432-018-2592-x
12. Barsegyan Y.A., Baranov V.V., Kravchenko A.N.,
6. Hopff S.M., Wang Q., Frias C., Ahrweiler M., Wil-
ke N., Wilke N., Berkessel A., Prokop A. J. Cancer
Strelenko Y.A., Anikina L.V., Karnoukhova V.A.,
Res. Clin. Oncol. 2021, 147, 2591-2607. doi 10.1007/
Kolotyrkina N. G. Synthesis. 2018, 50, 2099-2105. doi
s00432-021-03679-3
10.1055/s-0036-1591952
One-Pot Synthesis of 2,9-Di(halogenphenyl)substituted
Perhydrohexaazadibenzotetracenes
E. B. Rakhimova*, V. Yu. Kirsanov, and
A. G. Ibragimov
Institute of Petrochemistry and Catalysis, Ufa Federal Research Center, Russian Academy of Sciences,
prosp. Oktyabrya, 141, Ufa, 450075 Russia
*e-mail: rakhimovaelena@mail.ru
Received September 7, 2021; revised September 20, 2021; accepted September 24, 2021
A one-pot procedure has been developed for the synthesis of 2,9-di(halophenyl)substituted (3bR*,7aR*,10bR*,-
14aR*-cis-14c,14d)-octadecahydro-1Н,8Н-2,3а,7b,9,10a,14b-hexaazadibenzo[fg,op]tetracenes by the reaction of
multicomponent condensation of trans-1,6,7,12-tetraazaperhydrotetracene with formaldehyde and halogenated
anilines in the presence of YbCl3 6H2O as catalyst.
Keywords: catalysis, heterocyclization, formaldehyde, halogenated anilines, polycycles
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 3 2022