ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 9, с. 1012-1018
КРАТКИЕ СООБЩЕНИЯ
УДК 547.233.1
СИНТЕЗ ХИРАЛЬНЫХ ЭНАНТИОМЕРНО ЧИСТЫХ
ТИОМОЧЕВИН И ТИОГИДАНТОИНОВ НА ОСНОВЕ
(R)- И (S)-1-(2,4-ДИМЕТОКСИФЕНИЛ)ЭТAН-
1-АМИНОВ
© 2022 г. А. А. Барашкин, В. С. Поляков, Н. Л. Шикуть, А. Д. Путилова, А. Р. Горовой,
В. А. Тафеенко, Н. В. Зык, Е. К. Белоглазкина*
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова, химический факультет,
Россия, 119991 Москва, Ленинские горы, 1, стр. 3
*e-mail: bel@org.chem.msu.ru
Поступила в редакцию 10.03.2022 г.
После доработки 18.03.2022 г.
Принята к публикации 22.03.2022 г.
Предложен удобный метод выделения (R)- и (S)-энантимеров 1-(2,4-диметоксифенил)этан-1-амина из
рацемической смеси с использованием О,О-дибензоилвинных кислот. На основе (R)- и (S)-1-(2,4-диме-
токсифенил)этан-1-аминов реакцией с этилизотиоцианатоацетатом получены хиральные тиомочевины
и 2-тиогидантоины.
Ключевые слова: разделение энантиомеров, 1-арилалкиламины, О,О-дибензоилвинная кислота, тио-
мочевины, тиогидантоины
DOI: 10.31857/S0514749222090117, EDN: JMTAJK
Получение органических производных в энан-
противоракового препарата нутлина (-)-нутлин-3
тиомерно чистом виде является актуальной за-
примерно в 150 раз более эффективно ингибирует
дачей, прежде всего для синтеза биологически
взаимодействие белков p53-MDM2, чем его энан-
активных соединений, у которых целевую ак-
тиомер (+)-нутлин-3 [6,7], а другие диастереомеры
тивность, как правило, проявляет только один из
нутлина вообще не проявляют такой активности,
стереоизомеров, а другие оказываются неактив-
но зато ингибируют антиапоптический фактор
ными или даже токсичными [1-3]. Так, при ис-
транскрипции NFkB [8].
следовании действия энантиомеров α-пинена на
Энантимерно чистые первичные амины явля-
различные виды бактерий и грибов было обна-
ются удобными исходными соединениями для по-
ружено, что из 25 исследованных видов бактерий
лучения хиральных органических молекул. Чаще
18 более подвержены влиянию (-)-энантиомера,
всего в синтезе используются асимметрические
тогда как для мицелиальных грибов активным
производные
1-арилалканаминов, так как они
оказался (+)-энантиомер [4]. (+)-(S)-Энантиомер
легко доступны благодаря реакциям восстанови-
1-метил-3-(10H-фенотиазин-10-илметил)-1-азони-
тельного аминирования соответствующих ацето-
абицикло[2,2,2]октанйодида на порядок более эф-
фенонов [9], могут быть разделены на индивиду-
фективен в качестве антагониста гистамина, чем
альные энантиомеры через диастереомерные соли
(-)-(R)-энантиомер [5]. Один их стереоизомеров
с винной кислотой [10] и устойчивы к рацемиза-
1012
СИНТЕЗ ХИРАЛЬНЫХ ЭНАНТИОМЕРНО ЧИСТЫХ ТИОМОЧЕВИН
1013
ции в присутствии оснований [11-13]. Кроме того,
В данной работе мы предлагаем удобный пре-
1-арилалкиламинная группа может использовать-
паративный способ разделения рацемического
ся в качестве вспомогательной хиральной группи-
1-(2,4-диметоксифенил)этан-1-амина на энантио-
ровки с последующим удалением из целевой моле-
меры с использованием (+)- и (-)-O,O-дибензоил-
кулы гидрогенолизом или ацидолизом [11].
винных кислот и демонстрируем возможность ис-
пользования полученных (+)- и (-)-1-(2,4-диметок-
Несмотря на удобство разделения 1-арилалки-
сифенил)этан-1-аминов (R)-1 и (S)-1 для получе-
ламинов на энантиомеры через диастереомерные
ния оптически активных тиомочевин и тиогидан-
тартраты, эта методика не является полностью
тоинов без рацемизации в процессе синтеза.
универсальной, она дает удовлетворительные ре-
зультаты лишь для простых производных 1-фе-
Рацемический
1-(2,4-диметоксифенил)этан-
нилэтиламина и некоторых его аналогов [14, 15].
1-амин 1 был получен из резорцина в результа-
До настоящего времени в литературе отсутствова-
те трехстадийного синтеза [17-19] и разделен на
ли данные о разделении на энантиомеры 1-(2,4-ди-
энантиомеры после трехкратной перекристалли-
метоксифенил)этан-1-амина (1). Наши попытки
зации из метанола его диастереомерных солей c
(R,R)- и (S,S)-О,О-дибензоилвинными кислотами
провести такое разделение стандартным методом
с использованием (+)- и (-)-винных кислот не
(ODBTA). Для выделения аминов (R)-1 и (S)-1 в
привели к положительному результату из-за дли-
виде свободных оснований полученные соли обра-
батывали гидроксидом натрия (схема 1). Для син-
тельного (более 3 сут) процесса кристаллизации
тезированных аминов (R)-1 и (S)-1 было опреде-
и загрязнения выделяющейся виннокислой соли
лено удельное вращение методом поляриметрии;
вторым стереоизомером даже после многократ-
энантиомерную чистоту подтверждали методом
ных перекристаллизаций. В то же время 1-(2,4-ди-
хиральной ВЭЖХ.
метоксифенил)иламиновый фрагмент в качестве
вспомогательной хиральной группировки имеет
Полученные энантиомерно чистые амины (R)-1
преимущество перед 1-фенилэтиламиновым, по-
и (S)-1 не описаны в литературе, поэтому моно-
скольку производные амина 1 с метокси-группами
кристаллы обоих стереоизомерных тартратов ами-
в орто- и пара-положениях бензольного кольца
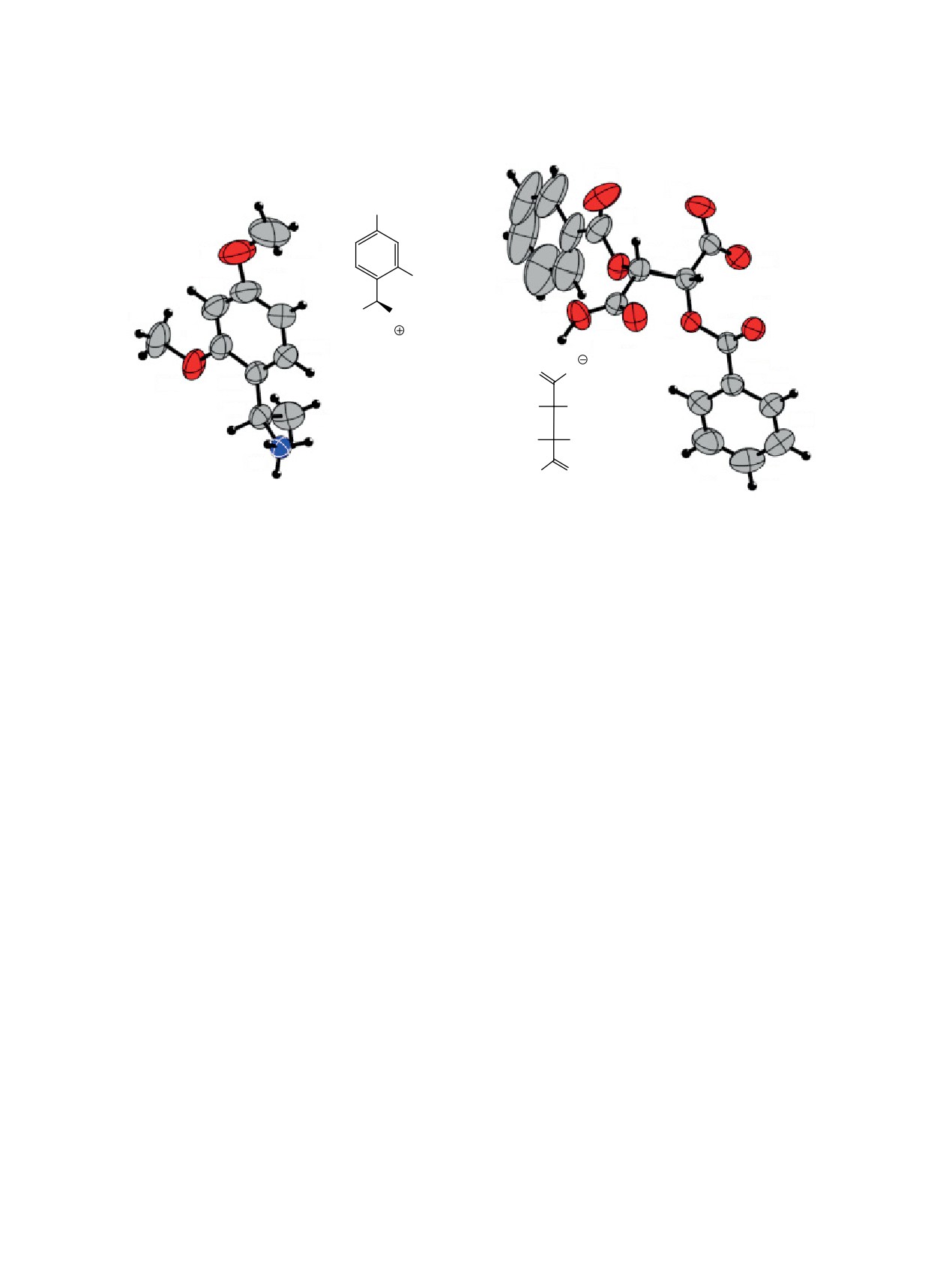
на 1 были исследованы методом рентгенострук-
образуют более устойчивый бензильный катион
турного анализа (РСА). Молекулярная структура
при расщеплении ацидолизом, и 2,4-диметоксифе-
соединения (S)-1.ODBTA представлена на рисун-
нилэтильная группировка может быть удалена из
ке. Установлено, что использование (-)-ODBTA
целевой молекулы в условиях, когда фенилэтила-
с конфигурацией стереоцентров (R,R) позволяет
минная группировка не отщепляется [16]. Кроме
выделить (R)-(+)-1-(2,4-диметоксифенил)этан-1-
того, в производных амина 1 дополнительные сте-
амин, а (+)-ODBTA с конфигурацией стереоцен-
рические эффекты способны усиливать различия в
тров (S,S) - (S)-(-)-1-(2,4-диметоксифенил)этан-1-
физико-химических свойствах получаемых на их
амин; таким образом были соотнесены направле-
основе пар диастереомеров, что может положи-
ние оптического вращения и абсолютная конфигу-
тельно сказаться на возможности их разделения.
рация полученных аминов.
Схема 1. Выделение энантимерных аминов (R)-1 и (S)-1
O OH
HO O
1.
(R)
1.
(S)
H
OBz
BzO
H
H3C NH2
H3C NH2
H3C NH2
(R)
(S)
(R)
BzO
H
H
OBz
(S)
OCH3
OCH3
OCH3
O OH
HO
O
2. 3-ɤɪɚɬɧɚɹ
2. 3-ɤɪɚɬɧɚɹ
ɩɟɪɟɤɪɢɫɬɚɥɥɢɡɚɰɢɹ
ɩɟɪɟɤɪɢɫɬɚɥɥɢɡɚɰɢɹ
ɢɡ ɆɟɈɇ
ɢɡ ɆɟɈɇ
OCH3
3. NaOH
OCH3
3. NaOH
OCH3
(R)-1, 46%
1
(S)-1, 33%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
1014
БАРАШКИН и др.
C8
C7
O7
O3
OCH
C6
3
C5
O9
C4
C25
C1
C9
C2
O4
C24
OCH
O2
C19
3
C23
(S)
C10
O8
C26
H3C
NH3
12
C11
3
C
C
C20
O6
O5
O1
C22
O O
C13
C21
C18
(R)
C14
O10
C27
H
OBz
28
C15
C
(R)
BzO
H
N1
17
C
16
HO
O
C
Молекулярная структура О,О-дибензоилтартрата 1-(2,4-диметоксифенил)этиламина (S)-1
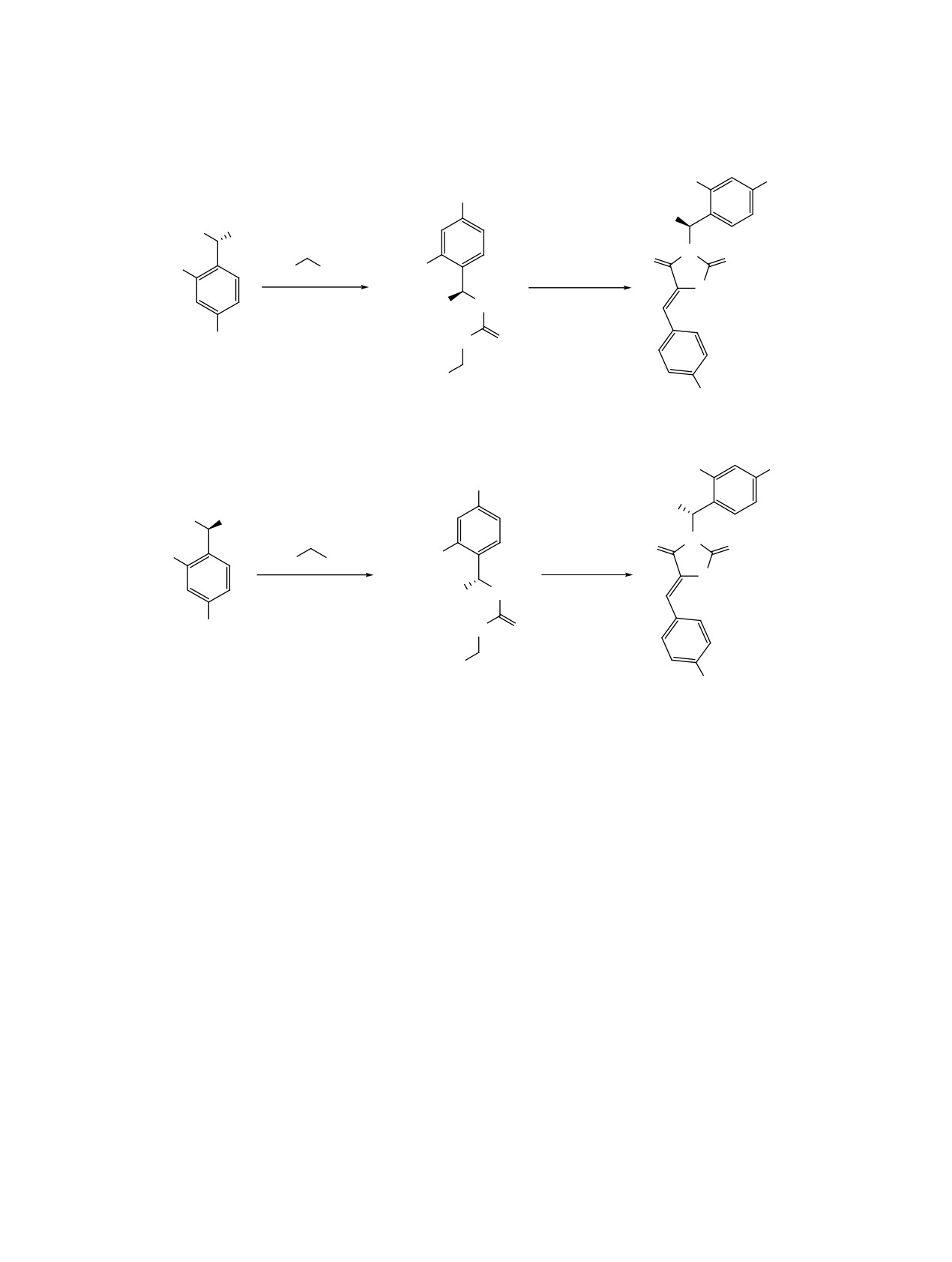
На основе полученных аминов (R)-1 и (S)-1 да-
фильтровывали, растворяли в воде, добавляли из-
лее были получены тиомочевины (R)-2 и (S)-2 и
быток КОН, экстрагировали диэтиловым эфиром
арилидентиогидантоины (R)-3/(S)-3 и (R)-4/(S)-4.
(3×50 мл). Эфирный экстракт сушили над суль-
Для этого энантиомерные амины 1 вводили в ре-
фатом натрия и упаривали растворитель. Выход
акцию с этиловым эфиром изотиоцианоуксусной
0.959 г (46%), бесцветная жидкость. [α]D20 +46.6°
кислоты, и далее полученную тиомочевину 2 ис-
(без растворителя) или +25.8° (c 1.0, CHCl3). Для
пользовали в реакции с бензальдегидом и 4-фтор-
соли с (+)-ODBTA [α]D20 +87° (c 0.2, MeOH). Спектр
бензальдегидом (схема 2).
ЯМР 1H (400 МГц, CDCl3), δ, м.д.: 1.36 д (3H, CH3,
J 6.7 Гц), 1.58 с (2H, NH2), 3.80 с (3H, OCH3), 3.82 с
Для доказательства отсутствия рацемизации
(3H, OCH3), 4.28 к (1H, CH, J 6.8 Гц), 6.47-6.45 д.д
в ходе представленных на схеме 2 реакций полу-
(2H, Ar, J 2.4, 2.0 Гц), 7.21-7.23 м (1H, Ar). Спектр
ченные соединения (R)-2, (S)-2, (R)-3, (S)-3, (R)-4
ЯМР 13С (101 МГц, CDCl3), δ, м.д.: 23.31, 45.53,
и (S)-4 были исследованы с помощью аналитиче-
55.14, 98.57, 103.69, 126.07, 128.34, 157.67, 159.40,
ской ВЭЖХ с хиральной неподвижной фазой. По
212.08. Mасс-спектр (ESI), m/z: 182.1176 [М + H]+.
результатам анализа в выделенных продуктах от-
C10H16NO2. М 182.1181.
сутствуют примеси противоположных энантиоме-
ров.
(S)-1-(2,4-Диметоксифенил)этил-1-амин
(R)-1-(2,4-Диметоксифенил)этил-1-амин
[(S)-1)]. В конической колбе растворяли 27.789 г
[(R)-1]. В конической колбе растворяли 4.354 г
(0.0739 моль, 1.01 экв) (-)-ODBTA в метаноле
(0.0116 моль, 1.01 экв) (+)-ODBTA в метаноле
(100 мл), нагревали до кипения, после чего по ка-
(50 мл), нагревали до кипения, после чего по ка-
плям прибавляли 13.244 г рацемического амина 1
плям прибавляли 2.075 г рацемического амина 1
(0.0732 моль, 1 экв). Колбу охлаждали до комнат-
(0.0115 моль, 1 экв). Колбу охлаждали до комнат-
ной температуры, декантировали раствор с вы-
ной температуры, декантировали раствор с вы-
павших игольчатых кристаллов, добавляли к ним
павших игольчатых кристаллов, добавляли к ним
50 мл метанола и нагревали до полного раство-
50 мл метанола и нагревали до полного раство-
рения, после чего охлаждали до комнатной тем-
рения, после чего охлаждали до комнатной тем-
пературы и отфильтровывали выпавший осадок.
пературы и отфильтровывали выпавший осадок.
Перекристаллизацию из метанола повторяли еще
Перекристаллизацию из метанола повторяли еще
2 раза, после чего образовавшиеся кристаллы от-
2 раза, после чего образовавшиеся кристаллы от-
фильтровывали, растворяли в воде, добавляли из-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
СИНТЕЗ ХИРАЛЬНЫХ ЭНАНТИОМЕРНО ЧИСТЫХ ТИОМОЧЕВИН
1015
Схема 2. Синтез энантиомерно чистых тиомочевин 2 и тиогидантоинов 3
H3CO
OCH3
OCH3
H3C
H3C NH2
(S)
(S)
ArCHO
O
N S
H3CO
SCN
COOEt
H3CO
KOH (3 ɷɤɜ)
(S)
NH
Et2O
C
H
3C
NH
2H5OH
OCH3
HN
S
EtOOC
X
(S)-1
(S)-2, 99%
(S)-3, X = H, 66%
(S)-4, X = F, 66%
H3CO
OCH3
OCH3
(R)
H3C
H3C NH2
(R)
O
N S
H3CO
H3CO
KOH (3 ɷɤɜ)
SCN
COOEt
(R)
NH
Et2O
C2H5OH
H
3C
NH
OCH3
HN
S
EtOOC
X
(R)-1
(R)-2, 99%
(R)-3, X = H, 57%
(R)-4, X = F, 59%
быток КОН, экстрагировали диэтиловым эфиром
Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.:
(3×100 мл). Эфирный экстракт сушили над суль-
1.17-1.22 д (3H, O-CH2-CH3, J 7.0 Гц), 1.31 д
фатом натрия и упаривали растворитель. Выход
(3H, CH-CH3, J 6.9 Гц), 3.74 с (3H, OCH3), 3.80 с
4.37 г (33%), бесцветная жидкость. Cпектральные
(3H, OCH3), 4.03 к (1H, CH-CH3, J 6.9 Гц), 4.09 к
данные аналогичны таковым изомера (R)-1. [α]D20
(2H, O-CH2-CH, J 7.0 Гц), 4.22 д (2H, NH-CH2, J
-46.4° (без растворителя) или -25.6° (c 1.0, CHCl3).
7.5 Гц), 6.48 д (1H, Ar, J 8.3 Гц), 6.54 с (1H, Ar), 7.09
Для соли с (-)-ODBTA [α]D20 +87° (c 0.2, MeOH).
д (1H, Ar, J 8.3 Гц), 8.03 д (1H, NH, J 7.5 Гц), 7.64
уш.с (1H, NH). Mасс-спектр (ESI), m/z: 327.1373
(R)- и (S)-Этил-{[1-(2,4-диметоксифенил)-
[М + H]+. C15H23N2O4S. М 327.1371.
этил]карбамотиоил}глицинаты (2). (+)-Изомер
[(R)-2]. К раствору 5.43 г амина (R)-1 (0.03 моль,
Тиогидантоины 3 и 4 (общая методика). К
1 экв) в диэтиловом эфире (15 мл) добавляли
раствору тиомочевины (R)-2 или (S)-2 (1 экв) в
4.35 г этилизотиоцианатоацетата
(0.03 моль,
этаноле добавляли альдегид (1.1 экв). Далее при
1 экв). Перемешивали 30 мин, упаривали раство-
перемешивании добавляли твёрдый КОН (3 экв).
ритель. Выход 9.5 г (98%), желтоватое масляни-
Полученный раствор жёлтого цвета перемешива-
стое вещество. [α]D20 +38.7° (c 1.0, MeOH).
ли при комнатной температуре в течение 2-3 ч,
(-)-Изомер [(S)-2] синтезировали аналогично
контроль по ТСХ, система ПЭ-ЭА, 3:1. После
соединению (R)-2. Выход 9.7 г (99%), желтоватое
окончания реакции добавляли избыток насыщен-
маслянистое вещество. [α]D20 -38.8° (c 1.0, MeOH).
ного раствора хлорида аммония; при этом выпадал
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
1016
БАРАШКИН и др.
осадок жёлтого цвета, который отфильтровывали
(1 ммоль), 0.136 г 4-фторбензальдегида (1.1 ммоль)
и сушили на воздухе.
и 0.168 г гидроксида калия (3 ммоль). Выход
0.253 г (66%). [α]D20 -65.0° (c 1.0, МeOH). Cпек-
(R,Z)-(+)-5-Бензилиден-3-[1-(2,4-диметокси-
тральные данные аналогичны таковым изомера
фенил)этил]-2-тиооксоимидазолидин-4-он [(R)-
(R)-4.
3] получали из
0.326 г тиомочевины (R)-2
(1 ммоль), 0.117 г бензальдегида (1.1 ммоль) и
Для синтеза использовались следующие реакти-
0.168 г гидроксида калия (3 ммоль). Выход 0.21 г
вы: этиловый эфир изотиоцианоуксусной кислоты
(57%), т.пл. 78-80°C. [α]D20 +82.0° (c 1.0, МeOH).
(97%б Sigma-Aldrich), O,O-дибензоилвинная кис-
Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.: 1.71
лота (98%, Sigma-Aldrich), 3,4-диметоксибеензаль-
д (3H, CH3, J 7.2 Гц), 3.72 с (3H, OCH3), 3.75 с (3H,
дегид (99%, Sigma-Aldrich), 4-Фторбензальдегид
OCH3), 6.04 к (1H, CH. J 7.3 Гц), 6.49 м (2H, Ar),
(98%, Sigma-Aldrich).
6.52 с (1H, HC=), 7.31 д (1H, Ar, J 8.0 Гц), 7.35-
Контроль хода реакций и чистоты веществ осу-
7.47 м (3H, Ar), 7.74 д (2H, Ar, J 6.6 Гц), 12.27 с
ществляли методом ТСХ на пластинах «Silufol-
(1H, NH). Спектр ЯМР 13С (101 МГц, ДМСО-d6),
UV254» с закрепленным слоем силикагеля.
δ, м.д.: 17.07, 39.81, 40.02, 40.23, 48.00, 55.60,
Cпектры ЯМР 1Н и 13С записывали на приборе
56.02, 98.67, 104.77, 112.45, 119.91, 126.44, 129.19,
Bruker Avance (Германия) с рабочей частотой 400
129.67, 130.62, 132.74, 157.98, 160.40, 164.32,
и 100 МГц соответственно, δ, м.д. В качестве
179.34. Mасс-спектр (ESI), m/z: 369.1267 [М + H]+.
растворителя использовали дейтерохлороформ и
C20H21N2O3S. М 369.1268.
ДМСО-d6. Химические сдвиги приведены в мил-
(S,Z)-(-)-5-Бензилиден-3-[1-(2,4-диметокси-
лионных долях по шкале δ относительно гекса-
фенил)этил]-2-тиооксоимидазолидин-4-он [(S)-
метилдисилоксана как внутреннего стандарта.
3] получали из 1.4 г тиомочевины (S)-2 (3.8 ммоль),
Масс-спектры высокого разрешения (МСВР) ре-
0.445 г г бензальдегида (4.2 ммоль) и 0.638 г ги-
гистрировали на приборе Bruker microTOF II ме-
дроксида калия (11.4ммоль). Выход 0.92 г (66%).
тодом электрораспылительной ионизации (ESI).
[α]D20 -81.7° (c 1.0, МeOH). Cпектральные данные
Измерения выполняли на положительных ионах
аналогичны таковым изомера (R)-3.
(напряжение на капилляре - 4500 В). Диапазон
сканирования масс - m/z 50-3000 D, калибровка -
(R,Z)-(+)-3-[1-(2,4-Диметоксифенил)этил]-5-
внешняя или внутренняя (Electrospray Calibration
(4-фторбензилиден)-2-тиооксоимидазолидин-
Solution, Fluka). Вещества вводили в виде раство-
4-он [(R)-4] получали из 0.326 г тиомочевины (R)-2
ров в ацетонитриле, скорость потока - 3 мкл/мин.
(1 ммоль), 0.136 г 4-фторбензальдегида (1.1 ммоль)
Газ-распылитель - азот (4 л/мин), температура
и 0.168 г гидроксида калия (3 ммоль). Выход
интерфейса 180°C. Для подтверждения энантио-
0.228 г (59%), т.пл. 73-75°C. [α]D20 +65.2° (c 1.0,
мерной чистоты соединений использовали хрома-
МeOH). Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ,
тограф Shimadzu Prominence LC20 с коллектором
м.д.: 1.69 д (3H, CH3, J 7.4 Гц), 3.71 с (3H, OCH3),
фракций. Температура анализа 40°С, скорость по-
3.74 с (3H, CH3), 6.02 д (1H, CH, J 7.4 Гц), 6.47-6.53
тока элюента - 1 мл/мин. Колонка Chiralpak AS-H
м (3H, HC=, Ar), 7.22-7.32 м (3H, Ar), 7.80 д.д (2H,
250×4 мм, зернение 5 мкм. Режим элюирования
Ar, J 9.0, 5.4 Гц), 12.33 с (1H, NH). Спектр ЯМР
градиентный, элюент А - гексан, элюент В - изо-
13С (101 МГц, ДМСО-d6), δ, м.д.: 17.04, 55.58,
пропанол. Градиент: до 0.5 мин - 15% В, от 0.5 до
55.99, 98.58, 104.66, 111.39, 116.14, 116.36, 126.16,
10.5 мин - от 15 до 50% В, от 10.5 до 12 мин - 50% В,
129.34, 129.14, 133.04, 157.93, 160.36, 161.57,
от 12 до 14 мин - от 50 до 15% В, полное время
164.28. Спектр ЯМР 19F (376 МГц, ДМСО-d6),
анализа - 20 мин. Масс-детектор: одинарный ква-
δ, м.д.: -110.73. Mасс-спектр (ESI), m/z: 387.1173
друпольный масс-спектрометр Shimadzu LCMS-
[М + H]+. C20H20FN2O3S. М 387.1173.
2020 с источником ионизации DUIS. Температура
(S,Z)-(-)-3-[1-(2,4-Диметоксифенил)этил]-5-
нагревателя - 400°С, капилляра - 250°С, поток об-
(4-фторбензилиден)-2-тиооксоимидазолидин-
дувающего газа - 1.5 л/мин, высушивающего газа -
4-он [(S)-4] получали из 0.326 г тиомочевины (S)-2
15 л/мин. Ионизация в совместном режиме ESI/
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
СИНТЕЗ ХИРАЛЬНЫХ ЭНАНТИОМЕРНО ЧИСТЫХ ТИОМОЧЕВИН
1017
APCI с регистрацией положительных и отрица-
2. D’Amato R.J., Loughnan M.S., Flynn E., Folkman J.
тельных ионов в режиме Scan. Измерение угла оп-
Proc. Natl. Acad. Sci. USA. 1994, 91, 4082-4085. doi
10.1073/pnas.91.9.4082
тического вращения проводили на автоматическом
поляриметре «A. Kruss Optronic GmbH» в виде од-
3. Alper P.B., Meyers C., Lerchner A., Siegel D.R.,
ноблочного прибора с интерференционным све-
Carreira E.M. Facile, Angew. Chem.
1999,
111,
тофильтром с максимумом пропускания на длине
3379-338. doi 10.1002/(SICI)1521-3757(19991102)
волны 589 нм, фокусирующей оптической систе-
111:21<3379::AID-ANGE3379>3.0.CO;2-J
мой и диапазоном измерений на данной длине вол-
4. da Silva A.C.R., Lopes P.M., de Azevedo M.M.B.,
ны от -90° до +90° и абсолютной погрешностью
Costa D.C.M., Alviano C.S., Alviano D.S. Molecules.
не более ±0.003°. Измерения проводили в стеклян-
2012, 17, 6305-6316. doi 10.3390/molecules17066305
ной кювете с длиной оптического пути 100 мм для
5. Di Bugno C., Dapporto P., Giorgi R., Manzini S., Paoli P.,
растворов с концентрацией 1 г/100г метанола или
Subissi A., Arcamone F. Chirality. 1994, 6, 382-388.
хлороформа или для чистых жидких веществ без
doi 10.1002/chir.530060505
растворителя.
6. Fischer P.M. Int. J. Peptide Res. Ther. 2006, 12, 3-19.
Рацемический амин 1 синтезировали трехста-
doi 10.1007/s10989-006-9016-5
дийной последовательностью реакций, исходя из
7. El Sawy K., Verma C.S., Lane D.P., Caves L. Cell
резорцина, по методикам [17-19]. (+)- и (-)-О,О-
Cycle. 2013, 12, 3727-3735. doi 10.4161/cc.27273
Дибензоилвинные кислоты (ее
98+%, партия
8. Sharma V., Peddibhotla S., Tepe J.J. J. Am. Chem. Soc.
62708-56-9, ООО «ХимПроцесс», г. Москва) полу-
2006, 128, 9137-9143. doi 10.1021/ja060273f
чали по методике [20].
9. Baxter E.W., Reitz A.B. Reductive Aminations of
ЗАКЛЮЧЕНИЕ
Carbonyl Compounds with Borohydride and Borane
Рацемический
1-(2,4-диметоксифенил)этан-1-
Reducing Agents. Ed. L.E. Overman. Wiley Online
Library. 2004, 59. doi 10.1002/0471264180.or059.01
амин может быть разделён на энантиомеры с ис-
пользованием
(+)- и
(-)-O,O-дибензоилвинных
10. Ault A. Org. Synth. 1969, 49, 93-96. doi 10.15227/
кислот. Выделенные (R)- и (S)-энантиомеры 1-(2,4-
orgsyn.049.0093
диметоксифенил)этан-1-амина могут быть ис-
11. Sallio R., Lebrun S., Capet F., Agbossou-Niedercorn F.,
пользованы для препаративного синтеза оптиче-
Michon C., Deniau E. Beilstein J. Org. Chem. 2018, 14,
ски активных тиомочевин и тиогидантоинов без
593-602. doi 10.3762/bjoc.14.46
рацемизации в процессе синтеза.
12. Davies S.G., Huckvale R., Lee J.A., Lorkin T.J.A.,
БЛАГОДАРНОСТИ
Roberts P.M., Thomson J.E. Tetrahedron. 2012, 68,
3263-3275. doi 10.1016/j.tet.2011.12.084
ЯМР и РСА исследования в данной работе
выполнены при поддержке Программы разви-
13. Davies S.G., Lee J.A., Roberts P.M., Stonehouse J.P.,
тия Московского Государственного Университета
Thomson J.E. Tetrahedron Lett. 2012, 53, 1119-1121.
doi 10.1016/j.tetlet.2011.12.088
имени М.В. Ломоносова.
14. Kwan M.H.T., Breen J., Bowden M., Conway L.,
ФОНДОВАЯ ПОДДЕРЖКА
Crossley B., Jones M.F., Munday R., Pokar N.P.B.,
Работа выполнена при финансовой поддержке
Screen T., Blacker A.J. J. Org. Chem. 2021, 86, 2458-
Российского Научного Фонда (проект № 21-13-
2473. doi 10.1021/acs.joc.0c02617
00023) и Российского Фонда Фундаментальных
15. Miyazaki M., Naito H., Sugimoto Y., Kawato H.,
Исследований (проект № 19-33-90237).
Okayama T., Shimizu H., Miyazaki M., Kitagawa M.,
КОНФЛИКТ ИНТЕРЕСОВ
Seki T., Fukutake S., Aonuma M., Soga T. Bioorg.
Med. Chem. Lett. 2013, 23, 728-732. doi 10.1016/
Авторы заявляют об отсутствии конфликта ин-
j.bmcl.2012.11.091
тересов.
16. Barashkin A.A., Polyakov V.S., Shikut N.L., Putilo-
СПИСОК ЛИТЕРАТУРЫ
va A.D., Gorovoy A.R., Degtiarev A.D., Tafeenko V.A.,
1. Antonchick A.P. Tetrahedron. 2011, 67, 10195-10202.
Tarasevich B.N., Zyk N.V., Beloglazkina E.K.
doi 10.1016/j.tet.2011.04.056
Mendeleev Commun. 2022, 32, 6641.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
1018
БАРАШКИН и др.
17. Schmidt N.G., Pavkov-Keller T., Richter N., Wilts-
19. Kinbara K., Harada Y., Saigo K. J. Chem. Soc.,
chi B., Gruber K., Kroutil W. Angew. Chem. Int. Ed.
Perkin Trans. 2000, 2, 1339-1347. doi 10.1039/
2017, 56, 7615-7619. doi 10.1002/anie.201703270
b000903m
18. Fardost A., Lindh J., Sjöberg P.J.R., Larhed M. Adv.
20. Zetzsche F., Hubacher M. Helv. Chim. Acta. 1926, 9,
Synth. Catal.
2014,
356,
870-878. doi
10.1002/
ADSC.201301004
291-297. doi 10.1002/hlca.19260090134
Synthesis of Chiral of Chiral Enantiomerically Pure Thioureas
and Thiohydantoins Based
on (R)- and (S)-1-(2,4-Dimethoxyphenyl)ethane-1-amines
A. A. Barashkin, V. S. Polyakov, N. L. Shikut, A. D. Putilova, A. R. Gorovoy,
V. A. Tafeenko, N. V. Zyk, and E. K. Beloglazkina*
M.V. Lomonosov Moscow State University, Faculty of Chemistry, Leninskie gory, 1/3, Moscow, 119991 Russia
*e-mail: bogtv@mail.ru
Received March 10, 2022; revised March 18, 2022; accepted March 22, 2022
A convenient method for isolating the (R)- and (S)-enantiomers of 1-(2,4-dimethoxyphenyl)ethane-1-amine from
their racemic mixture using O,O-dibenzoyltartaric acids have been proposed. Based on (R)- and (S)-1-(2,4-di-
methoxyphenyl)ethane-amines, chiral thioureas and 2-thiohydantoins were obtained by the reaction with ethyl
isothiocyanatoacetate.
Keywords: separation of enantiomers, 1-arylalkylamines, O,O-dibenzoyltartaric acid, thioureas, thiohydantoines
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022