ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 5, с. 603-608
УДК 547.669 + 547.304.7
СИНТЕЗ И ОПТИЧЕСКИЕ СВОЙСТВА
π-СОПРЯЖЕННЫХ АЗУЛЕНОВ
© 2023 г. Н. Мерхатулыa, *, А. Н. Искандеровa, С. К. Жокижановаb, Г. Т. Кокибасоваa
a Карагандинский университет им. Е.А. Букетова, Казахстан, 100028 Караганда, ул. Университетская, 28
b Агротехнический университет им. С. Сейфулина, Казахстан, 010000 Астана, просп. Женис, 62
*e-mail: merhatuly@ya.ru
Поступила в редакцию 12.05.2022 г.
После доработки 24.05.2022 г.
Принята к публикации 25.05.2022 г.
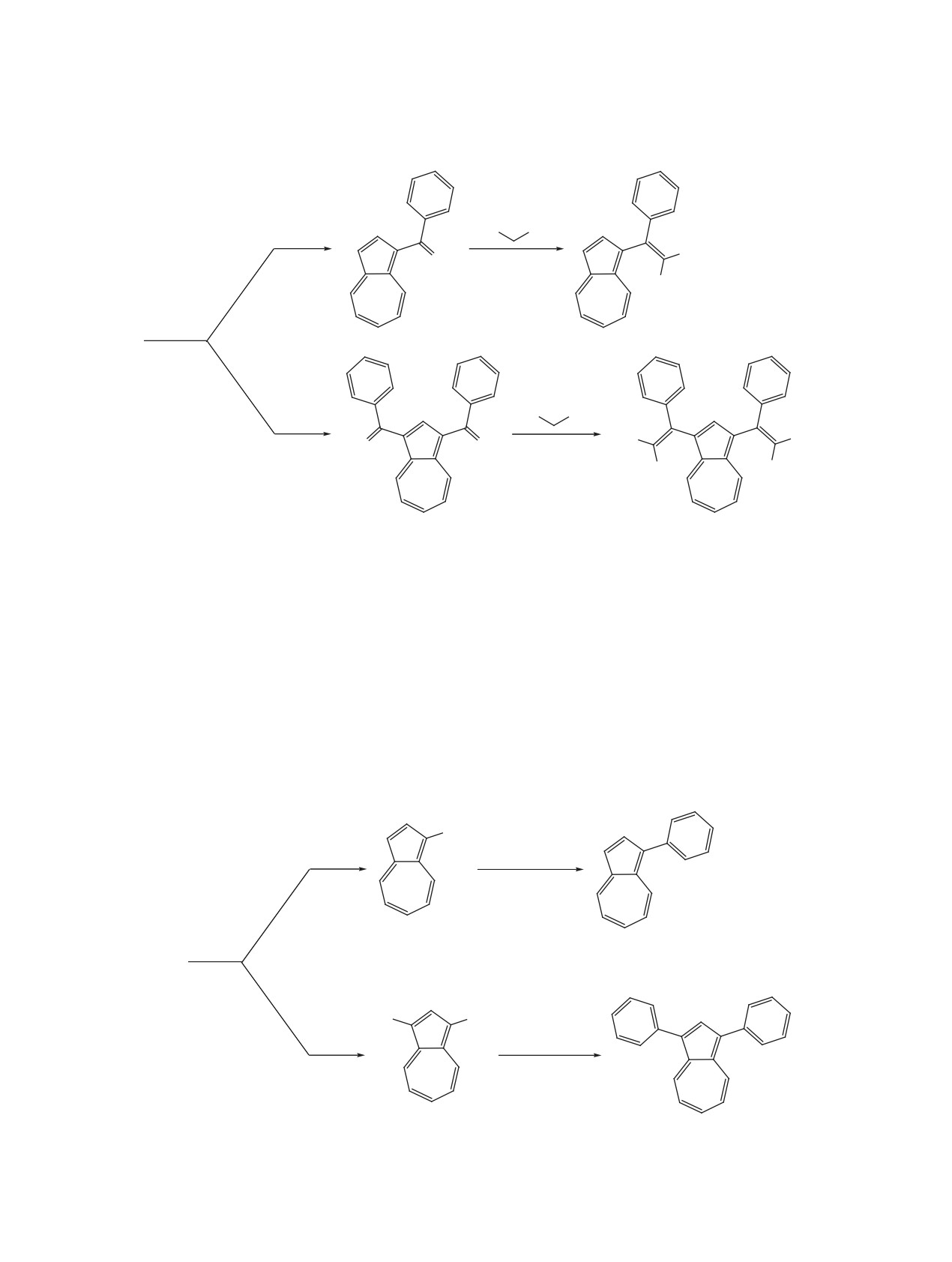
Конденсацией Кнёвенагеля азуленилкетонов с малононитрилом синтезированы π-сопряженные 1-мо-
но- и 1,3-бис(фенилдициановинил)-азулены, а также реакцией кросс-сочетания Кумады бромазуленов с
бромбензолом получены 1-моно- и 1,3-бифенилазулены. Электронные спектры дициановинилированных
азуленов показали интенсивные полосы поглощения внутримолекулярного переноса заряда в видимой
области, а также значительные батохромные смещения максимумов полос поглощения фенилазуленов.
Ключевые слова: азулен, дициановинилированные азулены, реакция Кнёвенагеля, кросс-сочетание
Кумады, π-сопряженные системы, оптические свойства, внутримолекулярный перенос заряда, батохром-
ный сдвиг
DOI: 10.31857/S0514749223050063, EDN: DQUMUM
ВВЕДЕНИЕ
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Возрастающий интерес к ароматическим со-
В продолжение исследований в области хи-
единениям с расширенной системой π-электрон-
мии азулена мы синтезировали ранее неизвестные
π-сопряженные дициановинилированные и фе-
ного сопряжения ввиду их важности в качестве
нилированные азулены и изучили их оптические
функциональных материалов для органической
свойства.
электроники в значительной степени сосредото-
чен на синтезе арилированных, а также замещен-
Для синтеза дициановинилированных произ-
ных акцепторными и/или донорными группами
водных в качестве ключевой реакции применили
бензоидных и гетероароматических соединений.
конденсацию Кнёвенагеля (схема 1). Как показано,
Однако до настоящего времени небензоидные
ацилирование азулена 1 с 1 или 2 эквивалентами
бензоилхлорида по Фриделю-Крафтсу в дихлор-
ароматические углеводороды не нашли свое-
метане региоселективно приводит к 1-моно- и
го широкого применения в качестве прекурсо-
1,3-дикетонам 2 и 3 с выходами 71 и 60% соот-
ров для синтеза новых материалов с полезными
ветственно. Далее полученные кетоны вступают
электронными свойствами. В частности, неаль-
в конденсацию с малононитрилом в присутствии
тернантный ароматический углеводород азулен 1
(см. рисунок) с уникальной дипольной струк-
8
1
7
турой может образовывать стабилизированные
2
6
ион-радикалы и представлять интерес как струк-
5
турный блок для получения новых π-сопряжен-
3
4
ных систем с оптоэлектронными свойствами [1-
1
10].
Поляризованная структура азулена 1
603
604
МЕРХАТУЛЫ и др.
Схема 1
NC
CN
1 экв
CN
O
NC
PhCOCl
2
4
1
AlCl3
NC
CN
2 экв
NC
CN
O
O
CN
NC
3
5
пиридина в ДМСО с образованием 1-моно- и
1-моно- и 1,3-дибромазуленов 6 и 7 с выходами 68
1,3-бис(фенилдициановинил)азуленов 4 и 5 в виде
и 90%, которые затем соединяются с фенилмагний
красных кристаллов с выходами 71 и 70% соответ-
бромидом в условиях сочетания Кумады в ТГФ с
ственно.
образованием 1-моно- и 1,3-бифенилазуленов 8 и
9 в виде синих кристаллов с выходами 80 и 75%
Синтез фенилированных азуленов осуществи-
соответственно.
ли по схеме 2, в качестве ключевой реакции ис-
пользовали кросс-сочетание Кумады. Так, взаимо-
Для исследования оптических свойств полу-
действие соединения 1 с одним или двумя экви-
ченных соединений проводили анализ азуленов 4,
валентами N-бромсукцинимида (NBS) в дихлор-
5, 8 и 9 с помощью абсорбционной спектрофото-
метане региоселективно приводит к получению
метрии в УФ и видимой области. УФ/ВИД спек-
Схема 2
Br
1 экв
PhMgBr THF
Pd(PPh3)4
6
8
NBS
1
Br
Br
2 экв
2PhMgBr THF
Pd(PPh3)4
7
9
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
СИНТЕЗ И ОПТИЧЕСКИЕ СВОЙСТВА π-СОПРЯЖЕННЫХ АЗУЛЕНОВ
605
Схема 3
CN
CN
NC
NC
4
NC
CN
NC
CN
NC
CN
CN
NC
CN
NC
CN
NC
5
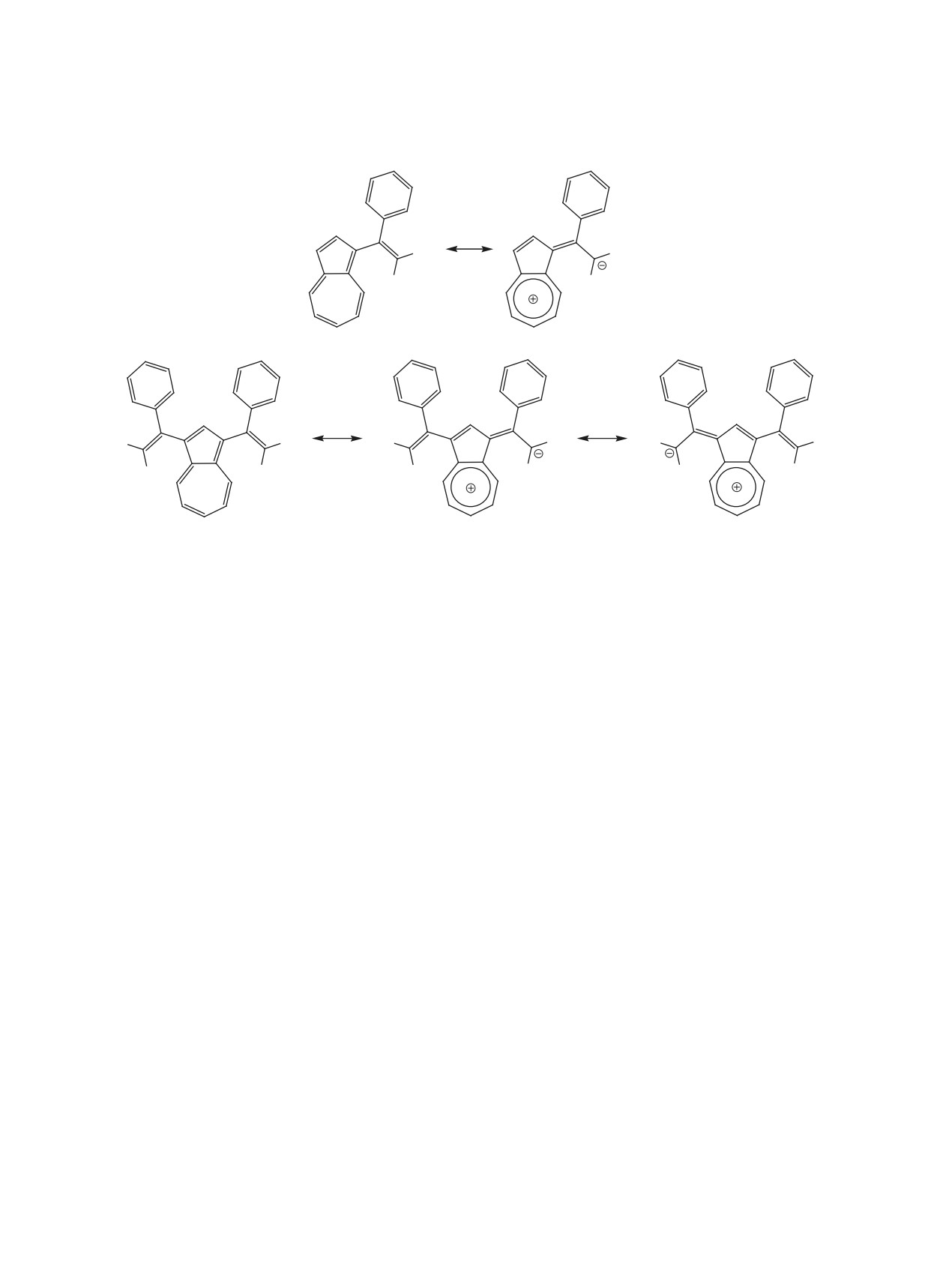
тры 4 и 5 показали интенсивные полосы поглоще-
5000 а.е. м/с). Элементный анализ выполняли на
ния в видимой области (λмакс 452 нм, ɛ 6591 и λмакс
автоматическом CHNS-анализаторе Euro Vektor
434 нм, ɛ 8186 соответственно), вызванные вну-
EA-3000 (Италия). Температуру плавления опре-
тримолекулярным переносом заряда (ВПЗ) между
деляли на приборе Melting Point M-560
азуленовым кольцом и фенилдициановинильной
(Швейцария). Для ТСХ использовали пластинки
группой, как продемонстрировано на резонансных
Sorbfil ПТСХ-АФ-УФ (Россия), элюент гексан,
структурах (схема 3). В спектрах азулена 8 (λмакс
гексан-этилацетат, проявляли насыщенным рас-
370 нм, ɛ 2456) и азулена 9 (λмакс 384 нм, ɛ 3733)
твором KMnO4. Для колоночной хроматографии
наблюдались батохромные сдвиги максимумов по-
использовали силикагель 60 (Merck).
лос поглощения на 30 и 44 нм соответственно из-
Исходные азулен (99.5%), AlCl3 (безводный
за расширения π-сопряжения в пятичленном коль-
сублимированный, ≥ 98%), Pd(PPh3)4 (≥ 99.99%),
це фенильными фрагментами.
PhMgBr (1.0 М раствор в ТГФ), NBS (99%), бензо-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
илхлорид (99%), малононитрил (≥ 99%), бромбен-
зол (≥ 99.5%), ДМСО (99.5%), ТГФ (безводный,
ИК спектры записывали на Фурье-спектромет-
≥ 99.9%), пиридин (≥ 99.0%), дихлорметан (≥ 99.8%)
ре Avatar-360 (США) в таблетках c КBr. Спектры
производства компании «Sigma-Aldrich» исполь-
ЯМР 1Н и 13С регистрировали на спектроме-
зовали без дополнительной очистки.
тре Jeol ECA-500 (Япония)
[рабочая частота
500.15 МГц] в СDCl3, внутренний стандарт - ТМС.
(Азулен-1-ил)(фенил)метанон (2). К раствору
Спектры поглощения снимали на спектрофотоме-
0.13 г (1.02 ммоль) AlCl3 в 2 мл дихлорметана при
тре Shimadzu UV-1800 (Япония) в дихлорметане
температуре -5°C в атмосфере аргона прибавляли
(С 10-5 моль/л). Масс-спектры снимали на хрома-
0.12 г (0.85 ммоль) бензоилхлорида. Реакционную
то-масс-спектрометре ShimadzuGC-MSQP-2010
смесь перемешивали в течение 30 мин, затем при-
Ultra (Япония) с ионизацией электронным ударом
бавляли раствор 0.1 г (0.78 ммоль) азулена 1 в
(энергия ионизации 70 эB, колонка GsBP-5MS:
1 мл дихлорметана. Смесь перемешивали в тече-
0.25 мкм×0.25 мм×30 м, газ-носитель гелий, мето-
ние 2 ч при комнатной температуре. После завер-
дика программируемого нагрева от 100 до 300°C,
шения реакции в реакционную колбу добавляли
режим сканирования всех целочисленных значе-
лед, затем смесь выливали в 5 мл дистиллиро-
ний в диапазоне от 15 до 900 m/z со скоростью
ванной воды и экстрагировали дихлорметаном.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
606
МЕРХАТУЛЫ и др.
Органическую фазу промывали 5%-ным раство-
тона 2 в 2 мл ДМСО при комнатной температу-
ром NaOH, водой, сушили над MgSO4, раствори-
ре в атмосфере аргона прибавляли раствор 0.1 г
тель отгоняли в вакууме. Остаток очищали коло-
(1.5 ммоль) малононитрила в 1 мл пиридина. Затем
ночной хроматографией на силикагеле (элюент
реакционную смесь перемешивали в течение
гексан-этилацетат, 9:1) и перекристаллизацией из
8 ч при температуре 107-110°С. После окончания
дихлорметана. Выход 0.13 г (71%), темно-красные
реакции ДМСО и пиридин отгоняли в вакууме.
кристаллы, т.пл. 111-112°С. ИК спектр, ν, см-1:
Остаток очищали колоночной хроматографией
1663 (С=О), 1588-1393 (С=C). Спектр ЯМР 1Н, δ,
на силикагеле (элюент гексан-этилацетат, 9:1) и
м.д.: 7.30 д (1H, H3, J 4.2 Гц), 7.48-7.52 м (2Hаром),
перекристаллизацией из дихлорметана. Выход
7.55 т (1H, H7, J 9.8 Гц), 7.56 т (1H, H5, J 9.8 Гц),
0.17 г (71%), красные кристаллы, т.пл. 149-150°С.
7.64 т (1H, H6, J 9.8 Гц), 7.83-7.86 м (3Hаром), 8.08
ИК спектр, ν, см-1: 2216 (С≡N), 1508 - 1365 (С=С).
д (1H, H2, J 4.2 Гц), 8.52 д (1H, H4, J 9.8 Гц), 9.75 д
Спектр ЯМР 1Н, δ, м.д.: 7.33 д (1H, H3, J 4.2 Гц),
(1H, H8, J 9.8 Гц).Спектр ЯМР 13С, δ, м.д.: 117.77,
7.47-7.54 м (3Hаром), 7.60-7.63 м (2Hаром), 7.66 т
125.03, 127.65, 128.21, 129.26, 129.69, 131.27,
(2H, H5,7, J 9.8 Гц), 8.01 т (1H, H6, J 9.8 Гц), 8.07 д
138.69, 139.28, 139.74, 141.39, 141.66, 142.72,
(1H, H2, J 4.2 Гц), 8.10 д (1H, H4, J 9.8 Гц), 8.15 д
145.36, 193.07 (СОPh). Масс-спектр, m/z (Iотн, %):
(1H, H8, J 9.8 Гц). Спектр ЯМР 13С, δ, м.д.: 116.08,
232 (55.00) [M]+. Найдено, %: C 87.99; H 5.19.
117.11,
120.05,
121.18,
125.25,
130.84,
131.21,
С17H12O. Вычислено, %: C 87.90; H 5.21.
132.85, 136.55, 141.17, 142.60, 145.49, 146.79,
(Азулен-1,3-диил)бис(фенилметанон) (3). К
151.18, 168.38. Масс-спектр, m/z (Iотн, %): 280
раствору 0.26 г (2.04 ммоль) AlCl3 в 3 мл дихлор-
(78.12) [M]+. Найдено, %: C 85.61; H 4.27; N 9.89.
метана при температуре -5°C в атмосфере арго-
С20H12N2. Вычислено, %: C 85.69; H 4.31; N 9.99.
на прибавляли 0.24 г (1.7 ммоль) бензоилхлори-
2,2'-[Азулен-1,3-диилбис(фенилметилиден)]-
да. Реакционную смесь перемешивали в течение
дипропандинитрил
(5).
К раствору
0.2 г
30 мин, затем прибавляли раствор
0.1 г
(0.6 ммоль) дикетона 3 в 2 мл ДМСО при комнат-
(0.78 ммоль) азулена 1 в 1 мл дихлорметана. Смесь
ной температуре в атмосфере аргона прибавляли
перемешивали в течение 2.5 ч при комнатной тем-
раствор 0.2 г (3 ммоль) малононитрила в 2 мл пи-
пературе. После завершения реакции в реакцион-
ридина. Затем реакционную смесь перемешивали
ную колбу добавляли лед, затем смесь выливали
в течение 10 ч при температуре 107-110°С. После
в 7 мл дистиллированной воды и экстрагировали
окончания реакции ДМСО и пиридин отгоняли
дихлорметаном. Органическую фазу промыва-
в вакууме. Остаток очищали колоночной хрома-
ли 5%-ным раствором NaOH, водой, сушили над
тографией на силикагеле (элюент гексан-этил-
MgSO4, растворитель отгоняли в вакууме. Остаток
ацетат, 9:1) и перекристаллизацией из дихлор-
очищали колоночной хроматографией на сили-
метана. Выход 0.18 г (70%), красные кристаллы,
кагеле (элюент гексан-этилацетат, 9:1) и пере-
т.пл. 238-239°С. ИК спектр, ν, см-1: 2218 (С≡N),
кристаллизацией из дихлорметана. Выход 0.16 г
1504-1361 (С=C). Спектр ЯМР 1Н, δ, м.д.: 7.49-
(60%), темно-красные кристаллы, т.пл. 174-175°С.
7.55 м (8Hаром), 7.61-7.64 м (2Hаром), 7.68 т (2H,
ИК спектр, ν, см-1: 1624 (С=О), 1508-1388 (С=C).
H5,7, J 9.8 Гц), 8.03 т (1H, H6, J 9.8 Гц), 8.07 с (1H,
Спектр ЯМР 1Н, δ, м.д.: 7.45-7.48 м (3Hаром),
H2), 8.15 д (2H, H4,8, J 9.8 Гц). Спектр ЯМР 13С, δ,
7.53-7.56 м (3Hаром), 7.83 уш.д (4Hаром, J 8.5 Гц),
м.д.: 114.06, 115.10, 124.05, 125.19, 129.35, 130.84,
7.90 т (2H, H5,7, J 9.8 Гц), 8.10 т (1H, H6, J 9.8 Гц),
131.21, 133.35, 136.55, 139.17, 142.70, 143.39,
8.24 с (1H, H2), 9.85 д (2H, H4,8, J 9.8 Гц). Спектр
144.79, 147.02, 155.18, 167.98. Масс-спектр, m/z
ЯМР 13С, δ, м.д.: 124.02, 128.42, 129,74, 131.96,
(Iотн, %): 432 (75.10) [M]+. Найдено, %: С 83.41; H
132.50, 136.01, 140.45, 140.85, 142.09, 145.21,
3.71; N 12.86. С30H16N4. Вычислено, %: C 83.32; H
146.95, 193.05 (СОPh). Масс-спектр, m/z (Iотн, %):
3.73; N 12.95.
336 (63.05) [M]+. Найдено, %: C 85.62; H 4.75.
С24H16O2. Вычислено, %: C 85.69; H 4.79.
1-Бромазулен (6). К раствору 0.1 г (0.78 ммоль)
[(Азулен-1-ил)(фенил)метилиден]пропан-
азулена 1 в 3 мл дихлорметана при 0°C в атмос-
динитрил (4). К раствору 0.2 г (0.86 ммоль) ке-
фере аргона добавляли 0.13 г (0.78 ммоль) NBS.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
СИНТЕЗ И ОПТИЧЕСКИЕ СВОЙСТВА π-СОПРЯЖЕННЫХ АЗУЛЕНОВ
607
Затем реакционную смесь перемешивали в тече-
9.6 Гц), 7.36 т (1Hаром, J 8.0 Гц), 7.41 д (1H, H2, J
ние 30 мин при комнатной температуре. После
3.6 Гц), 7.50 т (2Hаром, J 7.8 Гц), 7.60 т (1H, H6, J
окончания реакции растворитель отгоняли в ва-
9.6 Гц), 7.62 д (2Hаром, J 7.6 Гц), 8.04 д (1H, H3, J
кууме. Остаток очищали колоночной хроматогра-
3.6 Гц), 8.37 д (1H, H4, J 9.6 Гц), 8.58 д (1H, H8,
фией на силикагеле (элюент гексан). Выход 0.11 г
J 9.6 Гц). Спектр ЯМР 13С, δ, м.д.: 117.4, 123.0,
(68%), синее масло. ИК спектр, ν, см-1: 1578-1389
123.3, 126.2, 128.6, 129.7, 131.3, 135.2, 135.6, 137.1,
(С=C). Спектр ЯМР 1Н, δ, м.д.: 7.12 т (1H, H5, J
137.3, 137.5, 138.2, 141.7. Масс-спектр, m/z (Iотн,
9.9 Гц), 7.19 т (1H, H7, J 9.8 Гц), 7.29 д (1H, H3, J
%): 204 (100.00) [M]+. Найдено, %: C 93.99; H 5.88.
4.2 Гц), 7.56 т (1H, H6, J 9.8 Гц), 7.80 д (1H, H2, J
C16H12. Вычислено, %: C 94.08; H 5.92.
4.2 Гц), 8.19 д (1H, H4, J 9.5 Гц), 8.32 д (1H, H8, J
1,3-Дифенилазулен
(9). К раствору
0.2 г
9.8 Гц). Спектр ЯМР 13С, δ, м.д.: 104.1, 117.1, 123.4,
(0.70 ммоль) дибромазулена 7 и 0.004 г (5 мол %)
123.7, 135.4, 136.1, 137.3, 137.9, 138.8, 140.1. Масс-
Pd(PPh3)4 в 5 мл ТГФ при комнатной температу-
спектр, m/z (Iотн, %): 206 (43.10) [M]+. Найдено, %:
ре в атмосфере аргона прибавляли 1.4 мл PhMgBr
C 57.93; H 3.37. C10H7Br. Вычислено, %: C 58.00;
(1.0 М в ТГФ). Затем реакционную смесь переме-
H 3.41.
шивали в течение 3 ч при комнатной температу-
1,3-Дибромазулен
(7). К раствору
0.1 г
ре. После завершения реакции смесь выливали
(0.78 ммоль) азулена 1 в 4 мл дихлорметана
в насыщенный раствор NH4Cl и экстрагирова-
при 0°C в атмосфере аргона добавляли 0.26 г
ли дихлорметаном. Органический слой сушили
(1.56 ммоль) NBS. Затем реакционную смесь пе-
над MgSO4, растворитель отгоняли в вакууме.
ремешивали в течение 30-40 мин при комнатной
Остаток очищали колоночной хроматографией на
температуре. После окончания реакции раство-
силикагеле (элюент гексан) и перекристаллиза-
ритель отгоняли в вакууме. Остаток очищали ко-
цией из дихлорметана. Выход 0.14 г (75%), синие
лоночной хроматографией на силикагеле (элюент
кристаллы, т.пл. 117-118°С. ИК спектр, ν, см-1:
гексан) и перекристаллизацией из дихлорметана.
1626-1352 (С=C). Спектр ЯМР 1Н, δ, м.д.: 7.13 т
Выход 0.20 г (90%), синие кристаллы, т.пл. 92-
(2H, H5,7, J 9.6 Гц), 7.38 т (2Hаром, J 7.6 Гц), 7.52 т
93°С. ИК спектр, ν, см-1: 1574-1377 (С=C). Спектр
(4Hаром, J 7.6 Гц), 7.59 т (1H, H6, J 9.6 Гц), 7.66 д
ЯМР 1Н, δ, м.д.: 7.28 т (2H, H5,7, J 9.9 Гц), 7.65 т
(4Hаром, J 7.6 Гц), 8.12 с (1H, H2), 8.55 д (2H, H4,8, J
(1H, H6, J 9.8 Гц), 7.81 с (1H, H2), 8.30 д (2H, H4,8,
9.6 Гц). Спектр ЯМР 13С, δ, м.д.: 123.5, 126.5, 128.7,
J 9.9 Гц). Спектр ЯМР 13С, δ, м.д.: 102.9, 124.2,
129.9, 130.5, 136.2, 136.6, 137.1, 137.2, 139.0. Масс-
135.9, 136.8, 138.4, 140.2. Масс-спектр, m/z (Iотн,
спектр, m/z (Iотн, %): 280 (98.07) [M]+. Найдено, %:
%): 284 (53.17) [M]+. Найдено, %: С 41.92; H 2.07.
C 94.18; H 5.69. C22H16. Вычислено, %: C 94.25; H
C10H6Br2. Вычислено, %: C 42.00; H 2.11.
5.75.
1-Фенилазулен (8). К раствору 0.2 г (0.97 ммоль)
ЗАКЛЮЧЕНИЕ
бромазулена 6 и 0.005 г (5 мол %) Pd(PPh3)4 в
5 мл ТГФ при комнатной температуре в атмосфе-
Ацилированием азулена по Фриделю-Крафтсу
ре аргона прибавляли 0.97 мл PhMgBr (1.0 М в
и последующей конденсацией Кнёвенагеля азу-
ТГФ). Затем реакционную смесь перемешивали в
ленилкетонов с малононитрилом синтезированы
течение 2 ч при комнатной температуре. После за-
π-сопряженные 1-моно- и 1,3-бис(фенилдициано-
вершения реакции смесь выливали в насыщенный
винил) азулены. Кроме того, реакцией кросс-соче-
раствор NH4Cl и экстрагировали дихлорметаном.
тания Кумады моно- и дибромазуленов с реакти-
Органический слой сушили над MgSO4, раство-
вом Гриньяра получены π-сопряженные 1-моно- и
ритель отгоняли в вакууме. Остаток очищали ко-
1,3-бифенилазулены. Выявлены интенсивные
лоночной хроматографией на силикагеле (элюент
полосы поглощения ВПЗ в видимой области у
гексан) и перекристаллизацией из гексана. Выход
дициановинилазуленов с максимумами при 452 и
0.16 г (80%), синие кристаллы, т.пл. 56-57°С. ИК
434 нм, а также значительные батохромные сдви-
спектр, ν, см-1: 1626-1352 (С=С). Спектр ЯМР 1Н,
ги максимумов полос поглощения на 30 и 44 нм у
δ, м.д.: 7.15 т (1H, H5, J 9.6 Гц), 7.16 т (1H, H7, J
фенилированных азуленов.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
608
МЕРХАТУЛЫ и др.
ИНФОРМАЦИЯ ОБ АВТОРАХ
3. Xin H., Ge C., Jiao X., Yang X., Rundel K.,
McNeill C.R., Gao X. Chem. Int. Ed. 2018, 57,
1322-1326. doi 10.1002/anie.201711802
0000-0003-4588-2150
4. Shi X., Sasmal A., Soule J.-F., Doucet H. Chem. Asian
Искандеров Амантай Нурбаевич, ORCID:
J. 2018, 13, 143-157. doi 10.1002/asia.201701455
5. Zani L., Dessi A., Franchi D., Calamante M., Regina-
to G., Mordini A. Coord. Chem. Rev. 2019, 392, 177-
Жокижанова Салтанат Канатовна, ORCID:
236. doi 10.1016/j.ccr.2019.04.007
6. Ou L., Zhou Y., Wu B., Zhu L. Chin. Chem. Lett. 2019,
Кокибасова Гулмира Толепбергеновна, ORCID:
30, 1903-1907. doi 10.1016/j.cclet.2019.08.015
7. Xin H., Li J., Yang X., Gao X. J. Org. Chem. 2020, 85,
70-78. doi 10.1021/acs.joc.9b01724
КОНФЛИКТ ИНТЕРЕСОВ
8. Xin H., Li J., Lu R.-Q., Gao X., Swager T.M. J. Am.
Авторы заявляют об отсутствии конфликта ин-
Chem. Soc. 2020, 142, 13598-13605. doi 10.1021/
тересов.
jacs.0c06299
9. Xin H., Hou B., Gao X. Acc. Chem. Res. 2021, 54,
СПИСОК ЛИТЕРАТУРЫ
1737-1753. doi 10.1021/acs.accounts.0c00893
1. Dong J.-X., Zhang H.-Li. Chin. Chem. Lett. 2016, 27,
10. Lopez-Alled C.M., Park S.J., Lee D.J., Murfin L.C.,
1097-1104. doi 10.1016/j.cclet.2016.05.005
Kociok-Kohn G., Hann J.L., Wenk J., James T.D.,
2. Xin H., Ge C., Yang X., Gao H., Yang X., Gao X. Chem.
Kim H.M., Lewis S.E. Chem. Commun. 2021, 57,
Sci. 2016, 7, 6701-6705. doi 10.1039/c6sc02504h
10608-10611. doi 10.1039/d1cc04122c
Synthesis and Optical Properties of π-Conjucated Azulenes
N. Merkhatulya, *, A. N. Iskanderova, S. K. Zhokizhanovab, and G. T. Kokibasovaa
a Academician Y.A. Buketov Karaganda University,
ul. Universitetskaya, 28, Karaganda, 100028 Kazakhstan
b S. Seifullin Kazakh AgroTechnical University, prosp. Zhenis, 62, Nur-Sultan, 010000 Kazakhstan
*e-mail: merhatuly@ya.ru
Received May 12, 2022; revised May 24, 2022; accepted May 25, 2022
Knoevenagel condensation of azulenyl ketones with malononitrile synthesized π-conjugated 1-mono- and
1,3-bis(phenyl-dicyanovinyl)azulenes, and 1-mono- and 1,3-biphenylazulenes were obtained by the Kumada
cross-coupling ofbromazulenes with PhMgBr.The electronic spectra of dicyanovinylatedazulenes showed intense
absorption bands of intramolecular charge transfer in the visible region, as well as significant bathochromic
shifts of the absorption band maxima for phenylazulenes.
Keywords: azulene, dicyanovinylatedazulenes, Knoevenagel reaction, Kumada cross-coupling, π-conjugated
systems, optical properties, intramolecular charge transfer, bathochromic shift
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023