ПАРАЗИТОЛОГИЯ, 53, 1, 2019
УДК 616.9:599.4:591.531.213: (470.61)
УЧАСТИЕ ЛЕТУЧИХ МЫШЕЙ (CHIROPTERA, MAMMALIA)
И ИХ ЭКТОПАРАЗИТОВ В ЦИРКУЛЯЦИИ ВОЗБУДИТЕЛЕЙ
ПРИРОДНО-ОЧАГОВЫХ ИНФЕКЦИЙ НА ЮГЕ РОССИИ
© 2019 г. М. В. Забашта1*, М. В. Орлова2,3, Н. Л. Пичурина1,
А. П. Хаметова1, Л. В. Романова1, Т. Н. Бородина 1,
А. В. Забашта1
1 ФКУЗ Ростовский-на-Дону противочумный институт Роспотребнадзора,
ул. М. Горького, 117/40, Ростов-на-Дону, 344002 Россия
2 Томский государственный университет, ул. Ленина, 36, Томск, 634050 Россия
3 Тюменский государственный университет, ул. Володарского, 6, Тюмень, 625003 Россия
*е-mail: zabashta79@mail.ru
Поступила 04.06.2018 г.
Для определения видового состава эктопаразитов обследовано 65 особей рукокрылых 6 видов
семейства гладконосые (Chiroptera: Vespertilionidae). Собрана 521 особь членистоногих 11 видов
(гамазовых, аргасовых клещей и блох), из которых Steatonyssus noctulus и Nycteridopsylla eu-
sarca в Ростовской области выявлены впервые. В результате лабораторных исследований руко-
крылых и ассоциированных с ними эктопаразитов в Ростовской области ДНК бактерии Borellia
burgdorferi s. l., геновида Borellia afzelii, обнаружены в пробах нетопыря-карлика, малого и среди-
земноморского нетопырей, позднего кожана, Carios vespertilionis, Steatonyssus periblepharus;
р. Borellia spp. - в пробе Macronyssus flavus; Ehrlichia spp. - в пробах нетопыря-карлика
и средиземноморского нетопыря; Anaplasma fagocytophilum - в пробах рыжей вечерницы.
Впервые установлено участие рукокрылых и эктопаразитов в эпизоотическом процессе при
туляремии - ДНК Francisella tularensis выявлена в пробах нетопыря-карлика, рыжей вечерни-
цы, средиземноморского нетопыря и Cimex ex gr. pipistrelli. В материалах от рыжей вечерницы
и нетопыря-карлика впервые обнаружены маркеры вируса Конго-Крымской геморрагической
лихорадки.
Ключевые слова: эктопаразиты рукокрылых, Macronyssidae, возбудители природно-очаговых
инфекций, Borellia, Anaplasma, Ehrlichia, Francisella tularensis, крымская геморрагическая лихо-
радка, паразитарные системы.
DOI: 10.1134/S0031184719010010
Летучие мыши (Chiroptera) являются прокормителями различных групп кровосо-
сущих членистоногих, участвующих в циркуляции возбудителей бактериальных, ви-
русных и протозойных инфекций, наряду с другими группами животных способствуя
их распространению. Обитание летучих мышей в населенных пунктах в постройках
человека обусловливает их эпидемиологическое значение, как один из возможных
факторов риска инфицирования населения опасными заболеваниями.
Многочисленные исследования, проведенные в последние несколько десятилетий
в мире, показали активное участие летучих мышей и их паразитофауны в эпизоотических
3
процессах, связанных с возбудителями более чем 260 заболеваний, в том числе, имеющих
эпидемиологическую опасность: вирусов Эбола, Марбург, гриппа, бешенства, риккетсий,
коксиел., боррелий, анаплазм, эрлихий и др. (Ботвинкин, 1988; Сельникова и др., 2006;
Щелканов и др., 2012; Орлова, Кононова, 2018; Leroy et al., 2005; Walter et al., 2005;
Calisher et al., 2006; Towner et al., 2009; Mühldorfer, 2013; Melaun et al., 2014; Pfaender
et al., 2014; Veikkolainen et al., 2014; Cui et al., 2015; Moratelli, Calisher, 2015; Allocati
et al., 2016; Dietrich et al., 2016; Reeves et al., 2016).
В России и на территории стран СНГ установлено участие летучих мышей и ассоции-
рованных с ними аргасовых клещей в циркуляции вирусов бешенства, Иссык-Куль, Со-
кулук, Узун-Агач, бактерий р. Bartonella, Brucella, Leptospira и др. (Ботвинкин, 1988;
Сельникова и др., 2006; Альховский и др., 2013, 2014; Львов и др., 2014а, 2014б; Botvinkin
et al., 2003; Bai et al., 2017; Urushadze et al., 2017). На юге Европейской части России из-
учение роли летучих мышей и их специфической паразитофауны в циркуляции вирусных
и бактериальных патогенов ранее не проводили, за исключением исследований на лисса-
вирусы, обнаруженные в пробах мозга длиннокрыла Miniopterus schreibersi на Западном
Кавказе (Botvinkin et al., 2003).
В Ростовской и Астраханской областях для определения специфической фауны парази-
тов нами проведены осмотр и очес рукокрылых. Также в Ростовской области проведены
лабораторные исследования летучих мышей и их эктопаразитофауны с целью детализа-
ции возможных схем циркуляции и выявления новых компонентов паразитарных систем
природно-очаговых инфекций. В исследование включены преимущественно синантроп-
ные виды рукокрылых (нетопыри Pipistrellus spp., рыжая вечерница Nyctalus noctula
(Schreber, 1774)), как представляющие наибольшую опасность для населения.
МАТЕРИАЛ И МЕТОДИКА
Материал был собран в 2015-2017 гг., места сбора представлены в табл. 1.
Сбор эктопаразитов производился при помощи иглы и пинцета, членистоногих фик-
сировали в 70 %-ном растворе этанола. При изготовлении постоянных препаратов кле-
щей заключали в жидкость Фора-Берлезе, блох просветляли в 10 %-ном водном рас-
творе KOH и также помещали в жидкость Фора-Берлезе (Whitaker, 1988). Определение
клещей и насекомых производилось при помощи светового микроскопа Nikon Eclipse
50i с использованием определителей и других таксономических публикаций (Медве-
дев, 1996; Theodor, 1967; Stanyukovich, 1997). Всего для определения фаунистического
состава и проведения лабораторных исследований собрано 612 особей членистоногих
(гамазовые и аргасовые клещи, блохи, клопы). Индекс обилия (MI) рассчитывался как
среднее количество эктопаразитов на одном зараженном хозяине, индекс встречаемо-
сти (P) рассчитывался как доля зараженных особей.
При эпизоотологическом мониторинге на наличие возбудителей иксодовых клещевых
боррелиозов (ИКБ), моноцитарного эрлихиоза человека (МЭЧ), гранулоцитарного ана-
плазмоза человека (ГАЧ), туляремии, Крымской геморрагической лихорадки (КГЛ), лихо-
радки Западного Нила (ЛЗН), вирусного клещевого энцефалита (ВКЭ), геморрагической
лихорадки с почечным синдромом (ГЛПС) и лихорадки Батаи исследованы летучие мыши
(пробы мозга) и их специфическая паразитофауна, собранные в Ростове-на-Дону и на юге
Ростовской области (Азовский район) (табл. 3). Лабораторные исследования проб полево-
4
Таблица 1. Места отловов летучих мышей и сбора эктопаразитов юга России
Географи-
Дата отловов, вид животного
№
Локалитет
ческие
Ландшафт
и количество собранных
координаты
особей
Ростовская область
1.
Ростов-на-Дону
47°16ʹ N
Черта города
23.XI.2015 N. noctula (14)
39°49ʹ E
22.VII.2016 P. kuhlii (2)
24 III 2017 N. noctula (1)
13.VIII.2017 P. kuhlii (1)
28.VIII.2017 P. kuhlii (1)
7.IX.2017 P. kuhlii (1)
13.XI.2017 P. kuhlii (2)
2.
Азовский район, Ленин-
46°45ʹ N
Искусственный
2.VII.2016 P. pipistrellus (10)
ский лесхоз
39°08ʹ E
лесной массив
23.VII.2016 E. serotinus (2)
9.VII.2017 P. pygmaeus (3)
28.VI.2017 P. pipistrellus (9)
13.VIII.2017 P. pipistrellus (3)
3.
Шолоховский район, ста-
49°37ʹ N
Пойменные
1-5.VI.2015 P. kuhlii (1),
ница Вешенская
41°43ʹ E
заросли
P. nathusii (8), P. pipistrellus (3)
Астраханская область
4.
Астрахань
46°20ʹ N
Черта города
29.VII.2017 P. kuhlii (24)
48°02ʹ E
5.
Астраханский ордена
45°34ʹ N
Пойменные
2.VIII.2017 P. kuhlii (1)
Трудового Красного
47°54ʹ E
заросли
Знамени государствен-
ный природный био-
сферный заповедник
го материала на наличие ДНК возбудителей ИКБ, МЭЧ, ГАЧ, туляремии проводили с по-
мощью полимеразной цепной реакции (ПЦР) с использованием тест-систем производства
ООО «Лаборатории «Изоген»: ПЦР наборы на ДНК возбудителей Borellia spp., Borellia
burdorferi s. l. (B. burdorferi, B. garinii, B. afzelii), Borellia afzelii, Anaplasma fagocytoph-
ilum; АмплиСенс TBEV, B. burdorferi s. l., A. phagocytophilum, Ehrlichia chaffeensis/
E. muris; GenPak DNA PCR наборы реагентов для амплификации ДНК Ehrlichia sрр.,
E. muris/Yamaguchi, ДНК Francisella (tularensis+holarctica). Исследования на наличие
антигенов вирусов ККГЛ, ЛЗН, КЭ, ГЛПС и лихорадки Батаи проводили методом им-
муноферментного анализа (ИФА) с использованием наборов для постановки ИФА про-
изводства АО «Вектор-Бест»: ВектоКрым-КГЛ-антиген, ВектоВКЭ-антиген; производ-
ства ЗАО БТК «Биосервис», БиоСкрин-ВЗН комплект AG, БиоСкрин-Батаи комплект
AG, БиоСкрин-КЭ комплект AG, набор реагентов «ХАНТАГНОСТ» производства
ФГУП «Предприятие по производству бактерийных и вирусных препаратов Института
полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН».
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фауна эктопаразитов летучих мышей изучаемой территории
Для исследования видового состава эктопаразитов обследовано 65 особей руко-
крылых 6 видов семейства гладконосые (Chiroptera: Vespertilionidae), с которых собрана
521 особь членистоногих (клещей и насекомых) (табл. 2).
5
Таблица 2. Эктопаразиты летучих мышей юга России
Вид хозяина
Вид
Ареал;
паразита
хозяева
Acari: Ixodida: Argasidae
Carios vespertilionis
-
-
-
-
-
4
4
Палеарктическая, Афро-
1.3
тропическая, Индо-Ма-
9
лайская и Австралий-
ская области
Mesostigmata: Gamasina: Spinturnicidae
Spinturnix acuminatus
-
4
-
-
-
-
4
Западно-центрально-пале-
2
арктический субборе-
33
альный
S. myoti
-
1
-
-
-
-
1
Палеарктика от Велико-
1
британии до Дальнего
17
Востока и на юг до Сре-
диземноморья, включая
Северную Африку
Macronyssidae
Macronyssus flavus
-
42
-
-
-
-
42
Транспалеарктический
14
суббореальный
50
M. kolenatii
-
-
5
5
5
1
16
Западно-центрально-пале-
1.3
1.3
1
1
арктический бореально-
50
50
50
3
суббореальный
Steatonyssus noctulus
-
6
-
-
-
-
6
Западно-центрально-пале-
3
арктический субборе-
33
альный
St. periblepharus
1
-
172
66
32
117
388
Транспалеарктический
24.6
9.4
8
5
бореально-суббореаль-
87
88
40
72
ный
Insecta: Siphonaptera: Ischnopsyllidae
Nycteridopsylla
-
9
-
-
-
-
9
Западно-палеарктический
eusarca
9
суббореальный
17
6
Таблица 2 (продолжение)
Вид хозяина
Вид
Ареал;
паразита
хозяева
Ischnopsyllus elongatus
-
1
-
-
-
-
1
Транспалеарктический
1
суббореальный
17
Ischn. octactenus
-
-
-
-
5
8
13
Западно-палеарктический
1.7
1.6
бореально-суббореаль-
30
16
ный
Ischn. variabilis
-
-
30
4
3
-
37
Западно-палеарктический
5
4
1
бореально-суббореаль-
75
13
30
ный
Итого
1
63
207
75
45
130
521
16
29.6
10.7
5.6
4.2
67
87
100
80
97
П р и м е ч а н и е : Цифра в первой строке - абсолютное значение, во второй - MI, в третьей - P (%).
Поздний кожан Eptesicus serotinus Schreber, 1774
С одной обследованной особи собран единственный экземпляр (N1) гамазового кле-
ща Steatonyssus periblepharus Kolenatii 1858 (Ленинский лесхоз, 10.VIII.2016).
Рыжая вечерница Nyctalus noctula (Schreber, 1774)
С обследованных шести особей собрано 4 вида клещей и 2 вида насекомых.
Spinturnix acuminatus (C.L. Koch, 1836): ♀ (Ростов-на-Дону, 23.XI.2015); 3 ♀ (Ро-
стов-на-Дону, 10.VIII.2016).
Spinturnix myoti Kolenati, 1856: ♀ с внутриутробной личинкой (Ростов-на-Дону,
10.VIII.2016).
Macronyssus flavus (Kolenati, 1856): 3 ♀ (в том числе 2 с внутриутробной личинкой)
(Ростов-на-Дону, 23.XI.2015); 2 N1 (Ростов-на-Дону, 10.VIII.2016); 19 ♀ (все с вну-
триутробной личинкой), 6 ♂, 12 N1 (Ростов-на-Дону, 24.III.2017).
Steatonyssus noctulus Rybin, 1992: ♀ и 3 ♂ (Ростов-на-Дону, 10.VIII.2016); 2 ♂ (Ро-
стов-на-Дону, 24.III.2017). Для Ростовской области вид отмечен впервые.
Ischnopsyllus elongatus (Curtis, 1832): ♂ (Ростов-на-Дону, 23.XI.2015).
Nycteridopsylla eusarca Dampf, 1908: 6 ♀, 3 ♂ (Ростов-на-Дону, 23.XI.2015). Для Ро-
стовской области вид отмечен впервые.
7
Нетопырь Натузиуса Pipistrellus nathusii (Keyserling, Blasius, 1839)
На 8 экземплярах данного вида обнаружено 2 вида гамазовых клещей и 1 вид насе-
комых.
Macronyssus kolenatii (Oudemans, 1902): ♀ с внутриутробной личинкой, 2 ♂, 2 N1
(ст. Вешенская, 1.VI.2015).
Steatonyssus periblepharus: 52 ♀ (в том числе 13 с внутриутробным яйцом), 22 ♂,
98 N1 (ст. Вешенская, 1.VI.2015).
Ischnopsyllus variabilis Wagner, 1898: 27 ♀, 3 ♂ (ст. Вешенская, 1.VI.2015).
Нетопырь-карлик Pipistrellus pipistrellus (Schreber, 1774)
Обследовано 8 особей нетопыря-карлика, с которых собрано 2 вида гамазовых кле-
щей и 1 вид насекомых.
Macronyssus kolenatii: 3 ♀ (одна с внутриутробной личинкой) (Ленинский лесхоз,
2.VII.2017); ♀ с внутриутробной личинкой (Ленинский лесхоз, 9.VII.2017), N1 (ст. Ве-
шенская, 1.VI.2015).
Steatonyssus periblepharus: ♀, ♂, 9 N1 (ст. Вешенская, 1.VI.2015); 5 ♀ (одна с вну-
триутробной личинкой), 2 ♂, 44 N1 (Ленинский лесхоз, 2.VII.2017); 2 ♀, 2 N1 (Ленин-
ский лесхоз, 9.VII.2017).
Ischnopsyllus variabilis: 4 ♀ (ст. Вешенская, 1.VI.2015).
Малый нетопырь Pipistrellus pygmaeus Leach, 1825
С 10 осмотренных особей малого нетопыря собрано 2 вида гамазовых клещей и
2 вида насекомых.
Macronyssus kolenatii: 3 ♀ (в том числе 2 с внутриутробной личинкой), N1 (Ленинский
лесхоз, 3.VII.2016); ♀ с внутриутробной личинкой (Ленинский лесхоз, 9.VII.2017).
Steatonyssus periblepharus: 4 ♀ (две с внутриутробной личинкой), N1 (Ленинский
лесхоз, 3.VI. 2016); ♀, ♂, 25 N1 (Ленинский лесхоз, 9.VII.2017).
Ischnopsyllus variabilis: 2 ♀, ♂ (Ленинский лесхоз, 3.VII.2016).
Ischnopsyllus octactenus (Kolenati, 1856): ♂ (Ленинский лесхоз, 28.VI.2017); ♀, ♂ (Ле-
нинский лесхоз, 2.VII.2016); 2 ♀ (Ленинский лесхоз, 9.VII.2016).
Средиземноморский нетопырь Pipistrellus kuhlii (Kuhl, 1817)
С 32 обследованных особей собран 1 вид аргасового клеща, 2 вида гамазовых кле-
щей, 1 вид блохи.
Carios vespertilionis Latreille, 1796: 3 L (Астрахань, 29.VII.2017); L (Астраханский
заповедник, 2.VIII.2017).
Macronyssus kolenatii: ♀ (Ростов-на-Дону, 13.VIII.2017).
Steatonyssus periblepharus: 6 ♀, 3 ♂, 5 N1 (ст. Вешенская, 1.VI.2015); 30 ♀, 4 ♂, 26 N1
(Астрахань, 29.VII.2017); 3 N1 (Астраханский заповедник, 2.VIII.2017); ♀, 4 ♂, 3 N1
(Ростов-на-Дону, 13.VIII.2017); ♂, 31 N1 (Ростов-на-Дону, 13.XI.2017).
Ischnopsyllus octactenus: 2 ♀ (Ростов-на-Дону, 2.VII.2017); ♀, 3 ♂ (Ростов-на-Дону,
13.VIII.2017); ♀ (Ростов-на-Дону, 7.IX.2017); ♀ (Ростов-на-Дону, 13.XI.2017).
8
Лабораторные исследования рукокрылых и эктопаразитов
Для определения возможного участия в циркуляции возбудителей природно-очаговых
инфекций в Ростовской области было исследовано пять видов летучих мышей и пять ви-
дов эктопаразитов (табл. 3). Рыжая вечерница и средиземноморский нетопырь были со-
браны и осмотрены на наличие паразитов в восточной части Ростова-на-Дону. Поздние
кожаны были пойманы в охотничьей вышке, расположенной в искусственном лесу на юге
области, в Азовском районе.
Нетопыри-карлики и малые нетопыри были отловлены в смешанной выводковой ко-
лонии, обнаруженной в другой охотничьей вышке в том же лесном массиве. Появление
нетопырей на колонии происходит в конце апреля. В дальнейшем здесь происходит их
размножение и к концу июня - началу июля общая численность обоих видов нетопы-
рей составляет в разные годы 150-300 особей. Молодые особи нетопырей размеща-
лись в пространстве под крышей и рубероидной обивкой вышки. Со стен, из-под рубе-
роида и с рукокрылых этой колонии были собраны различные группы эктопаразитов
(гамазовые и аргасовые клещи, блохи, клопы).
Все исследованные рукокрылые относятся к обычным, а в некоторых районах - к
многочисленным видам региона (Газарян и др., 2010).
При исследовании летучих мышей на наличие возбудителей бактериальной природы
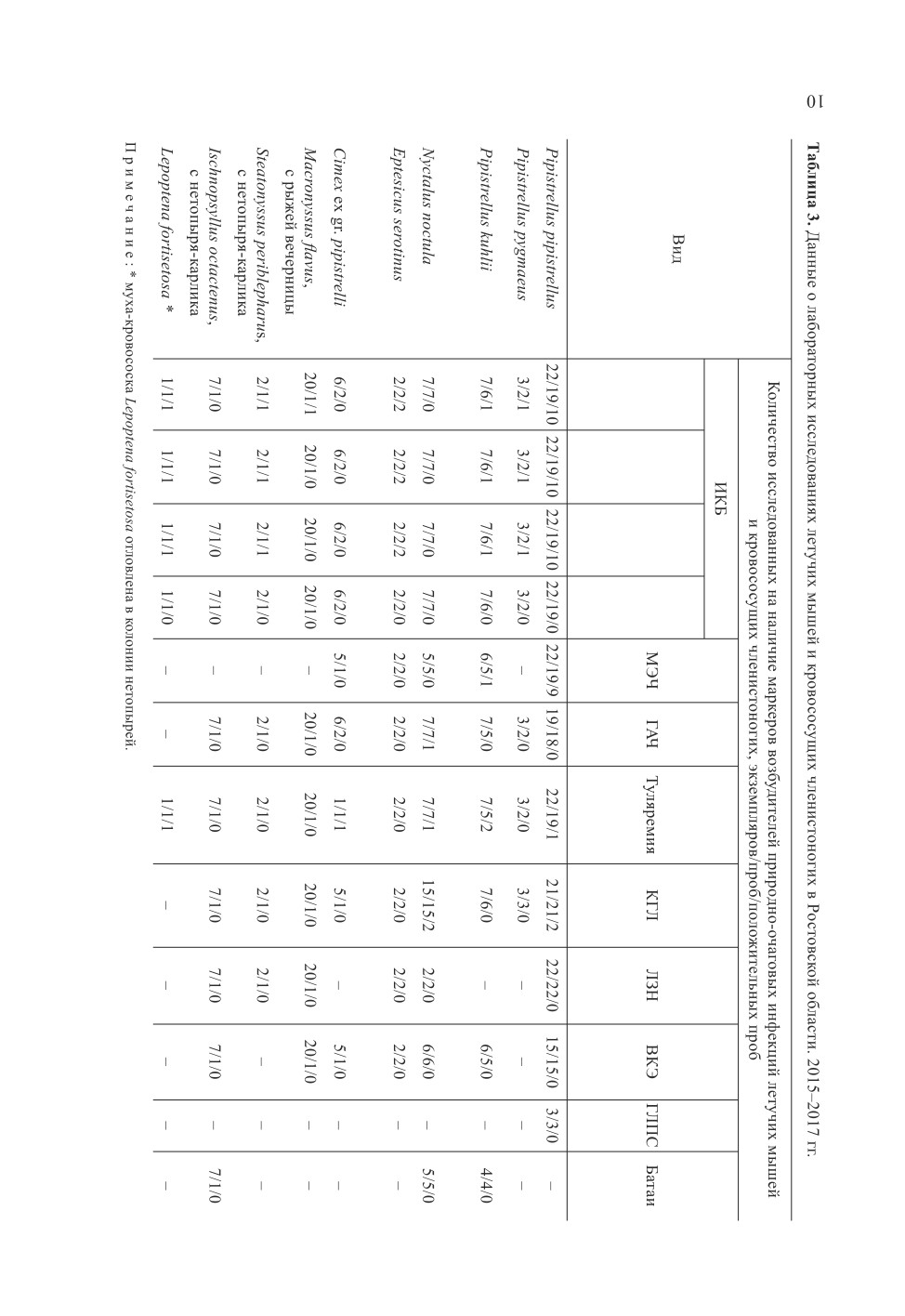
получены следующие результаты (табл. 3).
ДНК бактерии р. Borellia были обнаружены в 18 (40.9 %) пробах мозга из 44 проб
летучих мышей и их эктопаразитов. При исследованиях, направленных на определение
вида возбудителя, установлено, что в положительных пробах преобладают бактерии
Borellia burgdorferi s.l., геновида Borellia afzelii, которая была выявлена в десяти пробах
мозга (52.6 %) нетопыря-карлика, в двух пробах позднего кожана, личинок и имаго
C. vespertilionis, собранных в выводковой колонии, а также в одной пробе каждо-
го вида - средиземноморского нетопыря, малого нетопыря, и гамазовых клещей
S. periblepharus, снятых с нетопыря-карлика. В единичной пробе Macronyssus flavus,
собранных с рыжей вечерницы, выявлена ДНК Borellia spp. Участие летучих мышей
и их эктопаразитов в циркуляции боррелий показано в зарубежных работах (Hubbard
et al., 1998; Mühldorfer, 2013; Socolovschi et al., 2012; Cutler et al., 2016).
При исследовании пяти видов летучих мышей на наличие возбудителей МЭЧ и
ГАЧ - в пробах мозга нетопыря-карлика и средиземноморского нетопыря были обна-
ружены ДНК Ehrlichia spp. (47.4 % и 20.0 %, соответственно), а в одной пробе из семи
проб мозга рыжей вечерницы - ДНК Anaplasma fagocytophilum. В литературе имеются
данные об участии в циркуляции эрлихий и анаплазм аргасовых клещей, паразитов
летучих мышей (Mühldorfer, 2013; Socolovschi et al., 2012; Lv et al., 2018).
В результате исследований материала на наличие ДНК возбудителя туляремии впер-
вые обнаружено присутствие F. tularensis в пробах мозга нетопыря-карлика (5.3 %),
рыжей вечерницы (14.3 %), в двух пробах из пяти средиземноморского нетопыря,
а также в единичной пробе клопов Cimex ex gr. pipistrelli. Анализ литературных данных
показал, что при исследованиях рукокрылых и их специфической паразитофауны на
наличие F. tularensis, проведенных ранее, возбудитель туляремии выявлен не был.
9
р. Borellia
Borellia
burgdorferi s. l.
Borellia afzelii
Borellia garinii
Отдельно следует отметить, что в колонии нетопырей был отловлен один экземпляр
мухи-кровососки Lepoptena fortisetosa - паразита крупных копытных, в пробе которой
была обнаружена микст-инфицированность B. afzelii и F. tularensis.
При лабораторных исследованиях на наличие антигенов вирусных природно-оча-
говых инфекций методом ИФА впервые выявлены маркеры вируса Крым-Конго ге-
моррагической лихорадки в пробах мозга рыжей вечерницы (9.5 % положительных
проб) и нетопыря карлика (13.3 % положительных проб). По данным Müller с соавто-
рами (2016), исследования проб сывороток крови летучих мышей проводили в странах
Центральной Африки (республики Гана, Конго, Габон) и Америки (Панама), Западной
Европы (Германия), в результате которых маркеры вируса ККГЛ были обнаружены
в пробах африканских летучих мышей, собранных в Габоне и Конго.
Исследования летучих мышей, проведенные нами на другие вирусы (ЛЗН, ВКЭ,
ГЛПС, Батаи), дали отрицательные результаты.
Таким образом, в результате проведенных исследований определена паразитофа-
уна шести видов рукокрылых юга России. Она представлена 11 видами, из которых
Steatonyssus noctulus и Nycteridopsylla eusarca выявлены впервые в Ростовской обла-
сти. При проведении лабораторных исследований на юго-западе Ростовской области
получены данные, указывающие на возможную циркуляцию возбудителей клещевых
боррелиозов, анаплазмоза, эрлихиоза, туляремии и Крымской геморрагической лихо-
радки в популяциях рукокрылых посредством их специфичной паразитофауны, что
может косвенно свидетельствовать о значении летучих мышей и их эктопаразитов
в функционировании и поддержании паразитарных систем по другим, отличным от
классических представлений схемам циркуляции. Следует отметить, что нами впервые
обнаружена ДНК возбудителя туляремии в пробах летучих мышей и клопов. Полу-
ченные данные об обнаружении ДНК F. tularensis и антигена вируса ККГЛ в пробах
мозга летучих мышей указывают на их возможную роль в сохранении возбудителя,
в качестве нового компонента паразитарной системы при указанных инфекциях. Взаи-
моотношения летучих мышей, ассоциированных с ними эктопаразитов и возбудителей
природно-очаговых инфекций, требуют дальнейшего изучения.
БЛАГОДАРНОСТИ
Авторы признательны администрации Астраханского ГПБЗ (и лично к.б.н. И.В. Со-
коловой), а также А.П. Головановой (Си-Эй-Си Городской центр экспертиз, Санкт-Пе-
тербург) за содействие при проведении полевых работ. Результаты исследования по-
лучены при поддержке Программы повышения конкурентоспособности НИ Томского
государственного университета, а также при выполнении НИР № 189-1-17 «Биоце-
нотическая структура природного и антропургического очагов лихорадки Западного
Нила и других арбовирусных инфекций в Ростовской области» в Ростовском-на-Дону
противочумном институте.
СПИСОК ЛИТЕРАТУРЫ
Альховский С.В., Львов Д.К., Щелканов М.Ю., Дерябин П.Г., Щетинин А.М., Самохвалов Е.И.,
Аристова В.А., Гительман А.К., Ботиков А.Г. 2014. Генетическая характеристика вируса Узун-Агач
(UZAV - Uzun-Agach virus) (Bunyaviridae, Nairovirus), изолированного в Казахстане от остроухой ноч-
ницы Myotis blythii oxygnathus Monticelli, 1885 (Chiroptera; Vespertilionidae). Вопросы вирусологии
59 (5): 23-6.
Альховский С.В., Львов Д.К., Щелканов М.Ю., Щетинин А.М., Дерябин П.Г., Самохвалов Е.И., Гитель-
ман А.К., Ботиков А.Г. 2013. Таксономия вируса Иссык-Куль (Issyk-Kul virus, ISKV; Bunyaviridae,
11
Nairovirus), возбудителя Иссык-кульской лихорадки, изолированного от летучих мышей (Vesper-
tilionidae) и клещей Argas (Carios) vespertilionis (Latreille, 1796). Вопросы вирусологии 58 (5): 11-15.
Ботвинкин А.Д. 1988. Вирус бешенства выделен от летучей мыши в Западной Сибири. Журнал микробиоло-
гии, эпидемиологии и иммунобиологии 7: 97-98.
Газарян С.В., Бахтадзе Г.Б., Малиновкин А.В. 2010.Современное состояние изученности рукокрылых Ро-
стовской области. Plecotus et al., т. 3, с. 50-58.
Львов Д.К., Альховский С.В., Щелканов М.Ю., Щетинин A.M., Дерябин П.Г., Гительман А.К., Самохвалов
Е.И., Ботиков А.Г. 2014а. Таксономия вируса Сокулук (SOKV - Sokuluk virus) (Flaviviridae, Flavivirus,
антигенный комплекс летучих мышей Энтеббе), изолированного в Киргизии от летучих мышей не-
топырей-карликов (Vespertilio pipistrellus Schreber, 1774), аргасовых клещей (Argasidae Koch, 1844)
и птиц. Вопросы вирусологии 59 (1): 30-34.
Львов Д.К., Альховский С.В., Щелканов М.Ю., Щетинин А.М., Аристова В.А., Гительман А.К.,
Дерябин П.Г., Ботиков А.Г. 2014б. Таксономия ранее негруппированного вируса Тамды (TAMV -
Tamdy virus) (Bunyaviridae, Nairovirus), изолированного от иксодовых клещей Hyalomma asiaticum
asiaticum Schulce et Schlottke, 1929 (Ixodidae, Hyalomminae) в Средней Азии и Закавказье. Вопросы
вирусологии 59 (2): 15-22.
Медведев С.Г. 1996. Блохи сем. Ischnopsyllidae (Siphonaptera) фауны России и сопредельных стран. Энтомо-
логическое обозрение 75 (2): 438-454.
Орлова М.В., Кононова Ю.В. Возбудители инфекционных заболеваний, ассоциированных со специфичными
эктопаразитами рукокрылых (Chiroptera) (обзор литературных данных). 2018. Паразитология 52 (2):
137-153.
Сельникова О.П., Антонова Л.А., Моисеева А.В., Ботвинкин А.Д. 2006. Случай бешенства у человека
в Украине, связанный с укусом летучей мыши. Эпидемиология и инфекционные болезни 5: 55-56.
Щелканов М.Ю., Львов Д.К. 2012. Новый субтип вируса гриппа А от летучих мышей и новые задачи эколо-
го-вирусологического мониторинга. Вопросы вирусологии 1: 159-168.
Allocati N., Petrucci A.G., Giovanni P.Di., Masulli M., Ilio C.Di., Laurenzi V.De. 2016. Bat-man disease transmis-
sion: zoonotic pathogens from wildlife reservoirs to human populations. Cell Death Discovery 2: 16048.
Bai Y., Urushadze L., Osikowicz L., McKee C., Kuzmin I., Kandaurov A., Babuadze G., Natradze I., Imnadze
P., Kosoy M. 2017. Molecular Survey of Bacterial Zoonotic Agents in Bats from the Country of Georgia
(Caucasus). PLoS One 12 (1): e0171175.
Botvinkin A.D., Poleschuk Elena M., Kuzmin I.V., Borisova T.I., Gazaryan S.V., Yager P., Rupprecht C.E. 2003.
Novel Lyssaviruses Isolated from Bats in Russia. Emerg. Infect. Dis. 9 (12): 1623-1625.
Calisher C.H., Childs J.E., Field H.E., Holmes K.V., Schountz T. 2006. Bats: Important Reservoir Hosts of Emerging
Viruses. Clin. Microbiol. Rev. 19 (3): 531-545.
Cui J., Tachedjian G., Wang L.-F. 2015. Bats and Rodents Shape Mammalian Retroviral Phylogeny. Sci. Rep. 5:
16561.
Cutler S., Ruzic-Sabljic E, Potkonjak A. 2016. Emerging borreliae - Expanding beyond Lyme borreliosis. Molecular
and Cellular Probes 31. doi: 10.1016.
Dietrich M., Tjale M.A., Weyer J., Kearney T., Seamark E.C.J., Nel L.H., Monadjem A., Markotter W. 2016. Diver-
sity of Bartonella and Rickettsia spp. in Bats and Their Blood-Feeding Ectoparasites from South Africa and
Swaziland. PLoS One 11 (3): e0152077.
Hubbard M.J., Baker A.S., Cann K.J. 1998. Distribution of Borrelia burgdorferi s.l. spirochaete DNA in British
ticks (Argasidae and Ixodidae) since the 19th century, assessed by PCR. Med. Vet. Entomol. 12 (1): 89-97.
Leroy E.M., Kumulungui B., Pourrut X., Rouquet P., Hassanin A., Yaba P. 2005. Fruit bats as reservoirs of Ebola
virus. Nature 438: 575-576.
Lv J., Fernández de Marco M.D.M., Goharriz H., Phipps L.P., McElhinney L.M., Hernández-Triana L.M., Wu S.,
Lin X., Fooks A.R., Johnson N. 2018. Detection of tick-borne bacteria and babesia with zoonotic potential
in Argas (Carios) vespertilionis (Latreille, 1802) ticks from British bats. Sci Rep. 8 (1): 1865.
Melaun C., Werblow A., Bus h M.W., Liston A., Klimpel S. 2014. Bats as potential reservoir hosts for vector-borne
diseases. In: Klimpel S., Mehlhorn H. (eds). Bats (Chiropera) as vectors of diseases and parasites: facts and
myths. Parasitology Research Monographs 5, 187 pp.
Moratelli R., Calisher C.H. 2015. Bats and zoonotic viruses: can we confidently link bats with emerging deadly
viruses? Mem. Inst. Oswaldo Cruz. 110 (1): 1-22.
Mühldorfer K. 2013. Bats and bacterial pathogens: a review. Zoonoses Public Health. 60 (1): 93-103.
Müller M.A., Devignot S., Lattwein E., Corman V.M., Maganga G.D., Gloza-Rausch F., Binger T., Vallo P.,
Emmerich P., Cottontail V.M., Tschapka M., Oppong S., Drexler J.F, Weber F., Leroy E.M., Drosten C. 2016.
Evidence for widespread infection of African bats with Crimean-Congo hemorrhagic fever-like viruses. Sci
Rep. 6: 26637.
12
Pfaender S., Brown R.J.P, Pietschmann T., Steinmann E. 2014. Natural reservoirs for homologs of hepatitis C virus.
Emerg. Microbes Infect. 3 (3): e21.
Reeves W.K., Beck J., Orlova M.V., Daly J.L., Pippin K., Revan F., Loftis A.D. 2016. Ecology of bats, their
ectoparasites, and associated pathogens on Saint Kitts island. Journal of Medical Entomology 53 (5):
1218-1225.
Socolovschi C., Kernif T., Raoult D., Parola P. 2012. Borrelia, Rickettsia, and Ehrlichia Species in Bat Ticks, France,
2010. Emerging infectious diseases 18: 1966-1975.
Stanyukovich M.K. 1997. Keys to the gamasid mites (Acari: Parasitiformes, Mesostigmata, Macronyssoidea
et Laelaptoidea) parasiting bats (Mammalia, Chiroptera) from Russia and adjacent countries. Rudolstadter
naturhistorische Schriften. 7: 13-46.
Theodor O. 1967. An illustrated catalogue of the Rothschild collection of Nycteribiidae (Diptera)in the British
Museum (Natural History) with Keys and Short Descriptions for the Identification of Subfamilies, Genera,
Species and Subspecies, with an Introduction by Miriam Rothschild. Trust British National History Museum,
506 pp.
Towner J.S., Amman B.R., Sealy T.K., Carroll S.A., Comer J.A., Kemp A. 2009. Isolation of genetically diverse
Marburg viruses from Egyptian fruit bats. PLoS Pathog. 5: e1000536.
Urushadze L., Bai Y., Osikowicz L., McKee C., Sidamonidze K., Putkaradze D., Imnadze P., Kandaurov A., Kuzmin
I., Kosoy M. 2017. Prevalence, diversity, and host associations of Bartonella strains in bats from Georgia
(Caucasus). PLoS Negl. Trop. Dis. 11 (4): e0005428.
Veikkolainen V., Vesterinen E.J., Lilley T.M., Pulliainen A.T. 2014. Bats as reservoir hosts of human bacterial
pathogen, Bartonella mayotimonensis. Emerg. Infect. Dis. 20.
Walter D.E., Shaw M. 2005. Mites and disease. In: Marquardt W. C. (ed.), Biology of Disease Vectors. Elsevier
Academic Press, Amsterdam, pp. 25-44.
Whitaker J.O. 1988. Collecting and preserving ectoparasites for ecological study. Ecological and Behavioral
Methods for the Study of Bats. T. H. Kunz (ed.). Washington: Smithsonian Institution Scholarly Press,
pp. 459-474.
PARTICIPATION OF BATS (CHIROPTERA, MAMMALIA)
AND THEIR ECTOPARASITES IN THE CIRCULATION
OF PATHOGENS OF NATURAL FOCAL INFECTIONS
IN THE SOUTH OF RUSSIA
М. V. Zabashta, М. V. Orlova, N. L. Pichurina, А. P. Khametova, L. V. Romanova,
T. N. Borodina, А. V. Zabashta
Key words: ectoparasites of bats, Macronyssidae, pathogens of natural focal infections, Borellia,
Anaplasma, Ehrlichia, Francisella tularensis, Crimean-Congo hemorrhagic fever, parasitic
systems.
SUMMARY
To determine the species composition of ectoparasites, 65 individuals of the bats of six species
of the smooth-nosed family (Chiroptera: Vespertilionidae) were examined. 521 specimens of
arthropods of 11 species (the Gamasoidea and Argasidae mites, fleas) were collected, of
which Steatonyssus noctulus and Nycteridopsylla eusarca in the Rostov region were first
detected. As a result of laboratory studies of bats and ectoparasites associated with them
in the Rostov Region, the bacteria DNA of the genus Borrelia - Borellia burgdorferi s. l.,
species Borellia afzelii were found in the samples of a Pipistrellus pipistrellus, P. pygmae-
us and P. kuhlii, Eptesicus serotinus, Carios vespertilionis, Steatonyssus periblepharus and
Borellia spp. - in the samples of a Macronyssus flavus; Ehrlichia spp. - in the samples
of P. pipistrellus and P. kuhlii; Anaplasma fagocytophilum - in samples of Nyctalus
noctula. First established participation of bats and ectoparasites in the epizootic process of
tularemia - Francisella tularensis DNA detected in samples of P. pipistrellus, N. noctula,
P. kuhlii and Cimex ex gr. pipistrelli. In the samples of N. noctula and P. pipistrellus were first
discovered markers of Crimean-Congo hemorrhagic fever virus.
13