ПАРАЗИТОЛОГИЯ, 53, 1, 2019
УДК 571.895.133:597(571)
NEOECHINORHYNCHUS BAUERI SP. N. (EOACANTHOCEPHALA:
NEOECHINORHYNCHIDAE) - ПАРАЗИТ ПРЕСНОВОДНЫХ
РЫБ СЕВЕРНОЙ АЗИИ
© 2019 г. Е. И. Михайлова, Г. И. Атрашкевич
Институт биологических проблем Севера ДВО РАН, ул. Портовая, 18, Магадан, 685000 Россия
е-mail: emmodus@gmail.com
Поступила 20.06.2018 г.
Приводится описание нового вида Neoechinorhynchus baueri sp. n. от сиговых рыб (Coregonidae)
Северо-Востока России. В состав вида включены акантоцефалы с близкими по размеру апи-
кальными и медианными крючьями, корни которых снабжены корнями с передними выростами,
ранее относившиеся в Северной Азии к виду N. crassus Van Cleave, 1919. Скребни, у которых
крючья в двух верхних рядах тоже примерно равны по длине, но их корни не имеют передних
выростов, отнесены к виду N. tumidus Van Cleave et Bangham, 1949. Рассмотрены морфологи-
ческие и экологические отличия нового вида от N. crassus и особей N. tumidus из азиатских
популяций.
Ключевые слова: акантоцефалы, Neoechinorhynchus baueri sp. n., сиговые рыбы, арктический
голец, Азиатская Субарктика, Северная Азия.
DOI: 10.1134/S0031184719010046
Изучение скребней рода Neoechinorhynchus в субарктических районах Азии нача-
лось с исследований О. Н. Бауера. Ему принадлежит первая регистрация всех обнару-
женных неоэхиноринхов в качестве одного вида N. rutili (Müller, 1780) (Бауер, 1948),
также как последующее дополнение регистрацией вида N. crassus Van Cleave, 1919
(Бауер, 1953), а затем и сомнения в правильности такого определения. В своей позд-
ней публикации Бауер (1990) привел соображения в пользу отнесения обитающе-
го в сибирских реках скребня, ставшего известным в отечественной литературе как
N. crassus, к другому виду N. tumidus Van Cleave et Bangham, 1949.
Следует отметить, что принадлежность коллекционных экземпляров скребней от
рыб, распространенных в Сибири, к виду N. tumidus в свое время была установле-
на и другими исследователями. К таким выводам пришли В. И. Петроченко (1956)
при определении материалов из Оби, собранных 70-ой Союзной гельминтологиче-
ской экспедицией (СГЭ) 1929 г. возле г. Обдорска (Центральный гельминтологиче-
ский музей Всероссийского научно-исследовательского института гельминтологии
им. К. И. Скрябина (ЦГМ ВНИИП); Л. В. Филимонова и Н. И. Суменкова, определявшие
червей в сборах 302-ой Якутской СГЭ 1957 г. в р. Лене и В. Я. Трофименко, работавший
в составе Енисейской СГЭ 1963 г. (Гельминтологический Музей Центра паразитологии
40
Института проблем экологии и эволюции им. А. Н. Северцова РАН (ГМ ЦП ИПЭЭ
РАН). В дальнейшем Трофименко (1969) обнаружил различие в строении корней апи-
кальных и медианных крючьев у изученных им скребней и заключил, что найденный
признак разделяет виды N. crassus и N. tumidus. Позднее в известной ревизии Е. С. Скря-
бина (1978) пришла к выводу, что N. tumidus является младшим синонимом N. crassus.
Итоги отечественных исследований, касавшихся этих скребней, обобщены в работах
О. Н. Пугачева (1984, 2004).
Новые факты, полученные на основе молекулярно-генетического анализа, свиде-
тельствуют об отсутствии американского вида N. crassus в фауне скребней рыб Се-
веро-Востока Азии (Malyarchuk et al., 2014). Очевидно, что в Азии существуют две
формы, имеющие морфологическое сходство с N. tumidus и друг с другом. Исследова-
ние генома азиатских форм выявило их близость и на молекулярном уровне, показав
при этом высокую степень отличия от N. crassus: на участке 18S рРНК нуклеотидные
последовательности обеих форм оказались идентичными, при том что генетическая
дистанция от N. crassus составила 1.48 %. В митохондриальном геноме между азиат-
скими формами на участке первой субъединицы цитохром-c-оксидазы (cox 1) невы-
сокая дивергенция (9.5 %) была обнаружена. По сравнению с другими видами рода,
обитающими на северо-востоке Азии, ее уровень вдвое ниже (Malyarchuk et al., 2014).
Тем не менее, в разных популяциях скребней, обитающих на Северо-Востоке, про-
является обнаруженное Трофименко (1969) различие в строении корней хоботковых
крючьев, и можно утверждать, что этот признак четко разделяет упомянутые формы.
Кроме того, уже стало ясно, что эти две формы скребней приурочены к биотопам
с различными экологическими условиями, в которых каждая достигает высокой по-
пуляционной численности (Михайлова, 2015; Атрашкевич и др., 2016). Одна из форм
связана с речными руслами, точнее с их участками, где наблюдается слабое течение
и в бентосе формируется богатая фауна ракушковых раков (Ostracoda). В подобном
биотопе исследован жизненный цикл этой формы скребней, найдены промежуточные
хозяева - остракоды рода Candona, выявлены виды сиговых рыб, служащие основ-
ными облигатными дефинитивными хозяевами (Атрашкевич, Орловская, 1986; Ми-
хайлова, Атрашкевич, 1996; Михайлова, 2015; Атрашкевич и др., 2016). Вторая форма
скребней отмечена нами только у рыб в горных озерах тектонического и ледникового
происхождения, где ихтиофауна представлена, главным образом, жилыми формами
арктического гольца Salvelinus alpinus s. l. (Михайлова, 2015; Атрашкевич и др., 2016).
Промежуточный хозяин скребней в этих озерах до сих пор не обнаружен. Остракоды
в их бентосе встречаются исключительно редко, также экспериментально установле-
но, что в раках, принадлежащих к этому отряду, личиночное развитие паразита не про-
исходит (Михайлова, 2010; 2018).
Таким образом, возникла необходимость определить таксономический статус каж-
дой из близкородственных форм. Полагаем, что отсутствие общих промежуточных
хозяев в жизненных циклах паразитов является одним из важных признаков их ви-
довой самостоятельности. Подобного рода расхождения признаны убедительным ар-
гументом при обсуждении систематического положения среди акантоцефалов, в том
числе, и на уровне рода (Nickol et al., 1999; García-Varela, Pérez-Ponce de León, 2008).
Отсутствие сведений о форме корневых пластинок крючьев в первоописании
N. tumidus так же, как сообщений о находках его промежуточных хозяев в Северной
41
Америке не позволяет однозначно соотнести этот вид с одной из азиатских форм. Од-
нако совокупность фактов его регистрации в Америке свидетельствует о приуроченно-
сти вида к разного рода озерам. Опираясь на экологическое предпочтение паразитов,
мы склонны отнести форму скребней, обнаруженную в озерах на северо-востоке Азии
к виду N. tumidus. При этом хорошо знакомую отечественным гельминтологам реч-
ную форму, известную под именем N. crassus, мы выделяем в качестве нового вида
N. baueri и приводим его подробное описание. Следует также добавить, что коллек-
ционные материалы, с которыми работали предшественники, происходят из низовьев
рек Сибири и Чукотки. Сравнение червей из разных популяций продемонстрирова-
ло их единообразие во всех субарктических регионах, что было показано Скрябиной
(1978) на основании анализа морфометрических данных. К сожалению, коллекция
О. Н. Бауера не сохранилась и значительная часть коллекционных экземпляров из сбо-
ров других СГЭ также утрачена или не имеет качества, пригодного для таксономиче-
ского описания. При этом большая коллекция скребней рода Neoechinorhynchus собра-
на сотрудниками лаборатории экологии гельминтов ИБПС ДВО РАН на северо-востоке
России и хранится в лаборатории, что определило источник типовой серии для описа-
ния N. baueri sp. n.
МАТЕРИАЛ И МЕТОДИКА
Материалом для описания нового вида послужили сборы скребней от двух видов
сиговых рыб (Coregonidae): сига-пыжьяна Coregonus lavaretus pidschian (Gmelin, 1789)
и чира C. nasus (Pallas, 1776), добытых в р. Чаун (Северо-западная Чукотка) в окрест-
ностях Чаунского биологического стационара Института биологических проблем Се-
вера ДВО РАН (68°46′ с. ш., 170°33′ в. д.) за период 1983-1990 гг. Кроме этого, так-
сономические данные получены по выборкам скребней из р. Анадырь (64°41′ с. ш.,
170°24′ в. д.), из оз. Рыбное (67°19′ с. ш., 169°20′ в. д.), с участка верхнего течения
р. Колымы (63°27′ с. ш., 152°26′ в. д.), из озер Льдистое (61°00′ с. ш., 148°35′ в. д.),
Энгтери (61°10′ с. ш., 153°54′ в. д.) и Мак-Мак (59°57′ с. ш., 152°06′ в. д.). Также из-
учены коллекционные материалы из сборов СГЭ: 1929 г. (р. Обь); 1956, 1957 гг.
(р. Лена); 1963 г. (р. Енисей); 1956, 1969, 1970 гг. (р. Колыма); 1974 г. (р. Обь), хранящиеся
в ЦГМ ВНИИП и ГМ ЦП ИПЭЭ РАН (Москва).
Извлечение и фиксация червей были проведены по стандартным методикам. Все
скребни сохранялись в 70° этаноле, за исключением влажных препаратов в Музее
гельминтологии ВНИИП, которые содержатся в растворе формалина. Для изучения
морфологии и измерений были изготовлены временные препараты скребней, просвет-
ленных в глицерине. Микроскопические исследования проведены при помощи свето-
вого микроскопа Carl Zeiss AXIO Imager.D1, рисунки также сделаны с изображений,
полученных на этом микроскопе. В приведенных величинах длина тела представляет
собой длину метасомы без учета хоботка и шейки. Длина хоботка и крючьев измерена
в соответствии с принятыми стандартами (Петроченко, 1956). Измерение зрелых яиц
проводилось после их извлечения из полости тела самки, для чего были использованы
дополнительные экземпляры из тех же выборок, что и особи, выделенные в типовую
серию. Типовые экземпляры представлены взрослыми особями. Все размерные ха-
рактеристики приведены в микрометрах, кроме размеров тела и лемнисков, что особо
отмечено в тексте. В описании указаны предельные значения измеренного параметра
в выборке и среднее значение в скобках. В таблицах с количественными данными ис-
42
пользованы стандартные статистические показатели: ошибка среднего значения и ко-
эффициент вариации (в процентах).
РЕЗУЛЬТАТЫ
Описание Neoechinorhynchus baueri sp. n.
С ино ни мы: N. crassus Van Cleave, 1919 sensu Trofimenko, 1969; N. crassus Van
Cleave, 1919 sensu Skrjabina, 1978; N. crassus Van Cleave, 1919 sensu Pugachev, 1984.
Ти по в ые д е фи н ит ив н ые хо зяе ва : сиг-пыжьян C. lavaretus pidschian
(Gmelin, 1789) и чир C. nasus (Pallas, 1776). Экстенсивность их инвазии (ЭИ) 83 и
85 %, интенсивность инвазии (ИИ) 1-62 и 1-130 соответственно.
Другие виды дефинитивных хозяев в типовом местонахождении: обыкновен-
ный гольян Phoxinus phoxinus (L.,1758), тонкохвостый налим Lota lota leptura Hubbs
et Schultz,1941, полярная камбала Liopsetta glacialis (Pallas, 1776), четырехрогий кер-
чак Myoxocephalus quadricornis (L., 1758).
Промежуточные хозяева: в природе - Candona harmsworthi Scott, 1899 и Candona
spp., не определенные до вида [в первом упоминании (Атрашкевич, Орловская, 1986)
название ошибочно указано как C. hamworthi]; в эксперименте - C. candida, C. le-
vanderi, C. cf. pedata. В типовом местонахождении зараженность (ЭИ) остракод в тече-
ние летнего сезона варьирует в пределах 0.1-2.7 %.
Ло ка л иза ц ия в д е ф и ни ти в ном хо зя ин е : кишечник.
Тип ово е ме с то н а хож де н ие : р. Чаун в районе Чаунского биологического стационара
ИБПС ДВО РАН (68°46′ с. ш., 170°33′ в. д.).
Тип ово й мат ер и а л . Голотип № 1296, аллотип № 1297 и паратипы (40 экз.) № 1295
депонированы в ГМ ЦП ИПЭЭ РАН (Москва).
Э тим оло гия . Вид назван в честь выдающегося русского паразитолога Олега
Николаевича Бауера, которому принадлежат первые сведения о скребнях пресново-
дных рыб в Азиатской Субарктике.
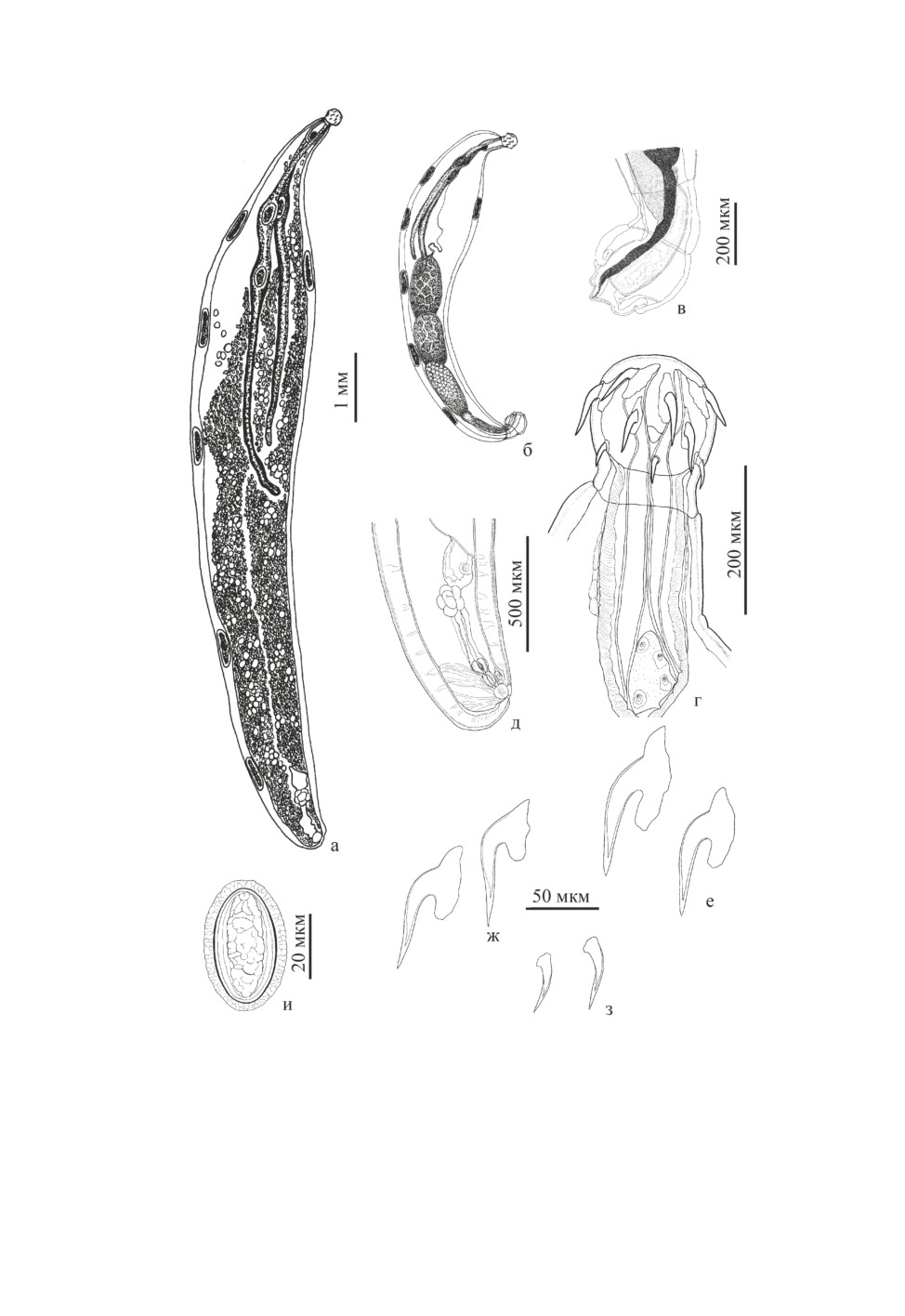
О б ща я ха ра кт ер и с т ика. Скребни средних размеров, при жизни белого цвета, обла-
дают всеми характерными признаками рода Neoechinorhynchus. Тело червей обоего пола имеет
веретенообразную форму (рис. 1 а, б). Толщина стенки тела увеличивается от переднего конца
к заднему, с вентральной стороны она несколько меньше, чем с дорсальной. В тегументе скреб-
ней присутствует шесть гигантских ядер: одно на вентральной стороне и пять на дорсальной.
Хоботок округлый, его ширина превосходит длину. Шейка короткая, чаще всего конической фор-
мы. 18 хоботковых крючьев располагаются шестью спиральными рядами, в каждом из которых
апикальный и медианный крючки, имея примерно равную величину, намного превосходят ба-
зальный. Наиболее мощные апикальные крючья имеют хорошо выраженные корни, имеющие
передние выросты (рис. 1 е). Корни медианных крючьев также снабжены подобными выростами
(рис. 1 ж). Более тонкие базальные крючья имеют слабо выраженный корень округлой формы
(рис. 1 з). Хоботковое влагалище, состоящее из одного слоя мышечных волокон, крепится в ос-
новании хоботка. На дорсальной и вентральной его сторонах имеются мышечные образования
небольшого размера (рис. 1 г) - «para-receptacle structure» (Amin et al., 2002), представляющие
собой рудимент еще одной мускульной оболочки влагалища (Herlin, Taraschewsky, 2017); эта
структура является новым признаком в диагностике скребней. Церебральный ганглий распо-
лагается на дне хоботкового влагалища. Парные, жгутовидные лемниски хорошо развиты и
43
незначительно различаются по длине. Меньший лемниск содержит одно ядро, а больший -
два ядра, расположенных близко друг к другу. Как правило, ядра в лемнисках выделяются
в виде утолщений. Величина большего лемниска, в среднем, составляет около половины длины
метасомы скребня, как у самцов, так и у самок. Органы половой системы у самцов занимают
большую часть полости тела. Каждый из двух семенников сопоставим по размеру с цементной
железой. Цементный резервуар снабжен двумя протоками. Мешок Сэфтигена имеется. Яйцевы-
водящий проток самок (рис. 1 д) короткий, включает в себя маточный колокол, сортировочный
аппарат, матку и влагалище. Генитальное отверстие самок, снабженное сфинктером, расположе-
но субтерминально и смещено на вентральную сторону (рис. 1 д). Зрелые яйца эллиптической
формы (рис. 1 и), с четырьмя оболочками. На тотальных препаратах скребней тонкая наружная
оболочка яиц, как правило, плохо различима внутри полости тела самки. Половой диморфизм
проявляется в размерах тела взрослых скребней, хоботка и хоботковых крючьев. Наибольшие по
значениям характеристики свойственны самкам.
Самец (размеры по 21 особи). Длина тела 4.0-7.2 (5.3) мм, наибольшая ширина 0.7-
1.6 (1.1) мм. Толщина стенки тела в передней части метасомы составляет 10-20, в задней ча-
сти достигает 85-175. Длина хоботка 120-156 (144), его ширина 162-214 (178). Длина острия
апикальных крючьев 61-80 (71), медианных 59-77 (70), базальных 37-50 (45). Длина хобот-
кового влагалища 256-544 (422), его ширина 92-236 (168). Длина меньшего лемниска 1.5-
3.1 (2.3) мм. Длина большего лемниска 1.7-3.4 (2.5) мм, его величина относительно длины метасомы
31-65 (49) %. Общая длина органов половой системы (без эвагинированной бурсы) 2.3-
5.4 (3.5) мм, относительно длины тела 57-83 (65) %. Семенники продолговато-удлиненные,
соприкасаются или слегка накладываются друг на друга. Длина переднего семенника 600-
1480 (967) при ширине 310-600 (463). Длина заднего семенника 520-1925 (920), его ширина
310-700 (455). Длина цементной железы 500-2110 (1016), ее ширина 220-550 (361). Цементный
резервуар передней частью латерально прилегает к цементной железе, его длина 200-460 (322),
наибольшая ширина 140-380 (218). Длина семенного пузырька 320-600 (444), его ширина 100-
230 (155). Длина мешка Сэфтигена 460-770 (626) при ширине 50-220 (91). Длина копулятивной
бурсы в эвагинированном положении составляет 300-520 (378), ее ширина 240-430 (320).
Самка (размеры по 21 особи). Длина тела 5.6-9.9 (7.2) мм, наибольшая ширина 0.9-
1.9 (1.3) мм. Толщина стенки тела меняется от 15-35 в передней части метасомы до 90-150 в зад-
ней. Длина хоботка 130-178 (156), его ширина 170-208 (189). Длина острия апикальных крючьев
62-85 (76), медианных 65-84 (78), базальных 43-54 (48). Длина хоботкового влагалища 164-
524 (375), его ширина 100-188 (151). Длина меньшего лемниска 2.3-4.7 (3.3) мм. Длина боль-
шего лемниска 2.4-5.3 (3.7), что составляет 36-66 (52) % от длины тела. Общая длина яйцевы-
водящих путей 480-900 (676), относительно длины тела 7-12 (10) %. Матка больше влагалища,
ее длина 175-295 (235). Длина влагалища 105-165 (132), что составляет 48-73 (57) % отно-
сительно длины матки. Вагинальный сфинктер, выдающийся в просвет матки, имеет длину
50-85 (65) при ширине 70-90 (78). Генитальный сфинктер округлый, его длина 40-90 (64)
и ширина 60-105 (77). 50 экз. зрелых яиц, выделенных из полости тела самок, не включенных
в типовую серию, имеют размеры 38-45 (42) × 23-27 (25). Размеры кератинсодержащей вну-
тренней оболочки яиц («hard shell» по Van Cleave et Bangham, 1949), хорошо видимой сквозь
стенку тела, составляют 35-40 (37) × 18-21 (20).
Таксономические сведения о скребнях N. baueri sp. n.
из других географических популяций
В проведенном ранее генетическом анализе (Malyarchuk et al., 2014) в качестве мате-
риала были использованы особи из популяций N. baueri sp. n., обитающих на Чукотке
и в бассейне верхней Колымы. В дополнение к морфологическому описанию червей
из чаунской популяции мы приводим данные о размерных характеристиках основных
диагностических признаков из трех других исследованных популяций (табл. 1).
44
Рис. 1. Neoechinorhynchus baueri sp. n. (а-и).
а - самка (голотип); б - самец (аллотип); в - задний конец самца с эвагинированной бурсой;
г - хоботок и хоботковое влагалище (аллотип); д - задний конец самки; е - апикальные крючья;
ж - медианные крючья; з - базальные крючья; и - зрелое яйцо.
45
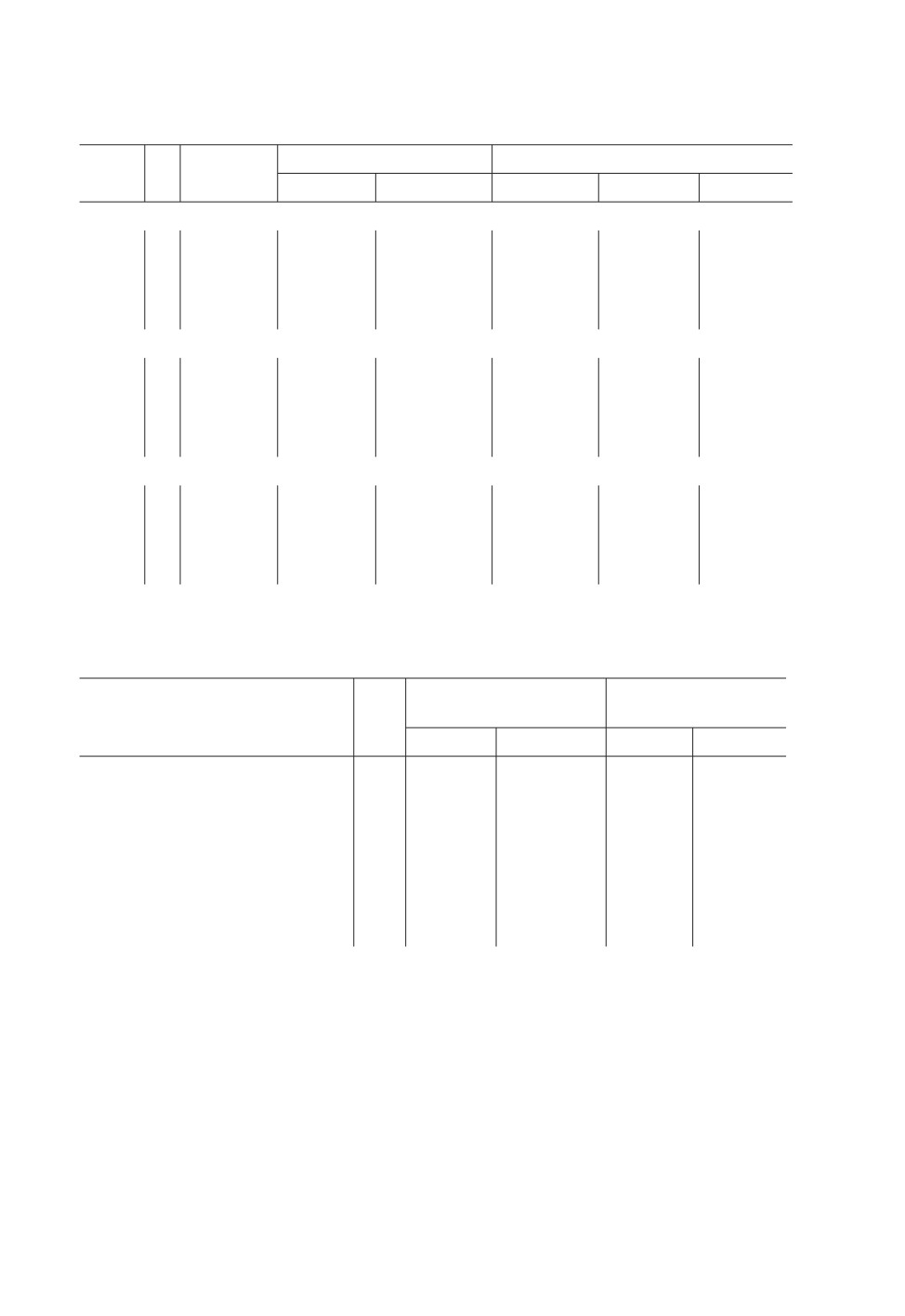
Таблица 1. Размерные характеристики (мкм) диагностических признаков N. baueri sp. n.
из разных географических популяций. N — количество экземпляров
Длина тела,
Хоботок
Длина крючьев
Пол
N
мм
Длина
Ширина
апикальных
медианных
базальных
Оз. Рыбное
самцы
15
5.7-9.3
124-148
160-188
64-80
65-78
38-52
(7.1 ± 0.3)
(139 ± 2.4)
(176 ± 2.2)
(72 ± 0.9)
(71 ± 0.6)
(45 ± 0.8)
самки
15
6.4-21.7
144-170
182-220
68-90
64-82
44-54
(12.4 ± 1.2)
(154 ± 2.1)
(198 ± 2.5)
(79 ± 1.1)
(75 ± 0.8)
(49 ± 0.7)
Р. Анадырь
самцы
6
4.5-8.2
120-130
162-206
70-80
64-76
42-50
(5.9 ± 0.5)
(126 ± 2.0)
(181 ± 7.2)
(74 ± 1.1)
(69 ± 1.2)
(45 ± 1.1)
самки
15
3.8-12.0
140-168
160-210
70-88
70-80
42-56
(7.1 ± 0.7)
(155 ± 2.2)
(187 ± 3.7)
(77 ± 0.8)
(75 ± 0.5)
(50 ± 0.6)
Бассейн верхнего течения р. Колымы
самцы
13
4.1-6.7
133-154
170-204
66-82
64-75
40-52
(5.2 ± 0.3)
(141 ± 2.5)
(184 ± 4.3)
(73 ± 0.8)
(71 ± 0.6)
(46 ± 0.7)
самки
15
4.0-16.7
132-168
160-204
68-88
61-78
38-52
(9.1 ± 0.8)
(147 ± 2.7)
(181 ± 3.8)
(74 ± 0.8)
(71 ± 0.6)
(47 ± 0.7)
Р. Чаун (типовая серия)
самцы
21
4.0-7.2
120-156
162-214
61-80
59-77
37-50
(5.3 ± 0.2)
(144 ± 1.9)
(178 ± 2.8)
(71 ± 0.7)
(70 ± 0.6)
(45 ± 0.5)
самки
21
5.6-9.9
130-178
170-208
62-85
65-84
43-54
(7.2 ± 0.3)
(156 ± 2.7)
(189 ± 2.0)
(76 ± 0.6)
(78 ± 0.4)
(48 ± 0.4)
Поскольку главным отличительным признаком в анатомии N. baueri sp. n. остается
форма корневой пластинки апикальных и медианных хоботковых крючьев, целесоо-
бразно продемонстрировать сходство этого признака у червей из чаунской популяции
и особей из районов, расположенных западнее типового местонахождения (рис. 2 а-в).
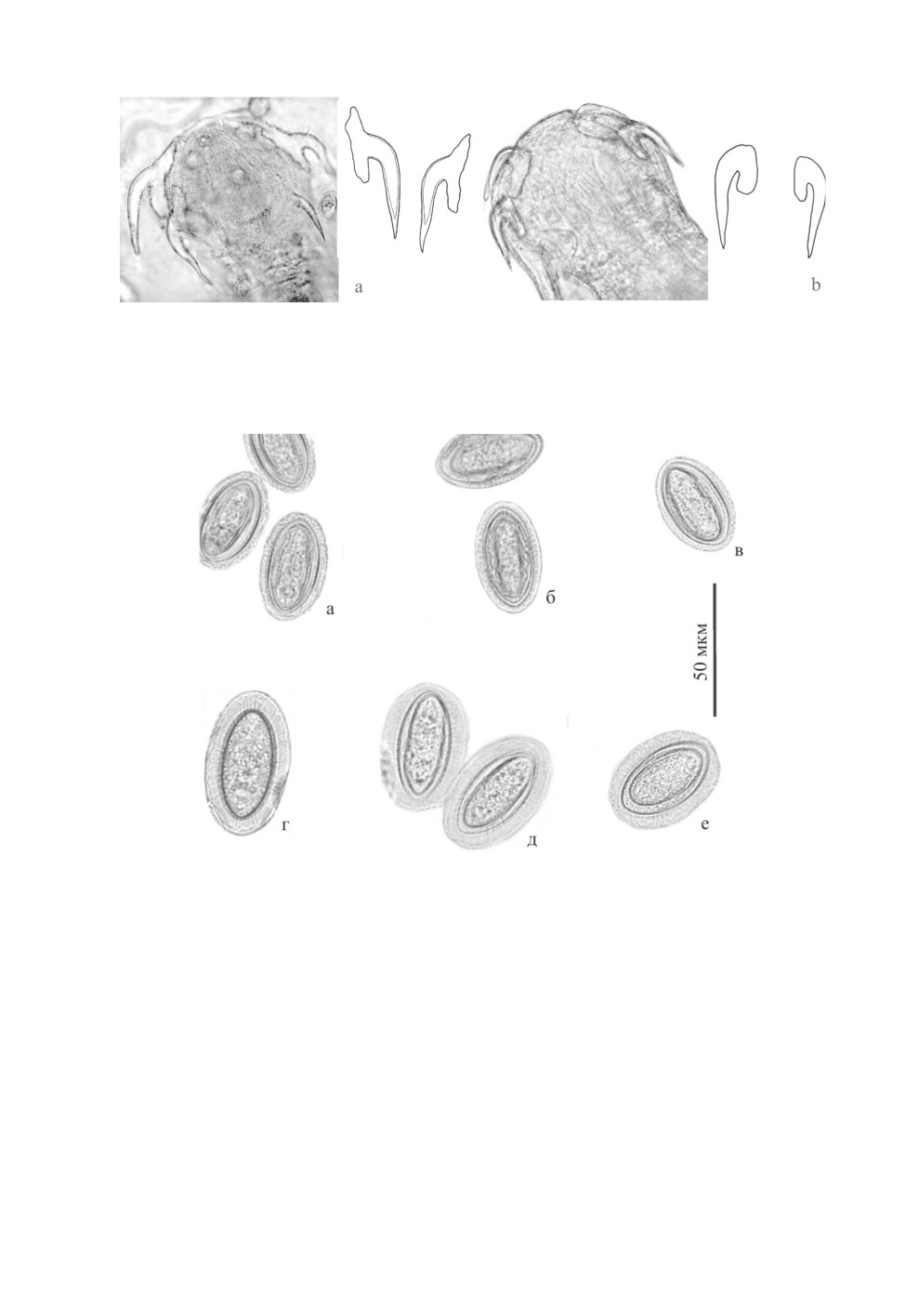
Рис. 2. Апикальные и медианные крючья N. baueri sp. n. (а-в) и N. tumidus (г, д) из разных
географических популяций Северной Азии.
а - р. Лена; б - р. Обь; в - р. Чаун; г - апикальный крючок (оз. Мак-Мак);
д - медианный крючок (оз. Энгтери).
46
Дифференциальный диагноз
Ревизия рода Neoechinorhynchus (Amin, 2002), в которой проведен анализ таксоно-
мических описаний всех известных к тому времени представителей, содержит ключ
для определения 88 валидных видов. Пользуясь таблицей Амина (Amin, 2002), состав-
ленной на основании значимых диагностических признаков, можно аргументированно
отделить заведомо несходные по морфологии виды и сосредоточить внимание на срав-
нении с близкими.
По соотношению длины хоботковых крючьев и размерам тела N. baueri sp. n. имеет
сходство только с N. crassus и N. tumidus, к которым его в разные периоды относили
отечественные исследователи.
Цилиндрическая форма тела с почти параллельными сторонами, характерная для
N. crassus, отделяет его от N. tumidus и N. baueri sp. n., которые имеют форму тела ве-
ретенообразную с наибольшим расширением в передней части. Кроме того, N. crassus
имеет хоботок, длина которого превышает ширину. Для N. baueri sp. n. характерен хо-
боток иных пропорций - его ширина существенно больше длины. Длина апикальных
крючьев N. crassus, приведенная в первоописании, составляет 94-100 мкм (Van Cleave,
1919), и значительно превышает размеры таковых у N. baueri sp. n. (61-90 мкм).
В первоописании N. tumidus размерные характеристики хоботка и крючьев представ-
ляют собой данные о минимальных и максимальных значениях измеренных величин.
В нем не имеется указаний на присутствие и форму корней хоботковых крючьев. Так-
же нет описания строения зрелых яиц или их рисунка, приведены только размеры их
внутренней твердой оболочки (Van Cleave, Bangham, 1949). Таким образом, ввиду от-
сутствия сведений о дифференцирующих признаках в описании американских особей
N. tumidus, сравнение N. baueri sp. n. проведено с особями N. tumidus из популяций
Северо-восточной Азии, исследованных нами. Особи N. tumidus представлены из трех
удаленных друг от друга озер Магаданской области: Льдистое, Мак-Мак и Энгтери.
Основным признаком, который позволяет различить эти два вида, является форма
корневых пластинок апикальных и медианных крючьев: корневые пластинки N. baueri
sp. n. имеют передний вырост, у N. tumidus такой вырост отсутствует. Отличие по этому
признаку демонстрируют фотографии отдельных крючьев скребней из разных популя-
ций на рисунке 2, а также рисунки крючьев и фотографии хоботков особей из р. Чаун
и оз. Льдистого (рис. 3).
Размеры хоботка и крючьев скребней N. tumidus в популяциях из разных озер
(табл. 2) меньше, чем таковые во всех изученных выборках N. baueri sp. n.
Еще одно важное отличие дифференцируемых скребней проявляется в размерах яиц:
у N. baueri sp. n. они меньше, чем у N. tumidus. Зрелые яйца N. tumidus имеют более ши-
рокое пространство между тонкой наружной и внутренней кератинсодержащей обо-
лочкой по сравнению с яйцами N. baueri sp. n. (рис. 4). Разница составляет 2-3 мкм, что
определяет больший размер яиц N. tumidus в наших выборках. В оригинальном опи-
сании вида N. tumidus авторы привели размеры только внутренней оболочки, назвав
ее твердой оболочкой «hard shell» (Van Cleave, Bangham, 1949). И, как можно видеть
(табл. 3), указанные ими величины не существенно отличаются от наших данных для
двух других форм.
47
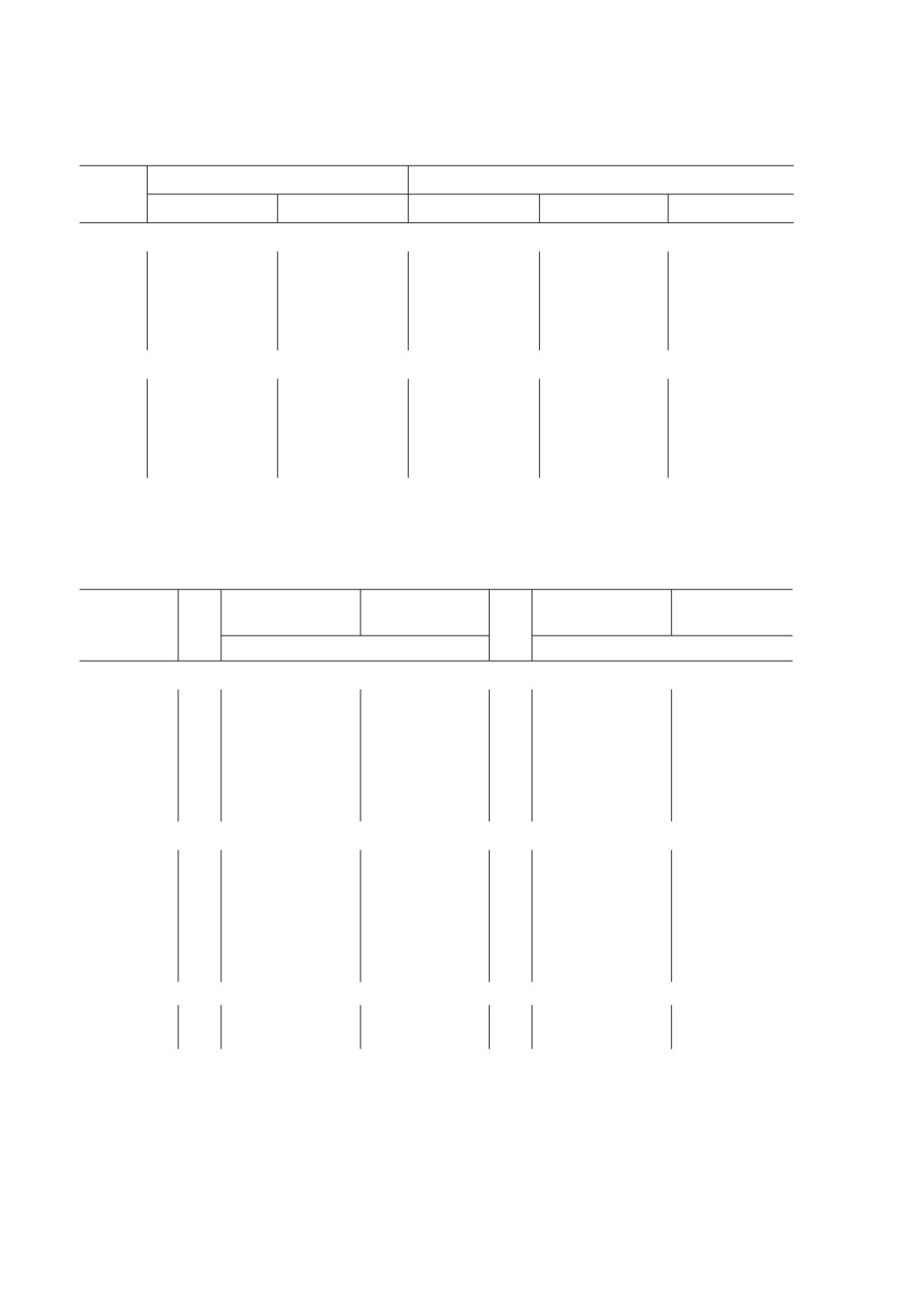
Таблица 2. Размерные характеристики (мкм) диагностических признаков N. tumidus из разных
географических популяций. N - количество экземпляров
Длина тела,
Хоботок
Длина крючьев
Пол
N
мм
Длина
Ширина
апикальных
медианных
базальных
Оз. Льдистое
самцы
15
2.9-6.2
106-130
138-164
48-58
44-54
30-40
(4.1 ± 0.2)
(115 ± 1.7)
(151 ± 2.0)
(52 ± 0.7)
(49 ± 0.5)
(34 ± 0.5)
самки
15
4.7-8.7
112-144
154-176
50-64
50-58
32-40
(6.2 ± 0.3)
(130 ± 2.3)
(164 ± 1.7)
(56 ± 0.6)
(53 ± 0.4)
(36 ± 0.4)
Оз. Мак-Мак
самцы
15
3.1-5.5
108-146
121-162
50-68
46-66
30-46
(4.0 ± 0.2)
(132 ± 2.6)
(145 ± 3.8)
(59 ± 0.8)
(55 ± 0.8)
(40 ± 0.6)
самки
15
5.0-7.8
126-171
156-192
50-72
60-70
40-50
(6.0 ± 0.2)
(143 ± 4.2)
(169 ± 3.0)
(65 ± 0.8)
(65 ± 0.4)
(45 ± 0.5)
Оз. Энгтери
самцы
15
3.3-6.32
128-156
160-190
52-72
54-68
34-44
(5.2 ± 0.2)
(142 ± 2.2)
(178 ± 2.5)
(64 ± 0.8)
(59 ± 0.5)
(40 ± 0.5)
самки
15
6.2-11.5
134-160
170-190
54-74
48-68
38-50
(7.9 ± 0.3)
(148 ± 2.4)
(182 ± 1.5)
(64 ± 0.7)
(61 ± 0.7)
(43 ± 0.5)
Таблица 3. Размеры (мкм) зрелых яиц N. baueri sp. n. и N. tumidus: диапазон, среднее значение
с ошибкой, коэффициент вариации
Размеры яиц
Размеры яиц
Местонахождение
N
по внутренней оболочке
с наружной оболочкой
Длина
Ширина
Длина
Ширина
N. tumidus, Северная Америка
36-40
16-19
-
-
(Van Cleave, Bangham, 1949)
N. tumidus из озер Льдистое,
50
36-49
18-24
44-59
28-37
Мак-Мак, Энгтери
40 ± 0.4
20 ± 0.2
51 ± 0.5
31 ± 0.3
7 %
6 %
7 %
6 %
N. baueri sp. n., р. Чаун
50
35-40
18-21
38-45
23-27
37 ± 0.2
20 ± 0.1
42 ± 0.2
25 ± 0.1
4 %
4 %
3 %
4 %
Пропорции хоботка сходны у обоих видов: ширина хоботка больше его длины
как у N. baueri sp. n., так и у N. tumidus. Однако абсолютные размеры обоих параме-
тров хоботка, также как и длина крючьев во всех рядах у N. baueri sp. n. больше, чем
у N. tumidus (табл. 4).
Хотя абсолютные размеры лемнисков не относятся к основным диагностическим
признакам, отметим еще одно различие, обнаруженное у скребней из всех исследован-
ных выборок: для самцов и самок N. baueri sp. n. характерны лемниски существенно
большей длины по сравнению с особями N. tumidus. Данные о величине большего лем-
48
Рис. 3. Хоботок, апикальные и медианные крючья N. baueri sp. n. и N. tumidus
из азиатских популяций.
а - N. baueri sp. n. (р. Чаун), б - N. tumidus (оз. Льдистое).
Рис. 4. Зрелые яйца N. baueri sp. n. (а-в) и N. tumidus (г-е) из азиатских популяций.
а - р. Чаун; б - р. Обь; в - р. Колыма; г - оз. Энгтери; д - оз. Льдистое; е - оз. Мак-Мак.
ниска приводит Скрябина (1978) в работе о морфологической изменчивости скреб-
ней р. Neoechinorhynchus, материалом для которой послужили гельминтологические
сборы, сделанные в низовьях рек Оби, Лены и Чауна. Изучая те же сборы скребней из
Оби и Лены в музейных коллекциях, мы имели возможность определить соотношение
размеров лемнисков и тела скребней из этих местонахождений и получить сравнитель-
ные данные для червей из типового местообитания в р. Чаун. Аналогичные данные
получены для N. tumidus из трех озер Магаданской области и приведены в таблице 5.
При этом следует отметить, что факторы, оказывающие влияние на степень развития
лемнисков, неизвестны, также как неясна их функция. Наши данные относятся к осо-
49
Таблица 4. Размерные характеристики (мкм) диагностических параметров N. baueri sp. n.
и N. tumidus из азиатских популяций (диапазон, среднее значение с ошибкой, коэффициент
вариации)
Хоботок
Длина крючьев
Пол
Длина
Ширина
апикальных
медианных
базальных
N. baueri из популяций северо-восточной Азии (рр. Чаун, Анадырь, Колыма, оз. Рыбное) 1
120-156
160-214
61-82
59-78
37-52
самцы
140 ± 1.4 (7%)
179 ± 1.7 (7%)
72 ± 0.4 (6%)
70 ± 0.3 (5%)
45 ± 0.3 (7%)
130-170
160-210
62-90
61-84
38-56
самки
153 ± 1.4 (7%)
189 ± 1.6 (7%)
77 ± 0.4 (7%)
75 ± 0.3 (6 %)
48 ± 0.3 (6%)
N. tumidus из популяций северо-восточной Азии (озера Льдистое, Мак-Мак, Энгтери) 1
106-156
121-190
48-72
44-68
30-46
самцы
130 ± 2.1 (11%)
159 ± 2.7 (11%)
59 ± 0.6 (10%)
55 ± 0.5 (10%)
39 ± 0.4 (10%)
112-171
154-192
50-74
48-70
32-50
самки
140 ± 2.1 (10%)
172 ± 1.7 (6%)
62 ± 0.6 (9%)
60 ± 0.6 (10%)
42 ± 0.5 (11%)
П р и м е ч а н и е : 1 данные для N. baueri sp. n. и N. tumidus рассчитаны по совокупным выборкам, состав-
ленным из всех представленных в результатах.
Таблица 5. Размеры большего лемниска N. baueri sp. n. и N. tumidus: абсолютная (мм) и отно-
сительная длина (в % от длины тела). N - количество экземпляров
Длина большего
Относительная
Длина большего
Относительная
Место
N
лемниска
длина
N
лемниска
длина
сбора
Самцы
Самки
N. baueri sp. n. = N. crassus sensu Skrjabina, 1978 (Скрябина, 1978)
Р. Чаун
29
1.4-3.8
26
2.4-4.8
(2.4 ± 0.11)
(3.7 ± 0.10)
Р. Обь
15
1.9-3.1
15
2.6-4.4
(2.5 ± 0.10)
(3,3 ± 0.10)
Р. Лена
34
1.3-2.4
22
2.2-4.9
(1.9 ± 0.06)
(3.5 ± 0.12)
N. baueri sp. n. по данным собственных измерений
Р. Чаун
43
1.0-4.5
33-87
46
1.7-5.7
34-80
(2.7 ± 0.40)
(50 ± 7.6)
(3.5 ± 0.10)
(50 ± 7.4)
Р. Обь
11
1.3-2.7
18-74
18
1,3-4,1
33-67
(1.9 ± 0.10)
(54 ± 15.0)
(2.8 ± 0.20)
(49 ± 11.8)
Р. Лена
17
1.1-3.8
38-63
34
1.8-4.8
31-68
(2.1 ± 0.10)
(49 ± 12.1)
(3.4 ± 0.10)
(49 ± 8.6)
N. tumidus из озер Льдистое, Мак-Мак, Энгтери
Озера
45
1.0-2.4
23-44
45
1.1-3.0
16-46
(1.5 ± 0.06)
(34 ± 7.1)
(1.9 ± 0.06)
(30 ± 6.8)
бям N. baueri sp. n., извлеченным из сиговых рыб, и особям N. tumidus, добытых исклю-
чительно из арктических гольцов. Скребень N. tumidus описан от американских видов
сигов (Van Cleave, Bangham, 1949), однако аналогичных данных о размере лемнисков
в описании не имеется, что не позволяет оценить возможное гостальное влияние на
формирование этого парного органа скребней.
50
ОБСУЖДЕНИЕ
Совокупность рассмотренных морфологических отличий N. baueri sp. n. от N. crassus
и установленных ранее различий их генотипа (Malyarchuk et al., 2014) (в этой работе
N. baueri sp. n. обозначен еще как N. sp.) свидетельствует о том, что мнение о распро-
странении в России скребня N. crassus следует признать ошибочным. Полное несо-
впадение круга дефинитивных хозяев N. crassus в Америке и Азии отметил еще Бауер
(1990), обосновывая свою рекомендацию пересмотреть определение этого скребня,
утвердившееся в России. Возможно также, что названные виды используют разные
систематические группы промежуточных хозяев. Есть данные о том, что в остракодах,
которые встречаются в местообитаниях N. crassus, его личиночное развитие прекраща-
ется на ранних стадиях (Uglem, 1972), тогда как формирование цистакантов N. baueri
sp. n. происходит именно в остракодах, что было установлено нашими наблюдениями
в природе и подтверждено экспериментально (Атрашкевич, Орловская, 1986; Михай-
лова, Атрашкевич, 1996; Михайлова, 2018).
За прошедшее после первоописания N. tumidus время накоплены данные о его новых
находках в Северной Америке (Hoffman, 1999; Muzzall, Madenjian, 2013 и др.), однако
сведения по морфологии и биологии скребня при этом не пополнились. Таким обра-
зом, для сравнительного анализа скребней в пределах всего амфиберингийского ареала
необходимы дополнительные морфологические и экологические данные о североаме-
риканских представителях вида N. tumidus.
Наши исследования подтверждают заключение Трофименко (1969) о существова-
нии в субарктических районах Азии двух форм червей, одну из которых мы описали
в качестве нового вида N. baueri sp. n., а вторую, так же как он, отнесли к N. tumidus.
Весомыми аргументами их таксономического расхождения можно считать явную при-
уроченность этих скребней к разным экологическим нишам и отсутствие общих про-
межуточных хозяев.
Имея в виду морфологическое и генетическое сходство обоих видов, исследованных
в Азии, можно полагать, что N. tumidus, распространенный в Северной Америке, так-
же имеет родственные связи с N. baueri sp. n. По нашему мнению, описанный новый
вид может быть обнаружен и в Неарктике. Получение в перспективе данных о геноме
американских образцов N. tumidus позволит судить о степени родства и дивергенции
всех форм, обитающих по разные стороны Берингова пролива. Весьма вероятно, что
мы имеем дело с комплексом сестринских таксонов, история расселения которых пока
не выяснена.
Молекулярно-генетические методы исследования, широко применяемые в настоя-
щее время, открыли новые возможности для установления связей в систематической
иерархии, но выявили также и новые вопросы. К примеру, не найдено объяснения
присутствию явных морфологических отличий у скребней, встречающихся в разных
таксономических группах камбал, при совпадении нуклеотидных последовательно-
стей в секвенированных генах (Sobecka et al., 2012). Подобный вопрос можно отнести
и к случаю близкого генетического сходства N. baueri sp. n. и азиатских популяций
N. tumidus (Malyarchuk et al., 2014).
Как показывает опыт исследования акантоцефалов, убедительными аргументами
в разрешении сложных вопросов таксономического характера служат данные об их
51
биологии и экологических свойствах. Без сомнения, продолжение изучения всех зве-
ньев жизненного цикла паразитов, как в природе, так и в эксперименте не утратило
своей актуальности и с развитием новых методов биологических исследований.
БЛАГОДАРНОСТИ
Авторы выражают глубокую признательность коллегам - сотрудникам ИБПС
ДВО РАН (Магадан), которые собирали материалы, позволившие осуществить на-
стоящее исследование. Искреннюю благодарность приносим сотрудникам ВНИИП
им. К. И. Скрябина Н. А. Самойловской и А. С. Москвину за предоставление возмож-
ности изучить препараты, хранящиеся в ЦГМ ВНИИП, а также О. С. Хасановой за
помощь при изучении коллекции в ГМ ЦП ИПЭЭ РАН. Мы глубоко признательны
О. И. Лисицыной (Институт зоологии НАН Украины, г. Киев), О. Н. Пугачеву (ЗИН
РАН, г. Санкт-Петербург) и С. Г. Соколову (ЦП ИПЭЭ РАН, г. Москва) за ценные сове-
ты в работе над рукописью.
Работа выполнена в рамках научных проектов по госзаданиям ААА-
А-Б17-217012740045-3 и АААА-А17-117012710031 (ИБПС ДВО РАН) и при поддерж-
ке гранта РФФИ № 15-04-01418.
СПИСОК ЛИТЕРАТУРЫ
Атрашкевич Г.И., Михайлова Е.И., Орловская О.М., Поспехов В.В. 2016. Биоразнообразие скребней рыб
пресных вод Азиатской Субарктики. Паразитология 50 (4): 263-290.
Атрашкевич Г.И., Орловская О.М. 1986. К экологии скребней пресноводных рыб Чукотки. В кн.: Ихтио-
логия, гидробиология, гидрохимия, энтомология и Паразитология Тез. докл. XI Всесоюз. симпоз.
«Биологические проблемы Севера». (Якутск, 1986). Якутск: Изд-во Якутского филиала СО АН СССР,
т. 4, с. 120.
Бауер О.Н. 1948. Паразиты рыб р. Енисея. Изв. ВНИОРХ 27: 97-156.
Бауер О. Н. 1953. Скребни рыб ледовитоморской провинции, их распространение и рыбохозяйственное зна-
чение. Тр. Барабинского отд. ВНИОРХ 6 (2): 31-51.
Бауер О.Н. 1990. Рец. на кн.: Guide to the parasites of fishes of Canada, (Ed. L. Margolis , Z. Kabata), Part III,
Acanthocephala. H. P. Arai. Cnidaria. M. N. Arai. Ottawa, 1989. Паразитология 24 (6): 542-543.
Михайлова Е.И. 2010. О значении признака, предложенного В. Я. Трофименко для разграничения видов
Neoechinorhynchus crassus Van Cleave, 1919 и N. tumidus Van Cleave et Bangham, 1949 (Acanthocephales:
Neoechinorhynchidae). В кн.: Биоразнообразие и экология паразитов. Тр. Центра паразитологии ИПЭЭ
РАН. Т. XLVI. М., Наука, с. 146-153.
Михайлова Е.И. 2015. Скребни рода Neoechinorhynchus (Acanthocephales: Neoechinorhynchidae) северо-вос-
точной Азии (таксономия, зоогеография, экология). Автореф. дис. … канд. биол. наук. СПб, 22 с.
Михайлова Е.И. 2018. Новые данные о циклах развития близких видов скребней Neoechinorhynchus tumidus
Van Cleave et Bangham, 1949 и N. baueri sp. n. (Eoacanthocephala: Neoechinorhynchidae) на Севе-
ро-Востоке Азии. В кн.: Современная паразитология - основные тренды и вызовы. Матер. VI съезда
Паразитологического общества. СПб, с. 162.
Михайлова Е.И., Атрашкевич Г.И. 1996. Сравнение паразитарных систем двух фоновых видов скребней
сиговых рыб Чаунского бассейна (Западная Чукотка). В кн.: Задачи и проблемы развития рыбного хо-
зяйства на внутренних водоемах Сибири. Матер. конф. по изучению водоемов Сибири. Томск, с. 107.
Петроченко В.И. 1956. Акантоцефалы (скребни) домашних и диких животных. Т. I. М., Изд-во АН СССР,
435 с.
Пугачев О.Н. 1984. Паразиты пресноводных рыб Северо-Востока Азии. Л., Изд-во Зоол. ин-та АН СССР,
155 с.
Пугачев О.Н. 2004. Каталог паразитов пресноводных рыб Северной Азии. Нематоды, скребни, пиявки, мол-
люски, ракообразные, клещи. Тр. Зоол. ин-та РАН. 304. СПб., Изд-во Зоол. ин-та РАН, 250 с.
Скрябина Е.С. 1978. Морфологическая изменчивость скребней рода Neoechinorhynchus (Acanthocephala:
Neoechinorhynchidae), паразитирующих у рыб Ледовитоморской провинции в пределах СССР.
Паразитология 12 (6): 512-521.
52
Трофименко В.Я. 1969. Гельминтофауна пресных вод Азиатской Субарктики. Дис. … канд. биол. наук. М.,
313с.
Amin O.M. 2002. Revision of Neoechinorhynchus Stiles et Hassall, 1905 (Acanthocephala: Neoechinorhynchidae)
with keys to 88 species. Systematic Parasitology 53 (1): 1-18.
Amin O.M., Saoud M.F. A., Alkuwari K.S. R. 2002. Neoechinorhynchus qatarensis sp. n. (Acanthocephala:
Neoechinorhynchide) from the blue-barred flame parrot fish, Scarus ghobban Forsskål, 1775, in Qatari
waters of the Arabian Gulf. Parasitology International 51 (1): 171-176.
García-Varela M., Pérez-Ponce de León G. 2008. Validating the systematic position of Profilicollis Meyer, 1931 and
Hexaglandula Petrochenko, 1950 (Acanthocephala: Polymorphidae) using cytochrome c oxidase (Cox 1).
Journal of Parasitology 94 (1): 212-217.
Herlin H., Taraschewsky H. 2017. Evolutionary anatomy of the muscular apparatus involved in the anchoring of
Acanthocephala to the intestinal wall of their vertebrate hosts. Parasitology Research 116 (4):1207-1225.
Hoffman G.L. 1999. Parasites of North American freshwater fishes. Comstock Publishing Associates, 539 pp.
Malyarchuk B., Derenko M., Mikhailova E., Denisova G. 2014. Phylogenetic relationships among Neoechinorhynchus
species (Acanthocephala: Neoechinorhynchidae) from North-East Asia based on molecular data. Parasitology
International 63 (1): 100-107.
Muzzall P., Madenjian C. 2013. Parasites of Bloater Coregonus hoyi (Salmonidae) from Lake Michigan, U.S.A.
Comparative Parasitology 80 (2): 164-170.
Nickol B. B., Crompton D. W. T., Searle D. W. 1999. Reintroduction of Profilicollis Meyer, 1931, as a genus in
Acanthocephala: Significance of the intermediate host. Journal of Parasitology 85 (4): 716-718.
Sobecka E., Szostakowska B., MacKenzie K., Hemmingsen W., Prajsnar S., Eydal M. 2012. Echinorhynchus gadi
Zoega in Müller, 1776 (Acanthocephala: Echinorhynchidae) from Atlantic cod Gadus morhua L. Journal of
Helminthology 86 (1): 16-25.
Uglem G. L. 1972. The life cycle of Neoechinorhynchus cristatus Lynch, 1936 (Acanthocephala) with notes on the
hatching of eggs. Journal of Parasitology 58 (6): 1071-1074.
Van Cleave H. J., Bangham R. V. 1949. Four new species of the acanthocephalan family Neoechinorhychidae from
fresh-water fishes of North America, one representing a new genus. Journal of Washington Academy of
Science 39 (12): 398-409.
NEOECHINORHYNCHUS BAUERI SP. N. (EOACANTHOCEPHALA:
NEOECHINORHYNCHIDAE) - PARASITE OF FRESHWATER FISHES
IN NORTHERN ASIA
E. I. Mikhailova, G. I. Atrashkevich
Key words: Acanthocephala, Neoechinorhynchus baueri sp. n., coregonid fishes, arctic char,
the Asian Subarctic, Northern Asia.
SUMMARY
A taxonomic description of N. baueri sp. n. based on 42 specimens from Chaun River population
(western Chukotka). This description is a summation of the many years of investigations of
acanthocephalans from the northern Russia belonging to the genus Neoechinorhynchus. New data
on genetic features and ecology of acanthocephalans parasitizing on salmonids inhabiting the North-
Eastern Russia determined the necessity to revise the species affiliation of these worms. Morphological
difference between the species N. crassus and N. tumidus in the shape of roots of anterior and middle
proboscis hooks described by V. Ya. Trofimenko (1969) was used by him to distinguish between
the two species. Basing on the established fact that N. crassus in Asia is not present, we allocated
acanthocephalans having roots with manubria in the new species N. baueri sp. n. Similarity of this
feature in specimens from different geographic populations is shown by the collection of photographs.
This form of acanthocephalans is widespread in low reaches of Siberian and Chukchi rivers. To the
species N. tumidus we attribute also the lacustrine form that occurs in mountain lands of the North-
Eastern Russia. In addition to the above mentioned morphological feature that was detected earlier, the
difference is described in egg structures between specimens of N. baueri sp. n. and N. tumidus from
Asian populations and the data are given on divergence in dimensions of their lemnisci.
53