ПАРАЗИТОЛОГИЯ, 53, 1, 2019
УДК 595.121:577.15
НЕКОТОРЫЕ ОСОБЕННОСТИ ИНГИБИРОВАНИЯ
АКТИВНОСТИ ТРИПСИНА ЦЕСТОДАМИ TRIAENOPHORUS
NODULOSUS И EUBOTHRIUM RUGOSUM
© 2019 г. Г. И. Извекова*, Т. В. Фролова
Институт биологии внутренних вод им. И.Д. Папанина РАН,
Борок, Ярославская обл., 152742 Россия
* e-mail: izvekov@ibiw.yaroslavl.ru
Поступила 28.11.2018 г.
Исследовано влияние экстрактов цестод Triaenophorus nodulosus (Pallas, 1781) и Eubothrium
rugosum (Batsch, 1786), обитающих в кишечниках щуки и налима соответственно, на активность
коммерческого препарата трипсина. Установлено, что добавление этих экстрактов приводит к
немедленному достоверному снижению активности раствора трипсина. Уровень влияния экс-
трактов зависит от их разведения. Чем меньше разведение экстракта червей, тем выше уровень
ингибирования активности трипсина. В то же время масса червей не оказывает достоверного
влияния на их ингибирующий эффект. Ингибиторы протеиназ защищают исследованных цестод
от деструктивного воздействия протеолитических ферментов хозяев.
Ключевые слова: цестоды, протеолитические ферменты, трипсин, ингибиторы протеиназ.
DOI: 10.1134/S0031184719010071
Все паразитические организмы в течение жизненного цикла сталкиваются со сход-
ными проблемами. Им необходимо проникнуть в другую среду, преодолев тканевой
барьер, получить необходимые для развития питательные вещества и избежать иммун-
ного ответа хозяина. Кроме этого, несмотря на весьма выгодное в отношении доступ-
ности питательных веществ окружение, цестодам, обитающим в кишечнике позвоноч-
ных животных, необходимо защититься от постоянного действия протеолитических
ферментов их хозяев. Один из главных механизмов защиты от протеиназ хозяина -
секреция паразитами ингибиторов этих ферментов, которые способны эффективно
инактивировать протеиназы в их среде обитания (Hawley, Peanasky, 1992). Ингибито-
ры протеиназ, так же как и сами протеиназы, играют важную роль в жизненном цикле
паразитов, их вирулентности и патогенезе (Rascón, McKerrow, 2013). Большое количе-
ство выделенных и описанных ингибиторов протеиназ имеет белковое происхожде-
ние, а большинство известных и охарактеризованных белковых ингибиторов относят-
ся к группе ингибиторов сериновых протеиназ (Molehin et al., 2012).
Большое количество работ посвящено исследованию ингибиторов протеиназ у раз-
личных видов нематод (обзор: Knox, 2007). Работ, касающихся ингибиторов протеиназ
у цестод, немного, список исследованных видов невелик (Извекова, Фролова, 2016),
существенная их часть посвящена эпидемиологически значимым представителям
родов Taenia Linnaeus, 1758 и Echinococcus Rudolphi, 1801 (Leid et al., 1987a, b;
Shepherd et al., 1991; Merckelbach, Ruppel, 2007; González et al., 2009). Известно, что ин-
гибиторы сериновых протеиназ - один из ключевых компонентов среди секреторных
73
продуктов многих видов паразитов (Merckelbach, Ruppel, 2007; González et al., 2009).
У цестод к настоящему времени установлено существование только ингибиторов
сериновых протеиназ - трипсина и химотрипсина. Трипсин - протеолитический фер-
мент, один из основных ферментов пищеварения, он катализирует гидролитическое
расщепление белков и пептидов. Трипсин обнаружен у всех позвоночных животных;
кроме того, у многих беспозвоночных, растений и микроорганизмов найден фермент,
аналогичный трипсину (Диксон, Уэбб, 1982).
Работ, посвященных способности обитающих в кишечнике рыб цестод ингибиро-
вать протеиназы хозяина, крайне мало. Есть сведения, что неповрежденная цестода
Proteocephalus longicollis (Zeder, 1800) из лососевых рыб секретирует в среду инги-
битор трипсина (Reichenbach-Klinke, Reichenbach-Klinke, 1970). Установлено, что экс-
тракты, приготовленные из личинок и взрослых червей Bothriocephalus acheilognathi
Yamaguti, 1934, угнетали трипсиновую и химотрипсиновую активность кишечника
карпа in vitro (Matskási, 1984). В серии наших работ показана способность взрослых
цестод, обитающих в кишечнике некоторых видов рыб, ингибировать активность трип-
сина и активность протеиназ гомогената слизистой оболочки кишечника их хозяев, и
определены условия осуществления этой способности (Извекова и др., 2017; Izvekova
et al., 2017 a, b).
Triaenophorus nodulosus (Pallas, 1781) - часто встречающийся и широко распростра-
ненный вид рода Triaenophorus. Этот вид цестод отмечен почти во всех водоемах Ев-
ропы, Сибири и Северной Америки, где обитает его окончательный хозяин - щука
(Куперман, 1988).
Eubothrium rugosum (Batsch, 1786) - специфичный паразит налима, обитающий
в его кишечнике. Головной конец червей прикрепляется в пилорических придатках
кишечника налима, а стробила выходит в его среднюю часть. Значительная часть чер-
вей способна после частичной дестробиляции полностью регенерировать и достигать
половой зрелости в кишечнике налима (Куперман, 1988).
Цель работы - исследовать некоторые особенности ингибирования экстрактами це-
стод Triaenophorus nodulosus и Eubothrium rugosum активности трипсина - одного из
основных пищеварительных ферментов, функционирующего в кишечнике хозяев-рыб.
МАТЕРИАЛ И МЕТОДИКА
Объектом исследований служили цестоды Triaenophorus nodulosus и Eubothrium
rugosum из кишечника щуки Esox lucius (L.) и налима Lota lota (L.), соответственно.
Исследованы черви из 5 щук и 12 налимов, выловленных в Рыбинском водохрани-
лище. Кишечники рыб вскрывали, извлекали червей и 3 раза тщательно промывали
в 10 мл раствора Рингера (6 г NaCl; 0.14 г KCl; 0.5 мл 10 % CaCl2; 0.54 г Na2HPO4;
0.02 г KH2PO4; 0.16 г MgSO4 в 1 л дистиллированной воды), рН 7.5 для холоднокров-
ных животных с целью удаления ферментов хозяина. Из каждой щуки извлекали по
2-4 червя массой 0.25 ± 0.03 г, из каждого налима - по 1-5 червей массой 0.64 ± 0.07 г.
Вскрытие рыб, их кишечников, извлечение червей и приготовление препаратов произ-
водили на ледяной бане.
Подготовка экстракта червей
Извлеченных из кишечников и отмытых, как описано выше, червей гомогенизиро-
вали и гомогенат разводили раствором Рингера в различных соотношениях в зависи-
мости от поставленных задач. Для исследования зависимости ингибиторной способ-
ности червей от времени действия на трипсин гомогенат разводили в соотношении
74
масса-объём 1 : 9. Это разведение было определено как оптимальное при исследо-
вании ингибирующей способности червей в предыдущих опытах (Izvekova et al.,
2017 a, b). Гомогенаты готовили с помощью стеклянных гомогенизаторов фирмы Sartorius
AG (Германия). Гомогенаты червей центрифугировали при 6500 g в течение 5 мин при
4 °C. Экстракты червей (супернатант), полученные после центрифугирования их гомо-
генатов, замораживали до дальнейшего использования.
Для исследования влияния разведения источника ингибитора на активность трипси-
на гомогенат червей разводили в соотношении масса-объём 1 : 4 (5 раз), центрифуги-
ровали, как указано выше, и из супернатанта готовили разведения 10, 20, 30, 40, 50 и
80 раз. Таким способом получали различные разведения растворенных в растворе Рин-
гера экскреторно-секреторных продуктов. Для исследования влияния массы червей на
активность трипсина гомогенат готовили из расчета 0.1, 0.25 и 0.5 г в 2 мл раствора
Рингера и центрифугировали, как описано выше, т.е. исследовали выделение экскре-
торно-секреторных продуктов червями разной массы в один и тот же объем раствора
Рингера.
Определение ингибирующей способности червей
При определении ингибирующей способности червей источником протеиназ слу-
жил коммерческий препарат трипсина (T4799, Sigma) в концентрации 0.01 мг/мл
в трис-буфере (рН 7.5). Для определения ингибирующей способности в опытную
среду, содержащую 200 мкл раствора трипсина, добавляли 20 мкл экстракта червей.
Время инкубации трипсина с ингибитором менялось в зависимости от поставленных
задач. В экспериментах по определению влияния разведения экстракта и массы чер-
вей на активность трипсина время инкубации составляло 15 мин. При определении
влияния времени действия ингибитора на активность трипсина время инкубации со-
ставляло 5, 10, 15, 20, 25 и 30 мин. Одновременно в соответствующую контрольную
пробу добавляли аналогичный объем буфера. После инкубации в пробах определяли
протеолитическую активность. Оптимальные концентрации трипсина и экстракта чер-
вей установлены ранее в специальных экспериментах (Izvekova et al., 2017 a, b).
Определение протеолитической активности
Активность трипсина определяли с использованием в качестве субстрата 0.3 %
азо-казеина в трис-буфере, рН 7.5 (Alarcón et al., 2002). Субстрат и ферментативно
активный препарат инкубировали 60 мин при 20-22 °С. Реакцию останавливали до-
бавлением 400 мкл 0.3 M раствора трихлоруксусной кислоты (ТХУ), образовавшийся
осадок из негидролизованного белка удаляли центрифугированием при 6500 g в тече-
нии 5 мин. Интенсивность развивающегося окрашивания, пропорционального актив-
ности фермента, измеряли в супернатанте при 440 нм на спектрофотометре Lambda 25
(PerkinElmer).
Единицы протеиназной активности (ЕА) вычисляли по формуле:
ЕА = Δ/ m × T,
где Δ - разница показаний спектрофотометра пробы с субстратом и холостой пробы
(при 440 нм); m - масса раствора трипсина, г; T - время инкубации, мин
Статистическая обработка
Результаты представлены в виде средних и их стандартных ошибок. Обработка ре-
зультатов выполнена с помощью программы Microsoft Excel 2010 и статистического
75
пакета STATISTICA 8 (StatSoft Inc., Tulsa, OK). Ингибиторный эффект оценивали при
помощи однофакторного дисперсионного анализа с использованием критерия Тьюки
для множественного сравнения средних значений при p < 0.05.
РЕЗУЛЬТАТЫ
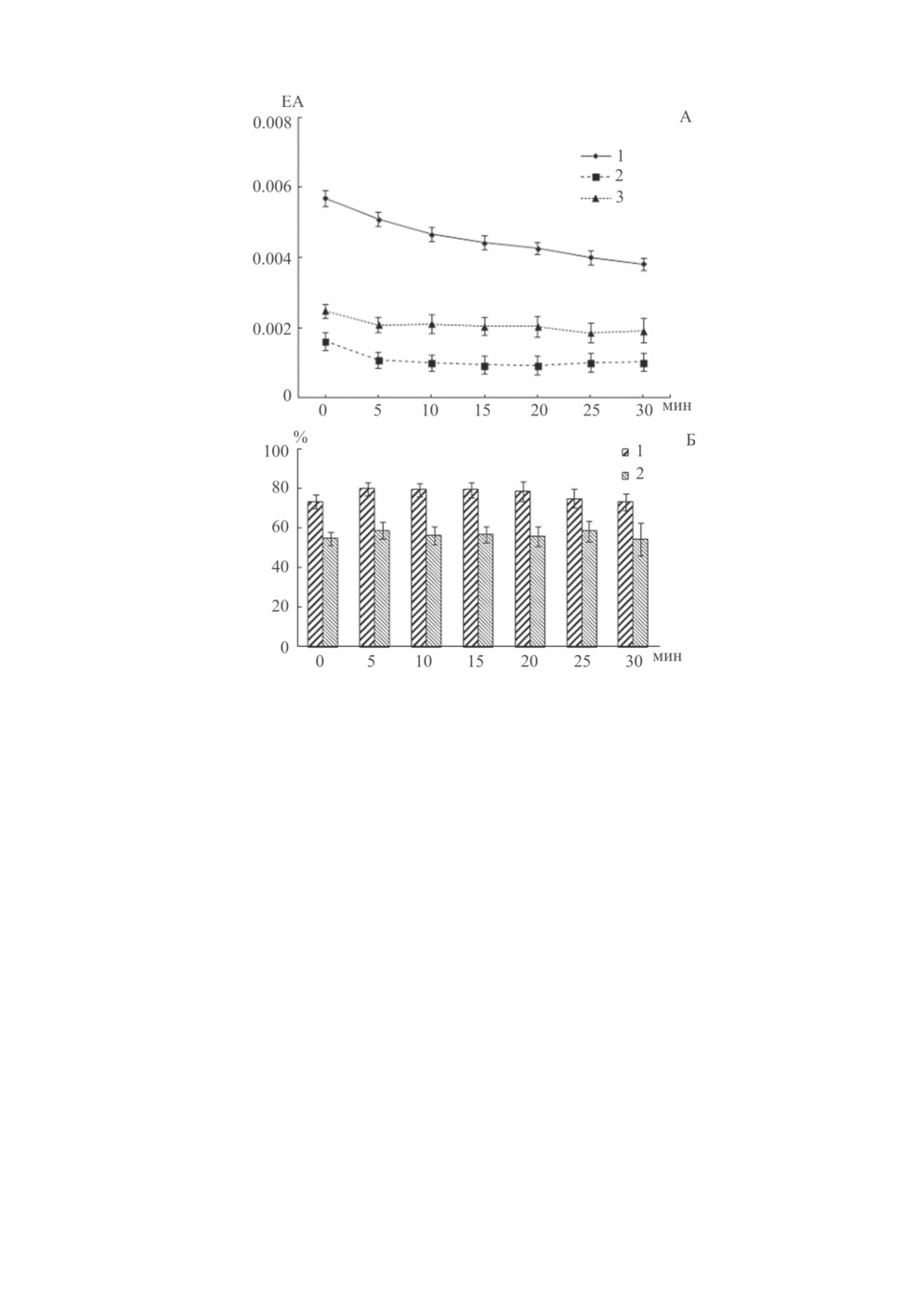
Исследование активности трипсина в концентрации 0.01 мг/мл через каждые 5 мин
показало, что она достоверно (p < 0.05) уменьшается через 10 мин; в течение следую-
щих 20 мин активность несколько снижается, но изменения ее уровня недостоверны
(рис. 1, А). Инкубирование трипсина с одним и тем же объемом (20 мкл) экстракта
цестод в течение различных промежутков времени приводит к достоверному (p < 0.05)
снижению его активности (рис. 1, А). При этом ингибирование активности трипсина
происходит немедленно после добавления экстракта цестод и уровень его активности
в течение последующих 30 мин значительно не изменяется. Не отмечено достовер-
ных различий между активностью трипсина при добавлении экстрактов T. nodulosus
или E. rugosum (рис. 1, А). В то же время доля ингибирования трипсина экстрактом
T. nodulosus составила от 73.1 до 79.7 % в зависимости от времени инкубации, а доля
ингибирования фермента при действии экстракта E. rugosum - от 54.2 до 58.7 %
(рис. 1, Б).
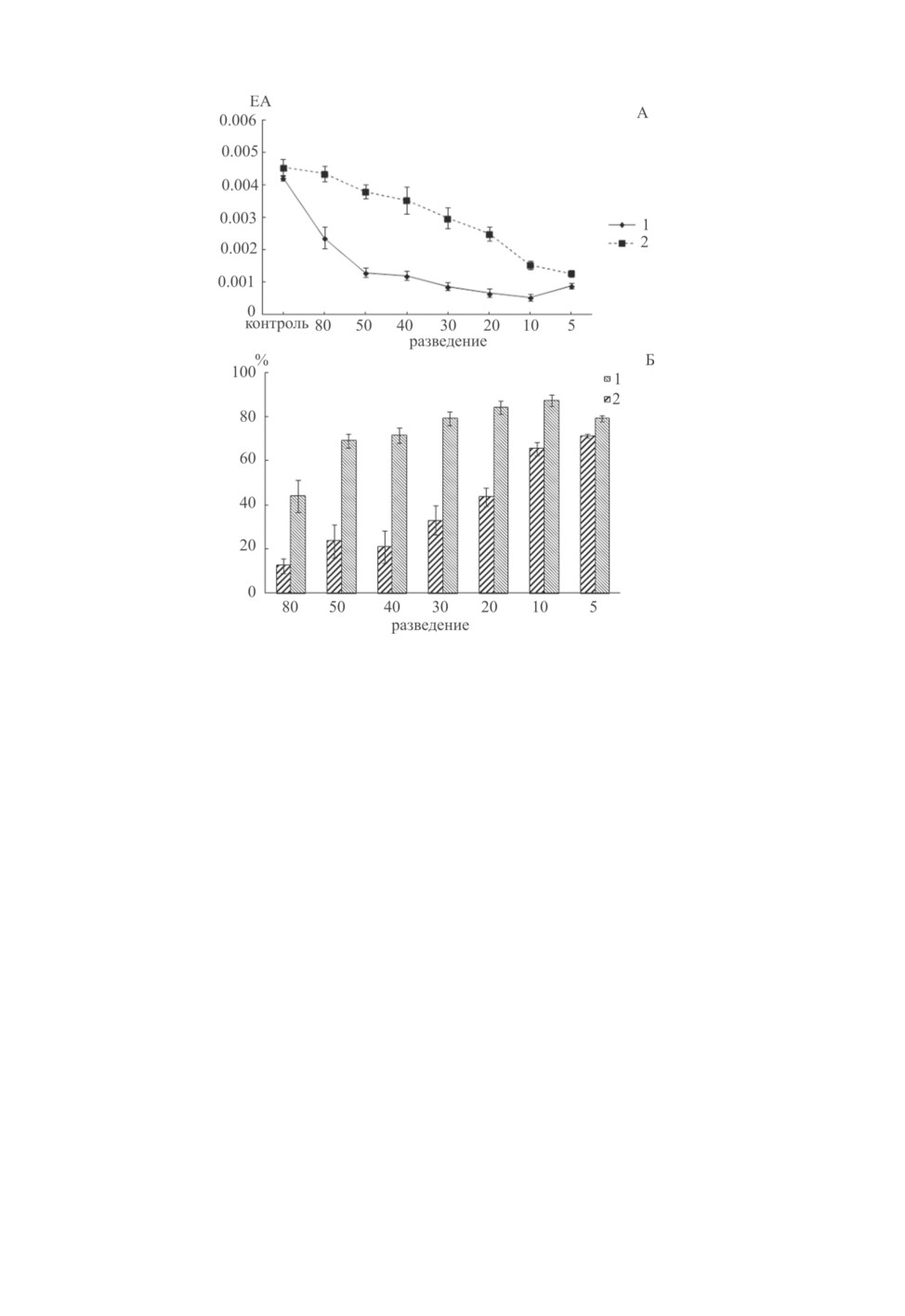
Разведение экстрактов T. nodulosus и E. rugosum показало, что чем меньше разве-
ден экстракт червей, тем больший эффект ингибирования он оказывает на активность
трипсина (рис. 2, А). Достоверное влияние достигается при разведении экстракта
T. nodulosus в 50 раз и меньше, а экстракта E. rugosum в 40 раз и меньше. При этом
влияние экстракта T. nodulosus достоверно сильнее, чем такового E. rugosum при раз-
ведениях от 20 до 80 раз (p <0 .05). При разведении в 5-10 раз действия экстрактов
этих цестод достоверно не различаются. С увеличением разведения влияние экстракта
T. nodulosus падает медленнее, чем экстракта E. rugosum. Доля ингибирования при раз-
личных разведениях для экстракта T. nodulosus составила 43.9-87.4 %, а для такового
E. rugosum - 12.4-71.3 % (рис. 2, Б).
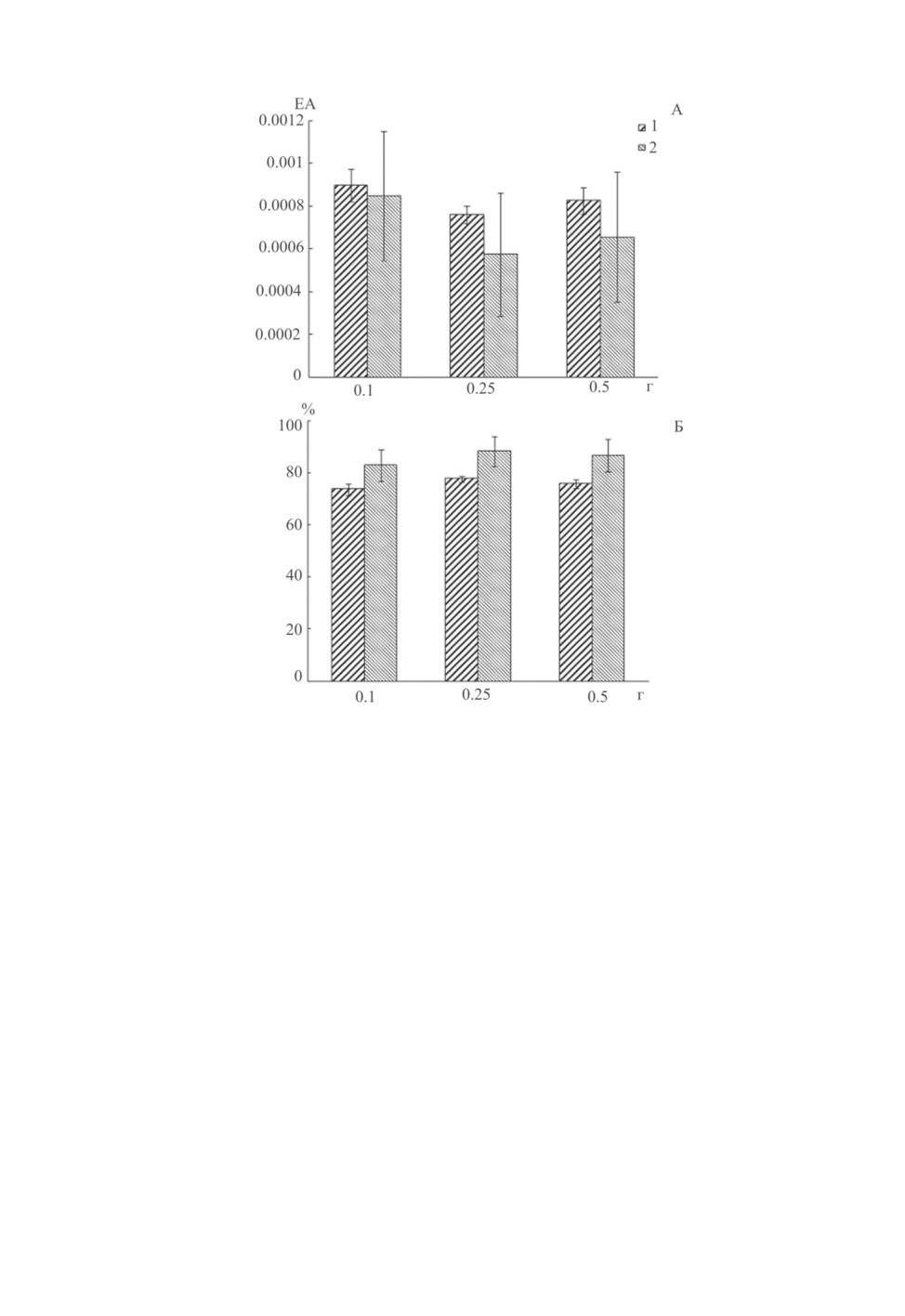
Приготовление экстрактов червей из расчета 0.1, 0.25 и 0.5 г в 2 мл раствора Рингера
показало, что их масса не оказывает достоверного влияния на ингибирующий эффект
исследованных цестод (рис. 3, А). Также достоверно не отличалось влияние на актив-
ность трипсина экстрактов T. nodulosus и E. rugosum в этих условиях эксперимента.
При этом доля ингибирования активности трипсина составила 73.6-77.7 % и 82.8-
88.3 % для экстрактов T. nodulosus и E. rugosum, соответственно (рис. 3, Б).
ОБСУЖДЕНИЕ
Ранее нами было показано, что при заражении цестодами в кишечнике их хозяев-рыб
изменяются активность и спектр протеиназ, причем основные изменения общей про-
теолитической активности у зараженных рыб происходят за счет сериновых протеи-
наз (Извекова, Соловьев, 2016). Было высказано предположение, что эти изменения
в частности могут быть обусловлены адсорбцией ферментов хозяина на поверхности
цестод и их ингибированием. Позже это предположение подтвердилось, и была показа-
на способность экстрактов цестод T. nodulosus и E. rugosum ингибировать активность
трипсина и активность протеиназ гомогената слизистой оболочки кишечника их хозяев
(Izvekova et al., 2017 a, b). Было установлено, что доля ингибирования трипсина в кон-
центрации 0.01 мг/мл экстрактами как T. nodulosus, так и E. rugosum, составляет около
80 % (Izvekova et al., 2017 a, b). Это позволило использовать трипсин указанной кон-
центрации в качестве основной концентрации при исследовании различных условий
76
Рис. 1. А - активность трипсина (0.01 мг/мл) через различные промежутки времени (1)
и влияние на его активность экстракта цестод T. nodulosus (2) и E. rugosum (3).
По горизонтали - время, мин; по вертикали - единицы протеиназной активности, ЕА. Б - доля (%)
ингибирования активности трипсина экстрактом цестод T. nodulosus (1) и E. rugosum (2) через различные
промежутки времени. По горизонтали - время, мин; по вертикали - доля ингибирования, %.
его ингибирования экстрактами цестод. В настоящей работе мы предприняли попытку
определить условия, при которых экстракты исследованных цестод ингибируют актив-
ность трипсина.
В наших экспериментах установлено, что трипсин различных концентраций ингиби-
руется экстрактом не полностью, но в достаточно высокой мере, что защищает параз-
ита от протеолиза. Поскольку ингибирование трипсина экстрактами цестод происхо-
дило немедленно после их добавления к раствору фермента, а черви предварительно
не содержались в этом растворе, можно предположить, что выделение ингибиторов не
индуцируется присутствием протеиназ в среде, а их синтез осуществляется паразитом
постоянно. Аналогичное предположение было сделано при исследовании растворимой
фракции изолированной щеточной каймы тегумента Hymenolepis diminuta (Rudolphi,
1819) (Pappas, Uglem, 1990). Попытки определить ингибиторную способность ще-
точной каймы тегумента H. diminuta позволили установить, что изолированная мем-
брана ее тегумента неустойчива к действию протеолитических ферментов и так же,
как нерастворимая фракция изолированной щеточной каймы, не ингибирует бычий
трипсин. Однако растворимая фракция изолированной щеточной каймы тегумента
77
Рис. 2. А - влияние различного разведения экстрактов T. nodulosus (1) и E. rugosum (2)
на активность трипсина.
По горизонтали- разведение; по вертикали: единицы протеиназной активности, ЕА. Б - доля (%)
ингибирования трипсина экстрактом цестод T. nodulosus (1) и E. rugosum (2) при различном
разведении. По горизонтали- разведение; по вертикали- доля ингибирования, %.
H. diminuta содержит вещества, ингибирующие протеолитическую и амидазную актив-
ность бычьего трипсина и некоторые протеолитические ферменты тонкого кишечника
хозяина; кроме того, выделение ингибитора не индуцируется присутствием протеиназ
в среде (Pappas, Uglem, 1990).
Исследование влияния экстракта червей на активность трипсина различной концен-
трации также показывает, что продуцируемый цестодами ингибитор не обеспечива-
ет 100 % инактивацию трипсина (Izvekova et al., 2017 a, b). При действии экстракта
червей активность всех исследованных концентраций трипсина снижалась, при этом
уровень активности фермента практически не зависел от его концентрации, но по-
вышалась доля ингибирования трипсина, т.е. увеличивалось абсолютное количество
ингибируемого фермента. Было высказано предположение о зависимости ингибирую-
щей способности экстракта червей от концентрации трипсина (Izvekova et al., 2017 b).
Высокая степень ингибирования трипсина экстрактами цестод в наших эксперимен-
тах подтверждает имеющиеся сведения о важной роли ингибиторов протеиназ в жиз-
ненном цикле паразитов (Rascón, McKerrow, 2013). Они продуцируются червями для
предотвращения гидролиза протеиназами хозяина и выживания в его кишечнике и, по
мнению некоторых авторов, вносят вклад в специфичность паразитирования (Hawley,
Peanasky, 1992).
78
Рис. 3. А - активность трипсина в зависимости от массы T. nodulosus (1) и E. rugosum (2).
По горизонтали - масса, г; по вертикали - единицы протеиназной активности, ЕА. Б - доля (%)
ингибирования трипсина экстрактом T. nodulosus (1) и E. rugosum (2) в зависимости от массы червей.
По горизонтали - масса, г; по вертикали - доля ингибирования, %.
Согласно классическим представлениям об ингибировании активности ферментов,
различают необратимое и обратимое ингибирование (Диксон, Уэбб, 1982). При этом
обратимое ингибирование характеризуется равновесием между ферментом и инги-
битором. Степень ингибирования зависит от концентрации ингибитора, достигается
довольно быстро, после чего уже не зависит от времени. Исходя из этих сведений и
полученных нами данных (ингибирование активности трипсина произошло немедлен-
но после добавления экстракта цестод, и затем уровень его активности значительно не
изменялся), можно сделать предположение, что в экстрактах исследованных цестод
содержится ингибитор трипсина, взаимодействующий с ним по типу обратимого инги-
бирования. Однако известно, что реакции захвата фермента ингибитором никогда не
являются действительно обратимыми, поскольку немодифицированный ингибитор
не подвергается восстановлению (Диксон, Уэбб, 1982). Исследования ингибирующей
способности экстрактов цестод T. nodulosus и E. rugosum показали ее зависимость от
концентрации, быстрое взаимодействие с ферментом и независимость от времени
взаимодействия. Это согласуется с данными, полученными при исследовании инги-
бирующей способности других гельминтов. Так, зависимость от концентрации экс-
трактов Taenia taeniaformis Batsch, 1786 обнаружена при исследовании способности
79
этих экстрактов ингибировать активность трипсина и химотрипсина (Suquet et al.,
1984). Также от концентрации ингибитора сериновых протеаз SmSPI, обнаруженного
у Schistosoma mansoni Sambon, 1907, зависел уровень ингибирования химотрипсина
(Pakchotanon et al., 2016).
Ранее в экстрактах половозрелых червей и в инкубационной среде плероцеркоидов
Taenia pisiformis Bloch 1780, содержащихся in vitro, обнаружен ингибитор протеиназ
(Németh et al., 1979). Ингибирующая способность проявлялась по отношению к три-
псину и химотрипсину быка, собаки и кролика. Однако этот ингибитор не влиял на
гидролитическую активность субтилизина, эластазы, коллагеназы, пепсина, ренина и
папаина. Кроме того, установлено образование комплекса между трипсином и химо-
трипсином и ингибитором, происходящее за 3-4 мин (Németh et al., 1979; Németh,
Juhász, 1981), что вполне согласуется с полученными нами данными для экстрактов
T. nodulosus и E. rugosum, при использовании которых в качестве источника ингиби-
тора трипсина, инактивация последнего наступала сразу после добавления экстрактов
цестод.
Взаимодействие паразит-хозяин обеспечивается комплексом различных веществ,
продуцируемых обоими партнерами. Известно, что в жизненном цикле гельминтов
протеазы играют ключевую роль при проникновении через тканевой барьер и укло-
нении от иммунного ответа хозяина. При этом продуцируемые паразитом ингибиторы
могут защищать их от протеолитических ферментов хозяина или регулировать актив-
ность собственных эндогенных ферментов (McKerrow et al., 2006).
ЗАКЛЮЧЕНИЕ
Таким образом, в результате проведенных исследований установлено, что добавле-
ние экстрактов цестод T. nodulosus и E. rugosum приводит к немедленному достовер-
ному снижению активности раствора коммерческого препарата трипсина. Чем больше
концентрация экстракта червей (т.е. чем меньше разведен экстракт), тем больший эф-
фект ингибирования он оказывает на активность трипсина. Масса червей не оказывает
достоверного влияния на ингибирующую способность исследованных цестод. Доля
ингибирования трипсина экстрактами червей зависит от условий эксперимента, пре-
вышая в некоторых случаях 80 %. Наличие ингибиторов протеиназ необходимо оби-
тающим в кишечнике цестодам для защиты от постоянного воздействия протеолити-
ческих ферментов хозяина.
БЛАГОДАРНОСТИ
Работа выполнена в рамках государственного задания ИБВВ РАН (тема № ААА-
А-А18-118012690100-5).
СПИСОК ЛИТЕРАТУРЫ
Диксон М., Уэбб Э. 1982. Ферменты. Москва, Мир, 1118 с.
Извекова Г. И., Соловьев М. М. 2016. Особенности влияния цестод, паразитирующих в кишечнике рыб, на
активность протеиназ хозяев. Известия РАН. Серия биологическая 2: 182-187.
Извекова Г. И., Фролова Т. В. 2016. Протеолитические ферменты и их ингибиторы у цестод. Успехи совре-
менной биологии 136 (4): 404-416.
Извекова Г. И., Куклина М. М., Фролова Т. В. 2017. Инактивация протеолитических ферментов цестодами.
Доклады Академии Наук 475 (4): 469-472.
Куперман Б. И. 1988. Функциональная морфология низших цестод. Ленинград, Наука, 168 с.
Alarcón F. J., Martínez T. F., Barranco P. Cabello T., Díaz M., Moyano F. J. 2002. Digestive proteases during de-
velopment of larvae of red palm weevil, Rhynchophorus errugineus (Olivier, 1790) (Coleoptera: Curculioni-
dae). Insect Biochemistry and Molecular Biology 32: 265-274.
80
González S., Fló M., Margenat M. Durán R., González-Sapienza G., Graña M., Parkinson J., Maizels R. M.,
Salinas G., Alvarez B., Fernández C. 2009. A family of diverse Kunitz inhibitors from Echinococcus granu-
losus potentially involved in host-parasite cross-talk. PLoS ONE 4 (9): e7009.
Hawley J. H., Peanasky A. J. 1992. Ascaris suum: Are trypsin inhibitors involved in species specificity of ascarid
nematodes? Experimental Parasitology 75: 112-118.
Izvekova G. I., Frolova T. V., Izvekov E. I. 2017a. Adsorption and inactivation of proteolytic enzymes by Triaeno-
phorus nodulosus (Cestoda). Helminthologia 54 (1): 3-10.
Izvekova G. I., Frolova T. V., Izvekov E. I. 2017b. Inactivation of proteolytic enzymes by Eubothrium rugosum
(Batsch, 1786) (Cestoda) from the gut of burbot Lota lota (Linnaeus). Folia Parasitologica 64: 016.
Knox D. P. 2007. Proteinase inhibitors and helminth parasite infection. Parasite Immunology 29: 57-71.
Leid R. W., Grant R. F., Suquet C. M. 1987a. Inhibition of equine neutrophil chemotaxis and chemokinesis by
a Taenia taeniaeformis proteinase inhibitor, taeniaestatin. Parasite Immunology 9 (2): 195-204.
Leid R. W., Grant R. F., Suquet C. M. 1987b. Inhibition of neotrophil aggregation by taeniaestatin, a cestode protein-
ase inhibitor. International Journal for Parasitology 17 (7): 1349-1353.
Matskási I. 1984. The effect of Bothriocephalus acheilognati infection on the protease and α-amylase activity in the
gut of carp fry. Symposia Biologia Hungarica 23: 119-125.
McKerrow, J. H. Caffrey C., Kelly B., Loke P., Sajid M. 2006. Proteases in parasitic diseases. Annual Review of
Pathology 1: 497-536.
Merckelbach A., Ruppel A. 2007. Biochemical properties of an intracellular serpin from Echinococcus multilocula-
ris. Molecular Biochemical Parasitology 156: 84-88.
Molehin A. J., Gobert G. N., McManus D. P. 2012. Serine protease inhibitors of parasitic helminthes. Parasitology
139 (6): 681-695.
Németh I., Juhász S. 1981. Properties of a trypsin and chymotrypsin inhibitor secreted by larval Taenia pisiformis.
International Journal for Parasitology 11 (2): 137-144.
Németh I., Juhász S., Baintner K. 1979. A trypsin and chymotrypsin inhibitor from Taenia pisiformis. International
Journal for Parasitology 9 (6): 515-522.
Pakchotanon P., Molee P., Nuamtanong S., Limpanont Y., Chusongsang P., Limsomboon J., Chusongsang Y.,
Maneewatchararangsri S., Chaisri U., Adisakwattana P. 2016. Molecular characterization of serine protease
inhibitor isoform 3, SmSPI, from Schistosoma mansoni. Parasitology Research 115 (8): 2981-2994.
Pappas P. W., Uglem G. L. 1990. Hymenolepis diminuta (Cestoda) liberates an inhibitor of proteolytic enzymes
during in vitro incubation. Parasitology 101: 455-464.
Rascón Jr, McKerrow J. H. 2013. Synthetic and natural protease inhibitors provide insights into parasite develop-
ment, virulence and pathogenesis. Current Medicinal Chemistry 20: 3078-3102.
Reichenbach-Klinke H.-H., Reichenbach-Klinke K.-E. 1970. Enzymuntersuchungen an Fischen. II. Trypsin- und
α-amylase-Inhibitoren. Archiv für Fischereiwissenschaft 21: 72-76.
Shepherd J. C., Aitken A., McManus D. P. 1991. A protein secreted in vivo by Echinococcus granulosus inhibits
elastase activity and neutrophil chemotaxis. Molecular and Biochemical Parasitology 44: 81-90.
Suquet C., Green-Edwards C., Wes Leid R. 1984. Isolation and partial characterization of a Taenia taeniaeformis
metacestode proteinase inhibitor. International Journal for Parasitology 14 (2): 165-172.
CERTAIN CHARACTERISTICS OF TRYPSIN ACTIVITY INHIBITION
BY CESTODES TRIAENOPHORUS NODULOSUS
AND EUBOTHRIUM RUGOSUM
G. I. Izvekova, T. V. Frolova
Key words: cestodes, proteolytic enzymes, trypsin, proteinase inhibitors.
SUMMARY
The effect of the extracts from cestodes T. nodulosus and E. rugosum inhabiting the intestines of pike
and burbot, respectively, on the activity of commercial trypsin was studied. It was found that adding
these extracts leads to an immediate and significant decrease in the activity of trypsin solution. The
impact level of the extracts depends on their dilution. The lower the dilution of the worm extract, the
higher the level of trypsin activity inhibition. At the same time, the mass of the tapeworms have no
significant influence on their inhibitory effect. Proteinase inhibitors protect the studied cestodes from
the destructive effects of host proteolytic enzymes.
81