ПАРАЗИТОЛОГИЯ, 53, 2, 2019
УДК 591.69:597.55
ВИДОВОЕ БОГАТСТВО СООБЩЕСТВ ПАРАЗИТОВ РОТАНА
PERCCOTTUS GLENII (ACTINOPTERYGII, ODONTOBUTIDAE)
В НАТИВНОЙ И ПРИОБРЕТЕННОЙ ЧАСТЯХ
АРЕАЛА ХОЗЯИНА
© 2019 г. Е. П. Иешко1, А. В. Коросов2, C. Г. Соколов1, 3*
1 Институт биологии Карельского научного центра РАН,
ул. Пушкинская, 11, Петрозаводск, 185035 Россия
2 Институт биологии, экологии и агротехнологий Петрозаводского государственного
университета, пр-т Ленина, 33, Петрозаводск, 185910 Россия
3 Институт проблем экологии и эволюции им. А.Н. Северцова РАН, Ленинский пр-т, 33,
Москва, 119071 Россия
* е-mail: sokolovsg@mail.ru
Поступила 4.12.2018 г.
После доработки 14.01.2019 г.
Принята к публикации 15.01.2019 г.
Исследованы особенности накопления видового богатства сообществ паразитов ротана
(Perсcottus glenii) в естественных местообитаниях и зонах интродукции хозяина. Показано,
что видовое богатство инфрасообществ паразитов ротана моделируется Гамма-законом как в
нативной, так и в приобретенных частях ареала хозяина. Исключение составляют случаи для
популяций хозяина в зонах интродукции, когда среднее значение видового богатства инфрасо-
обществ не превышает двух видов. Для анализа видового богатства компонентных сообществ (s)
использована степенная модель накопления видов s = anb, где a - ожидаемое значение видового
богатства на первой исследованной особи хозяина, а b - скорость нарастания видового богатства
компонентных сообществ паразитов, обусловленная увеличением числа исследованных особей
хозяина (n). Установлено, что инфра- и компонентные сообщества паразитов ротана в новых для
этого хозяина водоемах значимо беднее по видовому богатству, чем в естественных местооби-
таниях. При этом компонентные сообщества паразитов не различаются по темпам накопления
видового богатства, несмотря на то, что имеют различия по таксономическому разнообразию.
Ключевые слова: видовое богатство, инфра- и компонентные сообщества паразитов, кривые
накопления видов, интродуценты, Perccottus glenii.
DOI: 10.1134/S0031184719020066
Экологическая паразитология, в отличие от экологии свободно живущих организмов,
имеет определенные преимущества, связанные с выявлением минимальной единицы
сообщества - инфрасообщества (Poulin, 2007). Инфрасообщества, при соблюдении
определенных принципов однородности, являются статистически равноценными
повторностями, количество и состав которых обусловливают структурированность
145
параметров компонентного сообщества паразитов, в частности видовое богатство.
Визуальным выражением зависимости видового богатства паразитарных сообществ
от числа исследованных хозяев (инфрасообществ) служит кривая накопления видового
богатства.
Обычно построение кривых накопления служит инструментом оценки ре-
презентативности выборочного усилия для характеристики той или иной локальной
паразитофауны либо нивелирования различий сравниваемых выборок хозяев по коли-
честву исследованных особей (например,Walther et al., 1995; Poulin, 2007; Sellers
et al., 2015; Anglade, Randhawa, 2018). Однако моделирование кривых может иметь
более широкое применение, одно из которых - оценка скорости роста видового
богатства, обусловленного увеличением числа исследованных рыб (Иешко, Коросов,
2012).
Дифференциация ареала рыб-интродуцентов на нативную и приобретенную
части является существенным фактором изменчивости их паразитарных сообществ
(Петрушевский, 1954; Kennedy, Bush, 1994; Paterson et al., 2012; Соколов, Жуков, 2016).
Однако особенности накопления видового богатства паразитов у интродуцированных
видов рыб в разных частях их ареала еще не подвергались детальному рассмотрению.
К числу интродуцированных видов принадлежит ротан (Perccottus glenii Dybowski,
1877). Нативная часть ареала этой пресноводной рыбы охватывает бассейн Среднего
и Нижнего Амура и ряд сопредельных с ним водных систем, приобретенная часть -
водоемы Сибири и Европы (Решетников, 2009; Reshetnikov, Schliewen, 2013).
Концепция экологического соответствия (ecological fitting - по англоязычной
терминологии) определяет возможность формирования множественных ассоциаций
интродуцента с видами аборигенной фауны (Agosta, Klemens, 2008; Harvey et al.,
2012; Malcicka et al., 2015; Le Roux et al., 2017). Однако априори экологические
связи интродуцированного вида с другими членами реципиентного сообщества
имеют менее выраженный коадаптивный характер по отношению к экологическим
связям, сложившимся в нативном для него биоценозе. Поэтому мы предполагаем, что
инфрасообщества паразитов, сформированные у ротана в нативной части его ареала
и в условиях интродукции, различаются по видовому богатству, а компонентные
сообщества
- по скорости накопления видового богатства. Настоящая работа
направлена на проверку данной гипотезы.
МАТЕРИАЛ И МЕТОДИКА
В работе использован паразитологический материал, собранный из 9 водоемов, охва-
ченных нативной и приобретенной частями ареала ротана (табл. 1). Видовой состав па-
разитов, показатели зараженности ротана и размерные характеристики обследованных
рыб были приведены ранее (Соколов, Фролов, 2012; Соколов, 2013; Соколов, Мошу,
2013; Соколов и др., 2013, 2014; Sokolov et al., 2014). В настоящей публикации учте-
ны только результаты полных паразитологических вскрытий рыб. Все отмеченные ин-
фузории рода Trichodina Ehrenberg, 1838 рассматриваются в составе одного сборного
таксона Trichodina spp.
Исходные данные о регистрации s видов паразитов в n особях ротана, отловленных
в конкретном водоеме, были собраны в таблицы размером s × n, содержащие значения
146
Таблица 1. Данные об изученных выборках ротана
Водоем
Местонахождение
n, экз.
Нативная часть ареала ротана
«Озеро-1»
Приморский край,
30
43°6ʹ с.ш., 131°37ʹ в.д.
«Озеро-2»
То же,
30
43°4ʹ с.ш.,131°36ʹ в.д.
«Озеро-3»
То же,
30
43°3ʹ с.ш.,131°34ʹ в.д.
Оз. Сладкое
Сахалин,
47
53°23ʹ с.ш.,142°0ʹ в.д.
Приобретенная часть ареала ротана
Оз. Глушица Подстепная
Воронежская обл.,
37
51º14ʹ с.ш., 41º42ʹ в.д.
«Горнослинкино-2»
Тюменская обл.,
23
58º45ʹ с.ш., 68º47ʹ в.д.
Старица р. Драгиште у с. Булбоака
Республика Молдова,
21
48°22ʹ с.ш., 27°12ʹ в.д.
Оз. Жилое
Новосибирская обл.,
28
55°18ʹ с.ш., 78°28ʹ в.д.
Мотовилихинский пруд
Пермский край,
33
58°02ʹ с.ш., 56°19ʹ в.д.
1 (регистрация вида) и 0 (отсутствие вида). Отдельный столбец этих таблиц отражал
факты встречи разных видов паразитов на конкретной i-й особи хозяина, а отдельная
строка - случаи обнаружения данного j-го вида паразита на разных особях. Всего было
подготовлено 9 таких таблиц для отдельных водоемов. Кроме этого, были подготовле-
ны две таблицы, объединяющие данные из нативной и приобретенной частей ареала
ротана.
Для каждой таблицы исходных данных формировали дополнительную таблицу, в ко-
торой для каждого вида паразита рассчитывались накопленные частоты с использова-
нием программной среды R-3.4.1 for Windows. Таким образом, получали ряды чисел,
отображающие динамику пополнения видового списка паразитов по мере увеличения
числа обследованных особей хозяина. После деления чисел в рядах на те же числа по-
лучали таблицу, состоящую из значений 0 (отсутствие вида паразита) и 1 (присутствие
вида), которая обозначала факт регистрации данного вида паразита к моменту исследо-
вания данной особи (считая слева направо). Далее рассчитывался ряд значений суммы
для каждого i-го столбца. Этот ряд соответствует числу видов паразитов (si), учтенных
к моменту регистрации очередной i-й особи рыбы, и выражает динамику пополнения
видового списка паразитов при заданном порядке следования рыб в изучаемой выбор-
ке (s1 ≤ s2 ≤ … ≤ si ≤ … sn).
Изменение порядка включения рыб в представленный подсчет ведет к получению
иного ряда накопления видового богатства паразитов. В этой связи для корректного
анализа необходимо изучать или весь спектр вариантов кривых накопления числа ви-
дов, или существенное их множество. Это задача была решена путем случайной пере-
становки конкретных рыб в исходной выборке (ресамплинг) с последующим расчетом
147
новых частных рядов накопления числа видов. Для каждого нового ряда рассчитыва-
лось свое уравнение регрессии. Для каждого водоема и объединенных выборок были
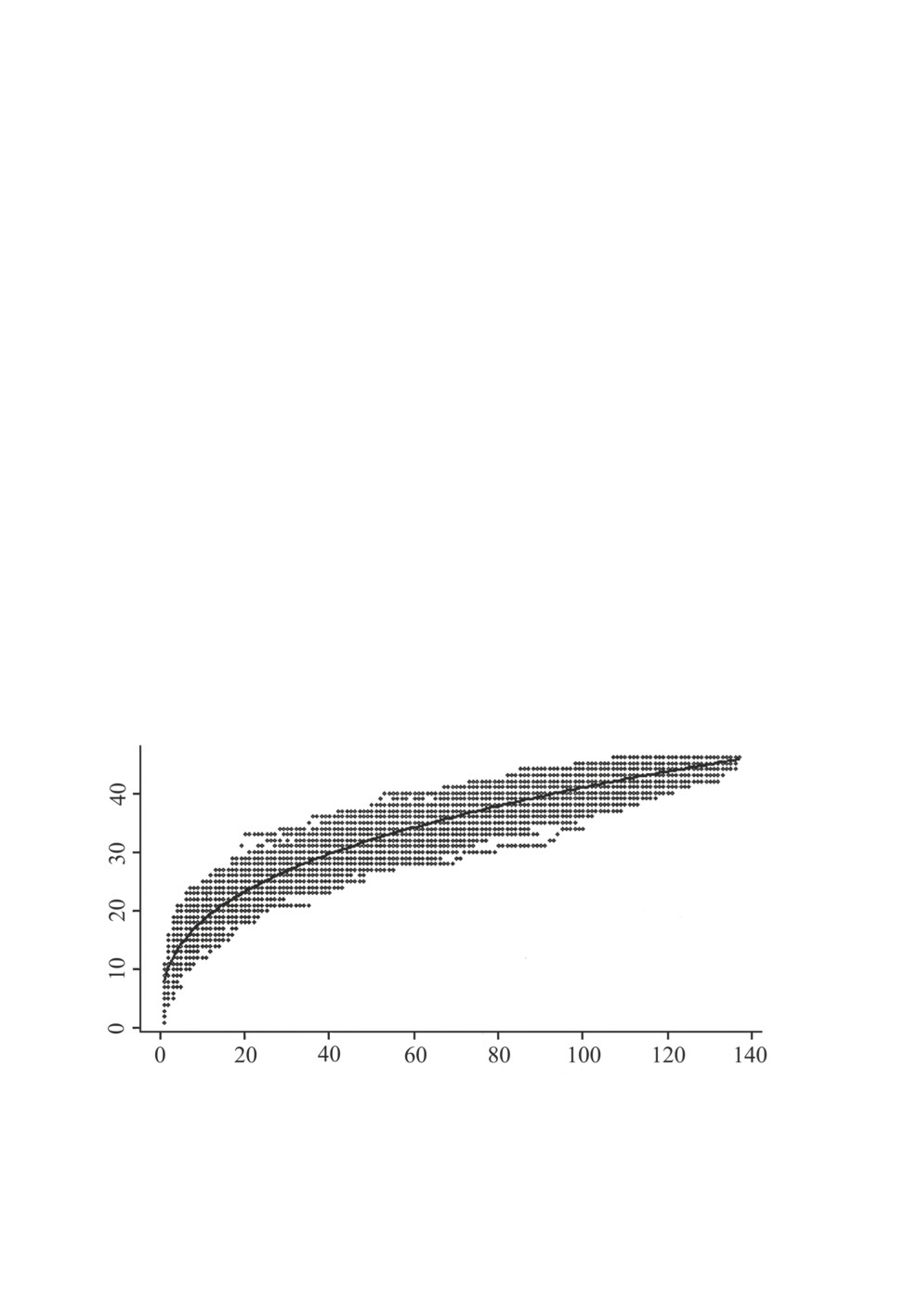
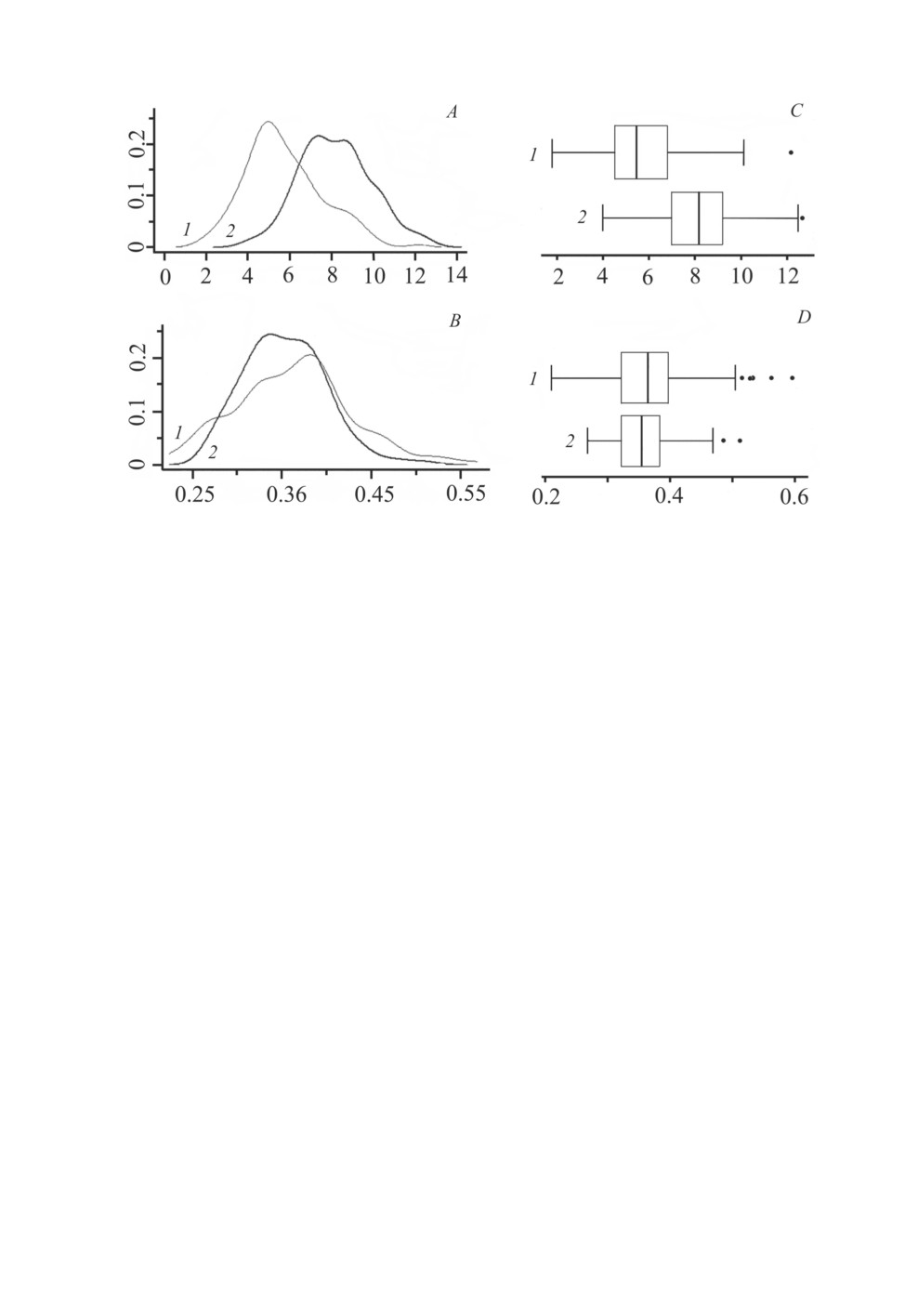
рассчитаны по 150 вариантов перетасованных рядов (рис. 1). Оказалось, что при таком
объеме повторности распределения параметров уравнений регрессии стабилизируют-
ся.
Для описания общего тренда нарастания видового богатства паразитов по мере уве-
личения объема выборки использовали уравнение степенной регрессии s = anb. Смысл
коэффициентов степенного уравнения легче понять, представив его в логарифмиче-
ской форме как уравнение линии ln(s) = ln(a) + ln(n) × b. C геометрической точки зре-
ния величина ln(a) - это точка, в которой ось ординат пересекается логарифмической
линией, когда величина ln(n) × b = 0, иначе - когда логарифм объема выборки равен
нулю ln(n) = 0: ln(a) = ln(s). Поскольку нулевой логарифм равен единице, ln(1) = 0, то
логарифмическая линия пересекает ординату ln(a) = ln(s) в точке n = 1. Избавившись от
логарифмов, получаем, что a = s при n = 1. Таким образом, коэффициент a равен числу
видов паразитов на первой рыбе, исследованной из данной выборки рыб. В свою оче-
редь, коэффициент b характеризует (логарифмическую) скорость нарастания видового
богатства компонентных сообществ паразитов (s) при росте числа проанализирован-
ных особей (n). Процедура ресамплинга преобразует a в наиболее ожидаемое видовое
богатство паразитов у первой исследованной особи хозяина, и b в среднею скорость
нарастания видового богатства.
Составление рядов накопления и оценка значимости различий между регрессион-
ными параметрами a и b разных выборок выполнены с использованием непараметри-
ческого критерия Уилкоксона-Манна-Уитни (W) для независимых выборок в среде
пакета R (Мастицкий, Шитиков, 2014; R-3.4.1 for Windows). Бета-разнообразие инфра-
сообществ по видовому богатству (βαγ-S разнообразие) оценивали по формуле «beta-2»,
предложенной Харисон с соавторами (Harrison et al.,1992). По данным Колефф и др.
Рис. 1. Вариабельность динамики накопления видового богатства паразитов по 150 вариантам
выборки из 137 экз. ротана из водоемов, охваченных нативной частью ареала (облако точек),
и кривая степенной регрессии (линия).
По оси абсцисс - число исследованных особей рыб, по оси ординат - видовое богатство паразитов.
148
(Koleff et al., 2003), формула «beta-2» принадлежит к числу наиболее эффективных мер
оценки бета-разнообразия.
Проверка гипотезы о соответствии полученных данных Гамма-распределению и
сравнение распределений проводили с использованием критерия Колмогорова-Смир-
нова (D) в пакете Paststatistics (Hammer et al., 2001).
РЕЗУЛЬТАТЫ
Видовое богатство инфрасообществ паразитов ротана в исследованных водоемах,
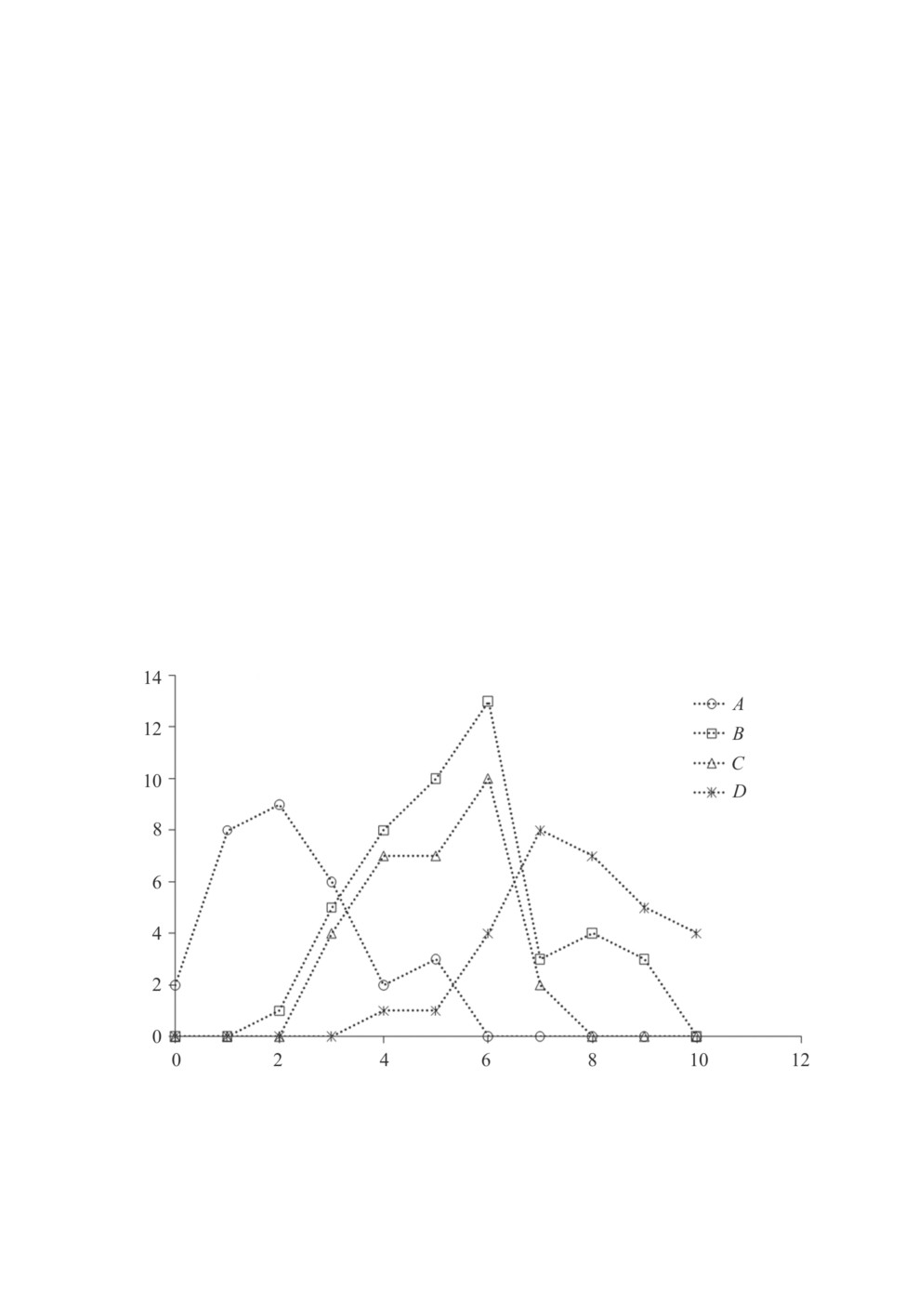
охваченных нативной частью ареала хозяина, изменялось от 1 до 10 видов. Наиболь-
шее значение среднего видового богатства инфрасообществ характерно для «Озеро 1»
(7.7), наименьшее - для «Озеро 2» (2.3).
В этих водоемах распределения видового богатства инфрасообществ паразитов до-
стоверно моделировались Гамма-законом при уровне значимости р ≥ 0.05 вне зависи-
мости от среднего богатства инфрасообществ (рис. 2). При этом данные распределе-
ния значимо различались между собой, имея разный характер встречаемости особей
с малым и большим числом видов паразитов на одной особи хозяина: D = 0.86,
р < 0.05, для «Озеро 1» и «Озеро 3»; D = 0.42, р < 0.05 для «Озеро 1» и оз. Сладкое;
D = 0.42, р < 0.05, для «Озеро 3» и оз. Сладкое; D = 0.83, р < 0.05, для «Озеро 1» и «Озе-
ро 2»; D = 0.96, р < 0.05, для «Озеро 3» и «Озеро 2» D = 0.81, р < 0.05, для оз. Сладкое
и «Озеро 2») (рис. 2A-2D ).
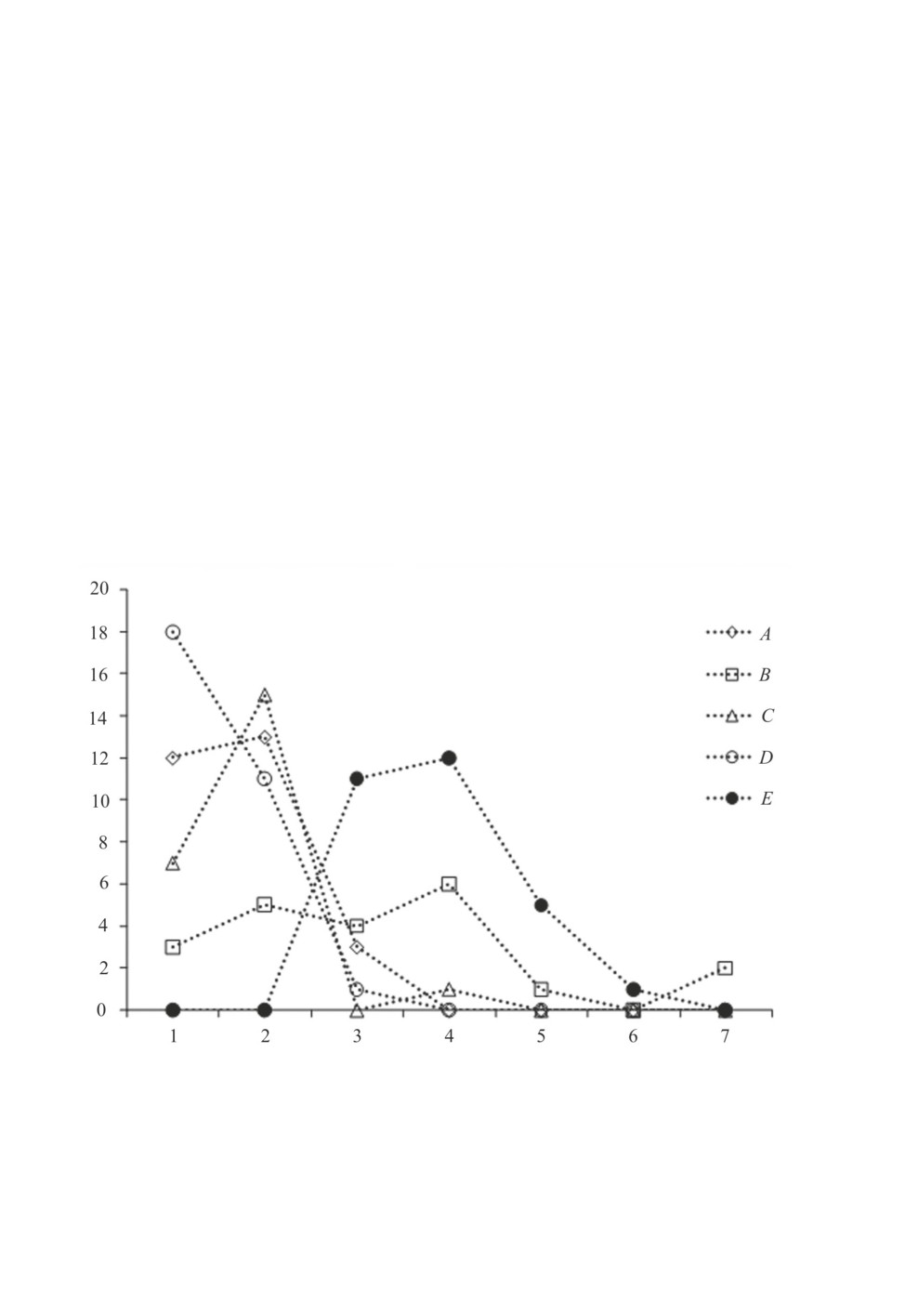
Видовое богатство инфрасообществ паразитов ротана водоемов, охваченных при-
обретенной частью ареала хозяина, было заметно беднее и изменялось в диапазоне
1-7 видов. Наибольшее значение среднего видового богатства инфрасообществ харак-
Рис. 2. Распределения видового богаства инфрасообществ паразитов ротана
в нативной части ареала хозяина.
A - «Озеро 2», B - оз. Сладкое, C - «Озеро 3», D - «Озеро 1».
По оси абсцисс - видовое богатство инфрасообществ паразитов, по оси ординат - частоты встречаемости.
149
терно для оз. Глушица Подстепная (3.9), наименьшее - для Мотовилихинского пруда
(1.4). Только в водоемах, где средние значения числа видов паразитов на одной рыбе
было > 2 - оз. Глушица Подстепная и старица р. Драгиште, распределение видового
богатства инфрасообществ достоверно моделируется Гамма-законом, при уровне зна-
чимости р ≥ 0.05 (рис. 3B, 3E). При этом установлены статистически достоверные от-
личия распределений видового богатства инфрасообществ паразитов ротана из этих
водоемов (D = 0.57, р < 0.05).
Для остальных водоемов, где среднее значение числа видов паразитов на одной рыбе
было меньше (≤ 2), не наблюдалось согласования ни с одним из распространенных
типов распределения (Пуассона, Гамма и НБР). Cравнение распределений видового
богатства паразитов ротана в парах: Мотовлихинский пруд - оз. Жилое, Мотовилихин-
ский пруд - «Горнослинкино-2» и оз. Жилое - «Горнослинкино-2» обнаружило досто-
верные различия между ними (D = 0.58, 0.66, 0.59 соответственно, р < 0.05 (рис. 3A,
3C, 3D).
Полученные графики степенных моделей накопления видового богатства ком-
понентных сообществ паразитов, построенные для обобщенных данных по двум
частям ареала ротана, имели выраженные отличия (рис. 4). Как показано на рис. 4,
регрессионная кривая для нативной части ареала стартует с более высоких значений
Рис. 3. Распределения видового богатства инфрасообществ паразитов ротана в приобретенной
части ареала хозяина.
A - оз. Жилое, B - старица р. Драгиште, C - «Горнослинкино-2», D - Мотовилихинский пруд,
E - оз. Глушица Подстепная.
По оси абсцисс - видовое богатство инфрасообществ паразитов, по оси ординат - частоты встречаемости.
150
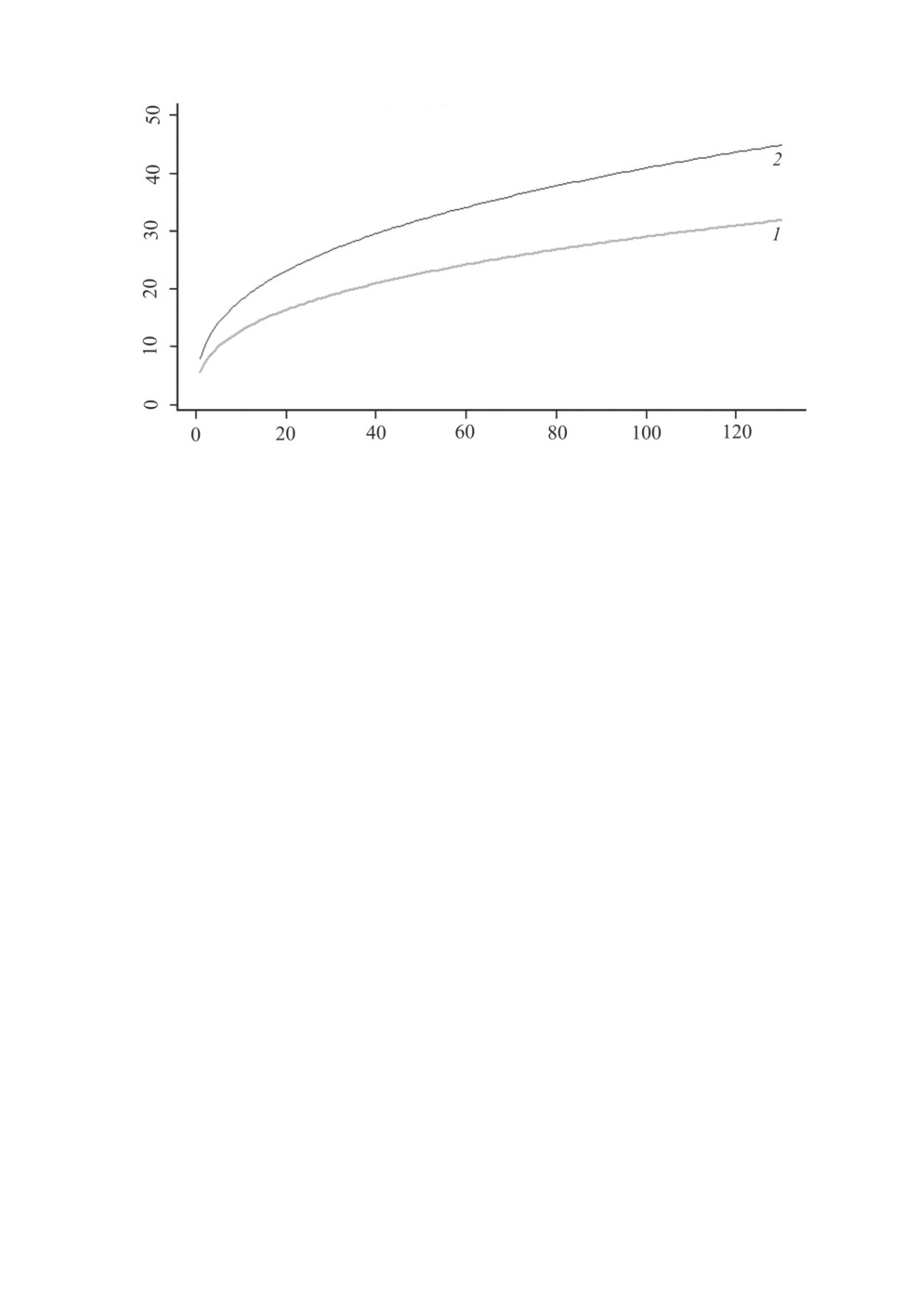
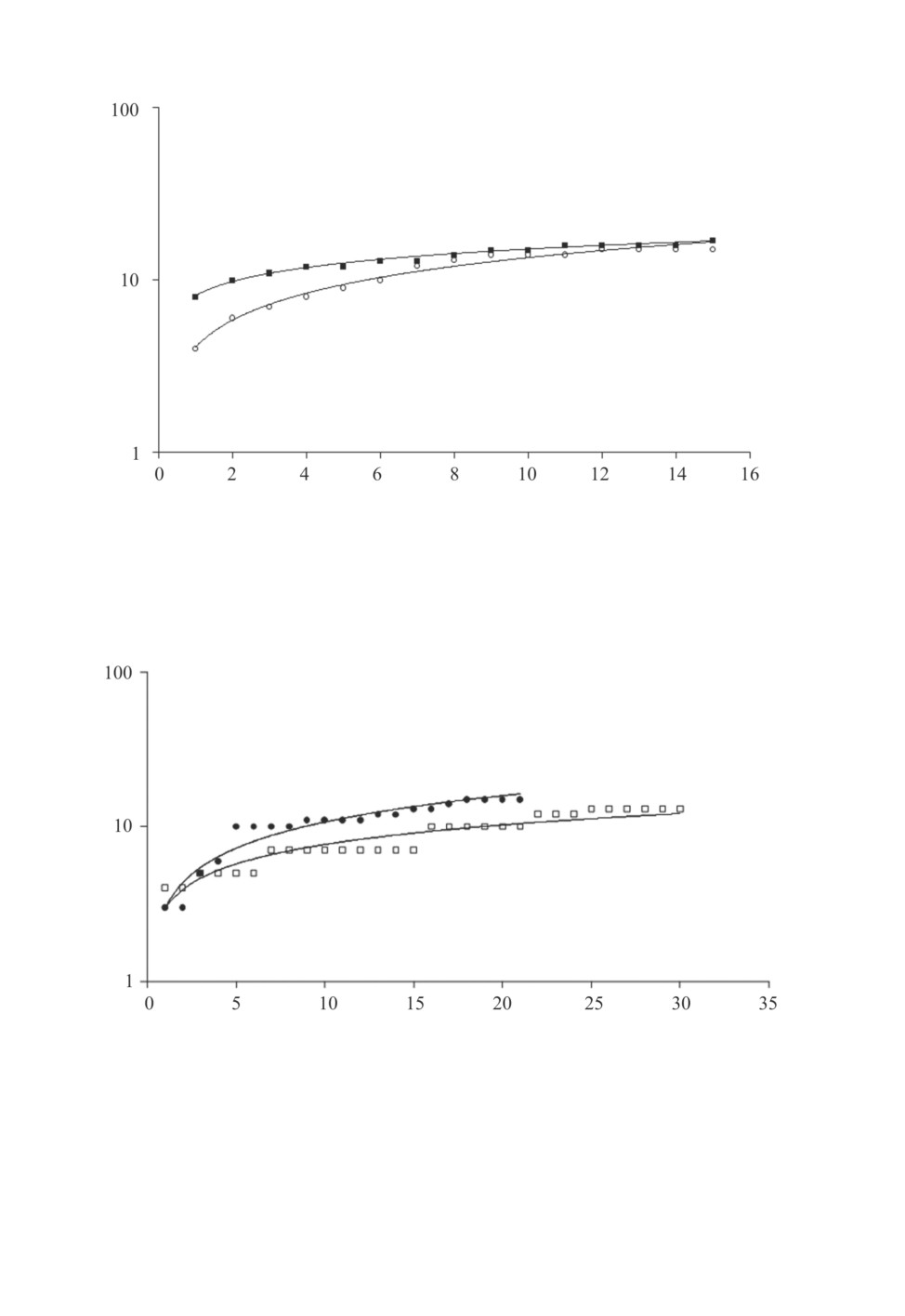
Рис. 4. Линии регрессии накопления видового богатства в компонентных сообществах
паразитов ротана из нативной s = 7.96n0.35 и приобретенной s = 5.45n0.36 частей ареала хозяина.
1 - сообщества в нативной части ареала, 2 - сообщества в приобретенной части ареала.
По оси абсцисс - число исследованных особей рыб, по оси ординат - видовое богатство паразитов.
(а1 = 7.96 против а2 = 5.45) и проходит выше линии, характеризующей накопление ви-
дов паразитов в приобретенной части ареала ротана.
Таким образом, ожидаемое значение видового богатства первого из случайно взя-
тых паразитарных инфрасообществ, приходящихся на нативную часть ареала хозяина,
выше, чем таковое в приобретенной части (7.96 против 5.45). Значимость этих раз-
личий была оценена по характеру распределений коэффициентов a и b, полученных
при расчете 150 вариантов уравнений регрессии (см. МАТЕРИАЛ И МЕТОДИКА).
Оказалось, что распределение коэффициента а, рассчитанное для обобщенной выбор-
ки ротана из нативной части ареала, смещено вправо относительно распределения,
полученного для рыб, населяющих приобретенную часть ареала; отличия значимы:
W = 19279 (для n1 = 150, n2 = 150), p < 0.01 (рис. 5A). Распределения коэффициентов b
для выборок из обеих частей ареала значимо не различалось: W = 10025 (для n1 = 150,
n2 = 150), p = 0.103 (рис. 5B).
Параметры степенных моделей, рассчитанные для каждого из изученных водое-
мов, выражают уже обозначенный феномен: ожидаемое значение видового богатства
первого из случайно взятых паразитарных инфрасообществ (a), приходящихся на на-
тивную часть ареала ротана, в целом выше, чем в приобретенной части (табл. 2). Ко-
эффициент a имеет достоверную положительную корреляцию с медианой видового
богатства паразитарных инфрасообществ (r = 0.95 при p < 0.05) и богатством ком-
понентных сообществ (r = 0.71 при p < 0.05). В этой связи частичное перекрывание
размахов варьирования коэффициента a, выявленное при сравнении компонентных
сообществ паразитов из двух частей ареала ротана, по-видимому, связано с тем, что
относительно «бедные» и «богатые» компонентные сообщества встречаются в каждой
из них (табл. 2).
151
Таблица 2. Видовое богатство компонентных сообществ, медиана богатства инфрасообществ,
βαγ-S разнообразие и коэффициенты уравнения накопления видового богатства паразитов
в изученных выборках ротана, s = anb
Видовое
Медиана
Коэффициенты
богатство
видового
уравнения
Водоемы
компонентных
богатства
βαγ-S
сообществ
инфра-
a
b
сообществ
Нативная часть ареала ротана
«Озеро 1»
21
8
0.04
8.42
0.27
«Озеро 2»
13
2
0.06
3.3
0.41
«Озеро 3»
8
5
0.005
6.33
0.08
Оз. Сладкое
24
6
0.04
5.53
0.38
Приобретенная часть ареала ротана
Оз. Глушица Подстепная
7
4
0.19
3.74
0.19
«Горнослинкино-2»
5
2
0.40
1.32
0.40
старица р. Драгиште
15
3
0.43
4.13
0.43
Оз. Жилое
4
2
0.20
2.17
0.20
Мотовилихинский пруд
6
1
0.44
1.37
0.44
Коэффициент b имеет положительную корреляцию с величиной βαγ-S разнообразия
инфрасообществ (r = 0.71 при p < 0.05). Оба параметра уравнения накопления видо-
вого богатства компонентного сообщества зависят от размерной структуры выборки
хозяина. Анализ двух группировок рыб из «Озеро1» с длиной тела (L) 97-127 (n = 15)
и 130-173 (n = 15) мм показывает, что паразитарные сообщества относительно мелких
рыб отличались от таковых у крупных рыб более низкими значениями коэффициента
a, но более высокими значениях коэффициента b (рис. 6).
В то же время, при сходстве размерной структуры выборок рыб, но небольших раз-
личиях в медианных значениях богатства инфрасообществ, коэффициенты уравнения
не имеют существенных различий, что демонстрирует сравнение компонентных со-
обществ паразитов ротана из «Озеро 2» и старицы р. Драгиште (нативная и приоб-
ретенная части его ареала, соответственно) (табл. 2; рис. 7). При этом между этими
двумя компонентными сообществами паразитов наблюдаются весомые отличия по ка-
чественному составу. К примеру, в старице р. Драгиште у ротана не были обнаружены
мискоспоридии и моногенеи, но в «Озеро 2» к этим группам относится 30% видов,
выявленных у ротана.
ОБСУЖДЕНИЕ
Распределение численности паразитов в популяциях хозяев обычно моделирует-
ся одним из трех математических законов: Пуассона, Гамма или отрицательным би-
номиальным (Павлов, Иешко, 1986). Распределения видового богатства инфрасооб-
ществ паразитов во всех исследованных выборках ротана из нативной и двух (из пяти)
выборок из приобретенной частей его ареала соответствуют Гамма-закону, который
проявляется при наличии индивидуальных различий рыб по устойчивости к зараже-
нию. Распределения в остальных трех водоемах, которые охвачены приобретенной
частью ареала ротана и которые отличаются бедностью видового богатства инфра- и
152
Рис. 5. Сглаженные распределения коэффициентов a и b уравнений степенной регрессии s=anb,
рассчитанных для 150 вариантов выборок ротана из нативной и приобретенной частей его
ареала, и их статистические характеристики.
A - распределения коэффициента a; по оси абсцисс - значения a, по оси ординат - частоты;
B - распределения коэффициента b, по си абсцисс - значения b, по оси ординат - частоты;
C - медиана и квантили 50 и 95% коэффициента a, D - медиана и квантили 50 и 95% коэффициента b,
1 - нативная часть ареала, 2 - приобретенная часть ареала.
компонентных сообществ паразитов, не имеют согласования с известными математи-
ческими законами (Пуассона, Гамма и НБР). Таким образом, моделирование Гамма-
законом становится успешным при средних значениях числа видов в инфрасообще-
ствах более двух вне зависимости от местообитания хозяина. Соответствие распреде-
лений видового богатства инфрасообществ паразитов в большинстве проанализиро-
ванных выборок ротана Гамма-закону подтверждает наличие естественных различий
особей данного хозяина по зараженности паразитами, обусловленных половым и раз-
мерно-возрастным факторами (Соколов, Жуков, 2014).
Обычно состав паразитов на отдельных особях хозяина отличается меньшим
богатством, чем в целой популяции, причем в популяции преобладают особи хозяев с
малым числом видов паразитов (Kennedy, Guegan, 1996; Poulin, 2007). Анализ видового
богатства инфрасообществ паразитов ротана в обеих частях ареала хозяина (рис. 2, 3)
подтверждает оба этих наблюдения.
Накопление видового богатства компонентного сообщества паразитов ротана имеет
степенную зависимость от числа обследованных особей хозяина. Степенная или
взаимосвязанная с ней логарифмическая зависимость между данными параметрами -
одна из общих закономерностей организации компонентных паразитарных сообществ
(например, Walther et al., 1995; Dove, Cribb, 2006; Sarabeev, 2015; Sellers et al., 2015).
Инновация использованного нами подхода (см. также Иешко, Коросов, 2012) состоит
в биологической интерпретации коэффициентов (a и b) полученных уравнений.
153
Рис. 6. Уравнения степенной регрессии для накопления видового богатства компонентных
сообществ паразитов в выборках крупных L = 130-173 мм (черные квадратики;
s = 8.09n0.27 при R2 = 0.99) и относительно мелких L = 97-127 мм
(белые кружки; s = 4.08n0.52 при R2 = 0.98) ротанов из «Озеро 1».
По оси абсцисс - число исследованных особей рыб, по оси ординат - видовое богатство компонентных
сообществ (шкала логарифмическая).
Рис. 7. Уравнения степенной регрессии для накопления видового богатства компонентных
сообществ паразитов в выборках ротана из «Озеро 2»в нативной части ареала хозяина
(черные кружки; s = 2.89n0.57 при R2 = 0.92) и старицы р. Драгиште в приобретенной
части ареала хозяина (белые квадратики; s = 2.91n0.42 при R2 = 0.88).
По оси абсцисс - число исследованных особей рыб, по оси ординат - видовое богатство компонентных
сообществ (шкала логарифмическая).
154
Помимо этого, нами предложен алгоритм сравнения моделей накопления видового
богатства, основанный на статистическом анализе коэффициентов степенного
уравнения. Данный метод позволяет вычленить вклад каждого из коэффициентов
в различие сравниваемых моделей. По мнению ряда авторов, нелинейный характер
роста видового богатства компонентного сообщества паразитов объясняется влиянием
межвидового конкурентного взаимодействия между видами в инфрасообществах
(Goater et al., 1987; Norton et al., 2004, Poulin, 2007). Мы не имеем аргументов для
подтверждения или оспаривания этого мнения на примере паразитов ротана. На
данный момент для нас очевиден лишь тот факт, что нелинейность обусловлена
агрегированным, левосмещенным распределением видового богатства паразитарных
инфрасообществ. В связи с агрегированным распределением кривая накопления растет
динамично в начальный период, а затем скорость регистрации новых видов паразитов
резко снижается.
Различия между кривыми накопления по коэффициенту а, построенными для
сообществ паразитов в двух частях ареала ротана (рис. 4, 5A), свидетельствуют о более
высоком видовом богатстве инфра- и компонентных сообществ в нативной части ареала
хозяина. Данное заключение вытекает из положительной корреляции коэффициента a
c числом видов в компонентных сообществах и медианой богатства инфрасообществ.
Различие по видовому богатству - одно из проявлений общей тенденции обеднения
α- и γ- разнообразия паразитарных сообществ рыб, связанного с интродукцией самого
хозяина (см., например, Догель, 1939; Poulin, Mouillot, 2003; Torchin et al., 2003; Sarabeev,
2015; Goedknegt et al., 2016; Соколов, Жуков, 2016). Согласно концепции экологического
соответствия, колонизация хозяина-вселенца нативным для реципиентой экосистемы
паразитом не требует коэволюционной связи между ними и обусловлена способностью
паразита к поиску экологически эквивалентного ресурса (Agosta, 2006; Brooks et al.,
2006). В этой связи видовое богатство инфра- и компонентных сообществ паразитов
у хозяина-вселенца, не имеющего родственных видов в зоне интродукции, к числу
которых принадлежит ротан, во многом производно от фауны аборигенных для
реципиентных экосистем эвригостальных видов паразитов. Таким образом, главными
причинами обеднения видового богатства у интродуцированного ротана мы считаем
саму интродукцию как естественный фактор потери разнообразия нативных для
переселенцев паразитов и, по-видимому, слабое перекрывание экологических ниш
интродуцированного ротана и местных представителей ихтиофауны, препятствующее
переходу на него эвригостальных видов паразитов с алиментарным способом
заражения (Соколов, Жуков, 2016).
Обращает на себя внимание тот факт, что значение коэффициента a, полученное
для выборки рыб из отдельного озера, может быть ниже величины a для объединенной
выборки из группы водоемов. Так, для выборок рыб из пяти озер, охваченных
приобретенной частью ареала ротана, a изменяется в интервале 1.32-4.13, но этот
же коэффициент для обобщенной выборки из этих озер равен 5.45. Причина этого
очевидна и кажется чисто технической - в каждом из пяти озер число видов паразитов
меньше, чем суммарно во всех озерах.
Компонентные сообщества паразитов нативного и интродуцированного ротанов не
различаются по темпам накопления видового богатства (рис. 4, 5B). Учитывая различия
по таксономическому разнообразию между компонентными сообществами паразитов,
155
сформированными у ротана в сравниваемых частях ареала (Соколов, Жуков, 2016),
можно сказать, что качественный состав видов не оказывает влияния на механизмы
формирования богатства инфрасообществ и динамику накопления видового богатства
компонентных сообществ у этого хозяина. К сожалению, динамика накопления видов
паразитов в разных частях ареала хозяина пока описана только на примере ротана и,
соответственно, не имеет аналогов для сравнения.
Сравнение кривых накопления видового богатства в компонентных сообществах,
относящихся к разным размерным группам рыб одного водоема, демонстрирует
выраженные отличия коэффициентов a и b, что подтверждает данные, полученные ранее
(Иешко, Коросов, 2012). Наши данные о положительной корреляции коэффициента
b с величиной βαγ-S разнообразия, полученные при анализе частных выборок ротана,
соотносятся с выводами Доува и Крибба (Dove, Cribb, 2006) о взаимосвязи темпа
накопления видового богатства компонентного паразитарного сообщества и уровня
гетерогенности интрасообществ паразитов по видовому составу.
ЗАКЛЮЧЕНИЕ
Полученные данные позволяют отвергнуть гипотезу о различиях между компонент-
ными сообществами паразитов нативного и интродуцированного ротанов по темпам
накопления видов, но подтверждают различия паразитарных сообществ этих рыб по
числу входящих в них видов. Качественный состав видов не оказывает влияния на ме-
ханизмы формирования богатства инфрасообществ и динамику накопления видового
богатства компонентных сообществ у этого хозяина.
БЛАГОДАРНОСТИ
Работа выполнена за средства федерального бюджета по государственному заданию
КарНЦ РАН (№0221-2017-0042) и при финансовой поддержке программы Президиума
РАН «Биоразнообразие природных систем и биологические ресурсы России».
СПИСОК ЛИТЕРАТУРЫ
Догель В.А. 1939. Влияние акклиматизаций рыб на распространение рыбных эпизоотий. Известия Всесоюз-
ного научно-исследовательского института озерного и речного рыбного хозяйства 21: 51-64.
Иешко Е.П., Коросов А.В. 2012. Оценка видового богатства паразитофауны рыб: экологический подход.
Принципы экологии 4: 28-40.
Мастицкий C.Э., Шитиков В.К. 2014. Статистический анализ и визуализация данных с помощью R.
Павлов Ю.Л., Иешко Е.П. 1986. Модель распределения численности паразитов. Доклады Академии наук
СССР 289 (3): 746-748.
Петрушевский Г.К. 1954. Изменения паразитофауны рыб в связи с их акклиматизацией. Труды проблемных
и тематических совещаний, вып. 4, с. 29-38.
Решетников А.Н. 2009. Современный ареал ротана Perccottus glenii Dybowski, 1877 (Odontobutidae, Pisces)
в Евразии. Российский журнал биологических инвазий 1: 22-35.
Соколов C.Г. 2013. Новые данные о паразитофауне ротана Perccottus glenii, Actinopterygii: Odontobutidae)
в Приморском крае с описанием нового вида миксоспоридий рода Myxidium (Myxozoa: Myxidiidae).
Паразитология 47 (1): 77-99.
Соколов C.Г., Бакланов М.А., Зиновьев Е.А. 2014. Особенности паразитофауны ротана (Perccottus glenii
Dybowski, 1877, Actinopterygii, Odontobutidae) в водоемах города Перми. Экология 5: 397-400.
Соколов C.Г., Фролов Е.В. 2012. Разнообразие паразитов ротана (Perccottus glenii, Osteichthyes, Odontobutidae)
в границах нативного ареала. Зоологический журнал 91 (1): 17-29.
156
Соколов C.Г., Лебедева Д.И., Ядрёнкина Е.Н. 2013. Первые данные о паразитофауне ротана Perccottus glenii
Dybowski, 1877 (Actinopterygii: Odontobutidae) в водоемах лесостепной зоны Западно-Сибирской рав-
нины. Паразитология 47 (6): 448-460.
Соколов C.Г., Мошу А.Я. 2013. Первые сведения о паразитах ротана Perccottus glenii Dybowski, 1877
(Actinopterygii: Odontobutidae) в водоемах республики Молдова. Известия Самарского научного цен-
тра РАН 15 (3): 213-221.
Соколов C.Г., Жуков А.В. 2014. Тенденции изменчивости паразитарных населений ротана Perccottus glenii
(Actinopterygii: Odontobutidae) в нативной части ареала хозяина. Известия РАН. Сер. Биологическая
5: 518-528.
Соколов C.Г., Жуков А.В.
2016. Разнообразие паразитов ротана Perccottus glenii Dybowski,
1877
(Actinopterygii: Perciformes) в условиях крупномасштабного расширения ареала хозяина. Известия
РАН. Сер. Биологическая 4: 439-448.
Agosta S.J. 2006. On ecological fitting, plant-insect associations, herbivore host shifts, and host plant selection.
Oikos 114 (3): 556-565.
Agosta S.J., Klemens J.A. 2008. Ecological fitting by phenotypically flexible genotypes: implications for species
associations, community assembly and evolution. Ecology Letters 11 (11): 1123-1134.
Anglade T., Randhawa H.S. 2018. Gaining insights into the ecological role of the New Zealand sole (Peltorhamphus
novaezeelandiae) through parasites. Journal of Helminthology 92 (2): 187-196.
Brooks D.R., McLennan D.A., León-Règagnon V., Hoberg E. 2006. Phylogeny, ecological fitting and lung flukes:
helping solve the problem of emerging infectious diseases. Revista Mexicana de Biodiversidad 77 (2):
225-233.
Dove A.D., Cribb T.H. 2006. Species accumulation curves and their applications in parasite ecology. Trends in
Parasitology 22 (12): 568-574.
Goedknegt M.A., Feis M.E., Wegner K.M., Luttikhuizen P.C., Buschbaum C., Camphuysen K., van der Meer J.,
Thieltges D.W. 2016. Parasites and marine invasions: Ecological and evolutionary perspectives. Journal of
Sea Research 113: 11-27.
Goater T.M., Esch G.W., Bush A.O. 1987. Helminth parasites of sympatric salamanders: ecological concepts
at infracommunity, component and compound community level. American Midland Naturalist 118 (2):
289-300.
Hammer Ø., Harper D.A. T., Ryan P.D. 2001. PAST: Paleontological Statistics Software Package for Education and
past/issue1_01.htm (23 ноября 2018).
Harvey J.A., Ximénez de Embún M.G., Bukovinszky T., Gols R. 2012.The roles of ecological fitting, phylogeny and
physiological equivalence in understanding realized and fundamental host ranges in endoparasitoid wasps.
Journal of Evolutionary Biology 25 (10): 2139-2148.
Harrison S., Ross S.J., Lawton, J.H. 1992, Beta diversity on geographic gradients in Britain Journal of Animal
Ecology 61 (1): 151-158.
Kennedy C.R., Bush A.O. 1994. The relationship between pattern and scale in parasite communities: a stranger in
a strange land. Parasitology 109 (2): 187-196.
Kennedy C.R., Guegan J.F. 1996. The number of niches in intestinal helminth communities of Anguilla anguilla: are
there enough spaces for parasites? Parasitology 113 (3): 293-302.
Koleff P., Gaston K.J., Lennon J.J. 2003. Measuring beta diversity for presence-absence data. Journal of Animal
Ecology 72 (3): 367-382.
Le Roux J.J., Hui C., Keet J.-H., Elli A.G. 2017. Co-introduction vs ecological fitting as pathways to the establishment
of effective mutualisms during biological invasions. New Phytologist 215: 1354-1360.
Malcicka M., Agosta S.J., Harvey J.A. 2015. Multi level ecological fitting: indirect life cycles are not a barrier to
host switching and invasion. Global Change Biology 21 (9): 3210-33218.
Norton J., Rollinson D., Lewis J. 2004. Patterns of infracommunity species richness in eels, Anguilla anguilla.
Journal of Helminthology 78 (2): 141-146.
Paterson R.A., Townsend C.R., Tompkins D.M., Poulin R. 2012. Ecological determinants of parasite acquisition
by exotic fish species. Oikos 121 (11): 1889-1895.
Poulin R. 2007. Evolutionary ecology of parasites (2nd Edition). Princeton, Princeton University Press, 332 p.
Poulin R., Mouillot D. 2003. Host introductions and the geography of parasite taxonomic diversity. Journal of
Biogeography 30 (6): 837-845.
windows/base/ (23 ноября 2018).
157
Reshetnikov A.N., Schliewen U.K. 2013 First record of the invasive alien fish rotan Perccottus glenii Dybowski,
1877 (Odontobutidae) in the Upper Danube drainage (Bavaria, Germany). Journal of Applied Ichthyology
29 (6): 1367-1369.
Sarabeev V. 2015. Helminth species richness of introduced and native grey mullets (Teleostei: Mugilidae).
Parasitology International 64 (4): 6-17.
Sellers A.J, Ruiz G.M, Leung B, Torchin M.E. 2015. Regional variation in parasite species richness and abundance
in the introduced range of the invasive Lionfish, Pterois volitans. PLoS One. 10: e0131075.
Sokolov S.G., Reshetnikov A.N., Protasova E.N. 2014. A checklist of parasites of non-native populations of rotan
Perccottus glenii Dybowski, 1877 (Odontobutidae). Journal of Applied Ichthyology 30 (3): 574-596.
Torchin M.E., Lafferty K.D., Dobson A.P., McKenzie V.J., Kuris A.M. 2003. Introduced species and their missing
parasites. Nature 421 (6923): 628-630.
Walther B.A., Cotgreave P., Price R.D., Gregory R.D., Clayton D.H. 1995. Sampling effort and parasite species
richness. Parasitology Today 11 (8): 306-310.
SPECIES RICHNESS OF PARASITE ASSEMBLAGES IN THE CHINESE SLIPPER
PERCCOTTUS GLENII DYBOWSKI, 1877 (ACTINOPTERYGII) IN THE HOST’S
NATIVE AND NON-NATIVE RANGES
E. P. Ieshko, A. V. Korosov, S. G. Sokolov
Keywords: species richness; infra- & component parasite communities; species accumulation;
geographic ranges; invaders, Perсcottus glenii.
SUMMARY
Species richness of parasite communities in the Chinese sleeper Perсcottus glenii was studied
in its natural habitats and regions where this host had been introduced. Species richness of parasite
infracommunities in both the native and acquired parts of the host’s range is sufficiently described by
Gamma distribution except for the introduced populations with species-poor (≤ 2) infracommunities.
The resampling method was applied to estimate the statistical significance of differences in coefficients
of the power-law equation s = anb, where a is the expected species richness in the first host individual
examined, and b is the rate of species accumulation in parasite component communities (s) related
to the increase in the number of examined host individuals (n). The species richness of infra- and
component parasite communities in the Chinese sleeper was found to be significantly higher in native
than in introduced habitats. Nevertheless, the rates of species accumulation in component parasite
communities did not differ between the native and non-native ranges in spite of the differences in the
taxonomic composition of parasites.
158