ПАРАЗИТОЛОГИЯ, 2019, том 53, № 3, с. 209-219.
УДК 57.083.18:579.841.95:576.895.42
ВОЗМОЖНОЕ УЧАСТИЕ ТАЕЖНОГО КЛЕЩА
IXODES PERSULCATUS SCHULZE, 1930 В ЦИРКУЛЯЦИИ
ВОЗБУДИТЕЛЯ ТУЛЯРЕМИИ В ПРИРОДНЫХ ОЧАГАХ
ЛЕСНОГО ТИПА
© 2019 г. М. И. Кормилицынаa, *, Э. И. Коренбергa,
Т. В. Михайловаa, Ю. В. Ковалевскийa, Д. В. Транквилевскийb
a Национальный исследовательский центр эпидемиологии и микробиологии
им. почетного академика Н.Ф. Гамалеи Министерства Здравоохранения
Российской Федерации, ул. Гамалеи, 18, Москва, 123098 Россия
b Федеральный центр гигиены и эпидемиологии Роспотребнадзора,
Варшавское ш., 19А, Москва, 117105 Россия
* е-mail: mkormilits@mail.ru
Поступила в редакцию 18.02.2019 г.
После доработки 11.03.2019 г.
Принята к публикации 11.03.2019 г.
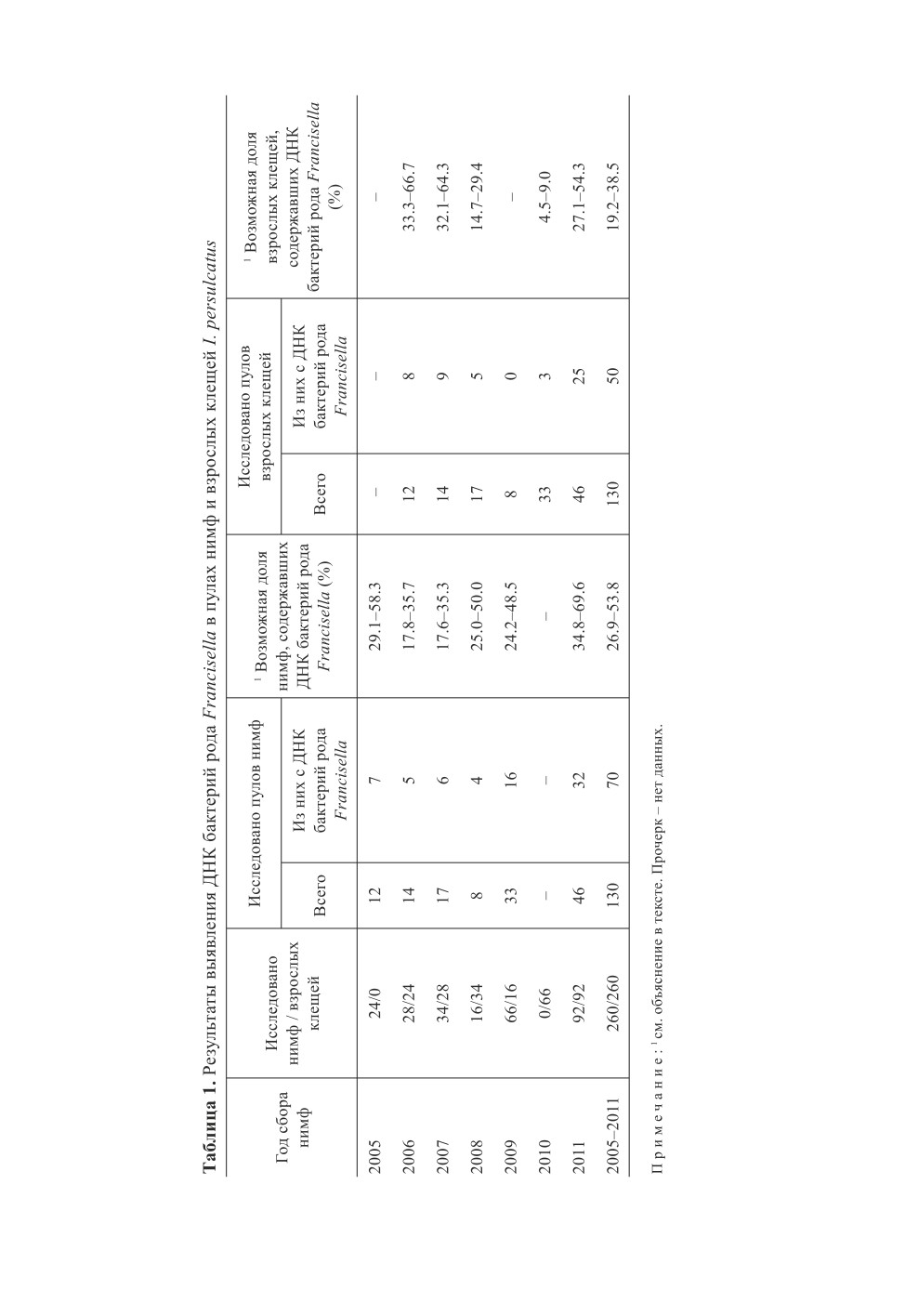
Исследованы 260 нимф и такое же количество взрослых особей таежного клеща Ixodes
persulcatus Schulze, 1930, собранных с мелких лесных млекопитающих и растительности
в южнотаежных лесах низкогорий Среднего Урала (Чусовской район Пермского края). Клещи
(по 2 особи в пуле) исследованы методом ПЦР в реальном времени с родо- и видоспецифически-
ми праймерами на наличие ДНК Francisella и Francisella tularensis McCoy et Chapin. Фрагмент
гена 16S rRNA Francisella spp. выявлен в 70 из 130 пулов нимф (53.8 %) и 50 из 130 пулов взрос-
лых клещей (38.5 %). В подавляющем большинстве положительных образцов обнаружена ДНК
F. tularensis: 85.7 % положительных проб нимф и 98 % взрослых клещей. Полученные данные
свидетельствуют о возможности участия клеща I. persulcatus в циркуляции возбудителя туляре-
мии в природных очагах лесного типа.
Ключевые слова: Francisella tularensis, Ixodes persulcatus, лесной тип очага.
DOI: 10.1134/S0031184719030037
Природные очаги туляремии широко распространены в пределах Северного полу-
шария. Основное значение для инфекционной патологии человека имеет возбуди-
тель туляремии - Francisella tularensis McCoy et Chapin, объединяющий 4 подвида:
F. t. tularensis, F. t. mediasiatica, F. t. holarctica и F. t. novicida. В настоящее время
в род Francisella также включены другие виды: F. halioticida, F. hispaniensis, F. marina,
F. noatunensis, F. persica, F. philomiragia (National Center for Biotechnology Information,
2019). К этому же роду были отнесены так называемые Francisella-like бактерии
(FLE). Они обнаружены в клещах разных родов: Amblyomma Koch, 1844, Dermacentor
Koch, 1844, Haemaphysalis Koch, 1844, Hyalomma Koch, 1844, Ixodes Latreille, 1795,
Rhipicephalus Koch, 1844 и Ornithodoros Koch, 1844 (National Center for Biotechnology
Information, 2019). Вероятно, это облигатные эндосимбионты, близкие к возбудителю
209
туляремии (Bonnet et al., 2017). FLE широко распространены в Европе и были иден-
тифицированы у D. reticulatus Fabricius, 1794, Hyalomma marginatum Panzer, 1795,
H. aegyptium L., 1758 и R. sanguineus Latreille, 1806 в Болгарии, Германии, Вен-
грии, Португалии, Словакии, Франции, Сербии и Польше (Sréter-Lancz et al., 2009;
De Carvalho et al., 2011; Ivanov et al., 2011; Gehringer et al., 2013; Kreizinger et al., 2013;
Michelet et al., 2013; Tomanović et al., 2013; Wójcik-Fatla et al., 2015; Špitalská et al.,
2018). Данные о выявлении FLE у клещей в Российской Федерации отсутствуют.
Описаны следующие типы природных очагов туляремии: степной, луго-полевой,
лесной, пойменно-болотный, предгорно/горно-ручьевой, тугайный и тундровый
(Максимов, 1957; Олсуфьев, Дунаева, 1970). Очаги туляремии лесного типа остают-
ся наименее изученными, хотя они широко распространены в лесной зоне Евразии.
Известно, что им свойствен сравнительно «вялый» эпизоотический процесс и слабое
эпидемическое проявление (Каменова , 1987; Коренберг и др., 1987 и др.). Циркуляцию
возбудителя поддерживают мелкие млекопитающие, зайцы, а также кровососущие
членистоногие-переносчики, в частности иксодовые клещи, которые, по всей видимо-
сти, могут быть длительными хранителями инфекции (Олсуфьев, Дунаева, 1970; Keim
et al., 2007; Petersen, 2009). Ранее ДНК F. tularensis обнаружена нами в очаге лесного
типа в клещах I. trianguliceps Birula, 1895 (Кормилицына и др., 2016), все фазы раз-
вития которого паразитируют на мелких млекопитающих и не нападают на человека
(Korenberg, Lebedeva, 1969; Филиппова, 1977).
Из иксодовых клещей в лесной зоне Евразии наиболее распространен треххозяинный
таежный клещ I. persulcatus Schulze, 1930 (Коренберг и др., 1969; Филиппова, 1977;
Коренберг, 1979; 1985; Филиппова, 2017). Это вид с пастбищным типом паразитиз-
ма, обитающий в лесных биотопах нескольких зональных формаций растительности
от Прибалтики до Тихого океана (Филиппова, 1977; Коренберг, 1985). Таежный клещ
хорошо известен как основной переносчик многих экологически связанных с ним воз-
будителей: клещевого энцефалита, иксодовых клещевых боррелиозов, гранулоцитар-
ного анаплазмоза, моноцитарного эрлихиоза, риккетсиозов, а также микст-инфекций
(Korenberg et al., 2001; Коренберг, 2008; Коренберг и др., 2013; Филиппова, 2011; 2017).
От клеща I. persulcatus культура туляремийного микроба впервые выделена в 1941 г.
в Западной Сибири на границе темнохвойных и лиственных лесов (Карпов, Попов,
1944). Единичные культуры были позднее изолированы методом биопробы от взрос-
лых клещей этого вида, собранных в лесах Северо-Запада России и Дальнего Востока
(Олсуфьев, Дунаева, 1970; Коренберг и др., 1987).
Цель нашей работы - получение молекулярно-биологическими методами более
полных данных о возможном участии клеща I. persulcatus в циркуляции F. tularensis
в природных очагах лесного типа.
МАТЕРИАЛ И МЕТОДИКА
Клещи собраны в 2005-2011 гг. в южно-таежных лесах низкогорий Среднего Урала (Чусов-
ской р-н Пермского края; 58°33ʹ с. ш., 57°28ʹ в. д.). Учет численности мелких млекопитающих
проводили в два тура (в июне и августе) линиями ловушек Шермана (по 25-50 в каждой), кото-
рые ежегодно расставляли в определенных местах различных биотопов; объем учетов в каждом
туре составлял от 400 до 1900 ловушко-ночей. Приемы сбора клещей, методика учета мелких
млекопитающих и его результаты, а также биоценотические особенности стационара, на кото-
210
ром проведены многолетние наблюдения, подробно описаны ранее (Ковалевский и др., 2004,
2013; Korenberg et al., 2015; Кормилицына и др., 2016).
Исследованы 520 клещей I. persulcatus: 260 в разной степени напитавшихся нимф, снятых
со 133 мелких млекопитающих 6 видов, и столько же голодных взрослых клещей, собранных
с растительности на флаг. Из нимф и взрослых клещей было составлено по 130 пулов, каж-
дый из которых включал 2 особи. На разные годы пришлось от 8 до 46 пулов нимф и такое же
количество пулов взрослых клещей (табл. 1). Клещей сохраняли до исследования в 70 % этаноле.
Пулы гомогенизировали в пробирках со 150 мкл фосфатно-буферного раствора. Для
экстракции ДНК использовали набор
«Проба НК» (ДНК-Технология, Россия). Суспен-
зии клещей исследовали на наличие ДНК методом ПЦР-РВ с гибридизационно-
флуоресцентным учетом результатов и анализом специфичности по кривым плавления
по «конечной точке» (Кормилицына и др., 2016). Для выявления ДНК франциселл, вклю-
чая FLE бактерии, амплифицировали участок гена 16S rRNA (размером 218-226 п.н.) с
родоспецифичными праймерами NC-Fran16Sr-F/Fr1281R0,1. Для идентификации видо-
вой принадлежности ДНК применяли праймеры и зонды: 1) lpnA2F/R и lpnA2P (82 п.н.),
2) ISFtu2F/R и ISFtu2P (97 п.н.) (Кормилицына и др., 2016, Михайлова и др., 2017). Некоторые
ДНК образцов дополнительно исследовали в ПЦР-РВ с праймерными парами iglCFt-F/R (5’-3’)
TTGCTTGTAATATACTCGAAACTTT / GATTCTTTAACTATAGCTGGGGA (226 п.н.) (по: Тимо-
феев, 2015, с изменениями). Использованные праймеры, зонды и реакционные смеси изготовле-
ны ЗАО «Синтол» (Россия). Объем исследуемой ДНК-матрицы составлял 5 мкл, объем конечной
смеси - 25 мкл. Состав реакционных смесей, использование контролей, условия проведения
ПЦР и гель-электрофореза описаны ранее (Кормилицына и др., 2016). Для последующего секве-
нирования полученного ПЦР-продукта его качество и концентрацию некоторых ДНК-амплико-
нов проверяли методом гель-электрофореза.
Секвенирование ДНК проведено с помощью набора реактивов ABI PRISM® BigDye™
Terminator v. 3.1 с последующим анализом продуктов реакции на автоматическом секвенато-
ре Applied Biosystems 3730 DNA Analyzer в Центре коллективного пользования «ГЕНОМ»
(Институт молекулярной биологии им. В.А. Энгельгардта РАН). Фрагменты матрицы ДНК
подготавливали методом прямого переосаждения ДНК-продукта в мягких условиях (по реко-
мендации упомянутого Центра). Таксономическую принадлежность полученных нуклеотид-
ных последовательностей определяли с помощью сайта Европейского нуклеотидного архива
(European Bioinformatics Institute, 2019). Данные секвенированных образцов сравнивали с из-
вестными последовательностями геномов и участков генов, имеющихся в ENA, с помощью
программы blastn из пакета BLAST+ версии 2.7.1. Построение кладограммы последователь-
ностей полученных образцов и частичных фрагментов сиквенсов некоторых представителей
рода Francisella, найденных в GenBank, проводили с использованием метода соседнего присо-
единения без коррекции расстояния с помощью программы MUSCLE версии 3.8.31 (European
Bioinformatics Institute, 2019).
Статистическая обработка выполнена для уровня значимости 0.95. В качестве доверительных
интервалов при расчете процентов (P) приняты удвоенные значения ошибки выборочной доли
(2mp). Сравнение результатов проведено по t-критерию Стьюдента.
РЕЗУЛЬТАТЫ
Фрагмент гена 16S rRNA ДНК Francisella sp. выявлен в 70 из 130 (53.8 ± 8.7 %) пулов
нимф клещей, питавшихся на зверьках. Частота выявления ДНК франциселл у голод-
ных взрослых клещей оказалась достоверно (t = 2.5 > 2.0) ниже: ПЦР-положительные
были только 50 из 130 пулов, т.е. 38.5 ± 8.5 % (табл. 1). Эти различия мы объясняем
211
уменьшением или утратой генетического материала туляремийных бактерий в процес-
се метаморфоза клещей (Олсуфьев, Дунаева, 1960, 1970).
ДНК Francisella обнаруживалась в паразитарной системе на протяжении всего мно-
голетнего периода сбора исследованных клещей. У взрослых клещей она не выявлена
только в одном (2009) году - вероятно, из-за малого количества исследованных клещей.
Поскольку исследованные пулы содержали по 2 клеща, любой пул мог содержать
только одну или двух нимф (или взрослых клещей) с ДНК бактерий рода Francisella.
Если во всех положительных пулах было по одному клещу с ДНК, их возможная общая
доля (в % от общего числа исследованных особей) была минимальной, а во втором
случае - вдвое большей. Эти значения приведены в табл. 1 и 2. Так как вероятность
таких вариантов оставалась неизвестной, мы полагаем, что реальные показатели доли
клещей с ДНК должны быть между указанными в этих таблицах предельными значе-
ниями.
Последовательности пяти секвенированных образцов ДНК-фрагментов (3 от ним-
фальных пулов и 2 от взрослых особей), а также контрольного типового штамма
503 (из музейной коллекции лаборатории туляремии ФГБУ «НИЦЭМ им. Н.Ф. Га-
малеи» Минздрава России) депонированы в ENA с номерами доступа: ERS2754311,
ERS2754313, ERS2803169, ERS2754312, ERS2754281 и ERS2754315, соответственно.
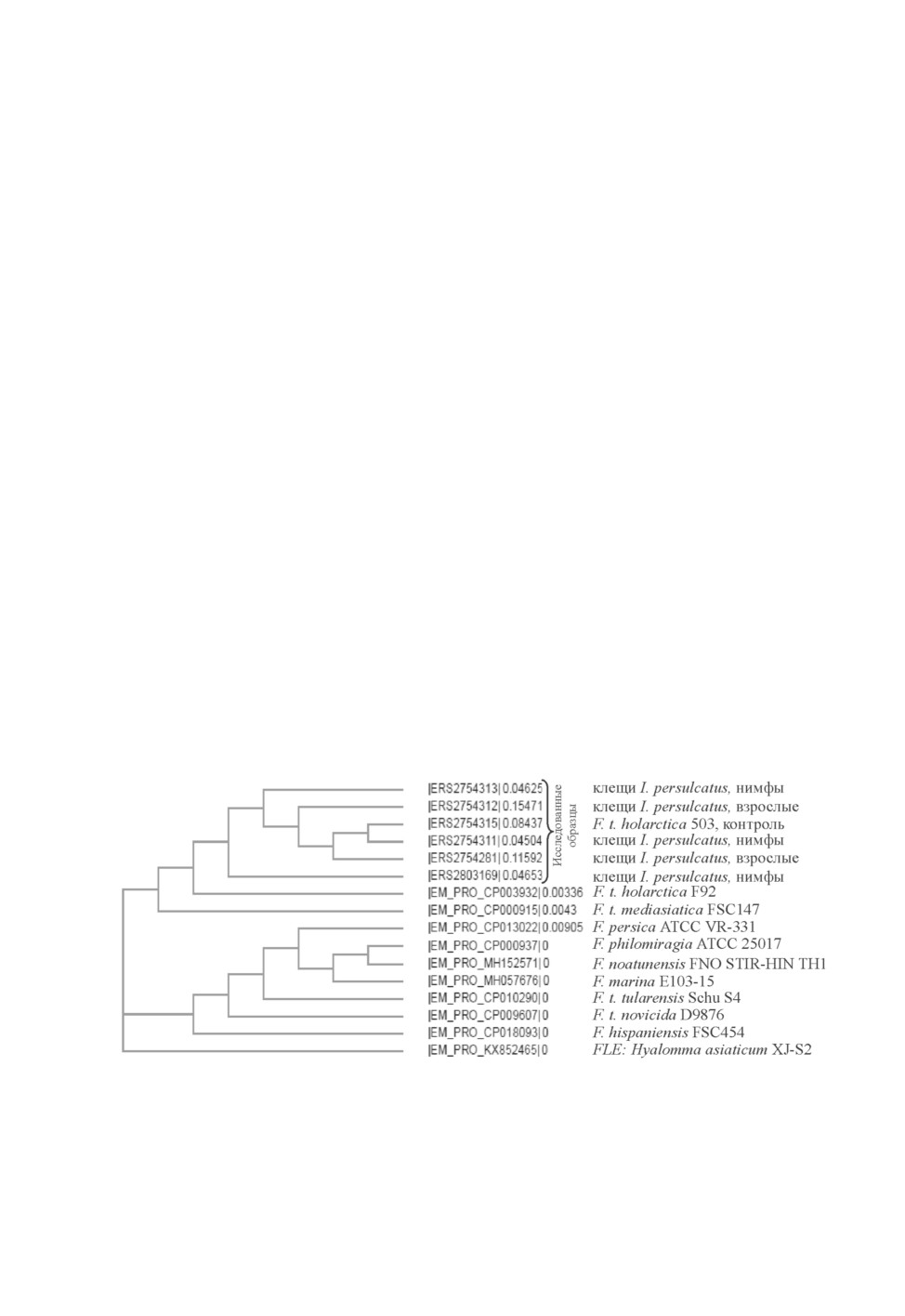
Анализ последовательностей всех образцов ПЦР-продуктов показал их большое сход-
ство (91-97 %) с фрагментом гена 16S rRNA представителей Francisella sp., имеющих-
ся в ENA. Результаты сравнения отражает кладограмма (рис. 1). Последовательности
нуклеотидов 5 ампликонов ДНК, выявленных в пулах клещей I. persulcatus, оказались
в одной кладе с группой сиквенсов локуса гена 16S rRNA представителей Francisella,
причем ближе к подвидам holarctica и mediasiatica микроба F. tularensis.
Все ДНК-положительные образцы были проверены на наличие видоспецифических
участков генов-мишеней (ПЦР-РВ с lpnA2F/R+lpnA2P и ISFtu2F/R+ISFtu2P). Подавля-
ющее большинство образцов идентифицировано как F. tularensis: 60 из 70 положи-
Рис. 1. Кладограмма полученных сиквенсов исследованных образцов ДНК
и последовательностей аналогичных участков гена 16S rRNA
некоторых представителей Francisella, депонированных в GenBank
(European Bioinformatics Institute, 2019).
213
тельных проб нимф (85.7 ± 8.4 %) и 49 из 50 проб взрослых клещей (98.0 ± 3.9 %).
Неопределенная видовая принадлежность остальных ДНК Francisella (10 пулов нимф
и 1 взрослых клещей) с фрагментами небольшого размера позволяет думать, что они
принадлежат FLE, которые содержатся в организме I. persulcatus. Не исключено, что
эти сходные по родовой принадлежности микроорганизмы относятся к числу еще не
описанных и не патогенных для человека симбионтов клещей (Коренберг, 2012).
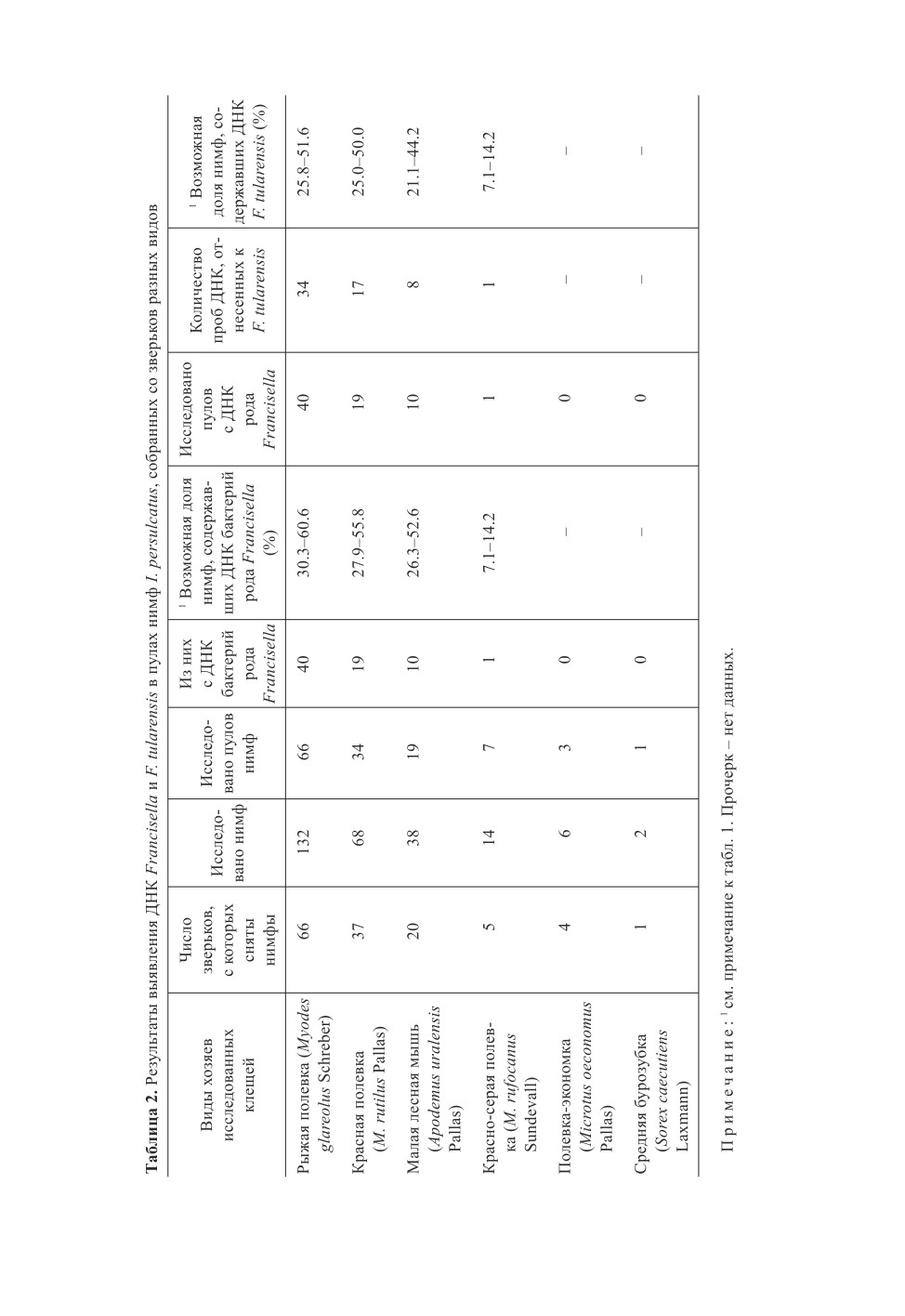
ДНК Francisella и F. tularensis выявлена у нимф, снятых с мелких млекопитающих
четырех видов (табл. 2). Это три вида лесных полевок рода Myodes Pallas (включая
красно-серую полевку, хотя было исследовано только 7 пулов) и малая лесная мышь.
В единичных пулах от полевки-экономки и средней бурозубки ДНК Francisella sp. не
обнаружена. При исследовании репрезентативных пулов нимф не отмечены суще-
ственные различия в частоте положительных результатов у клещей, кормившихся на
разных видах зверьков. Так, возможная доля нимф, содержавших ДНК бактерий рода
Francisella, как и ДНК непосредственно возбудителя туляремии, среди клещей, снятых
со зверьков трех наиболее массовых видов (Ковалевский и др., 2013), по всей вероят-
ности, была примерно сходной (табл. 2).
ОБСУЖДЕНИЕ
Приведенные выше данные свидетельствуют о возможной роли клеща I. persulcatus
в циркуляции возбудителя туляремии в природных очагах лесного типа на терри-
тории Пермского края, где, кроме этого вида, из иксодовых клещей обитает только
I. trianguliceps. В этом регионе видовой состав мелких млекопитающих - основных
прокормителей преимагинальных фаз I. persulcatus, а также всех фаз I. trianguliceps -
почти идентичен, причем на зверьке одновременно часто паразитируют клещи обоих
видов (Ковалевский и др., 2013; Korenberg et al., 2015). Ранее (Кормилицына и др.,
2016) нами была выявлена ДНК F. tularensis у клещей I. trianguliceps, снятых, в основ-
ном, со зверьков тех же видов, которые указаны в табл. 1. В целом, доля пулов с ДНК
возбудителя туляремии (одинаковых по количеству клещей в исследованных пулах)
у I. persulcatus существенно не отличалась от таковой у I. trianguliceps.
Инфицированные нимфы I. persulcatus при кровососании способны передавать
F. tularensis животным - их прокормителям. Мелкие лесные млекопитающие, с кото-
рых нами были сняты нимфы I. persulcatus, относятся к группе высоковосприимчивых
и высокочувствительных к туляремийному микробу видов (Олсуфьев, Дунаева, 1970).
Экспериментально показано, что, несмотря на это, животные данной группы могут
переносить хроническую туляремийную инфекцию, поддерживая диссеминацию воз-
будителя в природном очаге при некрофагии погибших грызунов или при попадании
бактерий в субстрат их обитания (Шлыгина, 1996).
Многолетние наблюдения, проведенные в районе наших исследований, выявили
изменения численности мелких лесных млекопитающих, которые имеют в основном
трехлетнюю цикличность. В годы их высокой летней численности на них прокарм-
ливается множество личинок и часть нимф I. persulcatus, причем зачастую, как уже
отмечено выше, и клеща I. trianguliceps. В следующем весенне-летнем сезоне обычно
наблюдается повышенная численность взрослых голодных клещей I. persulcatus. Эти
процессы способствуют горизонтальной и вертикальной передаче возбудителей, кото-
рые экологически связаны с иксодовыми клещами, и (или) их генетического матери-
ала (Korenberg et al., 2002; Ковалевский и др., 2004, 2013; Кормилицына и др., 2016).
215
Результаты исследований, приведенные в табл. 1, согласуются с этими представлени-
ями: в 2004, 2007 и 2008 гг. наблюдались максимальные пики, а в 2010 г. - повышен-
ная численность мелких млекопитающих. Соответственно, 2005, 2008, 2009 и 2011 гг.
характеризуются наиболее высокими показателями возможной доли нимф, содержав-
ших ДНК бактерий рода Francisella. В отношении взрослых клещей такая зависимость
оказалась менее четкой, что мы склонны объяснять значительно более широким, чем
у личинок, кругом прокормителей нимф - предшественников взрослых клещей.
Итак, приведенные нами данные свидетельствуют о том, что существование природ-
ных очагов туляремии лесного типа в Пермском крае, как и в других регионах (Бала-
шов, 2010), могут поддерживать разные виды иксодовых клещей и позвоночных жи-
вотных. Результаты применения молекулярно-биологических методов для индикации
фрагментов генома бактерий рода Francisella позволяют предполагать, что таежный
клещ может иметь важное эпизоотическое значение. В регионе наших исследований
I. persulcatus - единственный антропофильный вид иксодовых клещей, причем,
за редкими исключениями, на человека нападают исключительно голодные взрос-
лые клещи. В весенне-летний период население ежегодно интенсивно контактирует с
этими клещами (Korenberg et al., 2001). Например, в течение пяти лет (2013-2017 гг.)
в медицинских учреждениях Пермского края в среднем регистрировалось примерно
по 17.5 тыс. в год обращений людей по поводу присасывания клеща. Это обуслов-
ливает неизменно высокий уровень заболеваемости иксодовыми клещевыми борре-
лиозами, клещевым энцефалитом и другими трансмиссивными инфекциями (Фризен
и др., 2004; Коренберг и др., 2007; Тетерин и др., 2013), но не туляремией. Несмотря
на значительную долю голодных взрослых особей таежного клеща с ДНК возбудителя
этой инфекции, за 20 лет (1997-2017) в Пермском крае зарегистрировано всего 11 забо-
леваний туляремией, т.е. в среднем менее 1 случая в год. Это с большой вероятностью
свидетельствует о единичном трансмиссивном пути заражения пациентов в результа-
те присасывания клеща и исключает другие свойственные туляремии пути передачи
ее возбудителя, с которыми обычно связаны групповые или массовые эпидемические
вспышки. Следует, однако, учитывать, что выявление ДНК того или иного возбудителя
у любых животных свидетельствует лишь об их контактах с этим возбудителем. Само
по себе факт обнаружения ДНК, по нашему мнению (Коренберг, 2010; Коренберг и др.,
2013; Кормилицына и др., 2016), недостаточен для выводов об их истинной роли как
переносчиков или резервуарных хозяев в эпизоотическом и эпидемическом процессах.
ЗАКЛЮЧЕНИЕ
Представленные материалы мы рассматриваем лишь как свидетельство возможного
участия таежного клеща в эпизоотическом процессе в природных очагах туляремии
лесного типа, а также небольшой (по сравнению с классическими облигатно-транс-
миссивными инфекциями) вероятности заражения человека трансмиссивным путем
при присасывании взрослых особей I. persulcatus. Это, видимо, один из основных
факторов, определяющих слабые эпидемические проявления природных очагов туля-
ремии данного типа.
216
БЛАГОДАРНОСТИ
Работа выполнена при финансовой поддержке Российского фонда фундаментальных
исследований (грант № 16-04-00009).
СПИСОК ЛИТЕРАТУРЫ
Балашов Ю.С. 2010. Значение популяционной структуры иксодовых клещей (Parasitiformes, Ixodidae) под-
держания природных очагов инфекций. Зоологический журнал 89 (1): 18-25.
Каменнова Л.С. 1987. Итоги сероаллергического обследования населения на туляремию по трассе БАМ
в Хабаровской крае. В кн.: Коренберг Э.И. (ред.). Природноочаговые инфекции зоны хозяйственного
освоения БАМ. М., НИИЭМ им. Н.Ф. Гамалеи, с. 116-118.
Карпов С.П., Попов В.М. 1944. Иксодовые клещи как резервуар возбудителя туляремии в природных услови-
ях Западной Сибири. Медицинская паразитология и паразитарные болезни 13 (2): 75-79.
Ковалевский Ю.В., Коренберг Э.И., Горелова Н.Б. 2004. Многолетняя динамика эпизоотического процес-
са природных очагов иксодовых клещевых боррелиозов в горнотаежных лесах Среднего Урала.
Паразитология 38 (2): 105-121.
Ковалевский Ю.В., Коренберг Э.И., Горелова Н.Б., Нефедова В.В. 2013. Экология клеща Ixodes tringuliceps
и его роль в природных очагах иксодовых клещевых боррелиозов Среднего Урала. Зоологический
журнал 92 (5): 505-516.
Коренберг Э.И., Жуков В.И., Шаткаускас А.В., Бушуева Л.К. 1969. Распространение таежного клеща (Ixodes
persulcatus) в СССР. Зоологический журнал 48 (7): 1003-1014.
Коренберг Э.И., 1979. Биохорологическая структура вида (на примере таежного клеща). М., Наука, 170 c.
Коренберг Э.И. 1985. Границы ареала и его тип. В кн.: Филиппова Н. А. (ред.). Таежный клещ Ixodes
persulcatus Schulze (Acarina, Ixodidae): морфология, систематика, экология, медицинское значение.
Л., Наука, с. 188-193.
Коренберг Э.И., Ковалевский Ю.В., Бусоедова Н.М. 1987. Природный очаг туляремии лесного типа в восточ-
ной части зоны БАМ. В кн.: Коренберг Э. И. (ред). Природноочаговые инфекции зоны хозяйственного
освоения БАМ. М., НИИЭМ им. Н.Ф. Гамалеи, с. 106-115.
Коренберг Э.И., Воробьева Н.Н., Сумливая О.Н., Фризен В.И., Афанасьева М.В. 2007. Инфекции, передаю-
щиеся иксодовыми клещами, в Пермском крае (этиология, эпидемиология, патогенез, клиника, диа-
гностика, лечение и профилактика). Пермь, 67 с.
Коренберг Э.И., 2008. Современные черты природной очаговости клещевого энцефалита: новые или хорошо
забытые. Медицинская паразитология и паразитарные болезни 3: 3-8.
Коренберг Э.И. 2010. Природная очаговость инфекций: современные проблемы и перспективы исследова-
ний. Зоологический журнал 89 (1): 5-17.
Коренберг Э.И. 2012. Молекулярно-биологические методы и изучение феномена природной очаговости бо-
лезней. Успехи современной биологии 135 (5): 448-462.
Коренберг Э.И., Помелова В.Г., Осин Н.С. 2013. Природноочаговые инфекции, передающиеся иксодовыми
клещами. М., Комментарий, 463 с.
Кормилицына М.И., Коренберг Э.И., Ковалевский Ю.В., Мещерякова И.С. 2016. Первая молекулярно-гене-
тическая идентификация возбудителя туляремии у клещей Ixodes trianguliceps Bir. в России. Молеку-
лярная генетика, микробиология и вирусология 34 (2): 67-70.
Максимов А.А. 1957. Принципы типизации и опыт ландшафтной характеристики природных очагов туляре-
мии Западной Сибири. Известия Новосибирского отдела географического общества СССР 1: 53-67.
Михайлова Т.В., Демидова Т.Н., Кормилицына М.И., Квасов Д.А., Козорезов А.В., Транквилевский Д.В.
2017. Эпизоотическая активность и эпидемическое проявление природных очагов туляремии в Воро-
нежской области. Эпидемиология и вакцинопрофилактика 92 (1): 16-21.
Олсуфьев Н.Г., Дунаева Т.Н. 1960. Эпизоотология (природная очаговость) туляремии. В кн.: Олсуфьев Н.Г.,
Руднев Г.П. (ред.) Туляремия. М., Медгиз, 136-206.
Олсуфьев Н.Г., Дунаева Т.Н. 1970. Природная очаговость, эпидемиология и профилактика туляремии. М.,
Медицина, 272 с.
Тетерин В.Ю., Коренберг Э.И., Нефедова В.В., Воробьева Н.Н., Фризен В.И., Помелова В.Г. 2013.
Клинико-лабораторная диагностика инфекций, передающихся иксодовыми клещами в Пермском
крае. Эпидемиология и инфекционные болезни 4: 11-15.
Тимофеев В.С. 2015. Генетическое разнообразие Francisella tularensis из природных очагов России. Авто-
реф. дис. … канд. биол. наук. Оболенск, 24 с.
Филиппова Н.А. 1977. Фауна СССР. Паукообразные. Иксодовые клещи подсемейства Ixodidae. Л., Наука,
т. 4, вып. 4, 396 с.
217
Филиппова Н.А. 2011. Особенности биоразнообразия Европейской фауны иксодовых клещей (Acari,
Ixodidae) как переносчиков возбудителей природноочаговых болезней. Паразитология 45 (3): 161-181.
Филиппова Н.А. 2017. История ареала у иксодовых клещей (Acari, Ixodidae) - переносчиков возбудителей
природноочаговых болезней как один из факторов формирования их внутривидового биоразнообра-
зия. Энтомологическое обозрение 96 (1): 157-184.
Фризен В.И., Афанасьева М.В., Коренберг Э.И., Воробьева Н.Н., Наумова Л.М., Девятков М.Ю. 2004. Место
заболеваний, передающихся иксодовыми клещами, в инфекционной патологии Пермской области.
Эпидемиология и вакцинопрофилактика 15 (2): 27-29.
Шлыгина К.Н. 1996. Персистенция Francisella tularensis в организме высокочувствительных животных.
Журнал микробиологии, эпидемиологии и иммунобиологии 2: 110-112.
Bonnet S.I., Binetruy F., Hernández-Jarguín A.M., Duron O. 2017. The tick microbiome: why non-pathogenic
microorganisms matter in tick biology and pathogen transmission. Frontiers in Cellular and Infection
Microbiology 7: 236. doi: 10.3389/fcimb.2017.00236
de Carvalho I.L., Santos N., Soares T., Zé-Zé L., Núncio M.S. 2011. Francisella-like endosymbiont in Dermacentor
reticulatus collected in Portugal. Vector-borne and Zoonotic Diseases 11 (2): 185-188.
European Bioinformatics Institute. 2019. ENA, European Nucleotide Archive. Режим доступа: https://www.ebi.
ac.uk/ena/data/sequence/search (18 февраля 2019).
Gehringer H., Schacht E., Maylaender N., Zeman E., Kaysser P., Oehme R., Pluta S., Splettstoesser W.D. 2013.
Presence of an emerging subclone of Francisella tularensis holarctica in Ixodes ricinus ticks from south-
western Germany. Ticks and Tick-borne Diseases 4 (1-2): 93-100.
Ivanov I.N., Mitkova N., Reye A.L., Hübschen J.M., Vatcheva-Dobrevska R.S., Dobreva E.G., Kantardjiev T.V.,
Muller C.P. 2011. Detection of new Francisella-like tick endosymbionts in Hyalomma spp. and Rhipicephalus
spp. (Acari: Ixodidae) from Bulgaria. Applied and Environmental Microbiology 77 (15): 5562-5565.
Keim P., Johansson A., Wagner D.M. 2007. Molecular epidemiology, evolution, and ecology of Francisella. Annalls
of the New York Academy of Sciences, 1105: 30-66.
Korenberg E.I., Lebedeva N.N. 1969. Distribution and some general features of the ecology of Ixodes trianguliceps
Bir. in the Soviet Union. Folia Parasitologica 16: 143-152.
Korenberg E.I., Gorban’ L.Ya., Kovalevskii Yu.V., Frizen V.I., Karavanov A.S. 2001. Risk for human tick-born
encephalitis, borrelioses and double infection in the Pre-Ural region of Russia. Emerging Infectious Diseases
7 (3): 459-462.
Korenberg E.I., Kovalevskii Yu.V., Gorelova N.B. 2002. Tick-host-Borrelia population interactions: long-term
records in East Europe. Experimental and Аpplied Аcarology 28 (1-4): 225-229.
Korenberg E.I., Kovalevskii Yu.V., Gorelova N.B., Nefedova V.V. 2015. Comparative analysis of the roles of Ixodes
persulcatus and I. trianguliceps ticks in natural foci of ixodid tick-borne borrelioses in the Middle Urals,
Russia. Ticks and tick-borne diseases 6 (4): 316-321.
Kreizinger Z., Hornok S., Dán A., Hresko S., Makrai L., Magyar T., Bhide M., Erdélyi K., Hofmann-Lehmann R.,
Gyuranecz M. 2013. Prevalence of Francisella tularensis and Francisella-like endosymbionts in the tick
population of Hungary and the genetic variability of Francisella-like agents. Vector-borne and Zoonotic
Diseases 13 (3): 160-163.
Michelet L, Bonnet S, Madani N, Moutailler S. 2013. Discriminating Francisella tularensis and Francisella-like
endosymbionts in Dermacentor reticulatus ticks: evaluation of current molecular techniques. Veterinary
Microbiology 163 (3-4): 399-403.
National Center for Biotechnology Information. 2019. Taxonomy Browser. Режим доступа: https://www.ncbi.
nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi?mode=Tree&id=262&lvl=3&p=nuccore&p=genome&p=
has_linkout&p=blast_url&p=genome_blast&lin=f&keep=1&srchmode=1&unlock (18 февраля 2019).
Petersen J.M., Mead P.S., Schriefer M.E. 2009. Francisella tularensis: an arthropod-borne pathogen. Veterinary
Špitalská E., Sparagano O., Stanko M., Schwarzová K., Špitalský Z., Škultéty Ľ., Havlíková S. F. 2018. Diversity of
Coxiella-like and Francisella-like endosymbionts, and Rickettsia spp., Coxiella burnetii as pathogens in the
tick populations of Slovakia, Central Europe. Ticks and Tick-borne Diseases 9 (5): 1207-1211.
Sréter-Lancz Zs., Széll Z., Sréter T., Márialigeti K. 2009. Detection of a novel Francisella in Dermacentor
reticulatus: a need for careful evaluation of PCR-based identification of Francisella tularensis in Eurasian
ticks. Vector-borne and Zoonotic Diseases 9 (1): 123-126.
Tomanović S., Chochlakis D., Radulović Z., Milutinović M., Cakić S., Mihaljica D., Tselentis Y., Psaroulaki A.
2013. Analysis of pathogen co-occurrence in host-seeking adult hard ticks from Serbia. Experimental and
Applied Acarology 59 (3): 367-376.
Wójcik-Fatla A., Zając V., Sawczyn A., Cisak E., Sroka J., Dutkiewicz J. 2015. Occurrence of Francisella spp. in
Dermacentor reticulatus and Ixodes ricinus ticks collected in eastern Poland. Ticks and Tick-borne Diseases
6 (3): 253-257.
218
POSSIBLE INVOLVEMENT OF THE TAIGA TICK IXODES PERSULCATUS
SCHULZE IN THE CIRCULATION OF TULAREMIA CAUSATIVE AGENT
IN NATURAL FOCI OF FOREST TYPE
M. I. Kormilitsyna, E. I. Korenberg, T. V. Mikhaylova, Yu. V. Kovalevskii,
D. B. Trankvilevsky
Keywords: Francisella tularensis, Ixodes persulcatus, forest type focus.
SUMMARY
260 nymphs and the same number of adult of the taiga ticks Ixodes persulcatus collected
from small forest mammals and vegetation in the southern taiga forests of the low mountains
of the Middle Urals (Chusovskaya district of the Perm region) were investigated. Ticks
(2 individuals in each pool) were studied by real time PCR (RT PCR) for the presence of
Francisella DNA. 16S rRNA fragment gene (amplicon size 218-226) was detected in 70 of
130 nymph pools (53.8 %) and 50 of 130 adults (38.5 %). All positive samples were checked
using species-specific primers and probes complementary to a fragment of the lpnA gene and
the ISFtu2-element. The overwhelming majority of samples identified as F. tularensis: 60 of
70 nymph pools (85.7 %) and 49 of 50 adults (98 %). The obtained data indicate the possibility
of the involvement of the tick I. persulcatus in the circulation of tularemia causative agent
in natural foci of the forest type. There is a small probability of human infection by sucking
adult of this taiga tick.
219