ПАРАЗИТОЛОГИЯ, 2019, том 53, № 3, с. 241-250.
УДК 597-169. 574.34 (639.2.09)
ПАРАЗИТО-ХОЗЯИННЫЕ ОТНОШЕНИЯ В СИСТЕМЕ
ПЛЕРОЦЕРКОИДЫ LIGULA INTESTINALIS (L.)
(CESTODA: PSEUDOPHYLLIDEA) - КАРПОВЫЕ РЫБЫ
И ОСОБЕННОСТИ АККУМУЛЯЦИИ РТУТИ
В МУСКУЛАТУРЕ ЗАРАЖЕННЫХ ХОЗЯЕВ
© 2019 г. А. В. Тютинa, *, Е. Н. Медянцеваa, В. А. Гремячихa, **,
В. Т. Комовa, ***
a Институт биологии внутренних вод им. И.Д. Папанина РАН (ИБВВ),
пос. Борок, Ярославская обл., Некоузский р-н, 152742 Россия
* e-mail: atyutin2@gmail.com, helio@ibiw.yaroslavl.ru
** e-mail: grva@ibiw.yaroslavl.ru
*** e-mail: vkomov@ibiw.yaroslavl.ru
Поступила в редакцию 02.03.2019 г.
После доработки 20.05.2019 г.
Принята к публикации 02.06.2019 г.
Работа является частью исследования по изучению аккумуляции ртути в гельминтах и рыбах,
выполнявшегося в 2006-2017 гг. В разных размерно-возрастных группах карповых рыб (леще
Abramis brama L., 1758 и чехони Pelecus cultratus L., 1758) были отмечены значительные раз-
личия по встречаемости плероцеркоидов Ligula intestinalis L., 1758. Сравнительный анализ за-
раженных и незараженных экземпляров рыб показал вариабельность концентраций ртути как
в плероцеркоидах L. intestinalis, так и в мышцах промежуточных хозяев. Было выявлено сход-
ство в процессах аккумуляции металла у зараженных плероцеркоидами особей A. brama и
P. cultratus, отловленных в разных участках Рыбинского водохранилища (бассейн Верхней Вол-
ги). Среднее значение содержания ртути в тканях L. intestinalis составило 0.013 ± 0.005 мг Hg/кг
сырой массы (с разбросом значений 0.001-0.043 мг/кг, коэффициент вариации Cv = 109.8 %). В
мышцах незараженных особей леща содержание металла было ниже, по сравнению с мышцами
зараженных экземпляров: 0.073 ± 0.006 мг/кг (Cv = 39.0 %) и 0.094 ± 0.013 мг/кг (Cv = 40.5 %),
соответственно. Для показателей у пары L. intestinalis-чехонь, напротив, среднее значение пока-
зателя было выше у незараженных рыб (0.133 ± 0.008 мг Hg/кг, Cv = 36.4 %), чем у зараженных
L. intestinalis особей (0.092 ± 0.006 мг Hg/кг сырой массы, Cv = 16.4 %).
Ключевые слова: цестода, Ligula intestinalis, лещ Abramis brama, чехонь Pelecus cultratus,
ртуть, биоаккумуляция.
DOI: 10.1134/S0031184719030062
В последние годы особый интерес вызывают публикации, связанные со способно-
стью патогенных для хозяина гельминтов, к которым относятся цестоды семейства
Ligulidae, разнонаправлено влиять на процесс накопления тяжелых металлов в тканях
241
разных видов рыб-хозяев (Barus et al., 2012; Доровских, Мазур, 2013; Frank et al., 2013;
Palikova et al., 2014; Sures et al., 2017).
Изучение отношений в паразитарных системах «пресноводные рыбы-плероцерко-
иды цестод семейства Ligulidae» на популяционном и организменном уровнях часто
привлекало внимание исследователей, и многие аспекты проблемы отражены в лите-
ратуре достаточно подробно (Orr, 1967; Arme, Owen, 1968; Dubinina, 1980; Извекова,
Кузьмина, 1996; Куперман и др., 1997; Morley, Lewis, 2019).
Большинство эколого-паразитологических работ, связанных с изучением представи-
телей семейства Ligulidae, посвящено паразитарным системам, формируемым цесто-
дой L. intestinalis. На фоне общего глобального потепления в начале XXI века этот
паразит все чаще вызывает эпизоотии в популяциях рыб из водоемов Европы, Азии
и Африки (Loot et al., 2001; Brown et al., 2002; Britton et al., 2009; Vanacker et al., 2012;
Sohn et al., 2016; Чугунова, 2017). К числу негативных последствий для хозяев нередко
относят изменения в их поведении (Dubinina, 1980; Frank et al., 2013; Palikova et al.,
2014).
В бассейне р. Волги вид L. intestinalis наиболее распространенный представитель се-
мейства, имеющий большой круг промежуточных хозяев. В обзоре Е.А. Богдановой и
Н.П. Никольской (1965), суммирующем результаты паразитологических исследований
рыб за 1868-1955 гг., отмечено, что в р. Волге, до окончательного зарегулирования ее
стока, плероцеркоиды L. intestinalis встречались у леща A. brama, плотвы Rutilus rutilus
Linnaeus, 1758, ельца Leuciscus leuciscus Linnaeus, 1758, пескаря Gobio gobio Linnaeus,
1758, уклеи Alburnus alburnus Linnaeus, 1758, густеры Blicca bjoerkna Linnaeus, 1758.
Высокая встречаемость плероцеркоидов L. intestinalis была характерна для волжских
водохранилищ с небольшой скоростью водообмена в первые годы после их создания.
Например, в Рыбинском водохранилище в 1942-1963 гг. регулярно отмечали заражен-
ность леща (до 20.0-40.0 %), плотвы (до 60.0 %) и густеры (до 13.0 %) (Изюмова, 1977).
Несмотря на это, некоторые аспекты отношений паразит-хозяин для L. intestinalis
остаются слабоизученными. Чехонь P. cultratus, широко распространена в водоемах,
относящихся к бассейнам Черного, Каспийского и Балтийского морей и давно включе-
на в число вторых промежуточных хозяев L. intestinalis, наряду с большинством других
обычных для европейских водоемов карповых рыб (Dubinina, 1980). Однако данных об
особенностях отношений в этой паре «паразит-хозяин» мало, что, возможно, связано с
невысокой, по сравнению с другими видами рыб, зараженностью чехони плероцерко-
идами в большинстве ее европейских популяций.
В монографии Изюмовой (1977) при подробном описании особенностей лигулидо-
зов для волжской чехони после превращения Волги в каскад водохранилищ зарегистри-
рованы только две серьезные вспышки встречаемости плероцеркоидов L. intestinalis.
Эти случаи отмечены в первые годы после создания Горьковского водохранилища:
в 1956 г. (до 9.1 %) и в 1963 г. (до 80.0 %). В более поздние годы основные иссле-
дования проводились на леще из Рыбинского водохранилища (Куперман и др., 1997).
Однако даже при проведении паразитологических исследований карповых рыб в 1995-
2004 гг. случаев массового заражения чехони в этом водоеме не было зафиксировано,
хотя плероцеркоиды L. intestinalis регулярно присутствовали у взрослых особей леща,
плотвы, густеры и уклеи (Тютин, 2002; Тютин, Кияшко, 2005; Тютин и др., 2006). Толь-
242
ко в 2005 г. в водоеме была отмечена первое серьезное повышение зараженности чехо-
ни (до 13.3 % в среднем по водоему) с максимальными значениями встречаемости пле-
роцеркоидов у рыб из северной части водохранилища (Тютин и др., 2006). Северная
часть водосбора Рыбинского водохранилища находится в зоне действия Череповецкого
металлургического комбината (Komov et al., 2016; 2017). Можно предположить, что
токсическое отравление чехони тяжелыми металлами и другими загрязнителями, по-
служило возможной причиной ослабления рыб и привело к их повышенной заражен-
ности в северном участке водоема.
Цель данного исследования - изучение влияния патогенных гельминтов (плероцер-
коидов L. intestinalis) на аккумуляцию ртути в мышцах рыб-хозяев, различающихся по
типу питания (леще A. brama и чехони P. cultratus).
МАТЕРИАЛ И МЕТОДЫ
В работе использована часть материалов, собранных в 2006-2017 гг. в регулярных рейсах
экспедиционных судов ИБВВ РАН по всей акватории Рыбинского водохранилища. Отлов рыб
проводили в период с мая по октябрь с использованием пелагических и донных тралов по стан-
дартной сетке точек (максимально из 22 станций). Учитывали особенности экосистемы водоема
и наличие в нем локальных стад рыб (Рыбы Рыбинского…, 2015). Основное внимание было
уделено изучению закономерностей в системе L. intestinalis - P. cultratus, так как особенности
отношений между плероцеркоидами лигулид и A. brama в условиях Рыбинского водохрани-
лища достаточно подробно рассматривались ранее (Куперман и др., 1997; Тютин, 2002, 2003;
Тютин, Кияшко, 2005; Тютин и др. 2006; Tyutin et al., 2013). Часть центрального участка это-
го водоема активно используется мигрирующей молодью рыб, что ограничило возможность
использования результатов некоторых уловов в работе (примерно от 58°35ʹ с.ш., 38°30ʹ в.д. до
58°30ʹ с.ш., 37°90ʹ в.д.). Для анализа преимущественно использовали данные по рыбам, которые
можно было сгруппировать по двум-трем точкам в относительно удаленных зонах водохрани-
лища. Для «северного» участка примерными границами в нашем случае считали координаты от
58°50ʹ с.ш., 38°20ʹ в.д. до 58°45ʹ с.ш., 38°25ʹ в.д. и рассматривали его в качестве антропогенно
загрязненной зоны. Южную часть водохранилища от 58°00ʹ с.ш. и 38°25ʹ в.д. до 58°15ʹ с.ш. и
38°28ʹ в.д. - как «условно чистый» участок.
Отбор и хранение проб для определения содержания ртути в тканях проводили по описанной
ранее методике (Комов и др., 2004; Komov et al., 2016; 2017; Удоденко и др., 2019). Из траловых
уловов для исследования содержания ртути выбирали лещей из средней размерно-возрастной
группы (преимущественно 250-300 мм). В анализируемые выборки чехони не включали сего-
леток с длиной тела менее 90 мм и массой около 2 г., как и двухлеток, преобладающих в уловах
из центральной (нагульной) части водоема. Для определения содержания ртути были использо-
ваны взрослые особи чехони из северного (с длиной тела 160-213 мм) и южного (165-210 мм)
участков водоема. При среднем размере рыб 191.7 ± 4.0 мм и 184.7 ± 2.1 мм средняя масса тела
у них составляла 48.6 ± 3.5 г. и 44.3 ± 1.7 г, соответственно. В число исследованных проб были
включены плероцеркоиды L. intestinalis (8 экз.). Точность аналитических методов измерения
контролировали с использованием сертифицированного биологического материала DORM-2 и
DOLM-2 (Институт химии окружающей среды, Оттава, Канада). Во всех случаях содержание
ртути в образцах определяли в 2-3 повторностях атомно-абсорбционным методом холодного
пара на ртутном анализаторе РА-915+ с приставкой ПИРО (Люмэкс) без предварительной подго-
товки проб. Относительная погрешность измерений содержания ртути в образцах на используе-
мом нами приборе составляет от ± 28 % для мышечной ткани рыб до ± 40 %, для плероцеркоидов
(при n = 2).
243
Математическую обработку данных по зараженности рыб проводили с использованием обыч-
ных методов (Sokal, Rohlf, 1995; Bush et al., 1997). В качестве основного показателя исполь-
зовали встречаемость плероцеркоидов в выборках рыб (доля зараженных особей с расчетом
стандартной статистической ошибки). Принимая во внимание относительно небольшие объемы
выборок рыб, попарное сравнение достоверности различий в уровнях зараженности в выборках
проводили по критерию χ2 Пирсона (хи-квадрат) на уровне значимости p < 0.05 и p < 0.10.
Результаты анализа содержания ртути в мышечной ткани рыб в таблицах представляли в виде
средних значений и их ошибок (x ± SE), данные обрабатывали статистически, используя метод
однофакторного дисперсионного анализа (ANOVA) и процедуру LSD-теста при уровне значи-
мости р = 0.05. Для сравнительной оценки этого показателя дополнительно применяли коэффи-
циент вариации (Cv, %), отражающий соотношение среднего и дисперсии.
РЕЗУЛЬТАТЫ
В Рыбинском водохранилище среднее содержание ртути в тканях L. intestinalis оказалось не-
большим (0.013 ± 0.005 мг Hg/кг сырой массы) и в исследованной разновозрастной выборке пле-
роцеркоидов варьировало в диапазоне от 0.001 мг/кг до 0.043 мг/кг (с коэффициентом вариации
Cv = 109.8 %). Концентрации металла в мышцах зараженных плероцеркоидами особей леща и
чехони совпадали (табл. 1). Для обоих видов рыб в группах зараженных особей значения показа-
теля были несколько выше у экземпляров из северного участка водохранилища. В контрольных
группах незараженных плероцеркоидами рыб отмечены межвидовые различия в процессах ак-
кумуляции ртути. Ее содержание в мышцах незараженных особей леща из обоих сравниваемых
участков водохранилища (0.067 и 0.077) оказалось примерно в два раза ниже, чем у аналогичных
групп чехони (0.12 и 0.14 мг/кг сырой мaссы).
Из-за низкой концентрации ртути в мышцах исследованных особей леща влияние плеро-
церкоидов статистически слабо прослеживалось даже в усредненной по водоему выборке
(p > 0.5). Однако содержание ртути в мышцах незараженных лещей (0.067-0.077 мг/кг) для
обоих участков водоема было ниже по сравнению с зараженными плероцеркоидами особями
(0.084-0.097 мг/кг сырой мaссы).
Для обоих участков водоема коэффициенты вариации содержания ртути у незараженных
лещей почти не отличались от показателей у зараженных особей: Cv = 38.5-39.5 % и
Cv = 42.44-43.2 %, соответственно. Наиболее заметны различия по исследованному показателю
у леща из северной группировки, но и в этом случае они варьируют незначительно, что указы-
вает на относительно благополучное состояние популяции хозяина и сбалансированность отно-
шений в паре паразит-хозяин.
При исследовании выборок чехони из двух участков водоема в обоих случаях были выявлены
более высокие значения содержания ртути в мышцах незараженных особей (0.120-0.140 мг/кг,
при Cv = 34.8-39.5 %). У зараженных плероцеркоидами экземпляров чехони в выборках из обо-
их участков водоема содержание ртути ниже (0.086-0.108 мг/кг) и отличается минимальными
значениями коэффициента вариации (Cv = 5.9-14.9 %). В среднем по водоёму различия стати-
стически достоверны (p < 0.05). При сравнении содержания ртути в мышцах взрослых особей
чехони из северного и южного участков Рыбинского водохранилища статистически значимых
различий не выявлено, что, возможно, отражает относительно благополучную экологическую
ситуацию в водоеме.
Выявленные межвидовые различия отчасти могут быть связаны с тем, что встречаемость пле-
роцеркоидов в рассматриваемой размерно-возрастной группе леща слабо варьирует по годам
и в среднем невелика (4.0 ± 2.3 %, n = 75), тогда как пара L. intestinalis - чехонь выглядит ме-
нее сбалансированной (табл. 2). В первые три года наблюдений в выборках чехони было за-
ражено около трети особей. В последующие три года средняя встречаемость плероцеркоидов
была примерно в два раза ниже, что может быть следствием высокой патогенности паразита
244
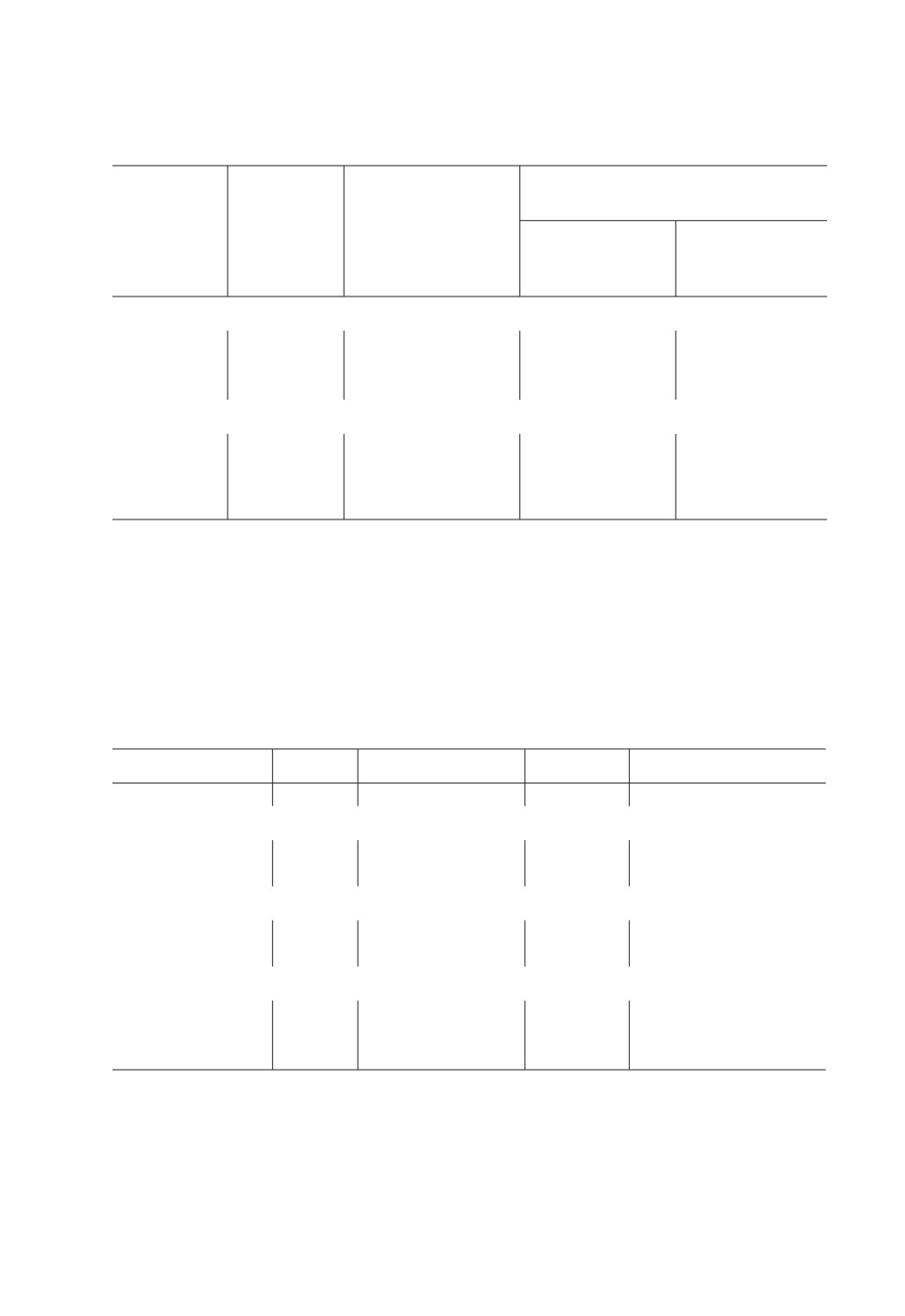
Таблица 1. Среднее содержание ртути (мг Hg/кг сырой ткани) в мускулатуре незараженных
и зараженных плероцеркоидами Ligula intestinalis экземпляров леща Abramis brama и чехони
Pelecus cultratus из Рыбинского водохранилища (2009-2017 г.)
Среднее содержание ртути
Вариабельность
(Hg, мг/кг сырой мaссы)
Число рыб
Участок
содержания
в выборке,
водоема
ртути
В группе
В группе
n1 (n2)
(Cv, %).
незараженных
зараженных
рыб
рыб
Лещ Abramis brama
Северный
15 (6)
38.5 / 42.4
0.067 ± 0.009
0.097 ± 0.017
Южный
16 (2)
39.5 / 43.2
0.077 ± 0.008
0.084 ± 0.026
По водоему
31 (8)
39.0 / 40.4
0.073 ± 0.006
0.094 ± 0.013
Чехонь Pelecus cultratus
Северный
14 (5)
39.5 / 5.9
0.120 ± 0.014
0.108 ± 0.005
Южный
28 (2)
34.8 / 14.9
0.140 ± 0.010
0.086 ± 0.006
По водоему
42 (7)
36.4 / 16.4
0.133 ± 0.008
0.092 ± 0.006
Примечания: n1 - число исследованных рыб, экз.; n2 - число зараженных рыб (в скобках), экз. Данные
по содержанию ртути представлены в виде средних значений и их ошибок (m ± SE). Вариабельность
содержания ртути (Cv, %) приведена для групп незараженных / зараженных особей. Включены данные по
чехони с длиной тела (L1 ) не менее 160 мм (со смешанным типом питания) и данные по лещу с длиной тела
(L2) около 250-300 мм.
Таблица 2. Различия по встречаемости плероцеркоидов L. intestinalis в размерно-возрастных
группах чехони Pelecus cultratus
Группы рыб
n, экз.
L2 (min-max, мм)
E ± SE, %
Достоверность различий
Суммарно
146
90-400
24.0 ± 3.5
-
Возрастные различия
Молодые особи
77
90-50
29.9 ± 5.2
χ2 = 3.109, p < 0.078*
Взрослые особи
69
151-400
17.4 ± 4.6
Межгодовые различия
2006 - 2008 гг.
85
100-400
29.4 ± 4.9
χ2 = 3.302, p < 0.069*
2009 - 2011 гг.
61
90-350
16.4 ± 4.7
По участкам водоема
Северный
49
100-400
22.4 ± 5.9
χ2 = 3.122, p > 0.209
Центральный
44
90-300
34.1 ± 7.2
Южный
48
110-350
18.8 ± 5.6
П р и м е ч а н и е : n - число исследованных рыб, экз.; L2 (min-max, мм) - разбросы значений длины
тела в размерной группе рыб. E ± s, % - значения встречаемости плероцеркоидов L. intestinalis приведены
с указанием стандартной ошибки.
* Различия по критерию Пирсона χ2 статистически достоверны на уровне значимости р < 0.10. Прочерк - не
сравнивали.
245
для чехони и селективной смертностью зараженных особей. В пользу этого свидетельствуют и
данные по встречаемости плероцеркоидов L. intestinalis в двух размерно-возрастных группах
P. cultratus. В рассматриваемый период этот показатель у молодых рыб примерно в два раза
превысил значение для взрослых особей чехони. Из-за небольшого объема выборок рыб это
различие по критерию χ2 статистически достоверно только на уровне значимости р < 0.10. Срав-
нение встречаемости плероцеркоидов в трех выборках рыб из разных участков водохранилища
(северного, центрального и южного) по критерию Пирсона, показало, что их можно отнести
к одной генеральной совокупности (χ2 = 3.122, p > 0.209). Возможно, это является прямым след-
ствием высокой миграционной активности ведущей пелагических образ жизни чехони. В уловах
из центральной (озеровидной) части водохранилища преобладали молодые особи чехони, и, как
следствие, встречаемость плероцеркоидов в этом участке водоема была заметно выше, по срав-
нению с группами рыб из северного и южного участков (речные плесы).
Сравнение зараженности рыб из северного и центрального участков водохранилища стати-
стически значимых различий не выявило (χ2 = 1.561, df = 1, p > 0.211). Встречаемость плеро-
церкоидов у рыб из южного участка водоема отличалась от показателя для центральной части
водохранилища более заметно (χ2 = 2.802, df = 1, p < 0.094). Интенсивность заражения у молодых
рыб варьировала от 1 до 6 экз. плероцеркоидов с явным доминированием рыб, зараженных сра-
зу несколькими некрупными экземплярами гельминта. У взрослых особей чехони агрегирован-
ность распределения паразитов выражена слабее: интенсивность заражения была ниже - от 1 до
3 экз., но плероцеркоиды были более крупными.
ОБСУЖДЕНИЕ
Современные данные литературы по накоплению металлов в мышцах рыб из есте-
ственных водоемов достаточно противоречивы. Очевидно, что различные металлы
накапливаются в тканях организма в разной степени, а влияние на этот процесс опре-
деленного вида паразитов часто зависит от рассматриваемого хозяина и особенностей
функционирования его конкретной популяции (Barus et al., 2012; Subbotic et al., 2015;
Sures et al., 2017). Нередко авторы отмечают повышенное аккумулирование металлов
в тканях гельминтов на фоне относительно низкого содержания в тканях зараженных
особей хозяина (по сравнению с незараженными). Возможный физиологический ме-
ханизм влияния гельминтов на накопление хозяином тяжелых металлов также пока
не ясен. В частности, нет однозначных результатов по изучению влияния зараженно-
сти L. intestinalis на металлотионеины, ответственные за вывод металлов из организма
рыб-хозяев (Frank et al., 2013).
На аккумуляцию ртути в тканях рыб и их паразитов, влияют выбор хозяином местоо-
битания и особенности его питания. Хорошо известно, что при заражении L. intestinalis
большинство видов карповых рыб обычно поднимаются к поверхности воды или пере-
ходят в более мелководные участки водоемов, что облегчает их элиминирование хищ-
никами (Dubinina, 1980; Loot et al., 2001; Britton et al., 2009). Такое манипулирование
поведением хозяина может продлевать период планктофагии, являясь одновременно
и причиной, и следствием агрегации плероцеркоидов в одной рыбе (Brownet al., 2002).
Непосредственное сравнение полученных нами данных по накоплению тяжёлых
металлов гидробионтами с результатами других исследователей затруднено из-за раз-
личий в методических подходах и особенностей конкретных водоемов. Современный
уровень содержания ртути в грунтах водохранилища даже в зоне влияния Черепо-
вецкого металлургического комбината оценивается как относительно невысокий для
крупного промышленного района (Komov et al., 2016, 2017). Тем не менее, наши дан-
246
ные не противоречат результатам исследования леща A. brama в бассейне реки Дунай,
согласно которым среднее содержание ртути в плероцеркоидах L. intestinalis примерно
в 7 раз меньше, чем в тканях хозяина (Palikova et al., 2014). Однако в этом случае ав-
торы анализировали зараженных плероцеркоидами особей, уже мигрировавших в ли-
торальную зону водоема, выявив у них повышенное содержание ртути в мускулатуре
(0.36 ± 0.11 мг/кг) по сравнению с отловленными в других биотопах незараженными
экземплярами (0.24 ± 0.10 мг/кг сырой массы).
Сложнее интерпретировать данные по чехони, способной переходить с возрастом
в некоторых водоемах не только к бентофагии, но и к ихтиофагии. Из литературы из-
вестно, что у чехони из бассейна р. Дунай, относимой к числу облигатных планктофа-
гов, содержание ртути в тканях относительно мало по сравнению, например, с пока-
зателями типичного европейского бентофага - ерша Gymnocephalus cernuus Linnaeus,
1758 (Subotic et al., 2015). При этом, в отличие от ерша, у дунайской чехони содержание
ртути примерно в полтора раза выше в мускулатуре (2.08 ± 1.19 мг/кг), чем в печени
(1.37 ± 0.70 мг/кг сухой массы). Чехонь в Рыбинском водохранилище ведет активный
пелагический образ жизни, до размера 150 мм питается почти исключительно зооплан-
ктоном и личинками сем. Chironomidae, и только в половозрелом состоянии начинает
пополнять рацион насекомыми и молодью рыб (Рыбы Рыбинского …, 2015). С начала
века в этом водоеме наблюдается устойчивый рост численности популяции чехони,
что связывают с улучшением условий нереста и формированием ряда урожайных по-
колений.
В результате проведенных нами исследований установлено, что содержание ртути
в мышцах зараженных особей чехони значительно ниже, чем у контрольных экзем-
пляров, что может быть связано с задержкой пребывания рыб в центральной части во-
доема, используемой молодью для нагула. Следует отметить явную несбалансирован-
ность отношений паразит-хозяин в данном случае, что находит отражение в заметных
возрастных и межгодовых колебаниях уровня зараженности чехони в Рыбинском водо-
хранилище. В качестве одной из причин нарушения нормального функционирования
паразитарных систем в этом водохранилище ранее рассматривали натурализацию чер-
номорско-каспийской тюльки Clupeonella cultriventris Nordmann, 1840, численность
которой в пелагиали водоема достигала в отдельные годы высоких значений (Тютин,
2003; Тютин, Кияшко, 2005; Tyutin et al., 2013). В случае перехода ихтиофагов на пи-
тание черноморско-каспийской тюлькой хищные рыбы могут в меньшей степени эли-
минировать зараженную чехонь, а места кормлений рыбоядных птиц (дефинитивные
хозяева L. intestinalis) перемещаются из прибрежной к центральной части водоема.
В Рыбинском водохранилище зараженность чехони плероцеркоидами L. intestinalis
достаточно долго сохраняется на высоком уровне, что влияет на процесс циркуляции
ртути в экосистеме водоема. В других водохранилищах верхней и средней Волги роста
зараженности чехони плероцеркоидами L. intestinalis не отмечено (Тютин и др., 2006).
У леща в водохранилищах верхней и средней Волги возрастные различия в зараженно-
сти плероцеркоидов L. intestinalis и Digramma interrupta (Rudolphi, 1810) отсутствуют,
а межгодовые колебания показателя встречаемости плероцеркоидов выражены слабее
(Тютин, 2002).
247
ЗАКЛЮЧЕНИЕ
Результаты работы подтверждают способность патогенных для рыб плероцеркои-
дов цестод сем. Ligulidae оказывать существенное влияние на хозяина. У зараженных
плероцеркоидами L. intestinalis взрослых особей чехони P. cultratus и леща A. brama
концентрации ртути в мышцах имели близкие значения. У незараженных рыб двух
видов отмечены существенные различия по этому показателю. По нашему мнению,
выявленная в данном случае закономерность связана с выбором зараженными особями
карповых рыб близких по типу мест обитания.
БЛАГОДАРНОСТИ
Работа выполнена в рамках государственного задания РФ (темы ААА-
А-А18-118012690100-5, АААА-А18-118012690123-4, АААА-А18-118012690106-7,
АААА-А18-118012690105-0). Авторы благодарят администрацию ИБВВ РАН, к.б.н.
Кияшко В.И., к.б.н. Удоденко Ю.Г., д.б.н. Герасимова Ю.В., д.б.н. Чуйко Г.М. за содей-
ствие при выполнении работы.
СПИСОК ЛИТЕРАТУРЫ
Богданова Е.А., Никольская Н.П. 1965. Паразитофауна рыб Волги до зарегулирования стока. Известия
ГосНИОРХ 60: 5-110.
Доровских Г.Н., Мазур В.В. 2013. Жизненная стратегия паразитов рыб и аккумулирование ими металлов.
Вода: химия и экология 4 (58): 57-63.
Извекова Г.И., Кузьмина В.В. 1996. Влияние заражения плероцеркоидами Ligula intestinalis на активность
пищеварительных ферментов и содержание гликогена в тканях леща. Паразитология 30 (1): 45-51.
Изюмова Н.А. 1977. Паразитофауна рыб водохранилищ СССР и пути ее формирования. Л., Наука, 284 с.
Комов В.Т., Степанова И.К., Гремячих В.А. 2004. Содержание ртути в мышцах рыб из водоемов Северо-
Запада России: причины интенсивного накопления и оценка негативного эффекта на состояние здоро-
вья людей. В кн.: Актуальные проблемы водной токсикологии. Борок: ИБВВ РАН, с. 99-123.
Куперман Б.И., Жохов А.Е., Извекова Г.И., Таликина М.Г. 1997. Динамика зараженности лигулидами лещей
Волжских водохранилищ и паразитохозяинные отношения при лигулезе. Биология внутренних вод
2: 41-49.
Рыбы Рыбинского водохранилища: популяционная динамика и экология. 2015. /ред. Ю.В. Герасимов; РАН,
Ин-т биологии внутр. вод им. И.Д. Папанина. Ярославль, Филигрань, 418 с.
Удоденко Ю.Г., Тютин А.В., Морозова Д.А., Гремячих В.А., Суконина А.И., Комов В.Т., Медянцева Е.Н.
Ртуть и некоторые паразиты карповых рыб. Экологический сборник 7. Труды молодых ученых. Все-
российская (с международным участием) молодежная конференция. С. 469-473. DOI: 10.24411/9999-
010A-2019-101118
Тютин А.В. 2002. Динамика встречаемости цестод семейства Ligulidae у леща в водохранилищах Верхней и
Средней Волги. Проблемы цестодологии 2: 232-242.
Тютин А.В. 2003. Сравнительный анализ паразитофауны двух пелагических рыб-вселенцев в Рыбинском
водохранилище. Биология внутренних вод 2: 86-91.
Тютин А.В., Кияшко В.И. 2005. Встречаемость цестод семейства Ligulidae у карповых рыб верхневолжских
водохранилищ после вселения черноморско-каспийской тюльки. Проблемы цестодологии 3: 267-276.
Тютин А.В., Кияшко В.И., Слынько Ю.В. 2006. Динамика роста зараженности карповых рыб волжских во-
дохранилищ плероцеркоидами цестод семейства Ligulidae. В кн.: Проблемы устойчивого функциони-
рования водных и наземных экосистем. Материалы международной конференции. Ростов-на-Дону,
с. 430-433.
Чугунова Ю.К. 2017. Нетипичная локализация плероцеркоидов Ligula intestinalis в плотве Курейского водо-
хранилища. Паразитология 51 (5): 445-446.
Arme C., Owen R.W. 1968. Occurrence and pathology of Ligula intestinalis infections in British fishes. Journal of
Parasitology 54 (2): 272-280.
Barus V., Simkova A., Prokes M., Penaz M., Vetesnik L. 2012. Heavy metals in two host-parasite systems: tapeworm
vs. fish. Acta Veterinaria Brno 81 (3): 313-317. DOI: 10.2754/avb201281030313
Bush A.O., Lafferty K.D., Lotz J.M., Shostak A.W. 1997. Parasitology meets ecology on its own terms: Margolis
et al. revised. Journal of Parasitology 83: 575-583.
248
Britton J.R., Jackson M.C., Harper D.M. 2009. Ligula intestinalis (Cestoda: Diphyllobothriidae) in Kenya: a field
investigation into host specificity and behavioural alterations. Parasitology 136 (11): 1367-1373. DOI:
10.1017/S003118200999059X
Brown S.P., Teriokhin A.T., Guegan J.F., Loot G., Brunel A., Brunel C. 2002. Host manipulation by Ligula
intestinalis: a cause or consequence of parasite aggregation? International Journal for Parasitology 32 (7):
817-824.
Dubinina M.N. Tapeworms (Cestoda, Ligulidae) of the Fauna of the U.S.S.R. 1980. Amerind Publishing Co., New
Dehli.
Frank S.N., Godehardt S., Nachev M., Trubiroha A., Kloas W., Sures B. 2013. Influence of the cestode Ligula
intestinalis and the acanthocephalan Polymorphus minutus on levels of heat shock proteins (HSP70) and
metallothioneins in their fish and crustacean intermediate hosts. Environmental Pollution 180: 173-179.
DOI:10.1016/j.envpol.2013.05.014
Komov V.T., Ivanova E.S., Gremyachikh V.A., Poddubnaya N.Y. 2016. Mercury Content in Organs and Tissues of
Indigenous (Vulpes vulpes L.) and Invasive (Nyctereutes procyonoides Gray.) Species of Canids from Areas
Near Cherepovets (North-Western Industrial Region, Russia). Bulletin of Environmental Contamination and
Toxicology 97 (4): 480-485. DOI: 10.1007/s00128-016-1891-7
Komov V.T., Ivanova E.S., Poddubnaya N.Y., Gremyachikh V.A. 2017. Mercury in soil, earthworms and organs
of voles Myodes glareolus and shrew Sorex araneus in the vicinity of an industrial complex in Northwest
Russia (Cherepovets). Environmental Monitoring and Assessment 189 (3): 480-485 DOI: 10.1007/s10661-
017-5799-4
Loot G., Brosse S., Lek S., Guegan J.F. 2001. Behaviour of roach (Rutilus rutilus L.) altered by Ligula intestinalis
(Cestoda : Pseudophyllidea): a field demonstration. Freshwater Biology
46
(9): 1219-1227. DOI:
10.1046/j.1365-2427.2001.00733.x
Morley N.J., Lewis J.W. 2019. Influence of Ligula intestinalis plerocercoids (Cestoda: Diphyllobothriidae) on the
occurrence of eyeflukes in roach (Rutilus rutilus) from a lake in south-east England. Journal of Helminthology
93 (1): 66-70. DOI:10.1017/S0022149X17001213.
Orr T.S.C. 1967. Distribution of the plerocercoid of Ligula intestinalis. Journal of Zoology 153: 91-97.
Palikova M., Navratil S., Dvorakova A., Bedanova I., Mares J., Celechovska O. 2014. Mercury content in the
parasite-host system of Ligula intestinalis and Abramis brama and the effect of the parasite on fish muscle
composition. Acta Veterinaria Brno 83 (2): 89-93. DOI:10.2754/avb201483020089
Sohn W.M., Na B.K., Jung S.G., Kim K.H. 2016. Mass death of predatory carp, Chanodichthys erythropterus,
induced by Plerocercoid Larvae of Ligula intestinalis (Cestoda: Diphyllobothriidae). Korean Journal of
Parasitology 54 (3): 363-368.
Sokal R.R., Rohlf F.J. 1995. Biometry. The principals and practice of statistics in biological research. N.Y.: W.H.
Freeman and Co, 887 pр.
Subotic S., Visnjic-Jeftic Z., Spasic S., Hegedis A., Krpo-Cetkovic J., Lenhardt M. 2015. Concentrations of 18
Elements in Muscle, Liver, Gills, and Gonads of Sichel (Pelecus cultratus), Ruffe (Gymnocephalus cernua),
and European Perch (Perca fluviatilis) in the Danube River near Belgrade (Serbia). Water Air and Soil
Pollution 226 (9): 1-11. DOI:10.1007/s11270-015-2544-x
Sures B., Nachev M., Selbach C., Marcogliese D.J. 2017. Parasite responses to pollution: what we know and where
we go in «Environmental Parasitology». Parasites and Vectors 10 (65): 1-19. DOI:10.1186/s13071-017-
2001-3
Tyutin A.V., Verbitsky V.B., Verbitskaya T.I., Medyantseva E.N. 2013. Parasites of alien aquatic animals in the
Upper Volga basin. Russian Journal of Biological Invasions 4(1): 54-59. DOI: 10.1134/S2075111713010098
Vanacker M., Masson G., Beisel J-N. 2012. Host switch and infestation by Ligula intestinalis L. in a silver bream
(Blicca bjoerkna L.) population. Parasitology 139 (3): 406-417.
HOST - PARASITE RELATIONSHIPS IN THE PLEROCERCOIDS OF LIGULA
INTESTINALIS (L.) (CESTODA: PSEUDOPHYLLIDEA) - CARP FISH SYSTEM
AND THE MERCURY ACCUMULATION IN THE MUSCLES OF HOSTS
A. V. Tyutin, E. N. Medyantseva, V. A. Gremyachikh, V. T. Komov
Key words: Cestoda, Ligula intestinalis, bream Abramis brama, sichel Pelecus cultratus,
mercury, bioaccumulation.
249
SUMMARY
This work is the part of studies of the mercury bioaccumulation in helminths and fish conducted
in 2006-2017. The high differences in the prevalence of plerocercoids of Ligula intestinalis in the
different body length groups of cyprinids fish (bream Abramis brama and sichel Pelecus cultratus)
were registered. The comparative analysis of the infected and non-infected fish resulted in the varied
concentration of Hg both in plerocercoids of Ligula intestinalis and in muscles of intermediate hosts
specimens - fish. On the other hand, there are the similarities of the mercury accumulation process
between parasitised specimens of Abramis brama and Pelecus cultratus, caught at the different
parts of the Rybinsk Reservoir (the Volga river basin). Mean value of mercury concentration in
the plerocercoids Ligula intestinalis was 0.013 ± 0.005 mg Hg/kg fresh wet weight (0.001-0.043,
with variation coefficient values Cv = 109.8 %). The levels of mercury was lower in muscles of non-
infected breams in comparison with infected specimens: 0.073 ± 0.006 mg /kg (Cv = 39.0 %) and
0.094 ± 0.013 mg/kg (Cv = 40.5 %), respectively. On the contrary, in the sichel (Pelecus cultratus) -
L. intestinalis cases mean concentrations of Hg were higher in muscles of non-infected fish (0.133 ±
0.008 mg Hg/kg, Cv = 36.4 %) than in infected by L. intestinalis specimens (0.092 ± 0.006 mg Hg/kg
fresh wet weight, Cv = 16.4 %).
250