ПАРАЗИТОЛОГИЯ, 2019, том 53, № 6, с. 483-505.
УДК 597-135:576.89 (282.247.41)
ПАРАЗИТЫ МОЛОДИ РЫБ ДЕЛЬТЫ РЕКИ ВОЛГА
© 2019 г. А. В. Коньковаа,*, Т. А. Солохинаа, Н. Ю. Терпуговаа
аВолжско-Каспийский филиал ФГБНУ
«Всероссийский научно-исследовательский институт
рыбного хозяйства и океанографии» («КаспНИРХ»),
ул. Савушкина 1, Астрахань 414056, Россия
*e-mail: kaspiy-info@mail.ru
Поступила в редакцию 10.06.2019 г.
После доработки 27.08.2019 г.
Принята к публикации 27.08.2019 г.
В период 2005-2018 гг. паразитофауна ранней молоди воблы, леща, красноперки, густеры,
карася, сазана, окуня в полоях дельты р. Волги и Волго-Ахтубинской поймы насчитывала
20 видов, паразитофауна сеголетков воблы и леща в северной части Каспийского моря - 13 ви-
дов. Самым распространенным паразитом являлась трематода Apophallus muhlingi (Jagerskiold,
1899), регулярно регистрируемая у молоди, зараженность которой находилась в тесной свя-
зи с продолжительностью пребывания рыб во временно заливаемых водоемах. Она наряду
с Posthodiplostomum cuticola (Nordmann, 1932) проявляла наибольшую патогенность по отноше-
нию к молоди длиной менее 13-14 мм. Установлено, что личинки и мальки рыб длиной 14-20 мм
выдерживали паразитарную нагрузку в количестве 1-4 метацеркарий A. muehlingi, в то время
как для рыб длиной 13-23 мм максимальная интенсивность инвазии P. cuticola не превышала
2 метацеркарий, что вероятно, соответствовало предельной паразитарной нагрузке. Помимо
двух указанных трематод и цестод сем. Ligulidae остальные паразитические организмы при
своих потенциальных возможностях не оказывали патогенного воздействия на развивающийся
организм молоди рыб на момент исследований.
Ключевые слова: молодь рыб, паразитофауна, дельта р. Волги, северная часть Каспийского
моря, летальные дозы, патогенность.
DOI: 10.1134/S003118471906005X
Рыбы являются наиболее уязвимыми в личиночный и мальковый периоды онтогенеза,
и, как правило, именно в это время они в большей степени подвержены патогенному
паразитарному воздействию. Выполняя роль естественного регулятора численности
хозяина (Контримавичус, 1982), паразиты могут значительно снижать эффективность
естественного воспроизводства рыб. Поэтому для прогнозирования эпизоотической
ситуации необходимо обладать полноценными данными о паразитологическом по-
483
тенциале отдельно взятых водоемов, в первую очередь, имеющих статус «водоемов
рыбохозяйственного значения», к которым, в том числе, относится и дельта р. Волги.
Изучению паразитофауны молоди дельты р. Волги посвящено большое количество
работ (Дубинин, 1952 а; 1952 б; Астахова, 1962, 1964, 1967; Ахмеров, Богданова, 1957;
Богданова, 1956; Владимиров, 1961; Курочкин, 1963; Каменский, Васильков, 1964; Би-
серова, 1990, 2001, 2005; Иванов, 1991, 2003; Иванов и др., 2012). Однако, в основном,
район отбора проб личинок и мальков в них был приурочен только к прибрежным
участкам русла р. Волги, акватории Астраханского биосферного заповедника и волж-
ским нерестово-вырастным хозяйствам. Наряду с этим, сведения о состоянии молоди
на естественных нерестилищах - полоях (где формируется численность основных
промысловых видов рыб) очень скудны и были получены более 50 лет назад. Поэто-
му вопрос изученности видового разнообразия паразитических организмов, а также
степени их влияния на младшие возрастные группы рыб непосредственно в полоях
(временно заливаемых водоемах, временных нерестилищах) дельты в настоящее время
полноценно не освещён. В связи с этим целью данной работы явилось всестороннее
изучение паразитов ранней молоди рыб в полойной системе дельты р. Волги и Волго-
Ахтубинской поймы, а также паразитов сеголетков воблы и леща при переходе этих
видов рыб на нагульные площади из реки в северную часть Каспийского моря.
МАТЕРИАЛ И МЕТОДИКА
Сбор и обработка паразитологического материала осуществлены по общепринятым методи-
кам (Лабораторный практикум по…, 1983; Быховская-Павловская, 1985; Методы санитарно-
паразитологической экспертизы..., 2001). Исследования по изучению паразитофауны молоди
полупроходных и речных рыб проводили в полоях дельты р. Волги в 2005-2018 гг. и Волго-
Ахтубинской поймы в 2005-2009 гг. Личинок и мальков отлавливали мальковой волокушей
в мае-июле. В дельте р. Волги обследовали две зоны - западную (у пос. Кировский, с. Икряное,
с. Зюзино, с. Трудфронт, с. Хмелевка, с. Евпраксино) и восточную (у с. Гандурино, с. Зеленга,
пос. Камардан, с. Забузан, с. Шагано-Кондаковка, с. Евпраксино, с. Нововасильево, с. Ямное (Во-
лодарского района). Сбор материала в Волго-Ахтубинской пойме проводили в районе с. Сеитовка,
с. Вольное, с. Досанг. В 2005-2006 гг. отловленную молодь рыб в охлажденном виде доставляли
в лабораторию ихтиопатологии Каспийского научно-исследовательского института рыбного
хозяйства (КаспНИРХ), где проводили её видовую идентификацию (совместно с сотрудниками
лаборатории воспроизводства рыб) и полный паразитологический анализ (за исключением кро-
вепаразитов). С 2007 г. проводили паразитологический анализ фиксированного 4 % -м раствором
формальдегида биологического материала.
Для уточнения особенностей формирования паразитофауны молоди рыб в период ската из
полоев в реку и далее до нагульных пастбищ в море с 2010 по 2018 гг. осуществляли непол-
ное вскрытие сеголетков воблы и леща, выловленных в северной части Каспийского моря во
время плановых экспедиционных работ, проводимых КаспНИРХ. У рыб методом компрессии
обследовали все внутренние органы, мышцы, жабры, глаза, плавники и кожные покровы. Район
исследования охватывал акваторию, ограниченную координатами от 44°10ʹ до 46°10ʹ СШ и от
47°10ʹ до 50°10ʹ ВД.
Суммарная выборка рыб за время исследований в полойной системе составила 19096 экз.
личинок и мальков рыб, в том числе 16871 экз. рыб в полоях дельты р. Волги (из них: воб-
484
ла Rutilus rutilus caspicus (Yakovlev, 1870) - 9373 экз., лещ Abramis brama (Linnaeus, 1758) -
3171 экз., красноперка Scardinius erythrophthalmus (Linnaeus, 1758) - 986 экз., густера Blicca
bjoerkna (Linnaeus, 1758) - 1364 экз., карась Carassius carassius (Linnaeus, 1758) - 437 экз., са-
зан Cyprinus carpio (Linnaeus, 1758) - 15 экз., окунь Perca fluviatilis (Linnaeus, 1758) - 628 экз.)
и 2225 экз. рыб в полоях Волго-Ахтубинской поймы (из них: вобла - 1028 экз., лещ -15 экз.,
красноперка - 346 экз., густера - 321 экз., карась - 418 экз., окунь - 97 экз.). Общая выборка
в северной части Каспийского моря составила 11033 экз. сеголетков рыб, из них 7082 экз.
воблы и 3951 экз. леща.
Идентификацию выявленных паразитов проводили с использованием стереомикроскопов
МБС-10, микроскопов «БИОМЕД-6 LED» и «Olympus», а также с помощью определителей и
соответствующих научных трудов (Определитель паразитов пресноводных…, 1962; Определитель
паразитов пресноводных …, 1987; Sandor et al., 2017; Kuchta, Scholz, 2007). Микрофотосъемка
осуществлена с помощью фотонасадки к микроскопу DCM 510 и фотоаппарата Sony Cyber-shot
DSC-W220.
Полученные результаты статистически обработаны при помощи стандартного пакета программ
Microsoft Excel 2016 (в указании среднего значения после знака «±» приведена стандартная
ошибка). Достоверность различий определена с помощью критерия Стьюдента (p < 0,05). Пара-
зитологические индексы приведены в соответствии с общепринятой методикой, экстенсивность
инвазии (ЭИ) соответствует “prevalence”, интенсивность инвазии (ИИ) - “intensity”, средняя
интенсивность инвазии (СИИ) - “mean intensity”, индекс обилия (ИО) - “abundance” (Bush
et al., 1997).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты проведенных в 2005-2018 гг. исследований показали, что паразитофауна
личинок и мальков промысловых рыб (воблы, леща, красноперки, густеры, карася,
сазана, окуня) во временно заливаемых водоемах (полоях) дельты р. Волги и Волго-
Ахтубинской поймы включала 20 видов паразитов, принадлежащих 7 классам: Mono-
genea, Cestoda, Trematoda, Nematoda, Hirudinea, Bivalvia, Crustacea (табл. 1).
Как видно из табл. 1, фауна паразитов рыб в полоях на начальных этапах развития
характеризовалась относительно небольшим видовым разнообразием, при этом 10 из
20 найденных видов являлись трематодами. Как правило, в обследованных рыбах
паразиты встречались либо эпизодически (H. triloba, P. ovatus, P. cuticola, Nematoda
gen. sp., Unio sp.), либо - однократно (B. acheilognathi, A. cornu, C. complanatum, Dip-
lostomum sp., T. clavata, P. parasquamosa, Contracaecum sp., P. geometra, A. foliacеus).
И только трематода A. muhlingi была ежегодно зарегистрирована у всех обследованных
карповых рыб, кроме карася и сазана. В целом максимальная интенсивность инвазии
рыб большинством выявленных паразитических организмов была единичной, за ис-
ключением P. parasquamosa и Nematoda gen. sp. (2 экз.), A. donicus и Contracaecum sp.
(3 экз.), Dactylogyrus sp. (13 экз.), A. muhlingi (57 экз.).
Следует отметить, что все полученные материалы об особенностях обнаруженных
паразитов (помимо определения их видовой принадлежности и показателей заражен-
ности) в тексте данной работы будут изложены с точки зрения оценки степени па-
тогенности паразита для своего хозяина (от высокой к низкой), для более точного
485
понимания которой необходимо прояснить некоторые моменты. Так, по мнению
ряда ученых (Беклемишев, 1945; Шульц, 1967; Шульц, Гвоздев, 1972; Лебедев, 1979;
Астафьев и др., 1989; Астафьев, 1991; Макаров, Тимофеев, 2006; Балашов, 2011;
Combes, 2001; Sonin, Rykovski, 2001; Hecker, Karbe, 2005; Simkova et al., 2008; Barber
et al., 2017) основным критерием паразитизма является вред (вредоносность), при-
чиняемый паразитом хозяину, а патогенность представляет собой видовой признак
организма, определяющий способность вида к паразитическому образу жизни. Однако
С.А. Беэр и В.А. Ройтман отмечали тот факт, что паразитизм в некоторых случаях может
выступать и как положительное природное явление (Беэр, 2004; Ройтман, Беэр, 2008).
В частности, они указали на то, что в начале совместной эволюции паразита и хо-
зяина, патогенность на популяционном уровне стимулирует ряд принципиально важ-
ных процессов и прежде всего - эволюцию механизмов иммунитета. В ходе взаи-
модействия патогенность становится препятствием в формировании равновесной
паразитарной системы, происходит отбор менее вирулентных форм паразита, направлен-
ный на взаимный адаптогенез паразита и хозяина. В результате паразит приспосабливается
к конкретной среде обитания (организм хозяина), а та, в свою очередь, приобретает
структурные и функциональные свойства, обеспечивающие защищенность от воздей-
ствия паразитарного фактора в дальнейшем. В целом патогенность паразита выступает
как результат снижения резистентности организма хозяина и связана с нарушением
его иммунной защиты, стрессом, недостатком питания. При сочетании высокой чис-
ленности паразитов с неблагоприятными условиями среды скрытое течение инвазии
переходит в эпидемию (эпизоотию), что, главным образом, характерно непосредственно
для молодых, эволюционно не адаптированных паразитарных систем.
Для дельты р. Волги ассоциация «Apophallus muhlingi - молодь карповых рыб» (на-
ряду с «Apophallus donicus - молодь окуневых рыб») является примером молодой пара-
зитарной системы. Массовая колонизация рыб A. muehlingi в дельте р. Волги началась
в 1980-х годах после проникновения в дельтовые водотоки первого промежуточно-
го хозяина гельминта моллюска Lithoglyphus naticoides (Pfeiffer, 1828) и оккупации
им всей дельты, когда экстенсивность инвазии рыб в отдельных районах составляла
100 %, а гибель молоди карповых от апофаллеза достигала 80 % (Бисерова, 1990; 2010).
Метацеркарии A. muehlingi и A. donicus стали доминировать в паразитофауне карповых
и окуневых рыб, чему способствовал комплекс природных факторов, таких как широкий
круг и высокая численность промежуточных и окончательных хозяев этих паразитов,
благоприятные климатические и географические условия.
Данная тенденция сохранилась и до настоящего времени. Так, в период исследований
среди всех зарегистрированных паразитов наиболее массовым продолжает оставаться
трематода A. muhlingi, инвазировавшая 7.70±2.02 % воблы (табл. 2), 5.44±2.43 % леща
(табл. 2), 1.89±1.22 % красноперки (ИИ - 1-5 экз., ИО - 0.03±0.01 экз.), 2.55±0.55 %
густеры (ИИ - 1-57 экз., ИО - 0.08±0.02 экз.). В свою очередь, у окуня также регулярно
отмечали ещё одного представителя сем. Heterophyidae - A. donicus (ЭИ - 1.45±1.01 %,
ИИ - 1-3 экз., ИО - 0.02±0.01 экз.). В связи с тем, что трематода A. muhlingi получила
486
Таблица 1. Паразитофауна молоди рыб в полоях дельты р. Волги
и Волго-Ахтубинской поймы в 2005-2018 гг.
Вид рыбы
Паразит
вобла
лещ
красноперка
густера
карась
сазан
окунь
Monogenea
Dactylogyrus sp.
+
+
+
+
+
+
-
Dactylogyrus vastator Nybelin,
+
-
-
-
-
-
-
1924
D. crucifer Wegener, 1857
+
-
-
-
-
-
-
D. wunderi Bychowsky, 1931
+
-
-
-
-
-
-
Cestoda
Bothriocephalus acheilognathi
-
+
-
-
-
-
-
Yamaguti, 1934
Trematoda
Apophallus donicus
-
-
-
-
-
-
+
(Skrjabin et Lindtrop, 1919)
A. muhlingi (Jagerskiold, 1899)
+
+
+
+
-
-
-
Apharyngostrigea cornu
-
-
-
+
-
-
-
(Zeder, 1800)
Clinostomum complanatum
-
-
-
-
-
-
+
(Rudolphi, 1814) Braun, 1899
Diplostomum sp.
-
-
-
-
-
-
+
Tylodelphys clavata (von
-
+
-
-
-
-
-
Nordmann, 1832) Diesing, 1850
Hysteromorpha triloba
-
+
-
+
-
-
-
(Rudolphi, 1819)
Paracoenogonimus ovatus
+
-
-
+
+
-
-
Katsurba, 1914
Parasymphylodora
+
-
-
+
+
-
-
parasquamosa Kulakova, 1972
Posthodiplostomum cuticola
(von Nordmann, 1832)
+
-
-
+
-
-
-
Dubois, 1936
Nematoda
Contracaecum sp.
-
-
-
-
+
-
-
Nematoda gen. sp.
+
-
-
-
-
-
-
Hirudinea
Piscicola geometra
-
-
+
-
-
-
-
(Linnaeus, 1761)
Bivalvia
Unio sp.
+
-
+
-
-
-
-
Crustacea
Argulus foliacеus
-
+
-
-
-
-
-
(Linnaeus, 1758)
487
широкое распространение у молоди рыб волжской дельты, и по ней накоплен большой
объем материала, позволивший осуществить полноценный анализ и выявить некоторые
закономерности в многолетнем аспекте, то описание данного вида будет приведено
чуть более подробно.
Максимальные показатели зараженности рыб A. muehlingi были зарегистрированы
в 2013 г. (табл. 2), что, в первую очередь, было обусловлено режимом половодья вес-
ной указанного года, а именно ранним заполнением нерестилищ водой (уже в первой
декаде апреля при температуре воды 5.1-5.5 °С, то есть до наступления нерестовой
(8.0 °С) температуры воды), полным и продолжительным обводнением всего нересто-
вого фонда, что в целом соответствовало условиям естественной водности реки. Высо-
кая волна половодья увеличила вероятность заноса церкарий A. muehlingi из русловой
зоны реки, где обитает его первый промежуточный хозяин (моллюск L. naticoides),
в полойную зону, что в свою очередь, создало предпосылки для более тесного контакта
молоди рыб с церкариями.
Таблица 2. Показатели зараженности молоди воблы и леща в полоях дельты р. Волги
и Волго-Ахтубинской поймы трематодами Apophallus muhlingi в 2005-2018 гг.
Вид рыбы
Год
вобла
лещ
ЭИ, %
ИИ, экз.
ИО, экз.
ЭИ, %
ИИ, экз.
ИО, экз.
2005
12.10
1-5
0.29
2.25
1-3
0.02
2006
0.20
1
0.01
0.00
0
0.00
2007
10.76
1-14
0.22
-*
-
-
2008
1.08
1-3
0.01
-
-
-
2009
0.63
1
0.01
-
-
-
2010
6.79
1-8
0.12
0.00
0
0.00
2011
0.69
1-3
0.01
0.24
1
0.01
2012
13.89
1-7
0.21
18.25
1-4
0.20
2013
27.19
1-54
0.89
23.78
1-12
0.68
2014
5.57
1-21
0.16
2.74
1-12
0.07
2015
13.44
1-21
0.18
6.86
1-18
0.12
2016
1.62
1-2
0.04
0.59
2
0.05
2017
3.72
1-14
0.11
3.78
1-8
0.12
2018
10.08
1-10
0.20
1.32
1-3
0.10
2005-2018
7.70±2.02
1-54
0.18±0.06
5.44±2.43
1-18
0.12±0.06
* Исследования не проводили.
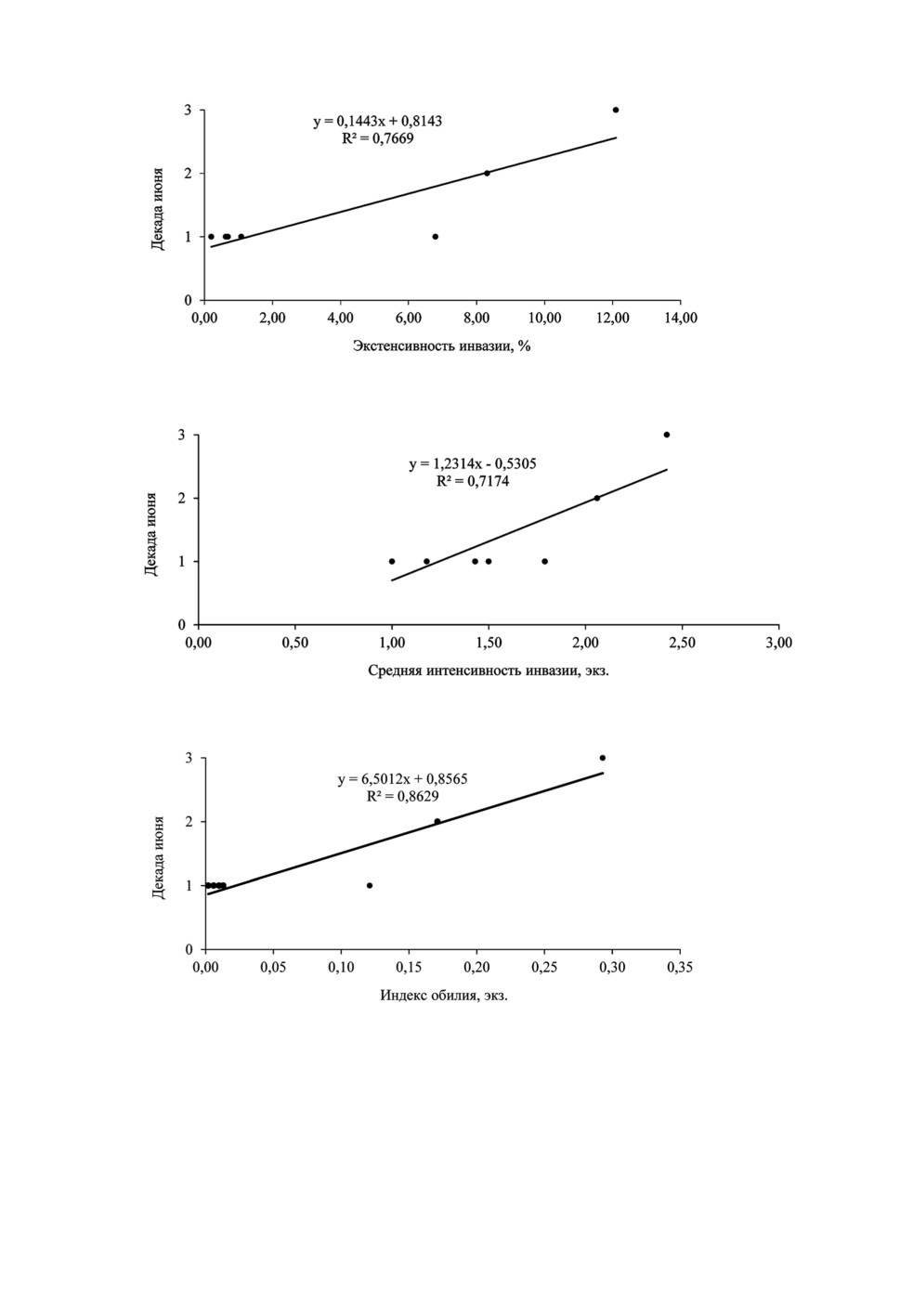
При анализе многолетних данных установлено, что уровень зараженности рыб
A. muehlingi находится в тесной связи с продолжительностью ее нахождения в по-
лоях (рис. 1). Так, например, молодь воблы, отобранная для анализа в конце июня,
была в большей степени инвазирована, чем в начале месяца. В свою очередь, степень
инвазированности рыб метацеркариями A. muehlingi тесно коррелирует со степенью
488
1а
1б
1в
Рис. 1. Зависимость зараженности (экстенсивность инвазии, средняя интенсивности инвазии,
индекс обилия) молоди воблы Apophallus muhlingi от длительности ее пребывания в полоях
дельты р. Волги в 2005-2011 гг.: а - экстенсивность инвазии; б - средняя интенсивности инва-
зии; в - индекс обилия.
489
зараженности его партенитами первого промежуточного хозяина - L. naticoides (Би-
серова, 2005). Вследствие этого, частота встречаемости рыб, пораженных A. muhlingi,
в разных полоях варьирует в широких пределах. Так, в 2012 г. экстенсивность инвазии
воблы колебалась от 0.00 до 29.00 %, леща - от 0.00 до 35.06 %, что было обусловлено,
в первую очередь, численностью моллюска L. naticoides, плотность и интенсивность
заражения которого в разных зонах значительно различалась (Бисерова, 2012).
При сопоставлении результатов обследования молоди из полоев дельты р. Волги
и Волго-Ахтубинской поймы было установлено, что показатели зараженности рыб,
в частности, воблы, были выше в районе поймы (табл. 3), однако различия эти были
недостоверны. Уровень зараженности молоди трематодой A. muehlingi в водоемах за-
падной и восточной части дельты значительно варьировал по годам (табл. 4), при этом
закономерности в распространении паразита в полойной системе по зонам также не
выявлены. В целом это свидетельствовало о том, что в обследованном регионе в за-
висимости от условий конкретного года (гидрологического режима, численности, осо-
бенностей распределения и степени инвазированности промежуточных (моллюсков) и
окончательных (теплокровных животных) хозяев), очаг апофаллеза функционировал
хаотично.
Представляют интерес и выявленные нами различия в локализации A. muehlingi
у разновозрастных особей. Если у взрослых рыб этот гельминт поражает, в основном,
кожные покровы и плавники, то у обследованной молоди - мышечную ткань, что обу-
словлено отсутствием чешуйного покрова у личинок рыб и слабым чешуйным покровом
у мальков, а, следовательно, его легкой проницаемостью для церкарий трематод. Так,
в период наблюдений у 70.01±2.30 % молоди воблы и 79.40±3.05 % леща метацеркарии
гетерофиид локализовались в мышцах спины, хвостового стебля, в непосредствен-
ной близости от позвоночного столба, единично в межреберных мышцах; 14.20±1.20
и 11.80±1.00 % - в лучах плавников, большей частью внутренных (птеригофоры),
остальные 15.80±1.83 и 8.80±0.50 % - в головном отделе рыб (рис. 2). У сеголетков
воблы в мышцах встречалось только 12.50±2.33 %, леща - 50.01±5.65 % метацеркарий
A. muehlingi. Относительно других видов трематод цисты A. muehlingi имели небольшой
размер, диаметр которых в течение всего периода исследований варьировал в пределах
от 100.0 до 439.7 мкм, в среднем составил 268.6±13.5 мкм.
Как было указано выше трематода A. muehlingi в разные годы вызывала в дельте
р. Волги гибель молоди рыб, и целым рядом работ (Иванов, 1991; Иванов, Семенова,
2000; Бисерова, 1997, 2005) было показано, что при высокой интенсивности инвазии
A. muehlingi патогенен для молоди рыб, а пределы толерантности хозяина к возбудителю
зависят от размерно-весовых параметров самого хозяина. Так, для ранних личинок рыб
длиной 6-8 мм и 9-11 мм летальная доза составляет соответственно 35 и 50 церкарий
на одну рыбу, для поздних личинок длиной 12-14 мм - 120 церкарий, для ранних
мальков при длине 15-17 мм - 500 церкарий (Иванов, 1991). В период ската летальная
интенсивность инвазии метацеркарий A. muehlingi для молоди воблы длиной 20 мм
соответствует 1300-1400, для молоди густеры длиной 19 мм - 1700-1800 экз. на 1 г
массы рыбы (Бисерова, 2005). Летальные дозы церкарий R. donicum для речного окуня
длиной 8-9 и 10-13 мм определены в 50 и 200 экз., соответственно (Иванов, 1991).
490
Таблица 3. Зараженность молоди воблы трематодой Apophallus muhlingi
в полоях дельты р. Волги и Волго-Ахтубинской поймы в 2005-2009 гг.
Год
Район
2005
2006
2007
2008
2009
исследования
ЭИ,
ИО,
ЭИ,
ИО,
ЭИ,
ИО,
ЭИ,
ИО,
ЭИ,
ИО,
%
экз.
%
экз.
%
экз.
%
экз.
%
экз.
Дельта р. Волги
3.33
0.07
0,00
0.00
5.32
0.09
0.85
0.01
0.50
0.01
Волго-Ахтуба
14.17
0.35
0.52
0.01
9.62
0.21
1.60
0.02
1.82
0.02
Таблица 4. Экстенсивность инвазии молоди воблы метацеркариями Apophallus muhlingi
в полоях западной и восточной частей дельты р. Волги в 2011-2018 гг., %
Год
Район исследования
2011
2012
2013
2014
2015
2016
2017
2018
пос. Кировский
3.08
11.00
24.00
-*
-
1.33
1.76
1.59
с. Икряное
1.00
17.00
-
-
0.00
-
-
0.00
с. Зюзино
-
25.32
-
-
-
-
-
-
с. Трудфронт
0.00
7.00
11.80
-
-
0.00
0.00
1.00
с. Хмелевка
0.00
6.45
-
-
-
-
-
-
с. Нижнее-Лебяжье
0.00
-
-
-
-
1.88
0.72
3.14
с. Гандурино
-
0.00
28.00
-
-
-
50.00
2.08
с. Зеленга
-
29.00
80.00
8.00
3.70
22.00
23.21
22.41
пос. Камардан
-
19.00
-
-
27.27
4.35
1.96
-
с. Забузан
0.00
10.00
7.00
0.00
22.50
1.54
0.00
0.00
с. Шагано-Кондаковка
-
8.33
-
0.00
-
-
-
-
с. Ямное
-
2.00
0.00
-
10.96
1.39
2.56
0.00
с. Нововасильево
1.00
-
-
3.00
10.00
-
-
3.57
* Исследования не проводили.
Представленные показатели были определены для молоди рыб в прибрежных участ-
ках русла р. Волги и не относились к полойной системе дельты. Поэтому для анализа
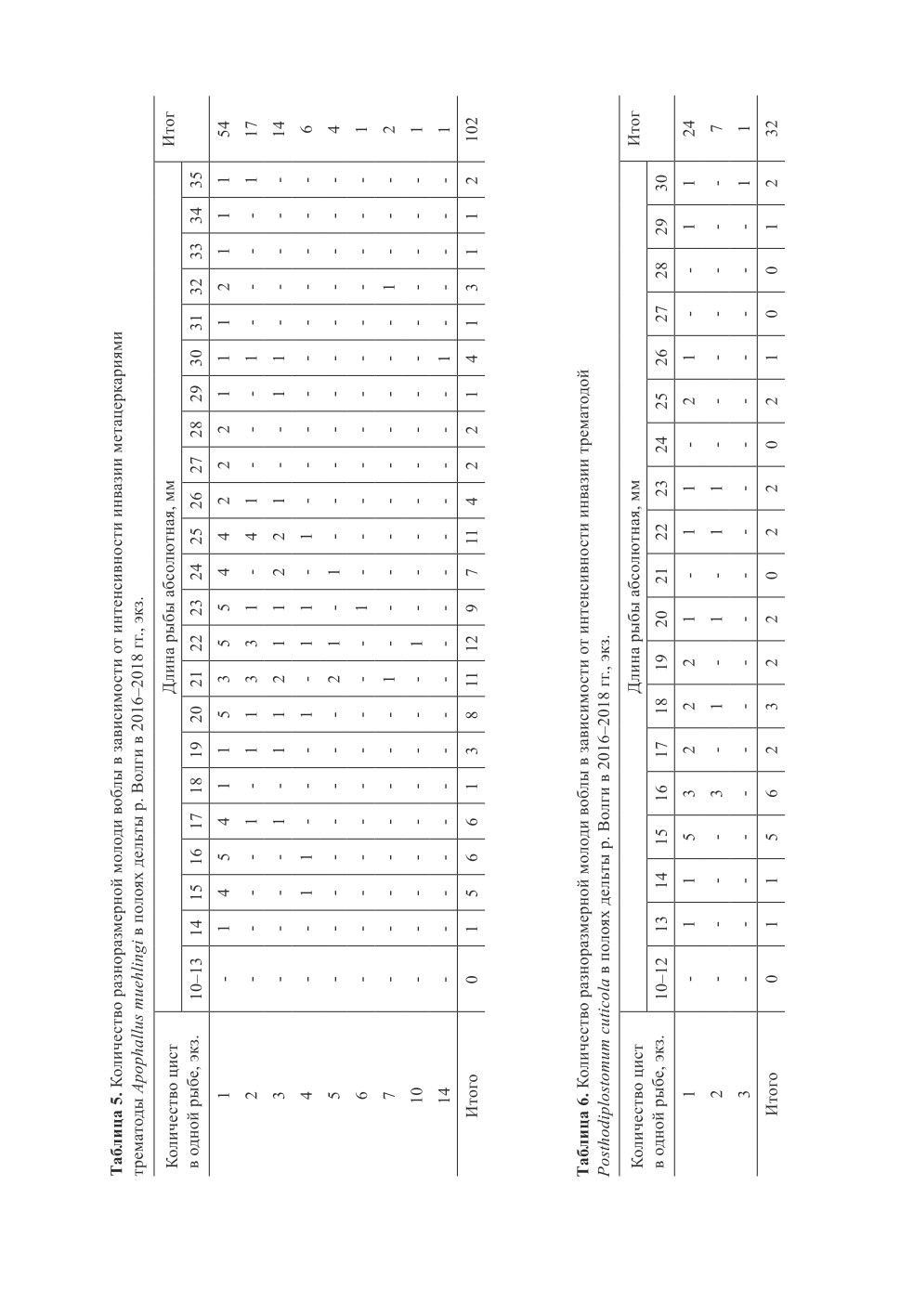
воздействия A. muehlingi на разноразмерную молодь воблы, полученные нами сведения
из полоев были систематизированы и распределены в зависимости от длины молоди
и количества метацеркарий паразита в инвазированной рыбе (табл. 5). Выявлено, что
молодь длиной менее 14 мм была свободна от инвазии A. muehlingi. Предполагаем, что
такие мелкие особи, погибают даже от воздействия одного гельминта. С наибольшей
частотой рыбы были инвазированы только одной метацеркарией, при этом, вариаци-
онный ряд длины молоди был наиболее широким (от 14 до 35 мм). С увеличением
численности гельминта в хозяине происходило как снижение количества зараженных
491
особей отдельных размерных групп молоди, так и сужение вариационного ряда дли-
ны вплоть до одной размерной группы (причем купного размера 30 мм) у высоко
инвазированных особей. Из этого следует, что паразитарную нагрузку в количестве
1-4 экз. выдерживает как крупная, так и достаточно мелкая молодь, в то время как
при увеличении количества паразитов в рыбе заражение мелких особей хозяина менее
21 мм не отмечали. По нашему мнению, это свидетельствует о том, что мелкие особи
с интенсивностью инвазии 5 и более метацеркарий, скорее всего, погибали. Таким
образом, результаты собственных наблюдений свидетельствовали о том, что в полоях
дельты р. Волги для ранней молоди рыб (аналогичной размерной группы) патогенность
метацеркарий A. muehlingi по сравнению с церкариями выше.
На патогенность метацеркарий A. muehlingi для молоди рыб даже в небольших ко-
личествах указывает и то обстоятельство, что помимо механического воздействия (на
месте внедрения цисты паразита (рис. 2) - на коже и в мускулатуре - возникают гемато-
мы, которые способствуют снижению двигательной активности рыб ввиду повреждения
мышц (Мошу, 2014)), гельминт также оказывает и токсическое воздействие. При этом
подобные изменения у рыб вызывает и трематода P. cuticola (только с более высо-
кой степенью тяжести проявления). Так, вокруг капсулы с метацеркариями P. cuticola
в мышцах рыб образовывалась значительная по площади зона пигментации черного
цвета - очаговый меланоз (рис. 3), что влекло за собой деформацию тела, искривление
позвоночника, снижение эластичности тканей тела, атрофию мышечной ткани. Помимо
этого, присутствие данного паразита могло привести к истощению и анемии (Мошу,
2014). По нашим наблюдениям паразит локализовался в основном в мышечной ткани,
реже - на плавниках (рис. 3 а).
В отличие от A. muehlingi первый промежуточный хозяин P. cuticola (моллюск
Planorbis planorbis (Linnaeus, 1758)) обитает в стоячей воде, там же где и проводит
первые дни жизни появившаяся молодь, что должно увеличивать шансы заражения
молоди. Однако по нашим многолетним данным в период 2005-2018 гг. зараженность
была низкая и регулярно отмечена только у воблы (ЭИ - 0.89±0.35 %, ИИ - 1-2 экз.,
ИО - 0.02±0.01 экз.), у густеры на протяжение трех лет (в 2006 г.: ЭИ - 3.40 %, ИИ -
1 экз., ИО - 0.03 экз.; в 2013 г.: ЭИ - 0.63 %, ИИ - 1 экз., ИО - 0.01 экз.; в 2014 г.:
ЭИ - 0.61 %, ИИ - 1 экз., ИО - 0.01 экз.), у леща - однократно (в 2018 г.: ЭИ - 0.23 %,
ИИ - 1 экз., ИО - 0.01 экз.), что обусловлено высокой патогенностью метацеркарий
P. cuticola для ранней молоди рыб. Так, по данным Бисеровой (2005) патогенность
одной метацеркарии P. cuticola в 100 раз превышает патогенность метацеркарии A. mue-
hlingi ввиду более крупных размеров личинок P. cuticola (даже один экземпляр паразита
является летальной дозой для наиболее мелкой молоди рыб). Также, как и в случае
с A. muehlingi с целью понимания летальных концентраций паразита для молоди рыб
в полоях, полученные нами данные были разбиты по категориям и занесены в таблицу
(табл. 6). При анализе было установлено, что зараженная P. cuticola молодь длиной
менее 13 мм в пробах не была отмечена, а большая часть обследованных особей была
инвазирована только одним паразитом. При увеличении интенсивности заражения до
двух-трех гельминтов количество инвазированных личинок и мальков резко сокраща-
492
2а
2б
Рис. 2. Метацеркарии Apophallus muhlingi в мышечной ткани и лучах хвостового плавника мо-
лоди воблы в полоях дельты р. Волги: а - внешний вид инвазированной рыбы; б - компресси-
рованный препарат рыбы (ув. 8.4 раз); стрелками указаны цисты паразита, покрытые черным
пигментом. Масштаб 5 мм.
493
3а
3б
Рис. 3. Метацеркарии трематоды Posthodiplostomum cuticola у молоди воблы в полоях дельты
р. Волги: а - внешний вид инвазированной рыбы; б - паразит в мышечной ткани хвостового
стебля; стрелками указаны цисты паразита, покрытые черным пигментом. Масштаб 5 мм.
494
лось, причем максимальная интенсивность инвазии (3 экз.) зарегистрирована только
у одной рыбы наибольшей длины (30 мм). Вероятно, что для рыб длиной менее 23 мм
интенсивность заражения P. cuticola в количестве двух метацеркарий, скорее всего,
соответствовала их предельной паразитарной нагрузке. В целом установлено, что
с ростом рыбы патогенность P. cuticola снижалась.
Помимо A. muehlingi и P. cuticola в паразитофауне обследованных в полоях рыб
также присутствовали эпизоотически значимые паразиты: моногенеи Dactylogyrus sp.,
цестоды B. acheilognathi, трематоды Diplostomum sp., H. triloba, пиявки P. geometra,
глохидии Unio sp., рачки A. foliacеus (табл. 1). Необходимо подчеркнуть, что у молоди
рыб перечисленные виды встречались однократно либо эпизодически и (за исключе-
нием Dactylogyrus sp.) при единичной интенсивности инвазии. Данное обстоятельство,
наряду с особенностями характера локализации, позволяет судить о том, что указанные
паразитические виды при своих потенциальных возможностях не проявляли патогенных
свойств в организме рыб на момент исследования.
Моногенеи были широко представлены у молоди во всех полоях. В период 2015-
2018 гг. представителей рода Dactylogyrus регулярно регистрировали у воблы (ЭИ -
3.84±1.55 %, ИИ -1-8 экз.) и леща (ЭИ - 23.66±8.55 %, ИИ - 1-13экз.). При этом у леща
была отмечена максимальная экстенсивность инвазии (43.48 % в 2018 г.). Единично
данные паразиты были выявлены в 2018 г. у красноперки (ЭИ - 4.20 %, ИИ - 1-2 экз.),
сазана (ЭИ - 6.67 %, ИИ - 1 экз.) и карася (ЭИ - 6.00 %, ИИ - 1-3 экз.). У большин-
ства обследованных рыб идентификация моногеней была возможна только до рода,
однако у личинок воблы в Яменском полое в 2017 г. моногенеи были определены до
вида - D. crucifer (ЭИ - 1.00 %, ИИ - 1 экз.), D. wunderi (ЭИ - 1.00 %, ИИ - 3 экз.) и
D. vastator (ЭИ - 1.00 %, ИИ - 1 экз.). При этом, последний вид имеет эпизоотическое
значение ввиду того, что является возбудителем дактилогироза А (Астахова, 1967).
В целом численность моногеней у молоди карповых рыб в полоях в период наблюдений
была небольшая и не превышала 13 экз. на одну зараженную рыбу.
Необходимо отметить, что среди всех паразитов именно моногенеи в организме
молоди рыб в полоях появлялись первыми. Так, первые личиночные формы их от-
мечены у воблы (с. Ямное, полой, 2016 г.) при абсолютной длине (TL) 19 мм, у леща
(с. Лебяжье, прибрежье, 2016 г.) - при длине 20 мм. Первых половозрелых диктило-
гирусов регистрировали у воблы (с. Ямное, полой, 2016 г.) при длине 15 мм, у леща
(с. Трудфронт, прибрежье, 2016 г.) - при длине 14 мм. Если рассматривать данные по
моногенеям молоди в самом полое и в его прибрежной части, то в целом в прибреж-
ной части водотоков в 1.45 раз чаще отмечали рыб, инвазированных р. Dactylogyrus,
у которых в 1.70 раза было больше указанных паразитов. Это свидетельствует о том,
что при выносе из полоев личинки и мальки рыб, уже инвазированные дактилогиру-
сами, дополнительно подвергались заражению в реке.
В период исследований однократно была отмечена цестода B. acheilognathi - паразит-
вселенец, завезенный на территорию бывшего СССР вместе с акклиматизированными
растительноядными рыбами (Щербань и др., 1963; Мариц, 1965; Мусселиус, 1973).
496
По нашим данным данная цестода была выявлена только в 2005 г. у 0.90 % мальков
леща (ИИ - 1 экз., ИО - 0.01 экз.) в полое у с. Евпраксино.
Трематоды р. Diplostomum отмечены в стекловидном теле глаз в 2007 г. у 4.00 % окуня
(ИИ - 1 экз., ИО - 0.04 экз.) и в 2015 г. у 7.40 % лещей (ИИ - 1 экз., ИО - 0.07 экз.),
обитавших в Грушевском полое (с. Икряное). Единичное паразитирование личинок
указанного вида у молоди не сопровождалось такими симптомами как помутнени-
ем, воспалением оболочек глаза, или в целом снижением темпа роста, упитанности,
которые обычно сопровождают рыб, инвазированных большим количеством указан-
ных паразитов (Комарова, 1978; Шигин, 1986). Из трематод также следует отметить
H. triloba, негативное воздействие которой обусловлено прежде всего ее крупными
размерами (что является причиной расслоения и нарушения целостности мышечной
ткани). Инцистированная личинка была отмечена в мышечной ткани у 3.00 % густеры
(ИО - 0.03 экз.) в 2005 и 2006 гг. в районе с. Досанг.
Пиявка P. geometra выявлена только в 2005 г. на кожных покровах у 1.00 % красно-
перки (ИИ - 1 экз., ИО - 0.01 экз.) из Грушевского полоя (с. Икряное). Питаясь кровью,
данный паразит может явится причиной анемии, повреждения кожных покровов, соз-
давая условия для возникновения бактериальных поражений и микозов (что возможно
только при их высокой численности). Личинки моллюсков (глохидий р. Unio) единично
отмечены в 2017 г. на жабрах воблы (ЭИ - 1.01-1.96 %) и красноперки (ЭИ - 6.25 %),
в 2018 г. у воблы в Кировском (ЭИ - 2.00 %) и Нововасильевском (ЭИ - 3.57 %) полоях.
Паразитический рачок A. foliacеus зарегистрирован только в 2005 г. исключительно на
кожных покровах у 0.90 % леща (ИИ - 1 экз., ИО - 0.01 экз.) у с. Евпраксино.
Кроме группы эпизоотически значимых организмов в паразитофауне молоди также
присутствовали такие паразиты как трематоды A. cornu, локализовавшиеся в мышечной
ткани 1.00 % густеры (ИИ - 1 экз., ИО - 0.01 экз., пос. Володарский), и C. complanatum,
поражавшие мышечный слой 2.40 % и 1.10 % окуня (с. Досанг, с. Икряное, ИО - 0.02
и 0.01 соответственно) в 2005 г. Метацеркарии P. ovatus найдены в мышцах 1.00 %
густеры у с. Досанг и 1.00 % воблы у с. Сеитовка (ИИ - 1 экз., ИО - 0.01 экз. в обоих
случаях) в 2005 г. и 0.89 % карася (ИИ - 1 экз., ИО - 0.01 экз.) у с. Сеитовка
в 2006 г. Дигенетического сосальщика P. parasquamosa отмечали у 8.00 % воблы (ИИ -
1 экз., ИО - 0.10 экз.) в районе с. Тулугановка в 2009 г. Помимо этого также была вы-
явлена нематода Contracaecum sp. у карася в 2006 г. у с. Евпраксино (ЭИ - 24.00 %,
ИИ - 1-2 экз., ИО - 0.32 экз.), с. Досанг (ЭИ - 2.17 %, ИИ - 1 экз., ИО - 0.02 экз.)
и с. Икряное в Грушевском полое (ЭИ - 2.90 %, ИИ - 1 экз., ИО - 0.03 экз.). У во-
блы единично отмечена Nematoda gen. sp. в 2006 г. (ЭИ - 0.01 %, ИИ - 1 экз., ИО -
0.01 экз.) и в 2012 г. (ЭИ - 0.11 %, ИИ - 1 экз., ИО - 0.01 экз.) у с. Ямное. Единичное
присутствие указанных выше паразитов в организме обследованных рыб клинически
выраженного ответа не вызвало.
Следует отметить, что паразитофауна рыб Волго-Каспийского региона формируется
не только в полойной системе, но и в русловой части реки, которую полупроходные
виды (такие как вобла, лещ) проходят транзитом в период миграции (ската) в морскую
497
зону. Для выявления особенностей изменения качественного и количественного соста-
вов фауны паразитов помимо изучения молоди непосредственно в полоях, были также
обследованы сеголетки указанных видов рыб, скатившиеся из реки в море.
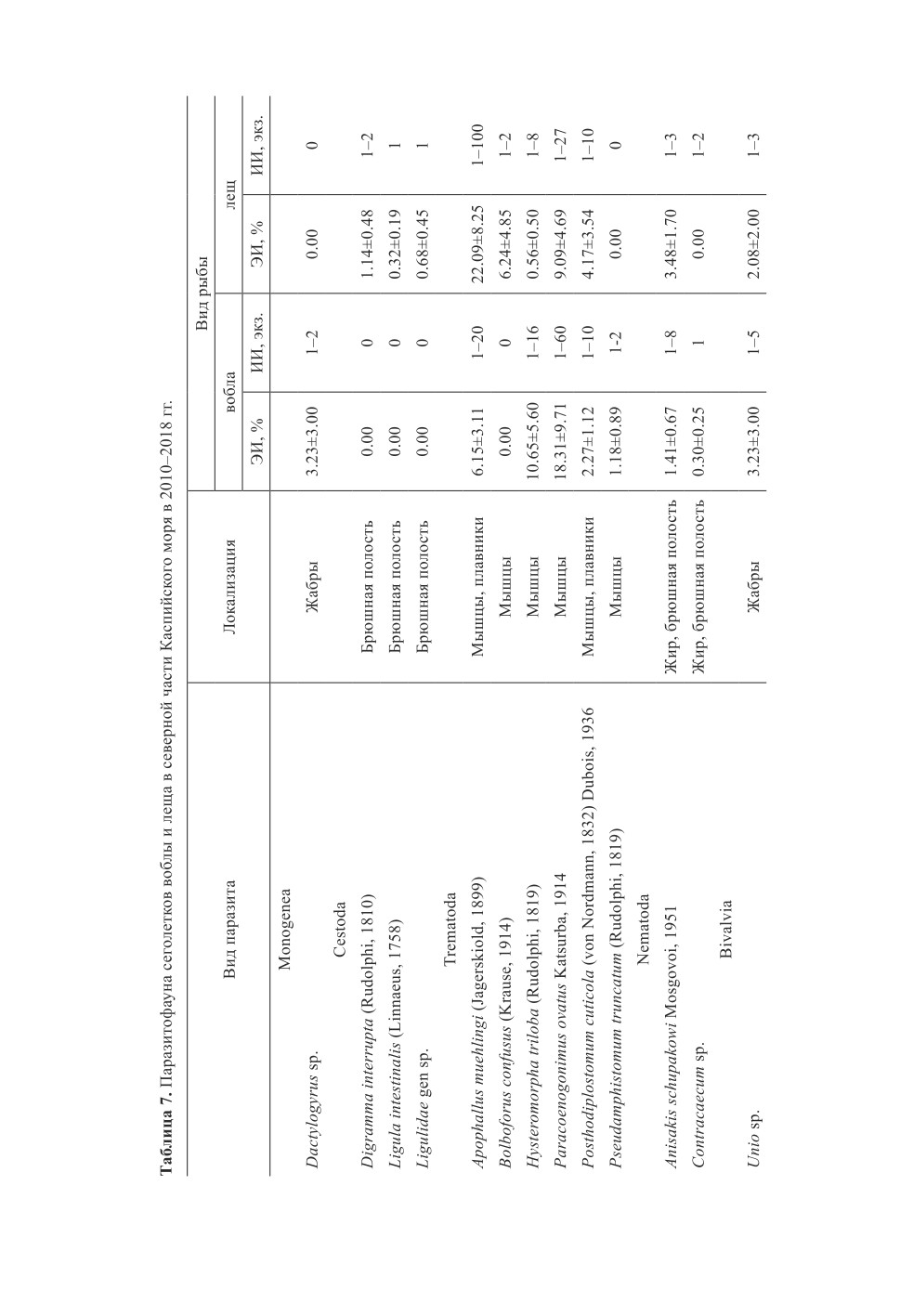
В результате проведенных исследований установлено, что спектр паразитов сеголет-
ков воблы и леща в морской части несколько видоизменялся по отношению к рыбам,
находившихся на личиночных и мальковых стадиях развития в дельте р. Волги, хотя его
основу по-прежнему формировали пресноводные трематоды (табл. 7). Паразитофауна
рыб пополнялась морскими нематодами A. schupakovi и эвригалинными цестодами
сем. Ligulidae (D. interrupta и L. intestinalis). В свою очередь, исчезало большинство
пресноводных моногеней р. Dactylogyrus, так как повышение солености воды по мере
ската рыбы из реки в море действовало на данную группу организмов угнетающе
(Астахова, 1967).
Частота встречаемости воблы и леща, пораженных выявленными гельминтами, а так-
же индексы обилия у сеголетков по сравнению с рыбами, находящихся на личиночных
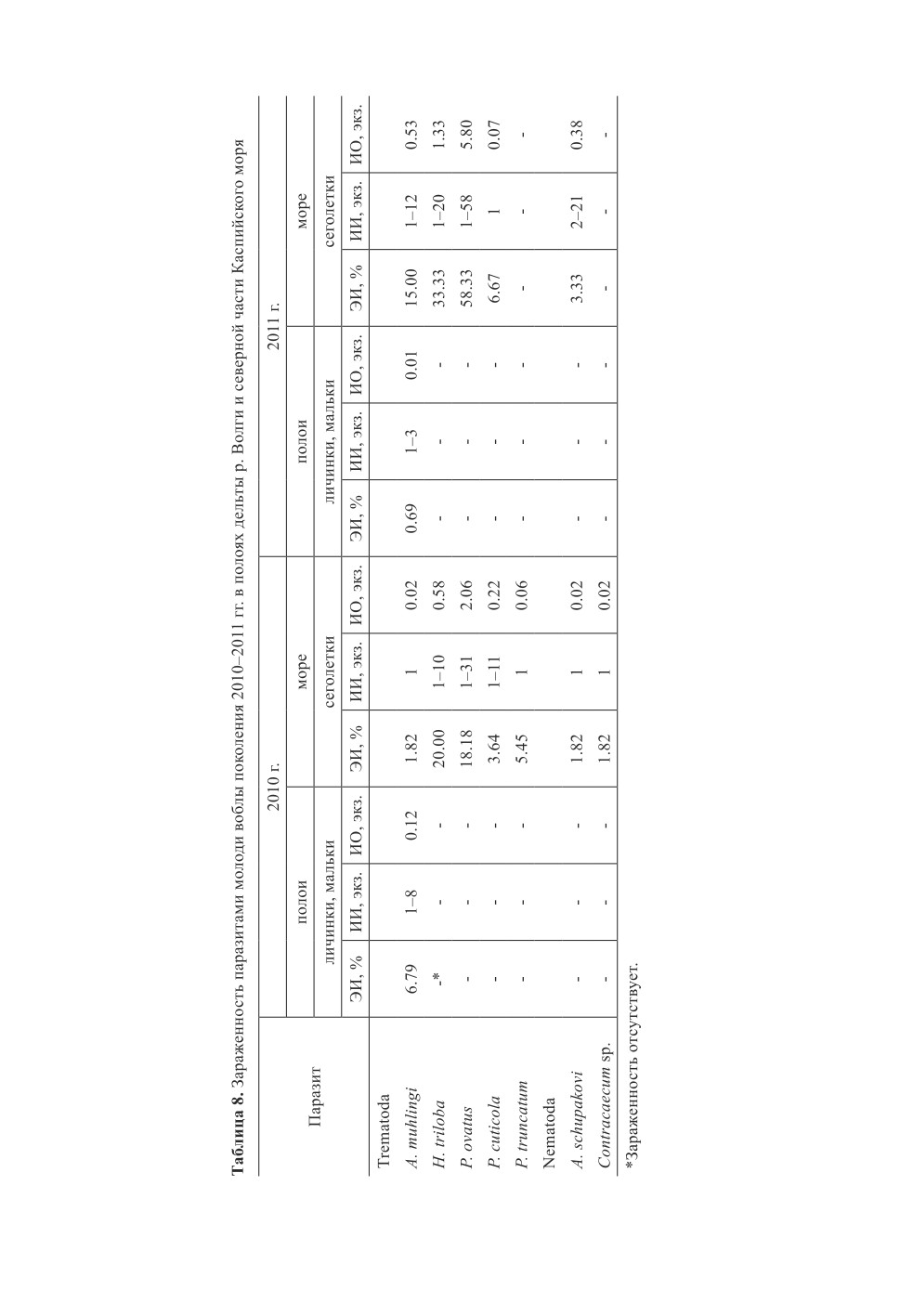
и мальковых стадиях, как правило, возрастали (табл. 8). Исключение составил 2010 г.,
когда у воблы в море было зарегистрировано снижение уровня заражения трематодами
A. muhlingi (табл. 8). Можно предположить, что, получив дополнительную дозу ме-
тацеркарий данного гельминта после выхода рыб из полоев, высоко инвазированная
часть молоди погибла. Помимо A. muhlingi, значительную часть рыб в море поражал
еще один представитель трематод - P. ovatus (табл. 8). В то время как у мальков в по-
лоях его регистрировали эпизодически и уровень инвазии не превышал 1.00 % рыб,
у сеголетков данный вид отмечали регулярно, и экстенсивность заражения им рыб
возрастала более, чем в 18 раз. Рост инвазированности рыб другими видами дигене-
тических сосальщиков в морской зоне также доказывал тот факт, что именно в период
ската организм молоди рыб подвергался внедрению трематод, жизненный цикл которых
приурочен к речной системе.
Наиболее патогенными паразитами для молоди рыб при переходе из реки в море явля-
лись трематода A. muhlingi, а также ремнецы D. interrupta и L. intestinalis, которые могли
инициировать гибель рыб первого года жизни. Доказательством этому может служить
2010 г., когда, по нашему мнению, высоко инвазированная A. muhlingi молодь погибала
(о чем было описано выше), а также тот факт, что у сеголетков леща, отловленных
в северной части Каспийского моря, при клиническом осмотре были зафиксированы
разрывы стенок брюшной полости предельно заполнившим пространство цестодами
сем. Ligulidae, что означало гибель инвазированных рыб.
498
ЗАКЛЮЧЕНИЕ
Таким образом, подводя итог исследованиям, проведенным в речной и в морской
зонах, следует отметить, что паразитофауна молоди рыб в полоях дельты р. Волги и
Волго-Ахтубинской поймы, а также северной части Каспийского моря характеризова-
лась относительно небольшим видовым разнообразием и низкой численностью своих
представителей. По сравнению с другими паразитическими формами трематоды пре-
обладали у молоди рыб как в реке, так и море. Наиболее массовым паразитом личинок
и мальков в полоях являлась трематода A. muhlingi, уровень зараженности рыб которой
значительно варьировал как по районам исследований, так и в межгодовом аспекте.
Степень зараженности гельминтами молоди воблы и леща увеличивалась от личиноч-
ных и мальковых стадий развития (в полоях дельты р. Волги) до сеголеток (в север-
ной части Каспия). Результаты проведенных исследований позволили установить, что
с ростом рыбы в полоях патогенность метацеркарий A. muehlingi и P. cuticola снижалась.
Помимо двух указанных трематод и цестод D. interrupta и L. intestinalis, остальные
паразиты при своих потенциальных возможностях не проявляли патогенных свойств.
ВЫВОДЫ
1. Паразитофауна ранней молоди семи видов рыб (воблы, леща, красноперки, густе-
ры, карася, сазана, окуня) во временно заливаемых водоемах (полоях) дельты р. Волги и
Волго-Ахтубинской поймы в период 2005-2018 гг. объединяла 20 видов паразитических
организмов, относящихся к семи классам. Экстенсивность инвазии рыб паразитами
колебалась в широких пределах, численность паразитов у рыб была низкой.
2. Первыми в организме молоди рыб в полоях появлялись моногенеи р. Dactylogyrus
у воблы при абсолютной длине 15 мм, у леща - 14 мм.
3. Наиболее массовым паразитом молоди рыб в полоях была трематода A. muhlingi,
зараженность которой значительно варьировала как по районам исследований, так и
в межгодовом аспекте. Максимальный уровень инвазированности младших возраст-
ных групп воблы (27.19 %) и леща (23.78 %) апофаллюсом в полоях зарегистрирован
в 2013 г., чему способствовали благоприятные гидрологические условия того года
в весенний период.
4. Несмотря на относительно невысокую интенсивность инвазии молоди рыб тре-
матодами сем. Heterophyidae (A. muhlingi и А. donicum) в полоях, частота встречаемо-
сти пораженных особей в отдельных водоемах достигала значительных величин: до
80.00 % воблы, 71.43 % леща, 30.69 % густеры, 13.33 % красноперки, 17.07 % окуня,
что свидетельствовало о высоком эпизоотическом потенциале этих гельминтов.
5. Достоверных различий в показателях инвазированности молоди метацеркариями
A. muhlingi в полоях Волго-Ахтубинской поймы, а также западной и восточной частях
дельты р. Волги не выявлено.
6. Уровень зараженности воблы метацеркариями A. muhlingi находился в тесной связи
с продолжительностью ее пребывания в полоях: чем дольше молодь рыб находилась
501
в полоях, тем более интенсивнее она подвергалась заражению трематодами. Зависи-
мость носила прямой линейный характер.
7. Выявлены особенности локализации A. muhlingi у молоди рыб по сравнению
со взрослыми особями. У личинок и ранних мальков большая часть паразитов была
приурочена к глубоким слоям мышечной ткани в непосредственной близости от по-
звоночника, у сеголеток метацеркарии находились, в основном, в лучах плавников и
гораздо реже - в мышечной ткани и на кожных покровах, в то время как у взрослых рыб
эти трематоды поражают, в основном, кожные покровы и плавники, что обусловлено
развитием чешуйного покрова (выполняющий барьерную функцию) по мере роста рыб.
8. Патогенность A. muehlingi и P. cuticola для мелкой молоди в полоях выше, чем
для более крупной, на что указывает отсутствие инвазированности метацеркариями
этих трематод у рыб длиной менее 13-14 мм. Наиболее часто регистрировали единич-
ную интенсивность инвазии личинок и мальков обоими видами трематод, при этом,
вариационный ряд длины молоди был наиболее широким. При нарастании интенсив-
ности поражения отмечали как снижение количества зараженных особей отдельных
размерных групп молоди, так и сужение вариационного ряда длины вплоть до одной
размерной группы причем купного размера. Установлено, что особи рыб длиной 14-20
мм выдерживала паразитарный пресс в количестве 1-4 метацеркарий A. muehlingi, при
том что 5 и более паразитов, скорее всего, вызывало ее гибель. Патогенность P. cuticola
была выше - для рыб длиной 13-23 мм максимальная интенсивность инвазии не пре-
вышала 2 экз., что скорее всего, соответствовало предельной паразитарной нагрузке
для рыб, находящихся на личиночных и мальковых стадиях онтогенеза.
9. Паразитофауна молоди воблы и леща в северной части Каспийского моря насчи-
тывала 13 видов организмов пяти классов, ядро которой, по-прежнему, формировали
пресноводные формы. Уровень зараженности паразитами младших возрастных групп
леща и воблы в возрасте сеголетков в северной части Каспийского моря был выше,
чем у ранней молоди в полоях дельты р. Волги. Наиболее патогенными паразитами для
молоди при переходе из реки в море являлись трематода A. muhlingi, а также ремнецы
D. interrupta и L. intestinalis, инициировавшие гибель рыб.
БЛАГОДАРНОСТИ
Коллектив авторов выражает глубокую сердечную признательность сотрудникам
лаборатории воспроизводства рыб Каспийского научно-исследовательского института
рыбного хозяйства за помощь в сборе и идентификации молоди рыб из полоев р. Волги
и Волго-Ахтубинской поймы в период исследований.
Список литературы
Астафьев Б.А. 1991. Паразитизм: сущность явления и определение. Эволюция паразитов: Первый Всесо-
юзный Симпозиум. Тольятти, 64-72.
Астафьев Б.А., Яроцкий Л.С., Лебедева М.Н. 1989. Экспериментальные модели паразитозов в биологии и
медицине. М., Наука, 280 с.
502
Астахова Т.В. 1962. Паразитофауна и инвазионные болезни молоди некоторых промысловых рыб дельты
Волги: дис. … канд. биол. наук: Астахова Тамара Васильевна. Астрахань, 175 с.
Астахова Т.В. 1964. Чернопятнистая болезнь карповых рыб. Сб. паразитол. работ. Тр. Астраханского запо-
ведника (9): 40-56.
Астахова Т.В. 1967. Паразиты и болезни молоди промысловых рыб дельты Волги и Северного Каспия. Тр.
КаспНИРХ. 23: 181-226.
Ахмеров А.Х., Богданова Е.А. 1957. Материалы по паразитофауне рыб водоемов зоны будущего Сталин-
градского водохранилища (в районе пойменных озер и р. Еруслан). Известия ВНИОРХ (Всесоюзного
научно-исследовательского института озерного и речного рыбного хозяйства) 42: 146-159.
Балашов Ю. С. 2011. Паразитизм и экологическая паразитология. Паразитология 45 (2): 81-93.
Беклемишев В.Н. 1945. О принципах сравнительной паразитологии в применении к кровососущим члени-
стоногим. Мед. паразитол. 14 (1): 4-11.
Беэр С.А. 2004. Роль патогенности паразитов в эволюции органического мира. Успехи общей паразитологии.
Тр. Института паразитологии. М., Наука, 44: 65-81.
Бисерова Л.И. 1990. Об основных механизмах, обусловивших вспышку численности трематод Apophallus
muehlingi и Rossicotrema donicum в дельте Волги. Факторы регуляции популяционных процессов у
гельминтов. Тез. докл. М., 17-18.
Бисерова Л.И. 1997. Оценка степени патогенного воздействия метацеркарий трематод на молодь карповых
рыб. Первый конгресс ихтиологов России. Тез. докл. М., ВНИРО, 406 с.
Бисерова Л.И. 2001. Гельминтофауна молоди рыб дельты Волги. Экология молоди и проблемы воспроиз-
водства каспийских рыб. Сб. науч. тр. М., ВНИРО, 58-61.
Бисерова Л.И. 2005. Трематоды Apophallus muehlingi и Rossicotrema donicum - паразиты рыб дельты Волги.
Автореф. дис. … канд. биол. наук. М., 24 с.
Бисерова Л.И. 2010. Паразитологические аспекты инвазий чужеродных видов. Искусственное воспроизвод-
ство ценных гидробионтов, акклиматизация и аквакультура. Труды ВНИРО. 148. М., ВНИРО, 137-141.
Бисерова Л.И. 2012. Динамика расселения гельминтов в новых ареалах в связи с особенностями их жизнен-
ных циклов. Материалы V Всероссийской конференции с международным участием по теоретической
и морской паразитологии. Калининград. АтлантНИРО, 36-38.
Богданова Е.А. 1956. Материалы к фауне паразитов мальков воблы из ряда волжских нерестово-выростных
хозяйств. ВНИОРХ, 42, 122-160.
Быховская-Павловская И. Е. 1985. Паразиты рыб. Л., Наука,121 с.
Владимиров В.Л. 1961. Биология и распределение метацеркарий возбудителя чернопятнистой болезни рыб.
Научно-технический бюллетень ГосНИОРХ: 13-14.
Дубинин В.Б. 1952 а. Паразитофауна молоди осетровых рыб Нижней Волги. Ученые записки ЛГУ 141 (35):
203-243.
Дубинин В.Б. 1952 б. Фауна личинок паразитических червей позвоночных животных дельты Волги. Пара-
зитол. сб. ЗИН АН СССР. T. XIV. Л., 213-265.
Иванов В.М. 1991. Трематоды Apophallus muehlingi и Rossicotrema donicum - возбудители гельминтозов рыб
в дельте Волги и Северном Каспии. Автореф. дис. … канд. биол. наук. М., 20 с.
Иванов В.М., Семенова Н.Н. 2000. Патогенное влияние церкарий Apophallus muehlingi (Trematoda,
Heterophyidae) на рыб. Вопросы рыболовства. 1, № 2-3. Биологические ресурсы окраинных и вну-
тренних морей России и их рациональное использование (запасы, многовидовые модели, сбаланси-
рованное рыболовство, экологическая ситуация): материалы Международной конференции, Ростов-
на-Дону. Ч. 1: 144-145.
Иванов В.М. 2003. Мониторинг, структурные изменения и экологические особенности трематодофауны
позвоночных животных дельты Волги и Северного Каспия (фауна, систематика, биология, экология,
патогенное значение). Авт. дис. … докт. биол. наук. М., 48 с.
Иванов В.М., Семенова Н.Н., Калмыков А.П. 2012. Гельминты в экосистеме дельты Волги (том 1. тремато-
ды). Астрахань: Волга, 255с
503
Каменский И.В., Васильков Г.В. 1964. Некоторые данные о биологии по эпизоотологии постодипостомоза
рыб Нижней Волги. Труды Астраханского заповедника (9): 153-163.
Комарова Т.И. 1978. Влияние метацеркарий семейства Diplostomatidae на выживаемость личинок рыб в
эксперименте. Проблемы гидропаразитологии. Киев, Наукова Думка, 87-93
Контримавичус В.Л. 1982. Паразитизм и эволюция экосистем. Журнал общей биологии 43 (3): 291-302.
Курочкин Ю.В. 1963. Церкариозы рыб. Четвертое Всесоюзное совещание по болезням рыб Тезисы до-
кладов. М., 59-62.
Лабораторный практикум по болезням рыб. 1983. Ред. Мусселиус В. А., Ванятинский В. Ф., Вихман А. А.
М.: Легкая и пищевая промышленность, 296 с.
Лебедев Б.И. 1979. Некоторые эволюционные проблемы общей паразитологии. Эволюционные исследования.
Труды Биолого-почвенного института ДВНЦ АН СССР. Владивосток, 91-102.
Макаров В. В., Тимофеев Б. А. 2006. Паразитизм, патогенность, инфекционная паразитарная система. Ве-
теринарная патология 4: 174-181.
Мариц Н.М. 1965. Ботриоцефалез карпов. Работы по паразитофауне юго-запада СССР. Кишинев, 88-89.
Методы санитарно-паразитологической экспертизы рыбы, моллюсков, ракообразных, земноводных, пре-
смыкающихся и продуктов их переработок (МУК 3.2.988-00). 2001. М., 69 с.
Мошу А. 2014. Гельминты рыб водоёмов Днестровско-Прутского междуречья, потенциально опасные для
здоровья человека. Междунар. ассоц. хранителей реки «Eco-TIRAS»/ ред. Илья Тромбицкий. Киши-
нэу: Eco-TIRAS, 88 с.
Мусселиус В.А. 1973. Паразиты и болезни растительноядных рыб Дальневосточного комплекса в прудовых
хозяйствах СССР. Тр. ВНИИПРХ. 22. М., 4-129.
Определитель паразитов пресноводных рыб СССР.1962. Быховская-Павловская И.Е., Гусев А.В., Дубинина
М.Н., и др. Москва-Ленинград. Академии наук СССР, 776 с.
Определитель паразитов пресноводных рыб фауны СССР. 3. 1987.Бауер О.Н. Л.: Наука, 583 с.
Ройтман В.А., Беэр С.А. 2008. Паразитизм как форма симбиотических отношений. М., Товарищество на-
учных изданий КМК, 310 с.
Шигин А.А. 1986. Трематоды фауны СССР. Род Diplostomum. Метацеркарии. М.: Наука, 254 с.
Шульц Р.С. 1967. Паразитизм и его эволюция. Доклады на чтении памяти Е.Н. Павловского. Алма-Ата, 3-9.
Шульц Р.С., Гвоздев Е.В. 1972. Основы общей гельминтологии. Т. 2. Биология гельминтов. М., Наука, 515 с.
Щербань Н.П., Монченко В.И., Шовкопляс М.Н. 1963. К изучению жизненного цикла Bothriocephalus
gowcongensis Yeh, 1955. Проблемы паразитол. Труды IV научн. конф. паразитологов Украины. Киев,
АН УССР, 476-478.
Barber I., Mora A.B, Payne E.M., Weinersmith, K.L., Sih A. 2017. Parasitism, personality and cognition in fish.
B ehavioural Processes 141: 205-219.
Bush A.O., Lafferty K.D., Lotz J.M., Shostak A.W. 1997. Parasitology meets ecology on its own terms: Margolis
et al. revisited. The Journal of Parasitology 83 (4): 575-583.
Combes C. 2001. Parasitism: the ecology and evolution of intimate interactions. University of Chicago Press, 725 p.
Hecker M., Karbe L. 2005. Parasitism in fish-an endocrine modulator of ecological relevance? Aquatic Toxicology
72 (3): 195-207.
Kuchta R., Scholz T. 2007. Diversity and distribution of fish tapeworms of the "Bothriocephalidea" (Eucestoda).
Parassitologia 49 (3): 129-146.
Sandor D., Molnar K., Gibson D. I., Szekely C., Majoros G., Cech G. 2017. An investigation of the host-specificity
of metacercariae of species of Apophallus (Digenea: Heterophyidae) in freshwater fishes using morphologi-
cal, experimental and molecular methods. Parasitology research 116 (11): 3065-3076.
Sonin M.D., Rykovski A.D. 2001. Helminths of Wildlife. Ed.: Chowdhury and Alonso Aquirre. Science Pubbish-
ers, Inc. USA, 199-232.
Simkova A., Lafond T., Ondrackova M., Jurajda P., Ottova E., Morand S. 2008. Parasitism, life history traits and
immune defence in cyprinid fish from Central Europe. BMC Evolutionary Biology 8 (1): 8-29.
504
PARASITES OF YOUNG FISH OF THE VOLGA DELTA
A. V. Konkova, T. A. Solokhina, N. Yu. Terpugova
Keywords: young fish; parasitofauna; the Volga delta; the northern part of the Caspian
Sea; lethal doses; pathogenicity.
SUMMARY
In the period 2005-2018 the parasitofauna of the early roach, bream, rudd, silver bream, crucian
carp, common carp, perch juvenile in the fields of the Volga delta and the Volga-Akhtuba floodplain
united 20 species, and 13 species of parasitic organisms of roach and bream underyearlings in the
northern part of the Caspian Sea. The most common parasite was the trematode Apophallus muhlingi
(Jagerskiold, 1899), regularly recorded in juveniles, the infection of which closely correlated with the
duration of the fish in the temporarily flooded waters. This species, along with Posthodiplostomum
cuticola (Nordmann, 1932), showed the greatest pathogenicity towards young fish less than 13-14 mm
long. It was noticed that the larvae and the fry 14-20 mm long were found to withstand a parasitic
load in the amount of 1-4 metacercaria of A. muehlingi, while the maximal intensity of P. cuticola
invasion did not exceed 2 metacercariae for fish 13-23 mm long that, most likely, corresponded to
the maximal parasitic load. Besides these two mentioned trematodes and cestods fam. Ligulidae, the
remaining parasitic organisms, with their potential, did not have a pathogenic effect on the developing
organisms of young fish at the time of the research.
505