ПАРАЗИТОЛОГИЯ, 2019, том 53, № 6, с. 518-528.
УДК 575.228, 595.771
ГЕНЕТИЧЕСКИЙ АНАЛИЗ ПОПУЛЯЦИИ ЗАВОЗНЫХ КОМАРОВ
AEDES (STEGOMYIA) ALBOPICTUS (SKUSE, 1895)
(DIPTERA, CULICIDAE) В КРАСНОДАРСКОМ КРАЕ
© 2019 г. М. В. Федорова a *, О. Г. Швец b,
И. М. Медяник b, Е. В. Шайкевич с.
a ЦНИИ эпидемиологии Роспотребнадзора,
Новогиреевская 3а, Москва 111123, Россия
b Причерноморская противочумная станция Роспотребнадзора,
ул. Куникова, 90, Новороссийск 353919, Россия
c Институт общей генетики им. Вавилова РАН,
ул. Губкина 3, Москва 117971, Россия
* e-mail: culicidae@mail.ru
Поступила в редакцию 03.05.2019 г.
После доработки: 05.06.2019 г.
Принята к публикации 05.06.2019 г.
Aedes albopictus, переносчик медицински значимых арбовирусов, является повсеместно рас-
пространенным завозным видом. В России A. albopictus был впервые зарегистрирован в Сочи
в 2011 г. и за последующие 6 лет быстро распространился в Краснодарском крае. Генетическое
разнообразие популяции A. albopictus исследовали, основываясь на анализе ДНК митохондри-
ального гена цитохром с оксидазы I 95 особей. В целом было обнаружено 6 гаплотипов, включая
4 известных гаплотипа и два новых гаплотипа. Филогенетический анализ выявил два отдельных
кластера, что позволяет предположить существование в Краснодарском крае двух популяций
с разным происхождением.
Ключевые слова: Aedes albopictus, Culicidae, кровососущие комары, мтДНК, COI, проис-
хождение.
DOI: 10.1134/S0031184719060073
Кровососущие комары Aedes (Stegomyia) albopictus (Skuse, 1895) - переносчики воз-
будителей многих заболеваний, опасных для человека, включая лихорадки денге, Чи-
кунгунья, Зика и желтую лихорадку (Gardner et al., 2016). За последние десятилетия
этот вид, родиной которого является юго-восточная Азия, распространился по всему
миру благодаря экологическим особенностям и деятельности человека (Medlock et al.,
2015). В Европе акклиматизировавшиеся популяции A . albopictus впервые обнару-
жены в Италии в 1991 г., а в настоящее время вид отмечен почти в 19 европейских
странах, включая страны Средиземноморского бассейна и центральной Европы ( Dalla
518
Pozza, Majori, 1992; Gojković et al., 2019). Распространение A. albopictus стало при-
чиной местной передачи возбудителей лихорадок денге и Чикунгунья. Случаи этих
заболеваний регистрируют в Италии, на юге Франции, в Хорватии, начиная с 2007 г.
(Tomasello, Schlagenhauf, 2013; Calba et al., 2017; Venturi et al., 2017).
На Черноморском побережье Кавказа A. albopictus был впервые найден в 2011 г.
в г. Сочи, на территории Республики Абхазия (Ganushkina et al., 2016) и в Грузии
(Kutateladze et al., 2016). В последующие годы вид продвинулся на запад вдоль побе-
режья более чем на 260 км до г. Анапы и на север более чем на 140 км от моря (Усть-
Лабинск) (Федорова и др., 2019). Таким образом, на обширной территории на юге Рос-
сии сформировались условия, благоприятные для возникновения вспышек лихорадок
денге и Чикунгунья. Эпидемический потенциал вида определяется в первую очередь
восприимчивостью к возбудителям инфекций и способностью к их передаче, уров-
нем антропофильности комаров, скоростью развития резистентности к инсектицидам
(Lourenço de Oliveira et al., 2003; Delatte et al., 2010; Marcombe et al., 2014). Указанные
признаки варьируют в разных популяциях A. albopictus (Honório et al., 2019). В связи
с этим эпидемиологическая опасность завозных комаров A. albopictus в значительной
степени зависит от их происхождения.
Целью нашей работы было изучение происхождения российской популяции A. albo-
pictus. Для этого был проведен генетический анализ гена цитохром с оксидазы (COI),
который широко используется в подобного рода исследованиях и потому представлен
в ГенБанке большим числом последовательностей из различных географических ре-
гионов (Ruiling et al., 2018).
МАТЕРИАЛ И МЕТОДЫ
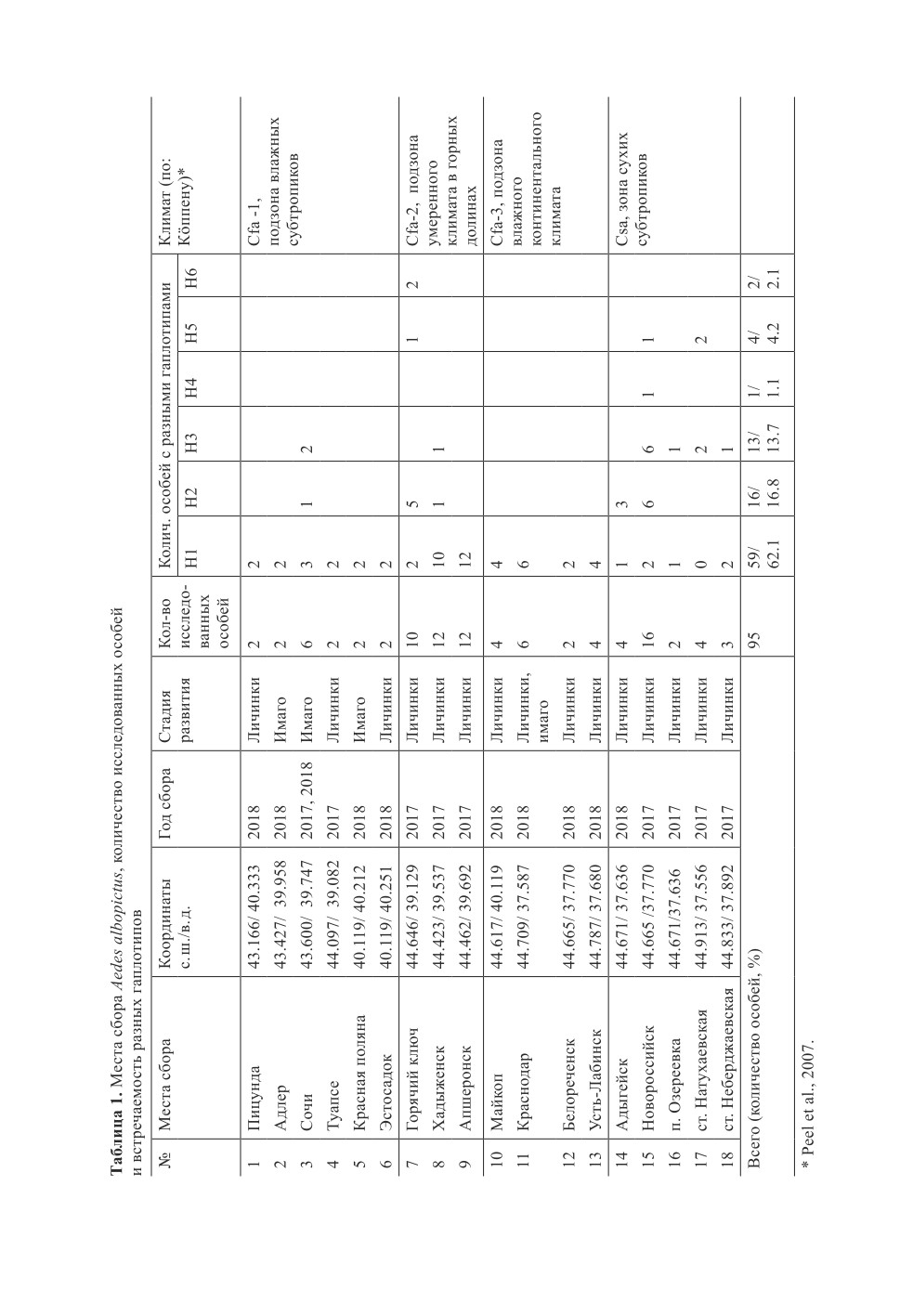
Места сбора. Район исследований расположен между 45°13ˊ- 43°10ˊ с. ш. и 38°59ˊ - 40°20ˊ в. д.
Согласно классификации Коппен-Гейгера, значительная часть территории лежит в зоне субтро-
пического климата (Cfa), за исключением Новороссийска и его окрестностей, где климат бли-
зок к сухому средиземноморскому (Csa) (Peel et al., 2007). В климатической зоне Cfa по ряду
параметров (средние январские температуры, продолжительность заморозков, уровень годовых
осадков) можно выделить подзоны, имеющие климатические особенности:
Cfa-1 - Республика Абхазия и окрестности Сочи характеризуются влажным субтропическим
климатом со средней январской температурой > 6°С и среднегодовыми осадками более 1400 мм,
Cfa-2 - горные долины западной части Кавказских гор с климатом, близким к умеренному, со
средней январской температурой -0,5°C и осадками около 900-1000 мм в год (табл.1);
Cfa-3 - Закубанская равнина, территория которой характеризуется переходным климатом от
Cfa к влажному континентальному Dfa: средняя температура января + 0,8°С, количество осадков
600-800 мм, без устойчивого снежного покрова.
Для генетического анализа использовали личинок и имаго, собранных в сентябре 2017 г. и
августе-сентябре 2018 г., которых хранили в 95% этаноле. Определение проводили по морфоло-
гическим признакам.
Молекулярные методы. Каждую личинку или имаго A. albopictus гомогенизировали в 300 мкл
физиологического раствора в гомогенизаторе тканей TissueLyser LT (Qiagen, Germany). ДНК
519
выделяли из 100 мкл гомогената набором Рибо Преп в соответствии с инструкцией произво-
дителя (Амплисенс, ЦНИИ эпидемиологии, Москва). Для проведения ПЦР использовали набор
реагентов Encyclo (Евроген, Москва).
Для ПЦР гена COI мтДНК использовали два набора праймеров: 1454F (5ˊ GGTCAACAAAT-
CATAAAGATATTGG 3ˊ) и 2160R (5ˊ TAAACTTCTGGATGACCAAAAAATCA 3ˊ) для 5ˊ конца
гена; 2027F (5ˊ CCCGTATTAGCCGGAGCTAT 3ˊ) и 2886R (5ˊ ATGGGGAAAGAAGGAGTTCG 3ˊ)
для 3ˊ конца гена, как описано ранее (Zhong et al., 2013). Праймеры амплифицируют два участка
гена длиной 700 п. н. и 850 п. н. Полное перекрывание фрагментов составило 1537 п. н., что соот-
ветствует более 90% целого гена. Секвенирование проводили с прямого и обратного праймеров
в каждой паре.
Анализ последовательностей. Последовательности ДНК, полученные от 95 экз. A. albopictus,
анализировали с помощью программ ChromasPro, Seqman, BLASTN, ClustalW, MAFFT V.6. Чис-
ло полиморфных сайтов, разнообразие гаплотипов (Hd) и разнообразие нуклеотидов (Pi) в ДНК
гена COI у особей из исследованных мест сбора определяли, используя DnaSP (Librado, Rozas,
2009). Для оценки степени генетических различий между популяциями определили индекс гене-
тической дифференциации (Fst) и уровень потока генов между выборками (Nm). Чтобы опреде-
лить филогенетические связи между гаплотипами была построена сеть гаплотипов с помощью
метода статистической парсимонии в программе TCS version 1.13 (Clement et al., 2000). Число
мутационных различий рассчитывалось с 95% вероятностью, что является максимальным чис-
лом мутационных связей между парами последовательностей, оправданным критерием «эко-
номии». Достоверность различий в частоте встречаемости определенных гаплотипов в выбор-
ках вычисляли методом хи-квадрат. Филогенетические дендрограммы построены в программе
MEGA V. 6 методом Максимального правдоподобия по модели Tamura-Nei (Tamura et al., 2013).
Вновь полученные последовательности гена COI зарегистрированы в GenBank под номерами
MH817490-MH817558.
РЕЗУЛЬТАТЫ
Последовательности гена COI получены для 95 особей, собранных в 18 пунктах
(табл. 1). При сравнении последовательностей выявлено 8 нуклеотидных полиморф-
ных сайтов и 6 митохондриальных гаплотипов (табл. 2). Шесть нуклеотидных замен
синонимичны, две приводят к аминокислотным заменам: пурины А103G - Изолейци-
на на Валин у особей с гаплотипами Н3, Н4 и пиримидины T110C - Изолейцина на
Треонин у особей с гаплотипами Н5 и Н6. Разнообразие гаплотипов (Hd) варьировало
от 0.27 до 0.76, в среднем 0.56 (табл. 3), среднее значение индекса разнообразия ну-
клеотидов (Pi) составило 0.00117 (табл. 3). Наиболее высокие значения Hd и Pi выяв-
лены в зоне Csa.
Гаплотип H1 обнаружен у 62% изученных комаров в 17 из 18 исследованных пун-
ктов. С наиболее высокой частотой H1 встречался в климатической зоне Cfa: на Заку-
банской равнине (85%, 17/20), на побережье, включая горные пункты Красная Поляна
и Эстосадок, - 81.3% (13/16) (табл. 1) и в горных долинах - 70.6% исследованных
особей (17/20). В зоне Csa гаплотип H1 встречался только у 20% комаров (5/25), досто-
верно реже, чем на указанных выше территориях (χ2 = 4.49, p=0.035).
Гаплотип H2 обнаружен у 16.8% особей; частота встречаемости варьировала от 6.2
в Абхазии и окрестностях Сочи до 24% в горных долинах, различия частоты встречае-
мости между климатическими зонами и подзонами недостоверны (табл. 1).
520
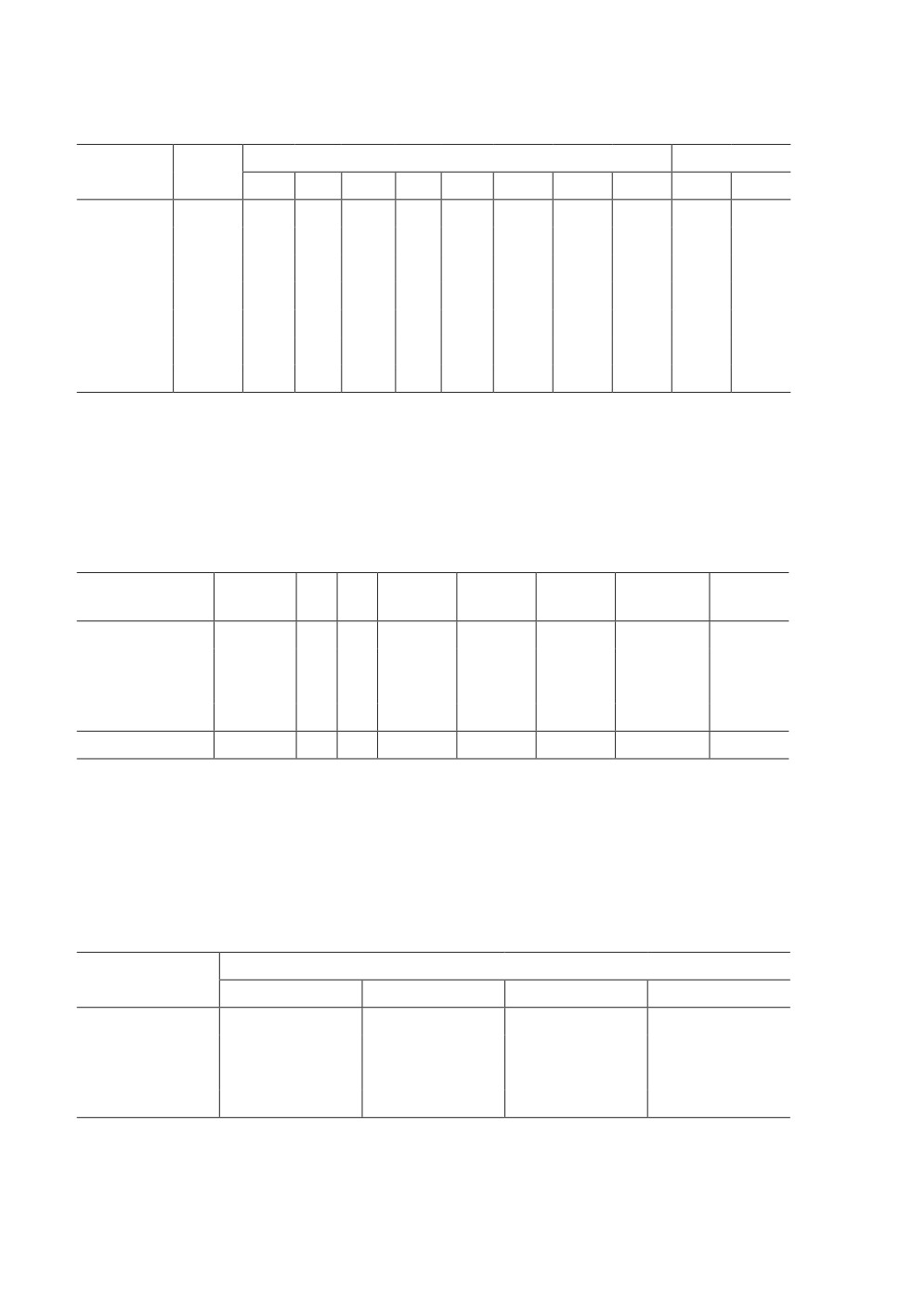
Таблица 2. Полиморфные сайты гаплотипов гена COI в популяции A. albopictus
в Краснодарском крае
Гаплотип
Колич.
Номер вариабельных нуклеотидов*
АА**
особей
72
103
110
276
732
861
888
1002
35
37
JQ004525
T
A
T
T
G
T
T
T
I
I
H1
59
A
C
H2
16
A
H3
13
G
C
V
H4
1
G
C
C
V
H5
4
C
C
A
T
H6
2
C
C
C
A
T
*Указаны только отличающиеся позиции относительно референсной последовательности
(GenBank аннотация JQ004525); **- сайты аминокислотных последовательностей; сайты,
идентичные верхней последовательности, обозначены точками.
Таблица 3. Генетическое разнообразие A. albopictus в Краснодарском крае
Климатическая
N
S
Н
Hd
К
Pi
Tajima’s D
Fu’s Fs
зона/подзона
(колич.)
Cfa-1
16
4
3
0.34167
1.025
0.00078
-0.46835
1.05
Cfa-2
34
7
5
0.4795
1.04991
0.0008
-1.10978
-0.367
Cfa-3
20
1
2
0.26842
0.26842
0.0002
-0.0861
0.381
Csa
25
7
5
0.75667
2.39333
0.00182
0.89987
1.609
Всего
95
8
6
0.57088
1.53953
0.00117
-0.03321
0.998
Н - число гаплотипов, S - число сайтов сегрегации, Hd - гаплотипическое разнообразие,
К - среднее число нуклеотидных различий, Pi - нуклеотидное разнообразие (PiJC).
Таблица 4. Значения FST и Nm для A. albopictus из разных климатических зон/подзон
в Краснодарском крае
Климатическая
Значения Fst и Nm для разных климатических зон/подзон
зона/подзона
Cfa-1
Cfa-2
Cfa-3
Csa
Cfa-1
25.09
16.95
0.64
Cfa-2
0.00987 ns
8.14
0.61
Cfa-3
0.01454 ns
0.02980 ns
0.34
Csa
0.26724*
0.29066***
0.42386***
* 0.01<P <0.05, ** 0.001<P <0.01, *** P <0.001.
ns - не достоверно, значения Nm выше диагонали.
522
Гаплотипом H3 обладали 13.7% (13/95) исследованных особей, из них 76.9% были
найдены в зоне Csa. На Закубанской равнине особи с таким генотипом не были обна-
ружены. Различия в частоте встречаемости Н3 в Новороссийске с окрестностями (Csa)
и остальных подзонах Cfa достоверны (χ2=13.446, p<0,001).
Гаплотипы H4, H5 и H6 являются редкими и обнаружены у 1.1, 4.2 и 2.1% исследо-
ванных особей, соответственно (табл. 1).
Значения Fst и Nm приведены в табл. 4. Статистически недостоверны различия меж-
ду значениями Fst для подзон климатической зоны Cfa. Напротив, различия между
значениями Fst зоны Csa и тремя подзонами Cfa статистически достоверны. При срав-
нении зоны Csa c тремя подзонами Cfa значения Nm были меньше 1 (табл. 4).
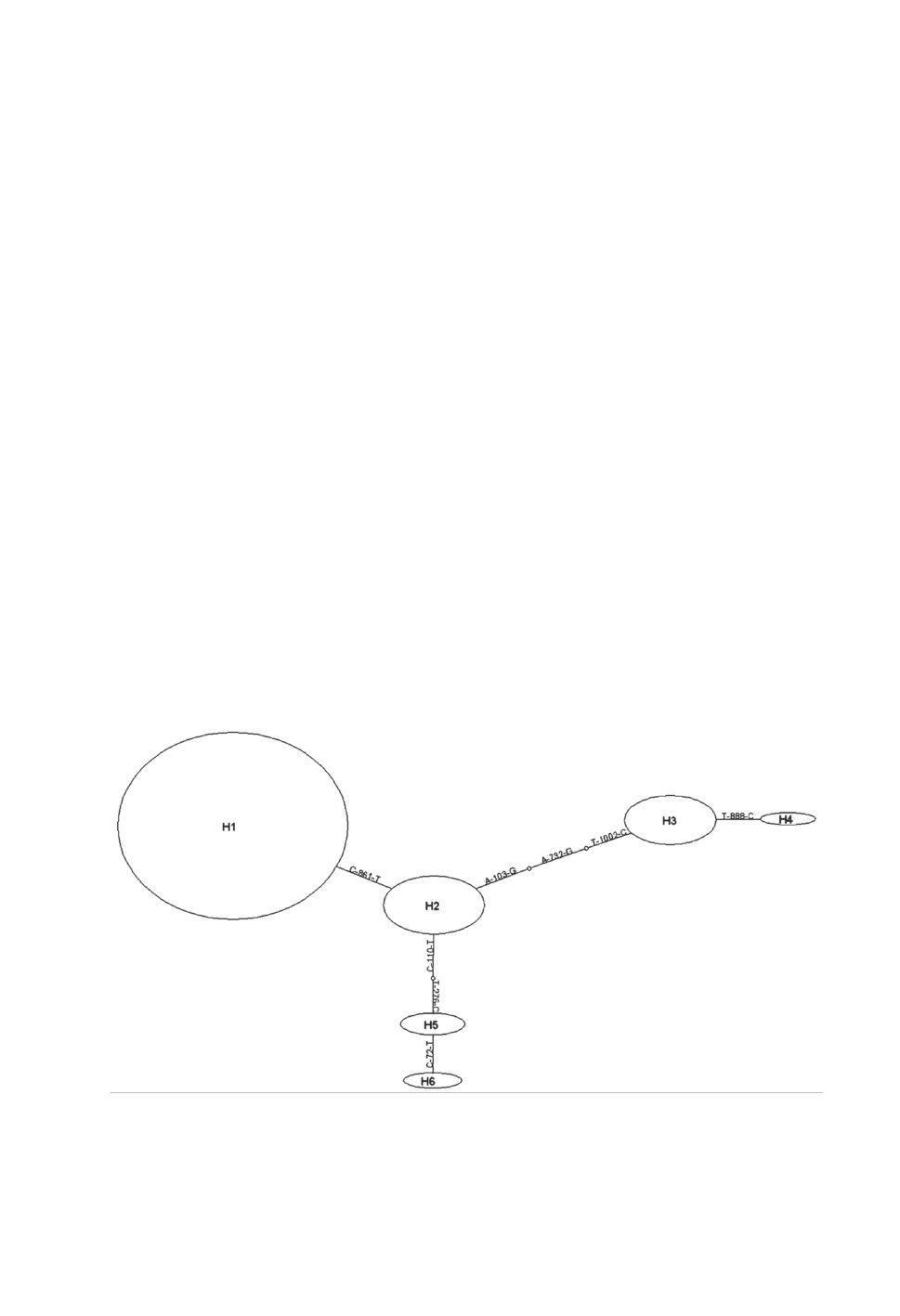
Сеть митохондриальных гаплотипов, полученных в наших исследованиях, представ-
лена на рис. 1. В центре находится гаплотип H2, связанный одной-тремя последова-
тельными мутациями с Н1, Н5 и Н3. Гаплотипы Н4 и Н6 изолированы одной нуклео-
тидной заменой от Н3 и Н5, соответственно.
Филогенетический анализ 95 последовательностей гена COI A. albopictus по всему
участку (1537 п. н.) представлен на рис. 2А. Поскольку количество сиквенсов гена
COI такой длины в ГенБанке незначительно, было также проведено сравнение по
последовательности 5' конца гена COI (513 п. н., рис. 2Б). В обоих случаях выявлены
два кластера. Первый кластер включает последовательности ДНК с гаплотипами H1,
H2, H5 и H6, которые группируются с ДНК комаров из Южной Европы и Турции,
а также с Черноморского побережья Кавказа. Идентичные последовательности были
обнаружены в Японии, Китае, Тайвани, а также в Северной Америке. Последователь-
ности второго кластера, гаплотипы H3 и H4, группируются с найденными у A. albopictus
в Японии и США (рис. 2А, 2Б).
Рисунок 1. Сеть митохондриальных гаплотипов, построенная на основе сравнения 1537 п. н.
гена COI Ae. albopictus. Размер овалов пропорционален частоте встречаемости гаплотипов.
523
А
Б
Рисунок 2. Дендрограмма гаплотипов гена COI комаров Aedes albopictus
из разных географических регионов: А - 1537 п. н., Б - 513 п. н. 5ˊ конца.
524
ОБСУЖДЕНИЕ
Среди шести обнаруженных нами гаплотипов мтДНК A. albopictus четыре были из-
вестны ранее. Гаплотипы, обозначенные в нашей работе Н1, H2 и H5, соответству-
ют гаплотипам H03, H17, H54, описанным из США, Японии, Китая и других стран
Zhong с соавторами (Zhong et al., 2013), гаплотип Н3 совпадает с Н79, обнаруженном
в Канаде (Giordano, 2018). Два гаплотипа найдены впервые: Н4 и Н6, оба отличаются
одной мутацией от Н3 и Н5, соответственно. Результаты тестов Tajima’s D и Fu’s Fs
свидетельствуют, что обнаруженные мутации носят нейтральный характер.
В регионах происхождения популяции A. albopictus характеризуются высоким гене-
тическим разнообразием: в Юго-Восточной Азии у 174 особей выявлено 62 гаплотипа
мтДНК (Poretta et al., 2012), в Китае - 42 гаплотипа обнаружено у 102 особей (Fang
et al., 2018). Полученные нами данные свидетельствуют о низком полиморфизме на
исследованном участке гена COI у A. albopictus на юге Краснодарского края. Низкое
число обнаруженных гаплотипов свидетельствует о недавнем происхождении россий-
ской популяции A. albopictus (Ruiling et al., 2018).
Генетические различия между популяциями, обитающими в разных климатических
подзонах Cfa, статистически не достоверны. Значения Fst и Nm (табл. 4) свидетель-
ствуют о высоком обмене генов и отсутствии пространственной изоляции между по-
пуляциями во всех трех подзонах Cfa, что указывает на существование на этой терри-
тории панмиктической популяции со свободно скрещивающимися особями. Наиболее
распространенным гаплотипом здесь является Н1. Он широко представлен в разных
регионах по всему миру и встречается как на эндемичных для A. albopictus территори-
ях - Японии, Китае, Тайване, - так и на территориях, где сформировались акклимати-
зировавшиеся популяции этого завозного вида (например, на Гавайях, в США, Канаде,
Италии, Албании и Греции) (Zhong et al., 2013; Battaglia et al., 2016; Giordano, 2018).
Следует отметить, что во многих опубликованных работах анализировали только 5ˊ
конец гена COI, размером 500-700 п. н., поскольку он выбран в качестве фрагмента,
по которому идентифицируют живые организмы (Folmer et al., 1994). На этом участке
гаплотипы Н1 и Н2 не различаются (табл. 2), и такой вариант мтДНК относится к са-
мым распространенным в мире (Battaglia et al., 2016; Zhong et al., 2013; Ruiling et al.,
2018). Опираясь на эти сведения и анализ филогенетических связей, приведенных на
рис. 2 и 3, можно высказать два предположения относительно происхождения рассма-
триваемой российской популяции. Во-первых, завозы кровососущих комаров в порты,
расположенные на Черноморском побережье Кавказа (Сочи, Сухуми, Батуми и др.) как
единичные, так и многократные, из регионов, где гаплотипы H1 и H2 распространены
широко (например, из Юго-Восточной Азии, Китая, США). Во-вторых, расширение
ареала завозных популяций A. albopictus, укоренившихся в южной Европе. В пользу
этого свидетельствует сходство особей из Сочи, Абхазии, Турции и Греции по 5ˊ концу
гена COI (рис. 2Б) (Oter et al., 2013; Шайкевич и др., 2018). В этом случае, российская
популяция A. albopictus может рассматриваться как северная часть популяции, оби-
тающей в Турции и на Балканах. В настоящее время сделать окончательный вывод
в пользу одной из высказанных гипотез не представляется возможным.
525
Статистически значимые генетические отличия на исследованном участке гена COI
выявлены между популяцией, обитающей в Новороссийске и его окрестностях (зона
Csa), и популяцией из зоны Cfa. Полученные значения Nm и Fst свидетельствуют
о пространственной изоляции между популяциями и ограниченном обмене генами.
В Новороссийске и его окрестностях преобладают особи с гаплотипом H3, который
встречается также в Японии, откуда он был завезен в США (рис. 2А, 2Б) (Battaglia
et al., 2016). С гаплотипом H3 тесно связан новый гаплотип H4 (рис. 1). Находки особей
с этими гаплотипами в Турции, Греции и Абхазии неизвестны (Шайкевич и др., 2018).
Поскольку Новороссийск является крупнейшим портом на юге России, можно предпо-
ложить, что A. albopictus был завезен сюда из Японии или США и в настоящее время
распространяется в окрестностях города, двигаясь на запад и север.
Таким образом, полученные данные позволяют предположить, что на юге России
существуют две популяции Ae. albopictus с разным происхождением. Эпидемиологи-
ческий потенциал каждой из них представляет большой интерес с точки зрения про-
гнозирования возможности вспышки заболеваний лихорадками денге и Чикунгунья
в случае их завоза больными людьми.
БЛАГОДАРНОСТИ
Работа Е.В. Шайкевич выполнена при финансовой поддержке РФФИ (19-04-
00739\19).
СПИСОК ЛИТЕРАТУРЫ
Федорова М.В., Швец О.Г., Патраман И.В., Медяник И.М., Отставнова А.Д., Леншин С.В., Вышемирский
О.И. 2019. Завозные виды комаров на черноморском побережье Кавказа: современные ареалы.
Медицинская паразитология и паразитарные болезни 1: 47-55.
Шайкевич Е.В., Патраман И.В., Богачева А.С., Ракова В.М., Зеля О.П., Ганушкина Л.А. 2018. Инвазивные
виды Aedes albopictus и Aedes aegypti на Черноморском побережье Краснодарского края: генетика
(COI, ITS2), зараженность Wolbachia и Dirofilaria. Вавиловский журнал генетики и селекции, 22 (5):
574-585. DOI 10.18699/VJ18.397
Battaglia V., Gabrieli P., Brandini S., Capodiferro M.R., Javier P.A., Chen X.G., Achilli A., Semino O., Gomulski
L.M., Malacrida A.R., Gasperi G., Torroni A., Olivieri A. 2016. The Worldwide Spread of the Tiger Mosquito
as Revealed by Mitogenome Haplogroup Diversity. Frontiers in Genetics, 23 (7): 208-219. doi: 10.3389/
fgene.2016.00208. PubMed PMID: 27933090; PubMed Central PMCID: PMC5120106
Calba C., Guerbois-Galla M., Franke F., Jeannin C., Auzet-Caillaud M., Grard G. Pigaglio L., Decoppet A.,
Weicherding J., Savaill M.C., Munoz-Riviero M., Chaud P., Cadiou B., Ramalli L., Fournier P., Noël H.,
De Lamballerie X., Paty M.C., Leparc-Goffart I. 2017. Preliminary report of an autochthonous chikungu-
nya outbreak in France, July to September 2017. Euro Surveillance, 22 (39). DOI: 10.2807/1560-7917.
ES.2017.22.39.17-00647
Clement M., Posada D., Crandall K.A. 2000. TCS: a computer program to estimate gene genealogies. Molecular
Ecology 9 (10): 1657-1660.
Dalla Pozza G., Majori G. 1992. First record of Aedes albopictus establishment in Italy. Journal of the American
Mosquito Control Association 8 (3): 318-20.
Delatte H., Desvars A., Bouétard A., Bord S., Gimonneau G., Vourc’h G., Fontenille D. 2010. Blood-feeding be-
havior of Aedes albopictus, a vector of chikungunya on La Réunion. Vector-Borne and Zoonotic Diseases
10: 249-258.
526
Fang Y., Zhang J., Wu R., Xue B., Qian Q., Gao B. 2018. Genetic Polymorphism Study on Aedes albopictus of
Different Geographical Regions Based on DNA Barcoding. Biomed Research Inernational, 2018:1501430.
doi: 10.1155/2018/1501430
Folmer O.M., Black W., Hoen R., Lutz R., Vrijenhoek R. 1994. DNA primers for amplification of mitochondrial
cytochrome c oxidase subunit I from diverse metazoan invertebrates. Molecular Marine Biology and Bio-
technology 3: 294-299.
Ganushkina L.A., Patraman I.V., Rezza G., Migliorini L., Litvinov S.K., Sergiev V.P. 2016. Detection of Aedes
aegypti, Aedes albopictus, and Aedes koreicus in the Area of Sochi, Russia. Vector-Borne and Zoonotic Dis-
eases 16 (1): 58-60. doi: 10.1089/vbz.2014.1761
Gardner L.M., Chen N., Sarkar S. 2016. Global risk of Zika virus depends critically on vector status of Aedes albop-
ictus. Lancet Infectious Diseases 16: 522-533.
Giordano B. 2018. Transmission Dynamics and Epidemiology of West Nile Virus in Ontario, Canada. PhD thesis.
Gojković N., Ludoški J., Krtinić B., Milankov V. 2019. The First Molecular and Phenotypic Characterization of the
Invasive Population of Aedes albopictus (Diptera: Culicidae) from the Central Balkans. Journal of Medical
Entomology, 56 (5):1433-1440. doi: 10.1093/jme/tjz064
Honório N.A., Wiggins K., Eastmond B., Câmara D.C.P., Alto B.W. 2019. Experimental Vertical Transmission of
Chikungunya Virus by Brazilian and Florida Aedes albopictus Populations. Viruses 11 (4). pii: E353. doi:
10.3390/v11040353
Kutateladze T., Zangaladze E., Dolidze N., Mamatsashvili T., Tskhvaradze L., Andrews E.S., Haddow A.D. 2016.
First Record of Aedes albopictus in Georgia and Updated Checklist of Reported Species. Journal of the
American Mosquito Control Association 32 (3): 230-233.
Librado P., Rozas J. 2009. DnaSP v5: A software for comprehensive analysis of DNA polymorphism data. Bioinfor-
matics 25: 1451-1452. doi: 10.1093/bioinformatics/btp187
Lourenço de Oliveira R., Vazeille M., de Filippis A.M., Failloux A.B. 2003. Large genetic differentiation and low
variation in vector competence for dengue and yellow fever viruses of Aedes albopictus from Brazil, the
United States, and the Cayman Islands. The American Journal of Tropical Medicine and Hygiene 69: 105-
114.
Marcombe S., Farajollahi A., Healy S.P., Clark G.G., Fonseca D.M. 2014. Insecticide resistance status of United
States populations of Aedes albopictus and mechanisms involved. PLoS One, 9:e101992. DOI: 10.1371/
journal.pone.0101992
Medlock J.M., Hansford K.M., Versteirt V., Cull B., Kampen H., Fontenille D., Hendrickx G., Zeller H., Van Bortel
W., Schaffner F. 2015. An entomological review of invasive mosquitoes in Europe. Bulletin of Entomologi-
cal Research 105 (6): 637-663. doi: 10.1017/S0007485315000103. Epub 2015 Mar 25
Oter K., Gunay F., Tuzer E., Linton Y.M., Bellini R., Alten B. 2013. First record of Stegomyia albopicta in Turkey
determined by active ovitrap surveillance and DNA barcoding. Vector Borne and Zoonotic Diseases 13 (10):
753-61. doi: 10.1089/vbz.2012.1093. Epub 2013 Jun 29
Peel M.C., Finlayson B.L., McMahon T.A. 2007. Updated world map of the Köppen-Geiger climate classification.
Porretta D., Mastrantonio V., Bellini R., Somboon P., Urbanelli S. 2012. Glacial History of a Modern Invader:
Phylogeography and Species Distribution Modelling of the Asian Tiger Mosquito Aedes albopictus. PLoS
ONE 7 (9). e44515
Ruiling Z., Tongkai L., Dezhen M., Zhong Z. 2018. Genetic characters of the globally spread tiger mosquito, Aedes
albopictus (Diptera, Culicidae): implications from mitochondrial gene COI. Journal of Vector Ecology 43
(1): 89-97. doi: 10.1111/jvec.12287
527
Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. 2013. MEGA6: Molecular Evolutionary Genetics Analy-
sis version 6.0. Molecular Biology and Evolution 30: 2725-2729. DOI:10.1093/molbev/mst197
Tomasello D., Schlagenhauf P. 2013. Chikungunya and dengue autochthonous cases in Europe, 2007-2012. Travel
Medicine and Infectious Disease 11 (5): 274-284. doi: 10.1016/j.tmaid.2013.07.006
Venturi G., Di Luca M., Fortuna C., Remoli M.E., Riccardo F., Severini F., Toma L., Del Manso M., Benedetti E.,
Caporali M.G., Amendola A., Fiorentini C., De Liberato C., Giammattei R., Romi R., Pezzotti P., Rezza G.,
Rizzo C. 2017. Detection of a chikungunya outbreak in Central Italy, August to September 2017. Euro Sur-
veillance 22 (39). doi: 10.2807/1560-7917.ES.2017.22.39.17-00646
Zhong D., Lo E., Hu R., Metzger M.E., Cummings R., Bonizzoni M., Fujioka K.K., Sorvillo T.E., Kluh S., Healy
S.P., Fredregill C., Kramer V.L., Chen X., Yan G. 2013. Genetic analysis of invasive Aedes albopictus popu-
lations in Los Angeles County, California and its potential public health impact. PLoS One 8 (7). e68586.
doi: 10.1371/journal.pone.0068586
GENETIC DIVERSITY OF INVASIVE
AEDES (STEGOMYIA) ALBOPICTUS (SKUSE, 1895)
POPULATION (DIPTERA, CULICIDAE) IN KRASNODAR REGION, RUSSIA
M. V. Fedorova, O. G. Shvets, I. M., Medyanik, E. V. Shaikevich
Keywords: Aedes albopictus, mtDNA, COI, origin.
Summary
Aedes albopictus, a vector of medically important arboviruses, is the global invasive species. In Rus-
sia, A. albopictus was recorded for the first time in Sochi in 2011 and over the past 6 years, it rapidly
spread in the south of Krasnodar region. Genetic diversity of A. albopictus population was examined
based on mitochondrial gene cytochrome c oxidase I (COI) sequences of 95 specimens. A total 6 hap-
lotypes were detected in the region, including 4 shared haplotypes and 2 new haplotypes. Phylogenetic
analyses revealed two genetically distinct clusters suggesting the occurrence of two populations with
different origin in Krasnodar region.
528