ПАРАЗИТОЛОГИЯ, 2020, том 54, № 1, с. 49-56.
УДК 595.772.59082
МОДИФИКАЦИЯ МЕТОДИКИ ИЗУЧЕНИЯ СТРОЕНИЯ
ГЕНИТАЛЬНОГО АППАРАТА СЛЕПНЕЙ (DIPTERA: TABANIDAE)
© 2020 г. В. В. Агасой a, *
a Псковский государственный университет,
пл. Ленина д. 2, г. Псков, 180000, Россия
* e-mail: veraagasoj1@rambler.ru
Поступила в редакцию 03.10.2019 г.
После доработки 20.01.2020 г.
Принята к публикации 20.01.2020 г.
В модификации методики препарирования и хранения генитального аппарата слепней пред-
лагается для размягчения мышц и связок гениталий, наряду с КОН, использовать 70 % спирт,
а для тотальных препаратов - монтирующую среду CytosealTM 60 (USA) вместо канадского
бальзама.
Ключевые слова: слепни, техника приготовления, генитальный аппарат, биологические
коллекции, идентификация вида
DOI: 10.31857/S123456780601006X
Особенности строения генитального аппарата используются для уточне-
ния видовой диагностики в различных семействах двукрылых. При этом, если при
определении видовой принадлежности представителей семейства Tabanidae, для самок
используют строение их терминалий (Виолович, 1968; Олсуфьев, 1977; Lyneborg, 1961;
Trojan, 1979), то изучение морфологии гениталий самцов слепней, для этих же целей,
пока не нашло широкого применения. В частности, особенности строения генитального
аппарата самцов как один из систематических признаков был использован Олсуфьевым
(1977) лишь для незначительного числа видов слепней. Кроме этого, сведения об изуче-
нии строения мускулатуры генитального аппарата самцов и его отдельных элементов
встречаются в крайне незначительном количестве работ (Овчинникова, 1989; Trojan,
1979; McAlpine, 1981; Sinclair, 2000) на протяжении последних 30-40 лет.
В связи с вышеизложенным, нами в 2011 г. были начаты комплексные исследования
по изучению фауны, биологии и экологии слепней, которые охватывают все основные
районы Псковской области (Агасой и др., 2019).
В ходе работы определения видовой принадлежности слепней проводились по тра-
диционной методике, включающей в себя анализ внешних морфологических признаков
(лобной полоски, нижней и средней лобной мозолей, концевого членика щупика, усиков,
нотоплевров, тергитов). Однако использование в качестве критерия только внешних
49
морфологических признаков не всегда позволяет точно идентифицировать видовую
принадлежность насекомого. В связи с этим, для уточнения видовой принадлежности
обычно используют особенности строения генитального аппарата слепней. У самок
учитывают форму гонопофиза (8-го стернита брюшка), церок и сперматек, а у самцов -
церок, эпандрия, гипандрия и 8-го тергита (Штакельберг, Тертерян, 1953; Шевченко,
1960; Олсуфьев, 1962; Mackerras, 1954; Lyneborg, 1961; Trojan, 1979).
При исследовании генитального аппарата согласно методике Олсуфьева (1962),
у свежеумерщвленных экземпляров самок, ещё не успевших подсохнуть, пальцами
сдавливают брюшко в дорсовентральном направлении, вследствие чего его кончик вы-
двигается наружу и становиться видимым 8-й стернит и церки. В таком положении самок
слепней подсушивают и затем от вытянутого кончика брюшка отрезают ножницами
1/3 от концевой части. Отрезанную часть кипятят в течение 2-3 мин в 1 % растворе КОН
(гидроксид калия), отмывают дистиллированной водой и далее препарируют на часовом
стекле под стереомикроскопом или бинокулярной лупой (Скуфьин, 1973).
При изучении генитального аппарата самцов методика, используемая для самок, явля-
ется не очень удобной. Это связано с тем, что строение этого отдела у самцов существенно
сложнее, чем у самок, т.к. он состоит из большого числа отдельных элементов и сложного
мышечно-связочного аппарата (Овчинникова, 1989). Поэтому сдавливание пальцами
брюшка в дорсовентральном направлении приводит к значительному смещению отдель-
ных частей генитальной области, что затрудняет их дальнейшее препарирование. При
изучении сложно устроенного мышечного и связочного аппаратов зачастую возникают
повреждения отдельных частей генитального аппарата при их разделении. Поэтому, для
более успешного препарирования, желательно как можно сильнее размягчить связки
и мышцы. Для этого, по общепринятой методике, заднюю часть брюшка в течение 2-3 мин
вываривают в 1 % растворе КОН. В процессе такой обработки, как у самцов так у самок,
зачастую, происходит потеря окраски генитальных сегментов. Это может затруднить сня-
тие морфометрических показателей для видовой диагностики из-за малой контрастности
контуров этих сегментов. Особенно сильно указанный недостаток проявляется при работе
с постоянными препаратами терминалий обработанных традиционным методом при
вываривании их в КОН.
Отпрепарированные части генитального аппарата традиционно хранят в микро-
пробирках с глицерином. Кроме того, с целью сохранения гениталий на длительный
срок предлагают изготовлять тотальные препараты путем их заключения в канадский
бальзам (Олсуфьев, 1962).
Цель статьи - модификация методики препарирования генитальных структур
слепней.
МАТЕРИАЛЫ И МЕТОДИКА
Для устранения вышеописанных недостатков традиционные методики нами были моди-
фицированы. При сборе материала большого объема часть особей, с целью сохранения, сразу
после отлова фиксировались в 70 % спирте. Эти слепни в дальнейшем препарировались без
выдерживания в KOH. В ходе препарирования оказалось, что их мышцы и связки размягчаются
значительно лучше, чем при вываривании в КОН, что существенно облегчало последующее раз-
деление частей генитального аппарата. Кроме того, выдерживание в спирте не изменяло окраски
отпрепарированного материала.
50
С целью подбора оптимальной методики препарирования генитального препарата заморожен-
ных или свежевысушенных (не более одного года) слепней их терминалии, первоначально, без
предварительного выдерживания в спирте, сразу помещали в термостат в 1%-й раствор КОН при
температуре 25-30 °C, где выдерживали в течение суток. Последующее препарирование обрабо-
танных таким образом частей генитального аппарата показало, что мышцы и связки достаточно
хорошо размягчаются, однако мембраны, связывающие тергиты между собой, размягчаются
значительно хуже, что при разделения тергитов зачастую приводит к повреждению последних.
Поэтому свежевысушенных (до одного года) или замороженных слепней, предварительно,
с целью размягчения покровов, накалывали на полипропиленовые пластинки или пенопласт и
помещали на 2-3 ч в эксикатор, заполненный горячей водой. После этого от слепней отрезали
ножницами 1/3 концевой части брюшка, помещали её в пробирку (объёмом 12 мл), на 1/6 запол-
ненную 70%-м спиртом. Через 10-12 ч эту часть брюшка вынимали из пробирки и препарировали
на часовом стекле в 70 % спирте с использованием микроскопа МБС-9. У самцов, помимо церок
с эпандрием, 8-го тергита, а также гипандрия, аккуратно отделяли 7-й тергит и 8-й стернит.
В этом случае наряду с мышцами и связками достаточно хорошо размягчались и мембраны, что
снижало вероятность повреждения тергитов при их разделении.
Для препарирования генитального аппарата слепней, хранящихся в сухом виде более одно-
го года, вышеописанная методика не подходит, так как их связки, мышцы и мембраны труд-
но размягчаются, что затрудняет разделение частей аппарата. С целью исключения повреж-
дения препарируемых частей генитального аппарата за счет лучшего размягчения мышц,
связок и мембран, вначале сухие экземпляры слепней помещали на 2-3 ч в эксикатор, запол-
ненный горячей водой. Затем от брюшка слепней отрезали ножницами 1/3 от концевой части
и переносили в пробирку с 70%-м спиртом на сутки, после чего спирт заменяли на 1%-й раствор
КОН. Пробирку с материалом не кипятили, согласно методике Олсуфьева (1962), а помещали
в термостат с температурой 25-30 °C на сутки. Через сутки пробирку вынимали из термостата
и приступали к препарированию. В результате подобной обработки препарирование существенно
облегчается, что позволяет отделить части генитального аппарата без повреждений.
Для изготовления тотальных препаратов генитального аппарата слепней и ротового аппарата
их личинок нами впервые была опробована монтирующая среда CytosealTM 60 (USA), которая
широко применяется в настоящее время при подготовке гистологических препаратов, постоянных
препаратов мелких насекомых и других членистоногих (Espinasa et al., 2015; Long, 2018). Эта
прозрачная бесцветная жидкость, вязкость которой легко регулировать ксилолом. Она не меняет
свой цвет с течением времени, а содержащиеся в ней антиоксиданты препятствует выцветанию
препарата. Положительные качества среды - она быстро растекается, что практически исключает
образование пузырьков, и быстро затвердевает (в течение 20-30 мин).
Перед изготовлением постоянного препарата предметные и покровные стекла, с целью обез-
жиривания, заранее помещали в смесь раствора спирта с эфиром в соотношении 1:1. В процессе
приготовления препарата на обезжиренное предметное стекло наносили небольшую каплю мон-
тирующей среды CytosealTM 60 (USA) и тонким слоем распределяли ее на небольшом участке
стекла. Затем на этом участке в необходимом порядке раскладывали отдельные части полового
аппарата, предварительно выдержанные в 100 % спирте для удаления остатков воды. Стекла
с терминалиями выдерживали в течение 20-30 мин, в результате чего объекты, размещенные
на тонком слое монтирующей среды, приклеивались к стеклу, что в дальнейшем исключало их
51
смещение. После этого, на подготовленные таким образом части генитального аппарата повтор-
но наносили необходимое количество монтирующей среды, целиком покрывающей их. Таким
образом, объемные элементы аппарата сохраняли свою форму и размеры, что крайне важно для
дальнейшего их анализа. Через 20-30 минут, после затвердевания смолы на нее наносили необ-
ходимое количество монтирующей среды и покрывали всё покровным стеклом. Изготовленному
препарату присваивали код, который указывали на этикетке под сухим экземпляром слепня,
а также делали видовую и географическую этикетки.
Приготовленные таким образом препараты, в ходе изучения генитального аппарата слепней,
можно многократно использовать без опасения их повреждения. Кроме того, прозрачность монти-
рующей среды позволяет производить качественную съемку препаратов (рис. 1-4) и использовать
полученные снимки в дальнейшей работе.
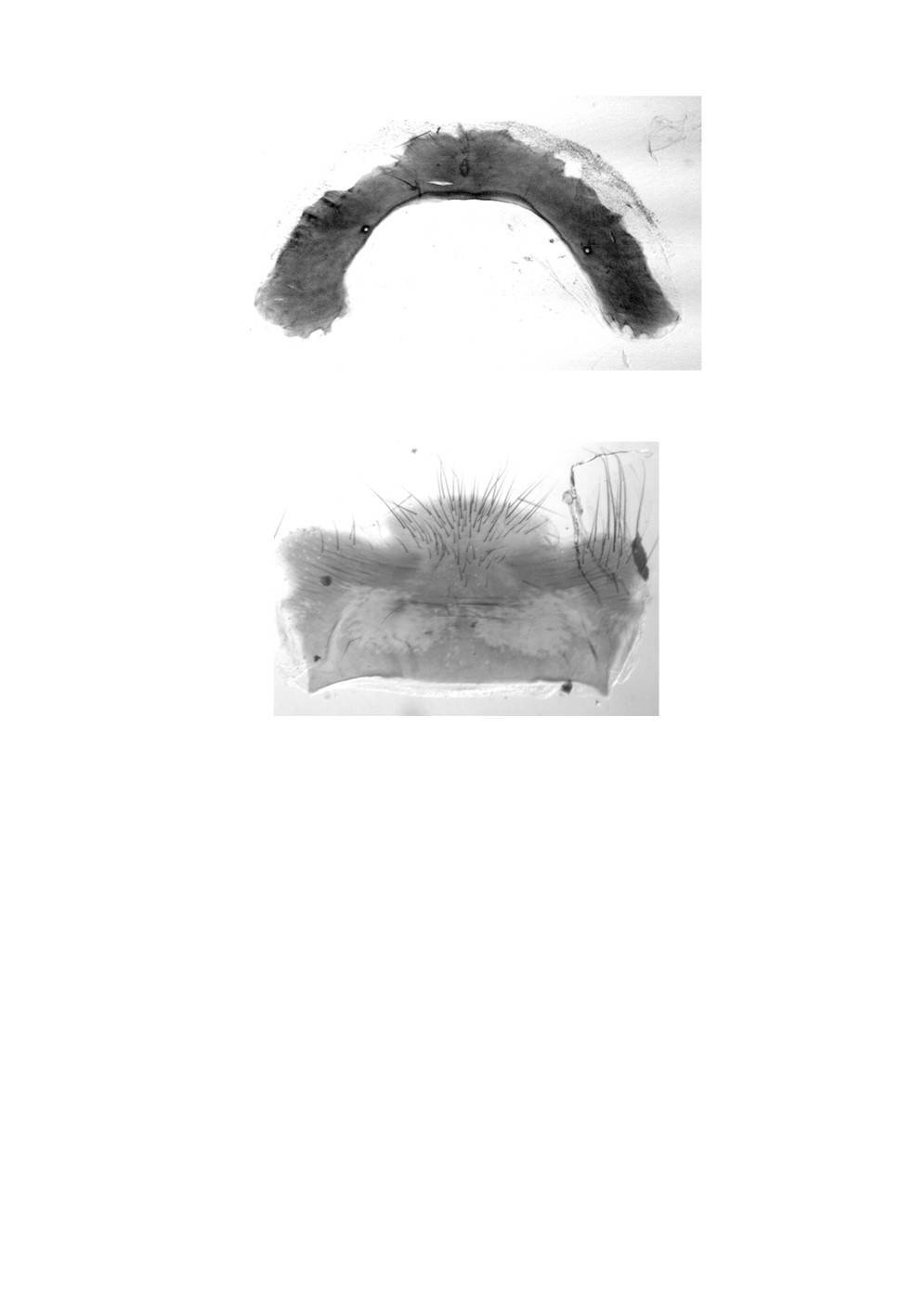
Рисунок 1. Церки и эпандрий самца Hybomitra muehlfeldi (Brauer, 1880).
Figure 1. Cercus and epandrium male Hybomitra muehlfeldi (Brauer, 1880).
Рисунок 2. Гипандрий самца Hybomitra muehlfeldi (Brauer, 1880).
Figure 2. Hypandrium male Hybomitra muehlfeldi (Brauer, 1880).
52
Рисунок 3. 8-й тергит самца Hybomitra muehlfeldi (Brauer, 1880).
Figure 3. 8th tergite of male Hybomitra muehlfeldi (Brauer, 1880).
Рисунок 4. 7-й тергит самца Hybomitra ciureai (Seguy, 1937).
Figure 4. 7th tergite of male Hybomitra ciureai (Seguy, 1937).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
С целью хранения генитального аппарата слепней для последующего их анализа
традиционно используют несколько методик (табл. 1). В частности части генитального
аппарата хранят в глицерине в микропробирках. Такой способ хранения позволяет из-
влекать эти фрагменты для их изучения. В силу малых размерах пробирок и собственно
элементов генитального аппарата при многократном и извлечении и помещении в нее
высока опасность их повреждения. Поэтому с целью длительного хранения элементы
генитального аппарата слепней заключают в канадский бальзам. Кроме того, при изго-
товлении тотальных препаратов наземных членистоногих, в том числе и двукрылых, в ка-
честве монтирующих сред используют синтетическую смолу Euparal (Крупицкий, 2016)
и жидкость Фора -Берлезе (Нестерова, 2008). Однако использование канадского бальза-
ми, Euparal и жидкости Фора - Берлезе в качестве монтирующих сред при исследовании
генитального аппарата слепней имеет ряд недостатков (табл. 2), поэтому мы предлагаем
для приготовления тотальных препаратов терминалий слепней и ротовых аппаратов
их личинок, в качестве альтернативы, использовать монтирующую среду CytosealTM
60 (USA).
53
Таблица 1. Сравнение традиционной и предлагаемой методик препарирования
генитального аппарата слепней
Table 1. Comparison of traditional and proposed methods of preparation
of the genital apparatus of horseflies
Особенности
Традиционная
Предлагаемая методика
методики
методика
для свежемороженого
для сухого
(Олсуфьев,
и свежевысушенного материала
материала
1962)
(хранение до 1 года)
(хранение
более 1 года)
Время
Не применяется
Не применяется
2-3 ч
2-3 ч
нахождения
в эксикаторе
Время
Не применяется
Не применяется
10-12 ч
24 ч
экспозиции
в 70 %-м спирте
в 70 %-м спирте
в спирте
Время
Кипячение
24 ч в термостате
Не применяется
24 ч в термостате
экспозиции
2-3 мин
при 25-30 °C
при 25-30 °C
в щелочи
Изменение
Отмечается
Не наблюдается
Не наблюдается
Не наблюдается
окраски
обесцвечивание
терминалий
Отделение
Без затруднений
Без затруднений
Без затруднений
Без затруднений
мышц
Отделение
Затруднено,
Затруднено,
Без
Без
связок
можно
можно
затруднений,
затруднений,
и мембран
повредить
повредить
связки
связки
терминалии при
терминалии при
и мембраны
и мембраны
их разделении
их разделении
легко
легко
из-за
из-за
отделяются
отделяются
уплотненных
уплотненных
связок
связок
и мембран
и мембран
Таблица 2. Сравнительная характеристика монтирующих смол
Table 2. Comparative characteristics of the resins of the installer
Жидкость
Канадский бальзам
CytosealTM 60 (USA)
Euparal
Фора - Берлезе
Медленно сохнет
Быстро сохнет (20-30
Длительное
Время приготовления
(не менее суток);
мин); прозрачный;
высыхание
раствора 2-3 дня;
темнеет с течением
не меняет окраску
препарата (в течение
длительное время
времени; показатель
препарата с течением
месяца); показатель
сушки препарата
преломления
времени; показатель
преломления 1.483;
(2-3 недели);
1.5447 (показатель
преломления
мало доступен
необходимость
преломления
1.495+0.005;
в России
окантовки лаком
покровного стекла
имеет доступную
для предотвращения
1.505); очень дорого
цену
высыхания тотального
стоит
препарата
54
Предлагаемая методика была нами опробована не только для препарирования и при-
готовления тотального препарата терминалий имаго слепней, но и для частей ротового
аппарата их личинок (рис. 5, 6).
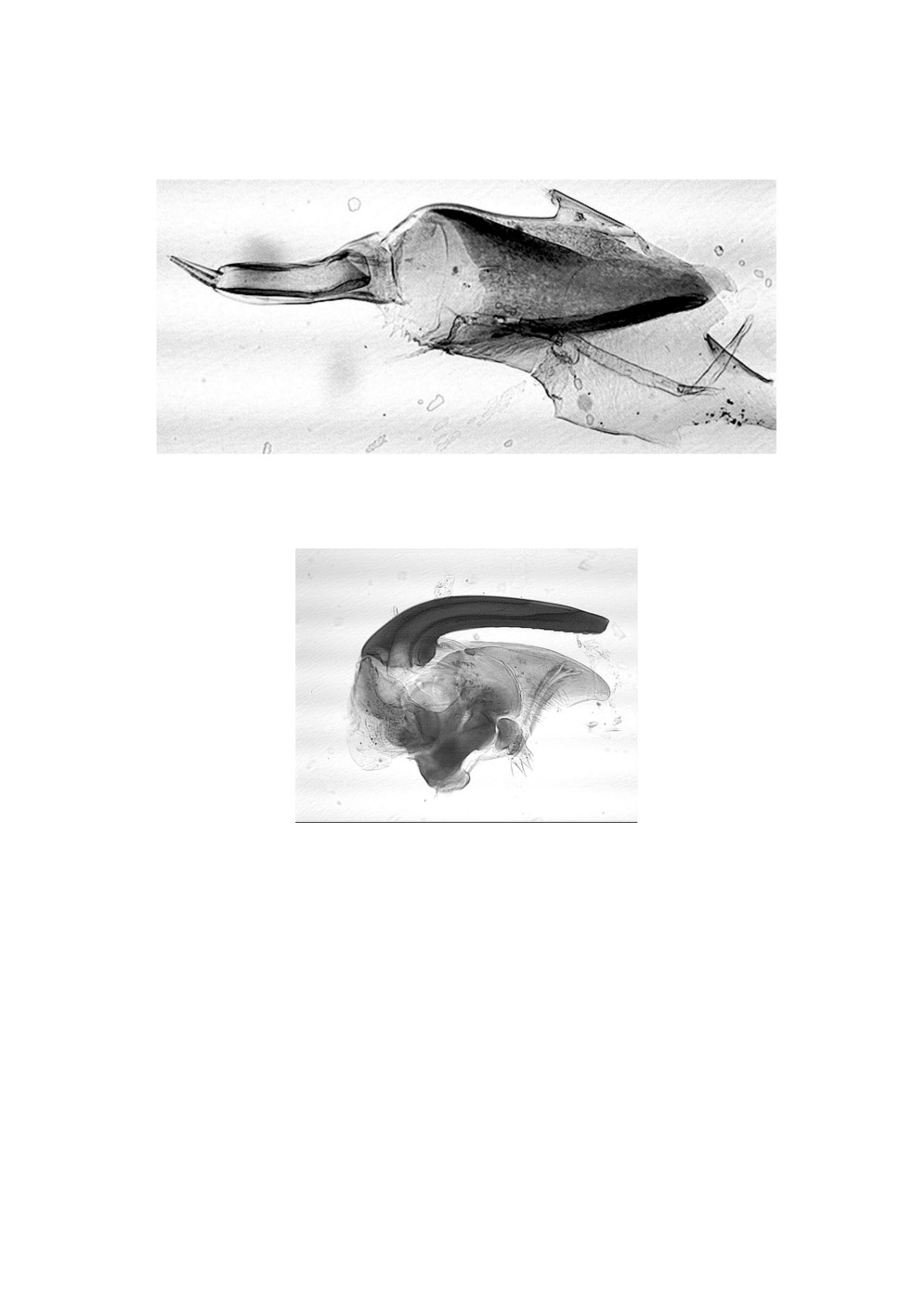
Рисунок 5. Усик личинки Hybomitra lundbecki lundbecki (Lyneborg, 1960).
Figure 5. Antennae of the larva Hybomitra lundbecki lundbecki (Lyneborg, 1960).
Рисунок 6. Мандибула и максилла личинки Hybomitra lundbecki lundbecki (Lyneborg, 1960).
Figure 6. Mandibula and maxilla of the larva Hybomitra lundbecki lundbecki (Lyneborg, 1960).
Список литературы
Агасой В.В., Прокофьев В.В., Медведев С.Г. 2019. Биологические особенности слепней (Diptera, Tabanidae)
и ландшафтное зонирование Псковской области. Паразитология 53 (5): 379-398.
Виолович H.A. 1968. Слепни Сибири. Новосибирск, Наука, 281 с.
Крупицкий А.В. 2016. Филогенетические связи и систематика палеарктических представителей рода Callophrys
Billberg, 1820 (Lepidoptera, Lycaenidae). Дис. … канд. биол. наук. М., 250 с.
Нестерова О.Л. 2008. Методика изготовления тотальных микроскопических препаратов насекомых и клещей
в жидкости Фора - Берлезе и использование многомерного дискриминантного анализа морфометри-
ческих данных в диагностике таксономической принадлежности трудноразличимых видов животных.
Учебно-методическое пособие. Минск, БГУ, 18 с.
Овчинникова О.Г. 1989. Мускулатура гениталий самцов двукрылых Brachycera - Orthorrhapha (Diptera).
Ленинград, ЗИН АН СССР, 167 с.
55
Олсуфьев Н.Г. 1962. О диагностическом значении строения гениталий самок в группе Tabanus (Tylostipia) trop-
cus Pz. (Diptera, Tabanidae). В сб.: Вопросы общей зоологии и медицинской паразитологии. М., 524-529.
Олсуфьев Н.Г. 1977. Слепни. Сем. Tabanidae. В кн.: Фауна СССР. Насекомые двукрылые. Л., Наука, т. 7, вып.
2., 208-210.
Штакельберг А.А., Тертерян А.Е. 1953. О морфологичсеком строении придатков полового аппарата самок
слепней (Diptera, Tabanidae). ДАН Армянской ССР 16 (2): 53-64.
Скуфьин К.В. 1973. Методы сбора и изучения слепней. Ленинград, Наука, 102 с.
Шевченко В.В. 1960. О таксономическом значении особенностей строения гениталий некоторых палеаркти-
ческих видов слепней подсемейства Chrysopsinae (Diptera, Tabanidae). Труды Институтата зоологии
Академии Наук КазССР 2: 157-172.
Espinasa L., Bartolo N.D., Sloat S. 2015. A new epigean species of the genus Anelpistina (Insecta: Zygentoma:
Nicoletiidea) from Sierra de El Abra, Taninul, Mexico. European Journal of Taxonomy 156: 1-7.
Long S. M. 2018. A novel protocol for generating intact, whole-head spider cephalothorax tissue sections. Bio
Techniques 64: 163-164.
Lyneborg L. 1961. On Tabanus tropicus and other Linnean species of Palearctic Tabanidae (Diptera). Entomologiske
Meddelelser 31: 97-103.
Mackerras I. 1954. The classification and distribution of Tabanidae (Diptera). 1. General review. Austral. Journal of
Zoology 2 (3): 431-454.
McAlpine J.F. 1981. Morphology and terminology. adults. In: McAlpine J.F., Petersen B.V., Shewell, G.E., Teskey
H.J., Vockeroth J.R., Wood D. M. (eds.). Manual of Nearctic Diptera, Agriculture Canada, Research Branch,
Vol. 1, 9-63.
Sinclair B.J. 2000. Morphology and terminology of adult of Diptera male genitalia. In: Papp L. and Darvas B. Manual
of Palaearctic Diptera. Vol. 1. 53-47.
Trojan P. 1979. Tabanidae Slepaki (Insecta: Diptera). Warszawa, Polska Akademia Nauk, Instytut Zoologii, 308 p.
MODIFIED TECHNIQUE TO STUDY THE GENITAL APPARATUS
STRUCTURE OF HORSEFLIES (DIPTERA, TABANIDAE)
V. V. Agasoi
Keywords: horseflies, methods of study of the genital apparatus by preparation and manu-
facture of total preparations
SUMMARY
The technique of preparation and storage of the genital apparatus of horseflies is developed. It is
proposed to use 70 % alcohol along with the KOH (potassium hydroxide) to enforce softening of the
muscles and ligaments of the genital structures. For the total preparations of the genital structures it is
proposed to use CytosealTM 60 (USA) as the mounting medium instead of Сanadian balm.
56