ПАРАЗИТОЛОГИЯ, 2020, том 54, № 3, с. 231-246.
УДК 619:578.427:595.771
СЕЗОННАЯ АКТИВНОСТЬ САМОК МОКРЕЦОВ
РОДА CULICOIDES (DIPTERA: CERATOPOGONIDAE)
В РАЗЛИЧНЫХ РЕГИОНАХ РОССИЙСКОЙ ФЕДЕРАЦИИ
© 2020 г. А. В. Спрыгин a,*, Г. А. Беллис b, В. И. Павелко c,
М. А. Пасунькина d, А. В. Кононов a
a Федеральный Центр охраны здоровья животных,
мкр. Юрьевец, Владимир, 600901 Россия
b НИИ Окружающей Среды и Жизнедеятельности, Университет Чарльза Дарвина,
Дарвин, штат Северная территория, 0810 Австралия
c Международный Биотехнологический центр «Генериум»,
Владимирская обл., Петушинский район, пос. Вольгинский, корпус 17, 601125 Россия
d Федеральный Центр охраны здоровья животных,
Симферополь, пос. Комсомольское, ул. Шоссейная, 21А, Республика Крым, 295494 Россия
*e-mail: spriginav@mail.ru
Поступила в редакцию 28.11.2019 г.
После доработки 19.03.2020 г.
Принята к печати 02.05.2020 г.
Представлены данные об активности мокрецов рода Culicoides групп obsoletus и pulicaris
(Diptera: Ceratopogonidae), привлеченных световыми ловушками с УФ-светом, на животновод-
ческих фермах в регионах Российской Федерации с разными климатическими условиями: Смо-
ленской области, Республике Крым и Республике Бурятия. Анализ численности показывает, что
видовой состав и активность в трех изученных регионах сильно различаются. С помощью гене-
тического секвенирования выявлены криптические виды изученных мокрецов.
Ключевые слова: мокрецы, Culicoides, климат, численность
DOI: 10.31857/S1234567806030049
Впервые в России проведены исследования, направленные на изучение особенно-
стей сезонности и активности кровососущих мокрецов рода Culicoides в трех клима-
тически различных регионах: Республике Крым, Республике Бурятия и Смоленской
области. Для изучения использовали световые ловушки с ультрафиолетовым светом,
размещенные внутри и снаружи помещения. Установлено, что мокрецы C. obsoletus/
C. scoticus и C. punctatus доминируют в Смоленской обл., тогда как в Р. Бурятия и
Р. Крым распространены мокрецы C. punctatus и C. newsteadi, соответственно. Пока-
зано, что мокрецы C. obsoletus/C. scoticus в Смоленской обл. в помещении в 4 раза
231
более многочисленны (81 %), чем на открытом воздухе (19 %) (p < 0.05). Мокрецы
С. punctatus в Смоленской области также преобладали в помещениях по сравнению
с мокрецами в пробах, собранных на открытом воздухе (p < 0.05). В Р. Крым мокрецы
C. newsteadi преобладали на открытом воздухе (p < 0.05). В Р. Бурятия доминирующим
видом внутри помещения был C. punctatus, однако сравнительных исследований в от-
ношении активности внутри и снаружи помещения не проводили.
Генетический анализ по гену митохондриальной цитохромоксидазы 1 показал
значительную генетическую вариабельность в пределах группы видов, таких как
C. obsoletus/C. scoticus и C. punctatus. Это свидетельствует о наличии криптических
видов, описание которых в использованных определителях не представлено к настоя-
щему времени.
Одними из наиболее изучаемых насекомых, представляющих интерес с точки
зрения эпизоотологии, являются кровососущие мокрецы рода Culicoides (Purse et al.,
2015). Эти мелкие насекомые, до 3 мм в длину, обильно встречаются в природных зонах
от тундры до тропиков (Sprygin et al., 2014). Кровососущие мокрецы рода Culicoides
являются переносчиками различных вирусных и протозойных заболеваний животных,
нанося экономический урон сельскому хозяйству. Например, сравнительно недавние
вспышки блютанга в Европе были связаны с изменением климата, что в свою очередь
впервые привело к распространению данного заболевания в страны Северной Евро-
пы через кровососущих мокрецов группы obsoletus (Purse et al., 2015). Также выявле-
ние ДНК вируса заразного узелкового дерматита крупного рогатого скота (ЗУД КРС)
в кровососущих мокрецах в Турции (Sevik, Dogan, 2017) подтверждает недооценен-
ную роль эндемичных мокрецов в эпизоотологии трансмиссивных заболеваний сель-
скохозяйственных животных в палеарктическом регионе в условиях изменяющегося
климата (Carpenter et al., 2008).
Российская Федерация занимает обширную часть палеарктического региона, где
представлены различные климатические условия и ландшафты. Наличие лесной под-
стилки и источников воды создают условия для выплода данных насекомых на всей
территории нашей страны. Однако, несмотря на расположение территории Россий-
ской Федерации в северных широтах, здесь уже зарегистрированы такие заболева-
ния крупного рогатого скота как блютанг (Новикова и др., 2015) и ЗУД КРС (Sprygin
et al., 2018), которые, как считалось ранее, ограничены Африканским континентом.
Источником данных инфекций на территории РФ предположительно считают насе-
комых (Пестова и др., 2019). Хотя факт биологической трансмиссии вируса блютанга
разными видами мокрецов доказан (Foxi et al., 2016), в отношении вируса ЗУД вопрос
трансмиссии остается открытым (Пестова и др., 2019). Возможными факторами ри-
ска для распространения ЗУД КРС являются теплый влажный климат и резервуары
воды, что потенциально свидетельствует об энтомологическом факторе трансмиссии.
Более того, существуют эпизоотологические данные о связи между вспышками ЗУД
232
и сезонным наличием большого количества популяций кровососущих членистоногих
в теплое время года (Kahana-Sutin et al., 2017).
Во многих регионах РФ жвачный скот находится на привязном содержании, что,
как предполагают, может защищать животных от укусов мокрецов при наличии сеток
на окнах помещений (Meiswinkel et al., 2008; European Comission (EU), 2012). Однако
эффективность такой защиты может варьироваться в зависимости от климатических
условий. Кроме этого, для различных климатических зон России отсутствуют актуаль-
ные данные о сезонной динамике мокрецов. Такая информация является востребован-
ной и играет важную роль при эпизоотологических исследованиях, например для уста-
новления периода отсутствия лёта мокрецов при планировании торговых операций
с КРС на территории РФ с учетом рисков распространения трансмиссивных инфекций
животных.
Таким образом, цель данного исследования - изучение сезонной активности мо-
крецов рода Culicoides с помощью ловушек с УФ-светом на открытых пространствах
и в животноводческих помещениях в трех климатических зонах РФ, а также оценка
генетического разнообразия отдельных видов по гену митохондриальной цитохромок-
сидазы I.
МАТЕРИАЛ И МЕТОДИКА
Для отбора проб было выбрано по одной точке в трех регионах РФ с различным климатом: на
северо-западе РФ в Смоленской области, деревня Демидово (55.4975715°N, 32.329698°E), на юго-
западе РФ в Р. Крым, деревня Ключи, окрестности Симферополя (56.316060°N, 160.846397°E)
и на востоке РФ в Р. Бурятия, деревня Усть-Киран (50.41334°N, 106.81234°E). Информация
о климате в этих регионах, а также видах животных и природном ландшафте для каждой
фермы представлена в табл. 1. Метеорологические данные, включая температуру снаружи, были
зафиксированы в ночное время, когда производился отлов мокрецов. Все помещения были от-
крыты для лёта мокрецов.
Таблица 1. Краткая характеристика мест отлова
Table 1. Brief site characteristics
Регион
Наличие животных
Растительность
Климат
Смоленская обл.
КРС, собаки
Заболоченная
Континентальный
местность, высокая
климат с теплым
растительность,
летом
смешанный лес
Р. Бурятия
КРС, МРС, собаки
Степная растительность,
Резко
отсутствие открытых
континентальный
источников воды
климат
Р. Крым
КРС, МРС, свиньи,
Степная растительность,
Средиземноморский
птицы
кустарники, наличие
климат
искусственного водоема
233
Сбор насекомых и их идентификация
Отлов мокрецов проводили с помощью ловушек с ультрафиолетовым светом в течение
2015 г. Они функционировали с 18:00 до 8:00, один раз из 7-8 дней в период с мая по октябрь
2015 г. в Смоленской обл. и Р. Бурятия, а также с апреля по октябрь 2015 г. в Р. Крым. Для
одновременного отлова мокрецов внутри помещений и снаружи использовали две ловушки. Все
ловушки были установлены в полутора метрах над землей и на расстоянии 2-6 м от животных.
В Р. Крым были представлены КРС, овцы, козы, свиньи и птицы; в Бурятии - КРС и овцы; в Смо-
ленской обл. - только КРС (табл. 1). Собранных мокрецов охлаждали и консервировали в 70 %
этаноле, затем доставляли в лабораторию для морфологических исследований. Мокрецов иден-
тифицировали по рисунку крыла с помощью морфологического определителя Глуховой В.М.
(1989) и Мирзаевой А.Г. (1989). Так как морфологическая дифференциация по рисунку крыла
между C. obsoletus Meigen и C. scoticus Downes et Kettle затруднена, эти виды определяли как
C. obsoletus/C. scoticus из группы obsoletus, к которой также относится C. chiopterus.
Генетическая идентификация
Для проведения генетического секвенирования использовали локус митохондриальной ци-
тохромоксидазы I (COI) согласно описанному ранее протоколу (Ander et al., 2013). ДНК вы-
деляли с помощью набора DNA mini kit (Qiagen, Германия) согласно инструкции производи-
теля. Секвенирование ДНК проводили с помощью наборов ABI Prism BigDye Terminator v3,
Cycle Sequencing Ready Reaction Kit (Applied Biosystems, США) и генетического анализатора
ABI 3130 (Applied Biosystems, США). Выравнивание полученных нуклеотидных последователь-
ностей было выполнено с помощью алгоритма ClustalW в программе BioEdit с параметрами по
умолчанию (Hall, 1999). Филогенетический анализ был выполнен с использованием алгоритма
Neighbor-joining в программе MEGA 6.06.
Статистика
Для выяснения статистически значимых различий численности мокрецов внутри помеще-
ний и снаружи выборки между собой сравнивали с помощью t-тест Стьюдента.
РЕЗУЛЬТАТЫ
Смоленская область
Всего в этом регионе было поймано 30762 самок C. obsoletus/C. scoticus и 3414 са-
мок C. punctatus. Небольшое количество особей C. grisescens Edwards выявили
в некоторых отловах, произведенных в конце лета. Значительно большее количество
мокрецов, принадлежащих к обеим группам, было поймано внутри помещения по срав-
нению с улицей (p ≤ 0.05) (24925 внутри и 5837 снаружи для C. obsoletus/C. scoticus
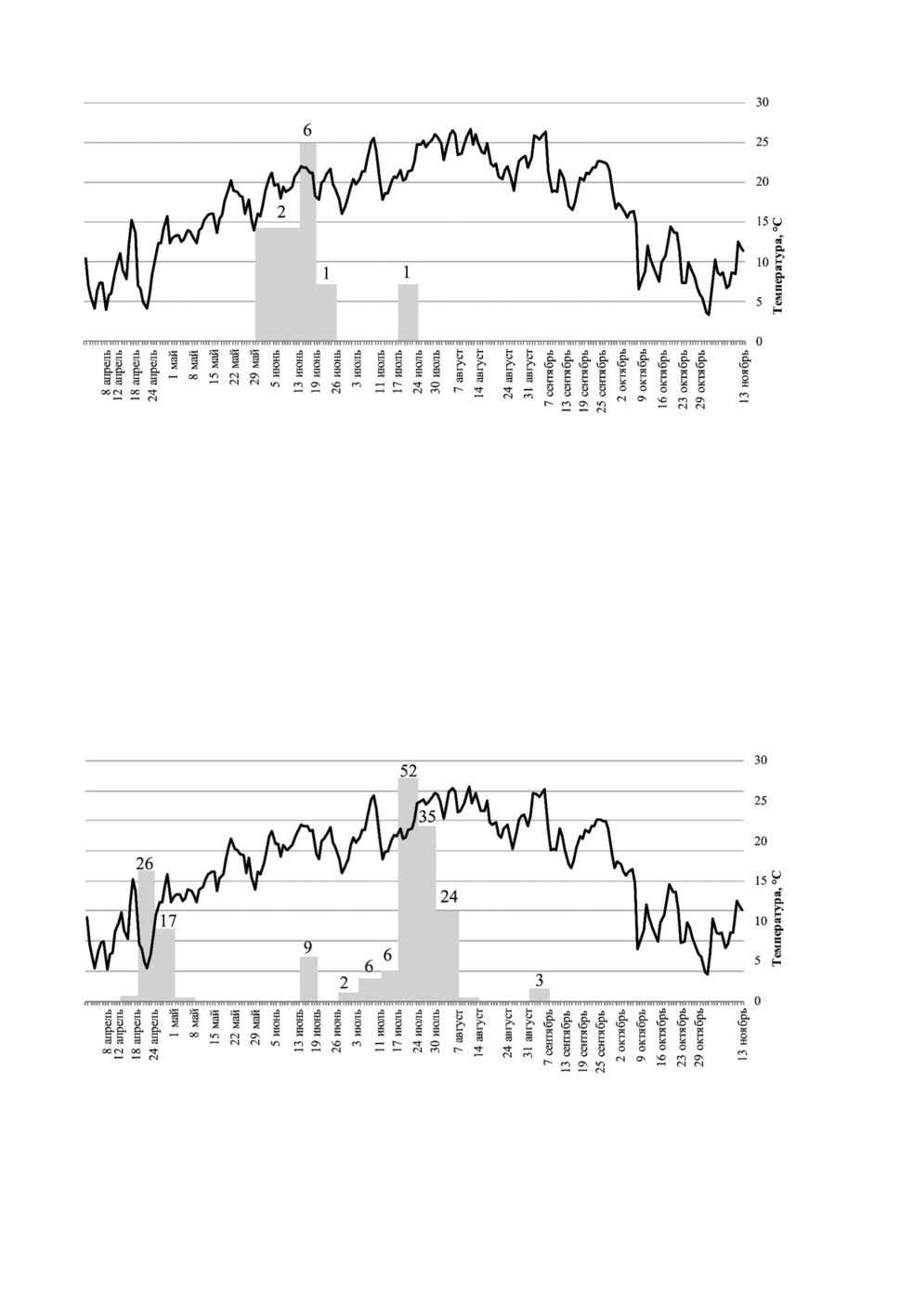
и 2473 внутри и 941 снаружи для мокрецов C. punctatus) (рис. 1-4).
234
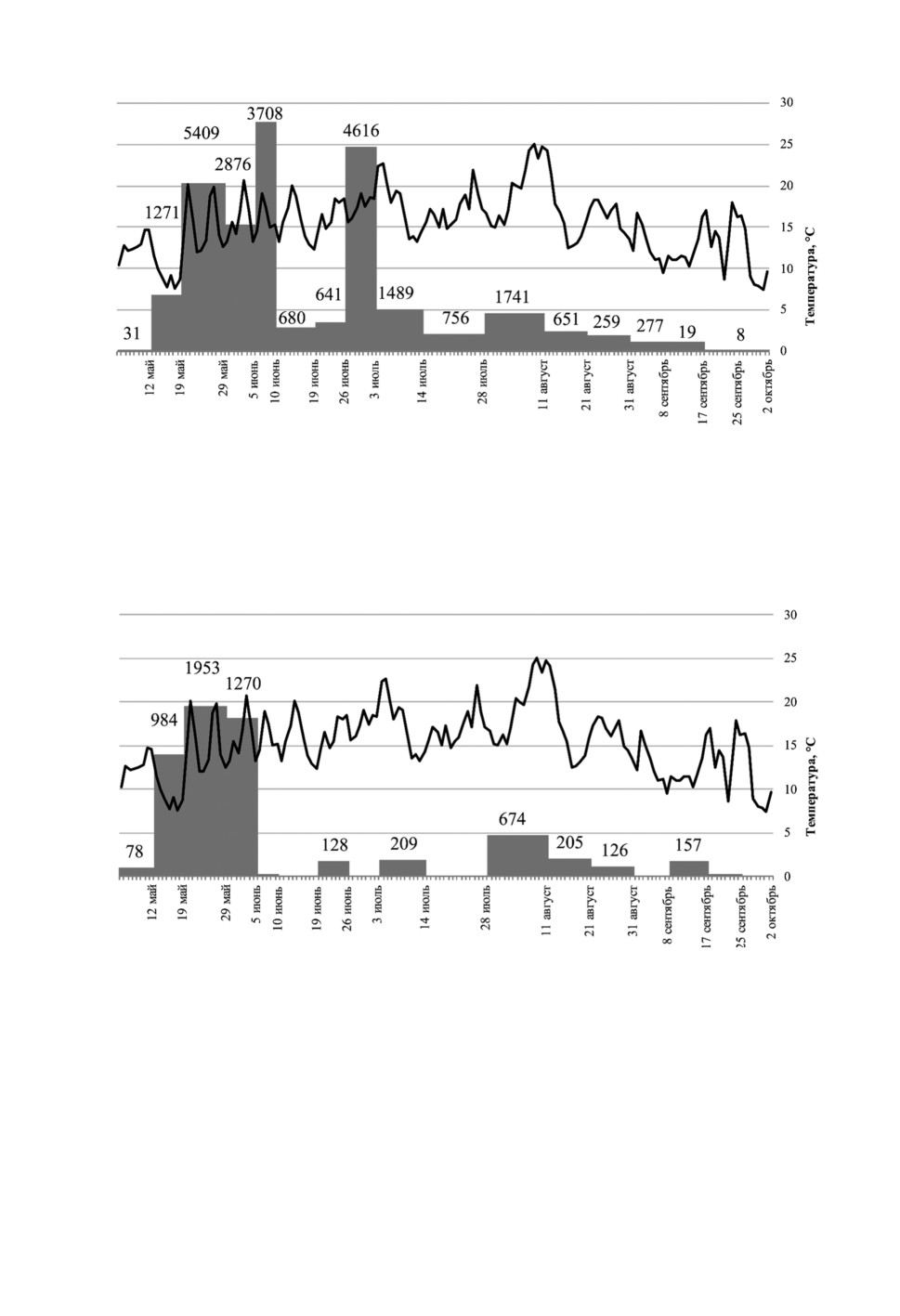
Рисунок. 1. Динамика популяции C. obsoletus/С. scoticus внутри помещения в Смоленской
области. Здесь и далее на рис. 2-9 серые столбики - количество мокрецов в улове, черная
линия - средняя дневная температура.
Figure 1. Diagram showing the abundance of indoor C. obsoletus/С. scoticus midges to outside
temperature in Smolenskaya province. Grey column denotes the number of midges in a single
collection, black line denotes average daily temperature.
Рисунок 2. Динамика популяции мокрецов C. obsoletus/С. scoticus снаружи помещения
в Смоленской области.
Figure 2. Diagram showing the abundance of outdoor C. obsoletus/С. scoticus midges to outside
temperature in Smolenskaya province. Grey column denotes the number of midges in a single
collection, black line denotes average daily temperature.
235
Рисунок 3. Динамика популяции мокрецов C. punctatus внутри помещения в Смоленской
области.
Figure 3. Diagram showing the abundance of indoor C. punctatus midges to outside temperature
in Smolenskaya province. Grey column denotes the number of midges in a single collection,
black line denotes average daily temperature.
Рисунок 4. Динамика популяции мокрецов C. punctatus снаружи помещения в Смоленской
области.
Figure 4. Diagram showing the abundance of outdoor C. punctatus midges to outside temperature in
Smolenskaya province. Grey column denotes the number of midges in a single collection, black line
denotes average daily temperature.
236
В конце мая резко возросло количество мокрецов C. obsoletus/C. scoticus как
в помещениях, так и на открытом пространстве, и так же резко уменьшилось в середине
июня. Численность мокрецов в помещении достигла второго пика 7 июля, однако это
не отразилось на результатах отлова снаружи помещения. Небольшой пик присут-
ствовал в обоих уловах 11 августа, после чего количество постепенно уменьшалось
до нуля к середине октября.
В конце июня число мокрецов C. punctatus как внутри помещений, так и снаружи
резко сократилось, а затем резко выросло в конце июля и снова сократилось в конце
августа и к середине октября достигло нуля.
Республика Крым
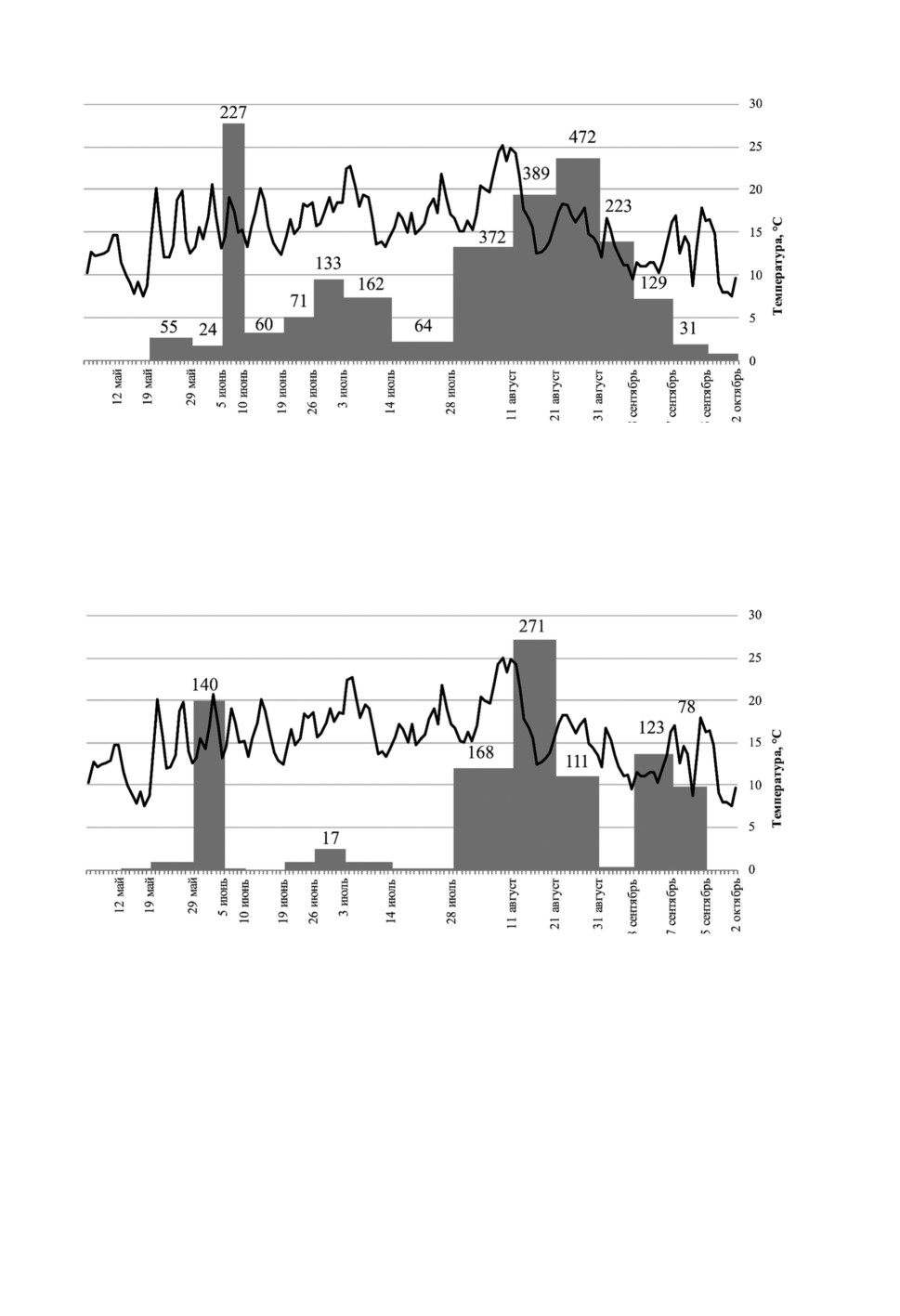
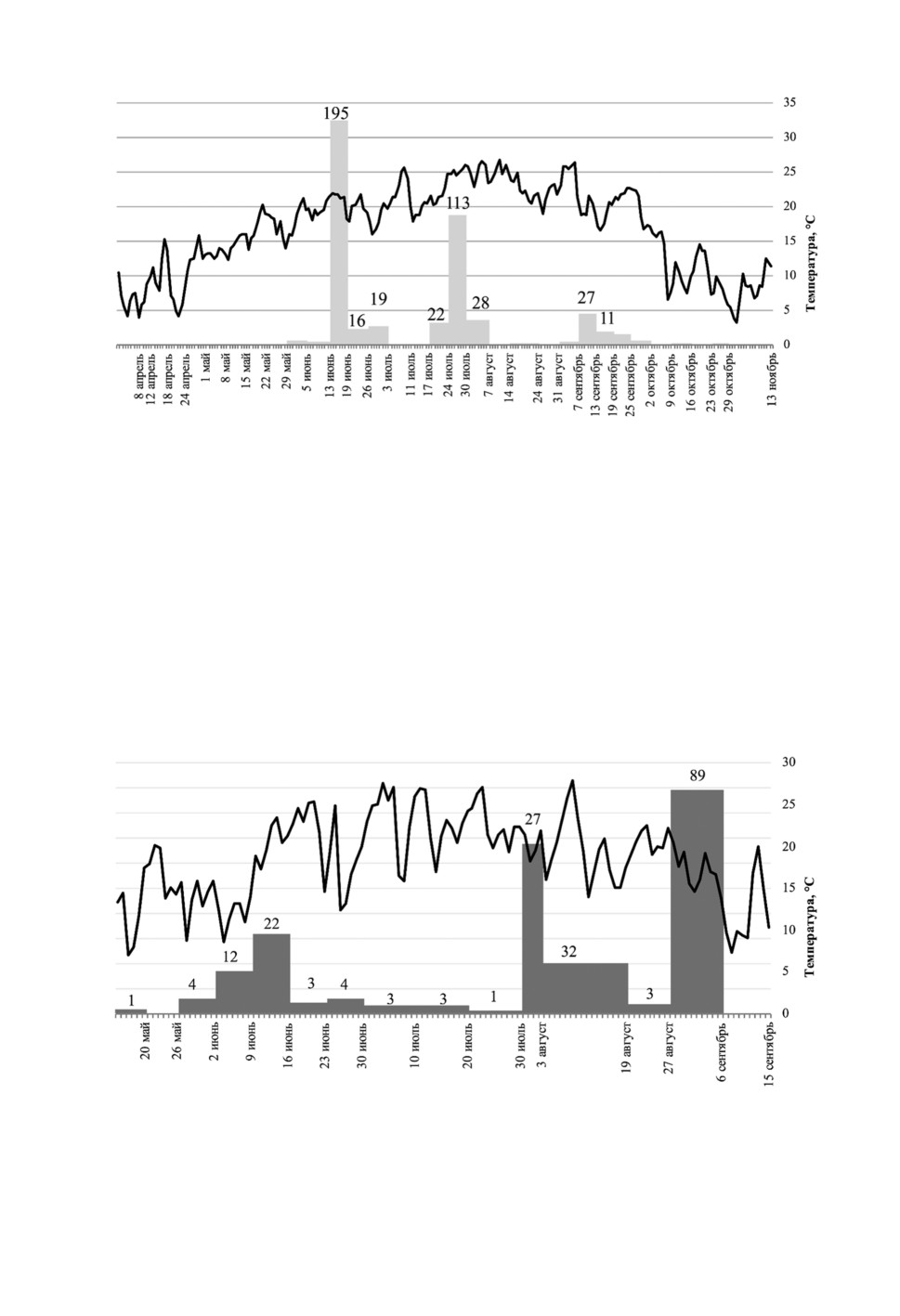
Всего в Р. Крым были отловлены 44 самки C. obsoletus/C. scoticus и 653 самок
C. newsteadi. Численность мокрецов C. obsoletus/C. scoticus была значительно выше
в помещении по сравнению с улицей (p ≤ 0.05). Несмотря на небольшое количество
всех отловленных насекомых, численность мокрецов C. newsteadi была выше на от-
крытом воздухе, чем в помещении (p ≤ 0.05). Общее количество мокрецов C. obsoletus/
C. scoticus было небольшим: впервые они появились в середине апреля, затем попу-
ляция увеличилась как внутри, так и снаружи помещений с середины-конца июня до
начала августа, после чего насекомые в уловах мокрецы отсутствовали (рис. 3). Число
особей C. newsteadi превышало число особей C. obsoletus/C. scoticus, но динамикой
лёта эти группы не различались: начало приходилось на конец апреля, максимум
отмечен с конца июня до начала августа и лёт проявлялся спорадически до начала
октября (рис. 5-8).
Рисунок 5. Динамика популяции мокрецов C. obsoletus/С. scoticus внутри помещения
в Р. Крым.
Figure 5. Diagram showing the abundance of indoor C. obsoletus/С. scoticus midges to outside
temperature in Crimea. Grey column denotes the number of midges in a single collection,
black line denotes average daily temperature.
237
Рисунок 6. Динамика популяции мокрецов C. obsoletus/С. scoticus снаружи помещения
в Р. Крым.
Figure 6. Diagram showing the abundance of outdoor C. obsoletus/С. scoticus midges to outside
temperature in Crimea. Grey column denotes the number of midges in a single collection,
black line denotes average daily temperature.
Рисунок 7. Динамика популяции мокрецов C. newsteadi внутри помещения в Р. Крым.
Figure 7. Diagram showing the abundance of indoor C. newsteadi midges to outside temperature
in Crimea. Grey column denotes the number of midges in a single collection, black line denotes
average daily temperature.
238
Рисунок 8. Динамика популяции мокрецов C. newsteadi снаружи помещения в Р. Крым.
Figure 8. Diagram showing the abundance of outdoor C. newsteadi midges to outside temperature
in Crimea. Grey column denotes the number of midges in a single collection, black line denotes
average daily temperature.
Республика Бурятия
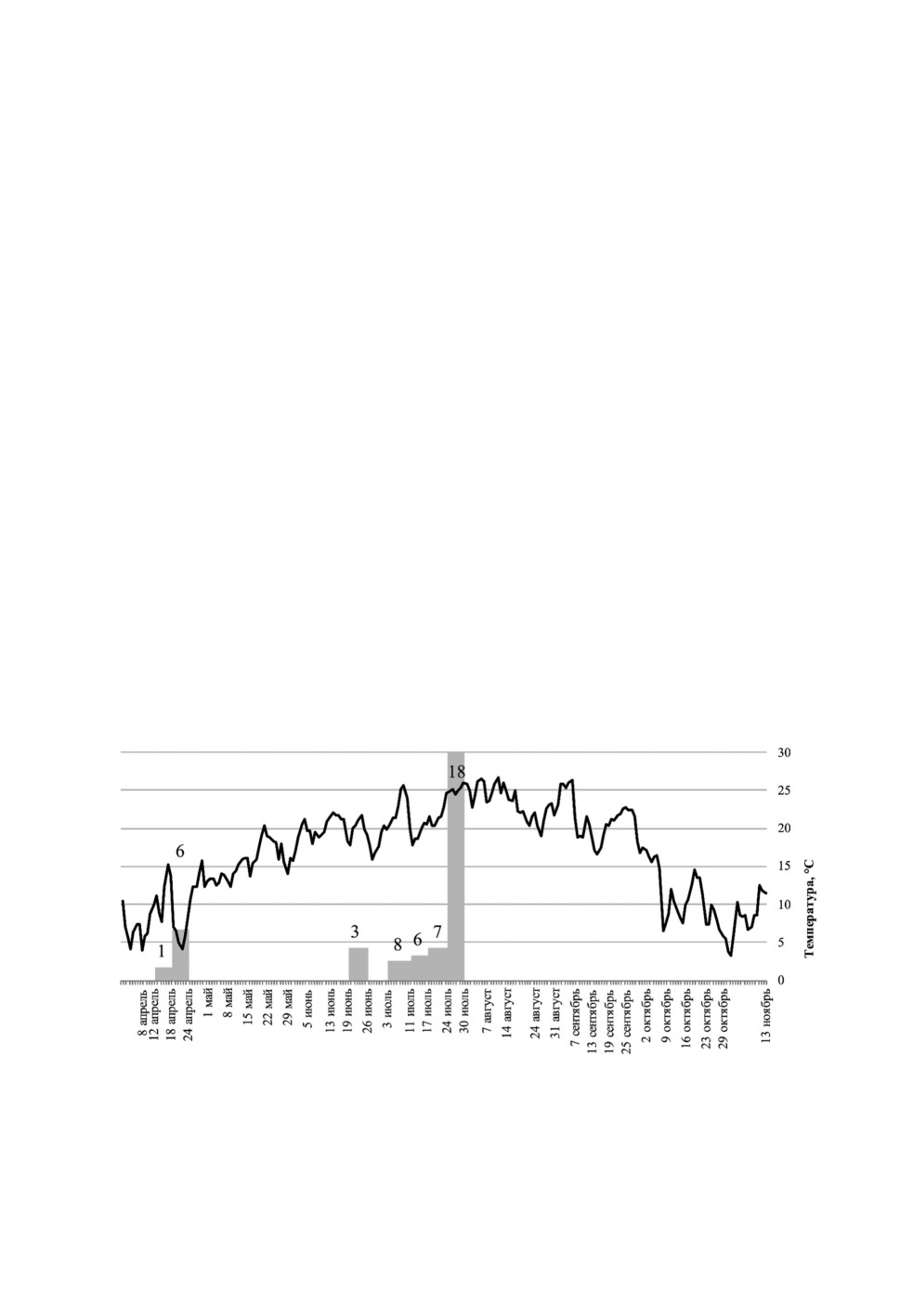
В улове отсутствовали мокрецы C. obsoletus/C. scoticus и C. chiopterus.. Мокрецы
C. punctatus впервые появились в середине мая, их численность постепенно увели-
чивалась и достигла пика в середине июня. Затем произошло снижение численности,
и этот показатель оставался низким. В начале августа сформировался второй, более
высокий пик численности, который отмечался до середины сентября, после чего чис-
ленность быстро уменьшилась до нуля (рис. 9).
Рисунок 9. Динамика популяции мокрецов C. punctatus внутри помещения в Р. Бурятия.
Figure 9. Diagram showing the abundance of indoor C. punctatus midges to outside temperature
in Buryatiya. Grey column denotes the number of midges in a single collection, black line denotes
average daily temperature.
239
Секвенирование мокрецов по локусу COI
Генетический анализ мокрецов, идентифицированных как C. obsoletus/C. scoticus,
отловленных в Смоленской области и Р. Крым, показал, что популяция C. obsoletus
представлена генетически однородными особями - криптическими видами, как и
C. scoticus (рис. 10). Различия составили менее 2 %.
C. punctatus представлен рядом криптических видов. Одна группа C. punctatus
из Смоленской области на дендрограмме расположена наиболее близко к видам
C. impunctatus, C. lupiraris. Вторая группа расположена рядом с C. punctatus из Ис-
пании и Дании. C. punctatus из Р. Бурятии образовали две группы: одна генетически
идентична C. punctatus из Румынии, а вторая образует отдельную кладу (рис. 10).
Таким образом, различия в данной группе составляют более 10 %.
C. newsteadi из Р. Крым представлен одной популяцией, которая группируется как
отдельная клада к особям из Канады и Дании. C. grisescence, отловленные в Смолен-
ской области, группируются вместе с особями C. grisescence из Скандинавии (рис. 10).
ОБСУЖДЕНИЕ
Климат, место обитания и наличие хозяев являются основными факторами, влияю-
щими на сезонную динамику популяции Culicoides (Федорова и др., 2017). Из них
климат, вероятно, оказывает наибольший эффект на популяцию, поскольку регулирует
физиологию мокрецов и влияет как на местообитание и выплод личинок, так и на на-
личие хозяев-прокормителей. Географическое и сезонное изменение климатических
условий могут сильно повлиять на разнообразие и численность мокрецов и, следова-
тельно, эпидемиологию болезней, переносимых Culicoides (Jung et al., 2016).
Например, ареал распространения вируса блютанга расширился до стран Северной
Европы, ранее считавшимися свободными от переносчиков (Carpenter et al., 2009).
Так как механизмы перезимовки вируса блютанга неясны, то это, в сочетании со
способностью вируса бессимптомно циркулировать в стадах КРС (St. George, 1985),
вызывает опасение в связи с дальнейшим проникновением вируса в палеарктический
регион и северные районы Европы и России. Более того, происходит беспрецедентное
распространение ЗУД КРС по территории РФ с 2015 г. Пики вспышек этого заболе-
вания приходятся на теплые месяцы (Sprygin et al., 2018) и согласуются с пиками,
представленными в данной работе (рис. 1-4), что свидетельствует о необходимости
детального изучения данных насекомых как потенциальных векторов трансграничных
инфекций. Поскольку векторная трансмиссия вируса ЗУД КРС механическая (т. е. раз-
множения вируса в организме членистоногих не происходит), то именно из-за повсе-
местной встречаемости и обилия данной группы насекомых необходимы дальнейшие
исследования в этом направлении (Пестова и др., 2019). Наличие энтомологических
данных о видовом разнообразии, векторной компетентности, численности, местах раз-
множения, лёта и хозяевах-прокормителях позволили бы более точно прогнозировать
риски заноса и распространения данных заболеваний.
240
Рисунок 10. Дендрограмма, отражающая филогенетическое родство мокрецов рода Culicoides
по гену COI, отловленных в данной работе в трех климатически различных регионах РФ.
Изученные особи мокрецов отмечены черным кружком.
Figure 10. Tree showing the phylogenetic relatedness of Culicoides midges based on the COI locus,
collected in three climatically diverse regions of Russia. Midges sequenced at COI are marked with
a black circle.
241
В нашей работе мы оценили активность Culicoides на фермах в Смоленской об-
ласти и Р. Бурятии и на ферме в Р. Крым в течение одного сезона в 2015 г. Эта ра-
бота представляет собой первое исследование сезонного обилия мокрецов в данных
климатически различных регионах России при использовании ловушек с УФ-светом.
Во всех исследованных регионах представители групп obsoletus (C. obsoletus/
C. scoticus) и pulicaris (C. punctatus, C. newsteadi) составляли почти всю фауну мокре-
цов, следовательно, эти виды являются доминирующими на этих территориях. Важно
отметить, что представители обеих этих групп являются переносчиками вируса блю-
танга, болезни Шмалленберг и потенциально ЗУД КРС (Meiswinkel et al., 2004; Elbers
et al., 2013; Sevik, Dogan, 2017). Таксономия обеих групп стала объектом тщательного
изучения в последнее время (Lassen et al., 2012; Mathieu et al., 2007; Nielsen et al.,
2015; Pages et al., 2009; Talavera et al., 2018), но большая часть этих исследований
была ограничена европейскими популяциями. Обе эти группы мокрецов встречаются
и на востоке Палеарктического региона — в Японии (Arnaud et al., 1956) и в Неар-
ктическом регионе (Wirth et al., 1985) и, по крайней мере, у одного вида C. punctatus
Meigen европейская и азиатская популяции значительно различаются по митохондри-
альной цитохромоксидазе I (Matsumoto et al., 2009). В нашей работе как в Р. Бурятия,
так и в Смоленской области выявлены многочисленные генетически различные виды
C. punctatus, что требует фундаментальных генетических и морфологических иссле-
дований для придания данным видам таксономического статуса (рис. 10). До тех пор,
пока не будет определен таксономический статус этих широко распространенных
видов, затруднительно говорить об их роли в эпизоотологии арбовирусных инфекций.
Наибольшая численность мокрецов C. obsoletus/C. scoticus установлена на ферме
в Смоленской области: здесь экземпляров обеих групп в 5-150 раз больше, чем в Кры-
му и Бурятии. Размер популяции является важным компонентом в оценке векторной
компетентности (Gerry et al., 2001), поэтому, если это соотношение будет сохраняться,
то Смоленская область имеет более высокий риск заноса и распространения транс-
миссивного заболевания с мокрецами, чем два других исследованных региона. Это
подтверждается двумя вспышками блютанга, зарегистрированными в Смоленской обл.
в 2012 г. и в Польше в 2014 г. (Новикова и др., 2015). Более того, учитывая механиче-
скую природу трансмиссии вируса ЗУД КРС, именно обилие вектора и, следовательно,
частота укусов и смена хозяев до полного насыщения будут являться главным фактором
повышения риска в отношении данного заболевания. Однако учитывая генетическую
вариабельность - наличие криптических видов, также необходимо проявлять осторож-
ность в интерпретации морфологических данных (рис. 10)
На ферме в Смоленской обл. C. obsoletus/C. scoticus была в 4 раза более много-
численна в помещении (81 %), чем на открытом воздухе (19 %), что, согласуется
с ранее проведенными исследованиями в Европе (Meiswinkel et al., 2008). В двух
других регионах было собрано недостаточное для статистически значимых сравнений
количество особей C. obsoletus/C. scoticus. Как в Смоленской обл., так и в Р. Бурятия
242
большее количество особей C. punctatus в пробах из помещений по сравнению с про-
бами, собранными на открытом воздухе, противоречат выводам Мейсвинкел и соавт.
(Meiswinkel et al., 2008) для Нидерландов. Виды, обитающие в Смоленской обл. и
Бурятии, генетически различаются внутри популяции в регионе, а также отличаются
от видов в Нидерландах или Крыму при внешне аналогичной морфологии, т. е. явля-
ются криптическими видами. Это может служить объяснением различий в сезонной
активности.
Интересно отметить, что в Р. Крым доминируют C. newsteadi, тогда как в Р. Бурятия
и Смоленской области доминируют C. punctatus и его криптические виды (рис. 10).
Относительно низкая численность C. obsoletus/C. scoticus в Р. Крым отличается
от наших результатов из Смоленской области и от данных из Европы (Baldet et al.,
2008; Carpenter et al., 2008), где виды из этой группы доминируют в сборах, сделанных
внутри помещения. Более того, в Ю. Корее (Kim et al., 2012; 2014; 2015) и Японии
(Yanase et al., 2005; 2011) выявить мокрецов группы obsoletus не удалось, что может
объяснить их отсутствие в сборах в Р. Бурятия.
Еженедельный режим работы ловушки, используемый в этом исследовании, за-
трудняет интерпретацию пиков на рис. 1-8, поскольку неясно, является ли попадание
в ловушки большого числа мокрецов следствием наступления благоприятных условий
для лёта (повышенные температуры ночью, повышенная влажность, низкая скорость
ветра и др) или скученности животных. Однако пики на графиках количества пой-
манных мокрецов внутри и снаружи помещений, длительностью более одной недели,
могут указывать на общую тенденцию в динамике численности популяции, и это на-
блюдалось для обеих групп во всех регионах, за исключением C. obsoletus/C. scoticus,
которая не была зарегистрирована в Р. Бурятия. Первый пик сезона может означать
появление либо взрослых насекомых после перезимовки личинок, либо первого по-
коления в этом сезоне. Второй пик, наблюдаемый для видов C. punctatus в Смоленской
области и C. newsteadi в Р. Крым - через 5-6 недель после первого пика, возможно,
отражает вылет имаго, выведенных от предыдущего поколения, и позволяет объяснить
наблюдаемую периодичность появления новых поколений в 5-6 недель. К сожалению,
пики в популяциях C. obsoletus/C. scoticus не так четко определены и оценку периода
генерации с такой же уверенностью не удается сделать.
В этой статье представлены первые данные о мокрецах Culicoides на фермах
в Р. Крым и Р. Бурятия, полученные с помощью световых ловушек. Анализ числен-
ности показывает, что видовой состав и активность в трех изученных регионах сильно
различаются, поэтому для более полного изучения потенциальной роли мокрецов
в России требуются фундаментальные исследования криптических видов на гене-
тическом уровне для придания им официального таксономического статуса. Кроме
того, для исследований, которые должны постоянно (рутинно) проводиться во всех
регионах страны, необходимо создание прочной таксономической базы. Определение
активного сезона лёта каждого вида при проведении отлова в течение года и корреляция
243
с климатическими условиями позволят прогнозировать периоды, когда мокрецы рода
Culicoides могут служить потенциальными переносчиками особо опасных вирусных
заболеваний КРС.
Благодарности
Работа выполнена при финансовой поддержке ФГБУ «ВНИИЗЖ».
СПИСОК ЛИТЕРАТУРЫ
Глухова В.М. 1989. Кровососущие мокрецы родов Culicoides и Forcipomyia (Ceratopogonidae). Ленинград:
Наука, 408 с.
Мирзаева А.Г. 1989. Кровососущие мокрецы Сибири и Дальнего Востока. Новосибирск: Наука, 231 с.
Новикова М.Б., Сидлик М.В., Журавлева В.А., Кольцов А.Ю., Вялых И.В., Панферова А.В., Куриннов
В.В. 2015. Изучение инфицированности крупного и мелкого рогатого скота вирусом блютанга 14-го
серотипа в Смоленской области. Ветеринария (2): 17-23.
Пестова Я.Е., Кононов А.В., Спрыгин А.В. 2019. Энтомологические аспекты эпизоотологии заразного
узелкового дерматита крупного рогатого скота. Ветеринария сегодня (1): 16-21.
Фёдорова О.А., Хлызова Т.А., Сивкова Е.И., Савчук Т.Е. 2017. Сроки лёта кровососущих мокрецов (Diptera,
Ceratopogonidae) в подзоне осиново-берёзовых лесов юга Тюменской области. Вестник мясного
скотоводства 1 (97): 141-145.
Ander M., Troell K., Chirico J. 2013. Barcoding of biting midges in the genus Culicoides: a tool for species
determination. Medical and Veterinary Entomology 27(3): 323-331.
Arnaud P. 1956. The heleid genus Culicoides in Japan, Korea and Ryukyu Islands (Insecta: Diptera). Microentomotogy
21: 84-207.
Baldet T., Delecolle J.C., Cetre-Sossah C., Mathieu B., Meiswinkel R., Gerbier G. 2008. Indoor activity of Culicoides
associated with livestock in the bluetongue virus (BTV) affected region of northern France during autumn
2006. Preventive Veterinary Medicine 87 (1-2): 84-97.
Carpenter S., Mellor P.S., Torr S.J. 2008. Control techniques for Culicoides biting midges and their application in the
U.K. and northwestern Palaearctic. Medical and Veterinary Entomology 22 (3): 175-187.
Carpenter Simon, Wilson A., Mellor P.S. 2009. Culicoides and the emergence of bluetongue virus in northern
Europe. Trends in Microbiology 17 (4): 172-178.
Elbers A.R.W., Meiswinkel R., van Weezep E., Marianne M. Sloet van Oldruitenborgh-Oosterbaan M.M., Engbert
A.K. 2013. Schmallenberg virus in Culicoides spp. biting midges, the Netherlands, 2011. Emerging Infectious
Diseases 19(1): 106-109.
European Commission (EU) 2012. Vector Protected Establishments for bluetongue: laid down in Annex II of
Commission Regulation (EC) No 1266/2007 as amended by Commission Regulation (EC) No 456/2012 of
food/files/animals/docs/ad_control-measures_bt_guidance_vpe_7068_2012.pdf (6 мая 2020)
Foxi C., Delrio G., Falchi G., Marche M.G., Satta G., Ruiu L. 2016. Role of different Culicoides vectors (Diptera:
Ceratopogonidae) in bluetongue virus transmission and overwintering in Sardinia (Italy). Parasites & Vectors
9 (1): 440.
Gerry A.C., Mullens B.A., Maclachlan N.J., Mecham J.O. 2001. Seasonal Transmission of Bluetongue Virus by
Culicoides sonorensis (Diptera: Ceratopogonidae) at a Southern California Dairy and Evaluation of Vectorial
Capacity as a Predictor of Bluetongue Virus Transmission. Journal of Medical Entomology 38 (2): 197-209.
Hall T.A. 1999 BioEdit: A User-Friendly Biological Sequence Alignment Editor and Analysis Program for Windows
95/98/NT. Nucleic Acids Symposium Series 41: 95-98.
Jung J.-M., Lee W.-H., Jung S. 2016. Insect distribution in response to climate change based on a model: Review of
function and use of CLIMEX. Entomological Research 46 (4): 223-235.
244
Kahana-Sutin E., Klement E., Lensky I., Gottlieb Y. 2017. High relative abundance of the stable fly Stomoxys
calcitrans is associated with lumpy skin disease outbreaks in Israeli dairy farms. Medical and Veterinary
Entomology 31 (2): 150-160.
Kim H.C., Bellis G.A., Kim M.-S., Chong S.-T., Lee D.-K., Park J.-Y., Yeh J.-Y, Klein T.A. 2012. Seasonal
Abundance of Biting Midges, Culicoides spp. (Diptera: Ceratopogonidae), Collected at Cowsheds in the
Southern Part of the Republic of Korea. The Korean Journal of Parasitology 50 (2): 127-131.
Kim H.C., Bellis G.A., Kim M.-S., Klein T.A., Chong S.-T., Park J.-Y. 2014. Seasonal Abundance of Culicoides
(Diptera: Ceratopogonidae) Collected by Mosquito Magnet® in Northern Gyeonggi-do (Province), Korea.
The Korean Journal of Parasitology 52 (1): 57-62.
Kim H.C., Bellis G.A., Kim M.-S., Klein T.A., Gopurenko D., Cai D.-C., Seo H.-J., Cho I.-S., Park J.-Y. 2015.
Species Diversity and Seasonal Distribution of Culicoides spp. (Diptera: Ceratopogonidae) in Jeju-do,
Republic of Korea. The Korean Journal of Parasitology 53 (4): 501-506.
Lassen S.B., Nielsen S.A., Skovgard H., Kristensen M. 2012. Molecular differentiation of Culicoides biting midges
(Diptera: Ceratopogonidae) from the subgenus Culicoides Latreille in Denmark. Parasitology Research 110
(5): 1765-1771.
Mathieu B., Perrin A., Baldet T., Delecolle J.-C., Albina E., Cetre-Sossah C. 2007. Molecular Identification of
Western European Species of obsoletus Complex (Diptera: Ceratopogonidae) by an Internal Transcribed
Spacer-1 rDNA Multiplex Polymerase Chain Reaction Assay. Journal of Medical Entomology 44 (6): 1019-
1025.
Matsumoto Y., Yanase T., Tsuda T., Noda H. 2009. Species-specific mitochondrial gene rearrangements in biting
midges and vector species identification. Medical and Veterinary Entomology 23 (1): 47-55.
Meiswinkel R., Goffredo M., Leijs P., Conte A. 2008. The Culicoides ‘snapshot’: a novel approach used to assess
vector densities widely and rapidly during the 2006 outbreak of bluetongue (BT) in The Netherlands.
Preventive Veterinary Medicine 87 (1-2): 98-118.
Meiswinkel R., Gomulski L. M., Delecolle J.C., Goffredo M., Gasperi G. 2004. The taxonomy of Culicoides vector
complexes - unfinished business. Veterinaria Italiana 40 (3): 151-159.
Nielsen S., Kristensen M., Pape T. 2015. Three new Scandinavian species of Culicoides (Culicoides): C. boyi sp.
nov., C. selandicus sp. nov. and C. kalix sp. nov. (Diptera: Ceratopogonidae). Biodiversity Data Journal 3
e5823.
Pages N., Munoz-Munoz F., Talavera S., Sarto V., Lorca C., Nunez J.I. 2009. Identification of cryptic species of
Culicoides (Diptera: Ceratopogonidae) in the subgenus Culicoides and development of species-specific PCR
assays based on barcode regions. Veterinary Parasitology 165 (3-4): 298-310.
Purse B.V., Carpenter S., Venter G.J., Bellis G., Mullens B.A. 2015. Bionomics of temperate and tropical Culicoides
midges: knowledge gaps and consequences for transmission of Culicoides-borne viruses. Annual Review of
Entomology 60: 373-392.
Sevik M., Dogan M. 2017. Epidemiological and Molecular Studies on Lumpy Skin Disease Outbreaks in Turkey
during 2014-2015. Transboundary and Emerging Diseases 64 (4): 1268-1279.
Sprygin A., Artyuchova E., Babin Y., Prutnikov P., Kostrova E., Byadovskaya O., Kononov A. 2018. Epidemiological
characterization of lumpy skin disease outbreaks in Russia in 2016. Transboundary and Emerging Diseases
65 (6): 1514-1521.
Sprygin A.V., Fiodorova O.A., Babin Y.Y., Elatkin N.P., Mathieu B., England M.E., Kononov A.V. 2014. Culicoides
biting midges (Diptera, Ceratopogonidae) in various climatic zones of Russia and adjacent lands. Journal of
Vector Ecology: Journal of the Society for Vector Ecology 39 (2): 306-315.
St. George T.D. 1985. The search for bluetongue viruses in Australia. Bluetongue and related orbiviruses. In: Barber
T. L., Jochim M. M. (eds). Bluetongue and related orbiviruses. New York, Alan R Liss Inc., 295-305.
Talavera S., Munoz-Munoz F., Verdun M., Pujol N., Pages N. 2018. Revealing potential bridge vectors for BTV and
SBV: a study on Culicoides blood feeding preferences in natural ecosystems in Spain. Medical and Veterinary
Entomology 32 (1): 35-40.
245
Wirth W.W., Dyce A., Peterson B.V. 1985. An Atlas of Wing Photographs: With a Summary of the Numerical
Characters of the Nearctic Species of Culicoides (Diptera: Ceratopogonidae). American Entomological
Institute 22: 1-46.
Yanase T., Kato T., Kubo T., Yoshida K., Ohashi S., Yamakawa M., Miura Y., Tsuda T. 2005. Isolation of bovine
arboviruses from Culicoides biting midges (Diptera: Ceratopogonidae) in southern Japan: 1985-2002.
Journal of Medical Entomology 42 (1): 63-67.
Yanase T., Hirata M., Matsumori Y., Matsumura M., Kato T., Shirafuji H., Yamakawa M., Hayama Y., Tsutsui T.
2011. Detection of Culicoides brevitarsis Activity in Kyushu. Journal of Veterinary Medical Science 73 (12):
1649-1652.
SEASONAL DIVERSITY OF BITING MIDGES,
CULICOIDES SPP. (DIPTERA: CERATOPOGONIDAE),
COLLECTED IN CLIMATICALLY DIFFERENT REGIONS
OF THE RUSSIAN FEDERATION
A. V. Sprygin, G. A. Bellis, V. I. Pavelko, M. A. Pasun'kina, A. V. Kononov.
Keywords: midges, Culicoides, climate, abundance
Summary
The territory of the Russian Federation harbors a wide range of habitats with different breeding
site conditions for arthropods across its territory. Many geographical regions have never been
entomologically studied, which leaves uncertainty as to epidemiological risks should a vector-borne
diseases occur there. In this paper for the first time the seasonal indoor and outdoor activities of farm-
associated Culicoides biting midges in three climatically diverse regions of Russia are examined:
Crimea (South), Buryatiya republic (Eastern Siberia) and Smolenskaya province (Central Russia). The
results indicate that species composition and abundance differ greatly in the three provinces due to
temperature and moisture availability. COI barcoding suggests a great genetic variation among the
morphologically identified Culicoides species.
246