ПАРАЗИТОЛОГИЯ, 2020, том 54, № 4, с. 285-297.
УДК 57.083.18:579.841.95:576.895.42
оценка возможной роли иксодовых клещей
в природных очагах туляремии лесостепной зоны
Европейской части России
© 2020 г. М. И. Кормилицынаa, *, Э. И. Коренбергa,
Т. В. Михайловаa, Ю. В. Ковалевскийa, А. В. Амирханянa,
Д. В. Транквилевскийb, Б. В. Ромашовc,
Д. А. Квасовd, А. М. Саломатинаe
a ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии
им. Н.Ф. Гамалеи» Министерства Здравоохранения Российской Федерации,
ул. Гамалеи, 18, Москва, 123098 Россия
b ФБУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора,
Варшавское ш., 19А, Москва, 117105 Россия
c ФГБУ «Воронежский государственный природный биосферный заповедник
имени В.М. Пескова»,
Воронеж, 394080 Россия
d ФБУЗ «Центр гигиены и эпидемиологии в Воронежской области»,
ул. Космонавтов, 21, Воронеж, 394038 Россия
e Центр профилактики,
ул. Мира, 3А, оф.1, Нововоронеж, 396070 Россия
* e-mail: mkormilits@mail.ru
Поступила в редакцию 12.03.2020 г.
После доработки 25.04.2020 г.
Принята к печати 12.06.2020 г.
Оценена возможная роль взрослых клещей Dermacentor reticulatus (Fabricius, 1894), D. mar-
ginatus (Sulzer, 1776) и Ixodes ricinus (L., 1758), собранных с растительности в апреле-мае 2018
и 2019 г., в природных очагах туляремии лесного и пойменно-долинного типа в лесостепной
зоне Воронежской области.
Ключевые слова: природная очаговость, возбудитель туляремии, типы очагов, иксодовые
клещи
DOI: 10.31857/S1234567806040021
285
Природным очагам туляремии свойственна, как известно (Олсуфьев, Дунаева, 1970),
большая устойчивость. В этом отношении показательна территория Воронежской об-
ласти, где были проведены наши исследования. Ее северная часть занята лесостепными
ландшафтами, а южная часть - разнотравной типчаковой степью. Туляремия известна
в этой области с 1925 г. Даже после массовой вакцинации населения противотуляре-
мийной вакциной со второй половины 40-х годов постоянно фиксировали споради-
ческие случаи этой инфекции (Сильченко, 1961). Продолжающаяся циркуляция воз-
будителя туляремии (Francisella tularensis McCoy et Chapin) в природных очагах была
неоднократно подтверждена выявлением в последние годы его антигена или антител
у мелких млекопитающих - резервуарных хозяев микроба, а также спорадическими
заболеваниями людей в ряде административных регионов (Мещерякова и др., 2015;
Михайлова и др., 2014, 2015, 2017; Транквилевский и др., 2014, 2015, 2016; Кудрявцева
и др., 2017, 2018, 2019, 2020). Эти исследования свидетельствуют о том, что в раз-
личных ландшафтных условиях Воронежской области существуют природные очаги
туляремии лесного, пойменно-долинного и, возможно, луго-полевого типа согласно
типизации Олсуфьева (1947).
Помимо возбудителя туляремии, к роду Francisella относятся также в высокой
степени сходные с ним по нуклеотидной последовательности гена 16S рДНК так на-
зываемые Francisella-like endosymbionts (FLE), которые обнаружены за пределами
России у иксодовых клещей нескольких родов, включая Dermacentor и Ixodes (Na-
tional Center for Biotechnology Information, 2020). Различные виды этих родов до-
вольно широко распространены на территории России и могут иметь существенное
значение в эпизоотологии туляремии (Олсуфьев, Дунаева, 1970; Филиппова, 2011).
Однако сведения о наличии или отсутствии FLE у иксодовых клещей фауны нашей
страны пока отсутствуют. Между тем такие данные чрезвычайно важны как для по-
нимания филогении туляремийного микроба, так и для совершенствования методов
его лабораторной идентификации.
В связи с изложенным цель нашего исследования состоит в том, чтобы на примере
территории Воронежской области оценить возможную роль иксодовых клещей в цирку-
ляции возбудителя туляремии и наличия у них FLE в природных очагах, характерных
для лесостепной зоны европейской части центральной России.
Материалы и методы
В апреле-мае 2018 и 2019 г. в Воронежской области на участках четырех исследуемых при-
родных очагов туляремии, где ранее лабораторными методами был выявлен контакт мелких мле-
286
копитающих с возбудителем этой инфекции (Михайлова и др., 2014, 2015, 2017; Транквилевский
и др., 2014, 2017), с растительности на флаг были собраны взрослые голодные иксодовые клещи.
В табл. 1 приведены условные номера и географические координаты очагов. Три из них (№ 1-3)
находятся в северной, лесостепной части области, а № 4 - в южной, степной. При этом очаг № 1
расположен в Верхнехавском р-не, на территории смешанного хвойно-лиственного лесного мас-
сива вблизи с. Большая Приваловка и Биосферного природного заповедника им. В.М. Пескова;
очаг № 2 - на границе Каширского и Лискинского районов вблизи г. Нововоронеж, в пойменных
сырых биотопах левобережья р. Дон, включая заросли вокруг стариц, а также прибрежные за-
ливные луга, богатые травянистой растительностью; очаг № 3 - в Новохоперском р-не на лево-
бережья р. Савала, в пойменных слабо повышенных по отношению к урезу воды влажных био-
топах сходных по характеру растительности с условиями очага № 2; очаг № 4 - в Богучарском
р-не на левобережье р. Дон, в сырых пойменных биотопах.
Всего было собрано и исследовано на наличие маркеров бактерий рода Francisella
1176 взрослых иксодовых клещей трех видов, из которых 703 экземпляра были Dermacentor
reticulatus (Fabricius, 1894), 261 особь - D. marginatus (Sulzer, 1776), 212 особей - Ixodes
ricinus (L., 1758). Из клещей одного вида, отловленных в конкретном очаге, формировали про-
бы (пулы) по 2 экземпляра. Лабораторному тестированию в общей сложности подвергнуто
588 пулов (табл. 1).
Гомогенизацию клещей каждого пула и экстракцию ДНК проводили по методике, описанной
ранее (Кормилицына и др., 2016, 2019). В связи с малой чувствительностью праймерной пары
Fr1530.1/Fr1281R0.1, которая была применена нами для выявления специфической ген-мишени
16s rRNA бактерий рода Francisella у клещей I. trianguliceps (Кормилицына и др., 2016), в дан-
ном исследовании для этой цели использованы праймеры NC-Fran16Sr-F/Fr1281R0.1, амплифи-
цирующие участок гена 16S rRNA размером 218-226 п. н. Он представлен в геноме одной-тремя
копиями, что увеличивает вероятность выявления положительных образцов при малом содержа-
нии в них ДНК.
Все образцы, у которых была выявлена ДНК бактерий рода Francisella, проверены на на-
личие видоспецифических участков генов-мишеней F. tularensis в ПЦР-РВ с праймерами и
зондами ISFtu2F/R + ISFtu2P (97 п. н.) и lpnA2F/R + lpnA2P (82 п. н.). Для подтверждения по-
ложительных результатов некоторые образцы дополнительно исследовали с парами праймеров
iglCFt-F/R (226 п. н.) (Кормилицына и др., 2019). Использовали праймеры, зонды и реакционные
смеси, изготовленные ЗАО «Синтол» (Россия). ПЦР в реальном времени (ПЦР-РВ) проводили
в приборе Rotor-GeneQ (QIAGEN, Германия) в лаборатории туляремии ФГБУ «Национальный
исследовательский центр эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Министерства
Здравоохранения Российской Федерации.
287
При оценке возможного количества (доли) клещей с ДНК бактерий мы исходили из того,
что все исследованные пулы включали по 2 особи членистоногих. Следовательно, любой ПЦР-
положительный пул мог содержать одну или две особи клещей с ДНК бактерий рода Francisella.
Если допустить, что все положительные пулы включали только по одной особи клеща с ДНК,
возможная общая доля таких особей (в % от общего числа исследованных) была бы минималь-
ной (равной числу положительных пулов), а если в каждом положительном пуле идентифициро-
ванную ДНК содержали оба клеща, общая доля таких особей в анализируемой выборке должна
была быть вдвое большей, т.е. максимально возможной. Эти предельные значения приведены
в таблицах. Поскольку соотношение пулов, содержавших одного или двух клещей с ДНК, было
неизвестно, мы полагаем, что реальные показатели доли таких членистоногих среди исследован-
ных могут быть между указанными минимальными и максимальными значениями. Этот способ
оценки вероятной доли иксодовых клещей с ДНК возбудителя по результатам ПЦР их пулов
аналогичной величины применен нами ранее (Кормилицына и др., 2019).
Статистическая обработка выполнена для уровня значимости 0.95. В качестве доверитель-
ных интервалов при расчете процентов приняты удвоенные значения предельной ошибки вы-
борочной доли (2mp). Сравнение результатов проведено по t-критерию Стьюдента.
Результаты
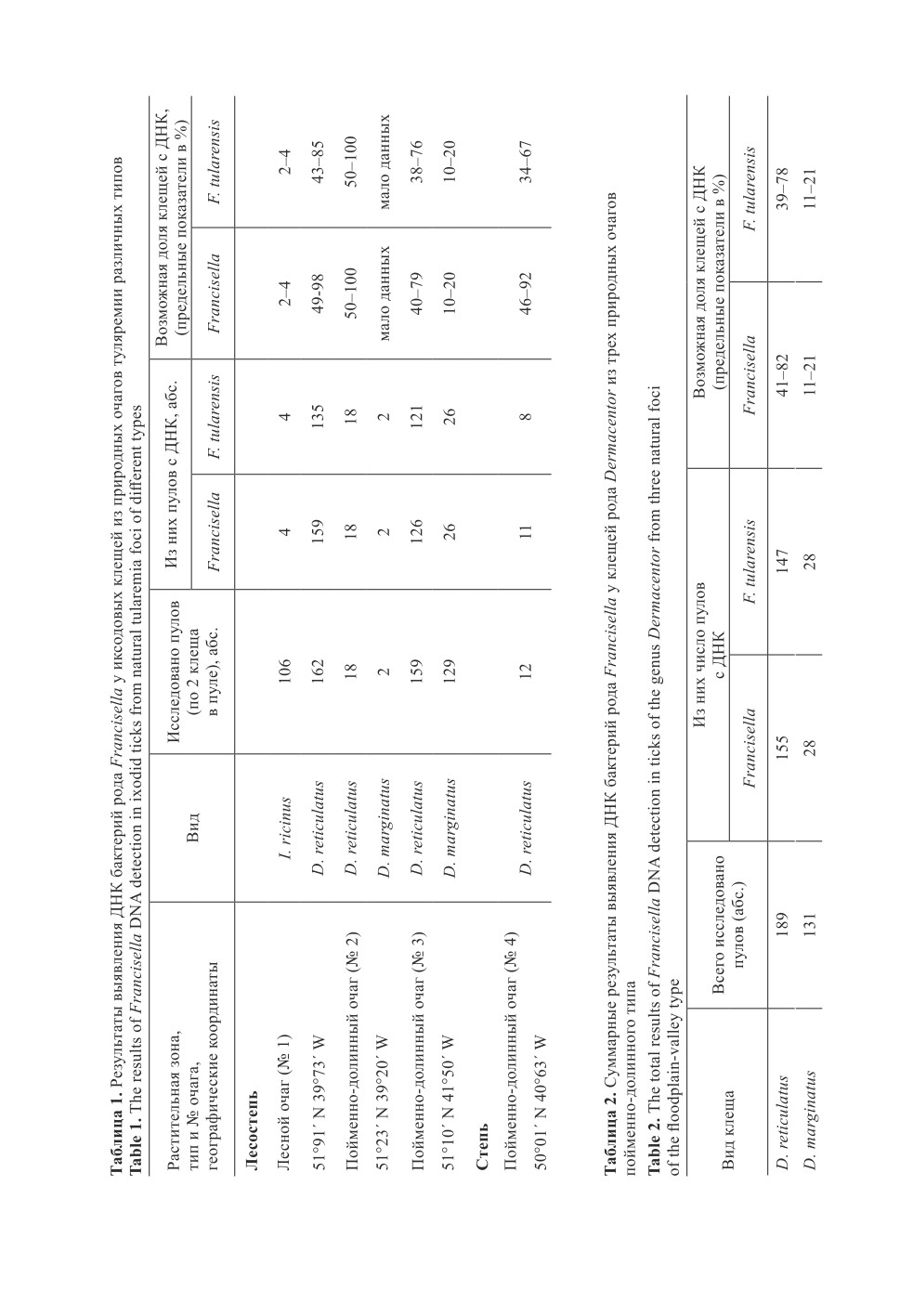
У исследованных взрослых голодных иксодовых клещей трех видов (D. reticulatus,
D. marginatus, I. ricinus) из природных очагов туляремии лесостепной и степной зон
Воронежской области с той или иной частотой выявлены специфические маркеры ге-
нома F. tularensis (табл. 1).
Среди клещей, собранных в природном очаге туляремии лесного типа (табл. 1,
№ 1), оказались два вида: I. ricinus, который повсеместно встречается в лесах лесостеп-
ной зоны области, расположенных южнее места нашей работы (Баркалова и др., 2012),
и D. reticulatus, характерный как для ее зональных лесных, так и для интразональных
ландшафтов. Исследование репрезентативного количества пулов (или экземпляров)
клещей обоих видов показало, что у I. ricinus ДНК F. tularensis встречается достоверно
(t = 23.0 > 2.0) реже (примерно в 20 раз), чем у D. reticulatus.
В природных очагах пойменно-долинного типа симбиотопично обитают клещи
D. reticulatus и D. marginatus, причем доля первого из них в вылове несколько выше,
чем второго. В природном очаге этого типа, расположенном в степной зоне, доля
D. marginatus в наших сборах составляла около 20%. В табл. 1 сведения о клещах этого
вида в данном очаге (№ 4) отсутствуют, поскольку по техническим причинам они не
были исследованы на наличие маркеров ДНК бактерий рода Francisella.
288
Чтобы сравнить вероятное значение двух близких видов клещей рода Dermacentor
в пойменно-долинных очагах туляремии, мы объединили результаты их исследования,
полученные в очагах № 2-4 (табл. 1), которые имеют большое биоценотическое сход-
ство. По ориентировочному подсчету среди клещей D. reticulatus особей с ДНК F. tu-
larensis достоверно (t = 12.0 > 2.0) больше (примерно в 3-4 раза), чем среди D. margin-
atus (табл. 2), хотя такую видоспецифичную ДНК содержали все положительные пулы
клещей этого вида. Напротив, она не обнаружена в 24 пулах D. reticulatus (15.1 ± 5.7 %)
от числа проб с ДНК бактерий рода Francisella из лесного очага (№ 1), в пяти пулах
(4.0 ± 3.5 %) - из пойменно-долинного очага № 3, а также в трех из 11 пулов из очага
№ 4 (табл. 1). Суммарно в очагах пойменно-долинного типа выявлено 8 проб из 155
(т. е. 5 ± 0.9 %) положительных с маркерами родоспецфичной ДНК, но отрицательных
в отношении специфичного фрагмента гена F. tularensis (табл. 2). По данным Козоре-
зова и др. (2017), при исследовании пулов клещей из природных очагов Воронежской
области туляремийный антиген возбудителя у D. reticulatus обнаруживался чаще, чем
у D. marginatus, что согласуется с нашими результатами, представленными выше.
Обсуждение
Как уже было отмечено, в ландшафтно-климатических условиях северной части
Воронежской области распространены стойкие природные очаги туляремии двух ти-
пов: лесного (зональные) и пойменно-долинного (интразональные). По всей видимо-
сти, они характерны для всей лесостепной зоны европейской части России. Нельзя
исключить существования природных очагов луго-полевого и пойменно-болотного ти-
пов, хотя совокупность необходимых для этого биотических и абиотических условий
представляется в этой зоне весьма ограниченной.
В лесостепной зоне в природных очагах туляремии лесного типа потенциальны-
ми хранителями и переносчиками F. tularensis, как показывают наши данные, могут
быть иксодовые клещи двух видов (D. reticulatus и I. ricinus), но их возможные роли
в эпизоотическом процессе сильно различаются. В этом отношении эти очаги гораздо
более сходны с центрально-европейскими очагами лесного типа (Gurycová et al., 1995;
Hildebrandt et al., 2011; Gehringer et al., 2013; Genchi et al., 2015), чем с восточноевро-
пейскими, где клещи данных видов отсутствуют, а потенциалом участия в эпизооти-
ческом процессе обладают I. trianguliceps и I. persulcatus (Олсуфьев, Дунаева, 1970;
Кормилицына и др., 2016, 2019).
Даже при массовом бактериологическом исследовании клещей I. ricinus, отловлен-
ных в природе, от них не всегда удается получить хотя бы единичный изолят туляре-
290
мийного микроба (Олсуфьев, 1947; Петров, 1968; Олсуфьев, Дунаева, 1970) или же
выявить F. tularensis иным способом, особенно у взрослых особей (Hildebrandt et al.,
2011). Экспериментально инфицированные этим микробом I. ricinus в процессе ме-
таморфоза чаще освобождаются от него, чем клещи рода Dermacentor, и поэтому «…
реже передают возбудителя туляремии восприимчивым животным. Для F. tularensis,
по-видимому, создаются неблагоприятные условия существования в клеще с сильно
продолжительным циклом развития, что свидетельствует о меньшей адаптации туля-
ремийных бактерий к организму I. ricinus, особенно к взрослой его фазе» (Петров,
1968, с. 428).
Изложенные результаты экспериментальных и полевых исследований, а также дан-
ные о мизерном числе взрослых голодных клещей этого вида с наличием маркеров
ДНК возбудителя туляремии, полученные нами в лесостепной части Воронежской
области, позволяют считать I. ricinus случайным хозяином бактерий F. tularensis. Мы
предполагаем, что контактам переносчиков с возбудителем может способствовать
одновременное паразитирование предимагинальных фаз I. ricinus и D. reticulatus на
высоко восприимчивых к инфекции мелких млекопитающих. Это часто происходит,
например, с клещами I. persulcatus и I. trianguliceps (в фауне Воронежской области эти
виды отсутствуют, Негробов, 2005) в восточноевропейских южнотаежных природных
очагах иксодовых клещевых боррелиозов (Ковалевский и др., 2013; Korenberg et al.,
2015), сочетанных с паразитарной системой лесного туляремийного очага (Кормили-
цына и др., 2016, 2019).
Известно, что в природных очагах нескольких различных типов на территори-
ях Палеарктики и Голарктики с умеренным климатом важное участие в циркуляции
туляремийного микроба принимают иксодовые клещи рода Dermacentor (Олсуфьев,
1953, 1987; Олсуфьев, Дунаева, 1970; Hubálek, Halouzka, 1997; Hubálek, Rudolf, 2017;
Whitten et al., 2019; Zelner, Huntley, 2019 и др.). Этому способствуют способность кле-
щей к восприятию бактерий и их трансфазовой передаче в ходе метаморфоза (Петров,
Дунаева, 1955; Олсуфьев, Петров, 1967; Петров, 1968), а также непродолжительность
полного цикла развития и смены генераций (Guryсová et al., 1995). Так, у D. reticulatus
и D. marginatus, например, развитие от яйца до взрослой особи может происходить
в течение одного вегетационного периода (Rubel et al., 2016).
Оба этих вида - важные хранители и переносчики возбудителя в природных очагах
туляремии (Олсуфьев, Дунаева, 1970), в том числе, как показывают представленные
нами данные, и на стыке лесостепной и степной зон европейской части России. Однако
эта роль ограничена особенностями их ареалов и территориального распределения.
291
Так, для более влаголюбивого клеща D. reticulatus южные пределы существования его
плакорных популяций в европейской части России, с которыми в значительной мере
связана локализация природных очагов туляремии лесного типа, существенно огра-
ничиваются затененными биотопами смешанных хвойно-лиственных насаждений ле-
состепной зоны. Но, как показывают наши сборы, клещи этого вида остаются много-
численными в условиях интразональных ландшафтов, где они, вероятно, обеспечива-
ют функционирование природных очагов пойменно-долинного типа. По долинам рек
клещ D. reticulatus заходит в степную зону (Филиппова, 1997), где могут существовать
природные очаги туляремии. Это отмечается и на территории Воронежской области.
Но в таких очагах видовой состав клещей-переносчиков и видовой состав резерву-
арных хозяев возбудителя в значительной степени отличаются от видовых составов
переносчиков и хозяев в типичных очагах степного типа (Олсуфьев, Дунаева, 1970) и
сходны с видовыми составами в пойменно-долинных очагах примыкающей лесостеп-
ной зоны.
Клещ D. marginatus является более ксерофильным по сравнению с D. reticulatus.
Ареал этого вида охватывает всю степную зону (Филиппова, 1997). Интразональные
пойменно-долинные биотопы, по которым он проникает в лесостепь, в значительной
мере ограничивают северные рубежи его ареала. Экспериментально установлено, что
клещ D. marginatus, как и D. reticulatus, способен при кровососании воспринимать
F. tularensis от резервуарных хозяев и с утратой некоторого количества бактерий пере-
давать этот микроб от личинок до взрослых особей в процессе метаморфоза. При пере-
ходе зараженных нимф в половозрелую фазу количество бактерий сокращается в клеще
от 10 до 1000 раз (Петров, Дунаева, 1955; Олсуфьев, Петров, 1967; 1968). Наши данные
позволяют предполагать, что в европейской части лесостепной зоны D. marginatus мо-
жет быть важным сочленом туляремийной паразитарной системы очагов пойменно-
долинного типа, но этот вид принимает несколько меньшее участие в эпизоотическом
процессе, чем D. reticulatus. Это предположение, видимо, можно распространить и
на очаги туляремии иных типов, паразитарные системы которых включают иксодо-
вых клещей обоих видов. В природных очагах Центральной Европы среди клещей
D. marginatus, исследованных молекулярно-биологическим или иными методами,
было меньше положительных, чем среди D. reticulatus (Hubálek et al., 1996; Wicki et al.,
2000; Sréter-Lancz et al., 2009 и др.).
Положительные результаты ПЦР-РВ с родоспецифичными праймерами при отсут-
ствии в тех же образцах ДНК F. tularensis позволяют предположительно объяснять их
292
наличием FLE. Они были констатированы только в пробах клещей D. reticulatus из
лесного и двух пойменно-долинных природных очагов, один из которых находился
в лесостепной, а второй - в степной зоне. Соотношение между числом клещей с FLE
и ДНК F. tularensis, по нашим результатам, в целом составляло примерно 1:10 и было
близко к полученному при исследовании клещей этого вида в Венгрии (Kreizinger
et al., 2013). При этом оно существенно отличалось от данных, полученных при вы-
явлении 16s rRNA фрагмента генома FLE другими исследователями: 50.4 % в Польше
(Wójcik-Fatla et al., 2015) и 79 % во Франции (Michelet et al., 2013). Взрослые клещи
D. reticulatus, собранные в различных районах Португалии и Испании, содержали или
ДНК F. tularensis, или ДНК FLE в большем количественном соотношении (de Carvalho
et al., 2011, 2016). По предположению авторов, эти различия обусловлены различиями
популяций клещей из разных географических областей. Нам не удалось обнаружить
FLE у взрослых клещей I. ricinus, хотя известно, что очень немногие из них могут
содержать этих эндосимбионтов (Wójcik-Fatla et al., 2015). Как справедливо отмеча-
ют авторы данной публикации, все эти «нестыковки» могут объясняться различиями
в применяемых методиках ПЦР, а также разницей в количестве тестируемых клещей.
Заключение
Изучение иксодовых клещей на наличие ДНК F. tularensis может быть информатив-
ным направлением мониторинга за состоянием природных очагов туляремии. Выяв-
ленные нами у D. reticulatus образцы с ДНК бактерий рода Francisella при отсутствии
в тех же образцах ДНК F. tularensis позволяют предположить, что у клещей присут-
ствуют эндосимбионты группы FLE. Их детальная идентификация и дальнейшие ис-
следования важны для понимания филогении туляремийного микроба и совершенство-
вания методов лабораторной диагностики. Для изучения FLE прежде всего необходима
разработка новых молекулярно-биологических методов с высокой чувствительностью,
позволяющих обнаруживать специфическую ДНК этих микроорганизмов при ее не-
большом количестве в клеще.
СПИСОК ЛИТЕРАТУРЫ
Баркалова Л.Д., Ромашова Н.Б., Транквилевский Д.В., Бахметьева Ю.О., Чубирко М.И. 2012. К вопросу рас-
пространения очагов иксодовых клещевых боррелиозов на территории Воронежской области. Здоро-
вье населения и среда обитания 234 (9): 30-34.
Ковалевский Ю.В., Коренберг Э.И., Горелова Н.Б., Нефедова В.В. 2013. Экология клеща Ixodes trianguliceps
и его роль в природных очагах иксодовых клещевых боррелиозов Среднего Урала. Зоологический
журнал 92 (5): 505-516.
293
Козорезов А.В., Попова Т.И., Гайдукова Е.П., Степкин Ю.И., Квасов Д.А. 2017. Обзор эпизоотической и
эпидемиологической ситуации по природно-очаговым инфекциям в Воронежской области в 2016 г.
Современные проблемы общей и прикладной паразитологии и эпизоотологии. Воронеж. 126-133.
Кормилицына М.И., Коренберг Э.И., Ковалевский Ю.В., Мещерякова И.С. 2016. Первая молекулярно-
генетическая идентификация возбудителя туляремии у клещей Ixodes trianguliceps Bir. в России. Мо-
лекулярная генетика, микробиология и вирусология 34 (2): 67-70.
Кормилицына М.И., Коренберг Э.И., Михайлова Т.В., Ковалевский Ю.В., Транквилевский Д.В. 2019. Воз-
можное участие таежного клеща Ixodes persulcatus Schulze, 1930 в циркуляции возбудителя туляремии
в природных очагах лесного типа. Паразитология 53 (3): 209-219.
Кудрявцева Т.Ю., Попов В.П., Мокриевич А.Н., Мазепа А.В., Окунев Л.П., Холин А.В., Куликалова Е.С.,
Храмов М.В., Дятлов И.А., Транквилевский Д.В. 2017. Эпидемиологический и эпизоотологический
анализ ситуации по туляремии в Российской Федерации в 2016 г., прогноз на 2017 г. Проблемы особо
опасных инфекций 2: 13-18.
Кудрявцева Т.Ю., Попов В.П., Мокриевич А.Н., Пакскина Н.Д., Холин А.В., Мазепа А.В., Куликалова Е.С.,
Транквилевский Д.В., Храмов М.В., Дятлов И.А. 2018. Туляремия: актуальные вопросы и прогноз
эпидемической ситуации на территории Российской Федерации в 2018 г. Проблемы особо опасных
инфекций 1: 22-29.
Кудрявцева Т.Ю., Попов В.П., Мокриевич А.Н., Пакскина Н.Д., Холин А.В., Мазепа А.В., Куликалова Е.С.,
Косилко С.А., Бирковская Ю.А., Транквилевский Д.В., Храмов М.В., Дятлов И.А. 2019. Эпидемиче-
ская активность природных очагов туляремии на территории Российской Федерации в 2018 г. и про-
гноз ситуации на 2019 г. Проблемы особо опасных инфекций 1: 32-41.
Кудрявцева Т.Ю., Попов В.П., Мокриевич А.Н., Холин А.В., Мазепа А.В., Куликалова Е.С., Транквилевский
Д.В., Храмов М.В., Дятлов И.А. 2020. Эпизоотолого-эпидемиологическая ситуация по туляремии на
территории Российской Федерации в 2019 г. и прогноз на 2020 г. Проблемы особо опасных инфекций
1: 21-32.
Мещерякова И.С., Транквилевский Д.В., Квасов Д.А., Михайлова Т.В., Кормилицына М.И., Демидова Т.Н.,
Степкин Ю.И., Жуков В.И. 2015. Оценка современной эпизоотической активности природных очагов
туляремии в Воронежской области с помощью иммуно-серологического и молекулярно-генетического
исследования основных носителей возбудителя. Журнал микробиологии, эпидемиологии и иммуно-
биологии 1: 11-17.
Михайлова Т.В., Мещерякова И.С., Транквилевский Д.В., Кормилицына М.И., Демидова Т.Н. 2014. Харак-
теристика природных очагов туляремии на Северо-Востоке Воронежской области. Дальневосточный
журнал инфекционной патологии 25: 58-60.
Михайлова Т.В., Мещерякова И.С., Демидова Т.Н., Кормилицына М.И., Квасов Д.А., Степкин Ю.И., Транк-
вилевский Д.В. 2015. Особенности биотопического распределения различных видов мелких млекопи-
тающих и их роль в поддержании природных очагов туляремии в Северо-Восточной части Воронеж-
ской области. Журнал эпидемиология и вакцинопрофилактика 3: 57-61.
Михайлова Т.В., Демидова Т.Н., Кормилицына М.И., Квасов Д.А., Козорезов А.В. Транквилевский Д.В.
2017. Эпизоотическая активность и эпидемическое проявление природных очагов туляремии в Во-
ронежской области. Журнал эпидемиология и вакцинопрофилактика 92 (1): 16-21.
Негробов О.П. (отв. ред.) 2005. Кадастр беспозвоночных животных Воронежской области. Воронеж, ВГУ.
825 с.
Олсуфьев Н.Г. 1947. О ландшафтных типах туляремийных очагов средней полосы РСФСР. Зоологический
журнал 26 (3): 255-261.
294
Олсуфьев Н.Г. 1953. К экологии лугового клеща Dermacentor pictus Herm., о происхождении его очагов и
путях их ликвидации в средней полосе Европейской части РСФСР. М. Вопросы краевой, общей и
экспериментальной паразитологии и медицинской зоологии 8: 49-98.
Олсуфьев Н.Г. 1987. Клещ Dermacentor pictus Herm. и антропогенное действие на его популяцию, а также
связанный с ним лугополевой очаг туляремии. Медицинская паразитология и паразитарные болезни
3: 16-20.
Олсуфьев Н.Г., Дунаева Т.Н. 1970. Природная очаговость, эпидемиология и профилактика туляремии. М.,
Медицина, 272 с.
Олсуфьев Н.Г., Петров В.Г. 1967. Кровососущие членистоногие и Francisella tularensis. В кн. Биологические
взаимоотношения кровососущих членистоногих с возбудителями болезней человека. М., Медицина,
200-218.
Петров В.Г. 1968. Dermacentor marginatus Sulz. и Ixodes ricinus L. как хранители и переносчики возбудителя
туляремии. Паразитология 2 (5): 424-429.
Петров В.Г., Дунаева Т.Н. 1955. Зависимость инфицирования иксодовых клещей от особенностей течения
туляремии у животных-доноров. М. Вопросы краевой, общей и экспериментальной паразитологии и
медицинской зоологии IX: 153-162.
Сильченко В.С. 1961. Природноочаговые инфекции в Воронежской области. Журнал микробиологии, эпиде-
миологии и иммунобиологии 5: 15-18.
Транквилевский Д.В. 2016. Об инфицированности мелких млекопитающих возбудителями зоонозов в Рос-
сийской Федерации. Здоровье населения и среда обитания 283 (10): 53-56.
Транквилевский Д.В., Квасов Д.А., Мещерякова И.С., Михайлова Т.В., Кормилицына М.И., Демидова Т.Н.,
Ананьина Ю.В., Савельева О.В., Малкин Г.А., Мутных Е.С., Коротина Н.А., Дзагурова Т.К., Проста-
ков Н.И., Сурков А.В., Куролап С.А., Клепиков О.В., Стёпкин Ю.И., Чубирко М.И., Жуков В.И. 2014.
Вопросы организации мониторинга природных очагов инфекций опасных для человека. Планирова-
ние, проведение и анализ результатов полевых наблюдений. Здоровье населения и среда обитания 257
(8): 38-43.
Транквилевский Д.В., Удовиков А.И., Попов В.П., Захаров К.С., Попов Н.В., Безсмертный В.Е. 2015. Состоя-
ние численности грызунов и эпидемиологическая обстановка по туляремии на территории Россий-
ской Федерации во втором полугодии 2014 и прогноз на 2015 г. Проблемы особо опасных инфекций
1: 30-35.
Филиппова Н.А. 1997. Иксодовые клещи подсем. Amblyomminae. Фауна России и сопредельных стран. Пау-
кообразные. Т. IV, вып. 5. СПб., Наука, 436 с.
Филиппова Н.А. 2011. Особенности биоразнообразия европейской фауны иксодовых клещей (Acari, Ixodi-
dae) как переносчиков возбудителей природноочаговых инфекций. Паразитология 45 (3): 161-181.
de Carvalho I., Santos N., Soares T., Zé-Zé L., Núncio M.S. 2011. Francisella-like endosymbiont in Dermacentor
reticulatus collected in Portugal. Vector-Borne and Zoonotic Diseases 11: 185-188.
de Carvalho I., Toledo A., Carvalho C.L., Barandika J.F., Respicio-Kingry L.B., Garcia-Amil C., García-Pérez A.L.,
Olmeda A.S., Zé-Zé L., Petersen J.M., Anda P., Núncio M.S., Escudero R. 2016. Francisella species in ticks
and animals, Iberian Peninsula. Ticks and Tick-borne Diseases 7 (1): 159-165.
Gehringer H., Schacht E., Maylaender N., Zeman E., Kaysser P., Oehme R., Pluta S., Splettstoesser W.D. 2013. Pres-
ence of an emerging subclone of Francisella tularensis holarctica in Ixodes ricinus ticks from south-western
Germany. Ticks and tick-borne diseases 4 (1-2): 93-100.
Genchi M., Prati P., Vicari N., Manfredini A., Sacchi L., Clementi E., Bandi C., Epis S., Fabbi M. 2015. Francisella
tularensis: no evidence for transovarial transmission in the tularemia tick vectors Dermacentor reticulatus
and Ixodes ricinus. PLoS One 10 (8): e0133593. doi: 10.1371/journal.pone.0133593.
295
Gurycová D., Kocianová E., Výrosteková V., Rehácek J. 1995. Prevalence of ticks infected with Francisella tula-
rensis in natural foci of tularemia in western Slovakia. European Journal of Epidemiology 11 (4): 469-474.
Hildebrandt A., Franke J., Schmoock G., Pauliks K., Krämer A., Straube E. 2011. Diversity and coexistence of tick-
borne pathogens in central Germany. Journal of Medical Entomology 48 (3): 651-655.
Hubálek Z., Treml F., Halouzka J. Juricova Z., Hunady M., Janik V. 1996. Frequent isolation of Francisella tularen-
sis from Dermacentor reticulates ticks in an enzootic focus of tularaemia. Medical and Veterinary Entomol-
ogy 10: 241-246.
Hubálek Z., Halouzka J. 1997. Mosquitoes (Diptera: Culicidae), in contrast to ticks (Acari: Ixodidae), do not carry
Francisella tularensis in a natural focus of tularemia in the Czech Republic. Journal of Medical Entomology
34: 660-663.
Hubálek Z., Rudolf I. 2017. Francisella tularensis prevalence and load in Dermacentor reticulatus ticks in an en-
demic area in Central Europe. Medical and Veterinary Entomology 31 (2): 234-239.
Korenberg E.I., Kovalevskii Yu.V., Gorelova N.B., Nefedova V.V. 2015. Comparative analysis of the roles of Ixodes
persulcatus and I. trianguliceps ticks in natural foci of ixodid tick-borne borrelioses in the Middle Urals,
Russia. Ticks and Tick-borne Diseases 6 (4): 316-321.
Kreizinger Z., Hornok S., Dán A., Hresko S., Makrai L., Magyar T., Bhide M., Erdélyi K., Hofmann-Lehmann R.,
Gyuranecz M. 2013. Prevalence of Francisella tularensis and Francisella-like endosymbionts in the tick
population of Hungary and the genetic variability of Francisella-like agents. Vector Borne Zoonotic Diseases
13 (3): 160-163.
Michelet L., Bonnet S., Madani N., Moutailler S. 2013. Discriminating Francisella tularensis and Francisella-like
endosymbionts in Dermacentor reticulatus ticks: valuation of current molecular techniques. Veterinary Mi-
crobiology 163 (3-4): 399-403.
National Center for Biotechnology Information. 2020. Taxonomy Browser. Режим доступа: https://www.ncbi.nlm.
nih.gov/Taxonomy/Browser/wwwtax.cgi (01 июня 2020)
Rubel F., Brugger K., Pfeffer M., Chitimia-Dobler L., Didyk Y.M., Leverenz S., Dautel H., Kahl O. 2016. Geo-
graphical distribution of Dermacentor marginatus and Dermacentor reticulatus in Europe. Ticks and Tick-
borne Diseases 7 (1): 224-233.
Sréter-Lancz Z., Széll Z., Sréter T., Márialigeti K. 2009. Detection of a novel Francisella in Dermacentor reticu-
latus: a need for careful evaluation of PCR-based identification of Francisella tularensis in Eurasian ticks.
Vector Borne and Zoonotic Diseases 9: 123-126.
Whitten T., Demontigny C., Bjork J., Foss M., Peterson M., Scheftel J., Neitzel D., Sullivan M., Smith K. 2019.
Prevalence of Francisella tularensis in Dermacentor variabilis ticks, Minnesota, 2017. Vector Borne Zoo-
notic Diseases 19 (8): 596-603.
Wicki R., Sauter P., Mettler C., Natsch A., Enzler T., Pusterla N., Kuhnert P., Egli G., Bernasconi M., Lienhard R.,
Lutz H., Leutenegger C.M. 2000. Swiss Army survey in Switzerland to determine the prevalence of Fran-
cisella tularensis, members of the Ehrlichia phagocytophila genogroup, Borrelia burgdorferi sensu lato, and
tick-borne encephalitis virus in ticks. European journal of clinical microbiology and infectious diseases 19:
427-432.
Wójcik-Fatla A., Zając V., Sawczyn A., Cisak E., Sroka J., Dutkiewicz J. 2015. Occurrence of Francisella spp. in
Dermacentor reticulatus and Ixodes ricinus ticks collected in eastern Poland. Ticks and Tick-borne Diseases
6 (3): 253-257.
Zelner B., Huntley J.F. 2019. Ticks and tularemia: do we know what we don’t know? Frontiers in Cellular and Infec-
tion Microbiology 9: 146. doi: 10.3389/fcimb.2019.00146
296
EVALUATION OF THE POSSIBLE ROLE OF IXODID TICKS
IN NATURAL TULAREMIA FOCI IN THE FOREST-STEPPE ZONE
OF THE EUROPEAN RUSSIA
M. I. Kormilitsyna, E. I. Korenberg, T. V. Mikhaylova,
Yu. V. Kovalevskii, A. V. Amirkhanyan, D. V. Trankvilevsky,
B. V. Romashov, D. A. Kvasov, А. М. Salomatina
Keywords: natural foci, the causative agent of tularemia, types of foci, ixodid ticks
SUMMARY
1756 adult individuals of ticks Dermacentor reticulatus (Fabricius, 1894), D. marginatus (Sulzer,
1776) and Ixodes ricinus (Linnaeus, 1758) collected from vegetation in April-May 2018 and 2019 in
natural foci of tularemia in forest and floodplain-valley types of the forest-steppe zone of the European
Russia (Voronezh region) were investigated. Ticks (2 individuals in a pool) were studied by RT-PCR for
the presence 16S rRNA gene fragment (amplicon size 218-226) in the Francisella genome. All positive
samples were checked using species-specific primers and probes complementary to a fragment of the
lpnA gene and the ISFtu2-element. Francisella DNA content in I. ricinus ticks from the forest biotope
was found almost 20 times less than in D. reticulatus. The amount of Francisella DNA in D. reticulatus
ticks collected in all studied floodplain-valley foci was more than 5 times greater than in D. marginatus.
All positive tick pools of D. marginatus ticks were identified as Francisella tularensis, in contrast to
D. reticulatus, which contained not only the DNA of F. tularensis, but also the unidentified DNA of
Francisella genus bacteria. 15 % of them were found in D. reticulatus ticks from a forest-type focus and
5 % - in three floodplain-valley biotopes (in total). This may indicate the presence of endosymbionts of
the FLE group in ticks of D. reticulatus. Thus, D. marginatus may be an important joint of the tularemia
parasitic system of foci of the floodplain-valley type, however, these ticks take a slightly lesser part in
the epizootic process than D. reticulatus in the European part of the forest-steppe zone. Adult forest
ticks I. ricinus are occasional hosts of bacteria F. tularensis.
297