ПАРАЗИТОЛОГИЯ, 2020, том 54, № 5, с. 355-370.
УДК 57.065:577.29
МИКРОСПОРИДИИ И ИХ БЛИЖАЙШИЕ РОДСТВЕННИКИ:
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ ОБ ЭВОЛЮЦИИ
УНИКАЛЬНОЙ ГРУППЫ ЭКСТРЕМАЛЬНЫХ ПАРАЗИТОВ
© 2020 г. С. А. Тимофеев*, И. В. Сендерский,
В. С. Журавлев, В. В. Долгих
Всероссийский институт защиты растений,
ш. Подбельского 3, Санкт-Петербург, Пушкин, 196608 Россия
*e-mail: ts-bio@ya.ru
Поступила в редакцию 21.07.2020 г.
После доработки 02.09.2020 г.
Принята к печати 07.09.2020 г.
В обзоре рассмотрены современные представления об эволюции и филогении облигатных
внутриклеточных эукариотических паразитов - микроспоридий. В процессе адаптации к вну-
триклеточному паразитизму геном и функциональный аппарат данных организмов претерпел
значительную редукцию и модификацию. Систематическое положение данной группы долгое
время оставалось неясным, и было доподлинно неизвестно, как происходила эволюция микро-
споридий, когда и каким образом возникли их уникальные адаптации к паразитическому об-
разу жизни. Настоящий прорыв в изучении эволюции микроспоридий был осуществлен только
в последние несколько лет. Были обнаружены и описаны группы, занимающие наиболее близкое
к микроспоридиям положение на древе жизни: Cryptomycota (Rozellida) и Aphelida. Секвени-
рование геномов представителей данных групп, которые также относятся к внутриклеточным
паразитам, и первые геномные данные о представителях базальных ветвей микроспоридий,
полученные в 2013-2020 гг., позволили по-новому взглянуть на эволюцию микроспоридий
и их ближайших родственников, обнаружить промежуточные формы на пути адаптации к вну-
триклеточному паразитизму.
Ключевые слова: Microsporidia, Aphelida, Cryptomycota, внутриклеточные паразиты, эво-
люция
DOI: 10.31857/S1234567806050016
Микроспоридии - это облигатные внутриклеточные эукариотические паразиты,
освоившие чрезвычайно широкий круг хозяев, от протистов до млекопитающих (То-
карев и др., 2016; Stentiford et al., 2016). Пятнадцать видов микроспоридий способны
заражать человека, вызывая микроспоридиозы - повсеместно распространенные за-
болевания, обычно проявляющиеся у пациентов с ослабленным иммунитетом (Тимо-
феев, 2015). Кроме того, микроспоридии наносят огромный ущерб таким отраслям
сельского хозяйства как пчеловодство и шелководство, вызывая тяжелые болезни
у медоносной пчелы и тутового шелкопряда (Stentiford et al., 2016; Martín-Hernández
355
et al., 2018). Все активные стадии жизненного цикла микроспоридий функционируют
только внутри клеток их хозяев, за пределами которых эти паразиты могут выживать
только в виде толстостенных спор с уникальной морфологией. В процессе адаптации
к внутриклеточному паразитизму геном и набор характерных для эукариот клеточных
систем и органелл данных организмов был значительно редуцирован и модифициро-
ван (Cuomo et al., 2012). Микроспоридии утратили множество метаболических путей,
в том числе способность к синтезу многих аминокислот и нуклеотидов, в результате
чего они в значительной степени стали зависеть от субстратов, заимствуемых у клеток
хозяина (Dean et al., 2016). Именно у микроспоридий, впервые среди эукариот, были
обнаружены уникальные переносчики АТФ, способные напрямую транспортировать
это соединение из цитоплазмы инфицированной клетки. Эта адаптация позволяет
данным паразитам не использовать собственную систему энергетического метаболизма
в ходе внутриклеточного развития, а полностью полагаться на энергетические ресурсы
хозяина (Dolgikh et al., 2011; Tsaousis et al., 2008; Alexander et al., 2016).
Систематическое положение микроспоридий долгое время оставалось неясным
и было доподлинно неизвестно, как происходила их эволюция, когда и каким образом
они приобрели свои уникальные адаптации к паразитическому образу жизни. Благодаря
развитию методов молекулярной филогении, в начале нынешнего столетия появились
первые данные, свидетельствующие о родстве микроспоридий с грибами (Hirt et al.,
1999; Keeling et al., 2000). Однако эти данные не позволяли ответить на вопрос, каким
образом происходила эволюция микроспоридий, практически не имеющих специфи-
ческих черт, общих с другими группами грибов. Настоящий прорыв в области изуче-
ния эволюции микроспоридий был осуществлен только за последние несколько лет.
В начале последнего десятилетия были опубликованы данные об обнаружении группы
под названием Rozellida (Lara et al., 2010) или Cryptomycota (Jones et al., 2011), которая
рассматривалась в качестве базального таксона среди грибов. Помимо многочислен-
ных сиквенсов неидентифицированных объектов из образцов окружающей среды,
в пределах данной группы был известен единственный описанный род Rozella - паразит
грибов или водорослей, ранее относимый к хитридиомицетам. Для представителей
данного рода характерны фаготрофное питание и расселение с помощью зооспор.
Параллельно с этим публиковались работы, в которых в качестве базальной группы
грибов рассматривались микроспоридии (Capella-Gutiérrez et al., 2012). В 2013 г. было
продемонстрировано близкое родство микроспоридий и Cryptomycota. При этом анализ
расшифрованного в указанной работе генома Rozella allomycis показал, что для данного
вида характерна сильная степень редукции и модификации функционального аппа-
рата, выраженная в чуть меньшей степени, чем у микроспоридий (James et al., 2013).
В это же время было показано, что к микроспоридиям и криптомикотам близка еще
одна группа грибов: Aphelida (Karpov et al., 2013; Karpov et al., 2014). Представители
данного таксона представляют собой фаготрофных зооспоровых паразитоидов водо-
рослей, морфологически схожих с Rozella sp.
Вскоре после этого был обнаружен новый вид паразитов, относящийся, по данным
молекулярной филогении, к Cryptomycota: Paramicrosporidium sp., обладающий сход-
ной с микроспоридиями морфологией и развивающийся внутри ядер амеб (Corsaro
et al., 2014). Кроме того, был переописан другой вид внутриядерных паразитов амеб -
Nucleophaga amoebae и было показано, что этот вид родственен Paramicrosporidium
и также относится к розеллидам (Corsaro et al., 2014a). В это же время были опу-
бликованы описание и данные расшифровки генома уникального паразита дафний
356
Mitosporidium daphniae, морфологически схожего с микроспоридиями и по степени
редукции и специализации генома к паразитическому образу жизни занимающего
промежуточное положение между данной группой и R. allomycis (Haag et al., 2014).
В последующие годы были расшифрованы геномы криптомикота P. saccamoebae
(Quandt et al., 2017), афелиды Paraphelidium tribonemae (Torruella et al., 2018), а так-
же двух представителей ранее не изученной с точки зрения молекулярной филоге-
нии группы микроспоридий - мечниковеллид, которые заняли базальное положение
в системе данных паразитов (Mikhailov et al., 2017; Galindo et al., 2018). Однако год
спустя были опубликованы результаты молекулярно-филогенетического анализа ми-
кроспоридии Chytridiopsis typographi, и клада Chytridiopsida сменила мечниковеллид
в качестве базальных микроспоридий (Corsaro et al., 2019). В 2020 г. был описан но-
вый вид розеллид Morellospora saccamoebae, являющийся паразитом амеб и имеющий
схожую с микроспоридиями морфологию, как и представители родов Nucleophaga
и Paramicrosporidium (Corsaro et al., 2020). Однако, в отличие от последних,
M. saccamoebae развивался не в ядрах амеб, а в их цитоплазме.
Таким образом, обнаружение ближайших родственников микроспоридий, расшиф-
ровка их геномов вкупе с геномными данными о корневых группах самих микроспо-
ридий позволили по-новому взглянуть на эволюцию данной группы. В настоящем
обзоре будут рассмотрены особенности функциональной морфологии, жизненных
циклов, геномов и других клеточных систем микроспоридий, розеллид и афелид
и обсуждены вероятные эволюционные пути развития данных систем.
СОВРЕМЕННОЕ ПРЕДСТАВЛЕНИЕ О ФИЛОГЕНЕТИЧЕСКОМ ПОЛОЖЕНИИ
ТАКСОНОВ APHELIDA, CRYPTOMYCOTA И MICROSPORIDIA
Афелиды (Aphelida Karpov et al., 2014 или Aphelidiomycota Tedersoo et al., 2018) -
небольшая группа внутриклеточных паразитоидов водорослей, первый представитель
которой, Aphelidium sp., был описан еще в 1885 г. (Karpov et al., 2014). На сегодняшний
день в составе группы описано около 20 видов в составе 4 родов (Seto et al., 2020).
С момента первоописания группа рассматривалась как таксон различного ранга
в таких группах как “Monadinea” “Rhizopoda”, “Mezomycetozoea”, “Paramycia” (Gro-
mov, 2000). В 2014 г. на основании массива молекулярно-филогенетических данных
группе был присвоен ранг типа в составе надтипа Opisthosporidia, который включает
также микроспоридий и розеллид и является сестринским таксоном по отношению
к грибам (Karpov et al., 2014). Однако расшифровка первого транскриптома афелиды
Paraphelidium tribonemae и применение методик мультигенной филогении (Torruella
et al., 2018) показали, что Opisthosporidia представляет собой парафилетическую груп-
пу и что афелиды занимают более близкое к грибам положение, чем другие таксоны
данной группы (рис. 1).
Таксономическое положение розеллид (Rozellida Lara et al., 2010), или криптомикот
(Cryptomycota Jones, Richards, 2011), также описанных под названиями Rozellomycota
Corsaro et al., 2014b и Rozellosporidia Karpov et al., 2017, на сегодняшний день остается
предметом дискуссий. Согласно ряду исследований, этот таксон включает в себя как
27 видов - паразитов грибов, оомицетов и водорослей в составе рода Rozella, морфо-
логически схожих с афелидами и зооспоровыми грибами, так и схожих с микроспори-
диями паразитов, относящихся к родам Nucleophaga, Paramicrosporidium, Morellospora
и Mitosporidium (Corsaro et al., 2020; Torruella et al., 2018). По мнению других
357
исследователей, представителей группы, за исключением Rozella, следует считать
примитивными микроспоридиями (Bass et al., 2018; Adl et al., 2019). На предложен-
ной нами консенсусной кладограмме мы отразили это противоречие в виде пере-
крывающихся границ между таксонами Rozellida и Microsporidia (рис. 1). По нашему
мнению, для однозначного разграничения розеллид и микроспоридий на сегодняшний
день накоплено недостаточно данных. При этом, несмотря на различную трактовку
границ между этими таксонами, характер филогенетических взаимоотношений между
описанными видами розеллид и микроспоридий не является предметом дискуссий в
последних опубликованных работах. Таким образом, вопрос о систематическом по-
ложении Nucleophaga, Paramicrosporidium и др. является формальностью и не влияет
на наши представления об эволюции розеллид и микроспоридий. Для унификации
терминологии в рамках данной работы мы будем обозначать представителей этих
морфологически сходных с микроспоридиями видов как «высшие розеллиды».
Рисунок 1. Консенсусная кладограмма, отражающая эволюционные взаимоотношения
микроспоридий, розеллид и афелид согласно Bass et al., 2018; Galindo et al., 2018; Torruella
et al., 2018; Corsaro et al., 2019. Пересечение границ таксонов розеллид и базальных
микроспоридий указывает на дискуссионное положение P. saccamoebae и M. daphnia, которых
иногда рассматривают как примитивных микроспоридий (Bass et al., 2018).
Figure 1. Consensus cladogram reflecting the evolutionary relationships of microsporidia, rozellids
and aphelids according to Bass et al., 2018; Galindo et al., 2018; Torruella et al., 2018; Corsaro et al.,
2019.
The intersection of the boundaries of the rozellid taxa and basal microsporidia indicates the
controversial position of P. saccamoebae and M. daphnia, which are sometimes considered as
primitive microsporidia (Bass et al., 2018).
Рассматривая систематическое положение микроспоридий, мы разделили данный
таксон на две условные группы, представители которых существенно отличаются друг
от друга по целому ряду морфологических и генетических признаков (Corsaro et al.,
2020; Galindo et al., 2018). Первая группа - «Базальные микроспоридии» - вклю-
чает в себя две клады, занимающие положение в корне филогенетического древа:
358
специализированных гиперпаразитов грегарин Metchnikovellida, а также Chytridiop-
sida, заражающих главным образом наземных членистоногих (насекомых, клещей
и многоножек) и кольчатых червей (Corsaro et al., 2019). Кроме того, как уже было
сказано, ряд исследователей относит к базальным микроспоридиям высших розеллид
(Bass et al., 2018; Adl et al., 2019). Вторая группа - «Каноничные микроспоридии» -
наиболее хорошо изученная группа, включающая в себя большую часть микроспо-
ридий (рис.1).
Помимо противоречий в установке границ между описываемыми таксонами, пред-
метом дискуссий до сих пор является характер их взаимоотношений с группой Fungi.
В данной работе мы придерживаемся гипотезы, согласно которой Aphelida, Cryptomycota
и Microsporidia следует рассматривать в качестве сестринских таксонов для гри-
бов (Bass et al., 2018; Karpov et al., 2017; Galindo et al., 2018), т.к. данные группы
в совокупности практически не имеют общих признаков с другими группами гри-
бов. При этом в систематических обзорах последних лет, посвященных классифи-
кации эукариот, описываемые таксоны обычно включаются в состав группы Fungi
(Adl et al., 2019; Tedersoo et al., 2018), хотя в этом случае, как утверждают сами авторы,
у грибов не остается однозначных морфологических, субклеточных или биохимических
синапоморфий (Adl et al., 2019).
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА И ЭВОЛЮЦИЯ
РАЗЛИЧНЫХ СИСТЕМ И ФИЗИОЛОГИЧЕСКИХ ОСОБЕННОСТЕЙ МИКРОСПОРИДИЙ
И ИХ БЛИЖАЙШИХ РОДСТВЕННИКОВ
Функциональная морфология и образ жизни
Стадией дисперсии у афелид являются споры, представленные в виде одножгутико-
вых зооспор или амебоидных клеток с развитым или редуцированным жгутиком. При
контакте с клеткой хозяина спора прикрепляется к ней, инцистируется и формирует
трубку, которая проникает («прорастает») через клеточную стенку водоросли. Через
эту трубку амебоидный зародыш попадает в пространство между клеточной стенкой
и плазмалеммой клетки хозяина и начинает поглощать ее содержимое путем фагоцитоза.
На следующей стадии развития амебоидный трофонт превращается в многоядерный
плазмодий, который полностью замещает содержимое клетки хозяина. За счет деле-
ния плазмодия образуются новые расселительные стадии, которые покидают клетку
хозяина и замыкают цикл развития паразитоида. Для некоторых видов афелид пока-
зано образование внутри клеток хозяев т.н. «покоящихся спор», которые так же как
и инфекционная циста имеют клеточную стенку из хитина (Karpov et al., 2014; Letcher,
Powell, 2019; Torruella et al., 2018). Зооспоры афелид, как и амебоидные трофонты,
обладают полным набором органелл эукариотической клетки - полноценными мито-
хондриями, эндоплазматическим ретикулумом, аппаратом Гольджи и т.д.
Несмотря на то, что жизненный цикл криптомикотов Rozella sp. в первом при-
ближении аналогичен таковому у афелид, за исключением отсутствия у данного рода
амебоидных расселительных стадий (Letcher, Powell, 2018), по всей видимости, для
представителей Rozella характерно более тонкое взаимодействие с клеткой хозяина, чем
для афелид. Существенные различия между представителями этих двух групп были
обнаружены при сравнительном анализе тонкого строения их клеток и особенностей
взаимоотношений с клеткой хозяина на ультраструктурном уровне. Как и афелиды,
криптомикоты проникают в пространство между клеточной стенкой и цитоплаз-
матической мембраной клетки хозяина (Powell et al., 2017). Афелиды после этого
359
поглощают содержимое клетки хозяина за счет фагоцитоза «извне», не проникая через
ее плазмалемму внутрь цитоплазмы. Представители рода Rozella, напротив, проника-
ют внутрь хозяинной клетки за счет инвагинации ее цитоплазматической мембраны
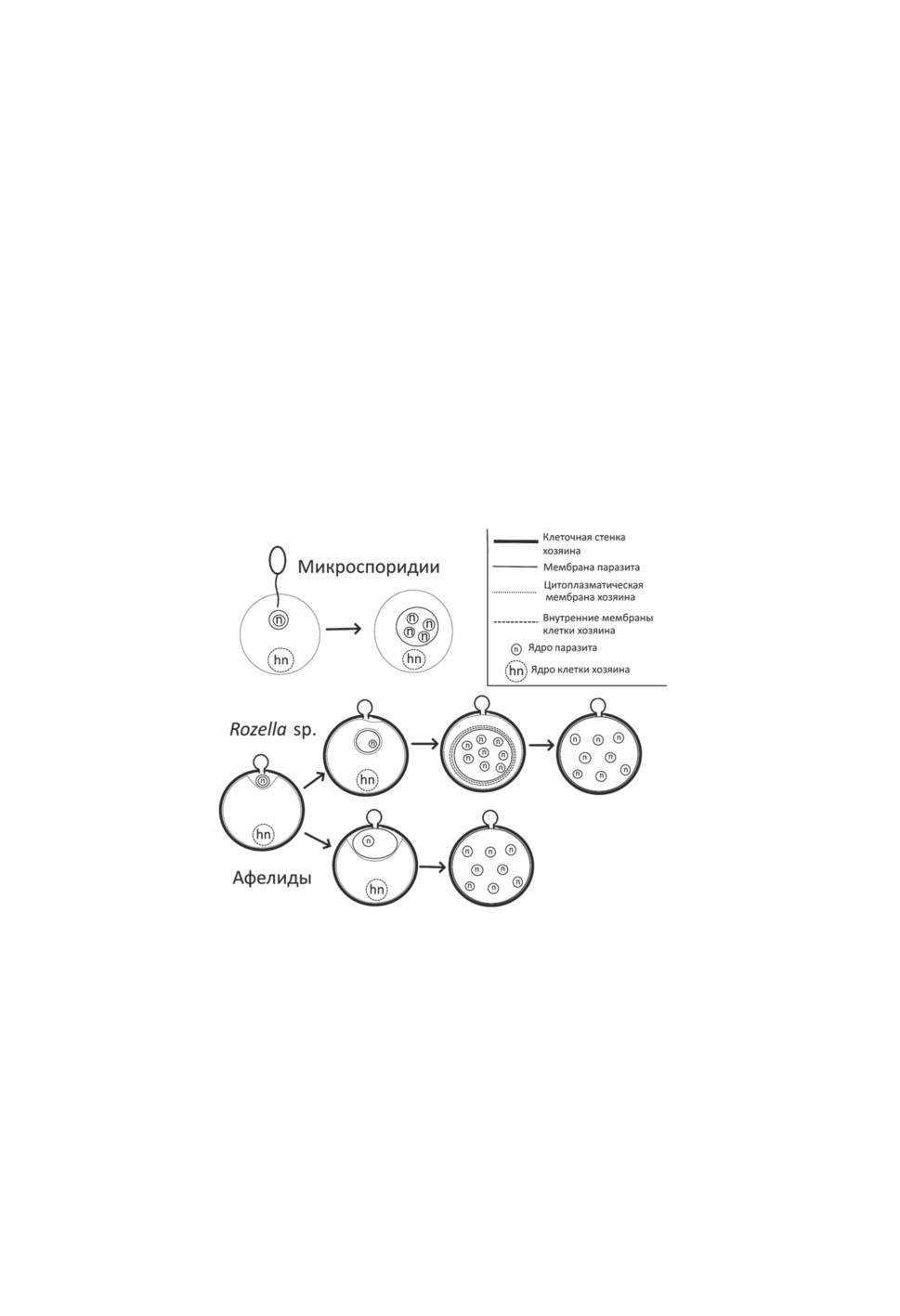
и затем поглощают ее содержимое «изнутри» (Powell, Letcher, 2019) (рис.2). При этом
если на раннем этапе заражения (около 24 ч после инфекции) паразит развивается
в вакуоли и окружен, помимо собственной плазмалеммы, одной мембраной, являю-
щейся производным плазмалеммы хозяина, то на более позднем этапе (около 96 ч)
развивающийся плазмодиум Rozella оказывается заключенным уже в двухмембранную
вакуоль. По мнению авторов последних исследований, описывавших инфекционный
процесс у R. allomycis (Powell et al., 2017; Powell, Letcher, 2019), первичная вакуоль
со временем разрушается, и образующаяся ей на смену двухмембранная структура
уже не является производным цитоплазматической мембраны хозяина. Эта вакуоль
может иметь разное происхождение и разную структуру у разных видов розеллид.
У R. allomycis и R. rhizoclosmatii она состоит образований, обозначенных авторами
как “host cisterna”, и имеет вид сплошной двойной мембраны, плотно прилегающей
к плазмалемме паразита. В тоже время плазмодиум R. polyphagi окружен разбросан-
ными участками гладкого и шероховатого эндоплазматического ретикулума хозяина,
не образующими сплошного слоя (Powell, Letcher, 2019).
Рисунок 2. Упрощенная схема фрагмента жизненного цикла от инфицирования клетки
хозяина до развития многоядерного плазмодия у микроспоридий, Rozella sp. и афелид,
иллюстрирующая различное положение данных организмов в клетках хозяев.
Figure 2. Simplified diagram of a life cycle fragment from infection of the host cell to the
development of multinucleated plasmodium in microsporidia, Rozella sp. and aphelids,
showing different localization of the organism in infected cells.
Некоторые виды Rozella, паразитирующие в гифах хитридиевых грибов, лишен-
ных классического клеточного строения, способны индуцировать в них образование
септ, благодаря чему в организме хозяина образуется обособленный компартмент, со-
держащий развивающегося паразита. По мнению авторов (Powell, Letcher, 2019), это
360
может быть необходимо паразиту для создания тургора внутри зараженной клетки,
способствующего выходу зооспор из хозяина. Кроме того, для представителей Rozella
показаны концентрация митохондрий хозяина вокруг развивающегося паразита и ча-
стичная деградация митохондрий самого патогена при внутриклеточном развитии
(Powell et al., 2017). Данную особенность можно рассматривать в качестве аргумента
в пользу теории о способности видов Rozella напрямую поглощать из клетки хозяина
АТФ для поддержания собственного развития и размножения, о чем подробнее будет
упомянуто в разделе, посвященном метаболизму. Кроме того, в клетках Rozella sp.,
как и у микроспоридий, не были обнаружены характерные для афелид диктиосомы
аппарата Гольджи (Powell et al., 2017).
В отличие от Rozella spp. и афелид, споры микроспоридий не способны к само-
стоятельному передвижению и представляют собой упакованные в систему оболочек
зародыши со сложно организованным аппаратом экструзии, необходимым для внедре-
ния паразита внутрь инфицируемой клетки. У каноничных микроспоридий этот аппарат
обычно состоит из уникальных для данной группы органелл: длинной нитевидной
полярной трубки, уложенной спирально, поляропласта, якорного диска и задней ва-
куоли (Исси, Воронин, 2007). Характерный для большинства видов микроспоридий
жизненный цикл включает в себя экструзию полярной трубки из споры паразита, про-
никновение зародыша в клетку хозяина, рост и размножение патогена, которое чаще
всего происходит за счет множественного деления - мерогонии. Затем микроспоридии
приступают к спорогонии, в результате чего образуются спорогональные плазмодии,
дающие начало споробластам, в которых происходит формирование спор. Обычно
на этом этапе происходит разрушение зараженной клетки хозяина; вышедшие таким
образом споры заражают другие клетки того же организма или выводятся наружу для
заражения других особей. Заражение многоклеточных животных обычно происходит
при попадании спор паразитов в пищеварительный тракт хозяина (Исси, Воронин,
2007). У некоторых микроспоридий жизненный цикл может значительно усложнять-
ся, включать в себя мейоз и половой процесс, смену нескольких хозяев, в которых
могут образовываться споры разных типов (Симакова, 2014). Клетки микроспоридий
лишены жгутиков и их производных, цистерн аппарата Гольджи. Их митохондрии
редуцированы до крохотных двухмембранных органелл - митосом, не обладающих
собственным геномом (Williams et al., 2002). Микроспоридии также утратили способ-
ность к фагоцитозу и везикулярному транспорту.
Споры базальных групп микроспоридий - Metchnikovellida и Chytridiopsida, а также
высших розеллид родов Nucleophaga, Paramicrosporidium, Morellospora и Mitosporidium
внешне напоминают каноничных микроспоридий, за исключением того, что в спорах
данных организмов отсутствует развитый аппарат экструзии. Для них характерно на-
личие короткой, не образующей витков полярной трубки; в спорах различных видов
могут быть также обнаружены отдельные структуры, напоминающие слабо развитые
аналоги других элементов аппарата экструзии каноничных микроспоридий (Corsaro
et al., 2016; Corsaro et al., 2019; Mikhailov et al., 2017). Важным отличием розеллид,
обладающих схожим с микроспоридиями строением споры, от базальных микроспо-
ридий также является наличие функциональных митохондрий, обладающих собствен-
ным геномом (Quandt et al., 2017). Кроме того, для данных организмов, по-видимому,
характерно множественное деление по типу мерогонии, в то время как у базальных
микроспоридий - Metchnikovellida и Chytridiopsida- такой вид деления не был обна-
ружен (Corsaro et al., 2019; Galindo et al., 2018).
361
Как мы уже отмечали во введении к настоящей работе, многочисленные расшиф-
ровки геномов каноничных микроспоридий показали их крайнюю редукцию и моди-
фикацию, что соотносится с чрезвычайно высокой специализацией этих организмов на
морфологическом уровне (Corradi, 2015; Cuomo et al., 2012). Анализ опубликованных
в последние годы данных расшифровки геномов розеллид и базальных микроспоридий
позволяет проследить, как формировалась данная особенность в эволюции и сопоста-
вить наблюдаемые морфофункциональные и молекулярные различия (James et al., 2013;
Galindo et al., 2018; Quandt et al., 2017). Наиболее глубокий анализ геномов розеллид
и базальных микроспоридий был произведен авторами расшифровки транскриптома
афелиды Paraphelidium tribonemae, которые, по нашему мнению, смогли выдвинуть
на основании собственных и литературных данных наиболее достоверную гипотезу
о ранних этапах эволюции грибов, афелид, розеллид и микроспоридий. Анализ транс-
криптома P. tribonemae продемонстрировал, что данные организмы практически не
претерпели редукции и специализации генома и, соответственно, различных функ-
циональных систем, что обычно свойственно внутриклеточным паразитам (Torruella
et al., 2018). По генетическому составу они оказались ближе к свободноживущим
зооспоровым грибам, чем к розеллидам и микроспоридиям.
Исходя из данных о сестринском положении грибов и афелид, авторы предположи-
ли, что последние наиболее близки к гипотетическому предку Opisthosporidia и грибов
и сохраняют большую часть черт, характерных для предковой формы. По мнению
авторов, такой организм представлял собой свободноживущего хищника, который, воз-
можно, как и афелиды, был приспособлен к эндобиотическому фаготрофному питанию
и имел амебофлагеллятную расселительную и покрытую хитином покоящуюся стадии.
Эволюционное развитие гипотетического предка грибов, розеллид и микроспоридий
в сторону общего предка различных групп грибов заключалось в утрате способ-
ности к фагоцитозу и переходе к осмотрофному питанию через клеточную стенку
из хитина, которая теперь окружала и вегетативную стадию, в то время как разви-
тие в сторону общего предка розеллид и микроспоридий подразумевало адаптацию
к внутриклеточному паразитизму, сопровождающуюся прогрессирующей редукцией
и специализацией геномов и различных клеточных систем данных организмов, в том
числе утратой подвижных расселительных стадий, способности к фагоцитозу, функ-
циональных митохондрий и т.д. (Torruella et al., 2018).
В данную концепцию логично вписываются описанные выше принципиальные
различия тонкого строения и взаимоотношений с клеткой хозяина между афелида-
ми и представителями рода Rozella, наблюдаемые при внешнем сходстве жизненных
циклов данных организмов. Афелиды, поглощающие клетки своих хозяев «извне»
и не вступающие с ними в более глубокие взаимоотношения, являются не настоящими
паразитами, а паразитоидами, наиболее близкими по образу жизни к свободноживуще-
му хищному предку, в то время как виды Rozella, развивающиеся внутри цитоплазмы
зараженных клеток, уже являются полноценными паразитами. И действительно, вы-
полненное ранее секвенирование генома R. allomycis показало, что для данного ор-
ганизма характерны признаки редукции и специализации генома и функционального
аппарата, выраженные чуть в меньшей степени, чем у микроспоридий и, вероятно,
унаследованные от общего эндопаразитарного предка (James et al., 2013).
Сравнительный анализ геномов розеллид и микроспоридий позволяет также про-
следить утрату последними способности к фагоцитозу и везикулярному транспорту.
В геноме у способного к фагоцитозу вида R. allomycis есть все необходимые гены
362
для этого процесса, в том числе белки TOR (белки-мишени для рапамицина) и кла-
трин (Wadi, Reinke, 2020). В геномах подобных микроспоридиям розеллид M. daphnia
и P. saccamoebae также присутствуют эти гены, хотя способность к фагоцитозу или
ее отсутствие не была экспериментально продемонстрирована для данных организмов
(Haag et al., 2014; Quandt et al., 2017). У базальных микроспоридий - мечниковеллид,
не способных к фагоцитозу, отсутствуют белки TOR, но все еще имеется клатрин,
в то время как у всех каноничных микроспоридий все указанные белки отсутствуют
(Wadi, Reinke, 2020).
На сегодняшний день доподлинно неизвестно, каким образом в эволюции сфор-
мировалось уникальное строение спор микроспоридий. Поскольку жизненный цикл
и строение спор и цист афелид и Rozella spp. адаптированы к инфицированию организ-
мов, обладающих клеточной стенкой, в первую очередь грибов и водорослей, логично
предположить, что формирование характерной для микроспоридий морфологии спор
и способа инфицирования связано с освоением нового круга хозяев, клетки которых
не обладают выраженной клеточной стенкой. И действительно, микроспоридии по-
ражают практически все группы животных, несколько групп протистов (грегарин,
инфузорий и парамиксид), но никогда не встречаются у грибов, высших растений
и водорослей (Stentiford et al., 2016, 2017; Yakovleva et al., 2020). Также на сегодняш-
ний день невозможно достоверно определить, какая стадия жизненного цикла Rozella
spp. может соответствовать спорам микроспоридий. Наиболее очевидным кандидатом
является циста, формирующаяся на поверхности хозяинной клетки и прорастающая
внутрь, т.к. данная стадия, как и спора микроспоридий, окружена хитином, а трубку
прорастания можно гипотетически считать аналогом полярной трубки микроспоридий.
Однако это предположение пока не было подкреплено экспериментальными данными.
Также пока неизвестно, является ли структура, напоминающая укороченную полярную
трубку у высших розеллид и базальных микроспоридий, аналогом полярной трубки
канонических микроспоридий. Неизвестно также, каким именно образом происходит
экструзия спор базальных микроспоридий и розеллид и внедрение зародышей этих
видов в клетки их хозяев.
Размер и структура генома
Геном микроспоридии Encephalitozoon intestinalis имеет размер всего 2.3 млн пар
нуклеотидов и кодирует около 1900 белков, что является наименьшим показателем
среди эукариот (Corradi etal., 2010). Геном данного организма также демонстрирует
беспрецедентный уровень компактизации: белок-кодирующие последовательности
составляют более 90 % генома, а промежутки между генами - в среднем 115 пар
оснований. Сопоставив данные о размере и структуре геномов разных видов микро-
споридий и их ближайших родственников, можно отметить, что тенденция к по-
добной компактизации является одним из основополагающих трендов их эволюции
(табл. 1). К примеру, для генома R. allomycis размером около 12 млн пар нуклеотидов,
в котором закодировано более 6300 белков, также характерны признаки редукции
и компактизации, однако менее выраженные, чем у микроспоридий (James et al.,
2013). Геномы высших розеллид P. saccamoebae и M. daphniae, находящихся ближе
к микроспоридиям на филогенетическом древе, уже значительно более редуцированы,
как и у базальных микроспоридий (табл. 1), а наивысшей степени компактизации
достигают только каноничные микроспоридии. Хотя для афелид пока отсутствуют
геномные данные, анализ транскриптома P. tribonemae выявил у данного организма более
10 тыс. потенциальных белок-кодирующих последовательностей (Torruella et al., 2018).
363
Таблица 1. Размеры геномов некоторых видов розеллид и микроспоридий
Table 1. Genome sizes of some species of Rozellida and Microsporidia
Размер генома
Количество
Вид
(млн пар нуклеотидов)
белок-кодирующих генов
Rozella allomycis
11.9
6350
Paramicrosporidium saccamoebae
7.3
3750
Mitosporidium daphniae
5.6
3330
Amphiamblys sp.
5.6
3642
Metchnikovella incurvata
5.4
2803
Nematocida parisii
4.1
2661
Edhazardia aedis*
51.3
4190
Enterocytozoon bieneusi
3.9
3632
Ordospora colligata
2.3
1820
Encephalitozoon intestinalis
2.2
1938
Nosema bombycis**
15.7
4468
При м еч а н ия. * Характеризуется сложным жизненным циклом, специфически адаптированным
к вертикальной передаче (см. текст).
** Характеризуется высокой эффективностью вертикальной передачи (см. текст).
Однако в наблюдаемую тенденцию компактизации генома видов, лежащих в осно-
вании филогенетического древа микроспоридий и родственных им групп, не вписыва-
ются многочисленные обнаружения каноничных микроспоридий с размером генома,
многократно превышающим средние значения для группы. Так, у микроспоридии
Edhazardia aedis размер генома составляет более 51 млн пар нуклеотидов, а у Nosema
bombycis, принадлежащей к группе эволюционно продвинутых микроспоридий
Terresporidia, - более 15 млн пар оснований (Pan et al., 2013). Таким образом, размер
генома в пределах одной группы может различаться более чем в 25 раз.
Развернутая гипотеза, объясняющая данное явление, была выдвинута только
в 2020 г. Авторы сопоставили известные геномы различных видов микроспоридий
с их образом жизни, а также провели собственное исследование геномов разных
видов микроспоридий, паразитирующих в одном и том же хозяине, и пришли к вы-
воду, что на эволюцию генома микроспоридий может сильно влиять структура по-
пуляции, в которой существуют данные организмы и которая во многом зависит
от характера их распространения (трансмиссии) в популяции хозяев (Haag etal., 2020).
По мнению авторов, у микроспоридий, в жизненном цикле которых присутствуют
специализированные механизмы вертикальной трансмиссии (передача из поколения
в поколение, в частности трансовариальным путем от родителей к потомкам у микро-
споридий насекомых), средний размер популяции оказывается значительно снижен, по
сравнению с видами, передающимися горизонтально. На такие популяции в гораздо
меньшей степени действуют силы естественного отбора, они подвергаются эффектам
«дрейфа генов» и «бутылочного горлышка», что значительно увеличивает участие
неадаптивных процессов в эволюции данных организмов (de Albuquerque et al., 2020;
Haag et al., 2020). У микроспоридий, преимущественно передающихся вертикально
за счет специализированных механизмов, в геноме могут накапливаться различные
повторяющиеся последовательности ДНК и другие участки, не относящиеся к белок-
364
кодирующим последовательностям. И действительно, для подавляющего большинства
микроспоридий с большим размером генома оказались характерны специализированные
механизмы вертикальной трансмиссии, тогда как виды с наиболее компактными гено-
мами передаются преимущественно горизонтально (среди особей одного поколения)
(de Albuquerque et al., 2020; Haag et al., 2020).
В геномах различных видов микроспоридий найдено всего около 800 консерва-
тивных белков, участвующих в основном в таких процессах, как репликация ДНК,
транскрипция и трансляция (Nakjang et al., 2013; Wadi, Reinke 2020). Интересно, что
32 семейства консервативных белков микроспоридий не обнаружены у других эукариот.
Некоторые из этих белков функционируют как часть полярной трубки или оболочки
споры, но функция большинства из них неизвестна (Nakjang et al., 2013; Wadi, Reinke
2020). Геном микроспоридий крайне вариативен и может содержать сотни уникальных
белков, отсутствующих даже у близкородственных видов того же рода (Reinke et al.,
2017). Из-за того, что многие белок-кодирующие последовательности микроспоридий,
как и их геномы в целом, редуцированы и модифицированы, зачастую простого анализа
присутствия или отсутствия у них генов, кодирующих белки, вовлеченные в определен-
ный процесс, недостаточно для определения функционирования этой системы. Согласно
результатам недавних исследований редуцированных рибосом микроспоридий, хотя
в геноме данных видов сохраняется относительно полный набор рибосомальных белков,
два из этих белков больше не являются структурными элементами данных органелл
и выполняют в клетках микроспоридий другие функции (Melnikov et al., 2018; Barandun
et al., 2019). К примеру, консервативный рибосомальный белок eS31у всех видов микро-
споридий утрачивает значительную часть своей аминокислотной последовательности
и связь с рибосомами. Однако данная молекула продолжает активно экспрессироваться
в клетках микроспоридий и, вероятно, участвует в биосинтезе убиквитина данных
организмов. Таким образом, можно сделать вывод, что многие компоненты клеток
микроспоридий, которые идентифицируются с помощью автоматической аннотации
геномов, могут утрачивать часть своих биологических функций из-за продолжающейся
редукции генома данных организмов в эволюции (Melnikov et al., 2018).
Система энергетического метаболизма
Система энергетического обмена микроспоридий демонстрирует наиболее яркий
пример их зависимости от хозяев. Некоторые из них полностью утратили способность
к самостоятельному синтезу АТФ, всецело полагаясь на метаболическую систему
хозяина (Wiredu et al., 2017). В целом, функционирование системы энергетического
метаболизма канонических микроспоридий может быть описано следующим образом:
(1) не обладая полноценными митохондриями, на стадии внутриклеточного развития
эти паразиты получают АТФ, транспортируя его из инфицированных клеток хозяев
с помощью уникальных АТФ-переносчиков (NTT translocases), приобретенных ими
в результате горизонтального переноса генов от бактерий; и (2) на стадии спор они
синтезируют это соединение посредством гликолиза с использованием глицерол-3-
фосфатного челнока и альтернативной оксидазы для реокисления восстановительных
эквивалентов, образующихся в ходе данного процесса (Williams et al., 2010). Эволюци-
онно продвинутые микроспоридии из группы Terresporidia утрачивают альтернативную
оксидазу и приобретают некий новый, на сегодняшний день не изученный механизм
для поддержания гликолиза (Timofeev et al., 2020). Некоторые представители этой
365
группы также утрачивают способность к гликолизу и, по всей видимости, адаптируют-
ся к АТФ-независимому существованию на стадии споры и инфицированию хозяина
(Keeling et al., 2010; Wiredu et al., 2017).
У мечниковеллид - базальных микроспоридий - также отсутствуют митохондрии
и, соответственно, способность к окислительному фосфорилированию. Кроме того,
у этих паразитов не обнаружена альтернативная оксидаза и характерные для других
микроспоридий АТФ-переносчики. По всей видимости, данные организмы могут син-
тезировать АТФ за счет гликолиза, используя пока не известный механизм его под-
держания. Авторы расшифровки геномов Amphiamblys sp. и Metchnikovella incurvata
предполагают, что на стадии внутриклеточного развития мечниковеллиды, как и высшие
микроспоридии, могут транспортировать из клетки хозяина АТФ, но используют для
этого переносчики другого типа (MCF) (Mikhailov et al., 2017; Galindo et al., 2018),
однако эта особенность еще не была подтверждена экспериментально.
Все представители розеллид обладают функциональными митохондриями и спо-
собностью к окислительному фосфорилированию (у P. saccamoebae эти органеллы
еще не были выявлены морфологически; имеются данные только о митохондриальном
геноме). У различных представителей группы может наблюдаться незначительная
редукция данных органелл, которая, по всей видимости, происходит у разных видов
независимо и заключается в утрате ими комплекса 1 окислительного фосфорилиро-
вания (James et al., 2013; Haag et al., 2014; Quandt et al., 2017). Интересно, что только
у наиболее базального вида данной группы, Rozella sp., но не у других близкородствен-
ных микроспоридиям паразитов, были обнаружены подобные микроспоридиальным
АТФ-переносчики, способные напрямую транспортировать АТФ из зараженной клетки
хозяина (Dean et al., 2018). Данный факт можно объяснить тем, что эти переносчики
могли быть приобретены независимо представителями рода Rozella sp. и каноничны-
ми микроспоридиями. Однако согласно исследованиям структуры и функций данных
транспортеров, более вероятны их приобретение розеллидами и микроспоридиями
от общего предка, и последующая утрата высшими розеллидами и базальными ми-
кроспоридиями (Heinz et al., 2014; Dean et al., 2018). Косвенным подтверждением
этой гипотезы стало недавнее обнаружение нового семейства транспортеров АТФ
(MFS transporters) в геномах у всех розеллид и микроспоридий и демонстрация по-
тенциальной способности этих транспортеров работать аналогично АТФ-переносчикам
(NTT translocases), т. е. участвовать в транспорте АТФ из клеток хозяев, зараженных
этими паразитами (Major et al., 2019).
Собрав воедино представленные выше данные, можно выстроить краткое описа-
ние гипотетического эволюционного пути микроспоридий, в результате которого они
стали экстремально специализированными внутриклеточными паразитами. Общий
предок микроспоридий и грибов, вероятно, был свободноживущим эндобиотическим
хищником или паразитоидом, который поражал организмы с выраженной клеточной
стенкой и обладал амебофлагеллятной расселительной стадией. Этот организм имел
полноценные, не редуцированные геном и систему энергетического метаболизма и по
всем характеристикам, вероятно, был близок к современным афелидам. В дальней-
шем данные организмы постепенно стали вступать в более тонкие взаимодействия
с клетками хозяев и в какой-то момент перешли от простого поедания содержимого
зараженных клеток к внутриклеточному паразитированию. На этом этапе начинается
процесс редукции генома и функционального аппарата этих организмов, который до-
366
стиг своей высшей степени уже у самих микроспоридий. Важным этапом эволюции
предков микроспоридий на этой стадии было приобретение ими уникальных АТФ-
переносчиков, способных напрямую транспортировать данное соединение из клеток
хозяина. Такие организмы больше зависели от своих хозяев, но все еще сохраняли
митохондрии и способность к окислительному фосфорилированию. Наиболее близ-
кими к такому предковому состоянию являются современные представители рода
Rozella. На следующем этапе произошло резкое изменение морфологии расселительной
стадии, с утратой жгутикового аппарата и ее превращением в неподвижную спору,
обладающую специализированным аппаратом экструзии, что, вероятнее всего, могло
быть связано с освоением нового круга хозяев - предков животных и простейших, не
обладающих выраженной клеточной стенкой. На этом этапе редукция и специализа-
ция геномов данных организмов уже достигла беспрецедентной для других эукариот
степени, однако они все еще сохраняли функциональные митохондрии и не достигли
высшей степени зависимости от своих хозяев. Наиболее близки к такому предковому
состоянию высшие розеллиды - Paramicrosporidium, Mitosporidium и др. Степень за-
висимости предков микроспоридий от их хозяев все возрастала и в какой-то момент их
митохондрии были редуцированы до митосом, неспособных к синтезу АТФ. Близкими
к такому состоянию являются современные базальные микроспоридии. И, наконец,
максимальную степень редукции и специализации генома, значительное усложнение
и совершенствование аппарата экструзии спор, а также полную утрату собственной
системы энергетического метаболизма мы можем наблюдать у различных видов ка-
ноничных микроспоридий.
БЛАГОДАРНОСТИ
Авторы выражают благодарностью ведущему научному сотруднику ФГБНУ ВИЗР
(Санкт-Петербург, Пушкин, Россия) Юрию Сергеевичу Токареву за критическую оценку
и правку рукописи статьи.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного
проекта № 19-14-50132.
Acknowledgements: The reported study was funded by RFBR, project number 19-14-
50132.
СПИСОК ЛИТЕРАТУРЫ
Исси И.В., Воронин В.Н. 2007. Тип Microsporidia. В кн.: Алимов А.Ф. (гл. ред.). Протисты: Руководство
по зоологии, ч. 2. СПб, Наука, 994-1045.
Симакова А.В. 2014. Сравнение таксономической значимости морфологических и молекулярно-генетических
признаков в систематике микроспоридий (Microsporidia) кровососущих комаров (Diptera: Culicidae).
Паразитология 48 (4): 284-301.
Тимофеев С.А. 2015. Современные представления о микроспоридиозе человека. Вестник РАМН 70 (2):
257-263.
Токарев Ю.С., Симакова А.В., Тимофеев С.А., Малыш Ю.М., Соколова О.И., Исси И.В. 2016. Гостальная
специфичность микроспоридий. Паразитология 50 (6): 446-459.
Adl S.M., Bass D., Lane C.E., Lukeš J., Schoch C.L., Smirnov A., Agatha S., Berney C., Brown M.W., Burki
F., Cárdenas P., Čepička I., Chistyakova L., delCampo J., Dunthorn M., Edvardsen B., Eglit Y., Guillou
L., Hampl V., Heiss A.A., Hoppenrath M., James T.Y., Karnkowska A., Karpov S., Kim E., Kolisko M.,
Kudryavtsev A., Lahr D.J., Lara E., LeGall L., Lynn D.H., Mann D.G., Massana R., Mitchell E.A., Morrow
C., Park J.S., Pawlowski J.W., Powell M.J., Richter D.J., Rueckert S., Shadwick L., Shimano S., Spiegel
F.W., Torruella G., Youssef N., Zlatogursky V. Zhang Q. 2019. Revisions to the classification, nomenclature,
and diversity of Eukaryotes. Journal of Eukaryotic Microbiology 66: 4-119.
367
Alexander W.G., Wisecaver J.H., Rokas A., Hittinger C.T. 2016. Horizontally acquired genes in early-diverging
pathogenic fungi enable the use of host nucleosides and nucleotides. PNAS 113: 4116-4121.
Barandun J., Hunziker M., Vossbrinck C.R., Klinge S. 2019. Evolutionary compaction and adaptation visualized
by the structure of the dormant microsporidian ribosome. Nature Microbiology 4: 1798-1804.
Bass D., Czech L., Williams B.A., Edric Berney C., Dunthorn M., Mah E.G., Torruella G.E., Stentiford G.D.,
Williams T.A. 2018. Clarifying the relationships between Microsporidia and Cryptomycota. Journal of
Eukaryotic Microbiology 65: 773-782.
Capella-Gutiérrez S., Marcet-Houben M., Gabaldón T. 2012. Phylogenomics supports microsporidia as the earliest
diverging clade of sequenced fungi. BMC Biology10: 47.
Corradi N. 2015. Microsporidia: eukaryotic intracellular parasites shaped by gene loss and horizontal gene transfers.
Annual Review of Microbiology 69: 167-183.
Corradi N., Pombert J.-F., Farinelli L., Didier E.S., Keeling P.J. 2010. The complete sequence of the smallest
known nuclear genome from the microsporidian Encephalitozoon intestinalis. Nature Communications 1: 77.
Сorsaro D., Michel R., Walochnik J., Venditti D., Müller K.-D., Hauröder B., Wylezich C. 2016. Molecular
identification of Nucleophaga terricolae sp. nov. (Rozellomycota), and new insights on the origin of the
Microsporidia. Parasitology Research 115 (8): 3003-3011.
Corsaro D., Walochnik J., Venditti D., Müller K.D., Hauröder B., Michel R. 2014. Rediscovery of Nucleophaga
amoebae, a novel member of the Rozellomycota. Parasitology Research 113: 4491-4498.
Corsaro D., Walochnik J., Venditti D., Steinmann J., Müller K.D., Michel R. 2014a. Microsporidia-like parasites
of amoebae belong to the early fungal lineage rozellomycota. Parasitology Research 113: 1909-1918.
Corsaro D., Wylezich C., Venditti D., Michel R., Walochnik J., Wegensteiner R. 2019. Filling gaps in the
microsporidian tree: rDNA phylogeny of Chytridiopsis typographi (Microsporidia: Chytridiopsida).
Parasitology Research 118: 169-180.
Corsaro D., Walochnik J., Venditti D., Hauröder B., Michel R. 2020. Solving an old enigma: Morellospora
saccamoebae gen. nov., sp. nov. (Rozellomycota), a Sphaerita-like parasite of free-living amoebae.
Parasitology Research 119: 925-934.
Cuomo C.A., Desjardins C.A., Bakowski M.A., Goldberg J., Ma A.T., Becnel J.J., Didier E.S., Fan L., Heiman D.I.,
Levin J.Z., Young S., Zeng Q., Troemel E.R. 2012. Microsporidian genome analysis reveals evolutionary
strategies for obligate intracellular growth. Genome Research 22: 2478-2488.
de Albuquerque N.R.M., Ebert D., Haag K.L. 2020. Transposable element abundance correlates with mode of
transmission in microsporidian parasites. Mobile DNA 11: 19.
Dean P., Sendra K.M., Williams T.A., Watson A.K., Major P., Nakjang S., Kozhevnikova E., Goldberg A.V.,
Kunji E.R.S., Hirt R.P., Embley T.M. 2018. Transporter gene acquisition and innovation in the evolution
of Microsporidia intracellular parasites. Nature Communications 9 (1): 1-12.
Dean P., Hirt R.P., Embley T.M. 2016. Microsporidia: why make nucleotides if you can steal them? PLOS Pathogens
12: e1005870
Dolgikh V.V., Senderskiy I.V., Pavlova O.A., Naumov A.M. and Beznoussenko G.V. 2011. Immunolocalization of
an alternative respiratory chain in Antonospora (Paranosema) locustae spores: mitosomes retain their role
in microsporidial energy metabolism. Eukaryotic Cell 10: 588-593.
Galindo L.J., Torruella G., Moreira D., Timpano H., Paskerova G., Smirnov A., Nassonova E., López-García
P. 2018. Evolutionary genomics of Metchnikovella incurvata (Metchnikovellidae): An early branching
Microsporidium. Genome Biology and Evolution 10: 2736-2748.
Gromov B.V. 2000. Algal parasites of the genera Aphelidium, Amoeboaphelidium, and Pseudaphelidium from the
Cienkovski’s “monadinea” group as representatives of a new class. Zoologicheskij Zhurnal 79: 517-525.
Heinz E., Hacker C., Dean P., Mifsud J., Goldberg A.V., Williams T.A., Nakjang S., Gregory A., Hirt R.P., Lucocq
J.M. 2014. Plasma membrane-located purine nucleotide transport proteins are key components for host
exploitation by microsporidian intracellular parasites. PLOS Pathogens 10: e1004547
Haag K.L., Pombert J.-F., Sun Y., de Albuquerque N.R.M., Batliner B., Fields P., Lopes T.F., Ebert D. 2020.
Microsporidia with vertical transmission were likely shaped by nonadaptive processes. Genome Biology
and Evolution 12: 3599-3614.
Haag K.L., James T.Y., Pombert J.F., Larsson R., Schaer T.M., Refardt D., Ebert D. 2014. Evolution of a
morphological novelty occurred before genome compaction in a lineage of extreme parasites. PNAS 111:
15480-15485.
Hirt R.P., Logsdon J.M., Jr, Healy B., Dorey M.W., Doolittle W.F., Embley T.M. 1999. Microsporidia are related
to Fungi: evidence from the largest subunit of RNA polymerase II and other proteins. PNAS 96: 580-585.
James T.Y., Pelin A., Bonen L., Ahrendt S., Sain D., Corradi N., Stajich J.E. 2013. Shared signatures of parasitism
and phylogenomics unite cryptomycota and microsporidia. Current Biology 23: 1548-1553.
368
JonesM.D.M., Forn I., Gadelha C., Egan M.J., Bass D., Massana R., Richards T.A. 2011. Discovery of novel
intermediate forms redefines the fungal tree of life. Nature 474: 200-203.
Karpov S.A., Mamkaeva M.A., Aleoshin V.V., Nassonova E., Lilje O., Gleason F.H. 2014. Morphology, phylogeny,
and ecology of the aphelids (Aphelidea, Opisthokonta) and proposal for the new superphylum Opisthosporidia.
Frontiers in Microbiology 5: 1-11.
Karpov S.A., Mikhailov K.V., Mirzaeva G.S., Mirabdullaev I.M., Mamkaeva K.A., Titova N.N., Aleoshin V.V. 2013.
Obligately phagotrophic aphelids turned out to branch with the earliest-diverging fungi. Protist 164: 195-205.
Karpov S.A., Torruella G., Moreira D., Mamkaeva M.A., López-García P. 2017. Molecular phylogeny of
Paraphelidium letcheri sp. nov. (Aphelida, Opisthosporidia). Journal of Eukaryotic Microbiology 64: 573-578.
Keeling P.J., Luker M.A., Palmer J.D. 2000. Evidence from beta-tubulin phylogeny that microsporidia evolved
from within the fungi. Molecular Biology and Evolution 17: 23-31.
Keeling P.J., Corradi N., Morrison H.G., Haag K.L., Ebert D., Weiss L.M., Akiyoshi D.E., Tzipori S. 2010.
The reduced genome of the parasitic microsporidian Enterocytozoon bieneusi lacks genes for core carbon
metabolism. Genome Biology and Evolution 2: 304-309.
Lara E., Moreira D., López-García P. 2010. The environmental clade LKM11 and Rozella form the deepest
branching clade of fungi. Protist 161: 116-121.
Letcher P.M., Powell M.J. 2018. A taxonomic summary and revision of Rozella (Cryptomycota). IMA Fungus
9: 383-399.
Letcher P.M., Powell M.J. 2019. A taxonomic summary of Aphelidiaceae. IMA Fungus 1 (1): 4.
Major P., Sendra K.M., Dean P., Williams T.A., Watson A.K., Thwaites D.T., Embley T.M., Hirt R.P. 2019. A
new family of cell surface located purine transporters in microsporidia and related fungal endoparasites.
eLife8: e47037
Martín-Hernández R., Bartolomé C., Chejanovsky N., Le Conte, Y., Dalmon A., Dussaubat C., García-Palencia
P., Meana A., Pinto M.A., Soroker V., Higes M. 2018. Nosema ceranae in Apis mellifera: a 12 years post-
detection perspective. Environmental Microbiology 20 (4): 1302-1329.
Mikhailov K.V., Simdyanov T.G., Aleoshin V.V. 2017. Genomic survey of a hyperparasitic microsporidian
Amphiamblys sp. (Metchnikovellidae). Genome Biology and Evolution 9: 454-467.
Melnikov S.V., Manakongtreecheep K., Rivera K.D., Makarenko A., Pappin D.J., Soll D. 2018. Muller’s ratchet
and ribosome degeneration in the obligate intracellular parasites Microsporidia. International Journal of
Molecular Sciences 19 (12): 4125.
Nakjang S., Williams T.A., Heinz E., Watson A.K., Foster P.G., Sendra K.M., Heaps S.E., Hirt R.P., Embley
T.M. 2013. Reduction and expansion in microsporidian genome evolution: new insights from comparative
genomics. Genome Biology and Evolution 5: 2285-2303.
Powell M.J., Letcher P.M., James T.Y. 2017. Ultrastructural characterization of the host-parasite interface between
Allomyces anomalus (Blastocladiomycota) and Rozella allomycis (Cryptomycota). Fungal Biology 121:
561-572.
Powell M.J., Letcher P.M. 2019. Ultrastructure of early stages of Rozella allomycis (Cryptomycota) infection of
its host, Allomyces macrogynus (Blastocladiomycota). Fungal Biology 123 (2): 109-116.
Pan G., Xu J., Li T., Xia Q., Liu S.L., Zhang G., Li S., Li C., Liu H., Yang L., Liu T., Zhang X., Wu, Z., Fan W.,
Dang X., Xiang H., Tao M., Li Y., Hu J., Li Z., Lin L., Luo J., Geng L., Wang L., Long M., Wan Y., He N.,
Zhang Z., Lu C., Keeling P.J., Wang J., Xiang Z., Zhou Z. 2013. Comparative genomics of parasitic silkworm
microsporidia reveal an association between genome expansion and host adaptation. BMC Genomics 14: 186.
Quandt C.A., Beaudet D., Corsaro D., Walochnik J., Michel R., Corradi N., James T.Y. 2017. The genome of
an intranuclear parasite, Paramicrosporidium saccamoebae, reveals alternative adaptations to obligate
intracellular parasitism. eLife 6: e29594
Reinke A.W., Balla K.M., Bennett E.J., Troemel E.R. 2017. Identification of microsporidia host-exposed proteins
reveals a repertoire of rapidly evolving proteins. Nature Communications 8: 14023.
Seto K., Matsuzawa T., Kuno H., Kagami M. 2020. Morphology, ultrastructure, and molecular phylogeny of
Aphelidium collabens sp. nov. (Aphelida), a parasitoid of a green alga Coccomyxa sp. Protist 171: 125728.
Stentiford G.D., Becnel J., Weiss L.M., Keeling P.J., Didier E.S., Williams B.P., Bjornson S., Kent M.L., Freeman
M.A., Brown M.J.F., Troemel E.R., Roesel K., Sokolova Y., Snowden K.F., Solter L. 2016. Microsporidia
- Emergent pathogens in the global food chain. Trends in Parasitology 32: 336-348.
Stentiford G.D., Ramilo A., Abollo E., Kerr R., Bateman K.S., Feist S.W., Bass D., Villalba A. 2017. Hyperspora
aquatica n. gen., n. sp. (Microsporidia), hyperparasitic in Marteilia cochillia (Paramyxida), is closely related
to crustacean-infecting microspordian taxa. Parasitology 144 (2): 186-199.
Tedersoo L., Sánchez-Ramírez S., Kõljalg U., Bahram M., Döring M., Schigel D., May T., Ryberg M., Abarenkov
K. 2018. High-level classification of the Fungi and a tool for evolutionary ecological analyses. Fungal
Diversity 90: 135-159.
369
Timofeev S., Tokarev Y., Dolgikh V. 2020. Energy metabolism and its evolution in Microsporidia and allied taxa.
Parasitology Research 119 (5): 1433-1441.
Torruella G., Grau-Bové X., Moreira D., Karpov S.A., Burns J.A., Sebé-Pedrós A., Völcker E., López-García P.
2018. Global transcriptome analysis of the aphelid Paraphelidium tribonemae supports the phagotrophic
origin of fungi. Communications Biology 1: 231.
Tsaousis A.D., Kunji E.R., Goldberg A.V., Lucocq J.M., Hirt R.P., Embley T.M. 2008. A novel route for ATP
acquisition by the remnant mitochondria of Encephalitozoon cuniculi. Nature 453: 553-556.
Wadi L., Reinke A.W. 2020. Evolution of microsporidia: An extremely successful group of eukaryotic intracellular
parasites. PLOS Pathogens 16(2): e1008276
Williams B.A., Elliot C., Burri L., Kido Y., Kita K., Moore A.L., Keeling P.J. 2010. A broad distribution of the
alternative oxidase in microsporidian parasites. PLOS Pathogens 6: e1000761
Williams B.A., Hirt R.P., Lucocq J.M., Embley T.M. 2002. A mitochondrial remnant in the microsporidian
Trachipleistophora hominis. Nature 418: 865-869.
Wiredu B.D., Jaroenlak P., Prachumwat A., Williams T.A., Bateman K.S., Itsathitphaisarn O., Sritunyalucksana K.,
Paszkiewicz K.H., Moore K.A., Stentiford G.D., Williams B.A. 2017. Decay of the glycolytic pathway and
adaptation to intranuclear parasitism within Enterocytozoonidae microsporidia. Environmental Microbiology
19: 2077-2089.
Yakovleva Y., Nassonova E., Lebedeva N., Lanzoni O., Petroni G., Potekhin A., Sabaneyeva E. 2020. The first
case of microsporidiosis in Paramecium. Parasitology 147 (9): 957-971.
MICROSPORIDIA AND THEIR CLOSEST RELATIVES: CURRENT IDEAS ABOUT
THE EVOLUTION OF A UNIQUE GROUP OF EXTREME PARASITES
S. A. Timofeev, I. V. Senderskiy, V. S. Zhuravlev, V. V. Dolgikh
Key words: Microsporidia, Aphelida, Cryptomycota, intracellular parasites, evolution
SUMMARY
This review presents modern ideas about the evolution and phylogeny of a group of obligate
intracellular eukaryotic parasites - the Microsporidia. In the process of adaptation to the intracellular
parasitism, the genome and functional apparatus of these organisms was significantly reduced and
modified. The systematic position of this group remained unclear for a long time, and it was not known
for certain how the evolution of microsporidia occurred, when and how they acquired their unique
adaptations to the parasitic lifestyle. A real breakthrough in the study of the evolution of microsporidia
has been made only in the last few years. The groups that occupy the position closest to microsporidia
on the tree of life were found and described: Cryptomycota (Rozellida) and Aphelida. Sequencing of
the genomes of representatives of these groups, which also belong to intracellular parasites, and the
first genomic data on the representatives of the basal branches of microsporidia obtained in 2013-2020,
made it possible to take a fresh look at the evolution of microsporidia and their closest relatives, to
find intermediate forms on the way to adaptation to intracellular parasitism.
370