ПАРАЗИТОЛОГИЯ, 2020, том 54, № 5, с. 371-401.
УДК 594.38 + 591.113.1 + 571.27
ЗАЩИТНЫЕ РЕАКЦИИ ЛЕГОЧНЫХ МОЛЛЮСКОВ
ПРИ ПАРАЗИТАРНОЙ ИНВАЗИИ
© 2020 г. Г. Л. Атаев⁕, Е. Е. Прохорова, А. С. Токмакова
Российский государственный педагогический университет им. А.И. Герцена,
кафедра зоологии, лаборатория экспериментальной зоологии,
наб. р. Мойки, д. 48, Санкт-Петербург, 191186 Россия
⁕e-mail: ataev@herzen.spb.ru
Поступила в редакцию 27.07.2020 г.
После доработки 21.08.2020 г.
Принята к печати 27.08.2020 г.
В последние десятилетия во всем мире активно изучаются защитные реакции легочных
моллюсков. В результате накоплены многочисленные сведения о различных аспектах иммунного
ответа пульмонат как на клеточном, так и на гуморальном уровнях. Анализу этого материала в
последние годы посвящено несколько обзорных статей (Adema, Loker, 2015; Pila et al., 2016a;
Melillo et al., 2018; Li et al., 2020). Однако в отечественной литературе подобные работы опу-
бликованы более пятнадцати лет назад (Атаев, Полевщиков, 2004; Атаев и др., 2005а, б; Галак-
тионов, 2005). Именно с целью обобщения современных представлений об иммунном ответе
легочных моллюсков и обозначения основных проблем, связанных с их изучением, выполнен
данный обзор. В работе рассматриваются защитные реакции моллюсков на различные факторы
иммунизации, но основное внимание уделяется иммунным реакциям на трематодную инвазию.
Это обусловлено не только большим значением пульмонат как промежуточных хозяев трематод,
но и ролью последних в развитии иммунитета моллюсков.
Ключевые слова: легочные моллюски, клеточный иммунитет, гуморальный иммунитет,
гемоциты, гемопоэз
DOI: 10.31857/S1234567806050028
У позвоночных животных наряду с системой врожденного иммунитета функцио-
нирует система адаптивного иммунитета. Ее отличительными признаками являются
способность распознавать антигены и реагировать на них с образованием клонов
лимфоцитов и высокоаффинных антител, а также наличие клеточной иммунной па-
мяти, которая позволяет более эффективно реагировать на патоген при повторной
иммунизации.
Долгое время существование подобной защитной системы у беспозвоночных боль-
шинством ученых не допускалось из-за отсутствия у этих животных «истинных»
лимфоцитов и антител. Однако в последнее время стали появляться данные, свиде-
тельствующие о наличии у представителей различных групп беспозвоночных, прежде
371
всего у моллюсков и артропод, защитных механизмов, демонстрирующих признаки
адаптивного иммунитета (Rowley, Powell, 2007; Adema, Loker, 2015; Gourbal et al., 2018
и др.). В частности, беспозвоночные животные могут быстрее и эффективнее реаги-
ровать на чужеродный фактор при повторной иммунизации. Доказательства наличия
иммунологической памяти у беспозвоночных получены при проведении исследований
инфекционного иммунитета, трансплантационного иммунитета и иммунного прайми-
рования с использованием чужеродных молекул. В то же время остаются дискуссион-
ными многие вопросы, прежде всего связанные с раскрытием механизмов иммунных
реакций, включая иммунологическую память (Gourbal et al., 2018; Melillo et al., 2018).
Современная концепция врожденного иммунитета, основанная на способности
клеток распознавать патоген-ассоциированные молекулярные паттерны (образы па-
тогенности) (Janeway, Medzhitov, 2002), позволила по-новому взглянуть на пробле-
му специфичности в системе врожденного иммунитета. Выяснилось, что явление
групповой специфичности к патогенам - важная характеристика клеток врожденного
иммунитета, которая реализуется благодаря наличию у них разнообразных патоген-
распознающих рецепторов. В то же время, раскрытие путей реализации основных форм
адаптивного иммунного ответа показало невозможность его запуска и реализации без
компонентов системы врожденного иммунитета. Это привело к пересмотру самого
понятия «специфичность», в том числе и в отношении беспозвоночных животных.
При этом механизмы защитных реакций беспозвоночных могут различаться как по
продолжительности, так и по специфичности в зависимости от природы патогена
(Adema, Loker, 2015).
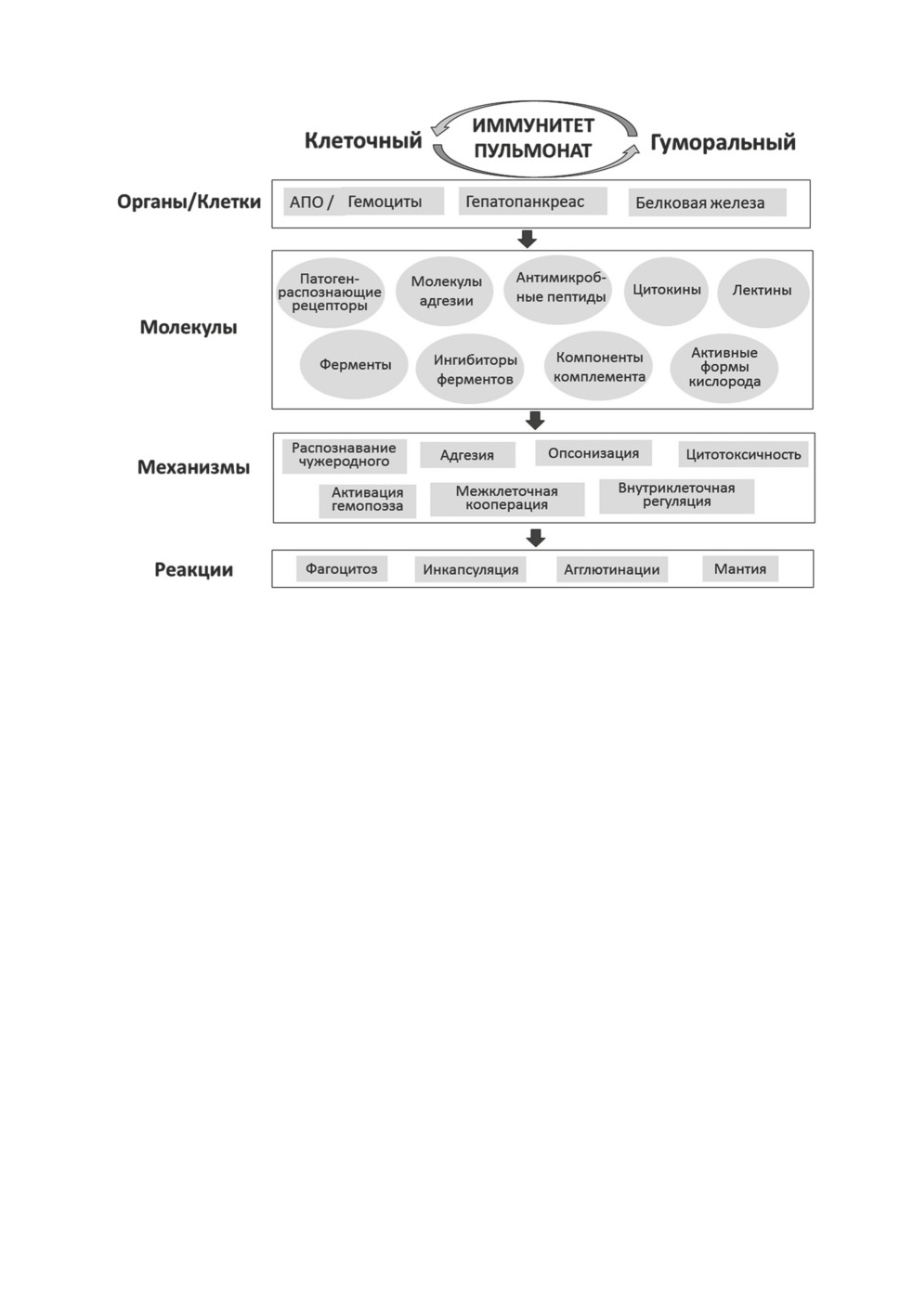
Традиционно рассматриваются два аспекта иммунных реакций животных: клеточ-
ный и гуморальный. Однако ключевым звеном осуществления иммунных реакций на
любом уровне признаются циркулирующие клетки, которые, кроме участия в эли-
минации чужеродного, также задействованы в образовании гуморальных факторов
(Adema, Loker, 2015). Соответственно, провести четкую границу между клеточным
и гуморальным иммунитетом зачастую невозможно (рис. 1).
Моллюски среди беспозвоночных обладают одними из наиболее сложных и эф-
фективных иммунных реакций. Данный обзор посвящен анализу защитных реакций
легочных моллюсков, которые в настоящее время, наряду с насекомыми, наиболее
активно изучаются в этом направлении. Понятие «иммунитет» в отношении моллю-
сков подразумевает способность последних адресно распознавать паразитических
представителей таксонов разного уровня, включая конкретные виды и даже штаммы
паразитов, а также активировать защитные механизмы, которые в итоге приводят
к элиминации патогена.
Защитные реакции моллюсков (прежде всего, клеточные) изучаются с середины
прошлого века. Накоплен большой экспериментальный материал о характере про-
текания трематодной инвазии для разных моделей (см. ниже). К сожалению, многие
прекрасно спланированные и проведенные исследования иллюстрируют ход иммун-
ных реакций, но не раскрывают механизмов их реализации. Поэтому большинство
сделанных выводов носят предположительный характер. И только в последние годы
исследования иммунного ответа моллюсков вышли на новый теоретический и мето-
дический уровни. Так, благодаря внедрению новых подходов стали возможны иссле-
дования паразито-хозяинных отношений на молекулярном уровне - генотипической
372
Рисунок 1. Компоненты иммунитета пульмонат.
Figure 1. Components of immunity of pulmonate molluscs.
совместимости улиток и трематод и межмолекулярных взаимодействий компонентов
системы иммунитета и паразита в ходе трематодной инвазии.
Анализу старых работ, многие из которых стали классическими, мы посвятили
предыдущие статьи (Атаев, Полевщиков, 2004; Атаев и др., 2005а, б). Здесь же мы по-
старались обобщить, прежде всего, результаты современных исследований иммунных
реакций легочных моллюсков.
За время своего существования моллюски приобрели очень широкий круг симби-
онтов, включающий как простых комменсалов, так и облигатных и узкоспецифичных
паразитов, относящихся к самым разным систематическим группам - от протистов до
целомических червей. Однако развитие иммунитета легочных моллюсков и в целом
гастропод прежде всего связано с эволюционно сложившимися паразито-хозяинными
системами «трематоды-моллюски» (Cribb et al., 2001; Атаев, Полевщиков, 2004;
Lockyer et al., 2004; Adema, Loker, 2015), в которых брюхоногие моллюски выступа-
ют в качестве первых, а иногда и вторых промежуточных хозяев (в случае развития в
них метацеркарий). Мирацидии избирательно заражают улиток, превращаются в них
в материнскую спороцисту, в результате развития и размножения которой формируются
дочерние поколения партенит (редии/спороцисты), способные отрождать следующие
генерации партенит и (или) личинок марит - церкарий.
Формирование инфрапопуляций партенит в моллюске может подчиняться раз-
личной стратегии паразитизма, однако во всех случаях подразумевает переключение
ресурсов хозяина на ее поддержание и развитие. В результате происходят значительные
373
изменения в физиологии хозяина. Одним из широко известных воздействий является
эффект паразитарной кастрации, проявляющийся в подавлении способности моллюска
размножаться. При этом реализуются две основные стратегии внутримоллюскового
развития трематод: формирование инфрапопуляции партенит лимитированного либо
пролонгированного типов (Атаев, 2017). В зависимости от этого зараженные улитки
эмитируют церкарий от нескольких дней до нескольких месяцев и даже лет. И все
это время партениты находятся в тесном контакте с тканями моллюска-хозяина
и их иммунной системой. В результате длительной коэволюции между трематодами
и моллюсками сложились тесные взаимодействия, отражающие уровень противоре-
чивых потребностей паразита и хозяина (Lockyer et al., 2004).
При долгом соседстве высокопатогенной линии паразитов с определенной груп-
пой хозяев можно ожидать, что иммунитет моллюсков станет более специфичным
в отношении распознавания и элиминации определенного вида (штамма) трематод, по
сравнению с другими гельминтами, не представляющими для них опасности.
Результаты изучения специфичности паразито-хозяинных систем «трематоды-мол-
люски» показали, что повторное заражение может вызывать два основных варианта
иммунного ответа моллюска. С одной стороны, имеется большое количество работ,
в которых отмечается повышение резистентности улиток на повторное заражение лю-
бым видом трематод (Lie, Heyneman, 1975; Lie et al., 1982, 1983; Sullivan et al., 1982;
Sire et al., 1998). Это явление получило название «личиночного антагонизма» (Sullivan,
Hu, 1996; Sire et al., 1998). Например, при последовательном заражении Biomphalaria
glabrata сначала Schistosoma mansoni, а затем Cotylurus lutzi двойного заражения не
возникает в том случае, если партениты шистосом развивались в моллюске 15 или
более дней (Bash, 1969). Действительно, относительно небольшая экстенсивность
двойной (тем более, тройной) трематодной инвазии улиток в природе отмечалась
многими исследователями. Однако следует учитывать, что явление личиночного анта-
гонизма может базироваться не только на защитных реакциях моллюска-хозяина (Sire
et al., 1998), но и возникать опосредованно - вследствие взаимодействия паразитов
при множественном заражении (Mouahid, Моnе, 1990; Атаев, Добровольский, 1992;
Combes, 1995). К сожалению, степень реализации того или иного механизма повышения
резистентности моллюсков к повторной инвазии в природе практически не изучена.
С другой стороны, предварительная инвазия одним видом трематод в ряде случаев
снижает последующий иммунный ответ моллюска на заражение паразитами других
видов (формируется «приобретенная чувствительность»). Это, в свою очередь, может
приводить к выживанию неспецифичного паразита. Например, заражение моллюсков
Biomphalaria glabrata спороцистами Echinostoma paraensei приводит к подавлению
некоторых компонентов иммунного ответа Biomphalaria glabrata (Adema et al., 2010;
Hanington et al., 2010a), в том числе тех, которые отвечают за предотвращение раз-
вития Schistosoma mansoni (Lie et al., 1977; Loker et al., 1986; Bayne, Yoshino, 1989).
Гемоциты улиток, зараженных эхиностомами, теряют способность оседать на поверх-
ности чужеродных объектов и образовывать вблизи них любые агглютинации, включая
капсулы (Lie, Heyneman, 1976b).
Предшествующая инвазия моллюсков Biomphalaria orbignyi и B. oligoza трематода-
ми Zygocotyle lunata делает моллюсков, обычно устойчивых к шистосомной инвазии,
чувствительными к заражению Schistosoma mansoni (Spatz et al., 2012). Известно также,
374
что Echinostoma paraensei оказывает сильное влияние на структуру и функциональное
состояние гемоцитов моллюска-хозяина, предотвращая формирование капсул вокруг
спороцист Schistosoma mansoni у моллюсков резистентных штаммов (Loker et al., 1992).
Возможно, явление приобретенной чувствительности проявляется в формировании
новых специфичных паразито-хозяинных отношений, что на практике может способ-
ствовать увеличению числа видов моллюсков - потенциальных хозяев конкретных
видов трематод. В результате происходит расширение географии этих паразитов.
Клеточный иммунитет
Гемоциты
За выполнение иммунных реакций моллюсков на любом уровне отвечают цирку-
лирующие клетки гемолимфы моллюсков - гемоциты (Атаев, Полевщиков, 2004; Pila
et al., 2016a).
Морфологическая классификация гемоцитов пульмонат основана на исследова-
ниях, проведенных с помощью световой и электронной микроскопии (Sminia, 1972;
Harris, 1975; Sminia, Barendsen 1980; Ottaviani, 1983; Adema et al., 1992; Sasaki et al.,
2003; Cavalcanti et al., 2012; Ataev et al., 2016; Pila et al., 2016a; Prokhorova et al., 2018;
Tokmakova et al., 2020 и др.), проточной цитометрии (Martins-Souza et al., 2009; Barсante
et al., 2012; Ataev et al., 2016; Prokhorova et al., 2018; Tokmakova et al., 2020), на данных
по изучению функциональной активности клеток (Cheng, 1984), по разделению клеток
центрифугированием в градиенте плотности (Adema et al., 1994), по связыванию анти-
тел (Yoshino, Granath, 1985) и ферментных маркеров (Sminia, Barendsen, 1980; Joky
et al., 1983; Yoshino, Granath, 1983).
В разных работах описывается различное количество типов клеток гемолимфы
пульмонат (Sminia, 1972; Rondelaud, Barthe, 1981; Ottaviani, Franchini, 1988; van der
Knaap et al., 1993; Matricon-Condrat, Letocart, 1999; Martins-Souza et al., 2009; Caval-
canti et al., 2012; Прохорова и др., 2018 и др.). Ситуация осложняется множеством
терминов, используемых для обозначения последних: лейкоциты, лимфоциты, фа-
гоциты, макрофаги, гранулоциты, амебоциты и др. (Cheng, 1975; Jeong, Heyneman,
1976; Cheng, Guida, 1980; Sminia, Barendsen, 1980; Stumpf, Gilbertson, 1980; Sminia,
1981; Barracco et al., 1993; Adamowicz, Bolaczek, 2003). Это разнообразие может быть
связано с использованием при их описании различных признаков: морфологических,
ультраструктурных особенностей, биохимических маркеров (Pila et al., 2016a).
Тем не менее, большинство исследователей выделяют у пульмонат два основных
типа гемоцитов - гранулоциты и гиалиноциты (рис. 2) (Cheng, 1975, 1984; Ottaviani,
2006; Yoshino et al., 2013; Ataev et al., 2016; Pila et al., 2016a, 2017; Prokhorova et al.,
2018; Tokmakova et al., 2020). Эти клетки различаются по ряду признаков: размеру,
способности образовывать псевдоподии, фагоцитарной активности, количественному
соотношению в кровотоке, а также набором и строением органелл (Barbosa et al., 2006;
Souza, Andrade, 2006).
Гемоциты участвуют в различных физиологических процессах в организме мол-
люска, включая иммунные реакции. В частности, они задействованы в распозна-
вании патогенов (Gust et al., 2013), фагоцитозе (Sminia, 1972, 1981; van der Knaap,
1981; Yamaguchi et al., 1988; Атаев, Полевщиков, 2004; Ataev et al., 2016; Pila et al.,
2016a; 2017), инкапсуляции чужеродных объектов (Sminia et al., 1974; Harris, 1975;
Lie, Heyneman, 1976b; Loker et al., 1982; Jourdane, Cheng, 1987; Ataev, Coustau, 1999;
375
Furuta, Yamaguchi, 2001; Прохорова и др., 2015), образовании цитотоксических моле-
кул - метаболитов кислорода и азота, антимикробных белков (Dikkeboom et al., 1988;
Adema et al., 1992, 1994; Humphries, Yoshino, 2008; Seppälä, Leicht, 2013), выработке
опсонинов (например, лектинов) (Horak, Deme, 1998) и цитокинов (De Jong-Brink,
1994, Gust et al., 2013). Кроме этого, гемоциты участвуют в процессах регенерации
(Franchini, Ottaviani, 2000; Furuta, Yamaguchi, 2001; Hermann et al., 2005) и формиро-
вании раковины (Mount et al., 2004). Участие в таких процессах может значительно
сокращать количество циркулирующих гемоцитов, однако эти потери восполняются
в результате гемопоэза.
Рисунок 2. Гемоциты моллюска Biomphalaria glabrata. А - гранулоцит, Б - гиалиноцит.
Figure 2. Hemocytes of Biomphalaria glabrata. A - granulocyte, Б - hyalinocyte.
Клеточные защитные реакции
Главной функцией гемоцитов является защита внутренней среды организма хозяина
от различных чужеродных факторов.
Распознавание чужеродного - центральное событие иммунного ответа, обеспечи-
вающее запуск всего каскада как клеточных, так и гуморальных реакций, необходимых
для элиминации патогена.
Распознавание в системе врожденного иммунитета связано со способностью кле-
ток узнавать так называемые образы патогенности (или патоген-ассоциированные
молекулярные паттерны, pathogen-associated molecular patterns, PAMP) и образы опас-
ности (damage-associated molecular patterns, DAMP). PAMP и DAPM содержат мо-
лекулярные мотивы, свидетельствующие о потенциальной опасности их носителя
(Janeway, Medzhitov, 2002). Считается, что такая молекулярная «метка» не является
высокоспецифичной и может являться признаком целой группы патогенов. Рецепторы
клеток врожденного иммунитета (как мембранные, так и секретируемые), способные
распознавать PAMP и DAMP, относят к паттерн-распознающим рецепторам (pattern
recognition receptors, PRRs). PRRs позвоночных и беспозвоночных животных имеют
различную молекулярную структуру и происхождение. Однако не только иммуно-
компетентные клетки, но и клетки барьерных и соединительных тканей могут экс-
прессировать такие рецепторы (Akira et al., 2006; Nie et al., 2018). К PRR относят
Toll-подобные рецепторы (toll-like receptors, TLR), лектины, рецепторы нуклеиновых
кислот (nucleotide-oligimerizing domain receptors, NOD), антибактериальные белки,
компоненты комплемента.
Благодаря развитию технологий высокопроизводительного секвенирования и про-
теомного анализа, в последние несколько лет доказано наличие у моллюсков основных
групп PRR: TLR, липополисахарид-связывающий белок (LBP), маннан и ламинарин-
376
связывающие молекулы, пептидогликан-распознающие белки (peptidoglycan recognition
proteins, PGRP), белок, связывающий грамотрицательные бактерии, белки гваделупского
комплекса резистентности (guadeloupe resistance complex, GRС) (Dhelly et al., 2015),
лектины нескольких групп (см. ниже).
Несмотря на разнообразие рецепторов, наиболее изученными являются TLR. Это
самая древняя группа PRR, обладающая наиболее широким спектром распознавания
чужеродного. С момента открытия у Drosophila melanogaster (Anderson et al., 1985)
они обнаружены у большинства позвоночных и беспозвоночных животных. Молеку-
лярная структура TLR и сигнальные пути, обеспечивающие активацию клетки при
взаимодействии патогена с TLR, очень консервативны (Takeda, Akira, 2015; Pila et al.,
2016b; Adema et al., 2017; Wallet et al., 2018). Однако разные группы TLR «специали-
зируются» на распознавании разных PAMP и DAMP (Takeda et al., 2003).
У Biomphalaria glabrata выявлено 56 генов, кодирующих TLR двух разных типов
(V-TLR и P-TLR) (Adema et al., 2017). Сравнительный анализ транскриптомов гемо-
цитов показал более высокий уровень конститутивной экспрессии гена TLR (BgTLR)
моллюсков B. glabrata, резистентных к заражению Schistosoma mansoni (линия BS-90),
по сравнению с чувствительными (линия M) (Pila et al., 2016b). Заражение S. mansoni
приводит к 27-кратному росту экспрессии гена в гемоцитах моллюсков резистентной
линии, в то время как в гемоцитах моллюсков чувствительной линии экспрессия не
изменяется. При этом нокдаун гена с помощью комплементарной РНК (siRNA) приво-
дит к значительному (на 43 %) повышению чувствительности к заражению S. mansoni
(Pila et al., 2016b) и снижению фагоцитарной активности гемоцитов (Pila et al., 2017).
Таким образом, наличие определенного набора генов TLR рассматривается в каче-
стве одного из возможных механизмов, определяющих специфическую совместимость
в системе «трематоды-моллюск» (Pila et al., 2016b).
Следующим за распознаванием этапом иммунной реакции является адгезия гемо-
цитов на поверхности чужеродного объекта. Она является необходимым условием для
реализации фагоцитоза и других форм клеточного ответа моллюсков. Сравнительный
анализ транскриптомов моллюсков Biomphalaria glabrata резистентных и чувстви-
тельных к заражению Echinostoma caproni линий показал наличие нескольких групп
молекул адгезии: дерматопонтины (двух типов), матрилины, интегрины и кадгерины
(Bouchut et al., 2006).
Дерматопонтины являются секреторными белками, выявленными у беспозвоночных
разных групп. Их участие в процессах адгезии доказано для губок, членистоногих
и моллюсков (Bouchut et al., 2006; Sarashina et al., 2006; Coustau et al., 2015). Уровень
экспрессии генов дерматопонтинов у моллюсков резистентных линий повышается при
трематодной инвазии. При этом максимальный уровень экспрессии наблюдается между
48 и 72 часами после заражения, что совпадает с динамикой инкапсуляции спороцист
гемоцитами (Mitta et al., 2005). У моллюсков, чувствительных линий наблюдается по-
степенное снижение экспрессии дерматопонтина при заражении Echinostoma paraensei
(Hanington et al., 2010a).
Матрилины демонстрируют схожую динамику экспрессии у резистентных мол-
люсков, однако у чувствительных интактных моллюсков их экспрессия выше, чем
у резистентных (при заражении E. caproni). Это послужило основанием для предпо-
ложения, что чувствительные моллюски имеют более мощную систему коагуляции
гемолимфы, которая может препятствовать миграции гемоцитов (Bouchut et al., 2006).
377
Другая группа трансмембранных белков, вовлеченных в межклеточные взаимодей-
ствия и формирование внеклеточного матрикса - кадгерины - также сильнее экспрес-
сируется у чувствительных моллюсков, зараженных E. caproni, чем у резистентных.
При этом показано снижение их экспрессии у моллюсков Biomphalaria glabrata, по-
вторно зараженных Schistosoma mansoni (Pinaud et al., 2019).
Различная способность циркулирующих клеток к адгезии и фагоцитозу может быть
обусловлена разным набором молекул адгезии у разных типов гемоцитов (Hermann
et al., 2008). Эта особенность сказывается на участии последних в клеточных защит-
ных реакциях.
На начальных этапах инвазии у моллюсков развивается неспецифическая первич-
ная клеточная реакция. Она осуществляется за счет гемоцитов, устремляющихся из
близлежащих тканей и циркуляции в очаг воспаления, где они способны к дальнейшей
агрегации, агглютинации, инкапсуляции и фагоцитозу проникших патогенов (Cheng,
Jourdan, 1987; Атаев, Полевщиков, 2004; Токмакова, 2018).
Неспецифичность этой реакции выражена в сходном протекании в ответ на вне-
дрение чужеродного фактора любой природы (алло- и ксенотрансплантаты, паразиты)
(Jourdan, Cheng, 1987; Ataev, Coustau, 1999; Прохорова и др., 2015). Во всех случаях
вокруг патогена образуется скопление распластывающихся гемоцитов, пытающихся
изолировать его от окружающих тканей. Результатом эффективной первичной реакции
может стать: гибель патогена; его долговременная изоляция внутри гемоцитарной
капсулы; в случае локализации патогена вблизи покровов моллюска возможно его
«выдавливание» во внешнюю среду и купирование тканевых последствий проникно-
вения (Lie, Heyneman, 1976a). Все перечисленные механизмы первичной клеточной
реакции могут реализоваться при трематодной инвазии пульмонат. В зависимости от
вида (линии) моллюска и вида трематод, а также их локализации в хозяине первичная
реакция выражена по-разному. Во многих случаях она приводит не только к изоляции
паразита, но и к его гибели.
Однако в большинстве случаев, независимо от последствий первичной реакции,
наблюдается активация гемопоэза легочных моллюсков (см. ниже), обеспечивающая
запуск вторичной клеточной реакции. Необходимость в ней обусловлена недостатком
имеющихся в циркуляции гемоцитов. В случае эффективности первичной реакции
задачей вновь образованных клеток является участие в ликвидации ее последствий,
либо завершение инкапсуляции паразита в районе его начальной локализации в хо-
зяине (рис. 3).
Более сложно она протекает при миграции материнской спороцисты после за-
вершения ею метаморфоза. Если первичная клеточная защитная реакция оказалась
недостаточно эффективной для изоляции и гибели спороцисты, последняя покидает
район начальной локализации и перемещается в другие органы. Здесь возможно не-
сколько основных вариантов поведения гемоцитов, мультипликация которых вызвана
трематодной инвазией.
Первый, и наиболее естественный для понимания клеточных иммунных реакций
вариант - отмеченное выше продолжение первичной реакции в форме инкапсуля-
ции либо формирование капсулы вокруг партенит, окончательно поселившихся во
внутренних органах моллюска-хозяина. Многочисленные гемоциты образуют вокруг
паразита мощную капсулу. При этом между внутренней поверхностью последней и
378
Рисунок 3. Схема инкапсуляции партенит гемоцитами моллюска. При проникновении
патогена вначале происходят миграция гемоцитов из близлежащих тканей и циркуляции.
В дальнейшем количество гемоцитов возрастает за счет работы гемопоэтических органов,
и патоген инкапсулируется. После гибели паразита происходит разборка капсулы.
Figure 3. A scheme of encapsulation of parthenitae by molluscan hemocytes. When a pathogen
enters, hemocytes first migrate from the nearby tissues and circulation. Then their number increases
due to the work of hematopoietic organs, and the pathogen is encapsulated. After the death of the
parasite, the capsule is disassembled.
телом паразита сохраняется узкий просвет. Возможно, именно здесь накапливаются
цитотоксические вещества, выделяемые клетками гемолимфы, которые и иницииру-
ют начало процесса разрушения чужеродных объектов. Предполагается, что этими
веществами могут быть активные формы кислорода и оксид азота, вырабатываемые
гемоцитами (Connors, Yoshino, 1990; Connors et al., 1991; Adema et al., 2001; Атаев и
др., 2005б). Внутри такой капсулы происходит гибель паразита, а затем фагоцитоз мерт-
вых клеток спороцисты и внутренних слоев капсулы (см. Атаев, Полевщиков, 2004).
После ликвидации очага воспаления наблюдается разборка внешних слоев капсу-
лы. При этом строение гемопоэтических структур и количественные характеристики
клеточного состава гемолимфы возвращаются в исходное состояние. Аналогичные про-
явления клеточного иммунитета в формировании капсул вокруг чужеродных факторов
описаны как для беспозвоночных, так и для позвоночных животных (Галактионов,
2005). Более того, описанная двухэтапность клеточной защитной реакции пульмонат
аналогична воспалительной реакции млекопитающих, у которых патоген вначале так-
же вызывает воспалительный процесс, а позднее в реакцию вовлекаются форменные
элементы, образованные в результате активации гемопоэтических структур.
Как уже упоминалось, гемоциты моллюсков, чувствительных и резистентных
к трематодной инвазии линий B. glabrata, отличаются по способности к участию
в инкапсуляции проникающего во внутреннюю среду паразита (Lie, Heyneman, 1976).
Инкапсуляция подразумевает тесный контакт гемоцитов между собой и с поверхностью
паразита. Такое взаимодействие предполагает участие в иммунном ответе молекул
адгезии. При этом различия между улитками чувствительной и резистентной линий
могут быть связаны с разным репертуаром молекул адгезии.
Второй тип реакций заключается в образовании агглютинаций. В специфичных
паразито-хозяинных системах инкапсуляции трематод в результате вторичной реакции
не происходит, несмотря на выраженную активацию гемопоэза и повышение адгезион-
ной способности вновь формируемых гемоцитов. Последние обнаруживают партенит
379
и могут образовывать крупные агглютинации в районе их локализации, иногда даже
на поверхности спороцист. Однако инкапсуляции не происходит, и паразиты продол-
жают нормально развиваться, несмотря на такое соседство. В дальнейшем подобные
агглютинации разбираются, и внешних проявлений клеточных реакций на трематодную
инвазию не наблюдается, хотя в гемолимфе зараженного моллюска отмечается повы-
шенное количество гемоцитов по сравнению с интактными животными.
Третий тип - образование гемоцитарной мантии вокруг паразита в результате из-
вращения защитной клеточной реакции хозяина на паразитирование партенит трематод.
Последние оказываются изолированными от окружающих тканей хозяина, однако не
подвергаются воздействиям иммунной системы, а скорее. наоборот, находятся под ее
защитой. Изначально такое образование было описано у спороцист отряда Plagiorchiata
(Schell, 1965; Добровольский, Райхель, 1973). Однако в настоящее время предлагает-
ся расширить применение термина «мантия» на все случаи гемоцитарной изоляции
трематод, при которой паразит не только не погибает, но и способен завершить свое
развитие. Остальные отличия характеризуют частные случаи адаптаций трематод
к паразитизму и не меняют общей картины взаимоотношений, складывающихся
у них с моллюском-хозяином. Мантия обычно покрывает все тело паразита. При этом
у него сохраняется возможность использовать ресурсы хозяина. Однако она может
и прерываться в определенных участках. Такой пример демонстрируют спороцисты
рода Leucochloridium, вокруг зрелых отростков которых образуется сплошная мантия,
но в районе центральной части столона (предположительно выполняющей репродуктив-
ную и трофическую функции) она представлена крупноячеистой сетью из гемоцитов
(Ataev et al., 2013; Токмакова, 2018).
Сочетание первичной и вторичной клеточных защитных реакций хорошо иллю-
стрируется динамикой иммунного ответа биомфалярий на заражение трематодами рода
Echinostoma. Мирацидии E. caproni после проникновения в моллюска Biomphalaria
glabrata в течение нескольких часов остаются вблизи от места пенетрации. Это время
(период покоя) необходимо им для метаморфоза в материнскую спороцисту. Только
после его завершения спороцисты мигрируют к сердцу хозяина, где происходит их
дальнейшее развитие (Ataev et al., 1997).
В улитках резистентной линии партениты могут быть инкапсулированы уже в начале
заражения (в результате первичной клеточной реакции) - до начала миграции (Ataev,
Coustau, 1999). Тем не менее, большинство спороцист покидают район начальной
локализации и устремляются к сердцу. Именно здесь и происходит их инкапсуляция
силами вторичной гемоцитарной реакции, вероятно, с участием клеток, сформировав-
шихся после активации гемопоэтических структур.
Внешне похожие результаты были получены при изучении заражения B. glabrata
мирацидиями Echinostoma lindoense (Lie, Heyneman, 1975). При инвазии лишь неболь-
шой процент моллюсков проявил резистентность. В остальных улитках спороцисты
мигрировали в сердце, но затем инкапсулировались и разрушались в течение 2-5
дней. Более того, при повторной инвазии элиминация партенит происходила намно-
го быстрее. Они даже не успевали достигнуть сердца и подвергались инкапсуляции
в месте пенетрации. Авторы пришли к выводу, что повышение устойчивости связано
с увеличением количества гемоцитов, образуемых в результате активации гемопоэти-
ческих органов моллюсков-хозяев. Они описали это явление как пример личиночного
380
антагонизма (см. выше). Вероятно, материнские спороцисты способны преодолеть
первичную клеточную реакцию, но через несколько дней после завершения миграции
инкапсулируются в результате развития вторичной реакции. При повторном заражении
партениты уже в начале развития (период покоя) сталкиваются с защитной реакцией
предварительно иммунизированного моллюска. Позднее сходные данные были по-
лучены для биомфалярий, зараженных трематодами E. caproni (Ataev, Coustau, 1999).
Таким образом, в процессе эволюции клеточного иммунитета моллюсков защитный
барьер, представленный на начальном этапе фагоцитозом бактерий и прочих корпу-
скулярных патогенов циркулирующими клетками, дополнился сложным комплексом
последовательных клеточных реакций, направленных на изоляцию и уничтожение
чужеродного. Это приобретение в полной мере реализуется и в отношении партенит
трематод. Вероятно, фагоцитарная активность как самодостаточная клеточная реак-
ция реализуется только в отношении микропатогенов. Однако в случае трематодной
инвазии фагоцитоз может сопровождать каждый этап реализации защитной реакции,
но особенно его проявление заметно на заключительных этапах - при ликвидации
тканей паразита и клеточного дебриса, представленного, в том числе, остатками ге-
моцитарных капсул.
Гемопоэз
Несмотря на интенсивные исследования морфологии и функциональной активности
гемоцитов, до сих пор отсутствует общепринятая гипотеза о природе и механизме
гемопоэза легочных моллюсков. Многие авторы признают наличие единого центра
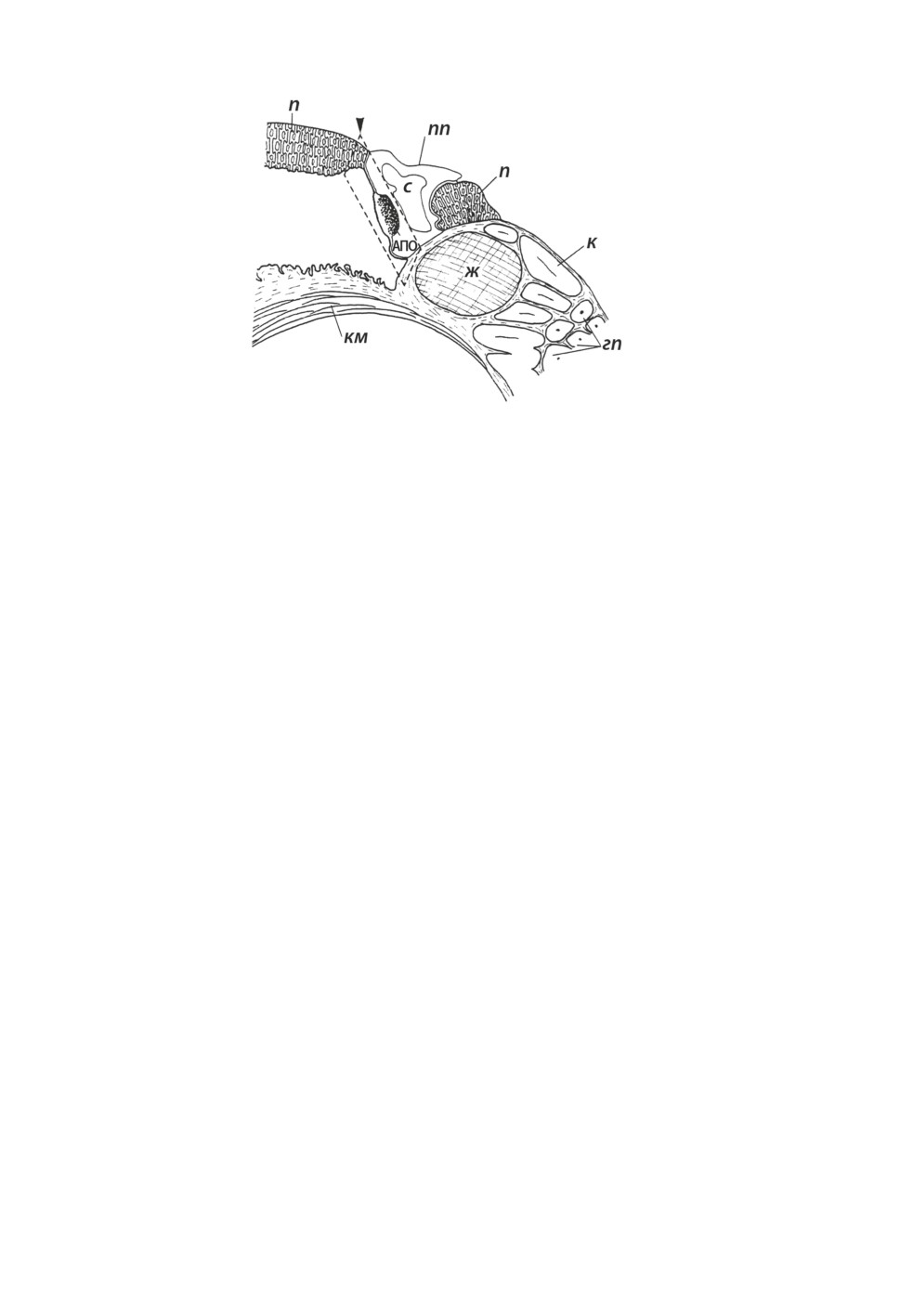
гемопоэза - амебоцито-продуцирующего органа (АПО), который расположен между
перикардиальным и мантийным эпителиями (Pan, 1958; Lie et al., 1975; Jeong et al.,
1983; Joky et al., 1983; Sullivan, 1988; Атаев, Прохорова, 2013). В то же время другие
исследователи настаивают на полицентричности происхождения гемоцитов, допуская,
что они могут образовываться из клеток соединительной ткани моллюсков (Souza,
Andrade, 2006). Существует и третья гипотеза, допускающая пролиферацию цирку-
лирующих клеток гемолимфы улиток (Sminia et al., 1983; Monteil, Matricon-Gondran,
1991; Portet et al., 2019).
Наиболее детально АПО изучен для Biomphalaria glabrata, у которых он располага-
ется между передней стенкой перикарда и мантийным эпителием (Lie et al.,1975; Pan,
1965; Jeong et al., 1983; Joky, Matricon-Condran, 1985; Sullivan, 1988; Атаев, Прохорова,
2013 и др.) и состоит из небольших скоплений клеток - «узелков» (рис. 4). Для клеток,
входящих в их состав, характерны удлиненная форма, базофильная цитоплазма и ядра
овальной формы. Кроме того, на базальной мембране перикардиального эпителия не-
которые авторы отмечают наличие небольших митотически активных клеток, которые,
согласно гистохимическим и ультраструктурным исследованиям, являются предше-
ственниками гемоцитов (Lie et al., 1975; Jeong et al., 1983; Sullivan, 1988; Горышина,
Чага, 1990; Токмакова, 2018).
Орган, гомологичный АПО и ответственный за образование амебоцитов, был об-
наружен и у ряда других пульмонат: Lymnaea truncatula и L. palustris (Rondelaud,
Barthe, 1981), L. stagnalis, (Sminia, 1974), Biomphalaria tenagophila (Oliveira et al., 2010),
B. obstructa, Helisoma trivolvis, Physa virgata (Sullivan, 1988), Planorbarius corneus
(Ottaviani, 2006); Bulinus africanus, B. truncatus и B. tropicus (Kinoti, 1971), Succinea
putris (Токмакова, 2018).
381
Рисунок 4. Локализация амебоцито-продуцирующего органа Biomphalaria glabrata.
АПО - амебоцито-продуцирующий орган, гп - гепатопанкреас, ж - желудок, к - кишка,
км - колумеллярная мышца, мп - мантийная полость, п - почка, пп - перикардиальная
полость, с - сердце. (По: Joky, 1982 с изменениями).
Figure 4. Localization of amoebocyte-producing organ of Biomphalaria glabrata.
АПО - amoebocyte-producing organ, гп - hepatopancreas, ж - stomach, к - intestine,
км - columellar muscle, мп - mantle cavity, п - kidney, пп - pericardial cavity, с - heart.
При заражении моллюсков мирацидиями трематод в АПО происходят структурные
изменения: в «узелках» обнаруживаются многочисленные митозы, в результате чего
увеличивается общее количество клеток, входящих в состав АПО. В дальнейшем
узелки сливаются, образуя единый клеточный тяж (гипертрофия и гиперплазия АПО)
(Lie et al., 1976; Jeong et al., 1983; Joky, 1985; Атаев, Полевщиков, 2004; Атаев, Про-
хорова, 2013; Токмакова, 2018). В дальнейшем прогемоциты дифференцируются
в гемоциты и покидают АПО, проникая в синусы кровеносной системы. Обычно мак-
симальная активация АПО и образование клеточного тяжа отмечается на третьи сутки
после заражения. Это, в свою очередь, вызывает повышение количества гемоцитов
в гемолимфе. В дальнейшем активность органа снижается и примерно на седьмой
день АПО возвращается к обычному состоянию.
Однако не только трематоды вызывают активизацию гемопоэтических органов мол-
люсков. Иммунизация различными чужеродными веществами, включая экскреторно-
секреторные продукты трематод, трансплантаты, липополисахариды (ЛПС) E. coli
или фукоидан, также стимулирует пролиферацию клеток в AПO (Noda, 1992; Sullivan
et al., 2004; Salamat, Sullivan, 2009; Sullivan et al., 2011, 2014; Zhang et al., 2016).
В то же время такие вещества, как изотонический солевой раствор, суспензия живых
грамположительных или грамотрицательных бактерий, некоторые лектины, зимозан,
бычий сывороточный альбумин, не оказывают заметного влияния на АПО (Sullivan
et al., 2004).
Для доказательства гемопоэтической роли АПО были проведены исследования по
трансплантации этого органа. Так, после пересадки гетеротопических аллотрансплан-
татов передней стенки перикарда у моллюсков Biomphalaria glabrata было показано
наличие кроветворной деятельности пересаженных участков АПО. В результате ги-
стологического исследования было установлено, что все трансплантаты оказались
382
жизнеспособными, и признаков их отторжения не наблюдалось (Sullivan, 1990; Sul-
livan et al., 1998). При трансплантации АПО от моллюсков, резистентных по отноше-
нию к Schistosoma mansoni, моллюскам чувствительной линии, последним передается
устойчивость к трематодной инвазии, что сопровождается повышением способности
к инкапсуляции спороцист паразита (Sullivan, Spence, 1999; Vasquez, Sullivan, 2001;
Barbosa et al., 2006). Однако приобретенная резистентность может быть обусловлена
различными растворимыми факторами, перенесенными трансплантированными клет-
ками, или путем секреции молекул, которые, в свою очередь, стимулируют реципиента
к продуцированию собственных факторов устойчивости. Данные молекулы может
синтезировать как сам трансплантат, так и гемоциты (Vasquez, Sullivan, 2001).
На сегодняшний день остаются нерешенными вопросы о природе и источнике
факторов, вызывающих активацию АПО, пролиферацию предшественников гемоцитов
и запуск защитных реакций моллюсков после проникновения патогена. Возможно,
эндогенные факторы, индуцирующие клеточную пролиферацию и дифференциров-
ку, вырабатываются циркулирующими гемоцитами и (или) клетками в составе АПО
(Sullivan et al., 2004; Pila et al., 2016a; Zhang et al., 2016).
Гуморальный иммунитет
Эволюционно гуморальные реакции являются вторичными по отношению к кле-
точным, так как их появление подразумевает наличие сформированной внутренней
среды организма. Становление гуморальных реакций, как правило, предусматривает
наличие циркуляторных систем и связанных с ними клеточных элементов, вовлеченных
в защитные реакции, а также существование кооперативных взаимодействий между
циркулирующими клетками и клетками других органов (см. Атаев и др., 2005а).
Гуморальные компоненты гемолимфы, многие из которых могут функционировать
как в составе рецепторных комплексов, так и в виде секретируемых в плазму молекул,
обеспечивают распознавание чужеродного, активацию гемоцитов, опсонизацию патоге-
нов (повышающую эффективность фагоцитоза), антибактериальный эффект, регуляцию
иммунных реакций, обладают агглютинирующей и литической активностями (Jourdane,
Cheng, 1987; van der Knaap, Loker, 1990; Sullivan, Spence, 1999; Connors, 2003).
Например, дочерние спороцисты Schistosoma mansoni агглютинируются только
в плазме резистентных моллюсков Biomphalaria glabrata (Bayne, Yoshino, 1989). Фак-
торы гемолимфы резистентных особей, находящиеся в плазме, вызывают приводящую
к гибели спороцист их инкапсуляцию гемоцитами моллюсков чувствительных линий
(Granath et al., 1984; Connors, Yoshino, 1990; van der Knaap, Loker, 1990). Имеются
данные, полученные in vivo, согласно которым роль гуморальных факторов в процессе
гибели партенит трематод является основной. Так, дегенерация материнских спороцист
Echinostoma lindoense в моллюсках Biomphalaria glabrata вообще может протекать без
предварительной инкапсуляции (Lie, Heyneman, 1976b).
В последние годы все больше подтверждается значимость гуморальных факторов
в формировании специфичности иммунитета пульмонат. Именно гуморальным фак-
торам приписывается основная роль в формировании так называемого иммунного
праймирования и тренированного иммунитета («индуцированной резистентности»),
которые рассматриваются в качестве доказательства наличия иммунологической па-
мяти у беспозвоночных (Coustau et al., 2016; Netea et al., 2016; Gourbal et al., 2018;
Melillo et al., 2018).
383
Участие гуморальных факторов в распознавании чужеродного
Ранее отмечалось, что в процессе распознавания чужеродных объектов принимают
участие лектины. К ним относятся белки или гликопротеины, обладающие сайтами
олигосахаридного связывания и способные агглютинировать или преципитировать
гликоконъюгаты, локализованные на клеточных поверхностях. В гемолимфе моллю-
сков выявлен целый спектр углевод-связывающих (лектиновых) веществ (Купер, 1980;
Glinski, Jarosz, 1997; Vasta et al., 2015).
Установлено, что лектины Biomphalaria glabrata являются агглютининами в отно-
шении спороцист Schistosoma mansoni и, более того, оказывают на них цитотоксиче-
ское воздействие (Вayne et al., 1985). Заражение моллюсков трематодами Echinostoma
paraensei приводит к сильному повышению концентрации лектинов в плазме гемо-
лимфы (Adema et al., 1997а).
Среди многообразия лектинов наиболее значимыми в иммунном ответе считаются
Са2+-зависимые лектины С-типа, обладающие высоким уровнем полиморфизма (Pees
et al., 2016). С-лектины (C-type lectin-related proteins, CREPs) экспрессируются в ге-
моцитах, в белковой железе и гепатопанкреасе пульмонат (Guillou et al., 2007; Ataev
et al., 2016) и чаще всего играют роль растворимых рецепторов и опсонинов (Renwrantz,
1986; Adema, Loker, 2015).
Избирательность связывания лектинов с чужеродным установлена при изучении
патогенсвязывающей способности белков плазмы Biomphalaria glabrata. Показано на-
личие в ней трех групп свободных лектинов С-типа. При этом они преимущественно
связывались с поверхностью бактерий (Micrococcus luteus, E. coli) и клеток дрож-
жей, но не осаждались на поверхности мирацидиев трематод Echinostoma caproni
и Schistosoma mansoni (Tetreau et al., 2017). Другие лектины, например, фибрино-
генподобные белки (см. ниже), связываются с поверхностью спороцист трематод
S. mansoni (Hokke et al., 2007; Peterson et al., 2009). Кроме этого, именно под лектины
мимикрируют поверхностные гликаны трематод, обеспечивающих себе таким образом
молекулярную мимикрию.
Другая группа лектинов пульмонат - галектины (galectin-relate proteins, GREPs) -
активно экспрессируются у моллюсков Biomphalaria glabrata резистентной и чувстви-
тельной линий, зараженных Schistosoma mansoni и Echinostoma paraensei (Hanington
et al., 2010a; Adema et al., 2010). Считается, что основная функция галектинов заклю-
чается в усилении адгезии гемоцитов на поверхности спороцист трематод (Yoshino
et al., 2008).
Лектины, подобные компоненту комплемента C1q, активнее транскрибируются
у зараженных трематодами Echinostoma paraensei и Schistosoma mansoni биомфалярий
чувствительных линий (Adema et al., 2010). C1q-подобные лектины могут взаимо-
действовать с фукозными остатками поверхности тегумента спороцист и усиливать
адгезию на них гемоцитов (Castillo et al., 2007).
Особую группу лектинов составляют фибриногенподобные белки (fibrinogen-related
proteins, FREPs). Они были отнесены к лектинам по способности связывать углевод-
ные эпитопы. Однако их молекулярная структура настолько уникальна, что их можно
рассматривать как отдельную группу PRR (Adema et al., 1997).
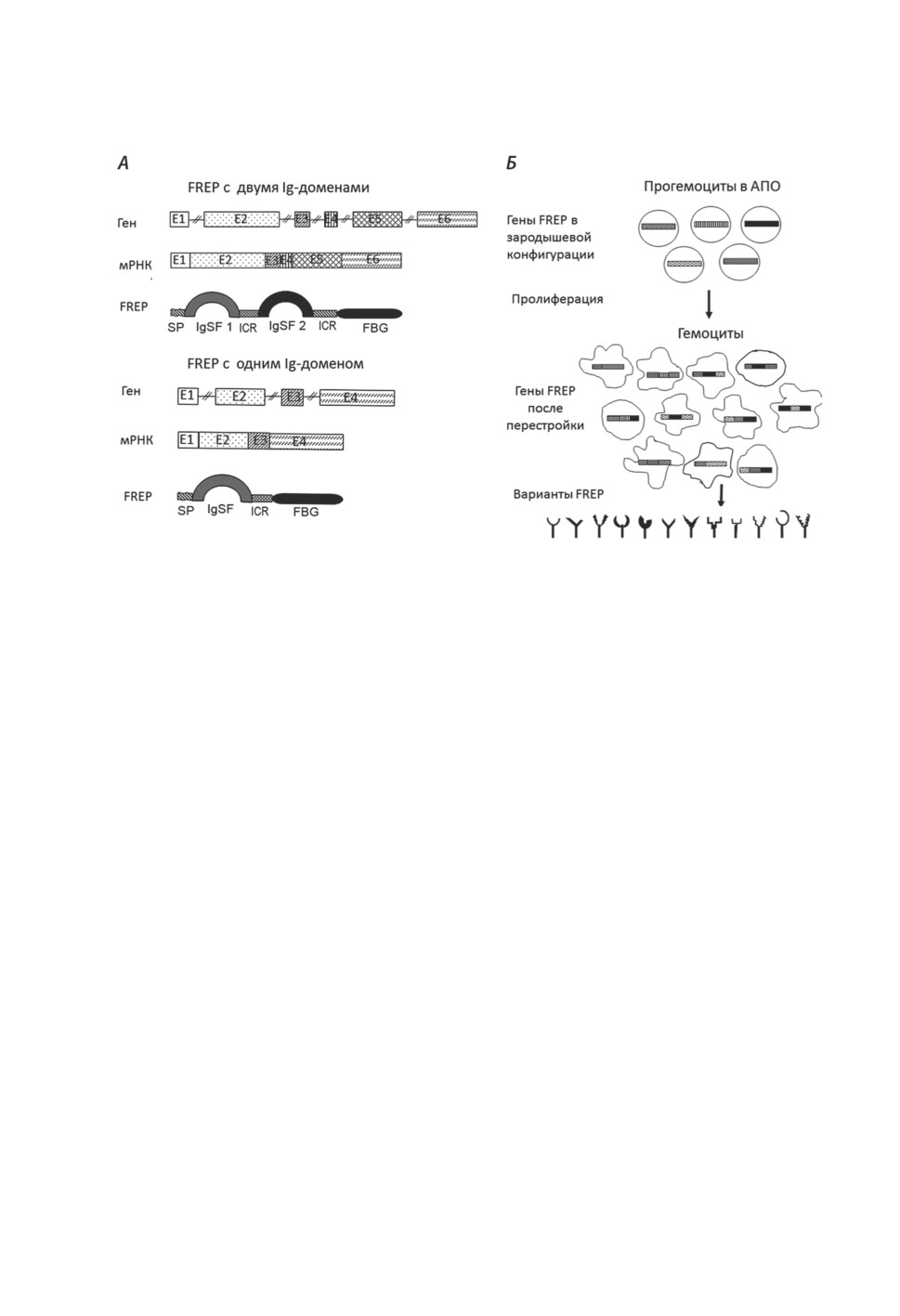
FREP имеют уникальную доменную организацию. На N-конце полипептида нахо-
дятся один или два вариабельных иммуноглобулиноподобных домена (immunoglobulin-
384
superfamily like domain, IGSF), а на С-конце - фибриногеновый домен (fibrinogen-like
domain, FBG) (Doolittle, 1992; Kurosava, Hashimoto, 1996; Adema et al., 1997) (рис. 5А).
Рисунок 5. Фибриногенподобные белки (FREP). А - организация геномных локусов
и доменная структура фибриногенподобных белков. Е1-Е6 - экзоны, SP - сигнальный белок,
IgSF - домен иммуноглобулинового суперсемейства, FBG - фибриногеновый домен,
ICR - промежуточный участок. Б - схема формирования разнообразия FREP в онтогенезе
моллюска (пояснения в тексте).
Figure 5. Fibrinogen-like proteins (FREP). A - organization of genomic loci and domain structure
of fibrinogen-like proteins. E1 - E6 - exons, SP - signaling protein, IgSF - domain of the
immunoglobulin superfamily, FBG - fibrinogen domain, ICR - intermediate region. Б - scheme
of the formation of the FREP diversity in the ontogeny of the mollusс (see text for explanations).
Фибриногеновый домен - наиболее консервативная часть молекул FREP. Гомо-
логия фибриногеновых доменов, относящихся к разным группам FREP, составляет
не менее 72 % (Dheilly et al., 2015). Принято считать, что фибриногеновый домен не
участвует в реакциях коагуляции гемолимфы, а основная его функция - облегчение
кальций-зависимого связывания лектинов с углеводами (Adema et al., 1999). Одним
из примеров фибриногенподобных белков, имеющих сайт связывания с ионами каль-
ция, является селектин, вовлеченный в процессы адгезии у моллюсков Biomphalaria
glabrata (Guillou et al., 2004).
Для иммуноглобулиновых доменов FREP характерна крайняя вариабельность,
которая была выявлена с помощью транскриптомного анализа (Dheilly et al., 2015).
В настоящее время на основании изучения структуры иммуноглобулинового домена
выделено как минимум 14 подсемейств FREPs моллюска B. glabrata (Loker et al.,
2004; Gordy et al., 2015; Galinier et al., 2017). У отдельных особей этого вида выяв-
ляется от 36 до 45 различных вариантов мРНК FREP3 (Zhang et al., 2004), которые
соответствуют 31 и 36 вариантам аминокислотных последовательностей. Репертуар
FREP также меняется по мере роста моллюска и после заражения трематодами разных
видов (Hanington et al., 2010a, b, 2012; Gordy et al., 2015).
385
По разным оценкам фибриногенподобные белки биомфалярии кодируются в 1-9
геномных локусах (Gordy et al., 2015). Однако разнообразие FREP не ограничивается
только генотипически определенным ресурсом. В частности, для нескольких FREP3
доказана индивидуальная вариабельность, источником которой может быть не только
аллельный полиморфизм, но и соматическая диверсификация генов (Zhang et al., 2004;
Hanington et al., 2010b). В качестве источников разнообразия рассматривают точечные
мутации (Zhang et al., 2004, 2008; Mone et al., 2010; Dheilly et al., 2015) и альтерна-
тивный сплайсинг (Zhang, Loker, 2004).
Получены данные, свидетельствующие о существовании механизма соматическо-
го мутагенеза в генах, кодирующих FREP. Гены FREP кластеризованы: 4 гена FREP
(FREP14 и три члена семейства FREP3) находятся в пределах геномной области
70 000 пн. Именно такая конфигурация генов часто ассоциируется с соматическим
мутагенезом в этих участках (Chen et al., 2007; Hanington et al., 2010b). Кроме того,
у B. glabrata выявлены нуклеотидные последовательности, кодирующие цитидиновую
дезаминазу (один из основных ферментов, обеспечивающих процесс соматического
гипермутагенеза), экспрессия которого повышается у моллюсков, зараженных трема-
тодами (Bouchut et al., 2006).
Возможность соматического гипермутагенеза заложена и в механизме гемопоэ-
за пульмонат. В основном FREP экспрессируются в гемоцитах моллюсков (Adema
et al., 1997; Hanington et al., 2010a, b). Предполагается, что случайные соматические
мутации могут возникать во время пролиферации и клеточной дифференцировки
в гемопоэтических структурах, что изменяет зародышевое состояние генов в некото-
рых гемоцитах. В результате часть гемоцитов содержат гены FREP не в зародышевой
конфигурации, а включают уникальные мутации (Hanington et al., 2010a, b). Так как
в онтогенезе улитки происходит обновление пула гемоцитов, то и репертуар FREP,
экспрессируемых в этих клетках, также меняется (рис. 5Б). Эта закономерность по-
казана экспериментально: транскрипты пулов из 20-40 гемоцитов B. glabrata содержат
различные наборы модифицированных последовательностей FREP (Hanington et al.,
2010a, b). Стимуляция патогеном может усиливать гемопоэз у B. glabrata, в результате
чего усиливается процесс мутагенеза и разнообразие FREP (Hanington et al., 2012;
Adema, Loker 2015). Соответственно, у моллюсков репертуар патоген-распознающих
молекул не ограничивается только генотипически определенным ресурсом. При этом
ранее онтогенетическая изменчивость патогенраспознающих молекул считалась пре-
рогативой только позвоночных животных (Medzhitov, Janeway,1997).
Структура кодирующих геномных локусов, соматическая диверсификация и призна-
ки наличия гипермутагенеза, а также способность специфично распознавать патогены
позволяют рассматривать FREP в качестве функциональных аналогов иммуноглобули-
нов позвоночных (Adema et al., 1997; Connors, 2003). Поэтому изучение разнообразия
FREP является одним из основных направлений раскрытия механизмов возможной
специфичности иммунитета пульмонат.
Впервые иммунологическая роль FREP была показана для моллюсков B. glabrata
M-линии, у которых экспрессия генов FREP повышалась в три раза после зараже-
ния Echinostoma paraensei (Adema et al., 1997). В настоящее время установлено, что
FREP - одна из самых обильно представленных фракций белков плазмы Biomphalaria
glabrata (Wu et al., 2017). Было многократно подтверждено изменение экспрессии
386
генов FREP при заражении моллюсков трематодами (Hertel et al., 2005; Mitta et al.,
2005; Hanington et al., 2010a, b).
У моллюсков резистентной и чувствительной линий выявлены конституционные
различия в экспрессии фибриногенподобных белков (Mitta et al., 2005). Так, при
заражении B. glabrata мирацидиями Echinostoma paraensei значительно усиливает-
ся транскрипция фибриногенподобных белков двух подсемейств (FREP2 и FREP4)
у особей как резистентной, так и чувствительной линий.
В опытах с нокдауном генов FREP показано повышение восприимчивости
Biomphalaria glabrata резистентных линий к заражению трематодами Echinostoma
paraensei и Schistosoma mansoni. Это подтверждает, что FREP является одним из фак-
торов, определяющих устойчивость моллюсков к заражению трематодами, а также
указывает на роль FREP в формировании памяти (Jiang et al., 2006; Hanington et al.,
2010a, 2012).
Кроме того, разные FREP обладают избирательной активностью в отношении па-
тогенов: FREP2 плазмы зараженных моллюсков связывается преимущественно со
спороцистами Echinostoma paraensei, а FREP3 - с бактериями и грибами (Zhang et al.,
2008). Показана четкая зависимость между зараженностью моллюсков и уровнем экс-
прессии фибриногенподобных белков разных подсемейств (Guillou et al., 2004; Hertel
et al., 2005; Jiang et al., 2006). Также имеются данные о специфичности экспрессии
FREP при заражении трематодами разных видов. Так, у моллюсков Planorbarius corneus
уровень экспрессии генов FREP различен у незараженных и зараженных разными ви-
дами трематод особей. При заражении улиток партенитами Notocotylus sp. и Plagiorchis
sp. экспрессия FREP понижается, а у особей, зараженных Cotylurus sp. и Bilharziella
polonica, экспрессия FREP выше, чем у незараженных (Прохорова и др., 2010).
Эффекторные молекулы иммунитета
После проникновения паразита в моллюска и его распознавания включаются эффек-
торные механизмы подавления инвазии. В реализации иммунных реакций моллюсков
участвуют такие группы факторов, как протеазы, ингибиторы протеаз, компоненты ком-
племента, антибактериальные белки, токсины, активные кислородные метаболиты и др.
Протеазы участвуют в уничтожении патогенов, ферментативных каскадах, модели-
ровании клеточного матрикса и передвижении иммунокомпетентных клеток в ткани.
У пульмонат обнаружены как многочисленные протеазы (серпины, катепсин, эластаза,
цинк-зависимая металлопротеаза, цистатины), так и их ингибиторы (ингибиторы сери-
новых и цистатиновых протеаз) (Сheng et al., 1978; Cheng, Dougherty, 1989). Заражение
трематодами приводит к усилению экспрессии этих молекул у Biomphalaria glabrata
(Mitta et a., 2005; Lockyer et al., 2012). В частности, показано усиление экспрессии
цистатина в гемоцитах в составе капсул вокруг спороцист Echinostoma caproni (Guillou
et al., 2007) и повышение выработки катепсина В, эластазы и цинковой металлопро-
теазы в гепатопанкреасе зараженных биомфалярий (Myers et al., 2008; Ittiprasert et al.,
2010; Lockyer et al., 2012).
Кроме того, цистеиновые протеазы вырабатываются мирацидиями и молодыми
материнскими спороцистами (Yoshino et al., 1993; Fryer et al., 1996). В частности,
секреторный белок SmVAL (venom allergen-like protein) Schistosoma mansoni влия-
ет на экспрессию белков внеклеточного матрикса гемоцитами Biomphalaria glabrata
(Yoshino et al., 2014).
387
Другая группа эффекторных белков, обладающих выраженным антипатогенным
свойством - антибактериальные белки. Они участвуют в элиминации фагоцитирован-
ных патогенов, а также в процессах внеклеточной цитотоксичности.
У пульмонат описано несколько антимикробных пептидов. Для белка митамацина
(mytimacin, или lipopolysaccharide-binding protein/bactericidal permeability increasing,
LBP/BPI), вырабатывающегося клетками белковой железы, показана антибактери-
альная и противогрибковая активность (Guillou et al., 2007; Baron et al., 2016; Adema
et al., 2017), а также повышение экспрессии при заражении моллюсков партенитами
эхиностом (Guillou et al., 2007; Hanington et al., 2010a). Другой антимикробный белок -
MPEG1 (macrophage expressed gene-1), относящийся к суперсемейству перфоринов,
вырабатывается гемоцитами резистентных биомфалярий, зараженных трематодами
Schistosoma mansoni (Ittiprasert et al., 2010).
Несколько лет назад был открыт белок биомфализин (biomphalysin), который
в настоящее время рассматривается в качестве одного из определяющих факторов
резистентности у моллюсков (Galinier et al., 2013; Li et al., 2020). Биомфализин - аэро-
лизинподобный белок, формирующий поры токсин, секретируемый в плазму. Предполо-
жительно биомфализин достался моллюскам от бактерий в результате горизонтального
переноса генов (Galinier et al., 2013). Белок включает два домена - домен, подоб-
ный формирующему β-поры токсину (β-pore-forming toxins), способный встраиваться
и перфорировать клеточные мембраны, и малый домен, вовлеченный в распознавание
углеводных PAMP. Биомфализины способны связываться с поверхностью спороцист
S. mansoni. При этом белки плазмы гемолимфы значительно усиливают их активность
(Galinier et al., 2013). In vitro показана его способность к взаимодействию как с бак-
териями и дрожжами, так и с трематодами S. mansoni и Echinostoma caproni (Tetreau
et al., 2017). Показана способность биомфализинов формировать комплексы с FREP
и тиоэфир-содержащим белком (Li et al., 2020).
Конститутивно в гемоцитах биомфализины экспрессируются в небольшом коли-
честве (Galinier et al., 2013). У особей, зараженных S. mansoni формируются много-
численные варианты транскриптов биомфализина (Pinaud et al., 2019). Выработка
того или иного варианта зависит от природы (особенностей) паразита. При этом часть
транскриптов перестает вырабатываться, выполнив свою задачу, а часть продолжает
экспрессироваться. Поэтому биомфализин рассматривают в качестве одного из ком-
понентов так называемой гуморальной иммунной памяти (Portela et al., 2013; Pinaud
et al., 2016).
Недавно в геноме Biomphalaria glabrata было выявлено пять генов, кодирующих
порообразующие белки, отличающиеся от биомфализина. Новое семейство токсинов
было названо глабрализинами (glabralysins). Для одних глабрализинов показано повы-
шение экспрессии при заражении трематодами Schistosoma mansoni, для других - при
иммунизации бактериями (Lassalle et al., 2020).
Путем in silico анализа в транскриптоме биомфалярии также выявлены мРНК, схо-
жие с теромацином (theromacin), ахацином (achacin) из моллюсков Achatina fulica, апли-
зианином (aplysianin) из Aplysia kurodai и несколько биомфамицинов (biomphamacins)
- богатых цистином катионных пептидов. Для всех факторов показано повышение
экспрессии в ответ на иммунизацию бактериями (Mitta et al., 2005; Adema et al., 2017).
Одной из основных составляющих гуморального иммунитета является система
комплемента. Однако для большинства беспозвоночных в настоящее время описаны
лишь отдельные ее компоненты (Кокряков, 2006). Анализ транскриптомов и протеомов
388
гемоцитов биомфалярий показал наличие C1q-подобного белка и тиоэфир-содержащего
белка (thioester-containing protein, TEP) (Pinaud et al., 2019). ТЕР - комплементопо-
добные молекулы, которые исполняют роль опсонинов, стимулируя фагоцитоз или
лизис клеток. Для моллюсков доказана роль TEP в фагоцитозе микроорганизмов и
антипаразитарном ответе (Blandin, Levashina, 2004). TEP участвуют в формировании
капсул вокруг спороцист трематод у Biomphalaria glabrata при первичной иммунизации
(Mone et al., 2010; Mitta et al., 2012; Portet et al., 2018). При повторном заражении, со-
провождающемся сдвигом в сторону гуморального иммунитета, происходит снижение
экспрессии TEP и C1q-подобного белка (Pinaud et al., 2016, 2019).
Активные метаболиты молекулярного кислорода и азота (reactive oxygen spe-
cies, ROS и reactive nitrogen species, RNS) являются важнейшими факторами иммунной
защиты моллюсков. В процессе фагоцитоза они обеспечивают деструкцию клеточных
мембран паразита.
Основное количество кислородных метаболитов образуется при активации медь-
содержащих фенолоксидаз, проявляющих тиразиназную активность. Фенолоксидаза
является купроэнзимом, который демонстрирует субстратную специфичность к моно-
и дифенолам. Она является одним из основных медьсодержащих ферментов гемолимфы
моллюсков, однако этот фермент также был обнаружен в других органах моллюсков
(Бабич и др., 2017). Считается, что при реализации иммунного ответа (в том числе
при инкапсуляции патогена) именно гемоциты секретируют фенолоксидазу. Однако
на сегодняшний день, не известно являются ли они единственным ее источником. По-
скольку фенолоксидаза является медь-содержащим ферментом, можно предположить
существенную роль меди в реализации защитных функций гемоцитов в иммунном
ответе. Механизмы поддержания гомеостаза меди в межклеточных пространствах по-
являются только у многоклеточных, и они мало изучены. Скорее всего, существуют
значительные различия этих механизмов между животными (водные, сухопутные,
с замкнутой и незамкнутой системой кровообращения, животные с разным уровнем
развития органов, в биосистеме «паразит-хозяин» и др.). Отсутствие данных о вну-
триклеточном и межорганном обмене меди у моллюсков препятствует пониманию
одной из важнейших сторон физиологии врожденного иммунитета - роли гомеостаза
меди в формировании «дыхательного взрыва» и меланизации.
Исследования in vitro показали, что H2O2 и NO способствуют уничтожению спо-
роцист Schistosoma mansoni гемоцитами Biomphalaria glabrata резистентной линии.
При этом резистентные улитки генерируют больше ROS и RNS, чем чувствительные
особи (Hahn et al., 2001; Mone et al., 2010). Для них показана конститутивно более
интенсивная экспрессия Cu/Zn супероксиддисмутазы (CuZn SOD) (Bonner et al., 2012).
При этом аллель гена SOD1 рассматривается как специфический маркер для выявления
специфической резистентности у B. glabrata к инвазии Schistosoma mansoni (Coustau
et al., 2015).
Продукция супероксиданиона (О2-) установлена для гемоцитов Lymnaea stagnalis
и Helix aspersa при фагоцитозе частиц зимозана. Аналогичные результаты показал
анализ гемоцитов чувствительных и резистентных линий Lymnaea stagnalis к зараже-
нию Trichobilharzia ocellata (Dikkeboom et al., 1988). При инвазии Lymnaea stagnalis
специфическим паразитом Trichobilharzia ocellata и неспецифическим Schistosoma
mansoni гемоциты моллюска отвечают продукцией активных форм кислорода в ответ
на неспецифического паразита, вызывают его гибель и не отвечают на специфического,
389
что обеспечивает выживание последнего. Материнские спороцисты обоих видов акти-
вируют внутриклеточную ксантин-оксидазную систему, что приводит к образованию
высокотоксичных перекисных соединений. Применение ингибитора НАДФН-оксидазы
задерживает элиминацию спороцист Trichobilharzia ocellata и Schistosoma mansoni
гемоцитами резистентных к инвазии Lymnaea stagnalis и Biomphalaria glabrata, со-
ответственно (Dikkeboom et al., 1988; Adema et al., 1994, 2001). Для Viciparus ater
показана способность гемоцитов к синтезу NО с помощью ключевого фермента -
НАДФН-зависимой нитритной окись-синтазы. Стимуляция клеток ЛПС увеличивает
активность этого фермента и продукцию NО в 2.4 раза (Conte, Ottaviani, 1995).
Трематоды имеют защитные системы, препятствующие их повреждению ROS
и RNS. Во время трансформации мирацидия в материнскую спороцисту вырабатыва-
ется целый ряд антиоксидантных ферментов - глутатион-S-трансфераза (GST), Cu/Zn
супероксиддисмутаза (SOD), глутатион пероксидаза (GPx) и пероксиредоксины (Prx),
обеспечивающие защиту развивающегося паразита (Guillou rt al., 2007).
Регуляторы иммунного ответа моллюсков
Основными регуляторами иммунного ответа животных являются небольшие пеп-
тиды - цитокины (см.: Атаев и др., 2005б; Mitta et al., 2005; Garcia et al., 2010). Цито-
кины участвуют как в регуляции иммунного ответа, так и в поддержании тканевого
гомеостаза.
У легочных моллюсков выявлены такие универсальные цитокины, как фактор не-
кроза опухолей (TNF-related protein), макрофагальный ингибирующий фактор, цистатин.
Кроме того, описаны некоторые белки, вовлеченные в сигнальные каскады активации
клеток - белки, содержащие цинковые пальцы (zinc-finger proteins), кальмодулин,
тимозин B4 (Yoshino et al., 1993; Bayne et al., 2001).
Одним из наиболее хорошо охарактеризованных цитокинов пульмонат являет-
ся фактор, ингибирующий миграцию макрофагов (macrophage migration inhibitory
factor, MIF) (Mitta et al., 2005). MIF экспрессируется в циркулирующих гемоцитах
(преимущественно гранулоцитах) и эмбриональных клетках Biomphalaria glabrata
(Bge cells). Показано его присутствие в плазме гемолимфы (Garcia et al., 2010). Он
способен стимулировать клеточную пролиферацию и ингибировать NO-зависимый
p53-опосредованный апоптоз Bge-клеток. Заражение Schistosoma mansoni приводит
к снижению экспрессии MIF, которое коррелирует с миграцией гемоцитов к инфициро-
ванным трематодами тканям. Нокдаун гена MIF приводит к нарушению инкапсуляции
спороцист S. mansoni в культуре Bge-клеток (Garcia et al., 2010). Консервативность
гена MIF позволяет рассматривать его в качестве ортолога MIF млекопитающих.
Помимо MIF в транскриптоме Biomphalaria glabrata обнаружены последователь-
ности, гомологичные воспалительным факторам трансплантации млекопитающих
(mammalian allograft inflammatory factors, AIF). AIF млекопитающих экспрессируются
при отторжении аллотрансплантатов и участвуют в регуляции воспаления (Deininger
et al., 2002). У биомфалярий резистентной линии показано пятикратное повышение
экспрессии AIF (Mitta et al., 2005).
Заключение
Выполненный анализ информации об иммунном ответе пульмонат на чужеродные
факторы позволяет рассматривать основные этапы его реализации как аналогичные со-
ответствующим реакциям других животных. В частности, защитные реакции пульмонат
390
включают два уровня: клеточный и гуморальный. Однако не всегда просто провести
четкое разграничение их функциональных компетенций. Так, гемоциты моллюсков,
способные к фагоцитозу и инкапсуляции патогена, используют при этом различные
факторы гуморального иммунитета для распознавания и элиминации чужеродного.
С другой стороны, в рамках рассматриваемой паразито-хозяинной системы большой
интерес представляют реакции трематод на комплекс защитных барьеров моллю-
ска. Анализ полученных результатов позволяет заключить, что выявленная иммунная
устойчивость пульмонат к трематодной инвазии полностью укладываются в общие
представления об адаптивных реакциях паразита на иммунный ответ хозяина. Способ-
ность партенит трематод избегать защитных реакций моллюска-хозяина указывает на
длительную историю становления данной паразито-хозяинной системы.
Существует несколько основных гипотез, объясняющих механизмы избегания
партенитами трематод иммунных реакций моллюсков. Основной из них является
«модель совместимого молекулярного полиморфизма». Для моллюска характерен
определенный набор клеточных и гуморальных компонентов иммунитета, заданных
генотипически. Резистентные моллюски отличаются от чувствительных по набору и
уровню экспрессии распознающих молекул, факторов цитотоксичности, адгезии и др.
Для паразита конкретного вида (или штамма) также характерен генотипически задан-
ный набор антигенных детерминант (рецепторы поверхности тегумента, экскреторно-
секреторные продукты, продукты метаболизма). Способность моллюска распознавать
патоген, реагировать на него, а с другой стороны, способность паразита избегать этого
ответа определяют совместимость конкретной паразито-хозяинной системы.
Для объяснения явления «молекулярного полиморфизма» были предложены альтер-
нативные гипотезы. Первая заключается в том, что совместимость определяется степе-
нью резистентности моллюска (Webster, Davies, 2001). Согласно второй, успешность
заражения определяется совпадением индивидуальных молекулярных характеристик
паразита и хозяина (Theron, Coustau, 2005). В то же время Митта с коллегами (Mitta
et al., 2017) допускают, что эти гипотезы не являются взаимоисключающими и что
совместимый статус конкретной улитки и трематоды определяется балансом между
несколькими молекулярными детерминантами, относящимися к двум категориям: пер-
вая - врожденные генетические особенности паразита и хозяина, вторая - молекулы
(рецепторы и антигены), обладающие полиморфизмом (например, FREP). Поэтому
чувствительность и резистентность не бывают абсолютными.
Гипотеза молекулярной мимикрии подразумевает экспрессию паразитом по-
верхностных молекул, опознаваемых внутренними защитными системами хозяина
как «свое» (Damian, 1989). Показано, что разные уровни восприимчивости хозяина
коррелируют с различным содержанием поверхностных антигенов паразита (van der
Knaap, Loker, 1990).
Согласно гипотезе молекулярной маскировки, выживание паразита обеспечи-
вается осаждением на его поверхности молекул гемолимфы хозяина. В основе этого
явления могут лежать как пассивная сорбция молекул гемолимфы, так и их активный
захват посредством специальных рецепторов на поверхности паразита (van der Knaap,
Loker, 1990). Например, трематоды Schistosoma mansoni экспрессируют на своей по-
верхности полиморфные муцины (polymorphic mucins, SmPoMucs), которые предот-
вращают распознавание иммунной системой моллюсков чужеродного.
391
Согласно четвертой гипотезе, выживаемость паразита основана на ингибирова-
нии процессов иммунного ответа хозяина. Это происходит с участием экскреторно-
секреторных продуктов, выделяемых паразитом (Loker et al., 1992; Lodes, Yoshino,
1990). В частности, экскреторно-секреторные продукты способны изменять профиль
экспрессии белков гемоцитами, что может препятствовать распознаванию патогена
иммунной системой моллюска (Yoshino et al., 2013).
В завершение настоящего обзора коротко затронем явление специфичности моллю-
сков к трематодной инвазии. В условиях постоянного взаимодействия с чужеродными
антигенами их резистентность к паразиту является скорее правилом, а восприимчи-
вость - исключением. Поэтому успешность заражения зависит, прежде всего, от спо-
собности паразита «избегать» защитных реакций хозяина или подавлять их. Моллюск
обеспечивает среду обитания, которую паразит использует для развития и увеличения
собственной численности. Для этого необходим тесный контакт между паразитом
и хозяином, и несомненно, это взаимодействие распространяется на молекулярный
диалог между ними, результатом которого, вероятно, является запуск и сила иммун-
ного ответа улиток.
Однако до сих пор остается много вопросов относительно формирования явления
специфичности и механизмов устойчивости паразито-хозяинных систем. Является ли
давление, создаваемое трематодной инвазией, фактором, способствующим развитию
специфичности в иммунных системах моллюсков, и служит ли такое приобретение
движущей силой для формирования разнообразия трематод?
Учитывая сложившиеся в ходе коэволюции паразито-хозяинные системы, можно
предположить, что трематоды оказали серьезное влияние на формирование иммунных
реакций легочных моллюсков, включая степень их специфичности.
Благодарности
Исследование выполнено при финансовой поддержке РФФИ в рамках научного
проекта № 20-54-15003 НЦНИ_а.
Список литературы
Атаев Г.Л. 2017. Размножение партенит трематод. Обзор основных теорий. СПб, Наука, 88 с.
Атаев Г.Л., Добровольский А.А. 1992. Развитие микрогемипопуляции редий Philophtalmus rhionica в мол-
люсках, природно-зараженных другими видами трематод. Паразитология 26 (3): 227-233.
Атаев Г.Л., Полевщиков А.В. 2004. Защитные реакции брюхоногих моллюсков. 1. Клеточные реакции.
Паразитология 38 (4): 342-351.
Атаев Г.Л., Еремина Е.Е., Полевщиков А.В. 2005а. Защитные реакции брюхоногих моллюсков. Гуморальные
реакции. Паразитология 39 (1): 3-15.
Атаев Г.Л., Дьячков И.С., Полевщиков А.В. 2005б. Сравнительно-иммунологический анализ защитных
реакций брюхоногих моллюсков. Известия РГПУ 5 (13): 265-281.
Атаев Г.Л., Прохорова Е.Е. 2013. Изменения в амебоцито-продуцирующем органе моллюсков Biomphalaria
glabrata при заражении трематодами Echinostoma caproni. Паразитология 47 (6): 472-479.
Бабич П.С., Кудрявцева П.С., Орлов Ю.А., Атаев Г.Л. 2017. Изучение содержания меди в тканях моллюсков
Planorbarius corneus и влияния трематодной инвазии на фенолоксидазную активность гемолимфы.
Паразитология 51 (6): 490-498.
Галактионов В.Г. 2005. Эволюционная иммунология. М., ИКЦ «Академкнига», 408 с.
Горышина Е.Н., Чага О.Ю. 1990. Сравнительная гистология тканей внутренней среды с основами имму-
нологии. Л., Издательство ЛГУ, 320 с.
392
Добровольский А.А., Райхель А.С. 1973. Жизненный цикл Haplometra cylindracea Zeder 1800 (Trematoda,
Plagiorchiidae). Вестник Ленинградского университета 3: 5-13.
Купер Э. 1980. Сравнительная иммунология. М., Мир, 422 с.
Прохорова Е.Е., Цымбаленко Н.В., Атаев Г.Л. 2010. Экспрессия генов факторов защитных реакций у мол-
люсков Planorbarius corneus (Gastropoda, Pulmonata) при заражении трематодами. Паразитология 44
(4): 310-325.
Прохорова Е.Е., Токмакова А.С, Атаев Г.Л. 2015. Реакция гемоцитов моллюсков Planorbarius corneus на
ксенотрансплантат. Паразитология 49 (2): 128-132.
Прохорова Е.Е., Серебрякова М.К., Токмакова А.С., Кудрявцев И.В., Усманова Р.Р., Атаев Г.Л. 2018. Анализ
клеточного состава гемолимфы трех видов планорбид (Gastropoda: Pulmonata). Invertebrate Zoology
15 (1): 103-113.
Кокряков В.Н. 2006. Очерки о врожденном иммунитете. СПб., Наука, 261 с.
Токмакова А.С. 2018. Клеточные реакции легочных моллюсков на трематодную инвазию. Автореф. дис. …
канд. биол. наук. СПб, 22 с.
Adamowicz A., Bolaczek M. 2003. Blood cells morphology of the snail helix Aspersa maxima (Helicidae). Zoologica
Poloniae 48 (1-4): 93-101.
Adema C.M., Harris R.A., van Deutekom-Mulder E.C. 1992. A comparative study of hemocytes from six different
snails: morphology and functional aspects. Journal of Invertebrate Pathology 59 (1): 24-32.
Adema C.M., Hertel L.A., Loker E.S. 1999. Evidence from two planorbid snails of a complex and dedicated
response to digenean (Echinostome) infection. Parasitology 119 (4): 395-404.
Adema C.M., Hertel L.A., Miller R.D., Loker E.S. 1997. A family of fibrinogen-related proteins that precipitates
parasite-derived molecules is produced by an invertebrate after infection. PNAS 94 (16): 8691-8696.
Adema C.M., van Deutekom-Mulder E.C., van der Knaap W.P., Sminia T. 1994. Schistosomicidal activities of
Lymnaea stagnalis haemocytes: the role of oxigen radicals. Parasitology 109 (4): 479-485.
Adema C.M., Sapp К.K., Hertel L.A., Loker E.S. 2001. Immunobiology of the relationship of echinostomes with
snail intermediate hosts. In: Fried B., Graczyk T.K. (eds). Echinostomes as experimental models for biologi-
cal research. Dordrecht, Boston, London, Kluwer Academic Publishers, 149-173.
Adema C.M., Hanington P.C., Lun C.-M., Rosenberg G.H., Aragon A.D., Stout B.A., Richard M.L., Gross P.S.,
Loker E.S. 2010. Differential transcriptomic responses of Biomphalaria glabrata (Gastropoda, Mollusca)
to bacteria and metazoan parasites, Schistosoma mansoni and Echinostoma paraensei (Digenea, Platyhel-
minthes). Molecular Immunology 47 (4): 849-860.
Adema C.M., Loker E.S. 2015. Digenean-gastropod host associations inform on aspects of specific immunity in
snails. Developmental and Comparative Immunology 48 (2): 275-283.
Adema C.M., Hillier L.W., Jones C.S., Loker E.S., Knight M., Minx P. et al. 2017. Whole genome analysis of a
schistosomiasis-transmitting freshwater snail. Nature Communications 8 (15451): 1-11.
Akira S., Uematsu S., Takeuchi O. 2006. Pathogen recognition and innate immunity. Cell 124 (4): 783-801.
Anderson K.V., Bokla L, Nüssleinvolhard C. 1985. Establishment of dorsal-ventral polarity in the Drosophila
embryo: the induction of polarity by the toll gene product. Cell 42 (3): 791-798.
Ataev G.L., Dobrovolskij A.A., Fournier A., Jourdane J. 1997. Migration and development of mother sporocysts
of Echinostoma caproni (Digenea: Echinostomatidae). Journal of Parasitology 83 (3): 444-453.
Ataev G.L., Babich P.S., Tokmakova A.S. 2013. The study of the sporocyst broodsacs coloring in Leucochloridium
paradoxum (Trematoda: Brachylaemidae). Parasitologiya 47 (5): 372-379.
Ataev G.L., Coustau C. 1999. Cellular response to Echinostoma caproni infection in Biomphalaria glabrata
strains selected for susceptibility/resistance. Developmental and Comparative Immunology 23 (3): 187-198.
Ataev G.L., Prokhorova E.E., Kudryavtsev I.V., Polevshchikov A.V. 2016. The influence of trematode infection
on the hemocyte composition in Planorbarius corneus (Gastropoda, Pulmonata). Invertebrate Survival
Journal 13 (1): 164-171.
Barbosa L., Caldeira R.L., Carvalho O.S., Vidigal T.H.D.A., Jannotti-Passos L.K., Coelho P.M.Z. 2006. Resistance
to Schistosoma mansoni by transplantation of APO Biomphalaria tenagophila. Parasite Immunology 28
(5): 209-212.
Barcante T.A., Barcante J.P., Fujiwara R.T., Lima W.S. 2012. Analysis of circulating haemocytes from Biomphal-
aria glabrata following Angiostrongylus vasorum infection using flow cytometry. Journal of Parasitology
Research 2012: 314723.
Baron O.L., Deleury E., Reichhart J.-M., Coustau C. 2016. The LBP/BPI multigenic family in invertebrates:
Evolutionary history and evidences of specialization in mollusks. Developmental and Comparative Im-
munology 57: 20-30.
393
Barracco M.A., Steil A.A., Garqioni R. 1993. Morphological characterization of the hemocytes of the pulmonate
snail Biomphalaria tenagophila. Memórias do Instituto Oswaldo Cruz 88 (1): 73-83.
Bash P.F. 1969. Cotylurus lutzi sp. n. (Trematoda: Strigeidae) and its life cycle. Journal of Parasitology 55 (3):
527-539.
Bayne C.J., Boswell C.A., Loker E.S., Yui M.A. 1985. Plasma components which mediate cellular defaces in
the gastropod mollusk Biomphalaria glabrata. Developmental and Comparative Immunology 9: 523-530.
Bayne C.J., Hahn U.K., Bender R.C. 2001. Mechanisms of molluscan host resistance and of parasite strategies
for survival. Parasitology 123 (Suppl: S): 159-167.
Bayne C.J., Yoshino T.P. 1989. Determinants of compatibility in mollusc-trematode parasitism. American Zoolo-
gist 29 (2): 399-407.
Blandin S.A., Levashina E.A. 2004. Thioester-containing proteins and insect immunity. Molecular Immunology
40 (12): 903-908.
Bonner K.M., Bayne C.J., Larson M.K., Blouin M.S. 2012. Effects of Cu/Zn superoxide dismutase (sod1) genotype
and genetic background on growth, reproduction and defense in Biomphalaria glabrata. PLoS Neglected
Tropical Diseases 6 (6): e1701.
Bouchut A., Roger E., Coustau C., Gourbal B., Mitta G. 2006. Compatibility in the Biomphalaria glabrata/Echi-
nostoma caproni model: potential involvement of adhesion genes. International Journal for Parasitology
36 (2): 175-184.
Castillo M.G., Wu X.J., Dinguirard N., Nyame A.K., Cummings R.D., Yoshino T.P. 2007. Surface membrane
proteins of Biomphalaria glabrata embryonic cells bind fucosyl determinants on the tegumental surface of
Schistosoma mansoni primary sporocysts. Journal of Parasitology 93 (4): 832-840.
Cavalcanti M.G.S., Filho F.C., Mendonc A.M.B., Duartec G.R., Barbosa C.C.G.S., De Castro C.M.M.B., Alves
L.C., Brayner F.A. 2012. Morphological characterization of hemocytes from Biomphalaria glabrata and
Biomphalaria straminea. Micron 43 (2-3): 285-291.
Chen J.M., Cooper D.N., Chuzhanova N., Férec C., Patrinos G.P. 2007. Gene conversion: Mechanisms, evolution
and human disease. Nature Reviews Genetics 8: 762-775.
Cheng T.C. 1975. Functional morphology and biochemistry of molluscan phagocytes. Annals of the New York
Academy of Sciences 266: 343-379.
Cheng T.C. 1984. A classification of molluscan hemocytes based on functional evidence. Comparative Pathobiol-
ogy 6: 111-146.
Cheng T.C., Dougherty W.J. 1989. Ultrastructural evidence for the destruction of Schistosoma mansoni sporocysts
associated with elevated lysosomal enzyme levels in Biomphalaria glabrata. Journal of Parasitology 75
(6): 928-941.
Cheng T.C., Guida V.G. 1980. Hemocytes of Bulinus truncatus rohlfsi (Mollusca, Gastropoda). Journal of Inver-
tebrate Pathology 35: 158-167.
Cheng T.C., Guida V.G., Gerhart P.L. 1978. Aminopeptidase and lysozyme activity levels and serum protein
concentrations in Biomphalaria glabrata (Mollusca) challenged with bacteria. Journal of Invertebrate Pa-
thology 32 (3): 297-302.
Cheng T.C., Jourdan J. 1987. Transient cellular reaction in Biomphalaria glabrata (Mollusca) to heterotopic iso-
grafts. Journal of Invertebrate Pathology 49 (3): 273-278.
Combes C. 1995. Interactions durables. Ecologie et evolution du parasitisme. Paris, Milan, Barcelone, Masson, 524 p.
Connors V.A., Lodes M.J., Yoshino T.P. 1991. Identification of Schistosoma mansoni sporocyst excretory secretory
antioxidant molecule and its effect on superoxide production by Biomphalaria glabrata hemocytes. Journal
of Invertebrate Pathology 58: 387-395.
Connors V.A. 2003. The schistosome-snail interaction: factors involved in host immunodefense activation and para-
site killing in susceptible and resistant Biomphalaria glabrata. In: Combes C., Jourdane J. (eds). Taxonomy,
ecology and evolution of metazoan parasites. Perpignan, Presses universitaires de Perpignan, 203-224.
Connors V.A., Yoshino T.P. 1990. In vitro effect of larval Schistosoma mansoni excretory-secretory products
on phagocytosis-stimulated superoxide production in hemocytes from Biomphalaria glabrata. Journal of
Parasitology 76 (6): 895-902.
Conte A., Ottaviani E. 1995. Nitric oxide synthase activity in molluscan hemocytes. FEBS Letters 365 (2-3):
120-124.
Coustau C., Gourbal B., Duval D., Yoshino T.P., Adema C.M., Mitta G. 2015. Advances in gastropod immunity
from the study of the interaction between the snail Biomphalaria glabrata and its parasites: a review of
research progress over the last decade. Fish and Shellfish Immunology 46 (1): 5-16.
394
Coustau C., Kurtz J., Moret Y. 2016. A novel mechanism of immune memory unveiled at the invertebrate-parasite
interface. Trends in Parasitology 32 (5): 353-355.
Cribb T.H., Bray R.A., Littlewood D.T. 2001. The nature and evolution of the association among digeneans, mol-
luscs and fishes. International Journal for Parasitology 31 (9): 997-1011.
Damian R.T. 1989. Molecular mimicry: parasite evasion and host defense. Current Topics in Microbiology and
Immunology 145: 101-115.
De Jong-Brink M. 1994. How schistosomes profit from the stress responses they elicit in their hosts. Advances
in Parasitology 35: 177-256.
Deininger M.H., Meyermann R., Schluesener H.J. 2002. The allograft inflammatory factor-1 family of proteins.
FEBS Letters 514 (2-3): 115-121.
Dheilly N.M., Duval D., Mouahid G., Emans R., Allienne J.-F., Galinier R. et al. 2015. A family of variable im-
munoglobulin and lectin domain containing molecules in the snail Biomphalaria glabrata. Developmental
and Comparative Immunology 48 (1): 234-243.
Dikkeboom R., van der Knaap W.P., van den Bovenkamp W., Tijnagel J.M., Bayne C.J. 1988. The production
of toxic oxygen metabolites by hemocytes of different snail species. Developmental and Comparative Im-
munology 12 (3): 509-520.
Doolittle R.F. 1992. A detailed consideration of a principal domain of vertebrate fibrinogen and its relatives.
Protein Science 1 (12): 1563-1577.
Franchini A., Ottaviani E. 2000. Repair of molluscan tissue injury: role of PDGF and TGF-beta1. Tissue Cell 32
(4): 312-321.
Fryer S.E., Bender R.C., Bayne C.J. 1996. Inhibition of cysteine proteinase from Schistosoma mansoni larvae by
alpha-macroglobulin from the plasma of Biomphalaria glabrata. Journal of Parasitology 82 (2): 343-347.
Furuta E., Yamaguchi K. 2001. Haemolymph: blood cell morphology and function. In: Barker G.M. (ed.). The
biology of terrestrial molluscs, 289-306.
Galinier R., Portela J., Mone Y., Allienne J.-F., Henri H., Delbecq S. et al. 2013. Biomphalysin, a new β pore-
forming toxin involved in Biomphalaria glabrata immune defense against Schistosoma mansoni. PLoS
Pathogens 9 (3): e1003216.
Galinier R., Tetreau G., Portet A., Pinaud S., Duval D., Gourbal B. 2017. First characterization of viruses from
freshwater snails of the genus Biomphalaria, the intermediate host of the parasite Schistosoma mansoni.
Acta Tropica 167: 196-203.
Garcia A.B., Pierce R.J., Gourbal B., Werkmeister E., Colinet B., Reichhart J.-M., Dissous C., Coustau C. 2010
Involvement of the cytokine MIF in the snail host immune response to the parasite Schistosoma mansoni.
PLoS Pathogens 6 (9): e1001115.
Glinski Z., Jarosz J. 1997. Molluscan immune defenses. Archivum Immunologiae et Therapiae Experimentalis
45 (2-3): 149-155.
Gordy M.A., Pila E.A., Hanington P.C. 2015. The role of fibrinogen-related proteins in the gastropod immune
response. Fish Shellfish Immunology 46 (1): 39-49.
Gourbal B., Pinaud S., Beckers G., Van Der Meer J., Conrath U., Netea M. 2018. Innate immune memory: an
evolutionary perspective. Immunological Reviews 283 (1): 21-40.
Granath W.O., Yoshino J., Yoshino T.P. 1984. Schistosoma mansoni: passive transfer of resistance by serum in the
vector snail, Biomphalaria glabrata. Experimental Parasitology 58: 188-193.
Guillou F., Mitta G., Dissous C., Pierce R., Coustau C. 2004. Use of individual polymorphism to validate potential
functional markers: case of a candidate lectin (BgSel) differentially expressed in susceptible and resistant
strains of Biomphalaria glabrata. Comparative Biochemistry and Physiology 138: 175-181.
Guillou F., Mitta G., Galonier R., Coustau C. 2007. Identification and expression of gene transcripts generated
during an anti-parasitic response in Biomphalaria glabrata. Developmental and Comparative Immunology
31: 657-671.
Gust M., Fortier M., Garric J., Fournier M., Gagne F. 2013. Effects of short-term exposure to environmentally
relevant concentrations of different pharmaceutical mixtures on the immune response of the pond snail
Lymnaea stagnalis. Science of the Total Environment 445-446: 210-218.
Hahn U.K.; Bender R.C.; Bayne C.J. 2001. Killing of Schistosoma mansoni sporocysts by hemocytes from resistant
Biomphalaria glabrata: role of reactive oxygen species. Journal of Parasitology 87: 292-299.
Hanington P.C., Lun C.-M., Adema C.M., Loker E.S. 2010a. Time series analysis of the transcriptional responses
of Biomphalaria glabrata throughout the course of intramolluscan development of Schistosoma mansoni
and Echinostoma paraensei. International Journal for Parasitology 40 (7): 819-831.
395
Hanington P.C., Forys M.A., Dragoo J.W., Zhang S.-M., Adema C.M., Loker E.S. 2010b. Role for a somatically
diversified lectin in resistance of an invertebrate to parasite infection. PNAS 107 (49): 21087-21092.
Hanington P.C., Forys M.A., Loker E.S. 2012. Somatically diversified defense factor, FREP3, is a determinant of
snail resistance to Schistosome infection. PLoS Neglected Tropical Diseases 6 (3): e1591.
Harris K.R. 1975. The fine structure of encapsulation in Biomphalaria glabrata. Annals of the New York Academy
of Sciences 266: 446-464.
Hermann P.M., Nicol J.J., Nagle G.T., Bulloch A.G., Wildering W.C. 2005. Epidermal growth factor-dependent
enhancement of axonal regeneration in the pond snail Lymnaea stagnalis: role of phagocyte survival. Journal
of Comparative Neurology 492 (4): 383-400.
Hermann P.M., Nicol J.J., Bulloch A.G., Wildering W.C. 2008. RGD-dependent mechanisms in the endoneurial
phagocyte response and axonal regeneration in the nervous system of the snail Lymnaea stagnalis. Journal
of Experimental Biology 211: 491-501.
Hertel L.A., Adema C.M., Loker E.S. 2005. Differential expression of FREP genes in two strains of Biomphalaria
glabrata following exposure to the digenetic trematodes Schistosoma mansoni and Echinostoma paraensei.
Developmental and Comparative Immunology 29 (4): 295-303.
Hokke C.H., Fitzpatrick J.M., Hoffmann K.F. 2007. Integrating transcriptome, proteome and glycome analyses of
Schistosoma biology. Trends in Parasitology 23 (4): 165-174.
Horak P., Deme R. 1998. Lectins and saccharides in Lymnaea stagnalis hemocyte recognition. Comparative He-
matology International 8 (4): 210-218.
Humphries J.E., Yoshino T.P. 2008. Regulation of hydrogen peroxide release in circulating hemocytes of the
planorbid snail Biomphalaria glabrata. Developmental and Comparative Immunology 32 (5): 554-562.
Ittiprasert W., Miller A., Myers J., Nene V., El-Sayed N.M., Knight M. 2010. Identification of immediate response
genes dominantly expressed in juvenile resistant and susceptible Biomphalaria glabrata snails upon exposure
to Schistosoma mansoni. Molecular and Biochemical Parasitology 169 (1): 27-39.
Janeway C.A. Jr, Medzhitov R. 2002. Innate immune recognition. Annual Review of Immunology 20: 197-216.
Jeong, K.H., Heyneman D. 1976. Leukocytes of Biomphalaria glabrata: morphology and behavior of granulocytic
cell in vitro. Journal of Invertebrate Pathology 28 (3): 357-362.
Jeong K.H., Lie K.J., Heyneman D. 1983. The ultrastructure of the amebocyte-producing organ in Biomphalaria
glabrata. Developmental and Comparative Immunology 7 (2): 217-228.
Jiang Y., Loker E.S., Zhang S.-M. 2006. In vivo and in vitro knockdown of FREP2 gene expression in the snail
Biomphalaria glabrata using RNA interference. Developmental and Comparative Immunology 30 (10):
855-866.
Joky A. 1982. Les amoebocytes de Biomphalaria glabrata; role dans les reactions de defense du mollusque.
Diplôme de docteur, Paris, 72 p.
Joky A., Matricon-Gondran M., Benex J. 1983. Fine structural differences in the amoebocytes of Biomphalaria
glabrata. Developmental and Comparative Immunology 7 (4): 669-672.
Joky A., Matricon-Gondran M. 1985. Response to the amoebocyte-producing organ of sensitized Biomphalaria
glabrata after exposure to Echinostoma caproni miracidia. Journal of Invertebrate Pathology 45 (1): 28-33.
Jourdane J., Cheng T.C. 1987. The two-phase recognition process of allografts in Brazilian strain of Biomphalaria
glabrata. Journal of Invertebrate Parasitology 49 (2): 145-158.
Kinoti G.K. 1971. Observation on the infection of bulinid snails with Schistosoma manttheei. II. The mechanism
of resistance to infection. Parasitology 62 (1): 161-170.
Kurosawa Y., Hashimoto K. 1996. The immoglobulin superfamily: where do invertebrate fit in? In: Cooper E.
(ed.). Advances in Comparative and Enviromental physiology, Berlin, Springer, 23: 151-184.
Lassalle D., Tetreau G., Pinaud S., Galinier R., Crickmore N., Gourbal B., Duval D. 2020. Glabralysins, potential
new β-pore-forming toxin family members from the schistosomiasis vector snail Biomphalaria glabrata.
Genes 11 (1): 65.
Li H., Hambrook J.R., Pila E.A., Gharamah A.A., Fang J., Wu X., Hanington P. 2020. Coordination of humoral
immune factors dictates compatibility between Schistosoma mansoni and Biomphalaria glabrata. Elife 9:
e51708.
Lie K.J., Heyneman D. 1975. Studies on resistance in snails: a specific tissue reaction to Echinostoma lindoense
in Biomphalaria glabrata snails. International Journal for Parasitology 5: 621-625.
Lie K.J., Heyneman D. 1976a. Studies on resistance in snails. 3. Tissue reactions to Echinostoma lindoense
sporocysts in sensitized and resensitized Biomphalaria glabrata. Journal of Parasitology 62 (1): 51-58.
Lie K.J., Heyneman D. 1976b. Studies on resistance in snails. 6. Escape of Echinostoma lindoense sporocysts
from encapsulation in the snail heart and subsequent loss of the host’s ability to resist infection by the same
parasite. Journal of Parasitology 62 (2): 298-302.
396
Lie K.J., Heyneman D., Jeong K.H. 1976. Studies on resistance in snails. 4. Induction of ventricular capsules and
changes in the amebocyte-producing organ during sensitization of Biomphalaria glabrata snails. Journal
of Parasitology 62 (2): 286-291.
Lie K.J., Heyneman D., Richards C.S. 1977. Studies on resistance in snails: interference by nonirradiated echinostome
larvae with natural resistance to Schistosoma mansoni in Biomphalaria glabrata. Journal of Invertebrate
Pathology 29: 118-125.
Lie K.J., Heyneman D., Yau P. 1975. The origin of amebocytes in Biomphalaria glabrata. Journal of Parasitology
61 (3): 574-576.
Lie K.J., Jeong K.H., Heyneman D. 1982. Further characterization of acquired resistance in Biomphalaria glabrata.
Journal of Parasitology 68 (4): 529-531.
Lie K.J., Jeong K.H., Heyneman D. 1983. Acquired resistance in snails. Inducton of resistance to Schistosoma
mansoni in Biomphalaria glabrata. International Journal for Parasitology 13 (3): 301-304.
Lockyer A.E., Jones C.S., Noble L.R., Rollinson D. 2004. Trematodes and snails: an intimate association. Canadian
Journal of Zoology 82 (2): 251-269.
Lockyer A.E., Emery A.M., Kane R.A., Walker A.J., Mayer C.D., Mitta G., Coustau C. et al. 2012. Early differential
gene expression in haemocytes from resistant and susceptible Biomphalaria glabrata strains in response to
Schistosoma mansoni. PLoS One 7 (12): e51102.
Lodes M.J., Yoshino T. 1990. The effect of schistosome excretory-secretory products on Biomphalaria glabrata
haemocyte motility. Journal of Invertebrate Pathology 56 (1): 75-85.
Loker E.S., Adema C.M., Zhang S.-M., Kepler T. 2004. Invertebrate immune systems - not homogeneous, not
simple, not well understood. Immunological Reviews 198: 10-24.
Loker E.S., Cimino D.F., Hertel L.A. 1992. Excretory-secretory products of Echinostoma paraensei sporocysts
mediate interference with Biomphalaria glabrata hemocyte functions. Journal of Parasitology 78 (1): 104-115.
Loker E.S., Bayne C.J., Yui M.A. 1986. Echinostoma paraensei: hemocytes of Biomphalaria glabrata as targerts
of Echinostome mediated interference with host resistance to Schistosoma mansoni. Experimental Parasi-
tology 62 (1): 149-154.
Loker E.S., Bayne C.J., Buckley P.M., Kruse K.T. 1982. Ultrastructure of encapsulation of Schistosoma mansoni
mother sporocysts by hemocytes of the juveniles of the 10-R2 strain of Biomphalaria glabrata (Mollusca:
Gastropoda). Journal of Parasitology 68 (1): 84-94.
Martins-Souza R.L., Pereira C.A.J., Coelho P.M.Z., Martins-Filho O.A., Negrão-Corrêa D. 2009. Flow cytometry
analysis of the circulating haemocytesfrom Biomphalaria glabrata and Biomphalaria tenagophila following
Schistosoma mansoni infection. Parasitology 136 (1): 67-76.
Matricon-Gondran M., Letocart M. 1999. Internal defenses of the snail Biomphalaria glabrata. I. Characterization
of hemocytes and fixed phagocytes. Journal of Invertebrate Pathology 74 (3): 224-234.
Medzhitov R., Janeway C.A. 1997. Innate Immunity: The virtues of a nonclonal system of recognition. Cell 91
(3): 295-298.
Melillo D., Marino R., Italiani P., Boraschi D. 2018. Innate immune memory in invertebrate metazoans: A Critical
Appraisal. Frontiers in Immunology 9: 1915.
Mitta G., Galinier R., Tisseyre P., Allienne J.-F., Girerd-Chambaz Y., Guillou F. et al. 2005. Gene discovery and
expression analysis of immune-relevant genes from Biomphalaria glabrata hemocytes. Developmental and
Comparative Immunology 29 (5): 393-407.
Mitta G., Adema C.M., Gourbal B., Loker E.S., Theron A. 2012. Compatibility polymorphism in snail/schistosome
interactions: From field to theory to molecular mechanisms. Developmental and Comparative Immunology
37 (1): 1-8.
Mitta G., Gourbal B., Grunau C., Knight M., Bridger J.M., Theron A. 2017. The compatibility between Biomphal-
aria glabrata snails and Schistosoma mansoni: an increasingly complex puzzle. Advances in Parasitology
97: 111-145.
Mone Y., Gourbal B., Duval D., Du Pasquier L., Kieffer-Jaquinod S., Mitta G. 2010. A large repertoire of parasite
epitopes matched by a large repertoire of host immune receptors in an invertebrate host/parasite model.
PLoS Neglected Tropical Diseases 4: e813.
Monteil J.F., Matricon-Gondran M. 1991. Hemocyte production in trematode-infected Lymnaea truncatula. Para-
sitology Research 77 (6): 491-497.
Mouahid A., Моnе H. 1990. Interference of Echinoparyphium elegans with the host-parasite system Bulinus trun-
cates-Schistosoma bovis in natural conditions. Annals of Tropical Medicine and Parasitology 84 (4): 341-348.
Mount A.S., Wheeler A.P., Paradkar R.P., Snider D. 2004. Hemocyte-mediated shell mineralization in the Eastern
oyster. Science 304 (5668): 297-300.
397
Myers J., Ittiprasert W., Raghavan N., Miller A., Knight M. 2008. Differences in cysteine protease activity in
Schistosoma mansoni resistant and susceptible Biomphalaria glabrata and characterization of the hepato-
pancreas cathepsin B full-length cDNA. Journal of Parasitology 94 (3): 659-668.
Netea M.G., Joosten L.A.B., Latz E., Mills K.H.G., Natoli G., Stunnenberg H.G. et al. 2016. Trained immunity:
a program of innate immune memory in health and disease. Science 352 (6284): aaf1098.
Nie L., Cai S.-Y., Shao J.-Z., Chen J. 2018. Toll-like receptors, associated biological roles, and signaling networks
in non-mammals. Frontiers in immunology 9 (1523): 1-19.
Noda S. 1992. Effects of excretory-secretory products of Echinostoma paraensei larvae on the hematopoietic organ
of M-line Biomphalaria glabrata snails. Journal of Parasitology 78 (3): 512-517.
Oliveira A.L.D., Levada P.M., Zanotti-Magalhaes E.M., Magalhaes L.A., Ribeiro-Paes J. 2010. Differences in the
number of hemocytes in the snail host Biomphalaria glabrata, resistant and susceptible to Schistosoma
mansoni infection. Genetics and Molecular Research 9 (4): 2436-2445.
Ottaviani E. 1983. The blood cells of the freshwater snail Planorbis corneus (Gastropoda, Pulmonata). Develop-
mental and Comparative Immunology 7 (2): 209-216.
Ottaviani E. 2006. Molluscan immunorecognition. Invertebrate Survival Journal 3: 50-63.
Ottaviani E., Franchini A. 1988. Ultrastructural study of haemocytes of the freshwater snail Planorbarius corneus
(Gastropoda, Pulmonata). Acta Zoolologica 69 (3): 157-162.
Pan C.T. 1958. The general histology and topographic microanatomy of Australorbis glabratus. Bulletin of Museum
of Comparative Zoology 119: 237-299.
Pan C.T. 1965. Studies on the host-parasite relationship between Schistosoma mansoni and the snail Australorbis
glabratus. American Journal of Tropical Medicine and Hygiene 14: 931-976.
Pees B., Yang W., Zarate-Potes A., Schulenburg H., Dierking K. 2016. High innate immune specificity through
diversified C-type lectin-like domain proteins in invertebrates. Journal of Innate Immunity 8: 129-142.
Peterson N.A., Hokke C.H., Deelder A.M., Yoshino T.P. 2009. Glycotope analysis in miracidia and primary spo-
rocysts of Schistosoma mansoni: differential expression during the miracidium-to-sporocyst transformation.
International Journal for Parasitology 39: 1331-1344.
Pila E.A., Sullivan J.T., Wu X.Z., Fang J., Rudko S.P., Gordy M.A., Hanington P.C. 2016a. Haematopoiesis in
molluscs: A review of haemocyte development and function in gastropods, cephalopods and bivalves.
Developmental and Comparative Immunology 58: 119-128.
Pila E.A., Tarrabain M., Kabore A.L., Hanington P.C. 2016b. A novel Toll-like receptor (TLR) influences compat-
ibility between the gastropod Biomphalaria glabrata, and the digenean trematode Schistosoma mansoni.
PLoS Pathogens 12: e1005513.
Pila E.A., Li H., Hambrook J.R., Wu X., Hanington P.C. 2017. Schistosomiasis from a snail’s perspective: advances
in snail immunity. Trends of Parasitology 33 (11): 845-857.
Pinaud S., Portela J., Duval D., Nowacki F.C., Olive M.A., Allienne J.-F. et al. 2016. A shift from cellular to
humoral responses contributes to innate immune memory in the vector snail Biomphalaria glabrata. PLoS
Pathogens 12: e1005361.
Pinaud S., Portet A., Allienne J.-F., Belmudes L., Saint-Beat C., Arancibia N. et al. 2019. Molecular characterisation
of immunological memory following homologous or heterologous challenges in the schistosomiasis vector
snail, Biomphalaria glabrata. Developmental and Comparative Immunology 92: 238-252.
Portela J., Duval D., Rognon A., Galinier R., Boissier J., Coustau C. et al. 2013. Evidence for specific genotype-
dependent immune priming in the lophotrochozoan Biomphalaria glabrata snail. Journal of Innate Immunity
5: 261-276.
Portet A., Galinier R., Pinaud S., Portela J., Nowacki F., Gourbal B., Duval D. 2018. BgTEP: an antiprotease
involved in innate immune sensing in Biomphalaria glabrata. Frontiers in Immunology 9: 1206.
Portet A., Pinaud S., Chaparro C., Galinier R., Dhelly N.M., Portela J. et al. 2019. Sympatric and allopatric
evolutionary contexts shape differential immune response in Biomphalaria/Schistosoma interaction. PLoS
Pathogens 15: e1007647.
Prokhorova E.E., Serebryakova M.K., Tokmakova A.S., Ataev G.L. 2018. Hemocytes of mollusc Biomphalaria
glabrata (Gastropoda, Pulmonata). Invertebrate Survival Journal 15: 346-351.
Renwrantz L. 1986. Lectins in molluscs and arthropods: their occurrence, origin and roles in immunity. In: Lackie
A.M. (ed.). Immune mechanisms in invertebrate vectors. Oxford, Oxford Scientific Publications, 81-93.
Rodelaud D., Barthe D. 1981. The development of the amoebocyte-producing organ in Lymnaea truncatula Müller
infected by Fasciola hepatica L. Zeitschrift für Parasitenkunde 65: 331-341.
Rowley A.F., Powell A. 2007. Invertebrate immune systems-specific, quasi-specific, or nonspecific? Journal of
Immunology 179: 7209-7214.
398
Salamat Z., Sullivan J. 2009. Involvement of protein kinase C signalling and mitogen-activated protein kinase in
the amebocyte-producing organ of Biomphalaria glabrata (Mollusca). Developmental and Comparative
Immunology 33 (6): 725-727.
Sarashina I., Yamaguchi H., Haga T., Iijima M., Chiba S., Endo K. 2006. Molecular evolution and functionally
important structures of molluscan dermatopontin: implications for the origins of molluscan shell matrix
proteins. Journal of Molecular Evolution 62 (3): 307-318.
Sasaki Y., Furuta E., Kirinoki M., Seo N., Matsuda H. 2003. Comparative studies of the internal defense sys-
tem of schistosome-resistant and -susceptible amphibious snail Oncomelania nosophora: 1. Comparative
morphological and functional studies on hemocytes from both snails. Zoological Science 20: 1215-1222.
Schell S.C. 1965. The life history of Haematoloechus breviplexus Stafford, 1902 (Trematoda: Haplometridae Mc-
Mullen, 1937) with emphasis on the development of the sporocysts. Journal of Parasitology 51 (4): 587-593.
Seppälä O., Leicht K. 2013. Activation of the immune defence of the freshwater snail Lymnaea stagnalis by dif-
ferent immune elicitors. Journal of Experimental Biology 216: 2902-2907.
Sire C., Rognon A., Theron A. 1998. Failure of Schistosoma mansoni to reinfect Biomphalaria glabrata snails:
acquired humoral resistance or intra-specific larval antagonism? Parasitology 117: 117-122.
Sminia T. 1972. Structure and function of blood and connective tissue cells of the fresh-water pulmonate Lymnea
stagnalis studied by electron microscopy and enzyme histochemistry. Zeitschrift für Zellforschung 130:
497-526.
Sminia T. 1974. Haematopoiesis in the freshwater snail Lymnaea stagnalis studied by electron microscopy and
autoradiography. Cell and Tissue Research 150: 443-454.
Sminia T. 1981. Gastropods. In: Ratcliffe N.A., Rowley A.F. (eds). Invertebrate Blood Cells, Vol. I. London,
Academic Press, 190-232.
Sminia T., van der Knaap W.P.W., van Asselt L.A. 1983. Blood cell types and blood cell formation in gastropod
molluscs. Developmental and Comparative Immunology 7: 665-668.
Sminia T.A., Barendsen L. 1980. Comparative morphological and enzymes histochemical study on blood cells
of the freshwater snails Lymnaea stagnalis, Biomphalaria glabrata, and Bulinus truncates. Journal of
Morphology 165: 31-39.
Sminia T., Borghart-Reinders E., van de Linde A.W. 1974. Encapsulation of foreign material experimentally in-
troduced into the fresh water snail Lymnaea stagnalis: an electron microscopic and autoradiographic study.
Cell and Tissue Research 153: 307-326.
Souza S.S., Andrade Z.A. 2006. On the origin of the Biomphalaria glabrata hemocytes. Memórias do Instituto
Oswaldo Cruz 101: 213-218.
Spatz L., Cappa S.M.G., Ostrowski de Núñez M. 2012. Susceptibility of wild populations of Biomphalaria spp.
from neotropical South America to Schistosoma mansoni and interference of Zygocotyle lunata. Journal of
Parasitology 98 (6): 1291-1295.
Stumpf J.L., Gilbertson D.E. 1980. Differential leukocytic responses of Biomphalaria glabrata to infection with
Schistosoma mansoni. Journal of Invertebrate Pathology 35 (2): 217-218.
Sullivan J.T. 1988. Hematopoiesis in three species of gastropods following infection with Echinostoma paraensei
(Trematoda: Echinostomatidae). Transactions of the American Microscopical Society 107 (4): 335-361.
Sullivan J.T. 1990. Long-term survival of heterotopic allografts of the amoebocyte-producing organ in Biomphal-
aria glabrata (Mollusca: Pulmonata). Transactions of the American Microscopical Society 109 (1): 52-60.
Sullivan J.T., Belloir J.A., Beltran R.V., Grivakis A., Ransone K.A. 2014. Fucoidan stimulates cell division in
the amebocyte-producing organ of the schistosome-transmitting snail Biomphalaria glabrata. Journal of
Invertebrate Pathology 123: 13-16.
Sullivan J.T., Bulman C.A., Salamat Z. 2011. Effect of crude lipopolysaccharide from Escherichia coli O127:B8
on the amebocyte-producing organ of Biomphalaria glabrata (Mollusca). Developmental and Comparative
Immunology 35 (11): 1182-1185.
Sullivan J.T., Hu P.C. 1996. Fate of Schistosoma mansoni in Biomphalaria obstructa. Journal of Parasitology 82
(5): 743-747.
Sullivan J.T., Lares R.R., Galvan A.G. 1998. Schistosoma mansoni infection inhibits maturation of ovotestis al-
lografts in Biomphalaria glabrata (Mollusca: Pulmonata). Journal of Parasitology 84 (1): 82-87.
Sullivan J.T., Pikios S.S., Alonzo A.Q. 2004. Mitotic responses to extracts of miracidia and cercariae of Schis-
tosoma mansoni in the amebocyte-producing organ of the snail intermediate host Biomphalaria glabrata.
Journal of Parasitology 90 (1): 92-96.
Sullivan J.T., Richards C.S., Joe L.K., Heyneman D. 1982. Ribeiroia marini: irradiated miracidia and induction of
acquired resistance in Biomphalaria glabrata. Experimental Parasitology 53 (1): 17-25.
399
Sullivan J.T., Spence J.V. 1999. Factors affecting adoptive transfer of resistance to Schistosoma mansoni in the
snail intermediate host, Biomphalaria glabrata. Journal of Parasitology 85 (6): 1065-1071.
Takeda K., Kaisho T., Akira S. 2003. Toll-like receptors. Annual Review of Immunology 21 (1): 335-76.
Takeda K, Akira S. 2015. Toll-like Receptors. Current Protocols in Immunology 109: 14.12.1-14.12.10.
Tetreau G., Pinaud S., Portet A., Galinier R., Gourbal B., Duval D. 2017. Specific pathogen recognition by multiple
innate immune sensors in an invertebrate. Frontiers in Immunology 8: 1249.
Theron A., Coustau C. 2005. Are Biomphalaria snails resistant to Schistosoma mansoni? Journal of Helminthol-
ogy 79 (3): 187-191.
Tokmakova A.S., Serebryakova M.K., Prokhorova E.E., Ataev G.L. 2020. Study of the proliferative activity of
hemolymph cells in pulmonate molluscs. Invertebrate Survival Journal 17: 63-74.
van der Knaap W.P.W. 1981. Recognition of foreignness in the internal defence system of the fresh-water gastropod
Lymnaea stagnalis. Developmental and Comparative Immunology 1: 91-97.
van der Knaap W.P.W., Loker E.S. 1990. Immune mechanisms in trematode - snail interactions. Parаsitology
Today 6 (6): 176-182.
van der Knaap W.P.W, Adema C.M., Sminia T. 1993. Invertebrate blood cells: morphological and functional aspects
of the haemocytes in the pond snail Lymnaea stagnalis. Comparative Haematology International 3: 20-26.
Vasquez R.E., Sullivan J.T. 2001. Hematopoietic tissue allografts in Biomphalaria glabrata (Mollusca: Pulmonata)
induce humoral immunity to Schistosoma mansoni. Developmental and Comparative Immunology 25 (7):
561-564.
Vasta G.R., Feng C., Bianchet M.A., Bacvaroff T.R., Tasumi S. 2015. Structural, functional, and evolutionary
aspects of galectins in aquatic mollusks: from a sweet tooth to the trojan horse. Fish and Shellfish Im-
munology 46 (1): 94-106.
Wallet S.M., Puri V., Gibson F.C. 2018. Linkage of infection to adverse systemic complications: periodontal disease,
Toll-like receptors, and other pattern recognition systems. Vaccines 6 (2): 21.
Webster J.P., Davies C.M. 2001. Coevolution and compatibility in the snail-schistosome system. Parasitology
123 (7): 41-56.
Wu X.-J., Dinguirard N., Sabat G., Lui H., Gonzalez L., Gehring M. et al. 2017. Proteomic analysis of Biomphalaria
glabrata plasma proteins with binding affinity to those expressed by early developing larval Schistosoma
mansoni. PLos Pathogens 13 (5): e1006081.
Yamaguchi K., Furuta E., Shimozawa A. 1988. Morphological and functional studies on hemolymph cells of land
slug, Incilaria bilineata, in vivo and in vitro. In: Kuroda Y., Kurstak E., Maramorosch K. (eds). Invertebrate
and fish tissue culture. Proceedings of the 7th international conference on invertebrate and fish tissue culture,
Japan, 1987. Berlin, Heidelberg, Springer-Verlag, 247-250.
Yoshino T.P., Brown M., Wu X.-J., Jackson C.J., Ocadiz-Ruiz R., Chalmers I.W. et al. 2014. Excreted/secreted
Schistosoma mansoni venom allergen-like 9 (SmVAL9) modulates host extracellular matrix remodelling
gene expression. International Journal of Parasitology 44: 551-563.
Yoshino T.P., Dinguirard N., Kunert J., Hokke C.H. 2008. Molecular and functional characterization of a tandem-
repeat galectin from the freshwater snail Biomphalaria glabrata, intermediate host of the human blood
fluke Schistosoma mansoni. Gene 411: 46-58.
Yoshino T.P., Granath W.O. 1983. Identification of antigenically distinct hemocyte subpopulations in Biomphalaria
glabrata (Gastropoda) using monoclonal antibobies to surface membrane markers. Cell Tissue Research
232: 553-564.
Yoshino T.P., Granath W.O. 1985. Surface antigens of Biomphalaria glabrata (Gastropoda) hemocytes: functional
heterogeneity in cell subpopulations recognized by a monoclonal antibody. Journal of Invertebrate Pathol-
ogy 45: 174-186.
Yoshino T.P., Lodes M.J., Rege A.A., Chappell C.L. 1993. Proteinase activity in miracidia, transformation excretory-
secretory products, and primary sporocysts of Schistosoma mansoni. Journal of Parasitology 79 (1): 23-31.
Yoshino T.P., Wu X.-J., Gonzalez L.A., Hokke C.H. 2013. Circulating Biomphalaria glabrata hemocyte sub-
populations possess shared schistosome glycans and receptors capable of binding larval glycoconjugates.
Experimental Parasitology 133 (1): 28-36.
Zhang S.-M., Adema C.M., Kepler T.B., Loker E.S. 2004. Diversification of Ig superfamily genes in an inverte-
brate. Science 305: 251-254.
Zhang S.-M., Loker E.S. 2004. Representation of an immune responsive gene family encoding fibrinogen-related
proteins in the freshwater mollusk Biomphalaria glabrata, an intermediate host for Schistosoma mansoni.
Gene 341: 255-266.
400
Zhang S.-M., Zeng Y., Loker E.S. 2008. Expression profiling and binding properties of fibrinogen-related proteins
(FREPs), plasma proteins from the schistosome snail host Biomphalaria glabrata. Innate Immunity 14 (3):
175-189.
Zhang S.-M., Loker E.S., Sullivan T.J. 2016. Pathogen-associated molecular patterns activate expression of genes
involved in cell proliferation, immunity and detoxification in the amebocyte-producing organ of the snail
Biomphalaria glabrata. Developmental and Comparative Immunology 56: 25-36.
DEFENSE REACTIONS OF PULMONATE MOLLUSCS
DURING PARASITIC INVASION
© G. L. Ataev, E. E. Prokhorova, A. S. Tokmakova
Keywords: pulmonate molluscs, cellular immunity, humoral immunity, hemocytes, he-
matopoiesis
Summary
Defense reactions of pulmonate molluscs have been actively studied in the last decades, which
resulted in the accumulation of abundant data on various aspects of their immune response both at the
cellular and the humoral level. Several reviews analyzing this material have recently been published
(Adema, Loker, 2015; Pila et al., 2016a; Melillo et al., 2018; Li et al., 2020). However, the last reviews
on this subject in Russian were published more than 15 years ago (Ataev, Polevshchikov, 2004; Ataev
et al., 2005a, b; Galaktionov, 2005). This review aims to generalize modern ideas about the immune
response of pulmonate molluscs and to outline the main problems in this area. It considers defense
reactions of the molluscs to various immunization factors, with the focus on the response to trematode
invasion. This is due not only to the importance of pulmonates as intermediate hosts of trematodes
but also but the possible involvement of these parasites in the development of molluscan immunity.
401