ПАРАЗИТОЛОГИЯ, 2021, том 55, № 1, с. 63-72.
УДК 595.772
К ОСОБЕННОСТЯМ РАЗВИТИЯ КУКОЛОЧНОЙ ФАЗЫ
СЛЕПНЕЙ (DIPTERA, TABANIDAE) СЕВЕРО-ЗАПАДА РОССИИ
2020 г. В. В. Агасой*
Псковский государственный университет,
пл. Ленина, д. 2, Псков, 180000 Россия
*e-mail: agasoi_87@mail.ru
Поступила в редакцию 28.08.2020 г.
После доработки 23.11.2020 г.
Принята к печати 27.11.2020 г.
Экспериментально изучены особенности развития куколочной фазы слепней на примере
табанид Псковской области. Исследована зависимость продолжительности фазы куколки от
температуры. Установлено, что в стабильных лабораторных условиях продолжительность раз-
вития куколок одного и того же вида, полученных из личинок, собранных в год проведения
наблюдений, характеризуется значительными колебаниями. Для куколок, полученных из личи-
нок, зимовавших в лабораторных условиях, отмечен минимальный разброс сроков развития.
Обсуждаются причины этих различий.
Ключевые слова: Tabanidae, слепни, продолжительность фазы развития, личинки, куколки,
местообитание
DOI: 10.31857/S0031184721010051
Слепни (Tabanidae) относятся к кровососущим двукрылым насекомым. Большая
часть жизненного цикла слепней приходится на преимагинальные фазы (яйцо, ли-
чинка и куколка). При этом длительность этих фаз у разных видов различна и может
существенно колебаться. Один из ведущих факторов, определяющих эти различия -
температура (Cameron, 1926; Segal, 1936a; b; Скуфьин, 1973; Лутта, 1970; Павлова,
1974; Лутта, Быкова, 1982; Атнагулова, 2008). На северо-западе России исследования,
посвящённые изучению продолжительности преимагинальных фаз слепней, проводи-
лись Лутта (1970). Показано, что в лабораторных условиях полное развитие куколки
вида Chrysops caecutiens caecutiens (L., 1758) занимает от 8 до 20 дней, Hybomitra
montana montana (Meigen, 1820) - от 8 до 21 дня и Haematopota pluvialis pluvialis
(L., 1758) - от 13 до 24 дней.
Темпы развития куколочной фазы определяют сроки и интенсивность лёта имаго,
что в свою очередь оказывает влияние на жизненный цикл слепней в целом. Поэтому
целью настоящего исследования стало изучение влияния температуры на продолжи-
тельность куколочной фазы некоторых видов слепней Псковской области.
63
Материал и методика
Материалом для исследования послужили куколки 13 видов слепней: Atylotus fulvus fulvus
(Meigen, 1820), Chrysops c. caecutiens (L., 1758), Ch. viduatus (Fabricius, 1794), Hybomitra bi-
maculata (Macquart, 1826), H. ciureai (Seguy, 1937), H. distinguenda distinguenda (Verrall, 1909),
H. lundbecki lundbecki (Lyneborg, 1960), H. lurida (Fallen, 1817), H. muehlfeldi (Brauer, 1880),
H. nitidifrons confiformis (Szilady, 1914), Tabanus bovinus (L., 1758), T. cordiger (Meigen, 1820)
и T. maculicornis (Zetterstedt, 1842).
Для получения куколок проводили сбор личинок слепней на специально выбранном мо-
дельном участке, расположенном в окрестностях д. Молоди (58.022777-28.705967) Струго-
Красненского района Псковской области. Здесь было выделено 4 типа личиночных стаций
(термин предложен Лутта, 1970), которые относятся к наиболее типичным местам обитания
преимагинальных фаз развития слепней: берег стоячего водоема эвтрофного типа (далее стация
1), заболоченные участки влажно-разнотравного луга (далее стация 2), заброшенная мелиора-
тивная канава (далее стация 3) и берег р. Псковы (далее стация 4) (Рис. 1).
Стация 1 расположена в 1 км от деревни и находится в мелколиственном лесу (Рис. 1А).
В лесном массиве преобладают береза повислая и осина. Под ними встречается крушина ломкая,
ольха серая, лещина обыкновенная. С юго-западной стороны водоема по берегу образовались
заросли ольхи серой и ивы ломкой. Мелколиственный лес относится к стации полузакрытого
типа. Берег водоема пологий с богатой прибрежной растительностью, в которой преобладают
осоки, злаки, рогоз, гипновые мхи, и с многочисленной фауной беспозвоночных (олигохет,
моллюсков и т. д.). Значение водородного показателя (pH), в зоне ниже 10 см от уреза воды,
находилось в пределах от 6.5 до 7.3, а в зоне выше 10 см от уреза воды - 6.5-6.9. Температура
поверхностных слоёв и моховой массы проб в мае составила 14-16 °C, в раннелетний период -
17-19 °C. Ранее данный водоём использовали как место водопоя крупного рогатого скота.
Здесь обнаружены личинки Atylotus f. fulvus, Chrysops viduatus, Hybomitra bimaculata, H. ciureai,
H. l. lundbecki, H. lurida, H. muehlfeldi, H. nitidifrons c., Tabanus bovinus и T. maculicornis. Из этих
личинок в лабораторных условиях было получено куколок: A. f. fulvus - 3 экз., Ch. viduatus -
2 экз., H. bimaculata - 32 экз., H. ciureai - 11 экз., H. l. lundbecki - 16 экз., H. lurida - 3 экз.,
H. muehlfeldi - 41 экз., H. nitidifrons c. - 2 экз., T. bovinus - 1 экз. и T. maculicornis - 43 экз.
Стация 2 расположена на проточно-увлажненных почвах и представлена разнотравно-
злаковыми ассоциациями растений (Рис. 1Б). Луг принадлежит к стации открытого типа. На
нём в изобилии развивается луговик дернистый, бодяк разнолистный, колокольчик раскиди-
стый, лабазник вязолистный, лютик едкий, щавель кислый, камыш лесной, герань луговая.
В понижениях луга расположены заболоченные участки, которые покрыты гипновыми мхами и
окружены кустарниками ивы ломкой. Значение pH поверхностного слоя заболоченных участков
луга в пределах от 4.0 до 4.5. Температура поверхностных слоёв и моховой массы проб в мае
составляла 16-18 °C, а в раннелетний период - 19-21 °C. Здесь были собраны личинки слепней
следующих видов: Chrysops viduatus, Hybomitra bimaculata, H. d. distinguenda, H. l. lundbecki,
H. muehlfeldi, H. nitidifrons c., Tabanus bovinus и T. maculicornis. Из этих личинок в лабора-
торных условиях было получено куколок: Ch. viduatus - 2 экз., Hybomitra bimaculata - 5 экз.,
H. d. distinguenda - 1 экз., H. l. lundbecki - 5 экз., H. muehlfeldi - 3 экз., H. nitidifrons c. - 1 экз.,
Tabanus bovinus - 2 экз. и T. maculicornis - 2 экз.
Стация 3 является непроточным эвтрофным водоёмом (Рис. 1В). Рядом с ней расположен
торфяник. С восточной стороны данная канава имеет крутой склон, на котором произрастают
древесные породы - береза повислая и осина, а также многочисленные кустарниковые породы -
ольха серая, лещина обыкновенная. С западной стороны канава отграничена от суходольного
луга полосой из кустарниковых пород. Данный участок является стацией закрытого типа. Бе-
рега и дно канавы покрыты большим количеством растительных остатков (опавшими листьями
и ветками кустарников). Значение pH поверхностного слоя грунта мелиоративной канавы
в пределах от 7.2 до 7.5. Температура поверхностных слоёв грунта в мае составляла 10-12 ºC,
а в раннелетний период - 14-16 °C. Обнаруженные в этой стации личинки относятся к видам
64
Chrysops viduatus, Hybomitra bimaculata, H. ciureai, H. d. distinguenda, H. l. lundbecki и Tabanus
maculicornis. Из этих личинок в лабораторных условиях было получено куколок: Ch. viduatus -
2 экз., H. bimaculata - 3 экз., H. ciureai - 1 экз., H. d. distinguenda - 16 экз., H. l. lundbecki -
1 экз. и Tabanus maculicornis - 1 экз.
Стация 4, в месте сбора личинок, представлена песчаным слабо заиленным дном (Рис. 1Г).
На этом участке река изгибается, имеет небольшую глубину и слабое течение из-за наличия
запруды. В местах взятия проб температура поверхностных слоёв грунта в мае составляла
10-12 °C и значение водородного показателя - 6.5. В данной стации отмечены личинки, при-
надлежащие к 3 видам слепней - Chrysops c. caecutiens, Hybomitra muehlfeldi и Tabanus cordiger.
Из этих личинок в лабораторных условиях было получено куколок: Chrysops c. caecutiens -
146 экз. и Tabanus cordiger - 3 экз.
Рисунок 1. Места сбора личинок слепней в окрестностях д. Молоди Струго-Красненского
района Псковской области. А - стоячий водоем эвтрофного типа, Б - влажно-разнотравный
луг, В - заброшенная мелиоративная канава, Г - левый берег р. Пскова.
Figure 1. Collecting sites of horsefly larvae in environs of Molody Village, Strugo-Krasnensky
district, Pskov Province. A - stagnant eutrophic reservoir, B - wet-grass meadow, C - abandoned
reclamation ditch, D - the left bank of the Pskov River.
65
Сбор материала проводили на протяжении 9 лет (2011-2013 и 2015-2020 г.г.). При этом
использовали методику, предложенную Скуфьиным (1973). В выбранных стациях материал со-
бирали: в 2011 г. во второй и третьей декадах июня, в течение всего июля, во второй и в третьей
декадах августа; в 2012 г. в третьей декаде июня, во второй декаде июля и в первой декадах
августа; в 2013 г. в первой декаде июня; с 2015 по 2020 г. в первой и третьей декадах мая.
Поскольку личинки в мае во всех местах сбора располагались на глубине 5-8 см, при их
поиске снимали поверхностный слой субстрата толщиной не более 10 см. Отбор почвы, грун-
та, моховой или торфянистой массы проводили металлической лопатой, совком или граблями.
Собранный мох раскладывали в сухом месте на клеенке и небольшими порциями тщательно
перебирали руками. Тяжелые глинистые почвы, растительные остатки (опавшие листья и пере-
гной), песчаные и илистые грунты промывали через два металлических сита, поставленных друг
на друга. Размер ячеек верхнего сита 10×10 мм, нижнего сита - 1.7×1.7 мм.
Инкубацию исследуемых личинок и куколок проводили в стабильных лабораторных услови-
ях при температуре 19-21 °C (2011-2013 г., 2015-2017 г.) и 16-18 °C (2018-2020 г.). При этом
личинок, предназначенных для получения куколок, поодиночке размещали в пластмассовые
стаканы объёмом 100-120 мл, на дно которых укладывали субстрат с места сбора и наливали
немного воды. Отверстие стакана затягивали бязью и закрепляли резинкой. Хищных личинок
1 раз в 5 дней подкармливали личинками комара-звонца или нарезанными кусочками дожде-
вого червя. Субстрат заменяли на свежий через 10-12 дней. После вылета взрослой особи
личиночную шкурку фиксировали в 70 % спирте, экзувий куколки сохраняли и подкалывали
под выведенный экземпляр имаго. Вылетевшие имаго использовались для определения видовой
принадлежности личинок и куколок.
Всего было собрано 784 личинки, из которых в лабораторных условиях удалось вывести
447 имаго, остальные личинки и куколки погибли (337). Среди собранного материала на стацию 1
пришлось 492 личинки, стацию 2 - 81 личинка, стацию 3 - 41 личинка, стацию 4 - 170 личинок.
В 2011-2013 г. сбор личинок проводили в летние месяцы, поэтому при содержании в ста-
бильных лабораторных условиях при температуре 19-21 °C и естественном освещении (на
подоконнике) они не приступали к окукливанию до конца осени. Они лишь успевали пройти
от 1 до 3 линек до наступления зимнего периода. Затем их переводили на перезимовку. Для
этого личинок в период с 1 декабря по 1 марта помещали в холодильную камеру в темноте при
температуре 4 °C. Во время зимовки личинок не кормили, а только контролировали влажность
субстрата. В марте личинок извлекали из холодильной камеры и вновь помещали в лаборатории
на подоконник при температуре 19-21 °C. Этих личинок периодически подкармливали, меняли
субстрат и контролировали его влажность. Всего зимовавших личинок было 279.
Личинки, собранные в 2015-2020 гг., в стабильных лабораторных условиях успевали пройти
цикл развития до вылета имаго. Таких личинок было 505. Их содержали в лаборатории на подо-
коннике при температуре 19-21 °C (2015-2017 гг. сбора) и 16-18 °C (2018-2020 гг. сбора). Все
эти личинки были собраны на предкуколочной стадии, т.к. после их окукливания в субстрате
обнаруживалась только личиночная шкурка с ротовым аппаратом.
Согласно литературным данным (Лутта, 1970; Павлова, 1974) продолжительность развития
личиночной фазы определяется в первую очередь температурой, которая также может оказы-
вать существенное влияние на длительность куколочной фазы. Поэтомудля выявления свя-
зи температуры окружающей среды с темпами развития куколочной фазы были определены
среднедекадные температуры воздуха в период сбора личинок и в декаду, предшествующую
сбору. Среднедекадную температуру рассчитывали по данным метеостанции Струги-Красные,
на которой замеры температуры проводились четыре раза в сутки.
Во время сбора материала измерения температуры и pH субстрата производили при помощи
анализатора почв «Soil Survey Instrument, model: KC-300».
66
Результаты
Наблюдения за продолжительностью куколочной фазы исследованных видов по-
казали, что у разных видов ее длительность в одинаковых условиях различна.
Личинки Hybomitra l. lundbecki, H. muehlfeldi, H. ciureai, собранные в первой декаде
мая 2015-2020 г., в лабораторных условиях приступали к окукливанию в период со
второй декады мая по первую декаду июня. При этом продолжительность собственно
куколочной фазы у личинок H. l. lundbecki составила 3-17 дней, у H. muehlfeldi -
4-19 дней и у H. ciureai - 6-14 дней. Личинки H. muehlfeldi и H. ciureai, собранные
в третью декаду мая, окукливались с конца третьей декады мая по середину первой
декады июня. Продолжительность фазы куколки для этих личинок составила 8-10 дней.
Личинки H. bimaculata, собранные в первую декаду 2016 и 2017 г., окукливались во
вторую декаду мая и находились в этой фазе от 4 до 10 дней. Личинки этого же вида,
собранные в первой декаде мая 2015 г., в 2018-2020 гг., окукливались в период со
второй декады мая по начало первой декады июня. Продолжительность фазы куколки
составила 12-20 дней. Личинки H. lurida, собранные в первой декаде мая 2017 и 2019 г.,
приступали к окукливанию в третью декаду мая, а длительность их куколочной фазы
составила 12-14 дней.
Личинки Tabanus cordiger в период наблюдений встретились всего один раз в первой
декаде мая 2019 г. в количестве двух экземпляров. Одна из этих личинок окуклилась
в третью декаду мая, другая - вторую декаду июня. Их куколочная фаза длилась 15 и
23 дня соответственно. Личинки T. maculicornis, собранные в первую декаду мая 2015 г.
и в 2017-2020 гг., окукливались во вторую и третью декады мая, а фаза куколки со-
ставила 4-18 дней.
В первой декаде мая 2013, 2017 и 2019 г. в стации 1 в слое мха на древесных
остатках были обнаружены личинки Atylotus f. fulvus приступившие к окукливанию
в третьей декаде мая. Их куколочная фаза продолжалась от 14 до 20 дней.
Личинки Chrysops c. caecutiens, собранные в первой декаде мая и июня 2017 г.,
окукливались в период с третьей декады мая по вторую декаду июня, а фаза их куколки
составляла 5-10 дней. Личинки Ch. viduatus, собранные в первой и третьей декадах
мая 2018 и 2020 г., приступали к окукливанию в третью декаду мая и первую декаду
июня соответственно. Фаза куколки этого вида составила 6-8 дней.
Наблюдения показали, что с увеличением температуры у всех исследованных
видов средняя продолжительность куколочной фазы сокращается (Табл. 1). Так,
у H. bimaculata, содержащейся в лаборатории при температуре 16-18 °C, средняя про-
должительность фазы куколки составила от 8.8 до 11.3 дня, при температуре 19-21 °C -
от 6.3 до 10.6 дня. Куколочная фаза вида H. ciureai при температуре 16-18°C в среднем
развивалась от 9.8 до 12.8 дня, при температуре 19-21 °C - от 7.8 до 11.8 дня.
Вместе с тем для куколок ряда видов отмечены существенные различия в средних
темпах их развития в разные годы. Для куколок H. l. lundbecki в 2015 г. в одних и тех
же лабораторных условиях средняя продолжительность фазы оказалась существенно
больше (13.6 дня), чем в 2016 и 2017 г. (от 5.0 до 8.6 дня соответственно). Соответ-
ственно в 2019 г. этот показатель составил 13.3 дня, в 2018 г. - 8.7 дня и в 2020 г.-
9.2 дня. Для H. muehlfeldi средняя продолжительность куколочной фазы в 2015 г.
составила 12.7 дня, в 2016 г. - 7.7 дня, в 2017 г. - 6.4 дня. Соответственно в 2019 г. -
11.8 дня, в 2018 г. - 6.2 дня и в 2020 г. - 7.4 дня. Куколки Tabanus maculicornis в 2015 г.
в лабораторных условиях развивались 14.4 дня, в 2017 г. - 11.2 дня. Соответственно
в 2019 г. - 14.7 дня, в 2018 г. - 9.1 дня и в 2020 г. - 12.2 дня (Табл. 1).
67
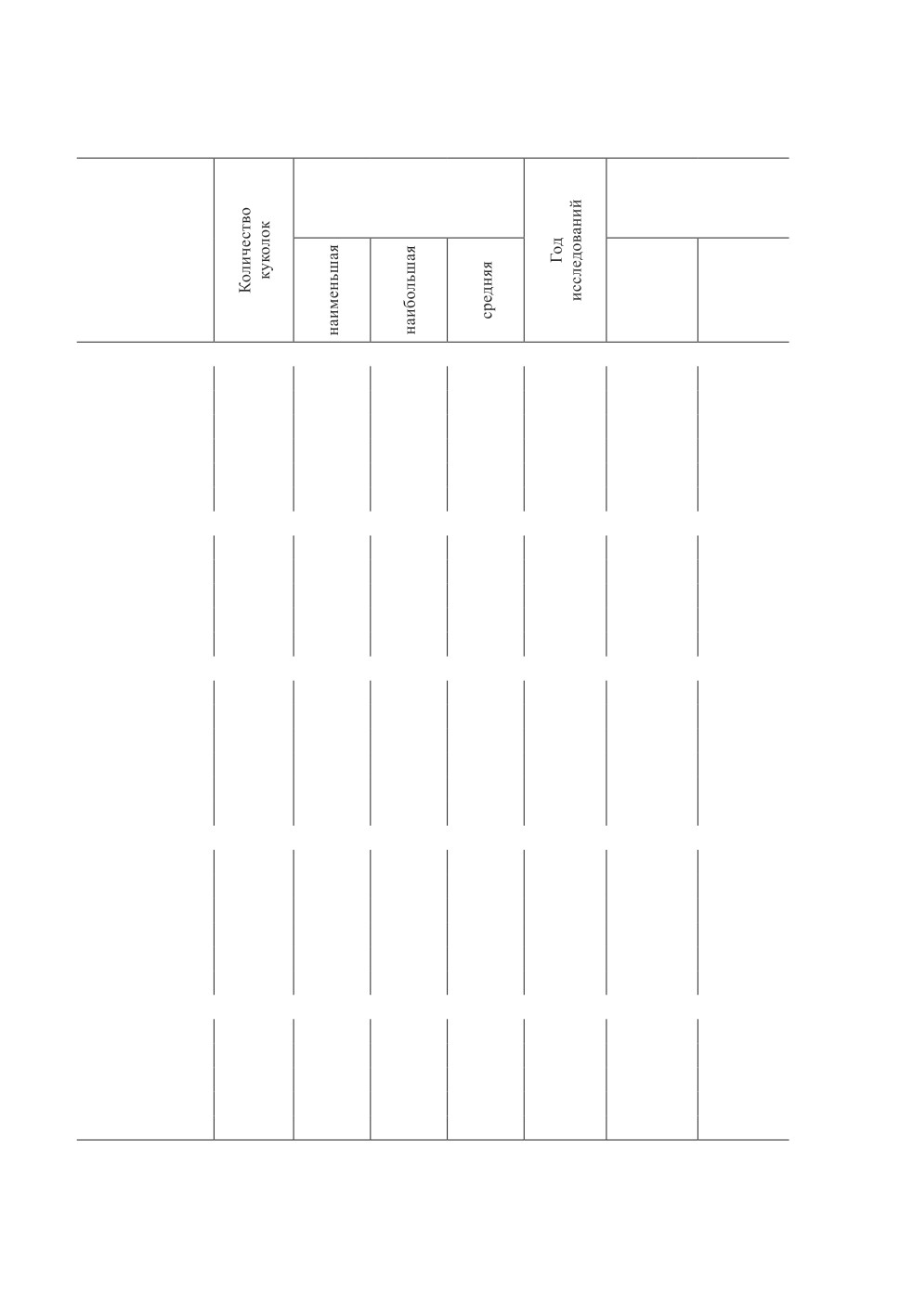
Таблица 1. Зависимость продолжительности куколочной фазы слепней
от температурных условий
Table 1. Dependence of the duration of the pupal phase of horseflies on temperature conditions
Продолжительность фазы
Среднедекадная
куколки
температура в районе
(в днях)
сбора материала
Температура
в лабораторных
условиях
III декада
I декада
апреля
мая
Hybomitra bimaculata
16-18 °C
5
8
12
9.4
2020
5.5
11.3
15
5
14
11.3
2019
12.4
7.4
12
3
18
8.8
2018
8.5
13.3
19-21 °C
5
7
8
7.4
2017
4
7.1
9
6
9
6.3
2016
6.5
14.1
7
4
14
10.6
2015
9.3
10.6
Hybomitra ciureai
16-18 °C
5
8
14
10.4
2020
5.5
11.3
5
12
13
12.8
2019
12.4
7.4
5
7
14
9.8
2018
8.5
13.3
19-21 °C
5
6
11
7.8
2016
6.5
14.1
5
11
12
11.8
2015
9.3
10.6
Hybomitra l. lundbecki
16-18 °C
5
7
11
9.2
2020
5.45
11.3
5
12
14
13.3
2019
12.4
7.4
5
6
11
8.7
2018
8.5
13.3
19-21 °C
5
7
15
8.6
2017
4
7.1
5
3
7
5
2016
6.5
14.1
5
11
16
13.6
2015
9.3
10.6
Hybomitra muehlfeldi
16-18 °C
5
4
10
7.4
2020
5.5
11.3
6
11
13
11.8
2019
12.4
7.4
6
3
9
6.2
2018
8.5
13.3
19-21 °C
8
5
8
6.4
2017
4
7.1
6
3
16
7.7
2016
6.5
14.1
17
9
16
12.7
2015
9.3
10.6
Tabanus maculicornis
16-18 °C
5
12
13
12.2
2020
5.5
11.3
6
11
18
14.7
2019
12.4
7.4
31
3
13
9.1
2018
8.5
13.3
19-21 °C
5
4
17
11.2
2017
4
7.1
5
14
16
14.4
2015
9.3
10.6
При м еч а н ия. Для повышения точности результатов приведены сведения только для видов
слепней, количество куколок которых было не менее 5. Куколки остальных видов были единичны.
68
Из 279 личинок, оставленных на перезимовку, выжило лишь 50 экз. (18 %), из ко-
торых удалось вывести 30 имаго, принадлежащих к 6 видам: Atylotus f. fulvus (1экз.),
Hybomitra bimaculata (4 экз.), H. d. distinguenda (18 экз.), H. l. lundbecki (4 экз.),
H. nitidifrons c. (1 экз.) и Tabanus bovinus (2 экз.). При этом личинки H. l. lundbecki,
H. bimaculata и H. nitidifrons c. окукливались в конце второй декады и в третьей де-
каде марта, их куколочная фаза длилась 8-10 дней, а взрослые особи вылуплялись
в третьей декаде марта или первой декаде апреля. Представители H. d. distinguenda
приступали к окукливанию в период с третьей декады марта по первую декаду апреля,
а фаза куколки составила 9-11 дней. Личинка A. f. fulvus окуклилась в третьей декаде
марта и вылупилась во взрослую особь во второй декаде апреля. Её куколочная фаза
продолжалась 20 дней. Личинки T. bovinus окукливались во второй декаде апреля или
во второй декаде мая и продолжительность фазы их куколки составила 6 и 19 дней.
Обсуждение
Эксперименты показали, что длительность куколочной фазы у одного и того же вида
при содержании в стабильных лабораторных условиях характеризуется значительными
колебаниями. Вероятно, личинки, собранные для выведения куколок, в момент сбора
пребывали в разной степени зрелости предкуколочной стадии. Поэтому в стабильных
лабораторных условиях при температурах, оптимальных для перехода к окукливанию
(11-29 °C; Лутта, 1970), окукливание начиналось через разные промежутки времени.
При этом чем дольше личинка оставалась в предкуколочной стадии, тем короче был
срок куколочной фазы и наоборот. Суммарная длительность развития от момента, когда
личинку помещали в стабильные лабораторные условия, до вылета имаго для одного
и того же вида была практически одинакова для всех особей (Табл. 2).
Проведенные эксперименты позволили отметить следующую закономерность -
в целом, для исследованных видов при повышении температуры содержания с 16-18 °C
(2018 и 2020 г.г.) до 19-21 °C (2016 и 2017 г.г.) средняя продолжительность фазы
куколки сокращается (Табл. 1). Подобная закономерность сокращения сроков раз-
вития при повышении температуры характерна для всех пойкилотермных животных,
и в этом плане исследованные нами виды подчиняются общему правилу.
Наблюдения показали, что перепады температур, предшествующих периоду сбора
личинок, и в период их сбора могут оказывать влияние на продолжительность куколоч-
ной фазы в стабильных лабораторных условиях. В частности, в 2015 г. среднедекадные
температуры третьей декады апреля (9.3 °C) и первой декады мая (10.6 °C) различа-
лись незначительно. При этом сроки развития куколок для разных видов составляли
от 10.6 до 14.4 дня (Табл. 1). Вместе с тем, в 2019 г. среднедекадная температура
третьей декады апреля составляла 12.4 °C, в первой декаде мая - 7.4 °C, а сроки раз-
вития куколки у тех же видов либо незначительно увеличивались, либо оставались
на том же уровне, что и в 2015 г. В 2016-2018 гг. и 2020 г., когда среднедекадная
температура, предшествующая периоду сбора личинок, была ниже, чем температура
в период сбора (колебалась от 4 до 6.5 °C в третьей декаде апреля и от 7.1 до 14.1 °C
в первой декаде мая), наблюдалась обратная картина - продолжительность развития
куколок уменьшалась (Табл. 1).
Из приведенных выше примеров можно сделать вывод о том, что смена природных
температур в сторону повышения от нижнего оптимума развития личинок (5-9 °C;
Павлова, 1974) к оптимальным значениям (16-23 °C; Лутта, 1970) в стабильных ла-
бораторных условиях приводит к сокращению сроков развития куколок. Подобные
69
сведения об ускоряющем влиянии колебаний температур в сторону повышения, по
сравнению с темпами развития при константной температуре, имеются в литературе
для личинок и куколок не только Tabanidae, но и других Diptera (Ludwig, Cable, 1934;
Huffaker, 1944; Лутта, 1970; Павлова, 1974; Ratte, 1985; Tun-Lin et al., 2000; Eisen
et al., 2014; Colinet, 2015; Majo, 2019).
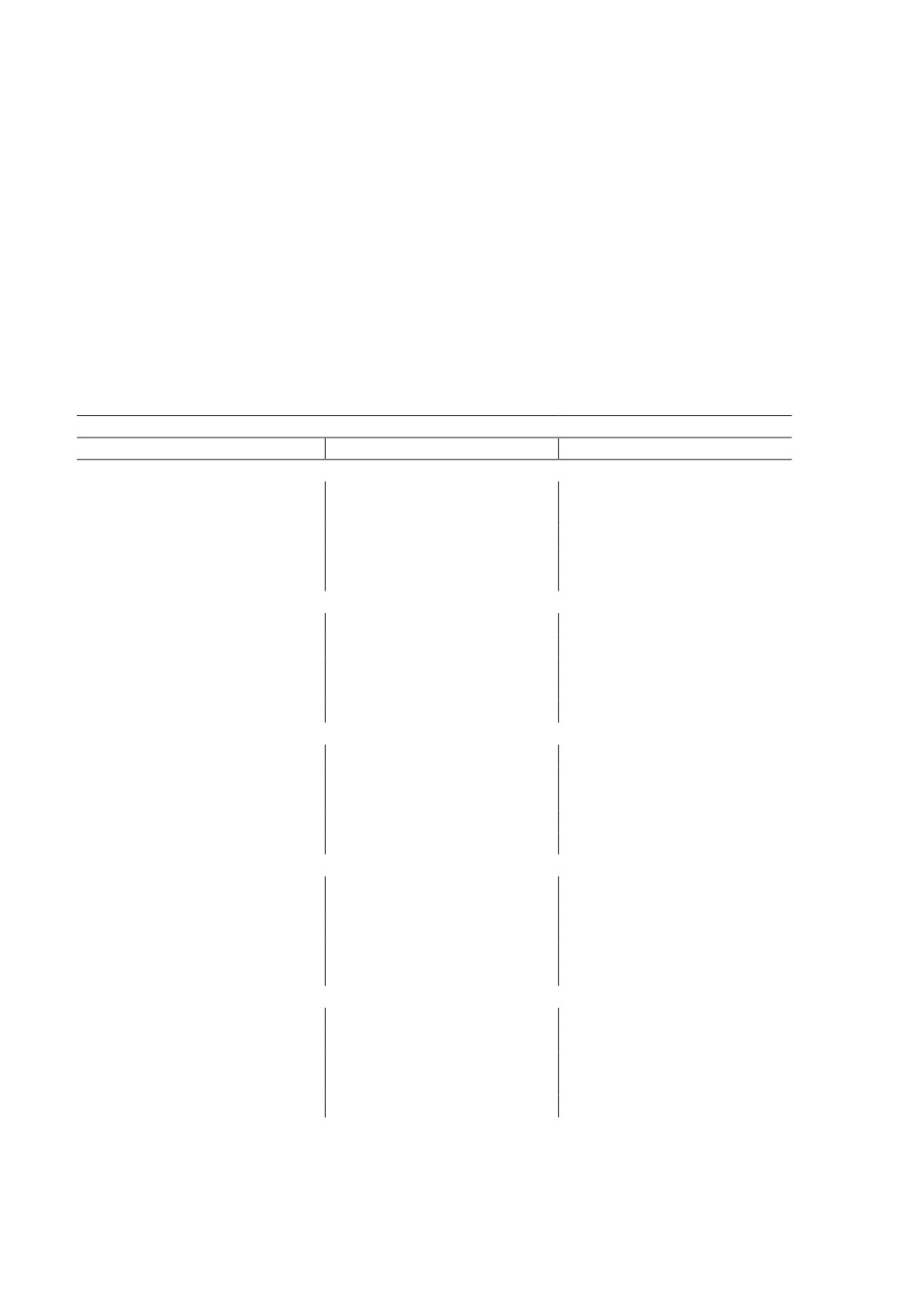
Как отмечалось выше, результаты наблюдений показали, что разброс сроков разви-
тия куколок зимовавших личинок был минимален (2 дня), по сравнению с куколками,
полученными из личинок-сеголеток (разброс от 1 до 15 дней) (Табл. 2).
Таблица 2. Продолжительность личиночной и куколочной фаз до вылета имаго
в лабораторных условиях
Table 2. Duration of larval and pupal phases before the emergence of adults
in laboratory conditions
Продолжительность личиночной и куколочной фаз (дней)
личинка
куколка
суммарная
Hybomitra bimaculata
18
3
21
17
4
21
12
9
21
8
12
20
2
18
20
Hybomitra l. lundbecki
21
3
24
16
7
23
6
12
18
8
14
22
5
16
21
Hybomitra muehlfeldi
19
3
22
18
5
23
9
11
20
8
13
21
6
16
22
Hybomitra ciureai
14
6
20
16
8
20
9
11
20
9
12
21
8
14
22
Tabanus maculicornis
18
3
21
19
4
23
8
13
21
6
16
22
5
18
23
70
Можно предположить, что указанные различия связаны с тем, что личинки-сеголетки
помещались в стабильные лабораторные условия в разной степени зрелости предку-
колочной стадии. Личинки, зимовавшие в экспериментальных условиях, длительное
время находились при стабильных температурах, что приводило к синхронизации их
развития. Поэтому по выходе из зимовки они оказывались в одинаковой степени зре-
лости предкуколочной стадии, что и определяло выравненность продолжительности
самой куколочной фазы.
Список литературы
Атнагулова Л.З. 2008. Слепни (Diptera, Tabanidae) г. Тобольска и Тобольского района. Тобольск, ТГПИ им.
Д. И. Менделеева, 135 с. [Atnagulova L.Z. 2008. Horseflies (Diptera, Tabanidae) of Tobolsk and Tobolsk
region. Tobolsk, D.I. Mendeleev Tobolsk State Pedagogical University, 135 p. (in Russian)]
Лутта А.С. 1970. Слепни Карелии. Ленинград, Наука, Ленинградское отделение, 304 с. [Lutta A.S. 1970.
Horseflies of Karelia (Diptera, Tabanidae). Leningrad, Nauka, 304 p. (in Russian)]
Лутта А.С., Быкова Х.И. 1982. Слепни (Сем. Tabanidae) Европейского Севера. Ленинград, Наука, 184 с.
[Lutta A.S., Bykova Kh.I. 1982. Horseflies (Diptera, Tabanidae) of the North of the European USSR.
Leningrad, Nauka, 184 p. (in Russian)]
Павлова Р.П. 1974. Влияние температуры окружающей среды на продолжительность фазы куколки слепней.
Паразитология 8 (3): 243-248. [Pavlova R.P. 1974. On the effect of environmental temperature on the
parazitologiya/content/1974/prz_1974_3_12_Pavlova.pdf
Скуфьин К.В. 1973. Методы сбора и изучения слепней. Л., Наука, 104 с. [Skuf’in K. V. 1973. Methods of
collecting and studying horseflies, Leningrad, Nauka, 104 p.]
Cameron A.E. 1926. Bionomiсs of the Tabanidae (Diptera) of Canadian prairie. Bulletin of Entomological Research
Colinet H., Sinclair B.J., Vernon P., Renault D., 2015. Insects in fluctuating thermal environments. Annual Review
Eisen L., Monaghan A.J., Lozano-Fuentes S., Steinhoff D.F., Hayden M.H., Bieringer P.E. 2014. The impact of
temperature on the bionomics of Aedes (Stegomyia) aegypti, with special reference to the cool geographic
Huffaker C.B. 1944. The temperature relation of the immature stages of the malarial mosquito, Anopheles quadri-
maculatus Say, with a comparison of the developmental power of constant and variable temperatures in insect
Ludwig D., Cable R. 1934. The efect of alternating temperatures on the pupal development of Drosophila me-
physzool.6.4.30151203
Majo M.S. De, Zanotti G., Campos R.E., Fischer S., 2019. Effects of constant and fluctuating low temperatures
on the development of Aedes aegypti (Diptera: Culicidae) from a temperate region. Journal of Medical
Ratte H.T. 1985. Temperature and insect development. In: Hoffmann K.H. (ed.). Environmental physiology and
Segal B. 1936a. Synopsis of the Tabanidae of New York, their biology and taxonomy. 1. The genus Chrysops
Segal B. 1936b. Synopsis of the Tabanidae of New York, their biology and taxonomy. (Concluded). Journal of the
Tun-Lin W., Burkot T.R., Kay B.H., 2000. Effects of temperature and larval diet on development rates and survival
of the dengue vector Aedes aegypti in north Queensland, Australia. Medical and Veterinary Entomology 14
71
TO THE PECULIARITIES OF THE DEVELOPMENT
OF HORSEFLY PUPAL PHASE (DIPTERA, TABANIDAE) IN NORTHWEST RUSSIA
V. V. Agasoi
Keywords: Tabanidae, horseflies, developmental phase duration, larvae, pupae, habitat
SUMMARY
Peculiarities of the pupal development of horseflies have been experimentally studied in Pskov
Province with an example of tabanids. The temperature dependence of the pupal phase duration was
investigated. Under stable laboratory conditions, the duration of pupal development of the same species
obtained from larvae collected in the year of the investigation was characterized by strong fluctuations.
Pupae obtained from larvae that had wintered in laboratory, had demonstrated the minimal degree
of fluctuation concerning duration of the development. Reasons of these differences are discussed.
72