ПАРАЗИТОЛОГИЯ, 2021, том 55, № 2, с. 134-173.
УДК 595.77, 576.8
Методы сбора двукрылых насекомых
комплекса гнуса (Diptera: Culicidae, Simuliidae,
Ceratopogonidae, Tabanidae)
© 2021 г. А. В. Халина,*, С. В. Айбулатова,**, А. А. Пржибороа,***
а Зоологический институт РАН,
Университетская наб., 1, Санкт-Петербург, 199034 Россия
*e-mail: hallisimo@yandex.ru
**e-mail: s.v.aibulatov@gmail.com
***e-mail: dipteran@mail.ru
Поступила в редакцию 30.09.2020 г.
После доработки 14.12.2020 г.
Принята к печати 10.03.2021 г.
Рассмотрены методы сбора и фиксации материала для двукрылых насекомых комплекса гнуса:
кровососущих комаров, мошек, мокрецов и слепней (Diptera: Culicidae, Simuliidae, Ceratopogo-
nidae, Tabanidae). Данные методики используются и отчасти разработаны авторами настоящей
статьи для эколого-фаунистических и таксономических исследований (предусматривающих
определение материала). Охарактеризованы методики, применяемые для имаго и преимагиналь-
ных стадий: как общие для всех насекомых комплекса гнуса, так и специфические для каждого
семейства. В частности, описаны методы выведения имаго из личинок и куколок.
Ключевые слова: кровососущие комары, мошки, мокрецы, слепни, методика, сбор, вы-
ведение имаго, фиксация, Diptera, Culicidae, Simuliidae, Ceratopogonidae, Tabanidae
DOI: 10.31857/S0031184721020058
Комплекс гнуса представляет собой сборную группу двукрылых насекомых (Hexa-
poda: Diptera), самки которых питаются кровью позвоночных животных, в т. ч. человека.
Основная часть гнуса на территории России (по количеству видов и по численности
в природе) представлена, как правило, видами из четырех семейств: кровососущие ко-
мары (Culicidae), мошки (Simuliidae), мокрецы (Ceratopogonidae) и слепни (Tabanidae)1.
Будучи докучливыми кровососами, а также переносчиками возбудителей опасных за-
болеваний (например, малярии, лихорадки Западного Нила, филяриоза и онхоцеркоза),
эти насекомые существенно влияют на здоровье, трудовую и рекреационную деятель-
ность человека (см., например, Мончадский, 1952; Becker et al., 2010).
1 В рамках данной статьи мы не рассматриваем москитов (Psychodidae: Phlebotominae), жига-
лок (Muscidae: Stomoxys Geoffroy, 1762), кровососок (Hippoboscidae) и некоторые другие группы
кровососущих двукрылых.
134
В настоящей статье изложен собственный опыт авторов по использованию различ-
ных методик сбора и фиксации кровососущих двукрылых. Разделы по сем. Culicidae
составлены А.В. Халиным и С.В. Айбулатовым, разделы по сем. Simuliidae -
С.В. Айбулатовым, разделы по сем. Ceratopogonidae и Tabanidae - А.А. Пржиборо. Все
описываемые методики использовались нами в течение многих лет и зарекомендовали
себя в качестве наиболее простых и рациональных для целей эколого-фаунистических
и таксономических исследований (включая морфологические, молекулярные и ци-
тогенетические работы). Вместе с тем настоящая статья не содержит обзора всех
методик, используемых при работе с кровососущими двукрылыми. Кроме того, мы не
рассматриваем методы количественного учета кровососов (как имаго, так и личинок),
а также многие специальные методики, применяемые при изучении особенностей
жизненного цикла и экологии двукрылых комплекса гнуса (в т. ч. связанные с пере-
носом возбудителей). В ряде случаев кратко упомянуты (со ссылками на литературные
источники) методики сбора, использование которых целесообразно, несмотря на от-
сутствие личного опыта в их применении.
Литература по методам сбора кровососущих двукрылых очень велика. Опубликован
ряд специальных методических статей и пособий как на русском, так и на иностранных
языках (например, по гнусу в целом: Павловский, 1927; Будаева, Хицова, 2012; Field
sampling methods…, 2018; Eiras et al., 2021; по кровососущим комарам: Service, 1976;
Silver, 2008; Малькова и др., 2013; по мошкам: Рубцов, 1956; Freeden, 1961; Itamies,
Kuusela, 1976; по мокрецам: Гуцевич, 1956; Мирзаева, 1967; Гуцевич, Глухова, 1970;
по слепням: Thompson, 1969; Скуфьин, 1973). Методические разделы различной сте-
пени подробности имеются и в большинстве монографий, посвященных комплексу
гнуса в целом (например, Мончадский, 1952; Расницын, 1974; Laird et al., 1982; Lane,
Crosskey, 1993), а также отдельным семействам, входящим в его состав (например, по
кровососущим комарам: Гуцевич и др., 1970; Becker et al., 2010; по мошкам: Рубцов,
1956а; Crosskey, 1990; Каплич, Скуловец, 2000; Adler et al., 2004; Чубарева, Петрова,
2008; по мокрецам: Campbell, Pelham-Clinton, 1960; Blanton, Wirth, 1979; Глухова, 1989;
Gonzalez de Heredia, Goldarazena Lafuente, 2011; по слепням: Шевченко, 1961; Лутта,
1970; Бошко, 1973; Олсуфьев, 1977; Соболева, 1977; Лутта, Быкова, 1982). Многие ме-
тоды, используемые для комплекса гнуса, упоминаются вместе с другими методиками
в руководствах, посвященным отряду двукрылых (например, Штакельберг, 1969; Нар-
чук, 2003; Stubbs, 2003; Chandler, 2010; Kirk-Spriggs, 2017; Brown, 2021) и насекомым
в целом (например, Oldroyd, 1970; Martin, 1977; Schauff, 2002; Голуб и др., 2012). По-
мимо этого, в литературных источниках имеется информация по специальным методи-
кам, например, для цитогенетических исследований (Чубарева, Петрова, 2008). В связи
с этим исследователи, начинающие работать с кровососущими двукрылыми, зачастую
теряются в разнообразии методик, не имея конкретного руководства к действиям.
Самки большинства видов сем. Culicidae, Simuliidae и Tabanidae фауны России
питаются кровью позвоночных животных. Как правило, представители этих семейств
хорошо отличаются по внешнему виду от других двукрылых (рис. 1). Например, для
кровососущих комаров характерен специализированный ротовой аппарат в форме
длинного хоботка (рис. 1A). Мошки отличаются сильно выпуклой среднеспинкой,
135
а также утолщенными бедрами и голенями всех пар ног (рис. 1Б). Помимо этого, имеет
место половой диморфизм строения глаз: у самцов глаза, как правило, крупные, зани-
мают бóльшую часть головы, у самок глаза небольшие. Слепни похожи на некоторых
короткоусых двукрылых среднего или крупного размера, от которых отличаются коре-
настым телом без крепких щетинок (рис. 1В-1Д). Кроме того, у живых экземпляров
сем. Tabanidae глаза зеленого, красного или коричневого цветов, часто с полосками.
Рисунок 1. Имаго кровососущих двукрылых. А-Д - живые экземпляры (вид спереди, сбоку и
сверху), Е - экземпляр в этаноле (сбоку). А-B, Д, Е - самка, Г - самец.
А - Aedes Meigen, кровососущий комар; Б - Simulium Latreille, мошка; В-Д - слепни (B -
Chrysops Meigen, Г - Haematopota Meigen, Д - Hybomitra Enderlein); E - Culicoides Latreille,
мокрец.
Figure 1. Adults of bloodsucking dipterans. A-Д - living individuals (frontal, lateral and dorsal
views), E - specimen in ethanol (lateral view). А-B, Д, Е - female, Г - male.
А - Aedes Meigen, mosquito; Б - Simulium Latreille, black fly; В-Д - horseflies (B - Chrysops
Meigen, Г - Haematopota Meigen, Д - Hybomitra Enderlein); E - Culicoides Latreille, biting
midge.
136
В отличие от этих трех семейств, большинство видов мокрецов фауны РФ не пита-
ются кровью, и лишь представители трех родов - кровососы млекопитающих. Среди
них: Forcipomyia (Lasiohelea) sibirica Bujanova, 1965 (известен с юга Сибири и из
Предуралья), виды родов Leptoconops Skuse, 1889 (встречаются преимущественно
в пустынях и на юге степной зоны) и Culicoides Latreille, 1809 (широко распространены
от юга тундровой зоны до пустынь). В большинстве регионов России кровососущие
мокрецы представлены только родом Culicoides, однако они не всегда легко различимы
в материалах сборов. Следующий набор признаков помогает опознать виды данного
рода и предварительно отличить их от других мелких двукрылых похожего облика.
Виды рода Culicoides (рис. 1Е) - это мелкие мокрецы (длина тела не превышает 3.5 мм)
с матовой окраской тела (обычно сероватой или желтоватой, но не блестяще-черной);
у самки имеется длинный хоботок, его длина сопоставима с длиной головы; крылья
в коротких волосках, прозрачные или с характерным рисунком из неярких пятен,
с короткими костальной жилкой и радиальными ячейками (заканчиваются примерно
у середины крыла).
Работы по сбору кровососущих двукрылых можно разделить на три основных
типа: сбор самок, нападающих на прокормителя, сбор имаго в иных ситуациях и сбор
преимагинальных стадий2.
Сбор самок на прокормителях - наиболее простой подход, позволяющий получить
массовый материал имаго. Вместе с тем, он помогает охарактеризовать таксономи-
ческий состав комплекса гнуса, нападающего на определенный вид прокормителя, и
выяснить спектр питания конкретных видов двукрылых. При проведении таких сборов
необходимо учитывать фенологическую, погодную и суточную динамику нападения
соответствующих видов, родов и семейств кровососущих двукрылых. Например, сборы
«на себе» позволяют охарактеризовать суточную динамику нападения кровососущих
комаров. У большинства видов фауны России динамика характеризуется двумя пиками:
утренним и вечерним.
Кроме сбора самок при нападении на прокормителей, взрослые кровососущие
двукрылые могут быть эффективно собраны с использованием ряда других методик,
в частности, на дневках и зимовках; эти сборы также могут выполняться для отлова
самцов.
Сбор преимагинальных стадий (личинок и куколок) необходим для установле-
ния биотопов развития конкретных видов кровососущих двукрылых. Как правило,
биотопы развития личинок гораздо более локальны и специфичны по сравнению
с биотопами, в которых встречаются имаго тех же видов. Обследование личиночных
биотопов нередко позволяет собрать материал и по видам, которые редко попадаются
2 В отечественной литературе по кровососущим двукрылым широко используется термин
«фаза» в значении «стадия» (яйцо, личинка, куколка, имаго). При этом термин «стадия» для ли-
чинки используется в значении «возраст»: 1-й, 2-й возраст и т. д., что соответствует промежутку
между линьками (например, Скуфьин, 1973; Глухова, 1989).
137
в сборах на стадии имаго. Кроме того, на основе сбора преимагинальных стадий воз-
можно проводить учеты их численности и решать другие задачи, в первую очередь
экологические. В целом работа по сбору личинок и куколок мокрецов и слепней более
трудоемка по сравнению с отловом имаго, в то время как собирать преимагинальные
стадии кровососущих комаров и мошек значительно проще. Методики, применяемые
для сбора личинок и куколок, специфичны для каждого из четырех семейств, по этой
причине они описаны отдельно. Определения видов кровососущих комаров и мошек
возможны по признакам имаго и личинок последнего возраста (в немногих случаях -
также и куколок), а слепней и мокрецов - главным образом по имаго. Для наиболее
же достоверной видовой диагностики кровососущих комаров и мошек в большинстве
случаев требуются признаки генитального аппарата самцов, но в сборах на прокор-
мителе удается отловить только самок. Поэтому за сбором преимагинальных стадий
мокрецов и слепней, а также куколок кровососущих комаров и мошек, нередко следует
работа по выведению из них имаго в лабораторных условиях. Процедура выведения
может занимать от нескольких дней до нескольких лет (в зависимости от изучаемой
группы). Диагностические признаки преимагинальных стадий многих видов мокрецов
и слепней до сих пор не изучены, также как и биотопы их развития. В связи с этим
выведенный материал может иметь большую ценность: особенно в тех случаях, когда
он собран в малоизученном регионе.
При выборе методик сбора двукрылых необходимо учитывать цель исследования:
приоритетным могут быть получение либо неповрежденного материала (для точного
определения видов, изучения их морфологии и т. д.), либо большого количества эк-
земпляров (в ряде случаев - без возможности точной видовой диагностики). Следует
помнить, что в большинстве случаев видовая диагностика будет наиболее эффективна
при наличии сохранных экземпляров имаго (в том числе и самцов), собранных вскоре
после выхода из куколок или же выведенных в лабораторных условиях.
Как правило, чем разнообразнее методики сбора, тем полнее будет охарактеризован
видовой состав кровососущих двукрылых в исследуемом районе. Поэтому важны сборы
в различных биотопах и ландшафтах, в различную погоду и время суток. Кроме того,
при проведении сборов следует учитывать региональные климатические особенности
и, по возможности, собирать двукрылых в течение всего теплого сезона.
СБОР МАТЕРИАЛА
1. Сбор имаго
1.1. Сбор самок, нападающих на прокормителя
Сбор с человека - наиболее простой и доступный вариант сбора с прокормителя.
Помимо сбора с человека, широко используется также сбор с домашних и диких
теплокровных животных (млекопитающих и птиц, в том числе из гнезд и с птен-
цов). Сбор с животных позволяет существенно расширить спектр видов кровосо-
сов, но он имеет особенности, описание которых выходит за рамки настоящей статьи
(см.: Гуцевич, Глухова, 1970; Скуфьин, 1973; Глухова, 1989).
138
При небольшом количестве нападающих двукрылых их удобнее собирать энтомо-
логической морилкой (рис. 2А), пробиркой или эксгаустером (рис. 2Б). В ходе сбора
следует накрывать питающихся самок энтомологической морилкой или пробиркой
с этиловым спиртом (этанолом).
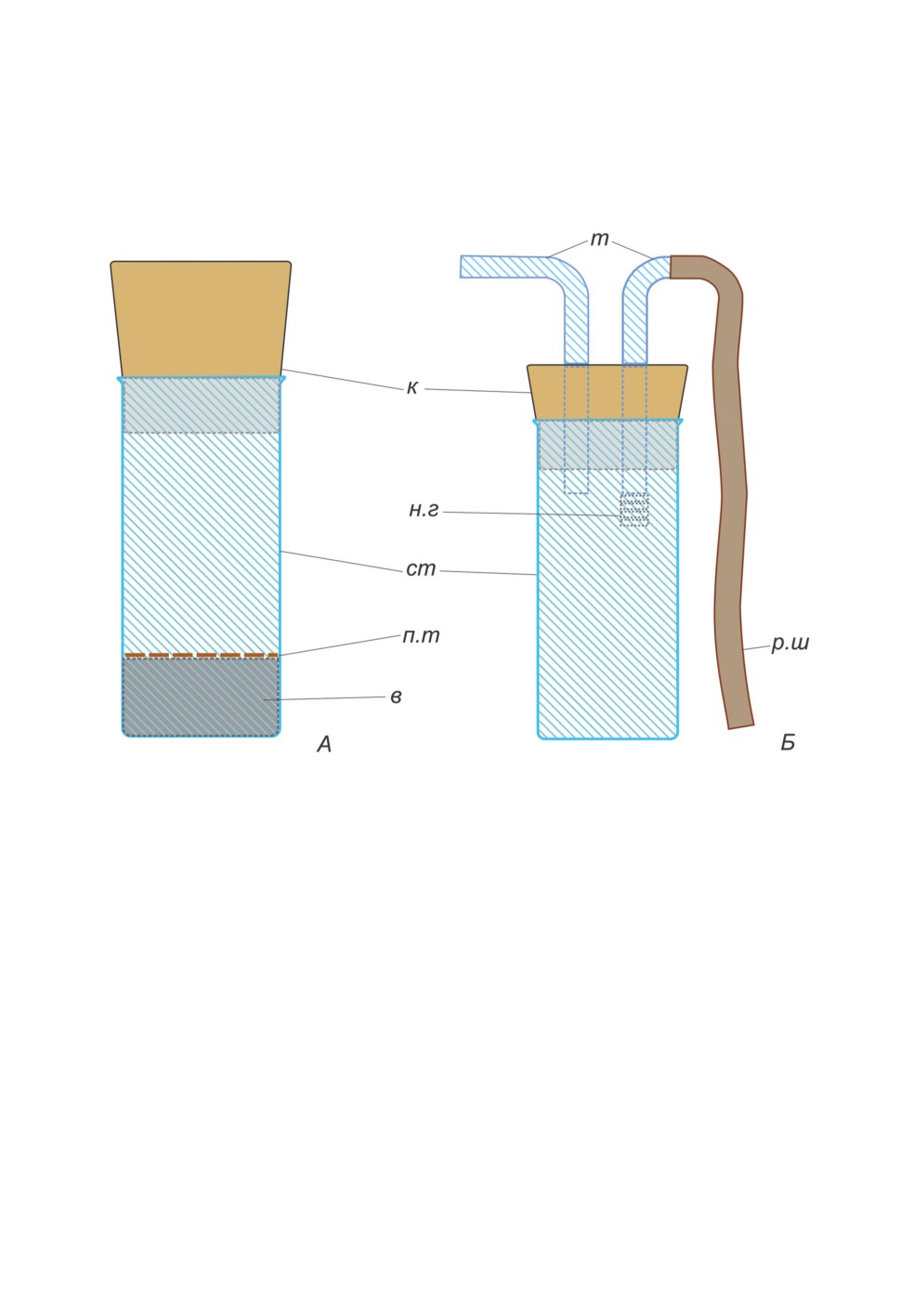
Рисунок 2. Энтомологическая морилка (А) и эксгаустер (Б). Схема.
Обозначения: в - слой ваты, к - крышка, н.г - насадка из газовой ткани, п.т - плотная ткань,
р.ш - резиновый шланг, ст - стакан, т - трубка.
Figure 2. Entomological killing jar (A) and reservoir-type aspirator (Б). Scheme.
В качестве энтомологической морилки рекомендуется использовать небольшую ци-
линдрическую стеклянную емкость (объем от 50 до 100 мл), плотно закрытую пробкой.
На дно морилки помещается материал, хорошо впитывающий токсическую жидкость
(хлороформ, серный эфир или этилацетат). Дополнительный вариант морилки описан
Скуфьиным (1973): на дно морилки кладут мелкие кусочки резины (например, от ре-
зиновых трубок), которые предварительно держат в токсической жидкости несколько
часов; их прижимают сверху кружком из плотного картона. Такая морилка действует
без перезарядки несколько дней.
Собирать с прокормителя морилкой или пробиркой следует главным образом кро-
вососущих комаров и мокрецов, поскольку слепни и мошки летают более маневренно.
Отлавливать слепней удобнее сачком, а мошек и мокрецов - эксгаустером.
139
Эксгаустер представляет собой небольшую емкость объемом от 50 до 100 мл, че-
рез крышку которой проходят две стеклянные или пластиковые трубки. К одной из
них присоединена гибкая трубка для засасывания воздуха, вторая служит для отлова
насекомых. Другая модификация эксгаустера - стеклянная или пластиковая трубка,
закрытая крышками с обоих концов. В одной крышке находится ловчая трубка, во
второй - трубка для засасывания воздуха (Silver, 2008; Becker et al., 2010). Ловчую
трубку эксгаустера подносят как можно ближе к насекомому и делают резкий вдох
через трубку гибкого шланга. Потоком воздуха двукрылое втягивается в ловчую трубку
и оказывается внутри эксгаустера. Для замаривания (т. е. умерщвления) насекомых,
собранных эксгаустером, по окончании сбора в ловчую трубку вставляется вата, смо-
ченная токсичной жидкостью. В некоторых случаях можно переместить насекомых из
эксгаустера в пробирку с фиксирующей жидкостью без предварительного умерщвле-
ния, после чего поместить туда этикетку. Методики первичной фиксации и хранения
различаются для четырех рассматриваемых семейств: они рассмотрены в разделе
«Фиксация и хранение материала».
При высокой численности кровососущих двукрылых наиболее удобно использовать
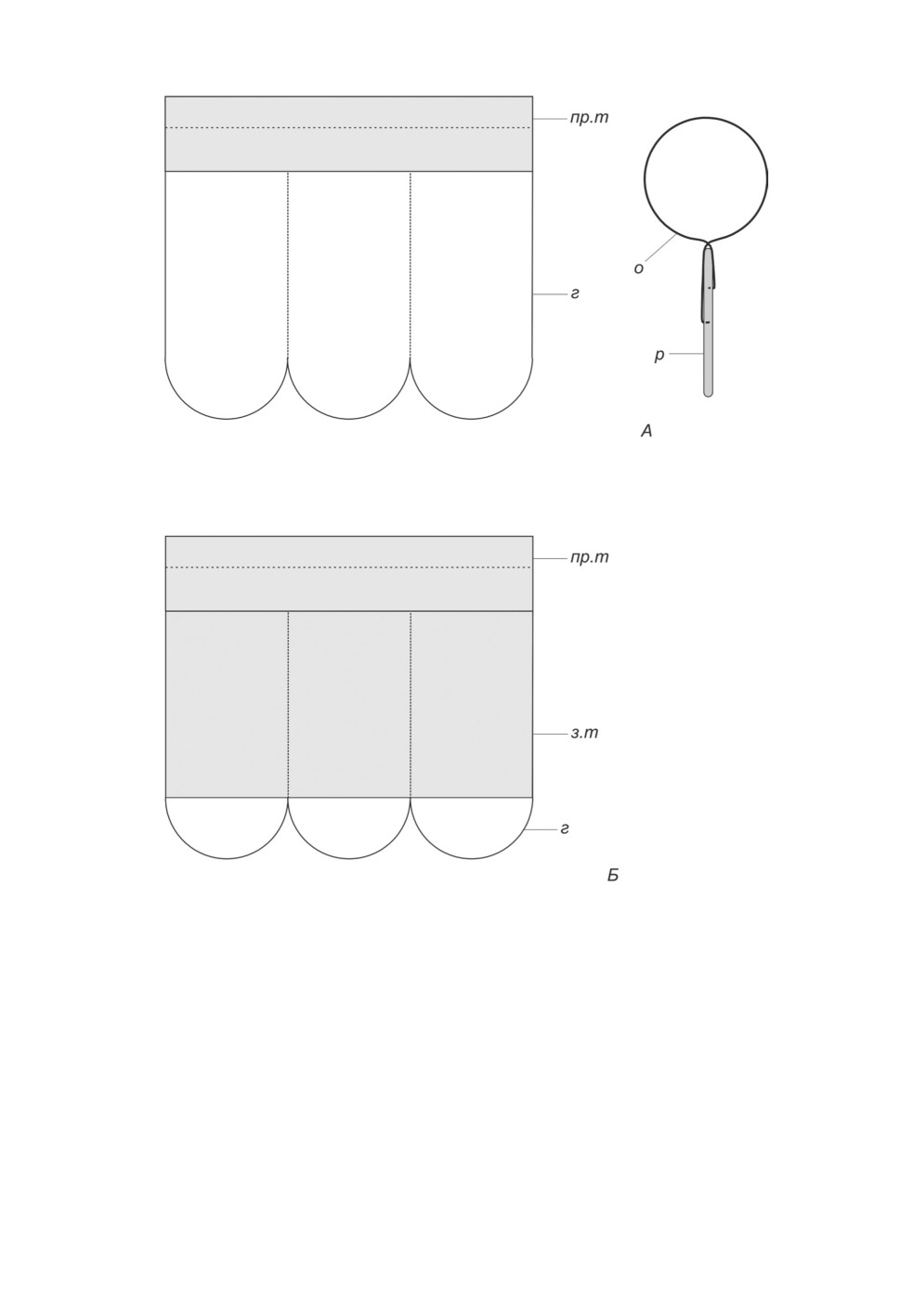
воздушный энтомологический сачок (рис. 3А). В большинстве случаев оптимален са-
чок с длиной ручки от 30 до 50 см, с диаметром обруча от 20 до 30 см и с глубиной
мешка от 50 до 70 см. Дно сачка должно быть округлым, материал мешка - мягкий
газ с диаметром ячеи 0.05-0.1 мм. Для сбора слепней, а также любых кровососов при
их низкой численности, удобнее использовать сачок бóльшего размера, с диаметром
обруча от 40 до 50 см и ручкой длиной около 1 м.
При сборе насекомых сачком следует обмахивать им прокормителя, делая от двух
до нескольких десятков взмахов, в зависимости от количества нападающих насекомых.
После этого нужно перекрутить мешок у устья, заморить насекомых в сачке и выбрать
их из него. Для этого используется пластиковый пакет, в который предварительно
помещена вата, кусок ткани или салфетка, смоченная в токсичной жидкости (серном
эфире, этилацетате или хлороформе). Необходимо на 3-8 минут поместить в пакет
мешок сачка или же мешок вместе с обручем. Следует учитывать, что в жаркую по-
году насекомые погибают быстрее. Двукрылых, собранных сачком, можно умерщвлять
также в энтомологической морилке или в эксгаустере.
После замаривания материал высыпают в небольшую кювету, где и происходит
его дальнейший разбор. Брать кровососущих двукрылых следует пинцетом за крылья.
Если разбор содержимого сачка происходит в ветреную погоду, то бывает удобнее
выбирать насекомых не в кювете, а прямо в сачке. В холодную погоду, а также при
небольшом количестве собранных двукрылых, можно выбирать их из сачка без пред-
варительного умерщвления, при помощи пинцета или эксгаустера.
Сразу после этого экземпляры, сохраняемые далее в сухом виде, накалывают на
энтомологические булавки и помещают в специальные коробки с мягким (прокалы-
ваемом булавками) дном. Если предполагается сохранять материал в спирте, то в ходе
сбора мелких двукрылых удобно смачивать пинцет этанолом, а собранные экземпляры
сразу переносить в пробирку, содержащую 80-85 %-ный водный раствор этанола (по-
дробнее см. раздел «Фиксация…»).
140
Рисунок 3. Энтомологический сачок (А) и его вариант для кошения (Б). Схема.
Обозначения: г - газовая ткань, з.т - защитная ткань, о - обруч сачка, пр.т - прочная ткань,
р - ручка сачка.
Figure 3. Entomological net (A) and net for sweeping (Б). Scheme.
1.2. Сбор имаго в иных ситуациях (не с прокормителя)
1.2.1. Кошения. Универсальный метод сбора кровососущих двукрылых - кошения
сачком (с растительности или вдоль ее края, а также вдоль берегов и над водой). Ко-
шения применяются для сбора любых насекомых комплекса гнуса, однако для слепней
они, как правило, неэффективны. Для их сбора используются другие методики (Лутта,
1970; Олсуфьев, 1977; Скуфьин, 1973).
141
Собирая кровососов кошением, нужно придерживаться нескольких общих прин-
ципов, которые актуальны и при сборе других двукрылых.
1) Число взмахов сачком определяется опытным путем и обычно составляет от 3 до
30. Оно зависит от группы двукрылых и от условий биотопа (в первую очередь - от
количества мелкого мусора и частей растений, попадающих в сачок).
2) Следует избегать кошения по влажной растительности (после дождя или по росе),
а также кошения мокрым сачком, поскольку при этом материал сильно повреждается.
Если все же необходимо сделать сборы в таких условиях, то рекомендуется ограни-
читься 3-4 взмахами при кошении. Материал, собранный мокрым сачком, следует
фиксировать в этаноле.
3) Кошения сильно осложняются, если на растениях присутствуют наземные мол-
люски. При попадании моллюска в сачок нужно немедленно прекратить кошение и
вынуть его из сачка, поскольку иначе быстро образуется «комок» с прилипшими по-
врежденными насекомыми.
4) Косить удобнее против ветра; при сильном ветре кошения малоэффективны.
Отловленных насекомых следует заморить в сачке, после чего выбрать материал
эксгаустером или пинцетом. Необходимо учитывать, что при сборах кошением мате-
риал двукрылых в той или иной степени повреждается, и это наиболее критично для
определения видов кровососущих комаров.
Для сбора кровососущих комаров следует применять кошение энтомологическим
сачком по травянистым растениям, которые растут возле мест выплода (луж, небольших
прудов и канав); при этом мы рекомендуем обращать особое внимание на зонтичные.
На растениях у мест выплода имаго зачастую присутствуют брюхоногие моллюски,
поэтому при сборе необходимо делать не более пяти взмахов сачком. Данную мето-
дику рационально применять во время массового вылета кровососущих комаров: она
позволяет собрать в том числе и самцов.
Собирая мошек, необходимо обкашивать сачком любую околоводную раститель-
ность (траву, кусты, низко расположенные ветви деревьев) вдоль ручьев, рек и других
водотоков. Лучше использовать специальный энтомологический сачок для кошения,
снабженный слоем защитной ткани (рис. 3Б). В некоторых случаях хорошие сборы
мошек можно сделать, отлавливая насекомых сачком над поверхностью воды рек и
ручьев, особенно в вечернее время.
Аналогично сбору мошек, кошение по растительности (особенно по приземному
ярусу) позволяет собирать кровососущих мокрецов. Необходимо учитывать, что мок-
рецы нередко проводят дневные часы у поверхности почвы (Глухова, 1989), поэтому
днем они плохо поддаются сбору сачком. Как правило, сборы мокрецов кошениями
дают наилучшие результаты перед закатом и после него. В то же время суток может
быть эффективным кошение над участками пологих (особенно заиленных) берегов без
высокой растительности. В последнем случае сачок нужно двигать в горизонтальной
плоскости, не допуская касаний влажного грунта и воды краем обруча или мешком.
142
Самцов слепней можно отлавливать сачком по одному; днем в жаркие часы они
часто барражируют над лесными дорожками или другими открытыми пространствами.
1.2.2. Сбор на окнах помещения или автомашины. Кровососущих двукрылых удоб-
но отлавливать на окнах помещения или автомашины (со внутренней стороны окон),
прикладывая раструб эксгаустера или морилку к поверхности окна с ползающими
экземплярами имаго. При большой численности насекомых их можно собирать непо-
средственно в емкость с этанолом, поднося ее к окну и стряхивая в нее ползающих
насекомых.
1.2.3. Сбор на дневках и зимовках. Данная методика используется для сбора крово-
сосущих комаров в антропогенных условиях (например, со стен и потолков жилых и
нежилых зданий), а также в естественных биотопах (в пещерах). Техника аналогична
сбору с окон: следует прикладывать раструб эксгаустера или морилку к поверхностям,
на которых сидят комары.
1.2.4. Сбор на свет. Многие виды мокрецов и некоторые виды кровососущих ко-
маров хорошо летят на свет в сумеречное и ночное время. Особенно массовым бывает
лет на свет мокрецов рода Culicoides. Для сбора этих двукрылых лов на свет не только
эффективен, но и позволяет собрать экземпляры в хорошей сохранности. Вместе с тем
следует учитывать, что лов на свет - весьма селективная методика сбора, позволяющая
собрать далеко не все виды кровососов.
Простейший вариант сбора на свет - поместить мощную электролампу на высо-
те 1.5-2 м над землей [например, удобна лампа OSRAM HWL (MBFT) мощностью
250 Вт и аналогичные лампы других производителей]. Источник света желательно ори-
ентировать в сторону ближайших открытых ландшафтов - мест выплода или укрытия
имаго кровососущих двукрылых (стоячих водоемов, водотоков, влажных травостоев или
кустарниковых зарослей). Позади лампы следует расположить вертикальный светлый
экран шириной не менее 1.5 м, высотой - от уровня земли до места крепления лампы
или выше. В качестве экрана можно использовать белую ткань, плотную бумагу или
светлую стену. На земле под лампой следует также постелить белую ткань, бумагу
или светлый полиэтилен. Кровососущих двукрылых удобно собирать эксгаустером,
морилкой или пробиркой с этанолом с вертикального и горизонтального экранов, об-
ращая наибольшее внимание на пространство вокруг лампы. Собранных в эксгаустер
насекомых замаривают и фиксируют (см. раздел «Фиксация…»).
Сборы на свет желательно начинать с наступлением вечерних сумерек, поскольку
в это время видовой состав насекомых, привлекаемых светом, существенно отличается
от ночного. Лов на свет дает наилучшие результаты в теплую безветренную погоду и
особенно - в темные безлунные ночи. Данная методика малоэффективна в условиях
высокого уровня освещенности ночью (например, в Заполярье).
Помимо этого, для сбора кровососущих двукрылых на свет можно использовать
самофиксирующие светоловушки (Горностаев, 1984; Голуб и др., 2012; Eiras et al.,
2021). Однако собираемый в ловушки материал бывает сильно загрязнен (попадает
143
большое количество иных насекомых, а также мусор) и требует длительной после-
дующей разборки. Традиционные методики сбора на свет мокрецов более подробно
описаны Гуцевичем и Глуховой (1970). В последние десятилетия для сбора мокрецов
получили широкое распространение ловушки с использованием ультрафиолетовых
ламп (например: Venter et al., 2009; Gonzalez de Heredia, Goldarazena Lafuente, 2011;
Rigot, Gilbert, 2012).
1.2.5. Липучки. У многих видов кровососущих мокрецов нередко наблюдается осо-
бенность суточного поведения: они держатся в приземном ярусе травостоя в дневное
время, а вечером поднимаются выше. В связи с этим эффективен сбор мокрецов липуч-
ками в местах их дневок. Данная методика позволяет также собирать мокрецов после
линьки на имаго в местах выплода (на влажных лугах, на берегах водоемов и т. п.).
В качестве основы липучек мы рекомендуем использовать пергаментную бумагу
(«тушевая калька») формата А4. На бумагу с одной стороны следует нанести тонким
слоем касторовое масло (достаточно нескольких капель масла на лист). Вместо пер-
гаментной бумаги можно использовать обычную бумагу или полиэтилен, а вместо
касторового масла - подсолнечное, но это дает худшие результаты. Листы размещают
горизонтально, липкой поверхностью вниз, прикрепляя за четыре угла к растениям
при помощи небольших прищепок. Липучки устанавливают в прохладную сухую
погоду на сутки; в жаркую солнечную погоду их ставят ближе к вечеру и снимают
утром следующего дня. При снятии липучки аккуратно сгибают пополам (липкой по-
верхностью внутрь) и помещают в переносной контейнер таким образом, чтобы они
лежали свободно, без сжатия. Снятые липучки осматривают в течение суток в лабо-
ратории или в полевом стационаре. Насекомых снимают с липучек тонким пинцетом,
отмывают от масла в пробирке с абсолютным этиловым спиртом, а затем фиксируют
в 85-90 %-ном водном растворе этанола.
Липучки в виде прямоугольных листов или полос также можно использовать для
сбора мокрецов в кронах деревьев и кустарников, а также при сборах с животных-
прокормителей (Глухова, 1989).
1.2.6. Ловушки других типов. Для массового сбора кровососущих двукрылых широко
используются ловушки различных типов, в основном привлекающие самок аналогично
прокормителям (Eiras et al., 2021). Ловушки позволяют собирать значительный объем
материала, но во многих случаях сохранность экземпляров бывает неудовлетвори-
тельной.
Чучеловидные и «конические» ловушки, имитирующие внешним видом прокор-
мителя, эффективны и широко используются для сбора слепней (Скуфьин, 1973).
Аналогичен таким ловушкам сбор кровососов «на автомобиль» (желательно темного
цвета). Для сбора кровососущих комаров, мошек и мокрецов используются углекис-
лотные ловушки (Silver, 2008; Becker et al., 2010). Кроме того, для сбора кровососущих
двукрылых применяются комбинированные ловушки, в которых используется свет и
несколько химических аттрактантов (Eiras et al., 2021).
144
2. Сбор преимагинальных стадий и выведение имаго
2.1. Крово со сущие комары
Личинки кровососущих комаров обладают удлиненно-веретеновидным телом, по
внешнему виду напоминают таковых сем. Dixidae и Chaoboridae. Однако у личинок
сем. Culicidae членики груди слиты в единый сильно расширенный несегментирован-
ный отдел (рис. 4А), что отличает их от сем. Dixidae. В отличие от другого близко-
го семейства (Chaoboridae) усики личинок кровососущих комаров не видоизменены
в орган для поимки добычи. Куколки сем. Culicidae с сильно расширенной передней
частью тела (головой и грудью) и обособленным от нее удлиненным уплощенным
брюшком. На последнем членике брюшка имеются две округлые лопасти, функцио-
нирующие как плавник. Длина тела личинок и куколок - от нескольких миллиметров
до нескольких сантиметров.
Личинки и куколки кровососущих комаров обитают в воде и обычно держатся
у ее поверхности. Местами их развития служат в первую очередь небольшие стоячие
водоемы - лужи, канавы, ямы с водой, пруды и озера, а также контейнеры и баки
с водой, затопленные подвальные помещения. Данные водоемы могут быть как по-
стоянными, так и временными (в т. ч. весенние, пойменные и т. д.). В лужах, канавах
и других небольших резервуарах личинки и куколки встречаются по всей площади
водной поверхности. В более крупных прудах и озерах они встречаются в прибрежных
и заболоченных участках, как правило, заросших водной и полуводной растительно-
стью и не подверженных заметному воздействию волн и ветра.
Для сбора личинок и куколок кровососущих комаров мы рекомендуем использо-
вать бытовое сито диаметром от 5 до 30 см (рис. 4Б). Таким ситом следует быстро
провести 1-2 раза в поверхностном слое воды обследуемого водоема. При сборе не-
обходимо учитывать, что насекомые чутко реагируют на механические сотрясения,
а также на появление тени на воде, быстро уходя вниз от поверхности. В таких случаях
рекомендуется 2-3 раза провести ситом в толще воды и у дна водоема, после чего
подождать несколько минут, пока личинки и куколки снова не всплывут к поверхно-
сти. При обследовании самых мелких водоемов (лужицы, заполненные водой ямки и
межкочья) удобнее пользоваться маленьким ситом, дуршлагом или ковшиком. Собран-
ный материал следует извлечь из сита в неглубокий светлый контейнер, наполненный
водой, погружая в него сито (рис. 4Б). После этого при помощи пластиковой пипетки
с широким носиком (диаметром 2-3 мм, рис. 4В) необходимо переместить личинок и
куколок из контейнера в пробирку, содержащую 80-85 %-ный водный раствор этанола
(для морфологического или молекулярного исследования) или жидкость Карнуа (для
цитогенетического исследования личинок), см. «Фиксация…».
Для получения имаго из преимагинальных стадий следует перелить воду с от-
ловленными личинками и куколками в емкости от 1 до 10 л (канистры, бутылки и
т. п.), а также взять дополнительно и воду из водоема развития личинок. Емкости
с личинками рекомендуется заполнять водой не более чем на 2/3, транспортировать
в лабораторию течение 1-2 суток при температуре от 5 до 15 °С (в зависимости от
таковой окружающей среды), избегая прямых солнечных лучей.
145
В стационаре необходимо при помощи пластиковой пипетки с широким носиком
рассадить личинок поодиночке в широкие емкости объемом 200-300 мл (рис. 4Г;
индивидуальный выплод) или же группами в емкости 0.5-5 л (массовый выплод), на-
крытые сверху москитной сеткой. Для большого количества материала в лабораторных
условиях удобно использовать самоклеящиеся этикетки. Текст на этикетках можно
частично или полностью печатать на принтере.
Рисунок 4. Личинка кровососущих комаров и инвентарь для сбора личинок. А - Aedes
Meigen, кровососущий комар, личинка, вид сверху; Б - сито и контейнер; B - пипетка для
сбора личинок и куколок; Г - емкость для индивидуального выплода кровососущих комаров.
Figure 4. Mosquito larva and devices for collecting larvae. А -Aedes Meigen, mosquito, larva,
dorsal view; Б - dipper and container; В - dropper for collecting mosquito larvae and pupae;
Д - container for individual rearing of mosquito larvae and pupae.
146
В дальнейшем емкости следует проверять один раз в сутки в течение всего развития
личинок и куколок (от первых суток до 2 месяцев) на предмет линьки, а также один
раз в 1-4 дня (в зависимости от температуры) менять в них воду. Перелинявших на
имаго насекомых необходимо заморить эфиром или хлороформом, наколоть на энтомо-
логические булавки (либо фиксировать в пробирке с этанолом, вместе с куколочными
и личиночными шкурками, а также поместить в пробирку этикетку).
2.2. Мошки
Личинки и куколки мошек (рис. 5) имеют характерный облик и легко отличимы от
других беспозвоночных. Тело личинки (рис. 5A) коротко-цилиндрическое, расширено
у заднего конца, которым личинка обычно прикрепляется к субстрату. Как правило,
голова спереди с двумя длинными веерами щетинок. Грудь неотчетливо сегментирова-
на, с хорошо заметным прикрепительным выростом. Куколка (рис. 5Б) с укороченным
телом, расширенным в передней части и суженным в задней; обычно располагается
в коническом полупрозрачном коконе, прикрепленном к субстрату. На переднем конце
тела куколки находятся, как правило, ветвящиеся выросты, выступающие из кокона.
Длина тела личинки не превышает 12 мм, куколки - 10 мм.
Личинки и куколки мошек живут только в проточной воде, при этом они населяют
водотоки всех типов: от крохотных ручейков до крупных рек. Эти насекомые встре-
чаются на относительно твердых субстратах (камнях, растениях и других предметах,
погруженных в воду или омываемых водой).
Для сбора личинок и куколок мошек необходимо осторожно вынимать из воды
погруженные субстраты (камни, мертвые части растений, зеленые растения, антро-
погенный мусор) и осматривать их в поисках личинок и коконов с куколками. Чаще
всего насекомых можно обнаружить на субстратах, находящихся в воде на перекатах
водотоков. Также личинок и куколок легко собирать с вертикальных скал и других
субстратов, по которым вода стекает в виде тонкой пленки или отдельных капель
(в частности, у водопадов). В первую очередь следует собирать личинок последнего
возраста, имеющих зачатки дыхательных органов куколки (рис. 5В). Из куколок нужно
выбирать наиболее темноокрашенных, т. к. они содержат в себе сформировавшееся
имаго. Насекомых собирают тонким пинцетом и помещают в пробирку, содержащую
80 %-ный раствор этанола (для морфологического или молекулярного исследования).
Поскольку куколки находятся в коконах, прикрепленных к субстрату, их следует, по воз-
можности, помещать в пробирки вместе с растительным или антропогенным субстра-
том (упаковки, пакеты, ветошь и т. п.). Если это невозможно, например когда куколки
прикреплены к крупным и прочным предметам (автомобильные покрышки, бетонные
конструкции, камни), следует аккуратно отделить кокон от субстрата. При обилии
растительного материала, помещаемого в пробирку, следует учитывать разбавление
фиксирующей жидкости; в таком случае лучше использовать 90 %-ный раствор этанола.
Для цитогенетического исследования собранный материал необходимо поместить из
контейнера в пробирку с жидкостью Карнуа. При перекладке в фиксирующую жид-
147
кость личинку следует брать за середину тела, так как на заднем конце и на головной
капсуле сосредоточено большинство структур, несущих диагностические признаки.
Рисунок 5. Simulium Latreille, преимагинальные стадии мошки: А - личинка сверху,
Б - куколка сбоку, B - личинка сбоку; з.д - зачатки дыхательных органов, гол - голова,
гр - грудь.
Figure 5. Simulium Latreille, immature black flies: А - larva, dorsal view; Б - pupa, lateral view;
В - larva, lateral view.
Выведение имаго мошек из личинок технически затруднено, поскольку требует их
содержания в проточной воде (см. Иващенко, 1977; Colbo, Thompson, 1978; Лиховоз,
1980; Takaoka, 1985; Ciborowski, Craig, 1989). В связи с этим гораздо чаще выводят
имаго из куколок. Для этого следует поместить собранных куколок с частицами суб-
страта в пустой и сухой контейнер или банку. В таких условиях куколки сохраняют
148
жизнеспособность в течение одного или нескольких часов, в зависимости от темпе-
ратуры. После транспортировки в стационар (или при разборе материала в полевых
условиях) нужно поместить фрагменты субстратов с 1-3 куколками в отдельные пустые
пробирки (объемом 2-5 мл). В горловинах пробирок следует расположить плотные
комки смоченной в воде и отжатой ваты. Фиксация материала будет осуществляться
в этой же пробирке. Необходимо содержать материал в хорошо проветриваемом по-
мещении при температуре от 5 до 20 °С, а также проверять его один раз в сутки
в течение 4-5 дней на предмет появления имаго. В ходе проверки следует вновь сма-
чивать и отжимать вату на горловине. После линьки на имаго можно приоткрыть край
ваты и пипеткой влить внутрь пробирки 90 %-ный этанол для фиксации взрослого
насекомого вместе с субстратом и куколочной шкуркой. В пробирку следует поместить
этикетку (см. раздел «Фиксация …»).
2.3. Крово со сущие мокрецы
Личинки и куколки рода Culicoides (рис. 6) сходны по внешнему виду с таковыми
многих некровососущих мокрецов и могут быть опознаны лишь при некотором навы-
ке, но нередко для этого требуется бинокуляр (стереомикроскоп). Тело личинок рода
Culicoides (рис. 6A) тонкое, более или менее нитевидное, без придатков. Окраска от
беловатой до сероватой, нередко с неясными темными пятнами по бокам передних
сегментов. Головная капсула направлена вперед, короткоовальная, при этом бывает за-
метно сужена кпереди (но не удлиненно-цилиндрическая и не заостренно-коническая).
Задний конец тела без длинных щетинок. Личинки рода Culicoides способны быстро
направленно плавать, совершая характерные резкие «синусоидальные» движения в го-
ризонтальной плоскости (у многих некровососущих мокрецов личинки неплавающие).
Внешний вид куколок рода Culicoides (рис. 6Б) характерен для мокрецов: на переднем
конце тела заметны парные булавовидные выросты; брюшко не уплощенное, с ши-
пиками по бокам и с парными остриями на вершине; окраска обычно коричневатая.
Длина тела личинок рода Culicoides не превышает 5-6 мм, а куколок - 3-4 мм, что
значительно меньше, чем у многих других мокрецов.
Личинки рода Culicoides развиваются в разнообразных полуводных и влажных
органических субстратах, а также в воде. Наиболее характерный биотоп - урез воды
по берегам различных постоянных водоемов. Как правило, в более крупных водоемах
(озерах и реках) личинки встречаются лишь на самом мелководье - вдоль уреза и на
участках не глубже 10-20 см. В небольших водоемах (канавах и лужах) они могут
встречаться по всей площади водоема (особенно в водоемах, загрязненных органикой
или имеющих повышенную соленость). Помимо этого, личинки Culicoides - обычные
обитатели влажных местообитаний, находящихся за пределами водоемов (например,
болота разного типа и заболоченные луга). Некоторые виды проходят развитие в по-
лужидком навозе, экскрементах птиц, а также в гниющей растительной органике и
грибах. В тех случаях, когда личинки обитают в воде, для окукливания они всегда
перемещаются в полуводные условия - как правило, на урез воды. Там же происходит
и линька на имаго.
149
Работы по сбору личинок мокрецов можно разделить на несколько этапов: (1) сбор
субстратов в поле, (2) их промывка и (3) извлечение личинок из промытого материала.
Как правило, за этим следует этап 4 - выведение имаго из личинок. Отдельно рас-
сматривается методика выведения имаго непосредственно из субстрата (5).
Рисунок 6. Culicoides Latreille, преимагинальные стадии мокрецов:
А - личинка сверху, Б - куколка снизу.
Figure 6. Culicoides Latreille, immature biting midges:
А - larva, dorsal view; Б - pupa, ventral view.
2.3.1. Сбор субстратов в поле. Техника сбора личинок мокрецов из водных и из
полуводных биотопов различается. Для сбора в воде используется гидробиологический
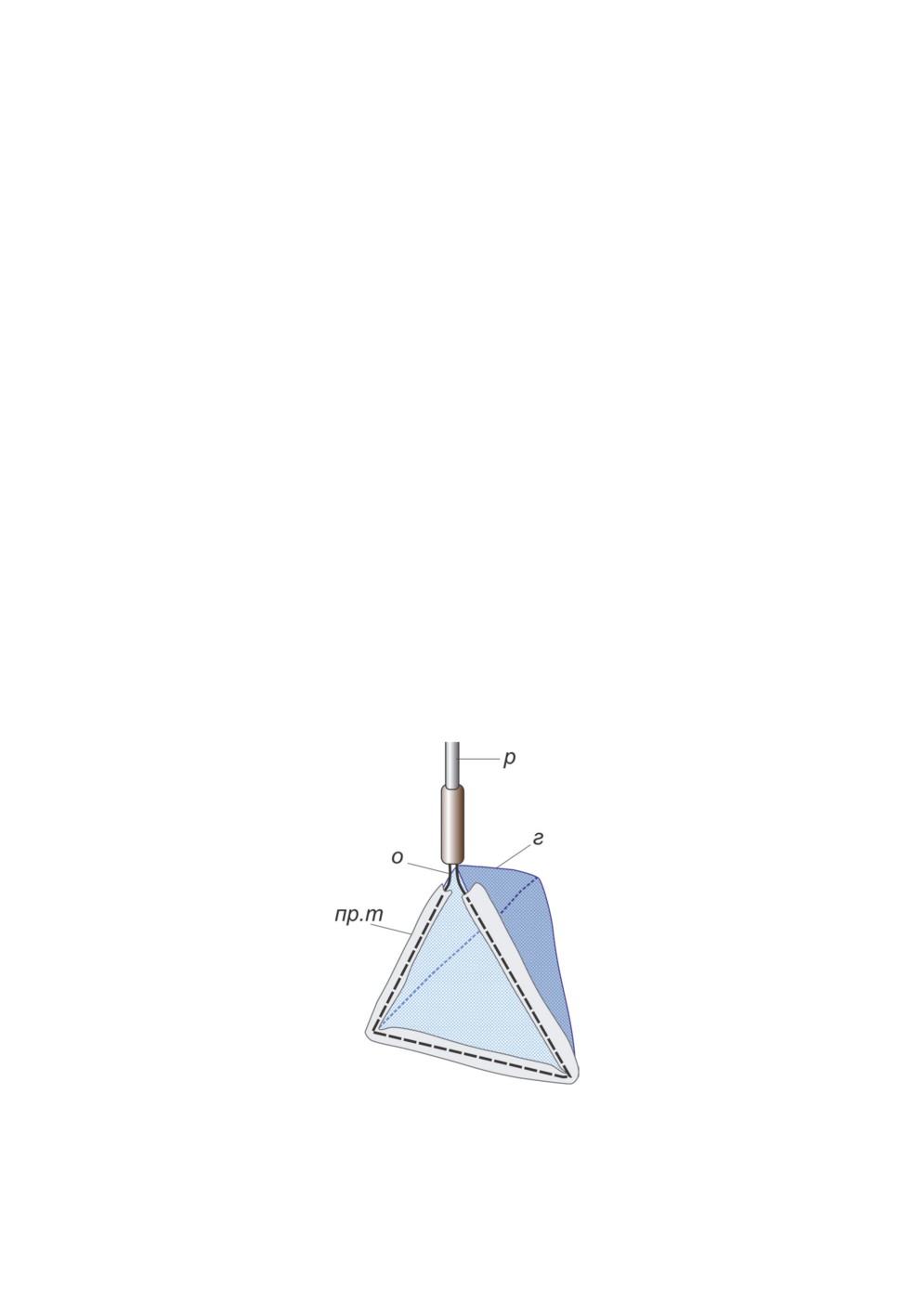
сачок, который должен иметь жесткий прочный металлический обод, устойчивый
к нагрузке, особенно в месте крепления к палке. Наиболее удобны сачки с полукруглым
или треугольным обручем (рис. 7). Ручка сачка может быть деревянной или может быть
изготовлена из алюминиевой трубки, а мешок - из мельничного газа. Длина мешка
сачка должна быть в 1.5-2.5 раза больше ширины обруча, его вершина - коническая
или закругленная, диаметр ячеи - от 0.1 до 0.25 мм. Мешок крепится к обручу рукавом
из прочной ткани (бязь, плотные синтетические ткани). Рекомендуемые ширина об-
руча сачка - от 20 до 30 см, длина ручки - от 1 до 2 м, но при обследовании мелких
150
луж и микроводоемов удобнее сачки с диаметром около 10 см на короткой ручке.
В качестве основы для изготовления сачков небольшого размера можно использовать
имеющиеся в продаже сачки для аквариумов; также удобны пластиковые и металли-
ческие дуршлаги с подходящим диаметром ячеи.
Для сбора личинок мокрецов в воде сачком проводят по дну и по подводным ча-
стям растений на прибрежных участках, где глубина не превышает 0.5 м. Хорошие
результаты дают сборы сачком в воде у самого уреза, особенно в тех местах, где бе-
реговая линия образует небольшой уступ. В таких местах сачком проводят несколько
раз вдоль одного и того же участка уреза (или вдоль края сплавины) длиной 0.5-1 м,
держа сачок вертикально и под углом к берегу, а затем так же обкашивается соседний
участок. При сборах сачком необходимо следить за тем, чтобы в нем оказывалось
умеренное количество субстрата. Если в сачке оказался ил, следует осторожно от-
мыть содержимое сачка от большей части ила, погружая нижнюю часть мешка в воду.
Собранный материал перекладывают из сачка в широкие пластиковые контейнеры
(1-3 л) или в полиэтиленовые мешки, снабженные этикетками. Удобны этикетки,
написанные водостойким маркером на кусках пластика, полиэтилена или на водо-
стойкой бумаге. Собранный материал должен содержать лишь небольшое количество
воды; его необходимо держать в прохладе и беречь от солнца. Желательно промыть
и разобрать материал в течение суток; допустимо его хранение в течение 2-3 суток
при температуре около +5 °C.
Рисунок 7. Гидробиологический сачок.
Обозначения как на рис. 3.
Figure 7. Aquatic net.
Abbreviations as in Fig. 3.
151
Материал из полуводных биотопов можно собирать вручную (растительные остатки,
подушки мхов и т. п.), при помощи ложки, небольшого совка (мягкие грунты: ил, песок
и т. п.) или ножа (субстраты со сплетением корней). При этом необходимо учитывать,
что в более плотных субстратах (ил, почва и т. п.) личинки мокрецов приурочены
только к поверхностному слою толщиной в 2-3 см. Собранный материал сохраняют
таким же образом как при сборах из воды. При избытке воды в отобранном материале
нужно слить жидкость через сито или сачок, оставляя лишь мокрый субстрат.
Куколок мокрецов удобно собирать, погружая полуводные субстраты в ведро или
таз с водой. Живые куколки всплывают на поверхность воды, откуда их следует ак-
куратно извлечь пинцетом или изогнутой иглой. Для выведения имаго собранных
куколок помещают в широкие пробирки на влажную вату и содержат при комнатной
температуре; как правило, при 20 °С имаго выводятся в течение недели.
2.3.2. Промывка субстратов. Пробы небольшого объема (менее 1 дм3) можно про-
мывать прямо в водоеме, используя гидробиологический сачок. Сачок с пробой по-
гружается нижней частью в воду и осторожно выполаскивается в течение нескольких
минут (до прекращения появления мути вокруг сачка). Если проба илистая, при про-
мывке ее можно слегка помешивать. Параллельно с промывкой крупные фрагменты
(растения, древесина и т. п.) вынимаются из сачка и выбрасываются.
Пробы большего объема промываются небольшими частями на колонке из 2-3 про-
мывочных сит, которые плотно вставляются друг в друга (рис. 8). При сборе мокре-
цов удобно использовать верхнее сито с диаметром ячеи 7-10 мм, среднее - 3 мм,
и нижнее - 0.25-0.5 мм; диаметр сит - 20 или 30 см. При промывке в лаборатории
используется слабая струя проточной воды, но нередко проще промыть пробы на си-
тах прямо в поле. В последнем случае необходимо следить за тем, чтобы не занести
в пробы других насекомых с промывочной водой. Для этого можно набрать в ведро
воду из водоема, затем ее перелить через сачок или мелкоячеистое сито в другую
емкость и лишь после этого использовать для промывки.
Рисунок 8. Сита для промывки субстрата.
Цифрами обозначен диаметр (мм) ячей соответствующего сита.
Figure 8. Sieves for substrate rinsing.
Numbers designate mesh diameter (mm) of corresponding net.
152
При наличии сплетения корней материал следует разделить на куски, которые вы-
поласкиваются в ведре с водой, после чего содержимое ведра по частям промывается
на колонке сит слабой струей воды. Аналогичным образом удобно выполаскивать
в ведре материал, если в нем преобладают крупные растительные компоненты (по-
душки мхов, водные растения и т. д.). Аккуратное выполаскивание ускоряет последую-
щую промывку субстрата, а также приводит к тому, что личинки и куколки меньше
повреждаются. При промывке нельзя перегружать верхнее сито субстратом, так как
это резко замедляет процесс: ячейки нижнего сита забиваются частицами субстрата,
и вода перестает уходить. В таком случае мы рекомендуем погрузить нижнее сито
нижней частью в воду и слегка встряхнуть колонку сит в вертикальной плоскости.
После промывки материал из нижнего сита ложкой собирается в контейнер. Здесь
материал можно хранить в том же виде в течение 1-2 дней при температуре 5-10 °С
до того момента, когда из него будут извлечены личинки и куколки мокрецов. В этот
же контейнер помещается исходная этикетка.
2.3.3. Извлечение личинок и куколок из промытого материала. Небольшие объемы
промытого материала (несколько см3) можно просматривать в светлой кювете в воде
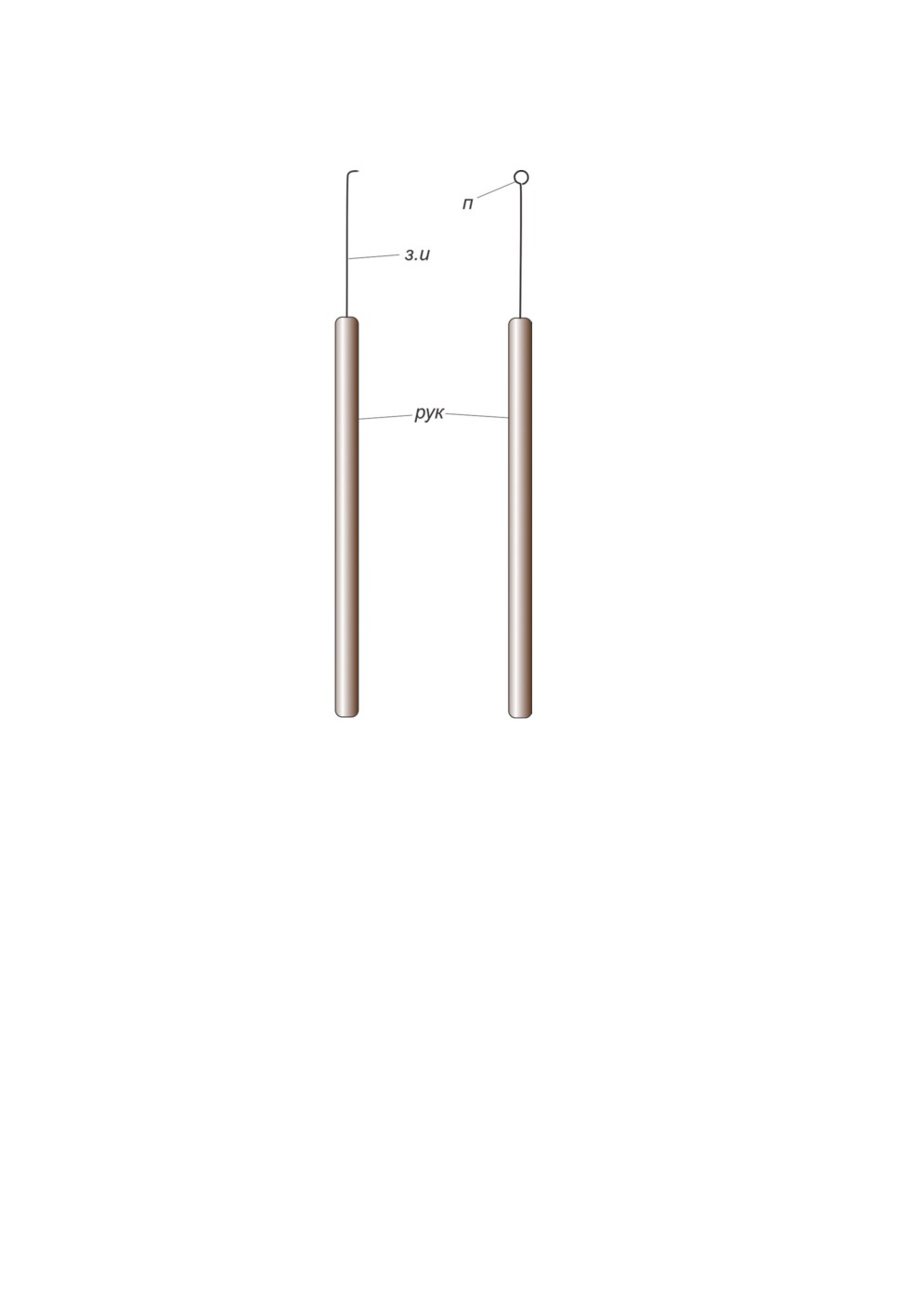
при хорошем освещении. Личинок собирают широкой пипеткой или тонкой иглой
(швейная игла или толстая энтомологическая булавка), загнутой на конце под углом
или в виде петли и насаженной на пластиковую ручку (рис. 9). Плавающих личинок
поддевают загнутой вершиной иглы снизу. Часто личинки мокрецов скапливаются
в более освещенном углу кюветы, и это облегчает их сбор.
Для сбора личинок мокрецов из большего объема материала наиболее эффективен
метод флотации (Панкратова, 1970; Глухова, 1979, 1989). Для флотации используется
раствор поваренной соли; наиболее удобна очищенная пищевая соль «экстра», также
можно использовать сульфат магния. Для изготовления раствора 2 кг соли следует
растворить в 10 л теплой воды и оставить отстояться в течение 1-2 ч, после чего
флотационный раствор наливают в широкие емкости (например, тазы из светлого
пластика объемом от 2 до 10 л). Небольшую порцию промытого субстрата помещают
в раствор и размешивают ложкой, при этом поверхность раствора должна быть хорошо
освещена. Большинство беспозвоночных в течение минуты всплывает на поверхность
раствора, так как плотность их тела ниже, чем у раствора; бóльшая часть остального
субстрата оседает на дно.
Всплывающих личинок и куколок мокрецов в течение 5-10 мин собирают тонким
пинцетом или загнутой иглой, после чего фиксируют в 80-85 %-ном этаноле. Если
предполагается сохранять личинок и куколок в живом виде, то следует избегать их
сдавливания (т. е. нужно переносить их пинцетом «в капле воды» или же использовать
иглу). Живых личинок и куколок необходимо быстро переместить из флотационного
раствора в чашки Петри диаметром 3-6 мм с небольшим количеством чистой воды.
При длительном (более 10-15 мин) пребывании во флотационном растворе личинки
могут погибнуть. После того как в одну чашку будет помещено 10-20 экз., необходимо
сменить в ней воду, так как вместе с насекомыми в чашку попадает соленый раствор.
153
Для этого удобно удалить воду пипеткой, на вершине которой зафиксирован кусок
мелкоячеистого газа (диаметр ячеи - 0.05-0.25 мм), а затем добавить свежую воду.
Рисунок 9. Иглы с загнутым и петлевидным концами для сбора личинок мокрецов:
з.и - загнутая игла, п - петля, рук - рукоятка.
Figure 9. Hooked and loop needles for collecting larvae of biting midges.
После сбора первой порции личинок и куколок осевший на дно флотируемый суб-
страт нужно перемешать ложкой, чтобы он вновь оказался в толще раствора. Обычно
после этого всплывает еще некоторое количество животных. Процедуру повторяют
1-2 раза, пока всплывают новые экземпляры. После того как порция субстрата обра-
ботана методом флотации, раствор сливают через мелкоячеистое сито или сачок, и его
можно использовать вновь. Поверхность раствора можно время от времени очищать
от мусора с помощью небольшого мелкоячеистого сита или сачка. Постепенно, при
внесении новых порций субстрата в раствор, концентрация соли понижается. Поэтому
время от времени необходимо добавлять соль небольшими порциями и периодически
проверять концентрацию раствора, помещая в него экземпляр из числа ранее отфлоти-
рованных. Очень медленное всплывание животных говорит о том, что концентрацию
соли необходимо увеличить. Для проб из каждого нового биотопа желательно использо-
вать новый флотационный раствор, чтобы исключить занос животных из предыдущих
154
проб. Объем каждой следующей порции субстрата, помещаемого в раствор, меняют
в зависимости от количества организмов в предыдущих порциях, но в любом случае
он не должен превышать 1/10 от объема флотационного раствора.
2.3.4. Выведение имаго из личинок и куколок. Личинок мокрецов помещают пооди-
ночке или по несколько экземпляров с небольшим количеством воды в чашки Петри
или же в широкогорлые контейнеры емкостью 50-250 мл, горловина которых закрыта
мелкоячеистой тканью, фиксированной резинкой (рис. 10А). Уровень воды не должен
превышать 3 мм. В воду помещают также небольшое количество субстрата из места
сбора личинок. Чашки Петри с личинками снабжают этикетками, на которых полезно
отметить окраску личинок. Температура при содержании личинок должна приблизи-
тельно соответствовать природной и в любом случае не должна превышать 20-25 °C;
материал следует хранить в тени. Раз в 2-3 дня нужно просматривать материал и
заменять воду. При использовании чашек Петри необходимо следить за тем, чтобы
в щель между собственно чашкой и ее крышкой свободно проходил воздух (т. е. чтобы
щель не была заполнена водой, поскольку в этом случае личинки часто погибают от
быстро возникающего дефицита кислорода). Если щель оказалась заполнена водой,
поверхности чашки Петри и ее крышки вытирают сухой фильтровальной бумагой.
Рисунок 10. Контейнеры для выведения имаго мокрецов и слепней:
А - объем 50-250 мл, Б - объем 1-2 л.
Figure 10. Containers for rearing of biting midge and horsefly larvae.
155
Личинки, близкие к окукливанию, отличаются вздутыми грудными сегментами.
Их следует пересадить в чашки Петри с небольшим количеством воды и с кусочком
фильтровальной бумаги. Лучше всего ставить эти чашки не строго горизонтально,
а под небольшим уклоном (чтобы фильтровальная бумага частично находилась вне
воды). Чаще всего личинки окукливаются у края воды. Живых куколок3 необходимо
перенести тонким пинцетом (избегая сдавливания) в широкогорлые пробирки с влаж-
ной ватой на дне.
Для куколок наиболее удобны пробирки высотой 4-5 см и диаметром 1.5 см; на
дно пробирки следует поместить плотный комок влажной ваты диаметром от 1 до
1.5 см. В горловине пробирки надо расположить сухую ватную пробку, а на боковой
части - этикетку.
Шкурку личинки после ее окукливания следует осторожно извлечь тонким пинце-
том и поместить в пробирку с 80-85 %-ным этанолом. При этом необходимо следить
за тем, чтобы не была потеряна головная капсула личинки. Обычно шкурки личинок
лучше видны в воде не на светлом фоне при верхнем освещении, а на более темном
фоне при нижнем или боковом освещении. Для их поиска в ряде случаев необходим
бинокуляр. После этого пробирку с фиксированной в этаноле шкуркой прикрепляют
резинкой или скотчем к пробирке с живой куколкой.
Пробирки с куколками нужно просматривать раз в 2-3 дня и периодически увлаж-
нять вату на дне (она должна быть слегка влажной, но не мокрой). Перелинявшее на
имаго насекомое следует оставить в пробирке на срок от 12 ч до суток для полной
склеротизации и окрашивания покровов. Если имаго не проявляет большой активности,
можно сразу взять его пинцетом, конец которого смочен в этаноле. Более активных
насекомых перед этим необходимо заморить, капнув на ватную пробку пробирки хло-
роформ или эфир (удобнее перенести небольшую каплю пинцетом). После этого имаго
фиксируют вместе со шкурками личинки и куколки; пробирка снабжают этикеткой
(см. раздел «Фиксация …»).
Личинки, собранные осенью, как правило, заканчивают развитие лишь на сле-
дующий год, и им необходима зимовка. Для этого личинок следует поместить на
3-4 месяца в темноту при температуре от 0 до +5 °С (например, в бытовой холодиль-
ник). Материал необходимо периодически просматривать, контролируя наличие воды
в чашках. После зимовки личинок вновь помещают в ”летние“ условия температуры
и освещения.
Более подробные обзоры методов сбора личинок мокрецов и выведения из них
имаго приводит Глухова (Гуцевич, Глухова, 1970; Глухова, 1979, 1989).
2.3.5. Выведения имаго непосредственно из субстрата. Для установления полувод-
ных биотопов развития мокрецов и получения материала имаго эффективен метод
выведения из субстрата. Данная методика использовалась уже в середине XX в. (Crisp,
3 Живые куколки обычно всплывают к поверхности воды, погибшие - тонут; кроме того,
живые куколки нередко совершают движения брюшком, изгибая его.
156
Lloyd, 1954), но лишь сравнительно недавно стала широко применяться и была под-
робно описана на русском языке (Пржиборо, 2001, 2012; Филиппов и др., 2017). По-
луводный субстрат (мох, береговой ил, растительные остатки, влажные дернины и т. п.)
собирается вручную или вырезается с помощью ножа до глубины 2-3 см. После этого
субстрат помещается ровным слоем 2-5 см высотой в широкие контейнеры (площа-
дью от 10×15 до 25×25 см, высотой до 15 см), плотно закрытые сверху прозрачной
крышкой или затянутые полиэтиленом (рис. 10Б). Крышка должна иметь широкое от-
верстие, затянутое мелкоячеистым газом, что необходимо для вентиляции. Например,
при площади контейнера 10×15 см площадь отверстия в крышке должна составлять
около 5×10 см. В отверстие в крышке следует вклеить кусок газа с размером ячеи сетки
0.05-0.25 мм. При закладке субстратов и их последующих осмотрах нужно срезать
крупные побеги растений и удалить всех хищных членистоногих. Из одного биотопа
единовременно целесообразно брать для выведения мокрецов субстрат с площади
0.1-0.25 м2. Контейнеры этикетируют на боковой поверхности.
Перелинявших на имаго мокрецов следует собирать эксгаустером каждые 2-3 дня.
Для их сбора необходимо аккуратно приподнять крышку контейнера с одного угла,
следя за тем, чтобы противоположная часть контейнера была лучше освещена (по-
скольку большинство активных мокрецов летит в более освещенную сторону). Если
в контейнере появилось большое количество активно летающих насекомых, можно
поместить его в прозрачный полиэтиленовый пакет и лишь затем приоткрыть крышку
для сбора эксгаустером. Собранных имаго удобно замаривать в эксгаустере и фикси-
ровать в 80-85 %-ном этаноле (см. «Фиксация …»). После того как все обнаруженные
имаго собраны, мы рекомендуем снять крышку и залить содержимое контейнера водой
таким образом, чтобы субстрат оказался под поверхностью воды. После этого можно
слегка встряхнуть контейнер или пошевелить субстрат пинцетом. При этом часто на
поверхность воды всплывают новые насекомые, которых следует собрать пинцетом.
Шкурки куколок можно собрать с поверхности воды и со стенок контейнера; в по-
следнем случае шкурки полезно смочить водой или этанолом с пинцета.
В ходе выведения имаго следует следить за степенью увлажнения субстрата: суб-
страт необходимо периодически увлажнять, не допуская его подсыхания. Напротив,
если субстрат сильно обводнен, то при его закладке необходимо следить, чтобы уровень
воды в контейнере не превышал 1-2 см (т. о., наибольшая часть субстрата должна на-
ходиться выше уровня воды). Не реже одного раза в неделю воду со дна контейнера
необходимо сливать, заменяя ее свежей. Условия хранения субстратов (температура,
освещение) аналогичны таковым для индивидуальных выведений мокрецов из личинок.
С конца осени для имитации зимних условий субстраты помещаются в температуру
от 0 до +5 °C и в темноту на 3-4 месяца (пригоден бытовой холодильник, если суб-
страты в нем не промерзают). После зимовки субстраты вновь помещаются в «летние»
условия (температура, освещение), и через 2-4 недели после этого обычно начинается
активный вылет имаго.
157
Субстраты можно сохранять в течение года с момента сбора. Но если есть возмож-
ность посещать биотоп регулярно, то желательно собирать новые субстраты не реже
одного раза в два месяца весной и летом и, соответственно, избавляться от старых.
Эффективность выведений имаго из субстрата зависит от численности личинок
в соответствующих биотопах. Например, ил с берега пруда, собранный с площади
30×30 см, обычно позволяет получить десятки или сотни имаго рода Culicoides. Од-
нако подушки влажных сфагновых мхов с болота, собранные с такой же площади,
позволяют получить лишь единичные экземпляры имаго. Тем не менее, во многих
случаях данная методика - единственный доступный способ получить материал имаго
мокрецов, проходящих развитие в конкретном биотопе.
2.4. Слепни
Личинки слепней (рис. 11А, 11Б) имеют характерный облик: веретеновидное
тело, как правило, с коротко заостренной вершиной брюшка. Головная капсула узкая,
удлиненная, почти полностью втянута в грудные сегменты. Брюшные сегменты имеют
валикообразные утолщения или выступы, служащие для передвижения, более выра-
женные на вентральной и латеральных поверхностях. Окраска личинок от беловато-
желтой и светло-зеленой до желтовато-коричневой, длина тела до 5 см. Куколки слепней
(рис. 11В) с удлиненно цилиндрическим телом, слегка выгнутым с дорсальной сто-
роны. Сбор куколок слепней затруднен из-за их низкой численности; куколки часто
повреждаются при сборе и оказываются непригодны для выведения имаго.
Личинки большинства видов слепней фауны России развиваются в заболоченных
и влажных почвах (в особенности, по берегам водоемов: по урезу воды и выше него),
а также в похожих субстратах. У немногих видов личинки живут преимущественно
в воде: в прибрежной зоне стоячих водоемов и на дне водотоков. Виды рода Chrysops
Meigen, 1803 (рис. 11А) развиваются в донных субстратах (песок, ил) на глубинах
до 2-3 м. Личинки некоторых видов рода Hybomitra Enderlein, 1922 (рис. 11Б) могут
встречаться у поверхности воды в прибрежных плотных зарослях растений. Водные
личинки слепней всегда перемещаются для окукливания к урезу воды или на сушу.
Основная сложность сбора личинок слепней состоит в том, что обычно их числен-
ность в природе невелика (из-за крупных размеров и преимущественно хищного образа
жизни). В связи с этим для сбора личинок приходится промывать значительные объемы
субстрата (почвы, торфа и т. п.), что требует затрат времени и физических усилий.
В воде личинок рекомендуется собирать гидробиологическим сачком. Его кон-
струкция аналогична таковой для сбора мокрецов, но предпочтительны диаметр ячеи
сетки мешка около 1 мм, а длина ручки сачка - около 2 м. При сборах со дна следует
обращать внимание на участки заиленного песка, в том числе и на песок, покрытый
слоем детрита, поскольку именно такие биотопы - типичные места обитания личинок
рода Chrysops. Для сбора личинок следует провести сачком по дну на протяжении
0.5-1 м, заглубляя нижний край обруча в наилок, песок или детрит на 2-3 см. Личинки
слепней могут обитать в водотоках под камнями на перекатах (особенно - в южных
158
регионах РФ). Для их сбора удобно переворачивать камни, установив сачок чуть ниже
по течению. При сборах из поверхностного слоя воды нужно обследовать прибрежные
стоячие участки с наиболее плотными зарослями растений, в особенности, места со
скоплениями растительных остатков у поверхности воды. Для этого сачком проводят
в поверхностном слое воды на протяжении 0.5-1 м.
Методика сбора материала из полуводных и наземных биотопов аналогична таковой
для личинок мокрецов. Плотные и обводненные почвенные субстраты следует брать
до глубины 5 см, менее плотные и менее влажные - до глубины 7-10 см. Как правило,
при обследовании одного биотопа необходимо собрать субстрат с площади от 0.25 до
2 м2, при этом удобно использовать лопату или совок для его отбора.
Относительно сухие субстраты (почву, торф, скопления влажных растительных
остатков и т. п.) можно разбирать без предварительной промывки. В этом случае мате-
риал размельчается и просматривается в кювете или на полиэтилене с использованием
пинцета.
Рисунок 11. Преимагинальные стадии слепней:
А - Chrysops Meigen, личинка сверху; Б - Hybomitra Enderlein, личинка сверху;
В - Hybomitra Enderlein, линочная шкурка куколки сбоку.
Figure 11. Immature horseflies: А - Chrysops Meigen, larva from above; Б - Hybomitra Enderlein,
larva from above; В - Hybomitra Enderlein, pupal skin (exuviae) from side.
159
Однако, в большинстве случаев только промывка субстрата обеспечивает полноцен-
ный сбор личинок. Учитывая значительный объем субстрата, может быть целесообразно
промывать его на берегу водоема у места сбора, предварительно выполаскивая субстрат
в ведре или тазу с водой. Мы рекомендуем промывать материал на ситах согласно
методике, охарактеризованной выше для мокрецов. Для промывки удобно использовать
сита диаметром 30 или 50 см; верхнее сито с размером ячейки 10 мм, нижнее - от 1 до
2 мм. Многие личинки слепней из-за крупных размеров хорошо видны на ситах уже
в процессе промывки. Их следует сразу собирать пинцетом и раскладывать по кон-
тейнерам (подробнее см. ниже). После промывки пробы нужно просмотреть материал
с верхнего сита (при его большом объеме - по частям в кювете с водой), а материал
с нижнего сита сложить в контейнер для более детального просмотра.
Небольшой объем промытого материала можно просматривать в кювете с водой.
Для извлечения личинок слепней из большего объема материала наиболее эффектив-
на флотация. Техника флотации аналогична таковой для мокрецов. Сначала личинок
необходимо собрать с поверхности флотационного раствора пинцетом и поместить
поодиночке в широкие контейнеры с небольшим количеством воды. Не следует остав-
лять контейнеры с личинками открытыми, учитывая, что личинки способны выползти
наружу.
Для выведения личинки помещаются поодиночке в широкие цилиндрические
стеклянные или пластиковые контейнеры объемом 60-250 мл (рис. 10А). Личинки
большинства слепней - хищники; если помещать более одного экземпляра в контей-
нер, то, как правило, выживает лишь одна личинка. Для содержания личинок удобны
емкости объемом около 90 мл, высотой примерно 7 см и диаметром 4 см. Контейнер
до половины заполняется влажным (но не обводненным) субстратом из мест сбора
личинки. Горловина контейнера должна быть закрыта мелкоячеистой тканью, плотно
фиксированной резинкой по краю. В качестве ткани лучше всего использовать газ, по-
скольку личинки способны пробуравить более мягкую ткань (бязь и т. п.) и выползти.
Другой вариант - прикрыть контейнеры крышками поверх ткани (сохраняя при этом
вентиляцию). Контейнеры этикетируют, указывая размер и окраску личинки.
Температурный режим при содержании личинок слепней должен приблизительно
соответствовать природному, но в любом случае температура не должна быть выше
20-25 °C. Материал следует хранить в тени, а в качестве корма 2-3 раза в месяц до-
бавлять в небольшом количестве резаных дождевых червей и более мелких олигохет,
личинок хирономид и комаров-долгоножек. Не реже раза в неделю контейнеры с ли-
чинками необходимо просматривать и удалять остатки корма, а раз в месяц желательно
заменять субстрат на новый. При этом необходимо соблюдать осторожность: если
личинка окуклилась, куколка может целиком находится внутри субстрата, и ее легко
повредить при манипуляциях.
В отличие от остальных слепней, личинки рода Chrysops не хищники, и их мож-
но содержать группами. Личинки рода Chrysops (рис. 11А) обычно имеют бледно-
160
зеленоватую окраску; они обитают на дне водоемов, в илистых и песчаных грунтах.
В воде они опускаются на дно, а не всплывают, как большинство других личинок
слепней. Этих личинок удобно содержать в широких контейнерах, которые использу-
ются для выведения мокрецов из субстрата (рис. 10Б). На дно контейнера помещается
песок и другой субстрат из места сбора личинок, добавляется вода до уровня 2-3 см.
Песок укладывается под уклон, таким образом, чтобы от 1/3 до половины площади
контейнера была с песком, не покрытым водой (в эту зону личинки выходят для
окукливания). Воду следует менять раз в неделю, детрит - раз в 2-3 недели; прочие
условия содержания аналогичны таковым для остальных слепней.
Работа по выведению личинок слепней может требовать значительного времени
(месяцы и годы); многие виды фауны России развиваются не менее 2-3 лет. Наиболь-
шее количество зрелых личинок можно собрать весной, поэтому для выведения имаго
целесообразно делать сборы в это время (так как многие личинки завершат развитие
в течение лета). Необходимо отбирать для выведения прежде всего более крупных
личинок длиной тела 2-3 см и более. Также представляют интерес и личинки среднего
размера (1-1.5 см), поскольку они могут относиться к другим, более мелким видам.
Более мелких личинок собирать для выведения нецелесообразно.
С конца осени до весны контейнеры с личинками следует поместить на 3-4 месяца
в темноту при температуре от 0 до +5 °C (пригоден бытовой холодильник, если мате-
риал не промерзает). В этот период личинок не нужно кормить, но следует периодиче-
ски проверять влажность субстрата, не допуская его подсыхания. Даже относительно
крупным личинкам может потребоваться более года для завершения развития. Стадия
куколки при комнатной температуре обычно длится от одной до трех недель (Соболе-
ва, 1977; Лутта, Быкова, 1982; и др.). При содержании в лаборатории обычно удается
вывести имаго лишь из части собранных личинок (от 1/3 до 3/4 от их общего числа).
Перелинявшее на имаго насекомое следует оставить в контейнере от 12 ч до суток
для полной склеротизации и окрашивания покровов. После этого имаго необходи-
мо заморить, поместив в течение 2-3 мин в контейнер вату, смоченную токсичной
жидкостью, затем наколоть на булавку (предпочтительный вариант) или сохранить
в 80-85 %-ном этаноле (см. раздел «Фиксация….»).
Как правило, после линьки на имаго шкурка куколки (рис. 11В) остается отчасти
погруженной в субстрат или лежит на его поверхности. Шкурку удобно извлечь из
контейнера пинцетом, при этом необходимо не потерять ее лобный щит. Затем следует
осторожно отмыть шкурку от грязи в воде мягкой кисточкой, после чего сохранить
в пробирке с в 80-85 %-ным этанолом. Также можно высушить и подколоть шкурку
на булавку с имаго (соблюдая при этом осторожность, чтобы не поломать шкурку) или
же приклеить шкурку на кусок картона, подколотый на ту же булавку.
Шкурку личинки найти сложнее; она практически всегда находится в сморщенном
состоянии, имеет беловатую окраску и уверенно опознается по темной удлиненной
головной капсуле. Зачастую шкурка личинки располагается под субстратом или сбоку
161
от него, либо в нижней части хода, проделанного куколкой. Иногда поиску помогает
погружение субстрата в воду: в ряде случаев шкурка всплывает на поверхность воды.
Обнаруженную шкурку следует аккуратно извлечь пинцетом, слегка отмыть мягкой
кисточкой в воде и сохранить в пробирке с 80-85 %-ным этанолом. Пробирку этикети-
руют таким же образом, как и смонтированное имаго (при необходимости, экземпляру
присваивают уникальный номер).
Более подробно методики сбора личинок и выведения имаго слепней описаны
Луттой (1970), Скуфьиным (1973) и Соболевой (1977).
ФИКСАЦИЯ И ХРАНЕНИЕ МАТЕРИАЛА4
1. Имаго
Имаго кровососущих комаров можно хранить как в сухом наколотом виде, так и
в этаноле. Взрослых особей мошек и кровососущих мокрецов предпочтительно сохра-
нять в виде спиртовых фиксаций, а слепней - в сухом наколотом виде. При большом
объеме сборов или при отсутствии возможности монтировать материал на булавки
в день сбора, экземпляры слепней допускается укладывать на ватные матрасики. Ма-
трасики со свежим материалом необходимо регулярно проветривать до его полного
высыхания, в дальнейшем хранить в плотно закрытых коробках. Для кровососущих
комаров, мошек и мокрецов мы не рекомендуем данный метод хранения материала.
1.1. Хранение материала имаго в сухом виде и его монтировка
Накалывать двукрылых на энтомологические булавки лучше всего непосредственно
после их сбора, пока они не высохли. Извлеченных из морилки насекомых распола-
гают на бумаге или ткани дорсальной стороной вверх, после чего аккуратно, слегка
придерживая энтомологическим пинцетом, прокалывают булавкой центральную часть
среднеспинки. Допускается накалывание кровососущих комаров и мошек в боковые
участки груди (аналогично накалыванию в среднеспинку). Для кровососущих комаров,
мокрецов и мошек целесообразно использовать самые тонкие булавки - минуции и
№ 00 и 0, для слепней - более толстые: № 1 и 2. Кровососущих комаров следует на-
калывать очень осторожно, не допуская повреждения чешуек груди и брюшка.
При накалывании необходимо следить за тем, чтобы булавка вышла из тела на-
секомого между тазиками средних ног. После этого прокалывают бумагу или ткань,
располагая насекомое на расстояние до 2/3 длины булавки (минуции - до 1/2, рис. 12).
Минуцию с наколотым экземпляром подкалывают на небольшой кусок пористого мате-
риала (пенополиэтилен и т. п.), который в свою очередь прокалывают энтомологической
булавкой (№ 2 или 3), на которую помещают этикетку с информацией по образцу:
Ленинградская обл., Ломоносовский р-н, окр. н. п. Большая Ижора,
59.928188, 29.539955, смешанный лес
Иванов С.М. 21.05.2017
4 В этот раздел включена информация о хранении материала в сухом виде и в фиксирующих
жидкостях. Вопросы защиты материала от поедания, влажности и т. п. нами не рассматриваются.
162
Рисунок 12. Экземпляр мошки, наколотый на минуцию.
Figure 12. Black fly pinned on a minuten pin.
При накалывании свежих экземпляров слепней (кроме мелких слепней - дождевок
и пестряков) целесообразно тонким пинцетом слегка (на 1-2 мм) аккуратно вытянуть
наружу вершину брюшка (рис. 13). Обычно она бывает несколько втянута и прикры-
та сверху и снизу уплощенными, гораздо более крупными и широкими склеритами
предвершинных сегментов. После вытягивания вершины брюшка самки становятся
хорошо видны парные церки (обычно они имеют более-менее полукруглую форму) и
непарная субгенитальная пластинка (находится у вершины брюшка с нижней стороны).
Форма данных структур имеет диагностическое значение для многих видов слепней,
163
поэтому предварительная подготовка экземпляров при накалывании существенно об-
легчает работу по их определению в дальнейшем.
Рисунок 13. Tabanus Linnaeus, слепень, самка, 7-10-й членики брюшка сбоку
(по: Олсуфьев, 1977): 7с-9с - стерниты 7-9 члеников брюшка;
8т-10т - тергиты 8-10 члеников брюшка; с.п - субгенитальная пластинка; ц - церки.
Figure 13. Tabanus Linnaeus, horsefly, female: abdominal segments 7-10, lateral view
(Olsufʼev, 1977).
Наколотых двукрылых помещают в герметичные деревянные или пластиковые
ящики с мягким (прокалываемом булавками) дном (рис. 14).
1.2. Фиксация и хранение имаго в этаноле
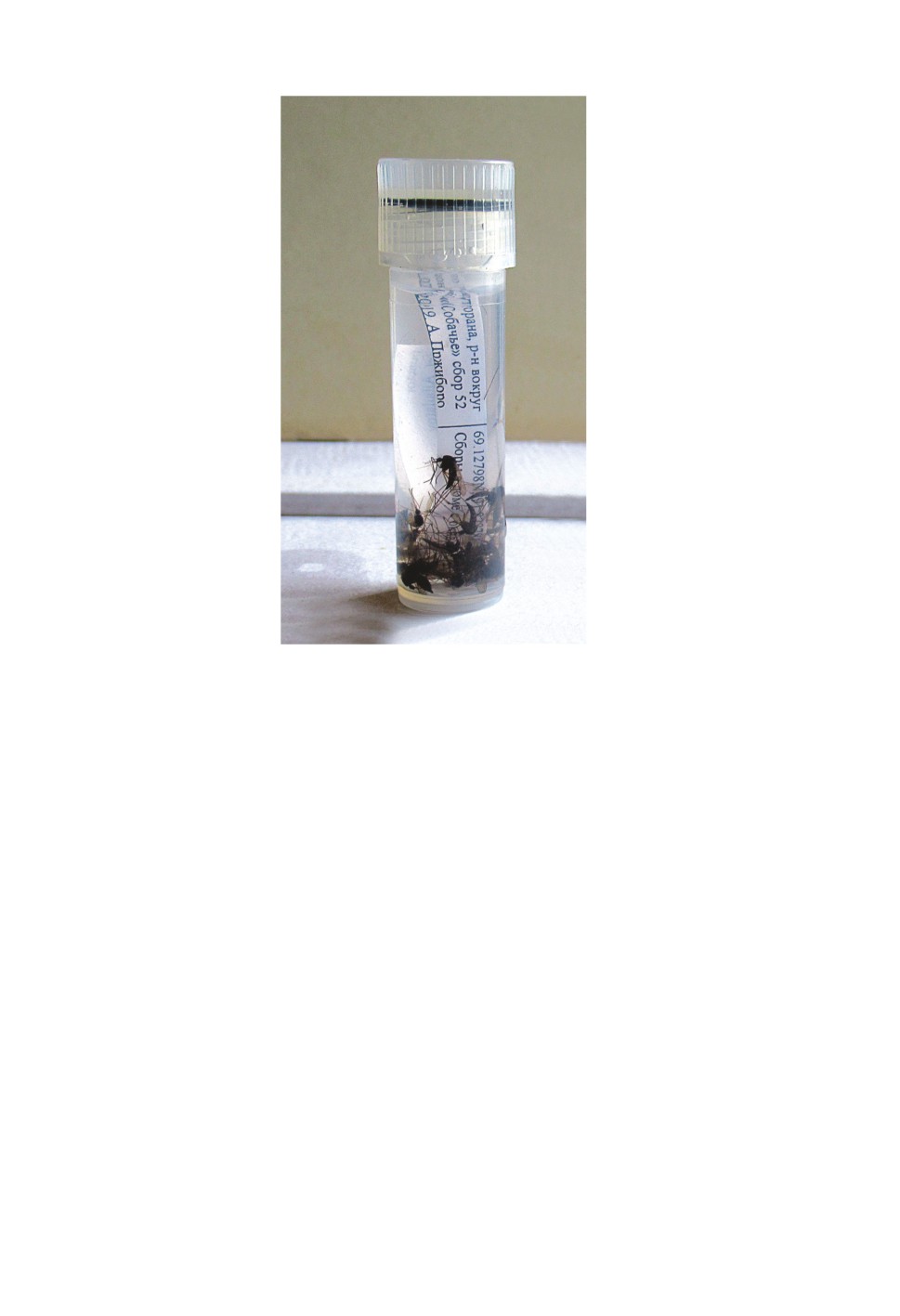
Для хранения материала в этаноле применяется 80-85 %-ный водный раствор эта-
нола (для мошек предпочтителен 90 %-ный этанол). Рекомендуется заливать этанол
комнатной температуры в пробирки примерно на 3/4 от их высоты (рис. 15). При этом
желательно, чтобы фиксируемые объекты занимали не более 1/3 от объема жидкости
в пробирке. Объем пробирки зависит от количества и размера насекомых. Для мокре-
цов и мошек, как правило, удобны пробирки емкостью 2-2.5 мл, для кровососущих
комаров - от 2 до 5 мл, для слепней - 5 мл и более. На груди и брюшке кровососущих
комаров расположены чешуйки, имеющие большое значение для диагностики видов.
Данные чешуйки легко утрачиваются, поэтому не следует помещать много экземпляров
в одну пробирку, а также использовать пробирки большого объема. Для длительного
хранения спиртового материала следует использовать пробирки с завинчивающейся
крышкой, снабженной резиновым уплотнительным кольцом (например, производителя
164
Sarstedt). В пробирку следует поместить этикетку по образцу (приведен выше). Для
наколотого материала удобно распечатывать этикетку на принтере. Для спиртового
материала рекомендуется тушевые этикетки на кальке (для длительного хранения) и
распечатанные на принтере этикетки (для временного хранения).
Спиртовые сборы следует хранить в темноте во избежание выцветания материала.
Если предполагается использовать спиртовые сборы для молекулярных исследований,
желательно хранить их в морозильной камере холодильника при температуре ниже 0 °С.
Рисунок 14. Коробка для наколки насекомых.
Figure 14. Storage box with pinned insects.
165
Рисунок 15. Пробирка с насекомыми, фиксированными в этаноле.
Figure 15. Vial with insects kept in ethanol.
2. Преимагинальные стадии
Личинок и куколок кровососущих двукрылых фиксируют в 80-85 %-ном водном
растворе этанола (для морфологического или молекулярного исследования) или в све-
жеприготовленной жидкости Карнуа (для цитогенетического исследования личинок;
см. ниже). Не следует помещать в одну пробирку большое количество экземпляров,
а объекты должны составлять не более 1/3 от объема фиксирующей жидкости. После
фиксации материала в пробирку помещают этикетку по образцу, приведенному выше.
Через 10-15 мин после фиксации в жидкости Карнуа необходимо переложить весь
собранный материал в другую пробирку того же размера, также содержащую жидкость
Карнуа. Жидкость из первой пробирки можно вылить, а пробирку промыть и использо-
вать повторно. В пробирку нужно поместить этикетку по образцу, приведенному выше.
Хранить пробирки с материалами в жидкости Карнуа следует в темном прохлад-
ном месте. Рекомендуется поместить эти пробирки в бытовую морозильную камеру,
а непосредственно перед этим повторить процедуру перекладки.
Часть личинок слепней, предназначенных для морфологического исследования,
желательно фиксировать в горячей воде и сохранять отдельно. Для этого личинку бе-
166
рут пинцетом и погружают на 3-5 с в горячую воду (70-80 °C), после чего переносят
в этанол. При такой фиксации личинки меняют окраску, но лучше расправляются;
последнее полезно для их дальнейшего определения.
3. Фиксация для вирусологического
или бактериологического исследований
Материал, предназначенный для вирусологического или бактериологического иссле-
дований, следует хранить при низких температурах, причем необходимо замораживать
кровососущих двукрылых (как имаго, так и преимагинальные стадии) прижизненно.
Исследуемый объект помещается поодиночке или группами в пластиковые пробир-
ки (2-5 мл), пробирки помещаются в зип-пакеты с этикеткой. Пакеты складываются
в пластиковые контейнеры, которые хранятся в морозильной камере при температуре
от -20 до -80 °С, в зависимости от дальнейших целей.
ЗАКЛЮЧЕНИЕ
Охарактеризованные методики сбора и фиксации материала насекомых комплекса
гнуса, на наш взгляд, наиболее рациональны для морфологического, молекулярного и
цитогенетического исследований, в том числе для видовой диагностики. Большинство
методов, описанных в нашей статье, в целом не оригинальны и ранее использовались
многими авторами (например, Гуцевич и др., 1970; Глухова, 1979, 1989; Скуфьин, 1973;
Лутта, 1970; Silver, 2008; Будаева, Хицова, 2012; Kirk-Spriggs, 2017; Field sampling
methods…, 2018).
Вместе с тем, некоторые методики, хотя и были известны ранее, детально разработа-
ны и подробно описаны авторами настоящей статьи. Например, это методика выведения
имаго из субстратов и методика сбора личинок и куколок с использованием флотации,
разработанные А.А. Пржиборо. Во многие другие методы нами внесены некоторые
изменения в сравнении с тем, что описано в известной нам литературе, благодаря
чему возможно более эффективно проводить сборы материала и выведение имаго.
Так, для отлова личинок и куколок кровососущих комаров мы рекомендуем ис-
пользовать бытовое сито (Халин, Айбулатов, 2012; 2013), а не водный сачок, как, на-
пример, рекомендует Гуцевич с соавт. (1970). Манипулировать ситом в большинстве
водоемов гораздо удобнее, кроме того, из сита легче извлекать отловленных насеко-
мых в контейнере с водой. В ходе индивидуального выплода имаго из личинок, на
наш взгляд, удобнее не нумеровать емкости для выведения и пробирки с линочными
шкурками, а по мере линьки на куколку и на имаго фиксировать шкурки в пробирке и
подцеплять ее к стаканчику резинкой. В целом фиксация линочных шкурок, как и сам
индивидуальный выплод имаго сем. Culicidae, не получили широкого распространения
у отечественных исследователей (Гуцевич и др., 1970); мы же считаем использование
данной методики оправданным. Кроме того, если брать про запас достаточное коли-
чество воды из водоемов развития личинок кровососущих комаров для ее замены,
можно довести личинок от младших возрастов до имаго.
167
При сборе личинок мокрецов и слепней удобнее предварительно выполаскивать
субстраты в ведре или в тазу с водой, а затем проводить промывку почвы и береговых
субстратов на ситах. Такая методика более щадящая по сравнению с прямой промыв-
кой на ситах и позволяет сохранить большее число экземпляров в неповрежденном
виде. Помимо этого, проводить индивидуальный выплод личинок мокрецов оказалось
удобнее в чашках Петри и широких пластиковых контейнерах, а не в часовых стеклах.
Для дальнейшего изготовления препаратов мы рекомендуем фиксировать большую
часть материала в спирте (самцы кровососущих комаров, мошки и мокрецы обоих
полов), а не накалывать на энтомологические булавки.
БЛАГОДАРНОСТИ
Авторы благодарят д.б.н. Э.П. Нарчук (ЗИН РАН) и к.б.н. И.А. Будаеву (Воро-
нежский государственный университет) за просмотр рукописи и ценные замечания,
а также Е.Ю. Кирцидели (Санкт-Петербург) за предоставление фотографий личинки
и имаго мошек.
Работа выполнена на базе коллекции Зоологического института РАН (ЗИН РАН)
(УФК ЗИН рег. No 2-2.20). Работа А.В. Халина и С.В. Айбулатова выполнена при
поддержке Гос. темы АААА-А19-119020790133-6. Работа А.А. Пржиборо выполне-
на при частичной финансовой поддержке РФФИ (грант 18-04-00988) и Гос. темы
АААА-А19-119020690091-0.
СПИСОК ЛИТЕРАТУРЫ
Бошко Г.В. 1973. Гедзi (Diptera, Tabanidae). Фауна Украiны. Киiв, Наукова Думка, т. 13, вип. 4, 207 с. [Boshko
G.V. 1973. Gedzi (Diptera, Tabanidae). Fauna Ukrainy (Horseflies. Fauna of Ukraine). Kiev, Naukova
Dumka, Vol. 13, No. 4, 207 pp. (in Ukrainian)].
Будаева И.А., Хицова Л.Н. 2012. Методы изучения экологии имаго кровососущих двукрылых. Воронеж,
Издательско-полиграфический центр Воронежского Государственного Университета, Часть 1. 56
с. [Budaeva I.A., Khitsova L.N. 2012. Metody izucheniya ekologii imago krovososushchikh dvukrylykh
(Methods for the ecology studying of adult bloodsucking dipterans). Voronezh, Izdatelʼsko-poligraficheskiy
tsentr Voronezhskogo Gosudarstvennogo Universiteta, Part 1, 56 pp. (in Russian)].
Глухова В.М. 1979. Личинки мокрецов подсемейств Palpomyinae и Сeratopogoninae фауны СССР (Diptera,
Ceratopogonidae = Heleidae). Л.: Наука, 231 с. [Glukhova V.M. 1979. Lichinki mokretsov podsemeystv
Palpomyinae i Seratopogoninae fauny SSSR (Diptera, Ceratopogonidae = Heleidae) (Larvae of biting midge
of the subfamilies Palpomyinae and Ceratopogoninae of the USSR fauna). L.: Nauka, 231 pp. (in Russian)].
Глухова В.М. 1989. Кровососущие мокрецы родов Culicoides и Forcipomyia (Ceratopogonidae). Фауна СССР.
Двукрылые. М., Л., Изд-во АН СССР, т. 3, вып. 5а, 408 с. [Glukhova V.M. 1989. Krovososushchie
mokretsy rodov Culicoides i Forcipomyia (Ceratopogonidae). Fauna SSSR. (Blood-sucking midges of the
genera Culicoides and Forcipomyia. Fauna of the USSR). Dvukrylye. M., L., Izd-vo AN SSSR, Vol. 3,
No. 5a, 408 pp. (in Russian)].
Голуб В.Б., Цуриков М.Н., Прокин А.А. 2012. Коллекции насекомых: сбор, обработка и хранение материа-
ла. М., Товарищество научных изданий КМК, 339 с. [Golub V.B., Tsurikov M.N., Prokin A.A. 2012.
Kollektsii nasekomykh: sbor, obrabotka i khranenie materiala (Insect collections: sampling, preparing and
storage of material). M., Tovarishchestvo nauchnykh izdaniy KMK, 339 pp. (in Russian)].
168
Горностаев Г.Н. 1984. Введение в этологию насекомых-фотоксенов (лет насекомых на искусственные ис-
точники света). Этология насекомых. Труды Русского энтомологического общества 66: 101-167.
[Gornostaev G.N. 1984. Vvedenie v etologiyu nasekomykh-fotoksenov (let nasekomykh na iskusstvennye
istochniki sveta). Etologiya nasekomykh (Introduction to the ethology of insects flying to light: collecting
insects on artificial light sources. Ethology of insects). Trudy Russkogo entomologicheskogo obshchestva
66: 101-167 (in Russian)].
Гуцевич А.В. 1956. Мокрецы - кровососущие двукрылые семейства Heleidae. М., Л., Издательство АН
СССР, 52 с. [Gutsevich A.V. 1956. Mokretsy - krovososushchie dvukrylye semeystva Heleidae (Biting
midge - bloodsucking dipterans of the family Heleidae). M., L., Izdatelʼstvo AN SSSR, 52 pp. (in Russian)].
Гуцевич А.В., Глухова В.М. 1970. Методы сбора и изучения кровососущих мокрецов. Методы паразитоло-
гический исследований № 3. Л., Наука, 103 с. [Gutsevich A.V., Glukhova V.M. 1970. Metody sbora i
izucheniya krovososushchikh mokretsov. Metody parazitologicheskiy issledovaniy № 3 (Methods of collecting
and studying for biting midges. Methods of parasitological research No. 3). L., Nauka, 103 pp. (in Russian)].
Гуцевич А.В., Мончадский А.С., Штакельберг А.А. 1970. Фауна СССР. Насекомые двукрылые. Комары сем.
Culicidae. Л.: Наука, Т. 3, вып. 4, 384 c. [Gutsevich A.V., Monchadsky A.S., Stackelberg A.A. 1970. Fauna
SSSR. Nasekomye dvukrylye (Fauna of the USSR. Insecta, Diptera), Komary sem. Culicidae (Mosquitoes,
Family Culicidae), Leningrad: Nauka, Vol. 3, Issue 4, 384 pp. (in Russian)].
Иващенко Л.А. 1977. Лабораторное содержание личинок кровососущих мошек. Насекомые - переносчики
заразных заболеваний. Иваново, 65-67. [Ivashchenko L.A. 1977. Laboratornoe soderzhanie lichinok
krovososushchikh moshek. Nasekomye - perenoschiki zaraznykh zabolevaniy (Laboratory cultivation of
black fly larvae. Insects - vectors of infectious diseases). Ivanovo, 65-67 (in Russian)].
Каплич В.М., Скуловец М.В. 2000. Кровососущие мошки (Diptera, Simuliidae) Беларуси. Минск, 365 с.
[Kaplich V.M., Skulovets M.V. 2000. Krovososushchie moshki (Diptera, Simuliidae) Belarusi. (Bloodsuck-
ing black-flies of Belarus). Minsk, 365 pp. (in Russian)].
Лиховоз Л.К. 1980. К вопросу методики лабораторного содержания личинок мошек. Тезисы докладов 9
конференции украинского паразитологического общества. Киев, Наукова думка, 49-50.
[Likhovoz
L.K. 1980. K voprosu metodiki laboratornogo soderzhaniya lichinok moshek. Tezisy dokladov 9 konfe-
rentsii ukrainskogo parazitologicheskogo obshchestva (On the methods of laboratory cultivation of biting
midge larvae. Abstracts of the 9th conference of the Ukrainian parasitological society). Kiev, «Naukova
dumka», 49-50 (in Russian)].
Лутта А.С. 1970. Слепни (Diptera, Tabanidae) Карелии. Л., Наука, 304 с. [Lutta A.S. 1970. Slepni (Diptera,
Tabanidae) Karelii (Horseflies of Karelia). L., Nauka, 304 pp. (in Russian)].
Лутта А.С., Быкова Х.И. 1982. Слепни (сем. Tabanidae) Европейского Севера СССР. Л., Наука, 184 с. [Lutta
A.S., Bykova Kh.I. 1982. Slepni (sem. Tabanidae) Evropeyskogo Severa SSSR (Horseflies of the European
North of the USSR). L., Nauka, 184 pp. (in Russian)].
Малькова М.Г., Якименко В.В., Винарская Н.П., Немчинова Н.Н., Михайлова О.А. 2013. Кровососущие ко-
мары Западной Сибири: фауна, систематика, особенности экологии, методы полевых и лабораторных
исследований: методическое пособие. Омск, ООО ИЦ «Омский научный вестник», 80 с. [Malʼkova
M.G., Yakimenko V.V., Vinarskaya N.P., Nemchinova N.N., Mikhaylova O.A. 2013. Krovososushchie komary
Zapadnoy Sibiri: fauna, sistematika, osobennosti ekologii, metody polevykh i laboratornykh issledovaniy:
metodicheskoe posobie (Mosquitoes of Western Siberia: fauna, taxonomy, ecology, methods of collecting
and preparing: a methodological guide). Omsk, OOO ITs «Omskiy nauchnyy vestnik», 80 pp. (in Russian)].
Мирзаева А.Г. 1967. К методике отлова и учета кровососущих мокрецов. Итоги исследования по проблеме
борьбы с гнусом. Новосибирск. Наука: Сибирское отделение, 168-176. [K metodike otlova i ucheta
krovososushchikh mokretsov. Itogi issledovaniya po probleme borʼby s gnusom (To the sampling method
for biting midges. Results of the study on control of bloodsucking dipterans). Novosibirsk. Nauka: Sibirskoe
otdelenie, 168-176 (in Russian)].
169
Мончадский А.С. 1952. Летающие кровососущие двукрылые - гнус (Способы защиты и методы исследо-
вания). М., Л., издательство АН СССР, 68 с. [Monchadskiy A.S. 1952. Letayushchie krovososushchie
dvukrylye - gnus (Sposoby zashchity i metody issledovaniya) (Flying bloodsucking dipterans: control and
research methods). M., L., izdatelʼstvo AN SSSR, 68 pp. (in Russian)].
Нарчук Э.П. 2003. Определитель семейств двукрылых насекомых (Insecta: Diptera) фауны России и со-
предельных стран с кратким обзором семейств мировой фауны. Труды Зоологического института 294,
250 с. [Nartshuk E.P. 2003. Opredelitelʼ semeystv dvukrylykh nasekomykh (Insecta: Diptera) fauny Rossii i
sopredelʼnykh stran s kratkim obzorom semeystv mirovoy fauny (Key to families of Diptera (Insecta) of the
fauna of Russian and adjacent countries). Trudy Zoologicheskogo instituta, Vol. 294, 250 pp. (in Russian)].
Олсуфьев Н.Г. 1977. Слепни. Семейство Tabanidae. Фауна СССР. Насекомые двукрылые. Л., Наука, Т. 7, вып.
2, 435 c. [Olsuf’ev N.G. 1977. Slepni. Semeystvo Tabanidae. Fauna SSSR. Nasekomye dvukrylye (Horseflies.
The family Tabanidae. Fauna of the USSR. Diptera insects). L., Nauka, Vol. 7, No. 2, 435 pp. (in Russian)].
Павловский Е.Н. 1927. Наставление к собиранию, исследованию и сохранению комаров (Culicidae). На-
ставления для собирания зоологический коллекций, издаваемые Зоологическим музеем Академии
Наук СССР. Л., Издательство АН СССР, Т. 14, 76 с. [Pavlovskiy E.N. 1927. Nastavlenie k sobiraniyu,
issledovaniyu i sokhraneniyu komarov (Culicidae). Nastavleniya dlya sobiraniya zoologicheskiy kollektsiy,
izdavaemye Zoologicheskim muzeem Akademii Nauk SSSR (Instructions for the collection, research, and
fixation of mosquitoes. Guidelines for sampling of Zoological collections published by the Zoological
Museum of the USSR Academy of Sciences). L., Izdatelʼstvo AN SSSR, Vol. 14, 76 pp. (in Russian)].
Панкратова В.Я. 1970. Личинки и куколки комаров подсемейства Orthocladiinae фауны СССР (Diptera,
Chironomidae = Tendipedidae). Определители по фауне СССР, издаваемые Зоологическим институтом
АН СССР, Л.: Наука, Т. 102, 344 с. [Pankratova V.Ya. 1970. Lichinki i kukolki komarov podsemeystva
Orthocladiinae fauny SSSR (Diptera, Chironomidae = Tendipedidae). Opredeliteli po faune SSSR, izdavae-
mye Zoologicheskim institutom AN SSSR, L.: Nauka, Vol. 102, 344 pp. (in Russian)].
Пржиборо А.А. 2001. Экология и роль бентосных двукрылых (Insecta: Diptera) в прибрежных сообще-
ствах малых озер Северо-Запада России: дис. … канд. биол. наук. СПб., 291 с. [Przhiboro A.A. 2001.
Ekologiya i rolʼ bentosnykh dvukrylykh (Insecta: Diptera) v pribrezhnykh soobshchestvakh malykh ozer
Severo-Zapada Rossii (Ecology and role of benthic Diptera in nearshore communities of small lakes in
Northwestern Russia). PhD dissertation. SPb., 291 pp. (in Russian)].
Пржиборо А.А. 2012. Водные и околоводные макробеспозвоночные и количественная оценка их обилия.
Экосистемы заказника «Раковые озера»: история и современное состояние. В кн.: Н.П. Иовченко
(ред). Труды Санкт-Петербургского общества естествоиспытателей. Сер. 6. Т. 6. СПб, 53-65, 208,
252-272. [Przhiboro A.A. 2011. Aquatic and shore macroinvertebrates and assessment of their abundance.
Ecosystems of the nature reserve “Lakes Rakovye”: History and present state. In: N.P. Iovchenko (ed.).
Proceedings of St Petersburg Society of Naturalists. Ser. 6. Vol. 6. SPb, 53-65, 208, 252-272. (in Russian)].
Расницын С.П. 1974. Методы сбора и количественного учета кровососущих двукрылых (гнуса). В кн.: В.П.
Дербенева-Ухова (ред.) Руководство по медицинской энтомологии. М., Медицина, 163-176. [Rasnitsyn
S.P. 1974. Metody sbora i kolichestvennogo ucheta krovososushchikh dvukrylykh (gnusa) (Sampling methods
for bloodsucking dipterans). In: V.P. Derbeneva-Ukhova (ed.). Rukovodstvo po meditsinskoy entomologii
(Guide to medical entomology). M., Meditsina, 163-176. (in Russian)].
Рубцов И.А. 1956. Методы изучения мошек. М., Л., 55 с. [Rubtsov I.A. 1956. Metody izucheniya moshek
(Methods for studying of black flies). M., L., 55 pp. (in Russian)].Рубцов И.А. 1956a. Мошки (сем. Simu-
liidae). Фауна СССР. Л., Т. 6. вып. 6, 2-е изд., 860 с. [Rubtsov I. A. 1956a. Moshki (sem. Simuliidae).
Fauna SSSR (Black flies. Fauna of the USSR). L., Vol. 6, No. 6, Second edition, 860 pp. (in Russian)].
Скуфьин К.В. 1973. Методы сбора и изучения слепней. Методы паразитологических исследований 8. Л.:
Наука, 103 с. [Skuf’in K.V. 1973. Metody sbora i izucheniya slepney. Metody parazitologicheskikh issle-
dovaniy 8 (Methods of collecting and studying for horse flies. Methods of parasitological research 8). L.:
Nauka, 103 pp. (in Russian)].
170
Соболева Р.Г. 1977. Биология слепней Приморского края. М.: Наука, 200 с. [Soboleva R.G. 1977. Biologiya
slepney Primorskogo kraya (Biology of horseflies in the Primorsky Territory). M.: Nauka, 200 pp. (in
Russian)].
Филиппов Д.А., Прокин А.А., Пржиборо А.А. 2017. Методы и методики гидробиологического исследования
болот: учебное пособие. Тюмень: Издательство Тюменского государственного университета. 208 с.
[Philippov D.A., Prokin A.A., Przhiboro A.A. 2017. Metody i metodiki gidrobiologicheskogo issledovaniya
bolot: uchebnoe posobie (Methods and methodology of hydrobiological studies for wetlands: a training
manual). Tyumenʼ: Izdatelʼstvo Tyumenskogo gosudarstvennogo universiteta. 208 pp. (in Russian)].
Халин А.В., Айбулатов С.В. 2012. Новая методика исследования склеритов груди кровососущих комаров
(Diptera: Culicidae) для точной диагностики родов и видов. Паразитология 46 (4): 253-259. [Khalin
A.V., Aibulatov S.V. 2012. A new technique for the study of thoracic sclerites of mosquitoes (Diptera, Cu-
licidae) allowing correct identification of genera and species. Parazitologiya 46 (4): 253-259 (In Russian;
Халин A.B., Айбулатов С.В. 2013. Перспективы использования методики индивидуального выплода кро-
вососущих комаров (Diptera Culicidae). Материалы конференции «Фундаментальные и прикладные
аспекты изучения паразитических членистоногих в XXI веке» памяти члена-корреспондента РАН
Ю.С. Балашова. Россия, Санкт-Петербург, 21-25 октября 2013 г. СПб., 158-161. [Khalin A.V., Aibulatov
S.V. 2013. The perspective of the individual rearing of immature stages of mosquitoes (Diptera Culicidae).
International conference in memoriam of Prof. Yuri S. Balashov, a corresponding member of the RAS:
«Fundamental and applied aspects of the study of parasitic arthropods in the XXI century». Russia, St.
Petersburg, 21-25 October, 2013, 158-161. (In Russian)].
Чубарева Л.А., Петрова Н.А. 2008. Цитологические карты политенных хромосом и некоторые особенности
кровососущих мошек России и сопредельных стран (Diptera: Simuliidae). СПб., М., Товарищество
научных изданий КМК, 135 с. [Chubareva L.A., Petrova N.A. 2008. Tsitologicheskie karty politennykh
khromosom i nekotorye osobennosti krovososushchikh moshek Rossii i sopredelʼnykh stran (Diptera: Simu-
liidae) (Cytological maps of polytene chromosomes and some features of black flies in Russia and adjacent
countries). SPb, M., Tovarishchestvo nauchnykh izdaniy KMK, 135 pp. (In Russian)].
Шевченко В.В. 1961. Слепни Казахстана (Diptera, Tabanidae). Алма-Ата, Издательство АН Казахской ССР,
327 с. [Shevchenko V.V. 1961. Slepni Kazakhstana (Diptera, Tabanidae) (Horseflies of Kazakhstan). Alma-
Ata, Izdatelʼstvo AN Kazakhskoy SSR, 327 pp. (In Russian)].
Штакельберг А.А. 1969. Определитель насекомых европейской части СССР. Определители по фауне СССР,
издаваемые Зоологическим институтом АН СССР. Двукрылые, блохи. Л., Наука, Т. 5, Вып. 100, Ч. 1,
808 с. [Stackelberg A.A. Keys to the insects of the European part of the USSR. Keys to the fauna of the
USSR, published by the Zoological Institute of the USSR Academy of Sciences. Diptera, Siphonaptera. L.,
Nauka, Vol. 5, No. 100, Part 1, 808 pp. (In Russian)].
Adler P.H., Currie D.C., Wood M.D. 2004. The black flies (Simuliidae) of North America. New York, Ithaca, 940 pp.
Becker N., Petric D., Zgomba M., Boase C., Madon, M., Dahl C., Kaiser A. 2010. Mosquitoes and their control.
Brown B.V. 2021. Sampling methods for adult flies (Diptera). In: J.C. Santos, G.W. Fernandes (Eds). Mea-
suring arthropod biodiversity. A handbook of sampling methods. Cham, Springer: 187-204. https://doi.
org/10.1007/978-3-030-53226-0
Blanton F.S., Wirth W.W. 1979. Arthropods of Florida and neighboring land areas. 10. The sandflies (Culicoi-
des) of Florida (Diptera: Ceratopogonidae). Gainesville, Florida Department of Agriculture and Consumer
Services. 204 pp.
Campbell J.A., Pelham-Clinton E.C. 1960. A taxonomic review of the British species of Culicoides Latreille
(Diptera, Ceratopogonidae). Proceedings of the Royal Society of Edinburgh, Section B: Biological Sciences
171
Chandler P.J. (ed.). 2010. A dipterist’s handbook (2nd edition). The Amateur Entomologist. The Amateur Ento-
mologists Society, Vol. 15, 525 pp.
Ciborowski J.J.H., Craig D.A. 1989. Factors influencing dispersion of larval black flies (Diptera: Simuliidae):
effects of current velocity and food concentration. Canadian Journal of Fisheries and Aquatic Sciences 46
Colbo M.H., Thompson B.H. 1978. An efficient technique for laboratory rearing of Simulium verecundum S. & J.
Crisp G., Lloyd L. 1954.The community of insects in a patch of woodland mud. Transactions of the Royal Ento-
Eiras Á.E., de Almeida Batista E.P., de Resende M.C. 2021. Sampling methods for blood-feeding insects diversity.
In: J.C. Santos, G.W. Fernandes (Eds). Measuring arthropod biodiversity. A handbook of sampling methods.
Field sampling methods for mosquitoes, sandflies, biting midges and ticks. 2018.VectorNet project 2014-2018.
files/documents/Vector-sampling-field-protocol-2018.pdf (14 декабря 2020).
Fredeen F.J.H. 1961. A trap for studying the attacking behaviour of black flies, Simulium arcticum Mall. Canadian
Gonzalez de Heredia M., Goldarazena Lafuente A. 2011. El Genero Culicoides en el Pais Vasco: Guia practica
para su identificacion y control. Vitoria-Gasteiz, Published by Servicio Central de Publicaciones del Go-
bierno Vasco, 247 pp.
Itämies J., Kuusela K. 1976. Black flies (Dipt., Simuliidae) collected with a light-trap on the outermost island
outside Rauma (SW Finland). Annales Zoologici Fennici 42 (1): 33-37.
Kirk-Spriggs A.H. 2017. Collection and preservation of Diptera. In: A.H. Kirk-Spriggs, B.J. Sinclair (eds). Manual
of Afrotropical Diptera. Pretoria, South Africa National Biodiversity Institute. Vol. 1, 425 pp.
Laird M., Aubin A., Belton P., Chance M.M., Fredeen F.J.H., Haufe W.O., Hynes H.B.N., Lewis D.J., Lindsay
I.S., McLean D.M., Surgeoner G.A., Wood D.M., Sutton M.D. 1982. Biting flies in Canada: health ef-
fects and economic consequences. National Research Council of Canada Publication No. 19248, Ottawa,
Ontario, 157 pp.
Lane R.P., Crosskey R.W. (Eds) 1993. Medical insects and arachnids. London: Chapman and Hall, xv + 723 pp.
Martin J.E.H. 1977. Collecting, preparing and preserving insects, mites and spiders. The insects and arachnids of
Canada. Part 1. Research Branch Canada Department of Agriculture, Publication 1643. Ottawa: Biosyste-
matics Research Institute, 182 pp.
Oldroyd H. 1970. Collecting, preserving and studying insects. London: Hutchinson, Second edition, 336 pp.
Rigot T., Gilbert M. 2012. Quantifying the spatial dependence of Culicoides midge samples collected by Onderste-
poort-type blacklight traps: an experimental approach to infer the range of attraction of light traps. Medical
Service M.W. 1976. Mosquito ecology. Field sampling methods. London, Applied Science Publishers Ltd, 582 pp.
Schauff M.E. (ed.). 2002. Collecting and preserving insects and mites: techniques and tools. Washington: Systematic
CollectingandPreservingInsectsandMites/collpres.pdf (14 декабря 2020).
Silver J.B. 2008. Mosquito ecology. Field sampling methods. Dordrecht, Springer, Third edition [Internet], 1500
Stubbs A.E. 2003. Dipterists forum starter pack. Huntingdon, Biological Records Centre. 89 pp. Режим доступа:
172
Takaoka H. 1985. Observations on the mating, blood feeding and oviposition of Simulium takahasii (Rubtsov)
(Simuliidae, Diptera) in the laboratory. Japanese Journal of Sanitary Zoology 36 (3): 211-217. https://doi.
org/10.7601/mez.36.211
Thompson P.H. 1969. Collecting methods for Tabanidae (Diptera). Annals of the Entomological Society of America
Venter J., Labuschagne K., Hermanides K.G., Boikanyo S.N.B., Majatladi D. M., Morey L. 2009. Comparison
of the efficiency of five suction light traps under field conditions in South Africa for the collection of Cu-
SAMPLING TECHNIQUES FOR BLOODSUCKING DIPTERANS
(DIPTERA: CULICIDAE, SIMULIIDAE, CERATOPOGONIDAE, TABANIDAE)
A. V. Khalin, S. V. Aibulatov, A. A. Przhiboro
Keywords: mosquitoes, black flies, biting midges, horseflies, sampling technique, rear-
ing, preserving, Diptera, Culicidae, Simuliidae, Ceratopogonidae, Tabanidae
SUMMARY
Techniques for sampling and preserving are reviewed for bloodsucking dipterans,
i. e. mosquitoes, black flies, biting midges, and horseflies (Diptera: Culicidae, Simuliidae, Ceratopogo-
nidae, Tabanidae). These techniques are used and partly developed by us for ecological-faunistic and
taxonomic studies requiring the identification of specimens. Here, we describe the techniques used
for adults, larvae, and pupae, both common to all bloodsucking dipterans and specific to each family.
In particular, techniques for rearing of adults from larvae and pupae are described.
173