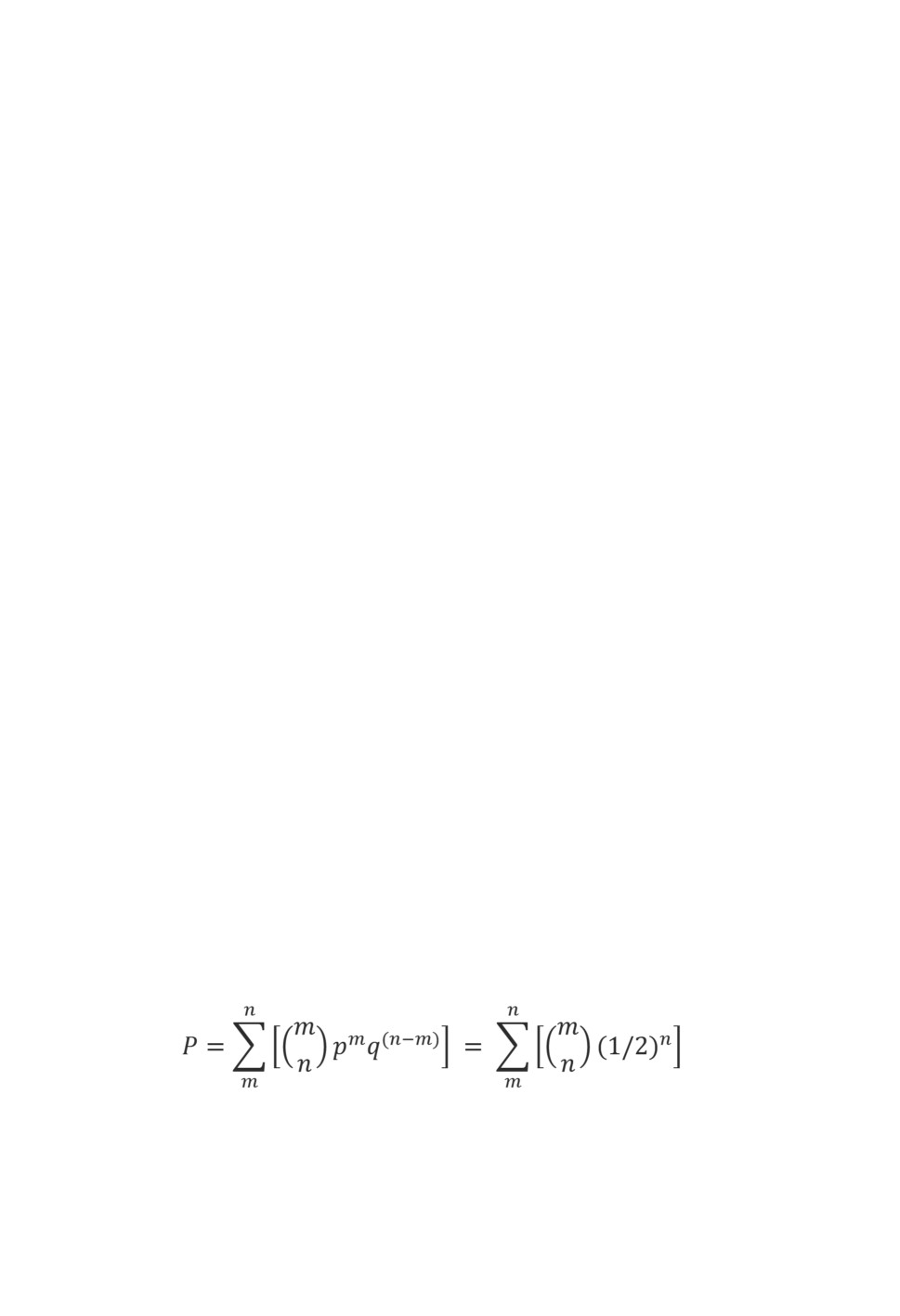ПАРАЗИТОЛОГИЯ, 2021, том 55, № 4, с. 287-304.
УДК 576.895.122 : 594.32 : 591.157
ЗАРАЖЕННОСТЬ ТРЕМАТОДАМИ МОЛЛЮСКОВ
LITTORINA OBTUSATA (GASTROPODA: LITTORINIDAE),
ИМЕЮЩИХ РАЗЛИЧНЫЙ ГЕНОТИП ПО ОКРАСКЕ РАКОВИНЫ
© 2021 г. Е. В. Козминский*
Зоологический институт РАН,
Университетская наб., 1, Санкт-Петербург, 199034 Россия
*e-mail: ekozminsky@gmail.com
Поступила в редакцию 12.04.2021 г.
После доработки 25.04.2021 г.
Принята к печати 31.05.2021 г.
Изучена зараженность литоральных моллюсков Littorina obtusata, имеющих различный ге-
нотип по окраске раковины, партенитами четырех видов трематод. Установлено, что активность
генов, отвечающих за формирование однопигментной пурпурной и оранжевой фоновой окраски
раковины, не влияет на уровень заражения моллюсков трематодами. Экстенсивность инвазии
литторин с двухпигментной желто-пурпурной фоновой окраской раковины и с рисунком из
белых пятен на раковине партенитами Microphallus piriformes и M. pygmaeus была ниже теоре-
тически ожидаемой. Зараженность моллюсков с коричневыми, белыми и оранжевыми полосами
на раковине не отличалась от таковой бесполосых особей. Обнаруженные различия связаны,
по-видимому, с генетически обусловленной восприимчивостью к заражению. Обсуждаются
возможные последствия дифференциальной зараженности моллюсков с разной окраской рако-
вины с точки зрения повышения устойчивости паразитарных систем и возможного изменения
фенотипической структуры популяции хозяина.
Ключевые слова: окраска раковины, Littorina obtusata, зараженность трематодами, генотип,
фенотип
DOI: 10.31857/S0031184721040025
Полиморфизм по окраске раковины у моллюсков является широко распростра-
ненным явлением (Backeljau et al., 2001). Благодаря плейотропному действию генов,
фенотипические признаки нередко маркируют физиологические различия между осо-
бями по отношению к различным факторам окружающей среды (Clarke, 1978; Rosin
et al., 2018). Одним из важнейших и широко распространенных факторов, влияю-
щих на популяции животных, является паразитизм. Различная восприимчивость морф
к заражению приводит к дифференциальной зараженности особей в популяции хо-
287
зяина и является одним из факторов, способствующих стабильности паразитарных
систем. В то же время, во многих случаях заражение приводит к полной паразитарной
кастрации хозяина, что может напрямую влиять на фенотипическую структуру его
популяции.
Удобным объектом для изучения подобных взаимодействий между паразитом и хо-
зяином на популяционном уровне являются беломорские моллюски Littorina obtusata
(Linnaeus, 1758), для которых характерен высокий полиморфизм по окраске раковины
(Сергиевский, 1982а, 1982б; Козминский, Лезин, 2007). У особей, имеющих различ-
ный фенотип, показано существование физиологических различий по отношению
к солености, температуре, продолжительности обсыхания и ряду других факторов
(Сергиевский, Бергер, 1984; Бергер и др., 1995; Sokolova, Berger, 2000 и др.). Лит-
торины служат первым промежуточным хозяином для ряда видов трематод (Чубрик,
1966; Подлипаев, 1979; Галактионов, 1983; 1984, 2009; Русанов, Галактионов, 1984;
Granovitch et al., 2000; Gonchar, Galaktionov, 2017 и др.) и, в частности, микрофаллид
группы “pygmaeus” (Trematoda: Microphallidae), вызывающих тяжелые заболевания
водоплавающих птиц (Кулачкова, 1960; 1979). Заражение литторин трематодами при-
водит к полной паразитарной кастрации моллюсков (Гранович, Сергиевский, 1990;
Галактионов, 1993; Ганжа, Гранович, 2008), что может быть основой для направлен-
ного изменения структуры популяции.
В условиях наших северных морей различия в зараженности у L. obtusata, имею-
щих различный фенотип, изучались Сергиевским (1986). В последние годы появилось
большое количество новых данных о закономерностях формирования и наследова-
ния признаков окраски раковины у литторин (Козминский, Лезин, 2007; Козминский
и др., 2010; Козминский, 2011, 2014, 2016), что позволяет оценить связь зараженности
не только с фенотипом, но и генотипом моллюсков.
Целью настоящего исследования было изучение особенностей заражения парте-
нитами трематод моллюсков Littorina obtusata (Linnaeus, 1758), имеющих различный
генотип по окраске раковины.
МАТЕРИАЛ И МЕТОДИКА
Littorina obtusata (Linnaeus, 1758) - широко распространенные литоральные моллюски,
встречающиеся от нуля глубин до верхней границы зоны произрастания бурых водорослей
Fucus vesiculosus Linnaeus, 1753. Литторины раздельнополы. Высота раковины беломорских
L. obtusata не превышает 12 мм, максимальный диаметр - 10 мм. Средняя продолжительность
жизни моллюсков составляет пять, максимальная - около 10 лет (Козминский, 2006).
Для L. obtusata характерен высокий полиморфизм по признакам окраски раковины (Серги-
евский, 1982а, 1982б; Козминский, Лезин, 2007). В формировании окраски участвуют четыре
пигмента: меланин, два каротиноида и (предположительно) гуанин (Козминский, Лезин, 2007).
Меланин отвечает за коричневую (традиционно называемую пурпурной) окраску участков ра-
ковины, каротиноиды - желтую и оранжевую, гуанин - белую. На основе одного и того же
пигмента могут возникать разные элементы окраски.
288
Фоновая окраска раковины может формироваться за счет включения в раковину одного,
двух и трех пигментов (Козминский, Лезин, 2007)1. В зависимости от того, какие пигмен-
ты включаются в раковину, формируются различные варианты фоновой окраски: монохрома-
тические (желтая, оранжевая, пурпурная), дихроматические (двухслойные желто-пурпурная,
желто-оранжевая, оранжево-пурпурная, бело-пурпурная) и трихроматические (трехслойные
желто-оранжево-пурпурная, желто-бело-пурпурная, оранжево-бело-пурпурная). С генетической
точки зрения, включение в раковину каждого пигмента является условно простым призна-
ком (Тихомирова, 1990) и контролируется отдельной группой генов, связанных с синтезом,
транспортом и распределением пигмента в раковине. Установлено (Козминский, 2014), что
при формировании фоновой окраски за включение в раковину пурпурного и желтого пигмен-
тов отвечают не менее двух комплементарных генов, а за включение в раковину оранжевого
пигмента - минимум один ген. Включение в раковину каждого пигмента доминантно. При
формировании монохроматических вариантов окраски активна только одна группа генов, при
формировании двухпигментных вариантов - две и при формировании трехпигментных вари-
антов окраски - сразу три группы генов.
Рисунок из пятен на раковине формируется на основе белого пигмента. Отдельные эле-
менты рисунка представляют собой включения пигмента линзовидной формы, расположен-
ные в верхней части неправильно-призматического слоя раковины (Козминский, Лезин, 2007).
Взаимное расположение элементов рисунка и степень их слияния чрезвычайно варьируют. За
наличие рисунка отвечают не менее двух комплементарных генов (Козминский и др., 2010).
Наличие рисунка доминантно. Широкие продольные полосы формируются как прослойки
коричневого, белого и оранжевого пигментов (Козминский, Лезин, 2007; Козминский, 2011,
2016). За формирование каждого типа полос отвечает один двухаллельный ген. В то время как
наличие коричневых и белых полос доминантно, наличие оранжевых полос, скорее всего, -
рецессивный признак.
Большинство признаков окраски наследуются независимо, однако локусы, отвечающие за
формирование коричневых полос и включение в раковину оранжевого пигмента, сцеплены
(Козминский, неопубл. данные).
В основу исследования положены данные, собранные в ходе мониторинговых наблюдений
за популяционной динамикой L. obtusata на западной косе Южной губы о-ва Ряжков (Канда-
лакшский государственный природный заповедник, 67o00′N, 32o34′E) в период с 2001 по 2016 гг.
Сбор материала осуществлялся один раз в год, в конце августа - начале сентября. Исполь-
зовались количественные сборы с площадок в 1/40 м2, которые были расположены сериями по
3 вдоль трансекты на уровнях 0, 5, 10, 15, 20 и 25 м. Пробы транспортировали в лабораторию,
где их промывали пресной водой с помощью почвенного сита с размером ячеек 0.6 мм и раз-
бирали. У обнаруженных L. obtusata измеряли максимальный диаметр раковины, фиксировали
признаки окраски раковины и - при вскрытии - определяли заражение моллюсков партенитами
трематод2. Для последующего анализа отбирали литторин с диаметром раковины 3 мм и более,
т.к. при меньшем размере достоверное определение фенотипа и наличия заражения невозможно.
Количество обследованных моллюсков приведено в табл. 1.
1 Детальное описание признаков окраски раковины L.obtusata с фотографиями можно найти на сайте
2 Описания паразитов можно найти в работах Джеймса (James, 1968), Галактионова (1983, 1984, 2009),
Гончар и Галактионова (Gonchar, Galaktionov, 2017).
289
В обследованном местообитании L. obtusata служит первым промежуточным хозяином для
9 видов трематод - Microphallus piriformes, M. pygmaeus, M. pseudopygmaeus, M. triangulatus,
Podocotyle atomon, Cryptocotyle lingua, Tristriata anatis, Himasthla elongata и Renicola sp. Че-
тыре последних вида встречаются спорадически; экстенсивность инвазии ими не превышает
0.5%. P. atomon - достаточно обычный вид, однако проведенный нами разведочный анализ не
выявил заметных различий в зараженности этим видом у моллюсков, имеющих различный
генотип. Поэтому в настоящей работе анализируются различия в зараженности у L. obtusata,
инфицированных микрофаллидами группы «pygmaeus».
В процессе анализа моллюски были объединены в группы, различающиеся с точки зрения
активности генов, отвечающих за разные элементы окраски раковины. В первые три группы
вошли L. obtusata, у которых активны гены, отвечающие за формирование фоновой окраски
с участием пурпурного (особи с пурпурной, желто-, бело-, оранжево-пурпурной и т. п. фоновой
окраской), желтого (желтые, желто-пурпурные и желто-оранжевые и т.п. особи) и оранжевого
(оранжевые, желто-оранжевые, оранжево-пурпурные и т.п. моллюски) пигментов. К четвертой
были отнесены литторины, у которых были активны гены, отвечающие за формирование ри-
сунка из белых пятен на раковине. Оставшиеся три группы составили особи, у которых были
активны гены, отвечающие за формирование широких продольных полос коричневого, белого
и оранжевого цвета.
При статистической обработке результатов использовались общепринятые статистические
методы. В случае генотипов, связанных с формированием фоновой окраски и рисунка из пятен,
отдельно для каждого года проведения исследований были построены четырехпольные таблицы
наблюдаемых и ожидаемых численностей. Для генотипов, отвечающих за формирование широ-
ких продольных полос, ввиду небольшого объема выборок, для каждого генотипа данные были
объединены за весь период исследований. Ожидаемые численности, соответствующие ячейкам
таблицы, рассчитывались как произведения соответствующих относительных маргинальных
частот на объем выборки. Далее, с помощью критерия χ2, сравнивались ожидаемая и реальная
зараженность моллюсков с активными и неактивными генами, отвечающими за появление
данного признака окраски. При малых объемах выборки значения критерия были рассчитаны
с учетом поправки на малые теоретически ожидаемые численности (Nass, 1959). С целью
наглядного представления результатов рассчитывалось отношение наблюдаемой к ожидаемой
зараженности, эквивалентное (с математической точки зрения) отношению экстенсивности ин-
вазии в данной группе к средней в популяции. В ряде случаев в разные годы прослеживалась
одна и та же тенденция к меньшей, чем ожидаемая, зараженности. Подобные систематиче-
ские (пусть и незначимые со статистической точки зрения) отклонения также свидетельствуют
о существовании различий. Вероятность того, что в серии из n испытаний будет наблюдаться
m или более случаев, когда наблюдаемая численность меньше ожидаемой, и n-m случаев, когда
наблюдаемая численность больше или равна ожидаемой, рассчитывалась по формуле:
где: p - вероятность того, что наблюдаемая численность меньше ожидаемой и q - вероятность того,
что наблюдаемая численность больше или равна ожидаемой (предполагается, что p и q одинаковы и равны
m
½). Символом (
) обозначено число сочетаний из n элементов по m элементов.
n
290
Для выявления связи между уровнем экстенсивности инвазии и наблюдаемой долей за-
раженности (от теоретически ожидаемой) использовался коэффициент ранговой корреляции
Спирмена. Дополнительно проводилась проверка возможности аппроксимации зависимости
между этими величинами уравнением линейной регрессии и проверка отличия коэффициента
регрессии от нуля.
Для проверки предположения о неравномерном распределении генотипов на литорали, при
сравнении частот генотипов на площадках в пределах одного уровня литорали и усредненных
частот между разными уровнями, использовали χ2-критерий.
РЕЗУЛЬТАТЫ
Наиболее распространенным вариантом фоновой окраски раковины в обследован-
ной популяции Littorina obtusata были желто-пурпурные моллюски. Их средняя за
весь период проведения исследований частота составила 55.0%. Вторыми по обилию
были литторины с пурпурной фоновой окраской раковины (42.4%). Чисто оранжевые
и желтые особи были относительно редки (2.0 и 0.3% соответственно). Прочие вари-
анты фоновой окраски встречались в следовых количествах; их средняя суммарная
частота составила 0.3% за весь период исследований. Доля литторин с рисунком из
белых пятен на раковине составила 54.2% особей в популяции. Моллюски с широ-
кими продольными полосами на раковине встречались в небольших количествах; их
средняя частота составила 1.5, 0.8 и 0.2% в случае белых, оранжевых и коричневых
полос, соответственно.
Сравнение частот генотипов на отдельных площадках в пределах уровней литора-
ли и усредненных частот между разными уровнями литорали не выявило значимых
различий.
Вследствие разной встречаемости фенотипов их соотношение в группах особей,
имеющих определенный генотип, было не одинаковым. Группа литторин с актив-
ными генами, отвечающими за формирование фоновой окраски с участием желтого
пигмента, состояла преимущественно из желто-пурпурных моллюсков (в среднем
99.3% за весь период исследований). В группу литторин с активными генами, от-
вечающими за формирование фоновой окраски с участием пурпурного пигмента,
входили примерно в равных соотношениях моллюски с чисто пурпурной (43.4%)
и желто-пурпурной (56.3%) фоновой окраской. Группа литторин с активными генами,
отвечающими за формирование фоновой окраски с участием оранжевого пигмента,
состояла практически полностью из моллюсков с чисто оранжевой фоновой окра-
ской (в среднем 99.9%). Следует отметить, что зараженные микрофаллидами особи
с активными генами пурпурной и желтой фоновой окраски наблюдались во все годы
проведения исследований, в то время как моллюски с активными генами оранжевой
фоновой окраски, в силу своей малочисленности, были отмечены только в 2003, 2011,
2013 и 2015 гг.
Экстенсивность инвазии микрофаллидами L. obtusata с фоновой окраской, форми-
рующейся с участием желтого пигмента, во все годы проведения исследований была
291
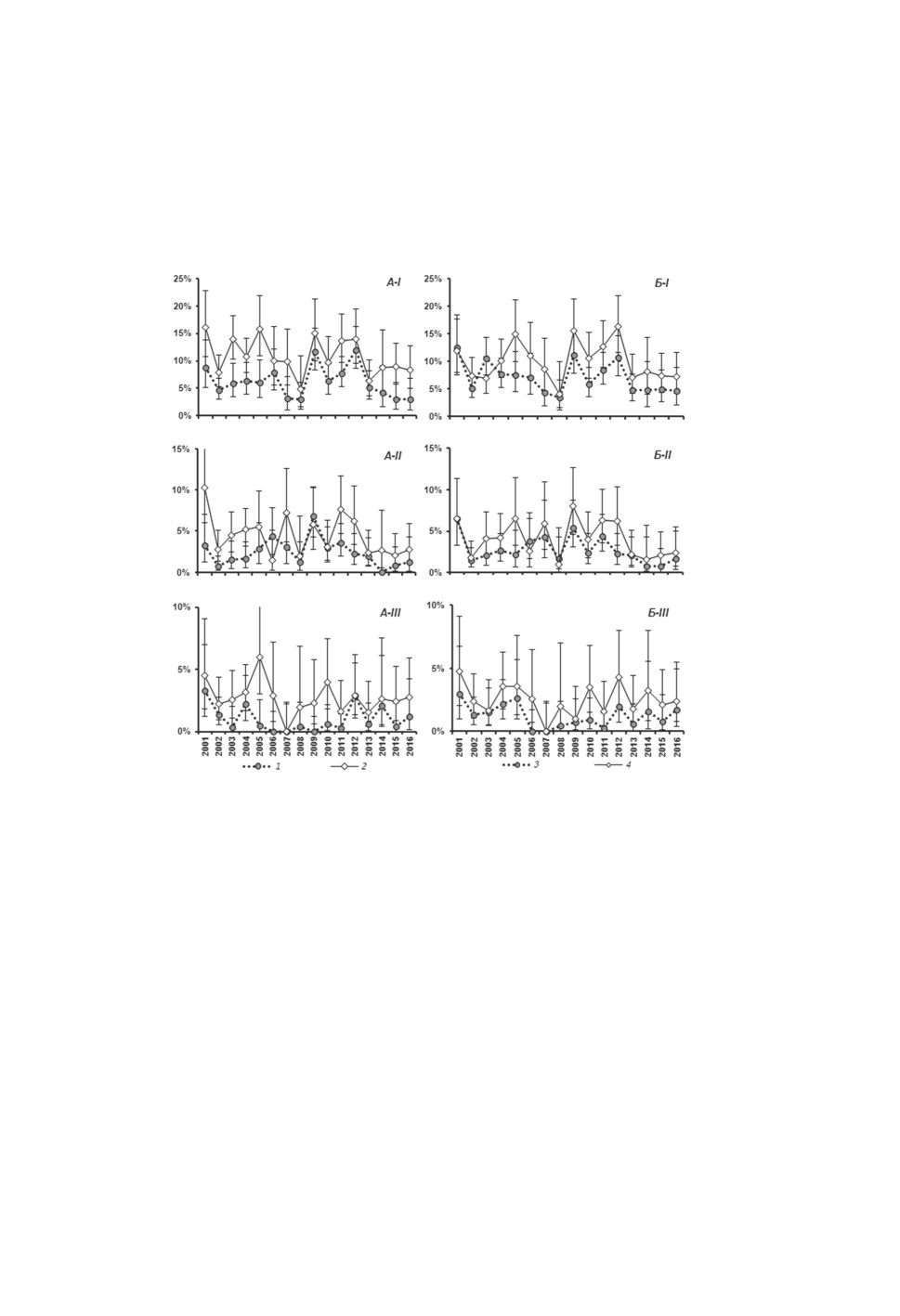
ниже зараженности моллюсков с фоновой окраской без его участия (рис. 1A-I). Наблю-
даемая экстенсивность инвазии колебалась от 49 до 94% от ожидаемой и составила
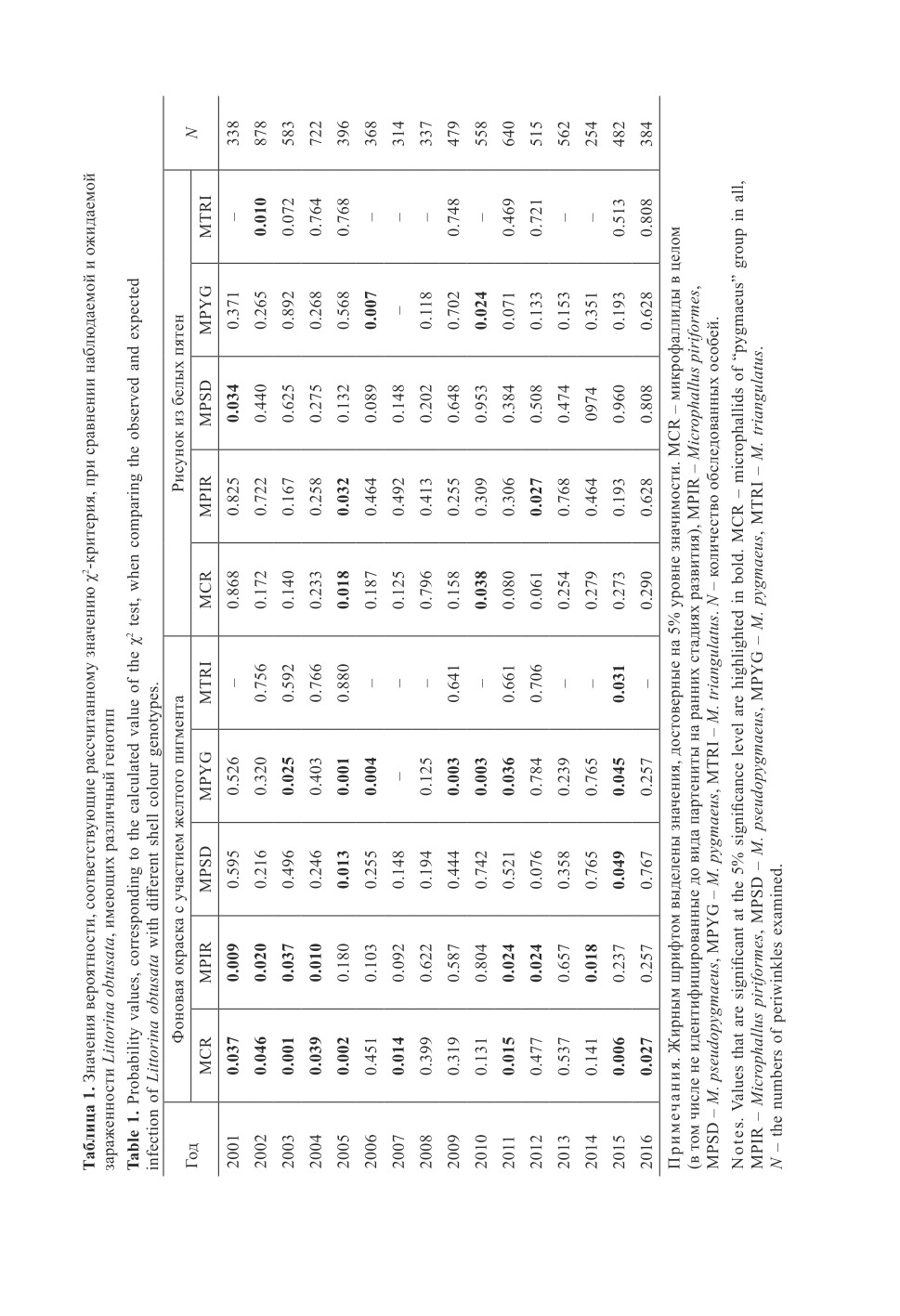
в среднем 72.5% (рис. 2А). Проверка с помощью критерия χ2 показала, что различия
были значимы в 9 из 16 случаев (α<0.05, табл. 1). Вероятность случайно наблюдать
однотипные отклонения на протяжении 16 лет ничтожна и составляет всего 1.5*10-5.
Рисунок 1. Экстенсивность инвазии трематодами у Littorina obtusata, имеющих различный
генотип по окраске раковины.
А - зараженность литторин, у которых фоновая окраска формируется с участием (1) или
без участия (2) желтого пигмента; Б - зараженность литторин с рисунком из белых пятен
на раковине (3) и литторин, лишенных такового (4). I, II и III - зараженность
микрофаллидами группы «pygmaeus» в целом, Microphallus piriformes и M. pygmaeus,
соответственно.
По оси абсцисс - год проведения наблюдений; по оси ординат - экстенсивность инвазии, %.
Для каждого значения экстенсивности инвазии приведен точный 95% доверительный
интервал.
Figure 1. Prevalence with trematodes of Littorina obtusata with different shell colour genotypes.
А - prevalence of periwinkles, in which the background shell coloration is formed with (1) or
without (2) the participation of yellow pigment; Б - prevalence of periwinkles with the pattern
of white pigment spots on the shell (3) and without it (4). I, II and III - prevalence with
microphallids of “pygmaeus” group in all, Microphallus piriformes and M. pygmaeus, respectively.
The abscissa shows the sampling time (years), the ordinate shows prevalence, %.
Error bars are confidence intervals (95%) of prevalence.
292
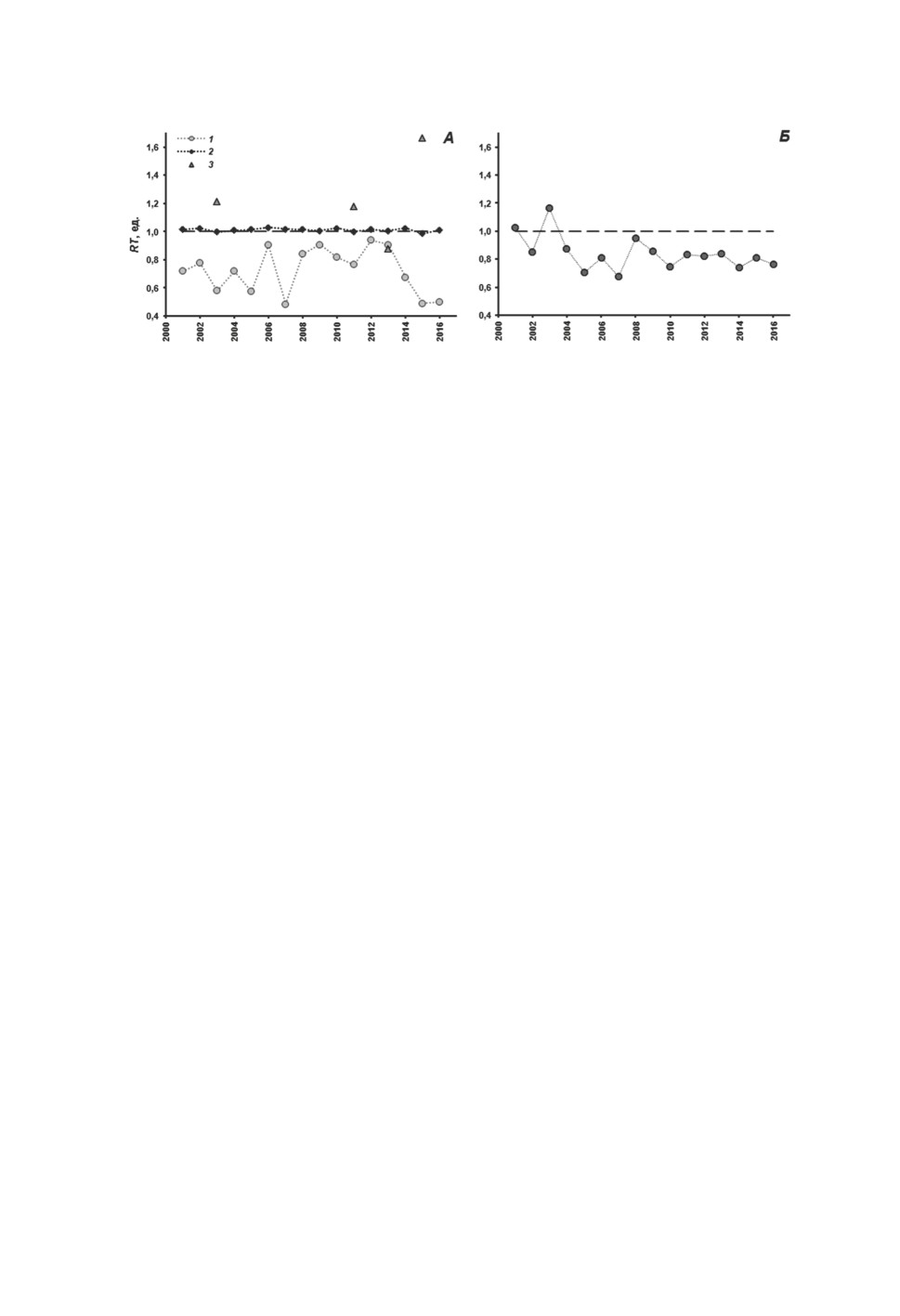
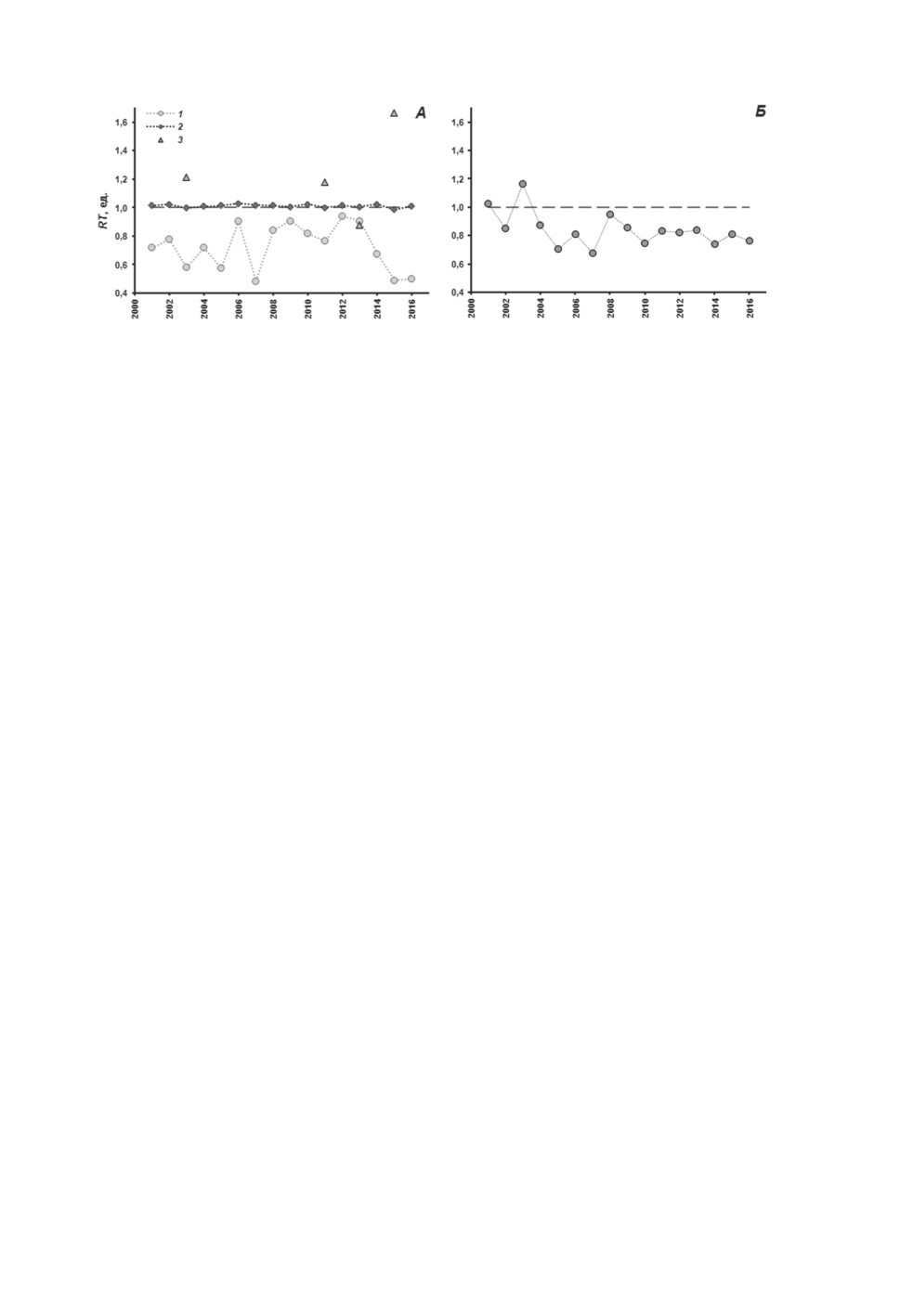
Рисунок 2. Отношение наблюдаемой к ожидаемой зараженности (RT) микрофаллидами
у Littorina obtusata с активными генами, отвечающими за формирование фоновой окраски
(А) и рисунка из белых пятен (Б).
Цифрами обозначены моллюски с активными генами, отвечающими за формирование
фоновой окраски с участием желтого (1), пурпурного (2) и оранжевого (3) пигментов.
По оси абсцисс - время отбора проб, годы.
Figure 2. The ratio of observed to expected infection (RT) with microphallids
of Littorina obtusata with active genes that are responsible for the formation of the background
shell coloration (A) and the pattern of white pigment spots (B).
Numbers denote mollusks with active genes that are responsible for the formation of the
background shell coloration with yellow (1), purple (2) and orange (3) pigments.
The abscissa shows the sampling time, years.
Связи между величиной экстенсивности инвазии и степенью отклонения наблюдае-
мой зараженности от ожидаемой не обнаружено. Коэффициент ранговой корреляции
Спирмена RS составил 0.185 (α>>0.05). Коэффициент регрессии при использовании
простой линейной зависимости не отличался от нуля (α=0.325).
Анализ зараженности отдельными видами паразитов показал, что наблюдаемая
зараженность была ниже ожидаемой только в случае M. piriformes и M. pygmaeus
(в среднем 67.5 и 48.9% от ожидаемой экстенсивности инвазии, соответственно)
(рис. 1А-II, 1А-III и 3А). Наблюдаемая зараженность M. piriformes была ниже ожи-
даемой в 9 из 10 изученных случаев. Отклонения были значимы (α<0.05), с точки
зрения критерия χ2, для 7 лет наблюдений (табл. 1), однако вероятность таких же
или еще более контрастных различий мала (α = 0.002). При заражении M. pygmaeus
одинаковые по знаку отклонения наблюдались в 14 из 15 случаев (вероятность таких
же или еще более контрастных различий α = 0.001). Проверка с помощью критерия
χ2 показала, что обнаруженные отклонения были значимы в 7 из 15 случаев (α<0.05,
табл. 1). В случае M. pseudopygmaeus и M. triangulatus существенных различий не
обнаружено; отношения наблюдаемых значений экстенсивности инвазии к ожидаемым
значениям были примерно одинаково часто выше и ниже единицы.
293
Зараженность микрофаллидами моллюсков с активными генами, отвечающими за
формирование фоновой окраски с участием пурпурного и оранжевого пигментов, не
отличалась от теоретически ожидаемой (рис. 2А). Отношения наблюдаемых значений
экстенсивностей инвазии к ожидаемым значениям у литторин с активными генами
пурпурной фоновой окраски практически не отличались от единицы, а у моллюсков
с активными генами оранжевой фоновой окраски были примерно одинаково часто
выше и ниже единицы. Величина критерия χ2 во всех случаях была ниже критической.
Таким образом, активность генов, отвечающих за формирование фоновой окраски
с участием этих двух пигментов, не влияет на зараженность.
Зараженность микрофаллидами моллюсков с рисунком из белых пятен на раковине
в 14 из 16 случаев была ниже, чем экстенсивность инвазии у литторин, не имеющих
такового (рис. 1Б-I). Наблюдаемая экстенсивность инвазии колебалась в диапазоне
от 68 до 117% от ожидаемой (в среднем 84.2%) (рис. 2Б). Величина критерия χ2 пре-
вышала критическую (α<0.05) только в двух случаях из 16 (табл. 1), однако вероят-
ность наблюдать сходные или еще более контрастные отклонения была небольшой
(α = 0.002).
Связи между уровнем экстенсивности инвазии и степенью отклонения наблюдае-
мой зараженности от ожидаемой, как и в случае фоновой окраски, не обнаружено.
Коэффициент ранговой корреляции Спирмена Rs составил 0.129 (α>>0.05). Коэффи-
циент регрессии при использовании простой линейной зависимости не отличался от
нуля (α = 0.392).
Анализ зараженности отдельными видами микрофаллид показал, что за об-
наруженные различия (как и в случае фоновой окраски) отвечают M. piriformes и
M. pygmaeus (рис. 1Б-II, 1Б-III; 3Б). Наблюдаемая зараженность этими видами трема-
тод составила в среднем 82.7 и 63.8% от ожидаемой, соответственно. При заражении
M. piriformes наблюдаемая зараженность была ниже ожидаемой в 13 из 16 случаев.
Проверка с помощью критерия χ2 показала, что отклонения были значимы (α<0.05)
только в двух из 16 случаев (табл. 1), однако вероятность таких же или еще более
контрастных различий мала (α = 0.011). При заражении M. pygmaeus во всех случа-
ях значения экстенсивности инвазии были меньше ожидаемых. Величина критерия
χ2 превышала критическую (α<0.05) только в двух случаях из 15 (табл. 1), однако
вероятность случайно наблюдать такие - однотипные - отклонения на протяжении
15 лет невелика и составляет 3.1*10-5. В случае M. pseudopygmaeus и M. triangulatus
существенных различий не выявлено.
Различий в зараженности между моллюсками с различными вариантами широких
продольных полос на раковине (коричневыми, белыми, оранжевыми) и бесполосыми
особями не обнаружено.
295
Рисунок 3. Отношение наблюдаемой к ожидаемой зараженности (RT) разными видами
микрофаллид у Littorina obtusata с активными генами, отвечающими за формирование
фоновой окраски с участием желтого пигмента (А) и рисунка из белых пятен (Б).
Заражение: 1 - Microphallus piriformes, 2 - M. pseudopygmaeus, 3 - M. pygmaeus,
4 - M. triangulatus. На оси абсцисс - время отбора проб, годы.
Figure 3. The ratio of observed to expected infection (RT) with different species of microphallids
of Littorina obtusata with active genes that are responsible for the formation of the yellow
background shell coloration (A) and the pattern of white pigment spots (B).
Infection with: 1 - Microphallus piriformes, 2 - M. pseudopygmaeus, 3 - M. pygmaeus,
4 - M. triangulatus. The abscissa shows the sampling time, years.
ОБСУЖДЕНИЕ
У полиморфных видов моллюсков различия по окраске раковины нередко маркиру-
ют физиологические различия между особями по отношению к факторам окружающей
среды и, в частности, восприимчивости к заражению (Бергер и др., 1995; Sokolova,
Berger, 2000; Rosin et al., 2018). Не одинаковая восприимчивость моллюсков к зара-
жению гельминтами может быть связана с различиями в окраске как мягких тканей
(Paraense, Correa, 1963; Richards, 1973; Newton, 1955), так и раковины (Сергиевский,
1986; Scheil et al., 2014). Тем не менее наличие такой взаимосвязи необязательно:
в ряде случаев связи между окраской раковины и уровнем зараженности не выявлено
(Miura et al., 2007; Scheil et al., 2014).
В ходе исследования, выполненного ранее С.О.Сергиевским (1986), была проана-
лизирована зараженность бесполосых L. obtusata с пурпурной, желтой, оранжевой и
коричневой фоновой окраской. В первом случае были рассмотрены моллюски с ри-
сунком из белых пятен и без такового, в трех оставшихся случаях - только пятнистые
особи. Экстенсивность инвазии пурпурных и оранжевых литторин не отличалась от
средней в популяции; в то же время зараженность желтых моллюсков была выше,
а коричневых - ниже таковой. При сравнении зараженности «пурпурных» L. obtusata,
имеющих и не имеющих рисунок из белых пятен на раковине, не было выявлено
296
существенных различий - в разных популяциях экстенсивность инвазии «шашечных»
особей могла быть как выше, так и ниже средней в популяции. Экстенсивности ин-
вазии полосатых и бесполосых литторин также не различались.
Наиболее существенной проблемой при сопоставлении полученных нами данных
с наблюдениями Сергиевского (1986) является различный подход к группировке осо-
бей - по генотипу или видимой окраске раковины, т.е. фенотипу. Различия в исполь-
зованном подходе позволяют сравнивать выделенные группы только с определенными
оговорками. Наиболее существенные расхождения имеют место в случае фоновой
окраски. Если группировать моллюсков по генотипу, к конкретной группе относятся
все особи с активными генами, отвечающими за включение определенного пигмента
в раковину. При группировке по фенотипу в аналогичную группу входят только особи
с определенной видимой окраской (т. е. те, у которых активны только гены, отвечаю-
щие за включение данного пигмента в раковину; гены, отвечающие за включение
в раковину других пигментов, неактивны). Например, включение в раковину пурпур-
ного пигмента происходит у чисто пурпурных, желто-пурпурных, бело-пурпурных
и некоторых других моллюсков (см. выше). При группировке по фенотипу в соот-
ветствующую группу «пурпурных» особей попадают преимущественно литторины
с чисто пурпурной фоновой окраской3. С учетом встречаемости различных вариантов
фоновой окраски в обследованной нами популяции, можно сопоставить друг другу
следующие генотипические и фенотипические группы. Литторинам с активными гена-
ми, отвечающими за включение в раковину пурпурного пигмента (преимущественно
пурпурные и желто-пурпурные особи), частично соответствуют моллюски с феноти-
пом «пурпурные». Литторинам, у которых активны гены, отвечающие за включение
в раковину оранжевого пигмента, соответствуют особи с фенотипом «оранжевые».
Литторинам, у которых активны гены, отвечающие за включение в раковину желтого
пигмента (в обследованном местообитании это в основном желто-пурпурные особи),
соответствуют моллюски с фенотипом «коричневые».
В случае рисунка из белых пятен генотипические и фенотипические группы при-
мерно соответствуют друг другу. Поскольку рассмотренные С.О. Сергиевским фено-
типические группы состоят, преимущественно, из «пятнистых» моллюсков с разными
вариантами фоновой окраски, оценить связь между наличием рисунка и уровнем
зараженности можно, только сопоставив зараженность пурпурных бесполосых мол-
люсков с рисунком из белых пятен и зараженность моллюсков без такого рисунка.
Необходимо также отметить, что при выделении фенотипических групп С.О. Серги-
евским не учитывался цвет широких продольных полос. Поскольку, как показывают
3 Так как в этом случае учитывается только видимая окраска раковины, фенотипическая группа может
быть «разбавлена» особями, имеющими другой генотип - например, к группе «желтых» моллюсков могут
быть отнесены желто-пурпурные литторины с высокой интенсивностью желтого пигмента.
297
полученные нами данные (Козминский, 2011, 2016), за полосы разного цвета отвечают
разные группы генов, в этом случае возможно только самое общее сопоставление
генотипических и фенотипических групп.
С учётом высказанных выше замечаний полученные нами результаты «в целом»
согласуются с наблюдениями С.О. Сергиевского (1986). Активность генов, отвечаю-
щих за формирование фоновой окраски с участием пурпурного и оранжевого пиг-
ментов, в обоих случаях не связана с уровнем зараженности. Зараженность желто-
пурпурных моллюсков в нашем случае, так же как и соответствующих им литторин
с фенотипом «коричневые», ниже ожидаемой. Различия в уровне экстенсивности
инвазии у полосатых и бесполосых моллюсков в обоих случаях не обнаружены.
В то же время, зараженность литторин с рисунком из белых пятен на раковине в на-
шем случае была ниже ожидаемой. Эти расхождения обусловлены, вероятно, более
низким уровнем различий у пятнистых моллюсков по сравнению с таковым у особей
с желто-пурпурной фоновой окраской в сочетании с меньшим количеством выборок,
проанализированных Сергиевским (1986).
Интересно отметить, что судя по данным С.О. Сергиевского, активность генов,
отвечающих за формирование чисто желтой фоновой окраски, связана с повышенной
восприимчивостью к заражению. В то же время, взаимодействие двух групп генов
при формировании желто-пурпурной фоновой окраски приводит к существенному
снижению восприимчивости к инвазии. Это показывает, что экстраполировать дан-
ные, полученные при изучении генотипов, на соответствующие им фенотипические
группы следует с осторожностью.
Различная зараженность L. obtusata с разной окраской раковины может быть обу-
словлена неравномерным распределением инвазионного начала в сочетании с неодно-
родным распределением моллюсков на литорали, различиями в продолжительности
жизни, уровне смертности при заражении, разной восприимчивостью к заражению
у моллюсков, имеющих различный генотип, и другими причинами. Для их выявления
необходимо проведение специальных исследований, выходящих за рамки настоящей
работы. Тем не менее некоторые заключения можно сделать, основываясь на уже
имеющейся информации. Факторы, связанные с неоднородным распределением мол-
люсков на литорали, можно исключить, так как признаков такового в обследованном
местообитании не обнаружено. Влияние некоторых других факторов - в частности,
различий в продолжительности жизни литторин или их выживаемости при зараже-
нии - возможно, но кажется маловероятным, т. к. в ходе наших исследований не
обнаружено явных указаний на существование подобных различий. Значительно бо-
лее вероятным представляется предположение о разной генетически обусловленной
восприимчивости моллюсков к заражению. В его пользу свидетельствует, во-первых,
298
высокий вклад генетических факторов в восприимчивость к гельминтозам у животных
вообще и у моллюсков в частности (Richards, 1973; Hansen et al., 1999; Quinnell, 2003;
Amarante et al., 2004 и др.). Во-вторых, возможность плейотропного действия генов
окраски и связанные с этим действием физиологические различия по отношению
к разным факторам внешней среды (Бергер и др., 1995; Sokolova, Berger, 2000; Rosin
et al., 2018 и др.). И, в-третьих, существование генов, отвечающих за восприимчи-
вость моллюсков к заражению (Richards, 1975; Ittiprasert et al., 2010; Rodrigues et al.,
1999; Dessein et al., 1999; Goodall et al., 2006; Tennessen et al., 2015; Начева, Кутихин,
2016; Famakinde, 2018). Следует также отметить, что различия в зараженности наблю-
даются только при заражении двумя из четырех видов микрофаллид - M. piriformes
и M. pygmaeus. Это позволяет предположить, что различия в восприимчивости
обусловлены какими-то тонкими биохимическими различиями между видами пара-
зитов.
Необходимо отметить, что уровень отклонений наблюдаемой зараженности от ожи-
даемой сильно варьирует год от года. Следовательно, делать выводы о различиях
в зараженности моллюсков с разной окраской раковины на основании однократных
наблюдений следует, как минимум, с осторожностью. Наряду с чисто стохастиче-
скими, наиболее вероятными причинами подобных флуктуаций являются, вероятно,
изменения восприимчивости хозяина и вирулентности паразита в разные годы. Нель-
зя исключать также возможность воздействия каких-либо абиотических факторов
внешней среды - в том случае, если они каким-либо образом влияют на выживание
моллюсков с разной восприимчивостью к инвазии.
Разная восприимчивость особей хозяина к заражению трематодами приводит
к перераспределению потока инвазии через популяцию хозяина. Такое перераспреде-
ление потока инвазии обеспечивает увеличение стабильности паразитарной системы
(Гранович, 2009), т. к. при изменении условий среды одна из фенотипических (или
генотипических) групп может оказаться более жизнеспособной и обеспечить сохра-
нение паразитарной системы. С другой стороны, более высокая устойчивость к зара-
жению одной из групп особей хозяина обеспечивает ей определенные эволюционные
преимущества. В условиях полной паразитарной кастрации, вызываемой трематодами
(Гранович, Сергиевский, 1990; Галактионов, 1993; Ганжа, Гранович, 2008), связанный
с этой группой фенотип (генотип) будет распространяться в популяции хозяина, в то
время как более восприимчивые фенотипы (генотипы) будут постепенно элиминиро-
ваться. Полученные нами данные показывают, что такими имеющими определенные
селективные преимущества фенотипами (генотипами) являются литторины с желто-
пурпурной фоновой окраской и моллюски с рисунком из белых пятен на раковине.
Если наше предположение верно, со временем в популяции должны накапливаться
299
фенотипы (генотипы) либо с повышенной устойчивостью (желто-пурпурные, шашеч-
ные), либо селективно-нейтральные (пурпурные, оранжевые). Чисто желтые литтори-
ны, как более восприимчивые к заражению, будут сохраняться в популяции в неболь-
ших количествах - за счет выщепления при скрещивании между желто-пурпурными
особями. Сходным образом, можно ожидать доминирования в популяции литторин
с рисунком из белых пятен на раковине. Результаты наших многолетних наблюдений
в целом согласуются со сделанными предположениями. В обследованной популяции
действительно доминируют желто-пурпурные (55%) и пурпурные (42%) моллюски,
в то время как оранжевые (2%) и желтые (0.3%) L. obtusata редки. Моллюсков с ри-
сунком из белых пятен также больше (54%), чем моллюсков, не имеющих такового
(46%). В рамки сделанных нами предположений не укладываются моллюски с оран-
жевой фоновой окраской (их относительно немного), но, вполне вероятно, дефицит
особей этого фенотипа обусловлен воздействием каких-то других факторов (напри-
мер, выеданием хищниками). Можно было бы ожидать значительно большего доми-
нирования пятнистых моллюсков, однако наличие рисунка связано с более слабым
изменением восприимчивости к заражению, в то время как гены фоновой окраски
играют, очевидно, значительно более важную роль. Более детальный анализ соот-
ветствия сформулированной нами гипотезы наблюдаемым данным выходит за рамки
настоящей работы и должен быть предметом специального исследования.
БЛАГОДАРНОСТИ
Пользуясь случаем, выражаю свою признательность сотруднику ИСиЭЖ СО РАН
Е.А. Сербиной за советы и ценные критические замечания, высказанные при под-
готовке рукописи. Выражаю искреннюю благодарность администрации Беломорской
биологической станции ЗИН РАН «Мыс Картеш» и Кандалакшского государственного
природного заповедника, а также всем сотрудникам этих организаций, оказывавшим
в разное время ту или иную помощь и поддержку при выполнении работы. Настоя-
щая работа была выполнена при частичной финансовой поддержке ГЗ ЗИН РАН, №
АААА-А19-119022690122-5 и РФФИ (проект № 05-04-48056).
СПИСОК ЛИТЕРАТУРЫ
Бергер В.Я., Богданов Д.В., Сергиевский С.О. 1995. Роль полиморфизма окраски раковины в температурных
адаптациях брюхоногого моллюска Littorina saxatilis (Olivi). Труды Зоологического института РАН
264: 46-60. [Berger V.Ja., Bogdanov D.V., Sergievsky S.O. 1995. The role of shell colour polymorphism in
temperature adaptations of the gastropod Littorina saxatilis (Olivi). Proceedings of the Zoological Institute
RAS 264: 46-60. (in Russian)].
Ганжа Е.В., Гранович А.И. 2008. Заражение партенитами трематод приводит к изменению строения пени-
альных желез самцов литоральных моллюсков Littorina saxatilis (Olivi) и L. obtusata (L.). Паразито-
логия 42(1): 13-22. [Ganzha E.V., Granovitch A.I. 2008. Modification of the structure of penial glands in
males of the intertidal molluscs Littorina saxatilis and L. obtusata under the influence of the infestation
by trematode parthenites. Parazitologia 42: 13-22. (in Russian)].
300
Галактионов К.В. 1983. Микрофаллиды группы “pygmaeus”. I. Описание видов Microphallus pygmaeus
(Levinsen, 1881) nec Odhner, 1905 и M. piriformes (Odhner, 1905) nom. nov. (Trematoda: Microphal-
lidae). Вестник Ленинградского университета 15: 20-30. [Galaktionov K.V. 1983. Microphallids of
the «pygmaeus» group. I. Description of species Microphallus pygmaeus (Levinsen, 1881) nec Odhner,
1905 and M. piriformes (Odhner, 1905) nom. nov. (Trematoda: Microphallidae). Vestnik Leningradskogo
Universiteta 15: 20-30. (in Russian)].
Галактионов К.В. 1984. Микрофаллиды группы “pygmaeus”. II. Описание вида Microphallus triangulatus
sp. nov. (Trematoda: Microphallidae). Вестник Ленинградского университета 3: 5-11. [Galaktionov
K.V. 1984. Microphallids of the “pygmaeus” group. II. Microphallus triangulatus sp. nov. (Trematoda:
Microphallidae). Vestnik Leningradskogo Universiteta 3: 5-11. (in Russian)]
Галактионов К.В. 1993. Жизненные циклы трематод как компоненты экосистем (опыт анализа на примере
представителей семейства Microphallidae). Апатиты, Изд-во КНЦ РАН, 190 с. [Galaktionov K.V. 1993.
Life Cycles of Trematodes as Components of Ecosystems. Apatity, Kola Scientific Centre of the RAS
Publ., 190 pp. (In Russian)].
Галактионов К.В. 2009. Описание марит и определение статуса вида Microphallus pseudopygmaeus sp. nov.
(Trematoda: Microphallidae). Паразитология 43 (4): 289-299. [Galaktionov K.V. 2009. Description of
the maritae and determination of the species status of Microphallus pseudopygmaeus sp. nov. (Trematoda:
Microphallidae). Parazitologiya 43 (4): 289-299. (in Russian)]
Гранович А.И. 2009. Паразитарная система как отражение структуры популяции паразитов: концепция
и термины. Труды Зоологического института РАН 313 (3): 329-337. [Granovitch A.I. 2009. Parasitic
system reflects population structure of a parasite: conception and terms. Proceedings of the Zoological
Institute RAS 313 (3): 329-337. (in Russian)].
Гранович А.И., Сергиевский С.О. 1990. Оценка репродуктивной структуры популяций моллюска Littorina
saxatilis (Olivi) (Gastropoda: Prosobranchia) в Белом море. Зоологический журнал 69: 32-41. [Grano-
vitch A.I., Sergievsky S.O. 1990. Estimation of reproductive structure of Littorina saxatilis (Olivi) (Gas-
tropoda, Prosobranchia) populations in the White Sea. Zoologicheskii Zhurnal 69: 32-41. (in Russian)].
Козминский Е.В. 2006. Определение возраста у Littorina obtusata (Gastropoda, Prosobranchia). Зоологический
журнал 85 (2): 146-157. [Kozminsky E.V. 2006. Determination of age in Littorina obtusata (Gastropoda,
Prosobranchia). Zoologicheskii Zhurnal 85 (2): 146-157. (in Russian)].
Козминский Е.В., Лезин П.А. 2007. Распределение пигментов в раковине брюхоногого моллюска Littorina
obtusata (Linnaeus, 1758). Биология моря 33 (4): 284-290. [Kozminsky E.V., Lezin P.A. 2007. Distri-
bution of pigments in the shell of the gastropod Littorina obtusata (Linnaeus, 1758). Russian Journal of
Marine Biology 33(4): 238-244. (In Russian)]
Козминский Е.В., Лезин П.А., Фокин М.В. 2010. Наследование рисунка из белых пятен на раковине у Lit-
torina obtusata (Gastropoda, Prosobranchia). Генетика 46 (12): 1652-1659. [Kozminsky E.V., Lezin P.A.,
Fokin M.V. 2010. A study of inheritance of white spots on the shell of Littorina obtusata (Gastropoda,
Prosobranchia). Russian Journal of Genetics 46 (12): 1455-1461. (in Russian)].
Козминский Е.В. 2011. Изучение наследования продольных полос на раковине у моллюсков Littorina obtu-
sata и Littorina saxatilis (Gastropoda, Prosobranchia). Генетика 47 (8): 1112-1119. [Kozminsky E.V. 2011.
Inheritance of longitudinal shell bands in the snails Littorina obtusata and Littorina saxatilis (Gastropoda,
Prosobranchia). Russian Journal of Genetics 47 (8): 987-993. (in Russian)].
Козминский Е.В. 2014. Особенности наследования фоновой окраски раковины у моллюсков Littorina ob-
tusata (Gastropoda, Littorinidae). Генетика 50 (10): 1177-1187. [Kozminsky E.V. 2014. Inheritance of
the background shell color in the snails Littorina obtusata (Gastropoda, Littorinidae). Russian Journal of
Genetics 50 (10): 1177-1187. (in Russian)].
301
Козминский Е.В. 2016. Наследование продольных белых полос на раковине у моллюсков Littorina obtusata
(Gastropoda, Prosobranchia). Генетика 52 (8): 991-995. [Kozminskiy E.V. 2016. Inheritance of longitudinal
white stripes on the shell of mollusks Littorina obtusata (Gastropoda, Prosobranchia). Russian Journal of
Genetics 52 (8): 991-995 (in Russian)]
Кулачкова В.Г. 1960. Гибель птенцов обыкновенной гаги и причины, ее вызывающие. Труды Кандалакш-
ского заповедника 3: 91-116. [Kulachkova V.G. 1960. Gibel ptencov obyknovennoj gagi i prichiny ee
vyzyvayushchie. Trudy Kandalakshskogo zapovednika 3: 91-116. (in Russian)].
Кулачкова В.Г. 1979. Гельминты как причина смертности обыкновенной гаги в вершине Кандалакшско-
го залива. В кн: Экология и морфология гаг в СССР. М.: Наука, 119-125. [Kulachkova V.G. 1979.
Gel’minty kak prichina smertnosti obyknovennoj gagi v vershine Kandalakshskogo zaliva. V kn: Ekologiya
i morfologiya gag v SSSR. M.: Nauka, 119-125. (in Russian)].
Начева Л.В., Кутихин А.Г. 2016. Генетика восприимчивости к гельминтозам у человека. Российский пара-
зитологический журнал 37 (3): 296-303. [Nacheva L.V., Kutikhin A.G. 2016. Genetics of susceptibil-
ity to human helminthiasis. Russian Journal of Parasitology 37 (3): 296-303. (in Russian)]. https://doi.
org/10.12737/21667
Подлипаев С.А. 1979. Партениты и личинки трематод литоральных моллюсков Восточного Мурмана. В кн.:
Экологическая и экспериментальная паразитология. Вып. 2. Л., изд-во ЛГУ, 47-101. [Podlipaev S.A.
1979. Partenity i lichinki trematod litoralnyh mollyuskov Vostochnogo Murmana. V kn.: Ekologicheskaya
i eksperimental’naya parazitologiya. Vyp. 2. L., Izd-vo LGU, 47-101. (in Russian)].
Русанов Н.И., Галактионов К.В. 1984. Сезонная динамика развития и размножения паретенит Podocotyle
atomon (Rudolphi, 1802) (Trematoda: Opecoelidae) в литоральных моллюсках Баренцева моря. В кн.:
Эколого-паразитологические исследования северных морей. Апатиты, изд. Кольского филиала АН
СССР, 41-51. [Rusanov N.I., Galaktionov K.V. 1984. Seasonal dynamics of development and reproduc-
tion of the parthenitae of Podocotyle atomon (Rudolphi, 1802) (Trematoda: Opecoelidae) in the littoral
molluscs of the Barents Sea. In: Ecological-Parasitological Investigations of the Northern Seas. Apatity,
Kola Branch of the USSR Academy of Sciences Publ., 41-51 (in Russian)].
Сергиевский С.О. 1982а. Экологическое изучение полиморфизма литорального моллюска Littorina obtusata
(L.) в Белом море. В кн.: Проблемы изучения и рационального использования биологических ре-
сурсов Белого моря. Л., Наука, 78-79. [Sergievsky S.O. 1982a. Ekologicheskoe izuchenie polimorfizma
litoralnogo mollyuska Littorina obtusata (L.) v Belom more. V kn.: Problemy izucheniya i racionalnogo
ispolzovaniya biologicheskih resursov Belogo morya. L., Nauka, 78-79. (in Russian).].
Сергиевский С.О. 1982б. Фенотипическая структура континуальных популяций. В кн.: Фенетика популяций.
М., Наука, 104-111. [Sergievsky S.O. 1982b. Fenotipicheskaya struktura kontinual’nyh populyacij. V kn.:
Fenetika populyacij. M., Nauka, 104-111. (in Russian).].
Сергиевский С.О., Бергер В.Я. 1984. Физиологические различия основных фенотипов окраски раковины
Littorina obtusata (L.). Биология моря 2: 36-44. [Sergievsky S.O., Berger V.Ja. 1984. Physiological dif-
ferences between the major shell colour phenotypes of the periwinkle Littorina obtusata (L.). Biologiya
Morya 2: 36-44. (in Russian)].
Сергиевский С.О. 1986. Различие в зараженности партенитами трематод особей разных фенотипов у лито-
рального моллюска Littorina obtusata. Паразитология 20 (1): 61-65. [Sergievsky S.O. 1986. Different
rates of infection of phenotypes of the littoral mollusc Littorina obtusata by trematode partenits. Parazi-
tologiya 20 (1): 61-65. (in Russian)].
Тихомирова М.М. 1990. Генетический анализ. Л.: Изд-во ЛГУ, 280 с. [Tihomirova M.M. 1990. Geneticheskij
analiz. L.: Izdatelstvo LGU, 280 pp. (in Russian)].
302
Чубрик Г.К. 1966. Фауна и экология личинок трематод из моллюсков Баренцева и Белого морей. Тру-
ды ММБИ 10 (14): 78-159. [Chubrik G.K. 1966. Fauna i ekologiya lichinok trematod iz mollyuskov
Barenceva i Belogo morej. Trudy MMBI 10 (14): 78-159. (in Russian)].
Amarante A.F.T., Bricarello, P.A., Rocha R.A., Gennari S.M. 2004. Resistance of Santa Ines, Suffolk and Ile de
France sheep to naturally acquired gastrointestinal nematode infections. Veterinary Parasitology 120 (1-2):
Backeljau T., Baur A., Baur B. 2001. Population and Conservation Genetics. In: The Biology of Terrestrial Mol-
luscs (Barker G.M., ed). Wallingford UK: CAB International Publishing, 383-412.
Clarke Br. 1978. Some contributions of snails to the development of ecological genetics. In: Ecological genetics:
the interface (ed. P.F. Brussard). N. Y.-Heidelberg-Berlin, 159-170.
Dessein A.J., Hillaire D., Elwali N.E. et al. 1999. Severe hepatic fibrosis in Schistosoma mansoni infection is
controlled by a major locus that is closely linked to the interferon-gamma receptor gene. American Journal
of Human Genetics 65: 709-721.
Famakinde D.O. 2018. Treading the path towards genetic control of snail resistance to schistosome infection.
Gonchar A., Galaktionov K.V. 2017. Life cycle and biology of Tristriata anatis (Digenea: Notocotylidae): mor-
016-5260-6
Goodall C.P., Bender R.C., Brooks J.K., Bayne C.J. 2006. Biomphalaria glabrata cytosolic copper/zinc superoxide
dismutase (SOD1) gene: Association of SOD1 alleles with resistance/susceptibility to Schistosoma mansoni.
Granovitch A.I., Sergievsky S.O., Sokolova I.M. 2000. Spatial and temporal variation of trematode infection in
coexisting populations of intertidal gastropods Littorina saxatilis and L.obtusata in the White Sea. Diseases
of Aquatic Organisms 41: 53-64.
Hansen D.S., Clery D.G., Estuningsih S.E., Widjajanti S., Partoutomo S., Spithill T.W. 1999. Immune responses
in Indonesian thin tailed sheep during primary infection with Fasciola gigantica: lack of a species IgG2
antibody response is associated with increased resistance to infection in Indonesian sheep. International
Journal for Parasitology 29 (7): 1027-1035.
Ittiprasert W., Miller A., Myers J., Nene V., El-Sayed N.M., Knight M. 2010. Identification of immediate re-
sponse genes dominantly expressed in juvenile resistant and susceptible Biomphalaria glabrata snails
upon exposure to Schistosoma mansoni. Molecular and Biochemical Parasitology 169: 27-39. https://doi.
org/10.1016/j.molbiopara.2009.09.009
James B.L. 1968. The distribution and keys of species in the family Littorinidae and of their digenean parasites,
in the region of Dale, Pembrokeshire. Field Studies 2: 615-650.
Miura O., Nishi S., Chiba S. 2007. Temperature-related diversity of shell colour in the intertidal gastropod Batil-
Nass C.A.G. 1959. The χ2 test for small expectations in contingency tables, with special reference to accidents
and absenteeism. Biometrika 46: 365-385.
Newton W.L. 1955. The establishment of a strain of Australorbis glabratus which combines albinism and high
susceptibility to infection with Schistosoma mansoni. Journal of Parasitology 41: 526-528.
Paraense W.L., Correa L.R. 1963. Variation in susceptibility of populations of Australorbis glabratus to a strain
of Schistosoma mansoni. Revista do Instituto de Medicina Tropical de São Paulo 5: 15-22.
Quinnell R.J. 2003. Genetics of susceptibility to human helminth infection. International Journal for Parasitology
33: 1219-1231.
303
Richards C.S. 1973. Susceptibility of adult Biomphalaria glabrata to Schistosoma mansoni infection. American
Journal of Tropical Medicine and Hygiene 22: 748-756.
Richards C.S. 1975. Genetic factors in susceptibility of Biomphalaria glabrata for different strains of Schistosoma
mansoni. Parasitology 70: 231-241.
Rodrigues V. Jr., Piper K., Couissinier-Paris P. et al. 1999. Genetic control of schistosome infections by the SM1
locus of the 5q31-q33 region is linked to differentiation of type 2 helper T lymphocytes. Infection and
Immunity 67: 4689-4692.
Rosin Z.M., Kwieciński Z., Lesicki A., Skórka P., Kobak J., Szymańska A., Osiejuk T.S., Kałuski T., Jaskulska
M., Ryjanowski P. 2018. Shell colour, temperature, (micro)habitat structure and predator pressure affect the
Scheil A.E., Hilsmanna S., Triebskorn R., Köhlera H.-R.. 2014. Shell colouration and parasite tolerance in two
Sokolova I.M., Berger V.Ja. 2000. Physiological variation related to shell colour polymorphism in White Sea
Littorina saxatilis. Journal of Experimental Marine Biology and Ecology 245: 1-23.
Tennessen J.A., Bonner K.M., Bollmann S.R., Johnstun J.A., Yeh J.Y., Marine M., Tavalire H.F., Bayne C.J.,
Blouin M.S. 2015. Genome-wide scan and test of candidate genes in the snail Biomphalaria glabrata
reveal new locus influencing resistance to Schistosoma mansoni. PLOS Neglected Tropical Diseases 9 (9):
INFECTION WITH TREMATODES OF THE SNAILS
LITTORINA OBTUSATA (GASTROPODA: LITTORINIDAE)
WITH DIFFERENT SHELL COLOUR GENOTYPES
E. V. Kozminsky
Keywords: shell colour, Littorina obtusata, infection with trematodes, genotype, phe-
notype
SUMMARY
Infection with trematodes of the littoral snails Littorina obtusata, that have different
shell colour genotypes, was studied. It was found that activity of genes that are responsible
for the formation of the purple and orange background shell coloration does not affect
infection level of trematodes in periwinkles. Prevalence of L. obtusata with the yellow-
purple background shell coloration and with the pattern of white pigment spots on the shell
by Microphallus piriformes and M. pygmaeus partenits was lower than the theoretically
expected one. Prevalence of mollusks with purple, orange or white bands on the shell did
not differ from that of bandless individuals. The differences found are apparently associated
with a genetically determined susceptibility to infection. Possible consequences of differ-
ent infection level of trematodes in periwinkles with different shell colour genotypes for
stability of parasitic systems and changes in the phenotypic structure of the host population
are discussed.
304