ПАРАЗИТОЛОГИЯ, 2021, том 55, № 5, с. 355-361.
УДК 576.895.122
ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ
ТРЕМАТОД LEUCOCHLORIDIUM PARADOXUM
НА ТЕРРИТОРИИ ЛЕНИНГРАДСКОЙ ОБЛАСТИ
ПО ФРАГМЕНТУ МИТОХОНДРИАЛЬНОГО ГЕНА COX1
© 2021 г. Р. Р. Усмановаa,*, А. С. Токмаковаa,
О. Д. Лопатинаa, Е. Е. Прохороваa
aРоссийский государственный педагогический университет им. А.И. Герцена,
кафедра зоологии, лаборатория экспериментальной зоологии,
наб. р. Мойки, д. 48, Санкт-Петербург, 191186 Россия
*rregina.usmanova@gmail.com
Поступила в редакцию 16.08.2021 г.
После доработки 09.09.2021 г.
Принята к публикации 11.09.2021 г.
Исследован генетический полиморфизм по фрагменту митохондриального гена I субъеди-
ницы цитохром-с оксидазы (cox1) спороцист трематод Leucochloridium paradoxum Carus, 1835
на территории Ленинградской области (пос. Вырица, пос. Кузьмолово, г. Бокситогорск, г. Лю-
бань). Выявлено 10 гаплотипов, средняя генетическая дистанция между которыми составила
0.00237 ± 0.00117. Среднее генетическое расстояние между изученными выборками составило
0.00219 ± 0.00030.
Ключевые слова: трематоды, Leucochloridium, cox1, генотипирование, гаплотипический
анализ
DOI: 10.31857/S003118472105001X
Трематоды рода Leucochloridium (Trematoda: Leucochloridiidae) используют
в качестве промежуточных хозяев моллюсков Succinea putris L., 1758 (Gastropoda:
Succineidae) (янтарки). Тело спороцист трематод этого рода представляет собой раз-
ветвленный столон, в центральной части которого формируются эмбрионы метацер-
карий. Развивающиеся метацеркарии накапливаются в отростках спороцисты, которые
по мере своего созревания приобретают характерную окраску. Они способны про-
никать в глазные щупальца моллюсков и сокращаться (пульсировать), что делает их
похожими на личинок насекомых. Паразиты привлекают птиц, которые заражаются
при питании (Pojmanska, Machaj, 1991).
355
Окраска зрелых отростков спороцист рода Leucochloridium видоспецифична (Ги-
нецинская, 1953). Это было доказано с использованием в качестве маркера фрагмента
ITS1-5.8S-ITS2 рДНК (Casey et al., 2003; Zhukova et al., 2014; Ataev et al., 2016). Было
также показано отсутствие внутривидовых различий между данными нуклеотидными
последовательностями. При этом моллюски S. putris отличаются внутривидовой кон-
сервативностью рДНК и незначительной вариабельностью митохондриальных локусов
(Prokhorova et al., 2020a).
Работ, посвященных популяционной структуре видов рода Leucochloridium, крайне
мало, несмотря на транcконтинентальное распространение этих видов. Ранее была
изучена внутривидовая изменчивость трематод рода Leucochloridium на территории
Японии с использованием в качестве маркера митохондриального гена I субъединицы
цитохром-с оксидазы (cox1) (Nakao et al., 2019). Наше исследование проведено с це-
лью анализа изменчивости по гену cox1 трематод Leucochloridium paradoxum Carus,
1835 Ленинградской области.
МАТЕРИАЛ И МЕТОДИКА
Моллюски S. putris (семейство Succineidae), зараженные трематодами L. paradoxum (n = 18),
были собраны на территории Ленинградской области в районе следующих населенных пунктов:
пос. Вырица (59°24′42.3″N, 30°19′08.1″E), пос. Кузьмолово (60°08′11.6″N, 30°28′52.8″E), г. Бок-
ситогорск (59°28′36.6″N, 33°48′21.0″E) и г. Любань (59°20′49.8″N, 31°13′53.2″E) в 2013-2021 гг.
Спороцист, извлеченных из моллюсков, хранили при температуре -80°C. ДНК выделяли
при помощи коммерческого набора ДНК-сорб-С-М (АмплиСенс, Россия) согласно инструк-
ции производителя. Для амплификации участка гена cox1 была использована пара специфи-
ческих праймеров: JB3 (5'-TTTTTTGGGCATCCTGAGGTTTAT-3') (Bowles et al., 1993) и CoxL
(5'-TCCTCCCCAGACCAGTCATAG-3'). Праймер CoxL был сконструирован при помощи про-
граммы Primer 3 v. 4.1.0 (Untergasser et al., 2012) c использованием нуклеотидной последова-
тельности гена cox1 L. paradoxum из GenBank (LC466790.1). ПЦР проводили с использовани-
ем DreamTaq ДНК-полимеразы (Thermo Scientific, Литва) по описанному ранее протоколу c
температурой отжига праймеров 55°C (Prokhorova et al., 2020b). Выделение ПЦР-продуктов
из агарозного геля и их очистку производили при помощи коммерческого набора Wizard® SV
Gel and PCR Clean-Up System (Promega, США) согласно инструкции производителя. Секвени-
рование по Сэнгеру осуществляли в научно-производственной компании «СИНТОЛ».
Анализ секвенограмм, сборку и выравнивание нуклеотидных последовательностей прово-
дили с помощью программ BioEdit v. 7.2.5 (Hall, 1999) и MEGA 7.0 (Kumar et al., 2016). Анализ
последовательностей, подсчет нуклеотидного, гаплотипического разнообразия и генетических
дистанций осуществляли с использованием программ DNAsp v.6 (Rozas et al., 2017) и MEGA
7.0 (Kumar et al., 2016). Для подсчета генетических расстояний, помимо полученных в дан-
ном исследовании нуклеотидных последовательностей L. paradoxum, использовали данные из
GenBank (LC466790.1-LC466795.1). Сети гаплотипов строили при помощи программы PopArt
v. 4.8.4 (Leigh, Bryant, 2015).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе исследования получено и аннотировано в GenBank 18 последовательностей
фрагмента гена cox1 спороцист трематод L. paradoxum длиной от 761 до 810 п. н.
(табл. 1). В дальнейшей работе использовали выравнивание длиной 761 п. н.
356
АТ-состав полученных нуклеотидных последовательностей участка гена cox1 ра-
вен 59.1%. Анализ полиморфизмов позволил выявить 10 гаплотипов. Было выявлено
9 синонимичных замен (1.2% от общей длины анализируемого локуса). Во всех случа-
ях изменен последний нуклеотид в триплете. Для гаплотипа Hap_7 характерна замена,
приводящая к замене цистеина на триптофан. Вероятно, данная замена не затрагивает
функциональный сайт белка.
Таблица 1. Гаплотипическое разнообразие трематод Leucochloridium paradoxum на террито-
рии Ленинградской области по фрагменту митохондриального гена cox1
Table 1. Genetic diversity of Leucochloridium paradoxum trematodes from the Leningrad Region
based on the cox1 gene fragment
№
Место сбора образцов
N
Sh
Hd
Pi
последовательностей
(обозначение популяции)
в GenBank
Вырица (Vyr)
10
5 (Hap_1, Hap_3,
0.84
0.00274
MZ676722-31
Hap_4, Hap_6, Hap_7)
Любань (Lub)
3
3 (Hap_3, Hap_8,
1.00
0.00175
MZ676733-34
Hap_9)
Бокситогорск (Boks)
3
3 (Hap_2, Hap_3,
1.00
0.00263
MZ676715-17
Hap_5)
Кузьмолово (Kuz)
2
2 (Hap_3, Hap_10)
1.00
0.00131
MZ676735-36
Общее
18
10
0.850
0.00242
П ри меч ан ия. Hd - гаплотипическое разнообразие, N - количество образцов,
Pi - нуклеотидное разнообразие (на сайт), Sh - количество гаплотипов.
Hd - haplotype diversity, N - number of specimens (sequences),
Pi - nucleotide diversity (per site), Sh - number of haplotypes.
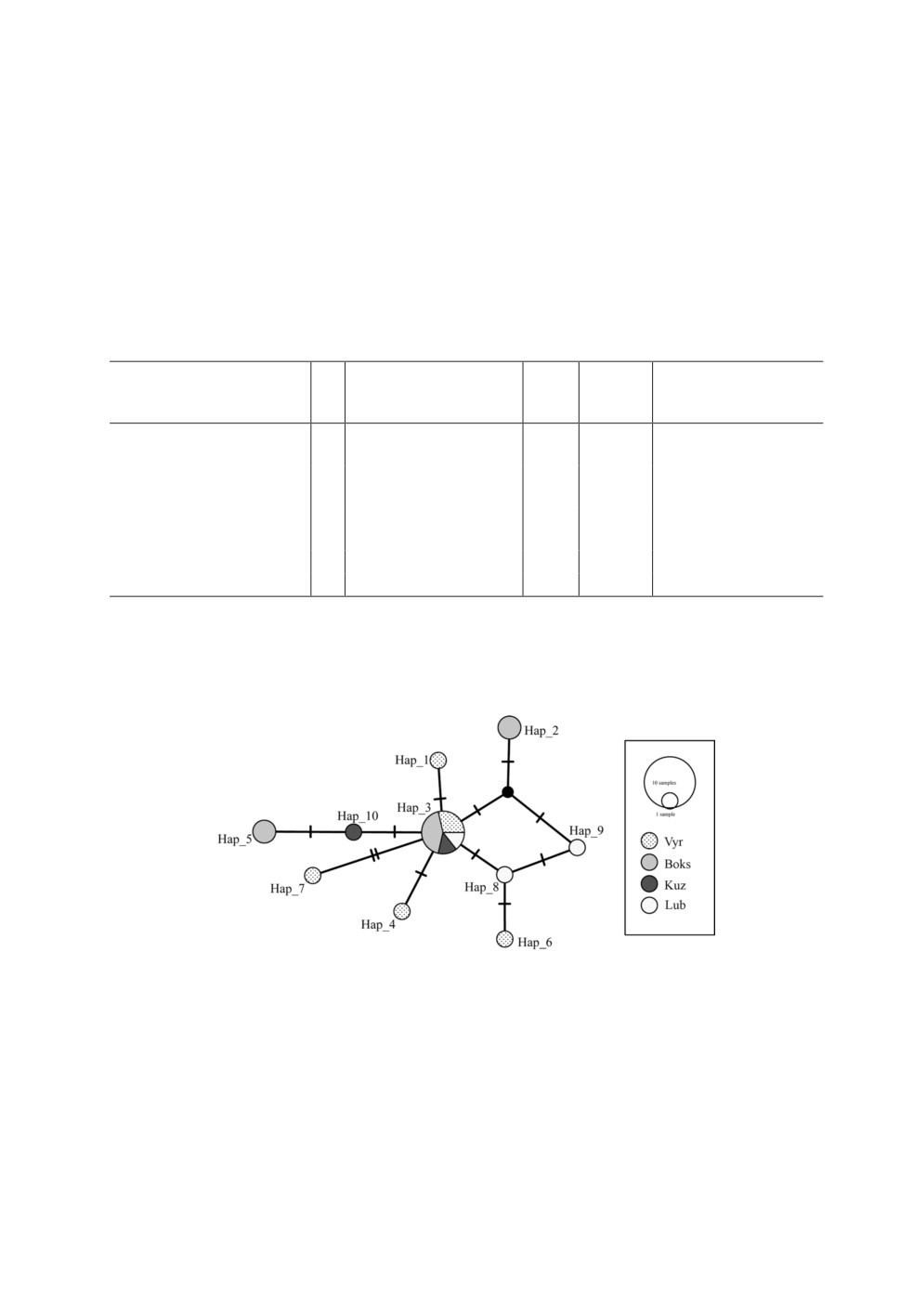
Рисунок 1. Медианная сеть гаплотипов, построенная на основании выравнивания
нуклеотидной последовательности фрагмента гена cox1 трематод Leucochloridium paradoxum.
Длина выравнивания 761 п. н. Размер кругов соответствует количеству последовательностей,
относящихся к гаплотипу. Обозначения места сбора образцов - как в табл. 1.
Штрихи - количество нуклеотидных замен. Черный круг - гипотетический гаплотип.
Figure 1. Median-joining haplotype network based on the nucleotide sequences of cox1
Leucochloridium paradoxum trematodes alignment. The length of alignment is 761 b.p.
The size of circles in the network is proportional to the frequency of the haplotype. Codes
of collection localities as in Table 1. Every mutation is shown as one hatch mark.
The solid circle indicates an unobserved hypothetic haplotype.
357
Гаплотипы на медианной сети формируют звездообразную структуру (рис. 1). При
этом основной гаплотип Hap_3 включает наибольшее число последовательностей (7)
из всех географических точек. Остальные представлены 1-2 последовательностями
и отличаются от основного гаплотипа 1-2 заменами. Большое количество последо-
вательностей, характеризующихся сходными полиморфизмами (Hap_3), может сви-
детельствовать о том, что данный гаплотип является предковым для всех остальных
(Ferreri et al., 2011).
Звездообразная структура гаплосети и доминирование одного гаплотипа ранее
были показаны для трематод Opisthorchis felineus Rivolta, 1884 (Brusentsov et al.,
2013). Отдельные гаплотипы не приурочены к географическим точкам и у трематод
Diplostomum pseudospathaceum Niewiadomska, 1984 (Enabulele et al., 2018). Авторы
этих работ рассматривают такую картину распределения гаплотипов как результат
резкого роста популяции при малом количестве ее основателей (эффект бутылочного
горлышка).
Число гаплотипов, выявленное в каждой географической точке, соответствует, как
минимум, количеству исследованных образцов. Наиболее представленной по числу
гаплотипов (5) является Вырицкая популяция. Однако следует отметить, что для этой
точки сбора было изучено наибольшее количество спороцист.
Анализ генетических расстояний показал, что наиболее близки друг к другу по-
пуляции из поселков Вырица и Кузьмолово (табл. 2). Самое большое расстояние на-
блюдалось между популяциями из Вырицы и Бокситогорска, а также из Вырицы и
Любани. Среднее генетическое расстояние между изученными выборками составляет
0.00219 ± 0.00030. Среднее генетическое расстояние между выявленными на терри-
тории Ленинградской области гаплотипами составляет 0.00237 ± 0.00117.
Таблица 2. Генетические дистанции (p-distance) между популяциями трематод
Leucochloridium paradoxum, рассчитанные на основании нуклеотидной последовательности
участка гена cox1
Table 2. Genetic distances (p-distance) between Leucochloridium paradoxum populations,
calculated on the basis of cox1 gene fragment
Географическая точка
Boks
Vyr
Lub
Kuz
Vyr
0.00250
Lub
0.00234
0.00250
Kuz
0.00197
0.00184
0.00197
Japan
0.03132
0.03132
0.31320
0.03066
П ри м еча ния. В анализе использованы 24 последовательности, объединенные в 5 групп
в соответствии с точками сбора. Обозначения образцов представлены в табл. 1.
В качестве внешней группы были использованы нуклеотидные последовательности
L. paradoxum из Японии (Japan).
Codes reflect the population groupings (see table 1). Nucleotide sequences
of L. paradoxum from Japan were used as outgroup.
358
Полученные данные о генетических дистанциях между выборками L. paradoxum
на территории Ленинградской области сопоставимы с результатами, описанными для
этого вида в Японии. Средняя внутривидовая генетическая дистанция, подсчитанная
на основе нуклеотидной последовательности гена cox1 спороцист L. paradoxum на
территории острова Хоккайдо, составляет 0.00300 при нуклеотидном разнообразии
0.00150 (Nakao et al., 2019). Соответствующие показатели для изученных в данном
исследовании трематод равны 0.00237 и 0.00240. При этом по охваченной исследова-
нием площади и расстоянию между точками сбора выборки сопоставимы. Для Чехии
генетические дистанции между исследованными образцами L. paradoxum составили
0.00500 ± 0.00300 (Heneberg et al., 2016). Генетические расстояния по исследуемому
маркеру между трематодами из Японии и Европы составляют от 0.01600 (с образцами
с территории Чехии) (Heneberg et al., 2016; Nakao et al., 2019) до 0.03120 (с террито-
рии Ленинградской области России), что свидетельствует о значительной изоляции
японских трематод.
В целом, значения генетических дистанций между популяциями L. paradoxum
сопоставимы с таковыми трематод семейства Leucochloridiidae других видов.
У L. perturbatum они составляют 0.0050-0.0240, у L. vogtianum - 0.0040 ± 0.0030,
у Urotocus rossitensis - 0.0360 (Heneberg et al., 2016; Nakao et al., 2019).
Рибосомная ДНК L. paradoxum является более консервативной по сравнению с ми-
тохондриальной. Ранее было установлено, что все спороцисты этого вида полностью
идентичны по протяженным последовательностям (около 5000 п. н.) рДНК, вклю-
чая самые вариабельные ее части - внутренние траснкрибируемые спейсеры (ITS1
и ITS2) (Zhukova et al., 2014). Незначительны различия по участку рДНК и между
близкими видами в пределах рода. Между L. paradoxum и L. perturbatum они соста-
вили 1.56% (Ataev et al., 2016). В то же время для других представителей семейства
Leucochloridiidae - видов рода Urogonimus - показаны намного бóльшие межвидовые
различия. По участкам ITS2 и 5.8 S рДНК виды U. certhiae и U. macrostomus раз-
личаются на 6.50 и 6.10 %, соответственно (Prokhorova et al., 2020b).
Таким образом, анализ фрагмента митохондриального гена cox1 позволил выявить
генетический полиморфизм спороцист трематод L. paradoxum на территории Ленин-
градской области. С использованием данного маркера было показано, что спороцисты
в этой части ареала обособлены от спороцист на территории Японии, однако выяв-
ленные различия укладываются в рамки внутривидовой изменчивости.
БЛАГОДАРНОСТИ
Исследование выполнено при финансовой поддержке РФФИ (проект № 20-34-
90012). Секвенирование выполнено за счет средств гранта Президента РФ для госу-
дарственной поддержки научных исследований молодых российских ученых - кан-
дидатов и докторов наук (№ МК-1015.2021.1.4).
359
СПИСОК ЛИТЕРАТУРЫ
Гинецинская Т.А. 1953. Значение окраски спороцист трематод рода Leucochloridium для диагностики вида.
Доклады АН СССР 88 (1): 177-179. [Ginetsinskaya T.A. 1953. Znachenie okraski sporocist trematod roda
Leucochloridium dlya diagnostiki vida. Doklady USSR Academy of Sciences (In Russian)]
Ataev G.L., Zhukova A.A., Tokmakova A.S., Prokhorova E.E. 2016. Multiple infection of amber snails Succinea
putris with sporocysts of Leucochloridium spp. (Trematoda). Parasitology Research 115 (8): 3203-3208.
Bowles J., McManus D.P. 1993. Rapid discrimination of Echinococcus species and strains using a poly-
merase chain reaction-based RFLPmethod. Molecular and Biochemical Parasitology 57: 231-240.
Brusentsov I.I., Katokhin A.V., Brusentsova I.V., Shekhovtsov S.V., Borovikov S.N., et al. 2013. Low genetic
diversity in wide-spread eurasian liver fluke Opisthorchis felineus suggests special demographic history of
Casey S.P., Bakke T.A., Harris P.D., Cable J. 2003. Use of ITS rDNA for discrimination of European green-and
brown-banded sporocysts within the genus Leucochloridium Carus, 1835 (Digenea: Leucochloridiidae).
Enabulele E.E., Awharitoma A.O., Lawton S.P., Kirk R.S. 2018. First molecular identification of an agent
of diplostomiasis, Diplostomum pseudospathaceum (Niewiadomska, 1984) in the United King-
dom and its genetic relationship with populations in Europe. Acta Parasitologica 63 (3): 444-453.
Ferreri M., Qu W., Han B. 2011. Phylogenetic networks: A tool to display character conflict and demographic
Hall T.A. 1999. BioEdit: A user-friendly biological sequence alignment editor and analysis program for Windows
95/98/NT. Nucleic Acids Symposium Series 41: 95-98.
Heneberg P., Sitko J., Bizos J. 2016. Molecular and comparative morphological analysis of central European para-
sitic flatworms of the superfamily Brachylaimoidea Allison, 1943 (Trematoda: Plagiorchiida). Parasitology
Kumar S., Stecher G., Tamura K. 2016. MEGA7: Molecular evolutionary genetics analysis version 7.0 for Bigger
Leigh J.W, Bryant D. 2015. PopART: Full-feature software for haplotype network construction. Methods in Ecol-
Nakao M., Sasaki M., Waki T., Iwaki T., Mori Y., Yanagida K., et al. 2019. Distribution records of three species
of Leucochloridium (Trematoda: Leucochloridiidae) in Japan, with comments on their microtaxonomy and
Pojmanska T., Machaj K. 1991. Differentiation of the ultrastructure of the body wall of the sporo-
cyst of Leucochloridium paradoxum. International Journal for Parasitology 21 (6): 651-659.
Prokhorova E.E., Usmanova R.R., Ataev G.L. 2020a. An analysis of morphological and molecular genetic char-
acters for species identification of amber snails Succinea putris (Succineidae). Invertebrate Zoology 17
Prokhorova E.E., Vinogradova A.A., Tokmakova A.S., Ataev G.L. 2020b. The first record of the trematode Uro-
gonimus certhiae (Trematoda: Leucochloridiidae) in the Eurasian nuthatch Sitta europaea. Zoosystematica
Rozas J., Ferrer-Mata A., Sánchez-DelBarrio J.C., Guirao-Rico S., Librado, P., Ramos-Onsins S.E., Sánchez-
Gracia A. 2017. DnaSP 6: DNA Sequence polymorphism analysis of large datasets. Molecular Biology
Untergasser A., Cutcutache I., Koressaar T., Ye J., Faircloth B.C., Remm M., Rozen S.G. 2012. Primer3 - new
Zhukova A.A., Prokhorova E.E., Tokmakova A.S., Tsymbalenko N.V., Ataev G.L. 2014. Identification of species
Leucochloridium paradoxum and L. perturbatum (Trematoda) based on rDNA sequences. Parazitologiya
48 (3): 185-192.
360
GENETIC VARIABILITY OF LEUCOCHLORIDIUM PARADOXUM TREMATODES
FROM THE LENINGRAD REGION WITH THE USE OF THE MITOCHONDRIAL
CYTOCHROME OXIDASE SUBUNIT I (COX1) GENE FRAGMENT
R. R. Usmanova, A. S. Tokmakova, O. D. Lopatina, E. E. Prokhorova
Keywords: trematodes, Leucochloridium, cox1, genotyping, haplotype analyses
SUMMARY
Genetic variability of Leucochloridium paradoxum Carus, 1835 trematodes from the
north-eastern Europe (Russia, Leningrad Region: Vyritsa, Kuzmolovo, Boksitogorsk, Ly-
uban) based on the mitochondrial cytochrome oxidase subunit I (cox1) gene fragment
was analyzed. Ten cox1 haplotypes were revealed. The average genetic distance between
samples was 0.00237 ± 0.00117. The average genetic distance between sampling sites was
0.00219 ± 0.00030.
361