ПАРАЗИТОЛОГИЯ, 2021, том 55, № 6, с. 443-464.
УДК 594.3+571.27+591.113
ФИБРИНОГЕНПОДОБНЫЕ БЕЛКИ ГАСТРОПОД
© 2021 г. Е. Е. Прохорова*, Г. Л. Атаев
Российский государственный педагогический университет им. А.И. Герцена,
кафедра зоологии, лаборатория экспериментальной зоологии,
наб. р. Мойки, д. 48, Санкт-Петербург, 191186 Россия
*e-mail: elenne@mail.ru
Поступила в редакцию 12.08.2021 г.
После доработки 30.08.2021 г.
Принята к публикации 01.09.2021 г.
К фибриногенподобным белкам (fibrinogen-related proteins, FREP) относятся кальций-
зависимые лектины, имеющие в своем составе один фибриногеновый и один или два иммуно-
глобулиновых домена. Для FREP гастропод характерна уникальная среди патогенраспознающих
молекул беспозвоночных способность к соматической диверсификации. Структура кодирующих
FREP геномных участков подразумевает возможность альтернативного сплайсинга и соматиче-
ского мутагенеза. С момента открытия у моллюсков Biomphalaria glabrata FREP были описаны
у многих гастропод. В настоящее время выделяют как минимум 14 подсемейств FREP. FREP
разных подсемейств избирательно участвуют в иммунном ответе на патогены различной при-
роды. В частности, подтверждена роль FREP в защитных реакциях на трематодную инвазию и
в формировании резистентности моллюсков к трематодам конкретных видов. Предполагаемые
функции FREP разнообразны - от распознавания чужеродного до опсонизации и нейтрализа-
ции патогенов. Несмотря на обилие работ, посвященных изучению и открытию новых FREP
моллюсков, в отечественной литературе этот вопрос почти не обсуждался. Соответственно,
основная цель данной статьи - анализ сведений о FREP гастропод и обсуждение места FREP
среди патогенраспознающих рецепторов моллюсков.
Ключевые слова: фибриногенподобные белки (FREP), гастроподы, трематодная инвазия,
резистентность, патогенраспознающие рецепторы, врожденный иммунитет
DOI: 10.31857/S0031184721060016
В последнее время заметно возрос интерес к исследованиям в области сравни-
тельной иммунологии. Среди беспозвоночных одной из наиболее изучаемых моделей
являются брюхоногие моллюски. Во многом это внимание обусловлено их ролью
промежуточных хозяев в жизненных циклах трематод. Изучение защитных реакций
проводится как на улитках из природных популяций, так и на лабораторных линиях
моллюсков, с разной степенью резистентности по отношению к трематодной инвазии.
Одиними из основных вопросов при изучении паразито-хозяинных систем являются
определение механизмов совместимости паразита и хозяина и определение степени
специфичности этого взаимодействия (Connors, 2003; Атаев и др., 2020). Взаимодей-
443
ствия между организмами происходят на уровне молекул - поверхностных рецепторов
и их лигандов. Соответствие поверхностных и секретируемых антигенов паразита
и хозяина определяет особенности этого взаимодействия и совместимость паразито-
хозяинной системы.
Распознавание чужеродного - центральное событие иммунного ответа. Особен-
ности этого процесса лежат в основе фундаментальной классификации типов имму-
нитета. Считается, что беспозвоночные животные являются обладателями системы
врожденных защитных реакций (см.: Атаев и др., 2020). В основе распознавания
в системе врожденного иммунитета лежит способность различать так называемые об-
разы патогенности, или патоген-ассоциированные молекулярные паттерны (pathogen-
associated molecular pattern, PAMP), сигнализирующие о возможности опасности их
носителя (Janeway, Medzhitov, 2002). Распознавание PAMP происходит с помощью
патогенраспознающих рецепторов (pattern recognition receptors, PRR), представленных
как на иммуноцитах, так и на других клетках (эпителиальных, нервных, соедини-
тельнотканных и др.). PRR очень разнообразны, но самой представленной среди них
является группа Toll-подобных рецепторов и лектинов (см. Атаев и др., 2020).
Лектины беспозвоночных животных хорошо изучены. Их функции в системе
иммунитета беспозвоночных не ограничиваются распознаванием PAMP (см.: Vasta,
Ahmed, 2009). Лектины обладают агглютинирующей активностью и опсонизируют
патогены, усиливая их фагоцитоз или инкапсуляцию (Кокряков, 2006). Роль лекти-
нов в распознавании и уничтожении партенит трематод была убедительно показана
в 80-х годах прошлого века в многочисленных экспериментах с заражением моллю-
сков Biomphalaria glabrata трематодами Schistosoma mansoni и Echinostoma paraen-
sei. В частности, было подтверждено наличие в плазме моллюсков, которые относи-
лись к резистентным к трематодной инвазии линиям, агглютинирующих факторов,
которых не было в плазме особей чувствительных линий (Loker et al., 1984, 1994;
Bayne et al., 1986; Couch et al., 1990). В экспериментах in vitro было показано, что
Biomphalaria glabrata, зараженные трематодами Echinostoma paraensei, продуцируют
белки, которые связывают экскреторно-секреторные продукты (ЭСП) трематод, по-
лученные при культивировании спороцист. У моллюсков, иммунизированных бакте-
риями, или незараженных особей таких реакций не наблюдалось (Hertel et al., 1994;
Adema et al., 1997). Это привело исследователей к мысли о том, что именно трема-
тодная инвазия приводит у биомфалярии к выработке и, как следствие, повышению
концентрации гуморальных защитных белков (вероятно, лектинов).
В дальнейшем было установлено, что с ЭСП E. paraensei связываются три груп-
пы молекул гемолимфы (Monroy, Loker, 1993; Hertel et al., 1994; Adema et al., 1997)
с молекулярным весом 65, 80-120 и 200 кДа. При этом in vitro связывание с ЭСП
избирательное и зависит от их концентрации в плазме. При добавлении 1 мкл ЭСП
в гемолимфу моллюсков Biomphalaria glabrata, зараженных Echinostoma paraensei,
в образующемся осадке с 4-го по 14-й день обнаруживаются белки из фракций
200 кДа и 80-120 кДа. При добавлении 10 мкл ЭСП в гемолимфу зараженных мол-
люсков они связываются белками из фракции с молекулярным весом 65 кДа. Белки
детектируются со 2-го по 8-й день после заражения (п.з.). Интересно, что обработка
гемолимфы одного и того же моллюска разным количеством ЭСП приводит к обра-
зованию обоих вариантов преципитатов.
444
В 1997 г. были секвенированы частичные аминокислотные последовательности
четырех пептидов из 65 кДа фракции белков, выделенных из плазмы M-линии Biom-
phalaria glabrata (Adema et al., 1997). Было установлено, что белки функционируют
как кальций-зависимые лектины, связывающиеся с остатками L-фукозы. Выявленные
пептидные последовательности были использованы для предсказания соответствую-
щих нуклеотидных последовательностей. Их анализ показал, что N-концевая часть
пептидов содержит участок, гомологичный домену иммуноглобулинового суперсе-
мейства (immunoglobulin-superfamily like domain, IgSF домен), а С-концевая область -
фибриногеновый домен (fibrinogen-like domain, FBG домен. Анализ экспрессии пока-
зал, что при заражении трематодами Echinostoma paraensei количество транскриптов
возрастает в три раза и коррелирует с ростом числа гемоцитов.
Бóльшая часть данных о FREP гастропод получена для моллюсков Biomphalaria
glabrata - промежуточных хозяев трематод Schistosoma mansoni. Именно для биомфа-
лярий впервые изучены защитные реакции гастропод в ответ на трематодную инвазию
(Lie, Heyneman, 1976a, 1976b; Lie et al., 1982, 1983; Sullivan et al., 1982; Sire et al.,
1998; Ataev, Coustau, 1999), бактериальное заражение (Cheng, 1975; Matricon-Gondran,
Letocart, 1999), а также описан клеточный ответ моллюсков на трансплантаты органов
и тканей улиток (Cheng, Jourdane, 1987; Jourdane, Cheng, 1987; Sullivan, 1990; Sullivan
et al., 1998). За длительное время культивирования в лабораторных условиях путем
направленных скрещиваний и отбора были выведены линии Biomphalaria glabrata,
различающиеся по уровню резистентности к разным видам трематод (Newton, 1953;
Richards, 1970; Richards, Shade, 1987; Lewis et al., 2001; см.: Атаев, Полевщиков, 2004;
Атаев и др., 2005). Выявление генетических основ резистентности биомфалярий при-
вело в том числе и к открытию геномных локусов, кодирующих FREP.
Классификация FREP
Первоначально было выделено четыре подсемейства FREP Biomphalaria glabrata,
различающихся по нуклеотидным последовательностям, которые кодируют IgSF до-
мены (Adema et al., 1997). Постепенно количество подсемейств доросло до 14 (Zhang
et al., 2008). Белки, которые кодируются последовательностями, гомологичными на
90% и со сходством аминокислотной последовательности не менее чем на 85%, от-
носят к одному подсемейству (Zhang et al., 2004). Классификация FREP затруднена,
что обусловлено большой вариабельностью внутри некоторых подсемейств (например,
FREP2) (Gordy et al., 2015). Кроме того, рост числа геномных и транскриптомных
исследований привел к открытию новых представителей FREP, которые не могли
быть классифицированы ни в одно из традиционных подсемейств (Adema et al., 2017;
Galinier et al., 2017; Lu et al., 2020).
В 2017 г. была предложена альтернативная классификация (Galinier et al., 2017).
Две любые последовательности FREP, идентичные более чем на 85%, были отнесены
к одному классу и обозначены одной латинской буквой. FREP с одним доменом IgSF
сгруппировали в классы от A до F, с двумя доменами - в классы от H до M. Коди-
рующие их геномные локусы обозначили числами (например, С1 и С2).
В настоящее время используются обе классификации FREP, что значительно
осложняет сопоставление получаемых результатов и описание вновь открытых FREP
моллюсков других видов.
445
Структура, геномные локусы и особенности организации
доменов FREP
FREP имеют уникальную доменную организацию. На N-конце полипептида на-
ходятся один или два IgSF домена, а на С-конце расположен FBG домен (Doolittle,
1992; Kurosava, Hashimoto, 1996; Adema et al., 1997). Между доменами располагаются
промежуточные участки (ICR, interceding region). мРНК FREP может содержать 4 или
6 экзонов (рис. 1).
Несмотря на то, что недавно стали доступными данные анализа геномных участ-
ков, кодирующих FREP (Lu et al., 2020), на сегодняшний день основная информация
о структуре молекул и участках генома, кодирующих FREP, - результат анализа транс-
криптомов. Многочисленные работы, посвященные изучению дифференциальной экс-
прессии факторов иммунного ответа у биомфалярий при трематодной инвазии, дали
примерное представление о том, как устроены домены FREP и их гены (Mitta et al.,
2005; Jiang et al., 2006; Guillou et al., 2007; Lockyer et al., 2008; Zhang et al., 2008;
Zahoor et al., 2014; Lu et al., 2020).
Рисунок 1. Организация генов, доменная организация и механизмы формирования
разнообразия фибриногенподобных белков (FREP) (по: Атаев и др., 2020, с изменениями).
А - организация геномных локусов и доменная структура FREP. Е1-Е6 - экзоны,
SP - сигнальный белок, IgSF - домен иммуноглобулинового суперсемейства, FBG -
фибриногеновый домен, ICR - промежуточный участок, PAN/Apple - PAN/Apple-подобный
домен. Для каждого FREP показан один из возможных вариантов мРНК. Б - схема
формирования разнообразия FREP в онтогенезе моллюска (пояснения в тексте).
Figure 1. Organization of genomic loci, domain structure and mechanisms of formation
of a variety of fibrinogen-like proteins (FREP) (see Ataev et al., 2020 with changes).
A - organization of genomic loci and domain structure of FREPs. E1-E6 - exons, SP - signaling
protein, IgSF - domain of the immunoglobulin superfamily, FBG - fibrinogen domain,
ICR - intermediate region, PAN/Apple - PAN/Apple-like domain. Б - scheme of the formation
of the FREP diversity in the ontogeny of the mollusс (see text for explanations).
446
Гены FREP биомфалярии кластеризованы и расположены в непосредственной бли-
зости друг от друга и от фрагментов FREP-подобных последовательностей (Zhang
et al., 2001; Gordy et al., 2015; Lu et al., 2020). Так, три гена FREP3 и один ген FREP14
локализованы в пределах геномной области 70000 пн. Вероятно, эти последователь-
ности FREP возникли в результате дупликаций генов. Такая конфигурация генов пред-
полагает большую пластичность и может обеспечить материал для диверсификации за
счет конверсии генов. Кроме того, именно такая структура генов часто ассоциируется
с соматическим мутагенезом. Биоинформатический анализ показал, что все гены FREP
кодируют сигнальные пептиды, обеспечивающие секрецию белков (Chen et al., 2007;
Hanington et al., 2010b).
Полная информация о кодирующих участках генома и аминокислотных последо-
вательностях получена только для некоторых представителей FREP, преимущественно
FREP2, 3, 4 и 7 (Gordy et al., 2015). Для всех FREP, у которых доступны после-
довательности интронов, границы экзон-интрон определяются правилом GT-AG.
Гомология последовательностей интронов составляет менее 25%. Cайты сплайсинга
относятся к типу 1, за исключением интрона 3 в FREP3 и 7, которые относятся
к типу 0 (Leonard et al., 2001; Zhang et al., 2001).
Фибриногеновый домен - наиболее консервативная часть молекул FREP. Гомоло-
гия FBG доменов, относящихся к разным группам FREP, составляет не менее 72%
(Dheilly et al., 2015). FBG домены высоко консервативны не только внутри классов
FREP (Leonard et al., 2001; Zhang et al., 2001, 2008; Zhang, Loker, 2003), но и между
классами (Hanington, Zhang, 2011). Средняя гомология по аминокислотной последова-
тельности FBG доменов составляет ~65% при функциональном сходстве аминокислот
~84% (Zhang et al., 2008).
Для иммуноглобулиновых доменов FREP характерна крайняя вариабельность, ко-
торая была выявлена с помощью транскриптомного анализа (Dheilly et al., 2015).
В настоящее время на основании изучения структуры IgSF домена выделено как мини-
мум 14 подсемейств FREP моллюска B. glabrata (см. выше) (Loker et al., 2004; Gordy
et al., 2015; Galinier et al., 2017). У отдельных особей этого вида выявляется от 36 до
45 различных вариантов мРНК FREP3 (Zhang et al., 2004), которые соответствуют 31
и 36 вариантам аминокислотных последовательностей. Репертуар FREP также меняет-
ся по мере роста моллюска и после заражения трематодами разных видов (Hanington
et al., 2010a, 2010b, 2012; Gordy et al., 2015).
Существует два основных варианта организации генов FREP. Одна группа содер-
жит один IgSF домен, другая - два IgSF домена (рис. 1А). Гены FREP с одиночным
IgSF доменом (FREP2, 4 и 14) содержат 4 экзона и 3 интрона. Все гены FREP с двумя
IgSF доменами (FREP3, 7, 12 и 13) (обозначаемыми как IgSF1 и IgSF2) имеют одина-
ковую организацию интронов и содержат 6 экзонов и 5 интронов (Zhang et al., 2001).
Между тандемно расположенными IgSF доменами находится небольшой линкерный
участок. Экзоны, кодирующие IgSF2, обычно прерываются интронами. Таким образом,
домен IgSF2 может быть закодирован двумя или тремя экзонами (Adema et al., 2017).
IgSF1 домены и FBG домены закодированы одним экзоном. Домены IgSF всех FREP,
описанных на сегодняшний день, демонстрируют наибольшее сходство первичной
структуры с вариабельными доменами иммуноглобулинов (Gordy et al., 2015). При
этом домен IgSF2 значительно более вариабелен, чем домен IgSF1 (Lu et al., 2020).
447
Каждый домен IgSF в известных FREP содержит разное количество идентичных
и вариабельных аминокислот (FREP2: 24 идентичных, 29 вариабельных; FREP3: 31
и 38 для обоих доменов IgSF; FREP4: 25, 20). Все они обладают четырьмя канони-
ческими цистеинами, которые образуют межцепочечную петлю посредством дис-
ульфидных связей (Leonard et al., 2001; Zhang et al., 2001, 2008; Zhang, Loker, 2003).
Интересно, что домен IgSF2 тандемных IgSF по предсказанной аминокислотной
последовательности и интрон-экзонной структуре FREP ближе к одиночному IgSF
домену (идентичность 31-46%), чем к IgSF1 в той же молекуле (Zhang et al., 2001;
Dheilly et al., 2015). Так, у FREP3 в доменах IgSF1 и IgSF2 совпадает только 11%
аминокиcлотной последовательности, а у FREP7 - 12% (Zhang et al., 2001, 2008).
Промежуточная область, которая соединяет IgSF домены с FBG доменом, всегда
кодируется на двух последних экзонах. Интроны FREP2 и 4 хорошо изучены и состоят
из большого числа прямых повторов, которые различаются по длине (Gordy et al.,
2015; Portet et al., 2017). Области ICR демонстрируют низкую гомологию между собой
(в среднем ~10%) и значительно различаются по длине (от 14 до 320 аминокислот)
(Dheilly et al., 2015; Lu et al., 2020). При этом они обогащены такими аминокислотами,
как изолейцин (I), лейцин (L), лизин (K), аспарагин (N) и глутаминовая кислота (E)
(Gordy et al., 2015). Для их структуры характерно формирование спиральных шпилек
(coiled-coils), которые могут участвовать в мультимеризации FREP (Gorbushin, 2019).
Недавно на основе геномной последовательности B. glabrata был выявлен новый
тип FREP, содержащий на N-конце PAN/Apple -подобный домен (Adema et al., 2017).
Вопрос о количестве геномных локусов, кодирующих FREР у биомфалярии, оста-
ется открытым. Первоначально транскриптомный анализ показал наличие 14 вари-
антов мРНК FREP в транскриптоме B. glabrata (Leonard et al., 2001; Hanington et al.,
2010a). Путем ПЦР со специфическим праймерами к FBG домену было установлено,
что у одной особи B. glabrata М-линии может присутствовать до 42 уникальные по-
следовательности, кодирующие FREP (Zhang, Loker, 2004; Hanington, Zhang, 2011).
Анализ транскриптомов биомфалярий нескольких линий выявил 69 транскриптов,
потенциально кодирующих FREP. Сопоставление со сборкой генома позволило от-
нести их к 24 геномным локусам. (Galinier et al., 2017). Первый поиск FREP в геноме
B. glabrata линии BB02 выявил 20 генов с двумя тандемными доменами IgSF и 4 гена
с одним IgSF доменом, а также FREP, содержащий PAN/Apple домен (Adema et al.,
2017). Согласно данным последнего анализа c использованием усовершенствованного
алгоритма поиска (Hidden Markov Models (HMM)) в геноме B. glabrata присутствует
39 генов FREP (Lu et al., 2020).
Важный аспект, определяющий формирование специфичного репертуара FREP, -
существование вариантов аллелей генов, кодирующих FREP, и различия по этим
аллелям между популяциями (линиями моллюсков), характеризующимися разной
степенью восприимчивости к трематодной инвазии. Различия по аллелям между
моллюсками B. glabrata двух линий (чувствительной и резистентной к трематодам
Schistosoma mansoni), были обнаружены для FREP2, FREP3.1 и FREP3.2. В частно-
сти, одиночные нуклеотидные полиморфизмы, приводящие к замене аминокислот,
присутствуют в последовательностях, кодирующих FBG домен FREP2, IgSF1 и IgSF
2 домены, IgSF1, IgSF2 и FBG домены в FREP3.2 (Lu et al., 2020). Различия в наборе
аллелей между линиями Biomphalaria glabrata могут являться одним из основных
факторов, определяющих разную восприимчивость моллюсков к заражению трема-
тодами (Pila et al., 2017; Allan et al., 2019; Li et al., 2020).
448
Механизмы формирования разнообразия FREP
Фенотипическое разнообразие FREP намного превосходит количество заложенных
в геноме вариантов. Сопоставление геномных и транскриптомых данных выявило воз-
можность существования у одной особи различных вариантов FREP в разных клетках
и на разных этапах онтогенеза (Hanington et al., 2012; Adema, 2015). Этот феномен
стал основной для проведения аналогий между FREP и антигенраспознающими моле-
кулами адаптивного иммунитета беспозвоночных. Механизмы формирования разноо-
бразия FREP - один из ключевых вопросов иммунологии моллюсков и молекулярной
сравнительной иммунологии.
Возможность соматической диверсификации была показана для FREP2, FREP3,
FREP4 и FREP12 B. glabrata (Zhang et al., 2004; Mone et al., 2010; Hanington et al.,
2010b; Dheilly et al., 2015). В частности, FREP3 по разным оценкам кодируется в пяти
локусах (Zhang et al., 2004; Hanington et al., 2010a), однако от одной особи может
быть получено до 34 уникальных домена IgSF1 (Zhang et al., 2004) и 77 вариантов
с учетом всех доменов (Hanington et al., 2010a). События диверсификации были про-
демонстрированы не только в вариабельных доменах IgSF, но и в более консерва-
тивных доменах FBG (Zhang et al., 2004), а также промежуточных регионах (Zhang
et al., 2001; Hanington et al., 2010b; Dheilly et al., 2015).
В качестве наиболее вероятного механизма формирования разнообразия FREP рас-
сматривается альтернативный сплайсинг. Это подтверждается результатами много-
численных транскриптомных исследований, в которых у моллюсков обнаруживаются
разные варианты транскриптов одного и того же FREP (Galinier et al., 2017). Само
явление альтернативного сплайсинга для гастропод изучено слабо и показано толь-
ко для нескольких генов, экспрессирующихся в клетках нервной системы гастропод
(Price, Greenberg, 1994; Santama et al., 1996).
Наличие кластерной организации генов и соматических мутаций позволили пред-
положить возможность гипермутагенеза FREР по механизму, аналогичному сома-
тическому гипермутагенезу генов иммуноглобулинов позвоночных (Adema, 2015).
У B. glabrata выявлены нуклеотидные последовательности, кодирующие цитидиновую
дезаминазу (AID, activation-induced deaminase). Её экспрессия повышается у моллю-
сков, зараженных трематодами (Bouchut et al., 2006). AID избирательно дезаминирует
цитозины в последовательностях, кодирующих вариабельные домены иммуноглобули-
нов, что приводит к точечным мутациям - преимущественно C-T- переходам (Chen
et al., 2007; Neuberger, 2008). Однако для генов FREP в основном показаны точечные
мутации с переходами A-G и T-C (Mone et al., 2010).
Возможность соматического гипермутагенеза заложена и в механизме гемопоэ-
за пульмонат (рис. 1Б). В основном FREP экспрессируются в гемоцитах моллюсков
(Adema et al., 1997; Hanington et al., 2010a, 2010b). Предполагается, что случайные
соматические мутации могут возникать во время пролиферации и клеточной диф-
ференцировки в гемопоэтических структурах, что изменяет зародышевое состояние
генов в некоторых гемоцитах. В результате часть гемоцитов содержат гены FREP не
в зародышевой конфигурации, а включают уникальные мутации (Hanington et al.,
2010a, 2010b). Так как в онтогенезе улитки происходит обновление пула гемоцитов,
то и репертуар FREP, экспрессируемых в этих клетках, также меняется (рис. 1Б). Эта
закономерность показана экспериментально: транскрипты пулов из 20-40 гемоцитов
B. glabrata содержат различные наборы модифицированных последовательностей
449
FREP (Hanington et al., 2010a, 2010b). Стимуляция патогеном может усиливать гемо-
поэз у B. glabrata, в результате чего усиливается процесс мутагенеза и разнообразие
FREP (Hanington et al., 2012; Adema, Loker, 2015).
Другой обсуждаемый механизм формирования разнообразного репертуара FREP -
ретротранспозиция. Наличие обратных последовательностей показано для FREP12
(Zhang, Loker, 2003). Кроме того, у B. glabrata выявлены мобильные генетические
элементы, подобные LINE1. Эти элементы фланкированы короткими повторами и со-
держат открытые рамки считывания (Raghavan et al., 2007). Источником разнообразия
FRЕP на посттрансляционном уровне может быть формирование мультимеров (Zhang
et al., 2001).
Соответственно, у моллюсков репертуар патогенраспознающих молекул не ограни-
чивается только генотипически определенным ресурсом. Важно отметить, что ранее
онтогенетическая изменчивость патогенраспознающих молекул считалась прерогати-
вой только позвоночных животных (Medzhitov, Janeway, 1997).
Участие FREP в иммунных реакциях моллюсков
Впервые иммунологическая роль FREP была показана для моллюсков B. glabrata
M-линии, у которых экспрессия генов FREP повышалась в три раза после заражения
Echinostoma paraensei (Adema et al., 1997). В настоящее время установлено, что FREP -
одна из самых обильно представленных фракций белков плазмы биомфалярий
(Wu et al., 2017).
Было многократно подтверждено изменение экспрессии генов FREP при зараже-
нии моллюсков трематодами (Hertel et al., 2005; Mitta et al., 2005; Hanington et al.,
2010a, 2010b). Имеются данные о специфичности экспрессии FREP при заражении
трематодами разных видов. Так, у моллюсков Planorbarius corneus уровень экспрес-
сии генов FREP различен у незараженных особей и особей, зараженных разными
видами трематод. При заражении улиток партенитами Notocotylus sp. и Plagiorchis
sp. экспрессия FREP понижается, а у особей, зараженных Cotylurus sp. и Bilharziella
polonica, экспрессия FREP выше, чем у незараженных (Прохорова и др., 2010).
Показана зависимость между зараженностью моллюсков трематодами и уровнем
экспрессии FREP разных подсемейств (Guillou et al., 2004; Hertel et al., 2005; Jiang
et al., 2006). При заражении Biomphalaria glabrata мирацидиями Echinostoma paraensei
значительно усиливается транскрипция FREP двух подсемейств (FREP2 и FREP4)
и снижаетcя выработка FREP8 (Mitta et al., 2005; Adema et al., 2010). Заражение
трематодами Schistosoma mansoni усиливает экспрессию FREP2, FREP6, FREP11. Ин-
тересно, что у моллюсков линии BS-90 временной интервал повышенной экспрессии
FREP2 больше, чем время, в течение которого происходят инкапсуляция и элиминация
спороцист (Hertel et al., 2005; Dinguirard et al., 2018).
Кроме того, разные FREP обладают разной избирательной активностью в отноше-
нии патогенов различной природы: FREP2 плазмы зараженных моллюсков связывается
преимущественно со спороцистами Echinostoma paraensei, а FREP3 - с бактерия-
ми и грибами (Zhang et al., 2008). Инъекция бактерий Micrococcus luteus приводит
к усилению экспрессии FREP4 и FREP7. При этом Escherichia coli вызывает снижение
экспрессии FREP7 (Adema et al., 2010).
Предполагается, что повышение транскрипции генов FREР при заражении тре-
матодами может быть связано с усилением пролиферации гемоцитов, происходящей
450
в ответ на трематодную инвазию (Salamat, Sullivan, 2008). Транскриптомный анализ
подтвердил экспрессию FREP3 и FREP12 гемоцитами и ее усиление в ответ на за-
ражение трематодами (Hanington et al., 2012; Lockyer et al., 2012; Larson et al., 2014;
Galinier et al., 2017; Li et al., 2020). Однако пока не ясно, могут ли отдельные клетки
гемолимфы иметь уникальные наборы FREP, являющиеся результатом перестройки
генов или транскриптов в ответ на иммунизацию (Gordy et al., 2015). Есть данные, что
FREP3 экспрессируется не во всех гемоцитах Biomphalaria glabrata. При этом трема-
тодная инвазия приводит к росту доли гемоцитов с транскриптами FREP3 (Hanington
et al., 2010a).
Исследование изменений профилей экспрессии FREP в течение жизни моллюска
лежит в основе решения вопроса об их возможной диверсификации в ходе онтогенеза.
В ряде экспериментов показано, что моллюски B. glabrata разных возрастов разли-
чаются по интенсивности экспрессии и набору FREP. В частности, у биомфалярий
M-линии разных размерных классов (0.2-2.3 см) FREP2, 3, 4, 12, 13, и 14 экспресси-
руются с разной интенсивностью. При этом средний уровень экспрессии генов FREP
выше у улиток небольших размеров. FREP2 и FREP4 показали более интенсивную
экспрессию в улитках наименьшего размера (FREP2 - до 16 раз, FREP4 - до 60 раз).
FREP14 в наименьшей степени представлен у крупных улиток. Экспрессия FREP3
и FREP12 не отличается значимо у моллюсков разных размеров (Zhang et al., 2008).
Такие результаты дают основание для обсуждения возможных путей и причин
изменения генетических кластеров, кодирующих FREP у гастропод в ходе онтогенеза
(см. выше). Возможно, изменение репертуара секретируемых белков свидетельствует
о преобладании различных механизмов защиты на разных этапах онтогенеза орга-
низма и своеобразном «созревании» его защитной системы. Вероятно, роль FREP
не исчерпывается антитрематодным ответом. Они участвуют в иммунном ответе на
другие группы патогенов (бактерии, грибы, вирусы). И возможно, FREP участвуют
в таких физиологических процессах, как морфогенез, постэмбриональное развитие
и поддержание тканевого гомеостаза.
Роль FREP в резистентности к трематодной инвазии
Вопрос о роли FREP в формировании фенотипа, устойчивого к трематодной ин-
вазии, является одним из наиболее дискуссионных в исследовании биологии этих
молекул. Существуют многочисленные доказательства того, что именно FREP могут
определять совместимость в паразито-хозяинной системе «трематоды-моллюски».
Известно, что трематоды экспрессируют на своей поверхности многочисленные
и разнообразные гликопротеины, набор которых меняется при превращении мира-
цидиев в спороцисты (Yoshino, Bayne, 1983; Yoshino et al., 1993; Mone et al., 2010).
Разнообразие этих поверхностных (и секретируемых) молекул у Schistosoma mansoni
отражено в их названии - «полиморфные муцины» (PoMucs, polymorphic mucins)
(Mone et al., 2010). Считается, что именно полиморфные муцины во многом опреде-
ляют совместимость или несовместимость трематоды с хозяином. Только паразит,
имеющий муцины, совместимые с иммунной системой хозяина, может успешно раз-
виваться и размножаться в моллюске (Mitta et al., 2012). При этом под совместимо-
стью подразумевается неспособность гемоцитов моллюска распознать муцины, что
и определяет отсутствие защитной реакции (рис. 2). Изменение репертуара муцинов,
их мимикрия под собственные антигены моллюска, а также способность блокировать
451
защитные факторы иммунной системы - необходимые условия успешной инвазии. Со
стороны моллюска такими молекулами, обеспечивающими взаимодействие с разноо-
бразными антигенами паразита, являются FREP. В комплексе с другими гуморальны-
ми факторами иммунной системы (см. ниже) последние участвуют в формировании
фенотипа, резистентного или чувствительного к трематодной инвазии.
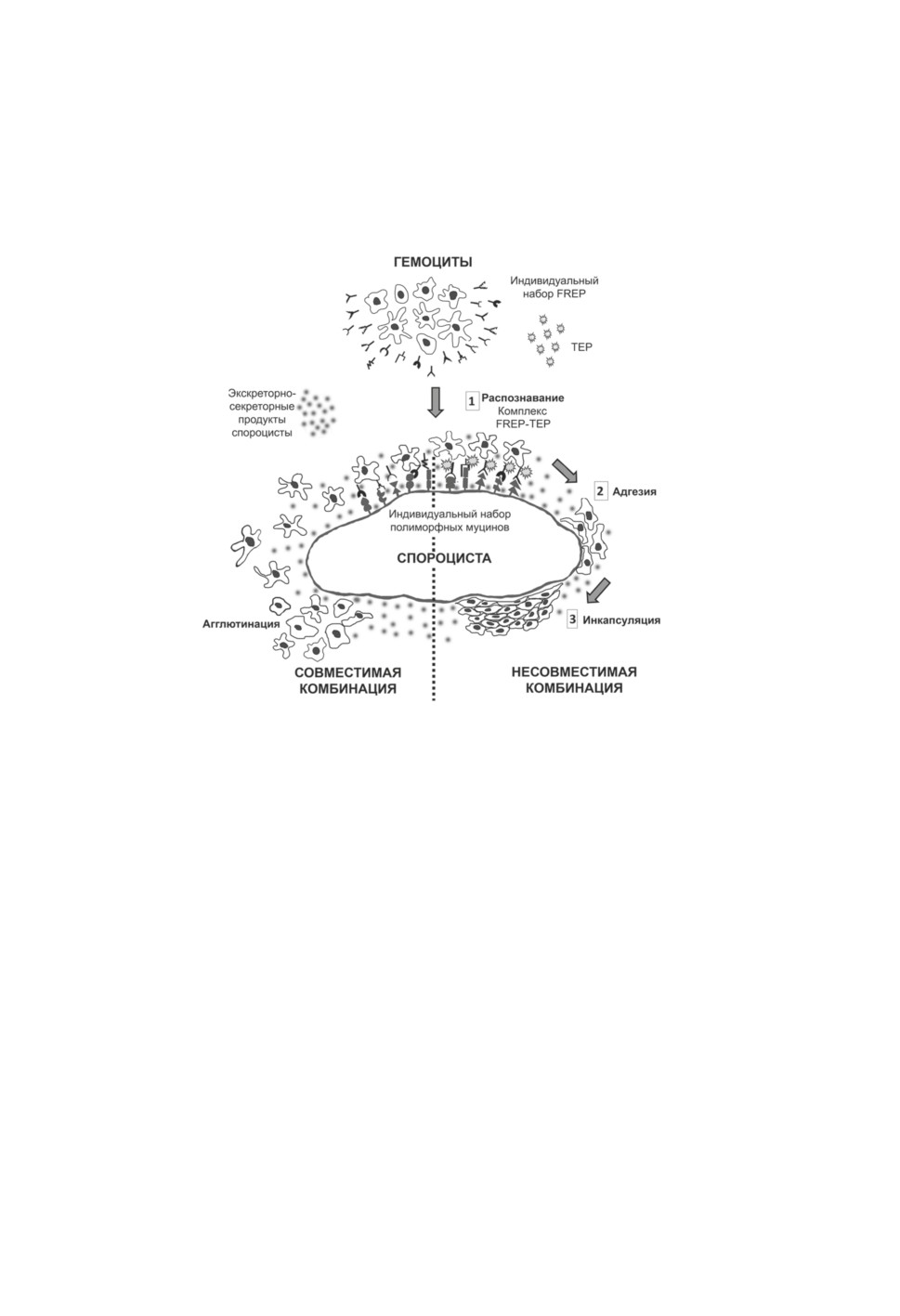
Рисунок 2. Участие фибриногенподобных белков в иммунных реакциях гастропод
на трематодную инвазию, основанное на взаимодействии комплексов молекул моллюска
с совместимыми полиморфными муцинами паразита.
FREP - фибриногенподобные белки, TEP - тиоэфирсодержащие белки.
Совместимая комбинация паразита и хозяина формируется в том случае,
когда FREP моллюска не способны взаимодействовать с полиморфными муцинами паразита.
В таком случае гемоциты, привлеченные экскреторно-секреторными продуктами спороцист,
скапливаются в месте инвазии (агглютинация), но не происходит их адгезии на поверхности
спороцисты. В несовместимой комбинации FREP моллюска подходят к полиморфным
муцинам паразита как ключ к замку. Комплекс FREP-TEP облегчает адгезию гемоцитов
на поверхности спороцисты, что приводит к ее инкапсуляции.
Figure 2. The participation of fibrinogen-like proteins in the immune reactions of gastropods
to trematode invasion, based on the interaction of the immune complexes of the mollusc
with compatible polymorphic mucins of the parasite.
FREP - fibrinogen-like proteins, TEP - thioester-containing proteins.
A compatible combination of the parasite and the host is formed when FREPs of the mollusc are
not able to interact with the polymorphic mucins of the parasite. In this case, hemocytes attracted
by the excretory-secretory products of sporocysts accumulate at the site of invasion (agglutination).
But their adhesion does not occur on the surface of the sporocyst. In an incompatible combination
of FREPs, the molluscs approach the polymorphic mucins of the parasite as the key to the lock.
The FREP-TEP complex facilitates the adhesion of hemocytes on the surface of the sporocyst,
which leads to its encapsulation.
452
У моллюсков Biomphalaria glabrata линий, различающихся по устойчивости
к трематодной инвазии, выявлены как конститутивные различия в экспрессии FREP,
так и различная интенсивность ответа при заражении трематодами (Hertel et al., 2005;
Mitta et al., 2005). В частности, у моллюсков резистентной линии BS-90 заражение
Schistosoma mansoni приводит к повышению уровня экспрессии FREP2 и FREP4 через
день п.з. в 57 раз и в 4.5 раза соответственно. А заражение Echinostoma paraensei
вызывает рост экспрессии FREP2 в 50 раз через день п.з. и FREP4 в 11 раз через
4 дня п.з. У моллюсков чувствительной линии M заражение обоими видами трематод
вызывает гораздо менее выраженный ответ. Линия М демонстрирует рост экспрессии
FREP2 на 4-й день п.з. трематодами E. paraensei только в 5 раз, а инвазия Schistosoma
mansoni вообще не приводит к повышению экспрессии FREP2 и FREP 4. В то же вре-
мя, для FREP7 было выявлено более специфическое повышение уровня экспрессии:
у моллюсков линии M, зараженных Schistosoma mansoni (до 12 раз), и улиток линии
BS-90, зараженных Echinostoma paraensei (увеличение в 6 раз) (Hertel et al., 2005).
В опытах с нокдауном генов FREP показано повышение восприимчивости
Biomphalaria glabrata резистентных линий к заражению трематодами Echinostoma
paraensei и Schistosoma mansoni. За два дня до заражения моллюскам и в культуру
эмбриональных клеток биомфалярии (Bge-cells) вводили двуцепочечную интерфери-
рующую РНК. РНК была комплементарна участку, кодирующему сигнальный пеп-
тид и IgSF домен FREP2. Это приводило к снижению экспрессии гена FREP2 после
заражения как шистосомой, так и эхиностомой на 20-30% по сравнению с контроль-
ной группой (Jiang et al., 2006).
Сходные результаты были получены и для FREP3 (Hanington et al., 2010a). Улит-
кам линии М Biomphalaria glabrata (резистентны к Echinostoma paraensei) вводили
коктейль из олигонуклеотидов, комплементарных консервативным участкам мРНК
FREP3. Это приводило к нокдауну экспрессии FREP3 через 72 ч после инъекции
и повышению чувствительности к инвазии E. paraensei на 28-33% (Hanington et al.,
2010a). Аналогичный эксперимент с моллюсками BS-90 линии Biomphalaria glabrata
(резистентной к Schistosoma mansoni) показал снижение резистентности к шистосом-
ной инвазии на 21% по сравнению с контрольной группой (Hanington et al., 2012).
Подавление резистентности в результате снижения экспрессии FREP3 может про-
исходить и в результате предварительного заражения облученными мирацидиями
Echinostoma parensei. В этом случае у моллюсков, зараженных эхиностомой линии
BS-90, снижается способность подавлять последующую инвазию Schistosoma mansoni
на 46%, а анализ экспрессии на микрочипах показывает значительное снижение числа
транскриптов FREP3 (Hanington et al., 2012).
Транскриптомный анализ также подтвердил, что FREP3.1 и FREP3.2 являются
факторами, определяющими устойчивость моллюсков к заражению трематодами.
Заражение S. mаnsoni приводит к быстрому нарастанию уровня экспрессии этих
белков только у резистентной линии моллюсков Biomphalaria glabrata (Lu et al.,
2020). Исследование транскриптома B. pfeifferi - вида, очень чувствительного к ин-
вазии Schistosoma mansoni, — показало, что уровень экспрессии FREP3 практически
не изменяется при заражении моллюсков шистосомами (Buddenborg et al., 2017). Од-
нако другие FREP реагируют на заражение: экспрессия FREP2 постепенно повышает-
ся во время инвазии, экспрессия FREP5, FREP7 и FREP14 увеличивается на ранних
стадиях заражения и во время эмиссии церкарий, а синтез FREP12 при инвазии по-
следовательно снижается.
453
Мишени FREP и взаимодействие с другими факторами иммунитета
В настоящие время остается невыясненной роль отдельных доменов FREP. Однако
существует множество предположений относительно функциональной активности
каждого из доменов на основе данных об участии этих (или гомологичных) доменов
в иммунных реакциях других беспозвоночных и позвоночных животных.
Известно, что FBG домен у позвоночных участвует в реакциях коагуляции
(Doolittle, 2016). Но его роль в этом процессе у беспозвоночных не подтверждена.
Для беспозвоночных разных групп показано участие FBG домена в защитных ре-
акциях - в распознавании бактериальных паттернов (Gokudan et al., 1999; Pieters,
Wolberg, 2019), аллогенном распознавании (Yamada et al., 2009), регуляции иммунного
ответа (Li, Graham, 2007), морфогенезе нервной системы и органов чувств (Yamada
et al., 2009). Принято считать, что FBG домен моллюсков не участвует в реакциях
коагуляции гемолимфы, а основная его функция - облегчение кальций-зависимого
связывания лектинов с углеводами (Adema et al., 1999). FBG домены гастропод спо-
собны распознавать сложные углеводы, участвуют в реакциях агглютинации и анти-
бактериальном ответе (Kurachi et al., 1998; Middha, Wang, 2008; Zhang et al., 2009).
Одним из лектинов, имеющих сайт связывания с ионами кальция, является селектин,
вовлеченный в процессы адгезии у моллюсков Biomphalaria glabrata (Guillou et al.,
2004).
Предполагаемые функции IgSF домена еще более разнообразны. У животных бел-
ки, содержащие IgSF домен, участвуют в тканевых межклеточных взаимодействи-
ях, являются рецепторами клеток нервной и мышечной тканей, а также выполняют
многочисленные функции в иммунной системе (Schroeder, Cavacini, 2010; Buchmann,
2014). IgSF домены беспозвоночных способны взаимодействовать с различными мо-
лекулярными паттернами, связанными с патогенами (Sun et al., 1990; Adema et al.,
1997; Zhang et al., 2001).
PAN/Apple-подобные домены участвуют в белок-белковых или белок-углеводных
взаимодействиях, выполняя разнообразные функции у представителей как позвоноч-
ных, так и беспозвоночных животных. Среди моллюсков PAN/Apple-подобные домены
обнаружены также у гастропод Lottia gigantea (Gorbushin et al., 2010) и бивальвий
Crassostrea gigas (Huang et al., 2015). Интересно, что FREP1 с PAN/Apple доменом
при заражении Schistosoma mansoni слабо экспрессируется у биомфалярий как рези-
стентной, так и чувствительной линии. Возможно, его функциональная активность
не связана с антитрематодным иммунным ответом (Lu et al., 2020).
Некоторые FREP биомфалярий образуют мультимеры. В частности, FREP4 обыч-
но секретируется в плазму в виде тетрамеров, а FREP3 формирует мультимерные
комплексы в ходе иммунного ответа (Zhang et al., 2008; Gordy et al., 2015). Пред-
полагается, что мультимеризация влияет на функции во время иммунного ответа.
Она может увеличить авидность (прочность) связывания и повысить аффинность
(специфичность) распознавания патогенов (Li et al., 2020).
Таким образом, каждый из доменов FREP может являться как патогенраспознаю-
щим, так и участвующим в нейтрализации патогена компонентом молекулы. Поэтому
в настоящее время FREP рассматриваются и в качестве наиболее значимых патоген-
распознающих молекул гастропод и в качестве функциональных молекул иммунного
ответа, обеспечивающих элиминацию патогена. Для того, чтобы выяснить функцио-
нальную роль FREP, необходимо определить их лигандную специфичность, выявить
молекулы-мишени, с которыми FREP взаимодействуют.
454
С использованием специфических антител показана способность FREP
Biomphalaria glabrata связываться с лигандами на поверхности бактерий, грибов
и тегумента трематод Schistosoma mansoni и Echinostoma paraensei (Zhang et al., 2008;
Mone et al., 2010). Впервые способность взаимодействовать с полиморфными муци-
нами шистосомы была показана для FREP2 Biomphalaria glabrata (Mone et al., 2010).
Доказательства распознавания полиморфных муцинов гемоцитами с участием FREP
были получены в экспериментах с использованием микросфер, покрытых гликопро-
теинами трематод (Peterson et al., 2009). Такие микросферы фагоцитируются гемоци-
тами B. glabrata быстрее и эффективнее, чем непокрытые микросферы.
С помощью вестерн-блоттинга было установлено, что FREP3 способен связывать-
ся моносахаридными мишенями, а наиболее сильно - с альфа-D-галактозой после
инкубации микросфер с бесклеточной плазмой B. glabrata. При этом микросферы,
покрытые дополнительно BgFREP3, фагоцитировались гемоцитами более эффектив-
но, чем любой из протестированных моносахаридов (Hanington et al., 2010b). Это
означает, что именно FREP является посредником во взаимодействии гемоцитов
с гликопротеинами трематод.
Другими белками моллюсков, выявленными в экспериментах по иммунопреципита-
ции, были тиоэфирсодержащий протеин (thioester-containing protein, TEP) и биомфали-
зин. Был предложен возможный механизм, объясняющий распознавание полиморфных
муцинов с участием комплекса FREP-TEP, а также биомфализина (Galinier et al., 2013;
Tereau et al., 2017; Portet et al., 2018; Pinaud et al., 2021).
Впервые TEP был описан как белок, содержащий характерный тиоэфирный домен
(TED). Этот домен отличается наличием β-цистеинил-γ-глутамильной связи. Данная
связь обладает высокой реакционной способностью и позволяет TEP образовывать
ковалентные связи с молекулами-мишенями (Bender et al., 1992). Связывание TEP
с поверхностями микроорганизмов и паразитов указывает на его иммунные функции
(Monе et al., 2010; Portet et al., 2018; Castillo et al., 2020). Иммуноцитохимическое
исследование показало наличие TEP в гемоцитарной капсуле, формируемой вокруг
паразита через день п.з. Schistosoma mansoni, а также в гемоцитах в непосредственной
близости от инкапсуляций (Castillo et al., 2020). Анализ сборки генома Biomphalaria
glabrata и связанных с ним баз данных RNAseq позволил выявить 12 TEP-подобных
последовательностей, для которых были предсказаны возможные сайты связывания
с NF-κB (Castillo et al., 2020).
Установлено, что FREP3 и комплекс FREP-TEP могут взаимодействовать с по-
верхностью тегумента спороцист Schistosoma mansoni в то время, как как сами по
себе TEP1 и FREP2 не обладают такой способностью. Соответственно, механизмы,
с помощью которых FREP3 и FREP2 распознают спороцисты S. mansoni, различны -
FREP3 не требует TEP для связывания с мишенями на поверхности спороцисты
S. mansoni, при том, что FREP2 без TEP1 связаться не может (Li et al., 2020). При этом
TEP способен связываться с FREP3 в отсутствие молекул S. mansoni. C поверхностью
тегумента спороцисты связывается уже готовый комплекс FREP-TEP.
Другой фактор, взаимодействующий с FREP, - биомфализин. Биомфализин - аэро-
лизинподобный белок плазмы, токсин, формирующий поры. Предположительно би-
омфализин достался моллюскам от бактерий в результате горизонтального переноса
генов (Galinier et al., 2013). Белок включает два домена - домен, который подобен
формирующему β-поры токсину (β-pore-forming toxins) и который способен встраи-
455
ваться и перфорировать клеточные мембраны, а также малый домен, вовлеченный
в распознавание углеводных PAMP. Биомфализины способны связываться с поверх-
ностью спороцист S. mansoni, Echinostoma caproni, с бактериями и дрожжами (Tetreau
et al., 2017).
Известно, что биомфализин напрямую связывается с поверхностью спороцист
Schistosoma mansoni без помощи каких-либо других факторов (Galinier et al., 2013).
Однако белки плазмы гемолимфы значительно усиливают его активность. Комплекс
FREP3-TEP может активировать биомфализин, способствуя его олигомеризации
(Li et al., 2020). В этом процессе также участвует FREP2 (Li et al., 2020). При этом
у моллюсков и чувствительных и резистентных линий может образовываться комплекс
FREP3-TEP-биомфализин, но только у резистентных особей этот комплекс привлекает
дополнительно другие FREP - FREP2 и FREP3 (Li et al., 2020).
Распространенность FREP
Бóльшая чaсть описанного в литературе многообразия FREP является результатом
изучения одного вида моллюсков - Biompaharia glabrata, у которой FREP были описа-
ны впервые. Работы, посвященные изучению факторов защитных реакций иммунитета
моллюсков других видов, и особенно моллюсков из природных популяций, единичны.
Однако уже сейчас ясно, что наличие FREP - особенность не только B. glabrata.
У другой биомфалярии - B. pfeifferi - выявлено 249 последовательностей, под-
ходящих под описание как FREP. Из них 12 - полноразмерные гомологи FREP
B. glabrata (Buddenborg et al., 2017). Заражение B. pfeifferi мирацидиями Schistosoma
mansoni значительно изменяет профиль экспрессии FREP: FREP2 постепенно воз-
растает, FREP7 и 14 значительно повышается на 3-й день п.з. При этом экспрессия
FREP3, который сильно реагирует на шистосомное заражение у Biompaharia glabrata,
возрастает незначительно только в самом начале инвазии. И наоборот, FREP5 экс-
прессируется значительно сильнее, тогда как у B. glabrata наблюдается снижение его
экспрессии (Buddenborg et al., 2017).
Работы, посвященные изучению FREP у других гастропод, не описывают такого
многообразия FREP, как у биомфалярий. Возможно, это связано с малочисленностью
таких исследований. Одним из видов, для которых убедительно доказано наличие
FREP, является Physella acuta. В геноме этой улитки пока выявлено только четыре
гена FREP, два из которых гомологичны FREP2 и FREP4 биомфалярии. При этом
транскриптомный анализ не выявил признаков соматической диверсификации этих
генов (Schultz et al., 2018; 2020). Заражение трематодами Echinostoma paraensei и бак-
териями не приводит к росту экспрессии FREP. Но некоторые другие лектины поло-
жительно реагируют на иммунизацию. Похожие результаты получены и для Lymnaea
stagnalis, у которой выявлено только два FREP (Seppälä et al., 2021). Из протести-
рованных факторов (грамположительные и грамотрицательные бактерии, дрожжи,
анестезия, голодание, экстракты тканей зараженных моллюсков) только иммуниза-
ция Micrococcus lysodeikticus приводит к повышению экспрессии одного из FREP.
У Helisoma trivolvis выявлен один белок, гомологичный FREP3 (Zhang et al.,
2004). Недавно гены, кодирующие FREP, были выявлены у глубоководных га-
стропод, обитающих в термальных источниках, - Gigantopelta aegis (18 генов)
и Chrysomallon squamiferum (14 генов). Максимальная экспрессия генов FREP у этих
улиток показана в барьерных структурах - ктенидиях и мантии (Lan et al., 2021).
456
В геноме Littorina littorea выявлено пять генов, кодирующих FREP, один из кото-
рых включает два иммуноглобулиноопобных домена (Gorbushin, Borisova, 2015). По-
следовательности содержат сигнальные пептиды, однако не включают трансмембран-
ные области. В гемоцитах литторины не обнаружено значительного полиморфизма
FREP. Только для одного из них выявлено два варианта мРНК. У переднежаберного
моллюска Aplysia californica выявлено два гена FREP. Однако их структура значи-
тельно отличается от генов FREP биомфалярии. Один из них не содержит интронов
и предположительно является ретрогеном. Второй включает интроны, но с сайтами
сплайсинга, отличными от таковых у биомфалярий (Gorbushin et al., 2010). Анализ
экспрессии не выявил соматической диверсификации этих генов FREP. Более того,
специфическая экспрессия одного из генов была выявлена только в сердце и жабрах.
Нельзя не упомянуть о том, что FREP также распространены среди моллюсков
других таксонов. Так, наличие генов FREP и их тканеспецифичная экспрессия показа-
ны для бивальвий Mytilus galloprovincialis, M. edulis, Argopecten irradians, Xenostrobus
securis (Romero et al., 2011, 2019; Yang et al., 2014; Tanguy et al., 2018; Saco et al.,
2020). У мидий Mytilus galloprovincialis выявлено индивидуальное разнообразие на-
боров FREP (Romero et al., 2011).
В геноме тихоокеанской устрицы Crassostrea gigas было идентифицировано 193 ге-
на FREP, характеризующихся большим количеством полиморфизмов и множественных
перекрывающихся FBG доменов. Наиболее активная экспрессия FREP наблюдается
в жабрах, пищеварительных железах и гемоцитах (Huang et al., 2015). У морского
гребешка Argopecten irradians выявлено значительное усиление экспрессии FREP
в ответ на введение липополисахаридов, β-глюкана, пептидоклюкана, бактерий
и грибов, показана значительная агглютинационная активность в отношении бактерий
Vibrio anguillarum и Staphylococcus aureus (Yang et al., 2014).
Таким образом, FREP распространены среди моллюсков. Но разнообразия FREP,
описанного у Biompaharia glabrata, не найдено ни у одного из изученных в этом
отношении других видов моллюсков. Однако исследований по анализу генома, про-
теома или транскриптомов биомфалярии в сотни раз юбольше, чем для других видов
гастропод.
ЗАКЛЮЧЕНИЕ
Участие FREP в защитных реакциях брюхоногих моллюсков против патогенов
различной природы, способность связываться с широким спектром PAMP, структур-
ное разнообразие и формируемое в ходе онтогенеза фенотипическое разнообразие
делают FREP идеальными PRR. В то же время способность формировать иммунные
комплексы, опсонизировать и агглютинировать патогены указывает на эффекторные
функции FREP в иммунном ответе гастропод. Такой набор функциональных актив-
ностей FREP не может не привести к аналогии с основополагающими молекулами
адаптивного иммунитета позвоночных - иммуноглобулинами, которые, как и FREP,
выполняют роль распознающих молекул и одновременно являются важными эффек-
торами и регуляторами иммунного ответа. Эти данные позволяют обсуждать анало-
гичность путей иммунной защиты, существующих параллельно у беспозвоночных
и позвоночных животных, и аналогичность молекулярных механизмов, которые ис-
пользуются системами врожденного и адаптивного иммунитета.
Существует предположение, что разнообразие FREP у биомфалярий могло сфор-
мироваться в результате длительной коэволюции с трематодами Schistosoma mansoni
457
(Bayne, 2009; Adema, Loker, 2015). Стремление паразита обмануть иммунную си-
стему хозяина путем повышенного полиморфизма и мимикрии приводило к тому,
что и иммунная система моллюска вырабатывала механизмы более эффективного
распознавания и уничтожения паразита. Одним из таких механизмов стали FREP.
Такие молекулы с возможностью распознавания широкого репертуара PAMP могут
быть эффективны и при встрече с другими патогенами. У других видов моллюсков,
взаимодействующих с другими видами трематод или других патогенов, механизмы
распознавания и элиминации патогенов могли совершенствоваться за счет других PRR
и других компонентов иммунитета.
То, что FREP не являются исключительными или преобладающими PRR в систе-
ме врожденного иммунитета гастропод, свидетельствует о важности вариабельно-
сти в системе врожденного иммунитета. Вариативность распознающих механизмов
достигается за счет разнообразия PRR, и система врожденного иммунитета в ходе
исторического развития адаптируется под условия, в которых существует моллюск.
В результате у каждого вида - свой уникальный набор PRR. Такая «адаптивность»
не требует сложных механизмов созревания рецепторов, присутствующих в системе
адаптивного иммунитета, но требует большого разнообразия PRR, которое еще пред-
стоит изучить.
БЛАГОДАРНОСТИ
Исследование выполнено при финансовой поддержке РФФИ в рамках научного
проекта № 20-54-15003 НЦНИ_а.
СПИСОК ЛИТЕРАТУРЫ
Атаев Г.Л., Еремина Е.Е., Полевщиков А.В. 2005. Защитные реакции брюхоногих моллюсков. Гуморальные
реакции. Паразитология 39 (1): 3-15. [Ataev G.L., Eremina E.E., Polevchchikov A.V. 2005. Defensive
reactions of Gastropod molluscs. Humoral reactions. Parazitologiya 39 (1): 3-15. (in Russian)]
Атаев Г.Л., Полевщиков А.В. 2004. Защитные реакции брюхоногих моллюсков. 1. Клеточные реакции.
Паразитология 38 (4): 342-351. [Ataev G.L., Polevchchikov A.V. 2004. Protective reactions of Gastropod
molluscs. 1. Cell reactions. Parazitologiya 38 (4): 342-351. (in Russian)]
Атаев Г.Л., Прохорова Е.Е., Токмакова А.С. 2020. Защитные реакции легочных моллюсков при паразитарной
инвазии. Паразитология 54 (5): 371-401. [Ataev G.L., Prokhorova E.E., Tokmakova A.S. 2020. Defense
reactions of pulmonate molluscs during parasitic invasion. Parazitologiya 54 (5): 371-401. (in Russian)].
Кокряков В.Н. 2006. Очерки о врожденном иммунитете. СПб., Наука, 261 с. [Kokryakov V.N. 2006. Essays
on innate immunity. Saint Petersburg, Nauka, 261 p. (in Russian)]
Прохорова Е.Е., Цымбаленко Н.В., Атаев Г.Л. 2010. Экспрессия генов факторов защитных реакций у мол-
люсков Planorbarius corneus (Gastropoda, Pulmonata) при заражении трематодами. Паразитология 44
(4): 310-325. [Prokhorova E.E., Tsymbalenko N.V., Ataev G.L. 2010. Expression of genes encoding defense
factors in the snail Planorbarius corneus (Gastropoda, Pulmonata) infested with trematodes. Parazitologiya
44 (4): 310-325. (in Russian)]
Adema C.M. 2015. Fibrinogen-Related Proteins (FREPs) in Mollusks. Results and Problems in Cell Differentia-
tion 57: 111-129.
Adema C.M., Hanington P.C., Lun C.-M., Rosenberg G.H., Aragon A.D., Stout B.A., Richard M.L., Gross P.S.,
Loker E.S. 2010. Differential transcriptomic responses of Biomphalaria glabrata (Gastropoda, Mollusca)
to bacteria and metazoan parasites, Schistosoma mansoni and Echinostoma paraensei (Digenea, Platyhel-
Adema C.M., Hertel L.A., Miller R.D., Loker E.S. 1997. A family of fibrinogen-related proteins that precipitates
parasite-derived molecules is produced by an invertebrate after infection. PNAS 94 (16): 8691-8696.
458
Adema C.M., Hertel L.A., Loker E.S. 1999. Evidence from two planorbid snails of a complex and
dedicated response to digenean (Echinostome) infection. Parasitology 119 (4): 395-404.
Adema C.M., Hillier L.W., Jones C.S., Loker E.S., Knight M., Minx P., et al. 2017. Whole genome analy-
sis of a schistosomiasis-transmitting freshwater snail. Nature Communications 8 (15451): 1-11.
Adema C.M., Loker E.S. 2015. Digenean-gastropod host associations inform on aspects of spe-
cific immunity in snails. Developmental and Comparative Immunology 48 (2): 275-283.
Allan E., Yang L., Tennessen J.A., Blouin M.S. 2019. Allelic variation in a single genomic region alters the
hemolymph proteome in the snail Biomphalaria glabrata. Fish and Shellfish Immunology 88: 301-307.
Ataev G.L., Coustau C. 1999. Cellular response to Echinostoma caproni infection in Biomphalaria glabrata
strains selected for susceptibility/resistance. Developmental and Comparative Immunology 23 (3): 187-198.
Bayne C.J. 2009. Successful parasitism of vector snail Biomphalaria glabrata by the human blood fluke (trema-
tode) Schistosoma mansoni: A 2009 assessment. Molecular & Biochemical Parasitology 165 (1): 8-18.
Bayne C.J., Loker E.S., Yui M.A. 1986. Interactions between the plasma-proteins of Biomphalaria glabrata (Gas-
tropoda) and the sporocyst tegument of Schistosoma mansoni (Trematoda). Parasitology 92 (3): 653-664.
Bender R.C., Fryer S.E., Bayne C.J. 1992. Proteinase inhibitory activity in the plasma of a mollusc: evidence
for the presence of a-macroglobulin in Biomphalaria glabrata. Comparative Biochemistry and Physiology
Bouchut A., Roger E., Coustau C., Gourbal B., Mitta G. 2006. Compatibility in the Biomphalaria glabrata/Echi-
nostoma caproni model: potential involvement of adhesion genes. International Journal for Parasitology
Buchmann K. 2014. Evolution of Innate Immunity: Clues from Invertebrates via Fish to Mammals. Frontiers in
Buddenborg S.K., Bu L., Zhang S-M., Schilkey F.D., Mkoji G.M., Loker E.S. 2017. Transcriptomic responses
of Biomphalaria pfeifferi to Schistosoma mansoni: Investigation of a neglected African snail that supports
more S. mansoni transmission than any other snail species. PLoS Neglected Tropical Diseases 11 (10):
Castillo M.G., Humphries J.E., Mourao M.M., Marquez J., Gonzalez A., Montelongo C.E. 2020. Biomphalaria
glabrata immunity: Post-genome advances. Developmental and Comparative Immunology 104: 103557.
Chen J.M., Cooper D.N., Chuzhanova N., Férec C., Patrinos G. P. 2007. Gene conversion: Mechanisms, evolution
Cheng T.C. 1975. Functional morphology and biochemistry of molluscan phagocytes. Annals of the New York
Cheng T.C., Jourdan J. 1987. Transient cellular reaction in Biomphalaria glabrata (Mollusca) to heterotopic
isografts. Journal of Invertebrate Pathology 49 (3): 273-278.
Connors V.A. 2003. The schistosome - snail interaction: factors involved in host immunodefense activation and
parasite killing in susceptible and resistant Biomphalaria glabrata. In: Combes C., Jourdane J. (eds).
Taxonomy, ecology and evolution of metazoan parasites. Perpignan: Presses Univ. de Perpignan, 203-224.
Couch L., Hertel L.A., Loker E.S. 1990. Humoral response of the snail Biomphalaria glabrata to trematode in-
fection: observations on a circulating hemagglutinin. Journal of Experimental Zoology 255 (3): 340-349.
Dheilly N.M., Duval D., Mouahid G., Emans R., Allienne J.-F., Galinier R., et al. 2015. A family of variable im-
munoglobulin and lectin domain containing molecules in the snail Biomphalaria glabrata. Developmental
Dinguirard N., Cavalcanti M.G.S., Wu X.J., Bickham-Wright U., Sabat G., Yoshino T.P. 2018. Proteomic analysis
of Biomphalaria glabrata hemocytes during in vitroencapsulation of Schistosoma mansoni sporocysts.
459
Doolittle R.F. 1992. A detailed consideration of a principal domain of vertebrate fibrinogen and its relatives.
Doolittle R.F. 2016. Some important milestones in the field of blood clotting. Journal of Innate Immunity 8 (1):
Galinier R., Portela J., Mone Y., Allienne J.-F., Henri H., Delbecq S., et al. 2013. Biomphalysin, a new β pore-
forming toxin involved in Biomphalaria glabrata immune defense against Schistosoma mansoni. PLoS
Galinier R., Roger E., Mone Y., Duval D., Portet A., Pinaud S., Chaparro C., Grunau C., Genthon C.,
Dubois E., Rognon A., Arancibia N., Dejean B., Theron A., Gourbal B., Mitta G. 2017. A multistrain
approach to studying the mechanisms underlying compatibility in the interaction between Biom-
phalaria glabrata and Schistosoma mansoni. PLOS Neglected Tropical Diseases 11 (3): e0005398.
Gokudan S., Muta T., Tsuda R., Koori K., Kawahara T., Seki N., Mizunoe Y., Wai S.N., Iwanaga S., Kawabata S.
1999. Horseshoe crab acetyl group-recognizing lectins involved in innate immunity are structurally related
Gorbushin A.M. 2019. Derivatives of the lectin complement pathway in Lophotrochozoa. Developmental and
Gorbushin A.M., Panchin Y.V., Iakovleva N.V. 2010. In search of the origin of FREPs: Characterization of Ap-
lysia californica fibrinogen-related proteins. Developmental and Comparative Immunology 34: 465-473.
Gorbushin A.M., Borisova E.A. 2015. Lectin-like molecules in transcriptome of Littorina littorea hemocytes.
Gordy M.A., Pila E.A., Hanington P.C. 2015. The role of fibrinogen-related proteins in the gastropod immune
Guillou F., Mitta G., Galinier R., Coustau C. 2007. Identification and expression of gene transcripts generated
during an anti-parasitic response in Biomphalaria glabrata. Developmental and Comparative Immunology
Guillou F., Mitta G., Dissous C., Pierce R., Coustau C. 2004. Use of individual polymorphism to validate
potential functional markers: case of a candidate lectin (BgSel) differentially expressed in susceptible
and resistant strains of Biomphalaria glabrata. Comparative Biochemistry and Physiology 138: 175-181.
Hanington P.C., Lun C.-M., Adema C.M., Loker E.S. 2010a. Time series analysis of the transcriptional re-
sponses of Biomphalaria glabrata throughout the course of intramolluscan development of Schistosoma
mansoni and Echinostoma paraensei. International Journal for Parasitology 40 (7): 819-831. 10.1016/j.
ijpara.2009.12.005.
Hanington P.C., Forys M.A., Dragoo J.W., Zhang S.-M., Adema C.М., Loker E.S. 2010b. Role for a somatically
diversified lectin in resistance of an invertebrate to parasite infection. PNAS 107 (49): 21087-21092.
Hanington P.C., Forys M.A., Loker E.S. 2012. Somatically diversified defense factor, FREP3, is a determi-
nant of snail resistance to Schistosome infection. PLoS Neglected Tropical Diseases 6 (3): e1591.
Hanington P.C., Zhang S.-M. 2011. The primary role of fibrinogen-related proteins in invertebrates is defense,
Hertel L.A., Adema C.M., Loker E.S. 2005. Differential expression of FREP genes in two strains of Biomphalaria
glabrata following exposure to the digenetic trematodes Schistosoma mansoni and Echinostoma paraensei.
Hertel L.A., Stricker S.A., Monroy F.P., Wilson W.D., Loker E.S. 1994. Biomphalaria glabrata hemolymph lec-
tins: binding to bacteria, mammalian erythrocytes, and to sporocysts and rediae of Echinostoma paraensei.
Huang B., Zhang L., Li L., Tang X., Zhang G. 2015. Highly diverse fibrinogen-related proteins in the Pacific oys-
Janeway C.A. Jr, Medzhitov R. 2002. Innate immune recognition. Annual Review of Immunology 20: 197-216.
10.1146/annurev.immunol.20.083001.084359.
460
Jiang Y., Loker E.S., Zhang S.-M. 2006. In vivo and in vitro knockdown of FREP2 gene expression in the snail
Biomphalaria glabrata using RNA interference. Developmental and Comparative Immunology 30 (10):
Jourdane J., Cheng T.C. 1987. The two-phase recognition process of allografts in Brazil-
ian strain of Biomphalaria glabrata. Journal of Invertebrate Parasitology 49 (2): 145-158.
Kurachi S., Song Z., Takagaki M., Yang Q., Winter H. C., Kurachi K., et al. 1998. Sialic-acid-binding lectin from
the slug Limax flavus e cloning, expression of the polypeptide, and tissue localization. European Journal
Kurosawa Y., Hashimoto K. 1996. The immunoglobulin superfamily: where do invertebrate fit in? In: Cooper E.
(ed.). Advances in Comparative and Enviromental physiology, Berlin, Springer, 23: 151-184.
Lan Y., Sun J., Chen C., Sun Y., Zhou Y., Yang Y., et al. 2021. Hologenome analysis reveals dual symbio-
sis in the deep-sea hydrothermal vent snail Gigantopelta aegis. Nature Communications 12 (1): 1165.
Larson M.K., Bender R.C., Bayne C.J. 2014. Resistance of Biomphalaria glabrata 13-16-R1 snails to Schistosoma
mansoni PR1 is a function of haemocyte abundance and constitutive levels of specific transcripts in hae-
Leonard P.M., Adema C.M., Zhang S.-M., Loker E.S. 2001. Structure of two FREP genes that combine IgSF
and fibrinogen domains, with comments on diversity of the FREP gene family in the snail Biomphalaria
Lewis F.A., Pattarson C.N., Knight M., Richards C.S. 2001. The relationship between Schistosoma man-
soni and Biomphalaria glabrata: genetic and molecular approaches. Parasitology 123: 169-179.
Li D., Graham L.D. 2007. Epiphragmin, the major protein of epiphragm mucus from the vineyard snail, Cernuella
virgata, Comparative Biochemistry and Physiology - Part B: Biochemistry & Molecular Biology 148 (2):
Li H., Hambrook J.R., Pila E.A., Gharamah A.A., Fang J., Wu X., Hanington P. 2020. Coordination of humoral
immune factors dictates compatibility between Schistosoma mansoni and Biomphalaria glabrata. Elife 9:
Lie K.J., Heyneman D. 1976a. Studies on resistance in snails. 3. Tissue reaction to Echinostoma lindoense
sporocysts in sensitized and resensitized Biomphalaria glabrata. Journal of Parasitology 62 (1): 51-58.
Lie K.J., Heyneman D. 1976b. Studies on resistance in snails. 6. Escape of Echinostoma lindoense sporocysts
from encapsulation in the snail heart and subsequent loss of the host’s ability to resist by the same parasite.
Journal of Parasitology 62 (2): 298-302.
Lie K.J., Jeong K.H., Heyneman D. 1982. Further characterization of acquired resistance in Biomphalaria glabrata.
Journal of Parasitology 68 (4): 529-531.
Lie K.J., Jeong K.H., Heyneman D. 1983. Acquired resistance in snails. Induction of resistance to Schistosoma
mansoni in Biomphalaria glabrata. International Journal for Parasitology 13 (3): 301-304.
Lockyer A.E., Emery A.M., Kane R.A., Walker A.J., Mayer C.D., Mitta G., Coustau C., et al. 2012. Early dif-
ferential gene expression in haemocytes from resistant and susceptible Biomphalaria glabrata strains in
Lockyer A.E., Spinks J., Kane R.A., Hoffmann K.F., Fitzpatrick J.M., et al. 2008. Biomphalaria glabra-
ta transcriptome: cDNA microarray profiling identifies resistant- and susceptible-specific gene ex-
pression in haemocytes from snail strains exposed to Schistosoma mansoni. BMC Genomics 9: 634.
Loker E.S., Adema C.M., Zhang S.-M., Kepler T.B. 2004. Invertebrate immune systems - not ho-
mogeneous, not simple, not well understood. Immunological Reviews
198:
10-24.
Loker E.S., Couch L., Hertel L.A. 1994. Elevated agglutination titers in plasma of Biomphalaria glabrata exposed
to Echinostoma paraensei: characterization and functional relevance of a trematode-induced response.
Loker E.S., Yui M.A., Bayne C.J. 1984. Schistosoma mansoni: agglutination of sporocysts, and formation of gels
on miracidia transforming in plasma of Biomphalaria glabrata. Experimental Parasitology 58 (1): 56-62.
461
Lu L., Loker E.S., Adema C.M., Zhang S.-M., Bu L. 2020. Genomic and transcriptional analysis of genes contain-
ing fibrinogen and IgSF domains in the schistosome vector Biomphalaria glabrata, with emphasis on the
differential responses of snails susceptible or resistant to Schistosoma mansoni. PLoS Neglected Tropical
Matricon-Gondran M., Letocart M. 1999. Internal defenses of the snail Biomphalaria glabrata. I. Charac-
terization of hemocytes and fixed phagocytes. Journal of Invertebrate Pathology 74 (3): 224-234.
Medzhitov R., Janeway C.A. 1997. Innate Immunity: The virtues of a nonclonal system of recognition. Cell 91
Middha S., Wang X. 2008. Evolution and potential function of fibrinogen-like domains across twelve Drosophila
Mitta G., Adema C.M., Gourbal B., Loker E.S., Theron A. 2012. Compatibility polymorphism in snail/schistosome
interactions: From field to theory to molecular mechanisms. Developmental and Comparative Immunology
Mitta G., Galinier R., Tisseyre P., Allienne J.-F., Girerd-Chambaz Y., Guillou F., et al. 2005. Gene discovery and
expression analysis of immune-relevant genes from Biomphalaria glabrata hemocytes. Developmental and
Mone Y., Gourbal B., Duval D., Du Pasquier L., Kieffer-Jaquinod S., Mitta G. 2010. A large repertoire of parasite
epitopes matched by a large repertoire of host immune receptors in an invertebrate host/parasite model.
Monroy F.P., Loker E.S. 1993. Production of heterogeneous carbohydrate-binding proteins by the host snail
Biomphalaria glabrata following exposure to Echinostoma paraensei and Schistosoma mansoni. Journal
of Parasitology 79 (3): 416-423.
Neuberger M.S. 2008. Antibody diversification by somatic mutation: from Burnet onwards. Immunology & Cell
Newton W.L. 1953. The inheritance of susceptibilityto infection with Schistosoma mansoni in Australorbis gla-
Peterson N.A., Hokke C.H., Deelder A.M., Yoshino T.P. 2009. Glycotope analysis in miracidia and primary spo-
rocysts of Schistosoma mansoni: differential expression during the miracidium-to-sporocyst transformation.
Pieters M., Wolberg A.S. 2019. Fibrinogen and fibrin: An illustrated review. Research and Practice in Thrombosis
Pila E.A., Li H., Hambrook J.R., Wu X., Hanington P.C. 2017. Schistosomiasis from a snail’s perspective: ad-
Pinaud S., Tetreau G., Poteaux P., Galinier R., Chaparro C., et al. 2021. New insights into biomphalysin gene
family diversification in the vector snail Biomphalaria glabrata. Frontiers in Immunology 12: 635131.
Portet A., Galinier R., Pinaud S., Portela J., Nowacki F., Gourbal B., Duval D. 2018. BgTEP: an antiprote-
ase involved in innate immune sensing in Biomphalaria glabrata. Frontiers in Immunology 9: 1206.
Portet A., Pinaud S., Tetreau G., Galinier R., Cosseau C., Duval D., Grunau C., Mitta G., Gourbal B. 2017.
Integrated multi-omic analyses in Biomphalaria-Schistosoma dialogue reveal the immunobiological
significance of FREP-SmPoMuc interaction. Developmental and Comparative Immunology 75: 16-27.
Price D.A., Greenberg M.I. 1994. Comparative aspects of FMRF-amide gene organization in mollusks. Netherlands
Journal of Zoology 44: 421-431.
Raghavan N., Tettelin H., Miller A., Hostetler J., Tallon L., Knight M. 2007. Nimbus (BgI): An active non-LTR
retrotransposon of the Schistosoma mansoni snail host Biomphalaria glabrata. International Journal for
Richards C.S. 1970. Genetics of a molluscan vector of schistosomiasis. Nature 227: 806-810.
Richards C.S., Shade P.C. 1987. The genetic variation of compatibility in Biomphalaria glabrata and Schistosoma
mansoni. Journal of Parasitology 73: 1146-1151.
462
Romero A., Aranguren R., Moreire R., Novoa B., Figueras A. 2019. Integrated transcriptomic and functional im-
munological approach for assessing the invasiveness of bivalve alien species. Scientific Reports 9: 19879.
Romero A., Dios S., Poisa-Beiro L., Costa M.M., Posada D., Figueras A., Novoa B. 2011. Individual sequence
variability and functional activities of fibrinogen-related proteins (FREPs) in the Mediterranean mussel
(Mytilus galloprovincialis) suggest ancient and complex immune recognition models in invertebrates. De-
Saco A., Rey-Campos M., Novoa B., Figueras A. 2020. Transcriptomic response of mussel gills after a Vibrio
splendidus infection demonstrates their role in the immune response. Frontiers in Immunology 11: 615580.
Salamat Z., Sullivan J.T. 2008. In vitro mitotic responses of the amebocyte-producing organ of Biom-
phalaria glabrata to extracts of Schistosoma mansoni. Journal of Parasitology 94 (5): 1170-1173.
Santama N., Li K.W., Geraerts W.P.M., Benjamin P.R., Burke J.F. 1996. Post-translational processing of the
alternative neuropeptide precursor encoded by the FMRFamide gene in the pulmonate snail Lymnaea
Schroeder H.W., Cavacini L. 2010. Structure and function of immunoglobulins. Journal of Allergy and Clinical
Schultz J.H., Bu L., Adema C.M. 2018. Comparative immunological study of the snail Physella acuta (Hygrophila,
Pulmonata) reveals shared and unique aspects of gastropod immunobiology. Molecular Immunology 101:
Schultz J.H., Bu L., Kamel B., Adema C.M. 2020. RNA-seq: The early response of the snail Physella acu-
ta to the digenetic trematode Echinostoma paraensei. Journal of Parasitology 106 (4): 490-505.
Seppälä O., Walser J.-C., Cereghetti T., Seppälä K., Salo T., Adema C.M. 2021. Transcriptome profil-
ing of Lymnaea stagnalis (Gastropoda) for ecoimmunological research. BMC Genomics 22 (1): 144.
Sire C., Rognon A., Theron A. 1998. Failure of Schistosoma mansoni to reinfect Biomphalaria glabrata
snails: acquired humoral resistance or intra-specific larval antagonism? Parasitology 117: 117-122.
Sullivan J.T. 1990. Long-term survival of heterotopic allografts of the amoebocyte-producing organ in Biomphal-
aria glabrata (Mollusca: Pulmonata). Transactions of the American Microscopical Society 109 (1): 52-60.
Sullivan J.T., Lares R.R., Galvan A.G. 1998. Schistosoma mansoni infection inhibits maturation of ovotes-
tis allografts in Biomphalaria glabrata (Mollusca: Pulmonata). Journal of Parasitology 84 (1): 82-87.
Sullivan J.T., Richards C.S., Joe L.K., Heyneman D. 1982. Ribeiroia marini: irradiated miracidia and induction
of acquired resistance in Biomphalaria glabrata. Experimental Parasitology 53: 17-25.
Sun S.C., Lindstrom I., Boman H.G., Faye I., Schmidt O. 1990. Hemolin: an insect-immune protein belonging to
Tanguy M., Gauthier-Clerc S., Pellerin J., Danger J.-M., Siah A. 2018. The immune response of Mytilus edulis
hemocytes exposed to Vibrio splendidus LGP32 strain: A transcriptomic attempt at identifying molecular
Tetreau G., Pinaud S., Portet A., Galinier R., Gourbal B., Duval D. 2017. Specific pathogen recogni-
tion by multiple innate immune sensors in an invertebrate. Frontiers in Immunology 8: 1249.
Vasta G. R., Ahmed H. 2009. Animal lectins. A Functional View. Boca Raton, London, New York, Crc Press,
596 pp.
Wu X.-J., Dinguirard N., Sabat G., Lui H., Gonzalez L., Gehring M., et al. 2017. Proteomic analysis of Biom-
phalaria glabrata plasma proteins with binding affinity to those expressed by early developing larval
Yamada S., Hotta K., Yamamoto T. S., Ueno N., Satoh N., Takahashi H. 2009. Interaction of notochord-derived
fibrinogen-like protein with Notch regulates the patterning of the central nervous system of Ciona intesti-
463
Yang C., Wang L., Zhang H., Wang L., Huang M., Sun Z., Sun Y., Song L. 2014. A new fibrinogen-related protein
from Argopecten irradians (AiFREP-2) with broad recognition spectrum and bacteria agglutination activity.
Yoshino T.P., Bayne C.J. 1983. Mimicry of snail host antigens by miracidia and primary sporocysts of Schisto-
Yoshino T.P., Lodes M.J., Rege A.A., Chappell C.L. 1993. Proteinase activity in miracidia, transformation excreto-
ry-secretory products, and primary sporocysts of Schistosoma mansoni. Journal of Parasitology 79 (1): 23.
Zahoor Z., Lokyer A.E., Davies A.J., Kirk R.S., Emery A.M., et al. 2014. Differences in the gene ex-
pression profiles of haemocytes from schistosome-susceptible and -resistant Biomphalaria gla-
brata exposed to Schistosoma mansoni excretory-secretory products. PLoS One 9 (3): e93215.
Zhang S.-M., Adema C.M., Kepler T.B., Loker E.S. 2004. Diversification of Ig superfamily genes in an inverte-
Zhang S.-M., Leonard P.M., Adema C.M., Loker E.S. 2001. Parasite-responsive IgSF members in the snail Biom-
phalaria glabrata: characterization of novel genes with tandemly arranged IgSF domains and a fibrinogen
Zhang S.-M., Loker E.S. 2003. The FREP gene family in the snail Biomphalaria glabrata: additional members,
and evidence consistent with alternative splicing and FREP retrosequences. Developmental and Compara-
Zhang S.-M., Loker E.S. 2004. Representation of an immune responsive gene family encoding fibrinogen-related
proteins in the freshwater mollusk Biomphalaria glabrata, an intermediate host for Schistosoma mansoni.
Zhang H., Wang L., Song L., Song X., Wang B., Mu C., et al. 2009. A fibrinogen-related protein from bay scal-
lop Argopecten irradians involved in innate immunity as pattern recognition receptor. Fish and Shellfish
Zhang S.-M., Zeng Y., Loker E.S. 2008. Expression profiling and binding properties of fibrinogen-related proteins
(FREPs), plasma proteins from the schistosome snail host Biomphalaria glabrata. Innate Immunity 14 (3):
FIBRINOGEN-RELATED PROTEINS OF GASTROPODA MOLLUSCS
E. E. Prokhorova, G. L. Ataev
Keywords: fibrinogen-like proteins (FREP), gastropods, trematode invasion, resistance,
pathogen-recognizing receptors, innate immunity
SUMMARY
Fibrinogen-related proteins (FREP) are calcium-dependent lectins with one fibrinogen
domain and one or two immunoglobulin-like domains. FREP of gastropod molluscs have an
ability to somatic diversification, which is unique among pathogen-recognizing molecules
of invertebrates. The structure of the genomic regions encoding FREP implies the pos-
sibility of alternative splicing and somatic mutagenesis. Since the discovery of FREPs in
Biomphalaria glabrata, these molecules have been described in many gastropods. At least
14 subfamilies of FREPs are currently known. FREPs of different subfamilies selectively
participate in the immune response to various pathogens. In particular, their role in defense
reactions to trematode invasion and in resistance to trematodes of particular species has
been confirmed. The supposed functions of FREP are diverse, ranging from recognition of
foreign matter to opsonization and neutralization of pathogens. Despite the abundance of
FREPs studies, the Russian literature on this subject is scarce. The main purpose of this
review is to analyze the available information on gastropod FREPs and to discuss their
role among pathogen-recognizing receptors of molluscs.
464