ПАРАЗИТОЛОГИЯ, 2022, том 56, № 4, с. 267-281.
УДК 576.895
АФАГИЯ САМЦОВ У ИКСОДОВЫХ КЛЕЩЕЙ
ПОДСЕМЕЙСТВА IXODINAE
© 2022 г. С. А. Леонович*
Зоологический институт РАН
Университетская наб., 1, Санкт-Петербург, 199034 Россия
*e-mail: Segei.Leonovich@zin.ru
Поступила в редакцию 21.05.2022 г.
После доработки 16.06.2022 г.
Принята к публикации 20.06.2022 г.
Анализ имеющихся материалов по строению ротового аппарата, слюнных желез и по-
ведению в двух основных группах клещей (Prostriata и Metastriata), а также рассмотрение
молекулярно-генетических данных, с новой стороны освещающих начальные этапы эволюции
иксодовых клещей, позволили автору высказать гипотезу о вторичном характере афагии самцов
у представителей подсемейства Ixodinae (род Ixodes). Становление афагии, в сочетании с неко-
торыми другими факторами, позволило представителям подсемейства достичь эволюционного
успеха, сравнимого с таковым представителей остальных родов (группа Metastriata).
Ключевые слова: иксодовые клещи, Ixodinae, афагия, ротовые органы, копуляция
DOI: 10.31857/S0031184722040019, EDN: fgcrqz
Афагия самцов является характерной чертой представителей подсемейства Ixodinae
(группа Prostriata), в отличие от представителей подсемейства Amblyomminae (группа
Metastriata) (Arthur, 1962; Hoogstraal, 1978; Балашов, 1998). Данная черта, возмож-
но, связана с тем, что у Prostriata, представленных в мировой фауне единственным
родом Ixodes, сперматогенез завершается либо на нимфальной стадии, либо в про-
цессе послелиночного доразвития самцов (Балашов, 1998), поэтому перелинявшие
из нимф голодные самцы способны к оплодотворению. У Metastriaia, в отличие от
этого, сперматогенез завершается только в процессе длительного питания на хозяине
(Леонович, 2005), так что голодные самцы, по сути, являются самцами недоразвитыми
и не способны к оплодотворению самок.
Ротовые органы самцов иксодовых клещей группы Metastriata обеспечивают пи-
тание самцов с целью завершения сперматогенеза, а также участвуют в копуляции.
У клещей Prostriata (род Ixodes) ротовые органы также участвуют в копуляции, а вот
их роль в питании остается неясной (учитывая афагию, характерную для большинства
видов рода Ixodes).
267
Вместе с тем факты присасывания самцов представителей рода Ixodes к хозяевам
широко известны, и в ряде работ указывается, что самцы (например, Ixodes ricinus L.)
либо не питаются, либо поглощают очень небольшое количество крови (Hermann,
Gern, 2015). Значительное число самцов Ixodes ricinus были обнаружены прикрепив-
шимися к хозяину (благородному оленю Cervus elaphus L.) (Mysterud et al., 2014).
Среди клещей Ixodes pilosus Koch, собранных с антилоп бушбок Tragelaphus scriptus
(Pallas, 1766) и дукер (род Cephalopus) (29 самцов и 102 самки), 51.7% самцов были
прикреплены к хозяевам, 24.1% - в состоянии копуляции с самками, а 24.1% - были
прикреплены к самкам (их ротовые органы были погружены в тела самок вне по-
лового отверстия). Таким образом, самцы, характеризующиеся афагией, способны
прикрепляться к хозяину, однако значение этого «прикрепления» остается неясным.
Основную роль в процессе прикрепления иксодовых клещей к хозяину и в после-
дующем питании играют ротовые органы с их специализированными механизмами,
обеспечивающими закрепление в коже (гипостом и зубцы хелицер), а также слюнные
железы, которые обеспечивают плотное прикрепление за счет образования цементного
футляра (Балашов, 1998). Кроме того, в процессе копуляции самцы вводят ротовые
органы во влагалище самок, помещая в половые пути сперматофор и обеспечивая
оплодотворение.
Автор поставил перед собой цель рассмотреть имеющиеся в литературе сведения
(включая собственные данные), позволяющие оценить первичный или вторичный
характер афагии у самцов Ixodinae, проследить пути развития этого явления. Данный
обзор является первой попыткой проанализировать феномен афагии самцов у клещей
Prostriata, привлекая данные по морфологии и функционированию структур, связанных
с питанием клещей (ротовые органы, слюнные железы и т.п.), поведению клещей,
палеонтологии, а также молекулярно-генетические данные.
Строение ротового аппарата иксодовых клещей
Прикрепление клещей к хозяину и последующее многодневное питание обеспе-
чивается ротовыми органами (хелицерами и гипостомом) и работой слюнных желез,
формирующих цементный футляр или иные типы прикрепительных структур, не свя-
занных непосредственно с ротовыми органами. Собственно ротовой аппарат клещей
представлен гнатосомой и ее производными.
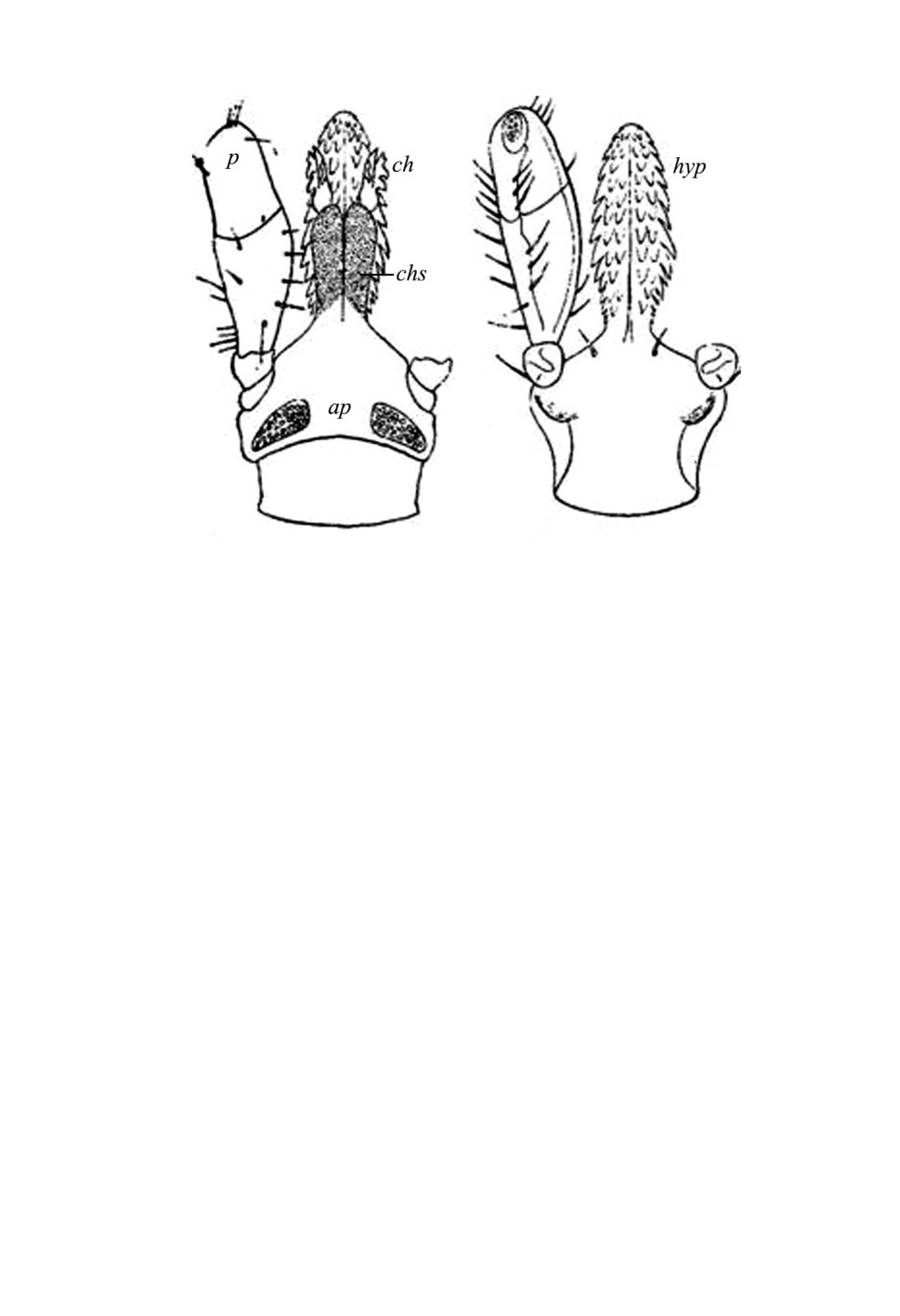
Гнатосома - дистальный отдел идиосомы клещей, состоит из основания, на кото-
ром латерально расположены четырехчлениковые пальпы (рис. 1). Дистально осно-
вание переходит в парные перепончатые трубки - футляры хелицер, способные теле-
скопически выворачиваться, обеспечивая движение собственно хелицер взад-вперед.
Хелицеры состоят из неподвижного наружного пальца и внутреннего подвижного
пальца. На подвижном пальце имеется дорзальный полулунный отросток, снабженный
зубцами. Вентрально основание гнатосомы переходит в непарный полый вырост.
268
Рисунок 1. Строение гнатосомы у клещей рода Ixodes (на примере I. persulcatus)
с дорзальной (слева) и вентральной стороны, по: Померанцев, 1950): ap - поровые поля
(area porosa), ch - хелицера, chs - футляр хелицеры, hyp - гипостом, р - пальпа.
Figure 1. Structure of the hypostome in ticks of the genus Ixodes (I. persulcatus),
according to Pomerantsev, 1950.
Дорзальная часть гипостома уплощена и образует по средней линии канал, по кото-
рому при питании кровь поступает в ротовое отверстие. Вентральная часть гипостома
жесткая, прочная, снабжена рядами зубцов. При помощи этих зубцов гипостома клещ
удерживается на теле хозяина (рис. 1).
Основные различия в строении ротового аппарата у самцов и самок Ixodinae об-
наруживаются именно в строении гипостома.
У клещей группы Metastriata (представители всех родов, за исключением рода
Ixodes), при всех различиях в строении ротовых органов, имеется одна общая черта:
на всех фазах развития (личинка, нимфа, самка, самец) гипостом обладает сильно
развитыми зубцами, что видно, например, на представителях родов Dermacentor,
Rhipicephalus и Hyalomma (рис. 2, 1b - 3b; 2, 1d - 3d), При этом различия в строе-
нии гипостома у самцов и самок одного вида совершенно не выражены (сравнить 1b
и 1d; 2b и 2d, а также 3b и 3d).
В отличие от представителей Metastriata, у клещей рода Ixodes самцы характе-
ризуются гипостомом с сильно недоразвитыми зубцами, в то время как самки и
неполовозрелые фазы обладают сильно развитыми зубцами, сравнимыми с таковы-
ми Metastriata, что видно, например, на строении гипостома у лесного клеща Ixodes
ricinus и паразита рукокрылых I. ariadnae Hornok, 2014 (рис. 3).
269
Взятые путем случайной выборки из литературы рисунки гипостома самцов
и самок представителей рода Ixodes наглядно демонстрируют значительные различия
в строении гипостома самцов: собственно гипостом значительно более тупой, зубцы
развиты слабо. Это характерно для гнездо-норовых видов (нидобионтов), таких как
I. accuminatus Neumann, 1901 (рис. 4a, 4b), обитателей пещер - паразитов рукокры-
лых (например, I. ariadnae) (рис. 4с, 4d), немобионов (Leonovich, 2019), таких как
собачий клещ I. canisugae Johnson, 1849 (рис. 4e, 4f), обитателей гнезд ласточек-
береговушек, нидобионтов I. lividus (Koch, 1844) (рис. 4g, 4h), таежного клеща
I. persulcatus Schultze, 1930 (рис. 4i, 4j), и узкоспециализированного паразита ежей,
нидобионта I. hexagonus Leach, 1815 (рис. 4k, 4l).
Таким образом, строение гипостома не позволяет клещам-иксодинам уверенно
закрепляться в покровах хозяина, косвенно подтверждая афагию самцов. Хотя при-
крепление и возможно, оно весьма ненадежно в сравнении с прикреплением питаю-
щихся самцов Prostriata.
Рисунок 2. Строение гнатосомы (вентральная сторона) у самцов (а) и самок (с) и гипостом
самцов (b), самок (d), нимф (e) и личинок (f) иксодовых клещей группы Metastriata:
1 - Dermacentor marginatus (Sulzer, 1776) (по: Hornok, 2020a), 2 - Rhipicephalus rossicus
Yakimov et Kohl-Yakimov, 1911 (по: Mihalca et al., 2020a); 3 - Hyalomma dromedarii
(Koch, 1844) (по: Mihalka et al., 2020b).
Figure 2. Structure of gnathosoma (in ventral view) in males (a) and females (c) and hypostom
of males (b), females (d), nymphs (e), and larvae (f) in ixodid ticks of the Metastriata group:
1 - Dermacentor marginatus (Sulzer, 1776) (from Hornok, 2020a), 2 - Rhipicephalus rossicus
Yakimov and Kohl-Yakimov, 1911 (from Mihalca et al., 2020a); 3 - Hyalomma dromedarii
(Koch, 1844) (from Mihalka et al., 2020b).
270
Рисунок 3. Строение гнатосомы (вентральная сторона) у самцов (а) и самок (с) и гипостом
самцов (b), самок (d), нимф (e) и личинок (f) иксодовых клещей группы Prostriata:
1 - Ixodes ricinus (Linneaus, 1758) (по: Otranto et al., 2020), 2 - Ixodes ariadnae Hornok, 2014
(по: Hornok, 2020b).
Figure 3. (1-2). Structure of gnathosoma (in ventral view) in males (a) and females (c)
and hypostom of males (b), females (d), nymphs (e), and larvae (f) in ixodid ticks of the Prostriata
group: 1 - Ixodes ricinus (Linneaus, 1758) (from Otranto et al., 2020), 2 - Ixodes ariadnae
Hornok, 2014 (from Hornok, 2020b).
Рисунок 4. Различия в строении гипостома самцов и самок иксодовых клещей рода Ixodes:
a, b - I. accuminatus Neumann, 1901; с, d - I. ariadnae; e, f - I. canisuga (Johnson, 1849)
(по: Sandor, 2020a); g, h - Ixodes lividus (Koch, 1844) (по: Sandor, 2020c); i, j - I. persulcatus
(Schulze, 1930) (по: Pfäffle et al., 2020b); k, l - I. hexagonus Leach, 1815, по: Sandor, 2020b).
Figure 4. Differences in the structure of the hypostome in males and females of ixodid ticks
of the genus Ixodes: a, b - I. accuminatus Neumann, 1901; с, d - I. ariadnae; e, f - I. canisuga
(Johnson, 1849) (according to Sandor, 2020a); g, h - Ixodes lividus (Koch, 1844) (according
to Sandor, 2020c); i, j - I. persulcatus (Schulze, 1930) (from Pfäffle et al., 2020b);
k, l - I. hexagonus Leach, 1815 (according to Sandor, 2020b).
271
Слюнные железы
Слюнные железы иксодовых клещей играют весьма важную роль в питании пара-
зитов кровью хозяев. Слюнные железы обеспечивают водно-солевой обмен в процессе
длительного питания (Балашов, 1998), а также играют существенную роль в закре-
плении паразита на хозяине, участвуя в формировании так называемого цементного
футляра, обеспечивающего длительное прикрепление паразита к коже хозяина.
У самок, нимф и личинок всех иксодовых клещей слюнные железы образованы
тремя типами альвеол, у самцов Metastriata - четырьмя, а у непитающихся сам-
цов иксодин - двумя типами альвеол. Например, в этих железах личинок, нимф и
самок таежного клеща обнаружено 3 типа многоклеточных секреторных альвеол,
а у самцов - только 2 типа (Таежный клещ, 1985).
У всех иксодовых клещей обнаружены альвеолы I типа (пирамидальные, или не
образующие гранул, альвеолы). Они встречаются только в передней части каждой
слюнной железы и открываются непосредственно в главные выводные протоки или
в их первичные ответвления (Балашов, 1998).
У самок Нyalomma asiaticum Scultze et Schlottke, 1929 в одной железе насчиты-
вают 200-300 подобных альвеол и у самцов - около 150, а у I. persulcatus - соот-
ветственно 100-120 и 20-30. Предполагают, что в первые дни питания эти альвео-
лы выделяют липоидный секрет. Однако главная функция альвеол I типа связана
с секрецией гипертоничной гигрофильной слюны для восполнения водного баланса
в организме голодного клеща (Knulle, Rudolph, 1982).
У таежного клеща в альвеолах II обнаружено только 2 типа гранулосекретирую-
щих клеток, и их гомологизация с соответствующими типами клеток амблиомин
затруднительна (Балашов, 1998). У самцов I. persulcatus секреторные клетки альвеол
заполнены секреторными гранулами вскоре после линьки, и для их функционирова-
ния нет необходимости в предварительном питании (Таежный клещ, 1985).
Первоначальное закрепление в коже хозяина обеспечивается зубцами гипостома
и раздвинутыми в стороны пальцами хелицер. Дальнейшее удерживание клеща на
коже в процессе многодневного питания достигается приклеиванием его ротовых ча-
стей к коже секретом слюнных желез. Секрет обволакивает ротовые органы и стенки
ранки, застывает и образует цементный футляр. У клещей группы Metastriata этот
футляр вокруг ротовых частей развивается либо на всю глубину проникновения ро-
товых частей в кожу (так называемые длиннохоботковые виды, представители родов
Abmblyomma и Hyalomma), либо проникает только верхних слоев дермы, но образует
поверхностный цементный конус, окружающий ротовые органы над поверхностью
кожи (так называемые короткохоботковые виды, представители родов Haemaphysalis,
Dermacentor, Rhipicephalus) (Балашов, 2009).
В отличие от Metastriata, клещи подсемейства Ixodinae не образуют цементного
футляра. Ротовые органы в данном случае находятся в непосредственном контакте
с тканями хозяина, они окружены фибриновым конусом и коллагеновой капсулой,
образуемыми тканями хозяина (Балашов, 2009),
272
Отсутствие цементного футляра, а также формирование фибринового конуса
и коллагеновой капсулы прослежены при паразитировании самок, личинок и нимф
представителей рода Ixodes на млекопитающих, птицах и рептилиях (Григорьева,
2001а, 2001б, 2002).
Автору не удалось найти в литературе данных об изменении кожи при питании
самцов рода Ixodes. Вероятно, этот процесс попросту не был исследован по той при-
чине, что предварительная фиксация для изучения в оптическом или электронном
микроскопе изменений, связанных с процессом прикрепления, требует удаления
кусочка покровов хозяина с прикрепившимся клещом. Если клещ при этом не за-
креплен, то такая фиксация попросту невозможна. В преобладающем же большин-
стве случаев самцы, видимо, просто не прикрепляются к лабораторным животным.
Таким образом, афагия самцов эволюционно закреплена не только строением ро-
тового аппарата (гипостома), но и строением слюнных желез, секрет которых вы-
зывает образование коллагеновой капсулы и фибринового конуса. Напомним, что,
например, в слюнных железах личинок, нимф и самок таежного клеща обнаружено
3 типа многоклеточных секреторных альвеол, а у самцов — только 2 типа (Таежный
клещ, 1985).
Ротовые органы клещей при копуляции
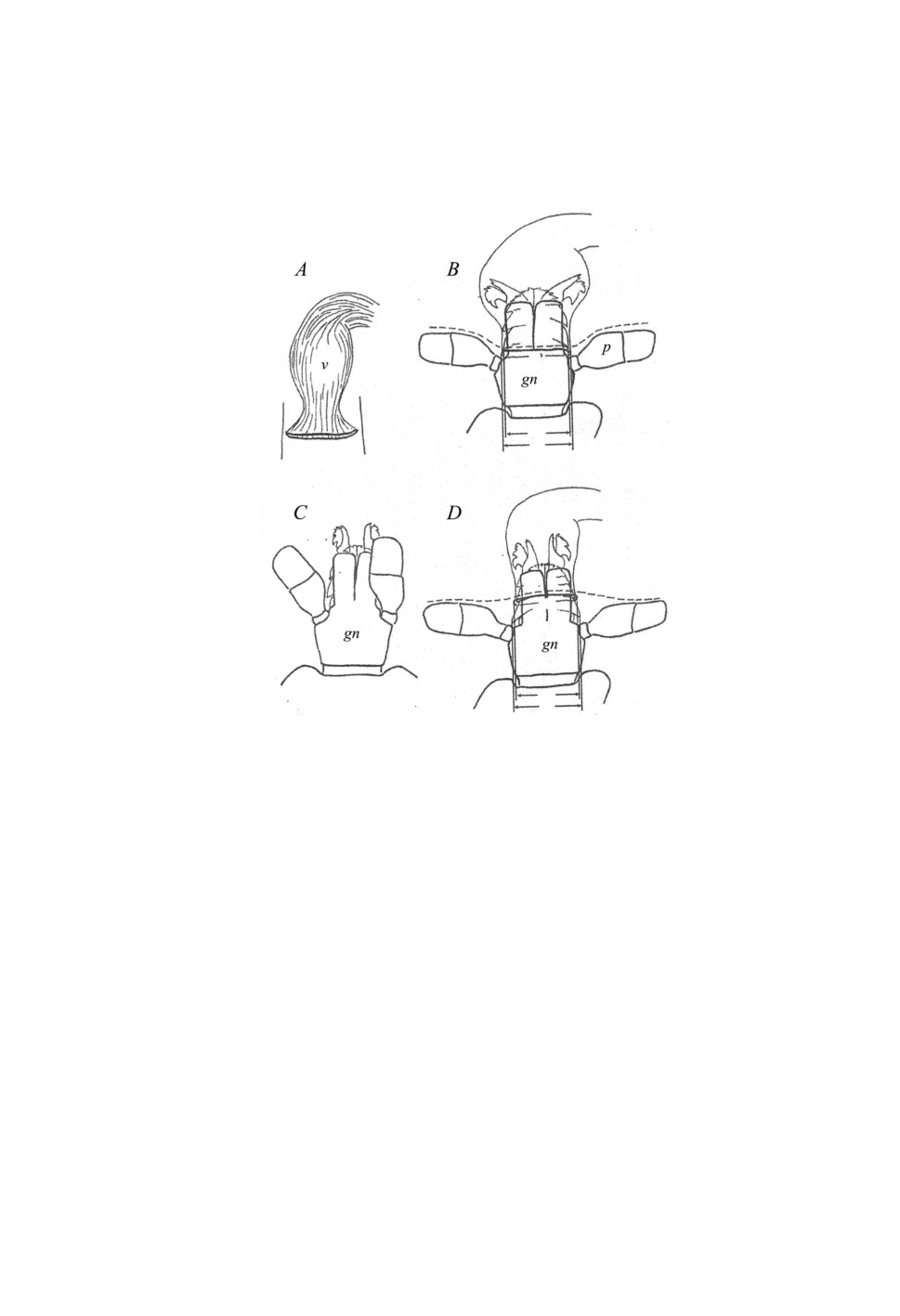
Процесс копуляции у всех иксодовых клещей очень сходен и подробно описан
в монографии Балашова (1998). Поведение самцов складывается из нескольких по-
следовательных этапов. После установления контакта с самкой самец заползает на
ее дорзальную сторону, затем переползает на вентральную поверхность всегда через
задний отдел идиосомы. Самец закрепляется на самке с помощью II и III пары ног
так, что вентральные поверхности особей обращены друг к другу. Затем самец с по-
мощью сенсорного аппарата ротовых органов (сенсилл пальп и хелицер) исследует
покровы вокруг генитального отверстия самки и через него вводит гипостом и хели-
церы во влагалище (рис. 5). Хоботок клеща при этом располагается перпендикулярно
спинному щитку, а пальпы остаются снаружи (Балашов, 1998; Bouman et al., 1999).
Расширяющие движения хоботка заканчиваются выделением сперматофора, и с по-
мощью пальцев хелицер сперматофор вводится внутрь полового отверстия самки, его
шейка надрезается при помощи хелицер, и содержимое сперматофора изливается во
влагалище. Исследование самцом покровов вокруг полового отверстия самки - очень
важный этап копуляции, который, по всей видимости, определяется генитальными
контактными феромонами. Эти феромоны были выделены из экстрактов кутикулы
самок. Они представляют собой сложную смесь холестериловых эфиров, холестери-
лолеата, стеролов, гидроксиэкдизона и жирных кислот (Sonenshine, 2006; Леонович,
2005). Рецепторы феромона копуляции обнаружены на хелицерах, это безволоско-
вые контактные хеморецепторные сенсиллы хелицер (Philips, Sonenshine, 1993); часть
таких контактных хеморецепторных сенсилл располагается на пальпах (Leonovich,
Dusbabek, 1991). Скорее всего, хотя прямо это показано не было, именно генитальные
феромоны способствуют определению самцом самки своего (или близкородственного)
273
вида и служат пусковым механизмом собственно копуляции (введения хоботка
в половое отверстие).
У большинства представителей Metastriata копуляция происходит однократно. Это
объясняется тем обстоятельством, что спермато- и овогенез завершается только в про-
цессе питания. Напитанная самка, прикрепленная к покровам прокормителя, остается
неподвижной все время питания. Самец, питавшийся кровью, копулирует с самкой,
при этом его подвижность также сильно ограничена (Леонович, 1981).
В отличие от этого, самцы клещей рода Ixodes копулируют до питания и нахож-
дения хозяина, что подтверждается наличием голодных оплодотворенных самок, со-
бранных на флаг (Репкина, 1973; Леонович, 2019а, 2019б ). Многократная копуляция
клещей рода Ixodes косвенно подтверждается наличием большого числа межвидовых
гибридов (Kovalev et al., 2016 ). Отметим, что наличие таких гибридов (личинок
и нимф) обнаруживается только на неполовозрелых фазах развития или в первом
поколении взрослых клещей (перелинявших из гибридных нимф). Второе поколение
таких гибридов, как было показано в специальных исследованиях, бесплодно (Бала-
шов и др., 1998).
Многократная копуляция клещей рода Ixodes часто приводит к успешным резуль-
татам. Клещи I. uriae White, 1852 паразитируют на колониальных морских птицах
в циркумполярных районах обоих полушарий. Как показали специальные исследова-
ния, они способны к неоднократным спариваниям. Изучение потомства самок, собран-
ных в природе, с использованием микросателлитных маркеров (McCoy, Tirard, 2002)
показало, что неоднократные спаривания приводят к генетическому разнообразию
потомства, т.е. в потомстве одной самки обнаруживаются генетически разнородные
личинки. Таким образом, генетическое многообразие потомства может быть обеспе-
чено одной самкой, которую оплодотворили несколько самцов.
Следует обратить внимание на строение гипостома самцов. Мелкие и гладкие на
вершинах зубцы позволяют достаточно легко извлекать гипостом из вульвы самки
после копуляции (рис. 5). По мнению автора, это обстоятельство служит одним из
важнейших факторов эволюционного изменения ротовых органов, основной функцией
которых является копуляция, а питание становится необязательным, так как сперма-
тогенез уже завершен после последней линьки нимфы на взрослого самца.
Подобная картина наблюдается и в других группах клещей. Так , у некоторых
мезостигматических клещей, в частности у паразитов (Varroa jakobsoni Oudemans,
1904, Euvarroa sinhai Delfinado & Baker, 1974) пчел, наблюдается явление, когда хе-
лицеры самцов настолько специализированы к переносу сперматофоров в половые
пути самок, что это не позволяет самцам питаться, и в таких группах наблюдается
афагия самцов (Emmanouel et al., 1983). Прокалывание хитинового эксоскелета пчелы
требует жесткости хелицер, а перенос сперматофора - нет, и проблема эта решилась
путем развития афагии самцов.
Отметим, что у клещей рода Ixodes может наблюдаться межвидовая репродуктив-
ная изоляция, обеспечиваемая механически , в частности у симпатрических видов
Ixodes persulcatus и I. pavlovskyi, за счет несовместимости размеров гипостома самца
274
Ixodes pavlovskyi и самки I. persulcatus (Филиппова, 2001) (рис. 5). У клещей груп-
пы Mesostigmata межвидовая репродуктивная изоляция обеспечивается химическими
стимулами (Sonenshine, 2006).
Рисунок 5. Ротовые органы иксодовых клещей при копуляции: A - влагалище самки Ixodes
persulcatus, B - проникновение гнатосомы I. persulcatus во влагалище самки того же вида,
С - гнатосома клеща Ixodes pavlovskiy, D - несовместимость размеров половых органов двух
видов (из Филиппова, 2001, подписи сокращены).
Figure 5. Mouthparts of ixodid ticks during copulation: A - vagina of Ixodes persulcatus;
B - penetration of male gnatosoma of the same species into this vagina; С - gnatosoma
of the tick Ixodes pavlovslyi; D - incompatibility of the size of sex organs in these two species
(from Filippova, 2001, with other designations).
Происхождение иксодовых клещей
(палеонтологические и молекулярные данные)
Для решения вопроса о первичности или вторичности афагии самцов у клещей-
иксодин необходимо рассмотреть существующие представления о происхождении
основных групп клещей. К сожалению, прямые палеонтологические материалы не
позволяют проследить ранние стадии формирования иксодид, ввиду отсутствия дан-
ных. Сохранившиеся в янтаре клещи принадлежат практически к существующим
группам (ссылки см. Балашов, 1998; Nava et al., 2009).
Представления об эволюции клещей основаны на сравнительно-морфологических
данных, а в последнее время - на результатах молекулярных исследований.
275
Согласно представлениям Хугстрала (Hoogstraal, 1978), основную роль в эволюции
иксодовых клещей играли паразито-хозяинные отношения, причем первыми хозяевами
иксодид были позднепалеозойские рептилии (300 mya ). Становление группы проис-
ходило в раннем мезозое (200 mya) в условиях влажного теплого климата. Дальней-
шее становление группы было связано с переходом на млекопитающих и датировано
меловым периодом. При этом наиболее примитивными группами Хугстрал считал
представителей родов Ixodes и Haemaphysalis.
В отечественной литературе в последней трети прошлого века господствовали
представления о связи происхождения иксодовых клещей с мезозойскими млекопи-
тающими (Филиппова, 1977; Балашов, 1989).
Полученные позднее молекулярные данные, однако, относят происхождение
иксодовых клещей к более раннему периоду и связывают происхождение иксодид
с позднепалеозойскими амфибиями. Так, на основании исследований митохондриаль-
ной ДНК у представителей 25 таксонов хелицерат было показано, что расхождение
эволюционных стволов пауков, скорпионов, клещей (mites, т.е. клещей всех таксо-
нов, кроме иксодоидных) и клещей иксодоидных (ticks) произошло в конце Палеозоя,
т. е. значительно ранее, чем считалось согласно палеонтологическим находкам (Shao,
Barker, 2007; Jeyaprakash, Hoy, 2009). Оценка времени расхождения (divergence time)
для иксодовых клещей привела авторов к предположению, что первыми хозяевами
иксодовых клещей более вероятно были амфибии, а не рептилии и млекопитающие
(Jeyaprakash, Hoy, 2009),
Представления о древности иксодин были получены в ходе молекулярно-
генетических исследований, выполненных другими авторами. Так, полное исследова-
ние митохондриального генома у клещей групп Prostriata и Metastriata (Black, Piesman,
1994; Black, Roehrdanz, 1999) показало, что у представителя рода Ixodes (I. hexagonus)
последовательность генов более древняя, соответствует таковой мечехвоста Limulus
polyphemus Linnaeus, 1758. При этом у Metastriata (Rhipicephalus sanguineus) последо-
вательность генов изменена, и эти изменения характерны для всех Metastriata. Таким
образом, по мнению авторов, клещи рода Ixodes являются более древней группой
в сравнении с Metastriata.
В плане нашего анализа происхождения афагии самцов иксодин, работы, связыва-
ющие происхождение клещей с определенными группами членистоногих, в частности,
с Holothyrida (Klompen, 2010), равно как и представления о зоогеографических аспек-
тах становления группы (Beati, Klompen, 2019, и мн. др.) не представляют интереса,
так как никаких данных об особенностях паразитирования или полового поведения,
тем более о наличии или отсутствия афагии они не содержат.
На основании косвенных данных, касающихся строения ротового аппарата, слюн-
ных желез, пищеварительной системы, поведения при нападении на хозяина, особен-
ностей копуляции рецентных видов мы можем привести аргументы в пользу того, как
возникла афагия самцов у представителей рода Ixodes и проанализировать первичный
или вторичный характер этого феномена.
276
В пользу вторичности этого явления говорят такие факты, как развитые пищевари-
тельные органы самцов иксодин и сохранение способности к питанию, т. е. сохране-
ние способности присасываться к хозяину и поглощать небольшие порции крови. Для
непитающихся самцов эти адаптации выглядят совершенно бесполезными, и могут
рассматриваться как атавизмы. Таким образом, самцы и самки предков современных
Ixodinae питались, а затем самцы утратили эту способность в ходе эволюции.
За первичность афагии самцов можно привести такой аргумент, как завершение
сперматогенеза до начала питания (на нимфальной фазе развития), при котором пи-
тание не является необходимым, так как никоим образом не влияет на способность
к оплодотворению (что наблюдается у всех самцов Prostriata).
По мнению автора (хочу подчеркнуть, что это только гипотеза, нуждающаяся
в подтверждении дополнительными исследованиями), становление афагии самцов
было непосредственно связано с первичным паразитированием предков иксодин имен-
но на амфибиях. «Первые» самцы и самки иксодовых клещей обладали одинаковым
ротовым аппаратом, пригодным как для прокалывания относительно тонких кожных
покровов позднепалеозойских наземных амфибий, так и для копуляции. Скорее все-
го, и самцы и самки питались просто для поддержания жизнедеятельности и могли
спариваться вне зависимости от питания. Питание при этом было достаточно кратков-
ременным, но само питание кровью открывало широкие эволюционные перспективы
(в частности, давало самке возможность произвести большее число яиц). В даль-
нейшем эволюционные пути иксодид разошлись. Часть из них приспособилась
к прокалыванию все более и более толстых и ороговевавших кожных покровов, что
потребовало развития ротового аппарата (хелицер и гипостома) и, соответственно,
удлинению времени питания, а это, в свою очередь, вызвало необходимость развития
прикрепительных механизмов - в первую очередь, зубцов гипостома, а затем и транс-
формирования слюнных желез. Таким образом, первые этапы становления группы
Metastriata были связаны с переходом к паразитированию на рептилиях (Hoogstraal,
1978), а потом - на покрытых перьями динозаврах, о чем свидетельствуют палеон-
тологические находки (Peñalver et al., 2017). В дальнейшем эти преадаптации позво-
лили клещам данной группы перейти и к паразитированию на крупных подвижных
млекопитающих и птицах. У этих клещей развились особые феромонные механизмы,
которые заставляют самцов нападать только на то животное, на котором уже на-
ходятся прикрепившиеся питающиеся самки (Леонович, 2005), обеспечивая, таким
образом, гарантированное оплодотворение. Способность образовывать прикрепитель-
ные структуры позволили клещам этой группы совершить многочисленные переходы
к вторичному паразитированию на таких толстокожих животных, как черепахи (пред-
ставители рода Hyalomma).
Клещи группы Prostriata, видимо, пошли иным путем. Сохранение сперматогенеза
и овогенеза, завершенного на нимфальной стадии, дает определенные (хотя и неяв-
ные) преимущества. Самцы Metastriata, не нашедшие хозяина, обрекают свои гены
на исключение из эволюционного процесса, в то время как самцы Ixodes способны
277
к многократному оплодотворению самок своего и даже других видов, создавая про-
стор генетическому разнообразию (McCoy, Tirard, 2002; Kovalev et al., 2016 ). Таким
образом, клещи группы Prostriata достигли не менее значимого эволюционного успеха,
также перейдя к паразитированию на крупных подвижных млекопитающих за счет
изменений ротового аппарата (развитие зубцов гипостома и особых клеток слюнных
желез, обеспечивающих длительное прикрепление к хозяину) только у самок, сохра-
нив способность самок и самцов к оплодотворению без питания.
Таким образом, можно предположить, что афагия самцов у клещей группы Pros-
triata (род Ixodes) развилась у представителей этой группы вторично, но только
в пределах этой группы, и представляет собой эволюционную адаптацию, обеспечи-
вающую эволюционный успех группы.
БЛАГОДАРНОСТИ
Работа выполнена в рамках Государственной темы «Разработка современных основ
систематики и филогенетики паразитических и кровососущих членистоногих» (Гос.
регистрационный номер: АААА-А19-119020790133-6).
СПИСОК ЛИТЕРАТУРЫ
Балашов Ю.С. 1989. Коэволюция иксодовых клещей и наземных позвоночных. Паразитология 23 (6):
457-468. [Balashov Yu.S. 1989. Coevolution of ixodid ticks and terrestrial vertebrates. Parazitologiya 23
(6): 457-468. (In Russian)].
Балашов Ю.С. 1998. Иксодовые клещи - паразиты и переносчики инфекций. СПб., Наука, 287 с. [Balashov
Yu.S. 1998. Ixodid ticks - parasites and vectors of infections. St. Petersburg, Nauka, 287 pp. (In Russian)].
Балашов Ю.С. 2009. Паразитизм клещей и насекомых на наземных позвоночных. СПб. Наука. 358 с.
[Balashov Yu.S. 2007. Parasitism of acarines and insects on terrestrial vertebrates. SPb., Nauka, 358 pp.
(In Russian)].
Балашов Ю.С, Григорьева Л.A, Оливер Дж., 1998. Репродуктивная изоляция и межвидовая гибридизация
иксодовых клещей группы Ixodes ricinus - I. persulcatus (Acarina, Ixodidae). Энтомологическое обо-
зрение 77 (3): 713-721. [Balashov Yu.S., Grigoryeva L.A., Oliver J. 1998. Reproductive isolation and
interspecific hybridization of ixodid ticks of the group группы Ixodes ricinus - I. persulcatus (Acarina,
Ixodidae). Entomologicheskoe obozrenie 77 (3): 713-721. (In Russian)].
Григорьева Л.А. 2001a. Гистопатологические изменения кожи мелких млекопитающих в местах питания
Ixodes trianguliceps, I. persulcatus и I. ricinus (Ixodidae). Паразитология 35 (3): 177-183. [Grigoryeva
L.A. 2001a. Histopathological changes of micromammalian skin in feeding places of the ticks Ixodes
trianguliceps, I. persulcatus and I. ricinus (Ixodidae). Parazitologiya 35 (3): 177-183. (In Russian)].
Григорьева Л.А. 2001б. Гистопатологические изменения кожи птиц в местах питания клещей рода Ixo-
des (Acari: Ixodidae). Паразитология 35 (6): 490-495. [Grigoryeva L.A. 2001b. Histopathologic changes
of bird skin in feeding places of ticks of the genus Ixodes (Acari: Ixodidae). Parazitologiya 35 (6): 490-495.
(In Russian)].
Григорьева Л.А., 2002. Гистопатологические изменения кожи ящериц (Reptilia: Lacertidae) в местах пи-
тания клещей рода Ixodes (Acari: Ixodidae). Паразитология 36 (5): 375-378. [Grigoryeva L.A. 2002.
Histopathologic changes in a skin of lizard (Reptilia: Lacertidae) in feeding places of ticks of the genus
Ixodes (Acari: Ixodidae). Parazitologiya 36 (5): 375-378. (In Russian)].
Леонович С.А. 1981. О наличии полового феромона у иксодового клеща Hyalomma asiaticum (Ixodidae).
Паразитология 15 (2): 150-156. [Leonovich S.A. 1981. On the presence of a sexual pheromone in the
ixodid tick Hyalomma asiaticum (Ixodidae). Parazitologiya 15 (2): 150-156. (In Russian)].
278
Леонович С.А. 2005. Сенсорные системы паразитических клещей. СПб., Наука, 232 с. [Leonovich S.A. 2005.
Sensory systems of parasitic ticks and mites. Saint-Petersburg, Nauka, 232 pp. (In Russian)].
Леонович С.А., 2019а. Сравнительный анализ особенностей полового поведения иксодовых клещей
(Ixodidae). Паразитология 53 (4): 294-306. [Leonovich S.A. 2019a. Comparative analysis of sexual
behavior in ixodid ticks (Ixodidae). Parazitologiya 53 (4): 294-306. (In Russian)].
Леонович С.А. 2019b. О типах паразитизма иксодовых клещей (Ixodidae). Паразитология 53 (5): 416-420.
[Leonovich S.A. 2019b. Types of parasitism of hard ticks (Ixodidae). Parazitologiya 53 (5): 416-420. (in
Померанцев Б.И. 1950. Иксодовые клещи (Ixodidae). Фауна СССР. Паукообразные. Т. 4. Вып. 2. М.-Л.:
Изд-во АН СССР. [Pomerantsev B.I. 1950. Ixodovye kleshchi (Ixodidae). Fauna SSSR. Paukoobraznye,
4 (2), Moscow. Izd AN SSSR (In Russian)].
Репкина Л.В. 1973. Встречаемость оплодотворенных голодных самок Ixodes persulcatus P. Sch. в природе.
Медицинская паразитология и паразитарные болезни 2: 237-239. [Repkina L.V. 1973. Vstrechaemost’
oplodotvorennykh golodnych samok Ixodes persulcatus P. Sch. v prirode. Meditsinskaya parazitologoya i
parazitarnye bolezni 2: 237-239. (In Russian)].
Таежный клещ Ixodes persulcatus Schulze (Acarina, Ixodidae): Морфология, систематика, экология, меди-
цинское значение 1985 . Л.: Наука, 420 с. [Taiga tick Ixodes persulcatus Schulze (Acarina, Ixodidae):
Morphology, taxonomy, medical importance. Leningrad, Nauka, 420 pp. (In Russian)].
Филиппова Н.А. 2001. Многоступенчатый механизм репродуктивной изоляции близкородственных видов
Ixodes persulcatus и I. pavlovskyi (Ixodidae) в области симпатрии. Паразитология 35 (5): 361-375.
[Filippova N.A. 2001. Multistage mechanism of reproductive isolation of closely related species Ixodes
persulcatus and I. pavlovskyi (Ixodidae) in sympatric area. Parazitologiya 35 (5): 361-375. (In Russian)].
Филиппова Н.А. 1977. Иксодовые клещи подсем. Ixodinae Фауна СССР. Новая серия, № 114. Паукообраз-
ные. Т. 4. Вып. 4. Ленинград, Наука. [Filippova N.A. 1977. Ixodovye kleshchi podesemeistva Ixodinae.
Fauna SSSR, Novaya seriya, 114, Paukoobraznye, Vol. 3, no. 4, Leningrad. Nauka. (In Russian)]
Arthur D.R. 1962. Ticks and diseases. Oxford, Pergamon Press, 316 pp.
Beati L., Klompen H. 2019. Phylogeography of ticks (Acari: Ixodida). Annual review of Entomology. DOI
10.1146/annurev-ento-020117-043027
Black W.C., Piesman J. 1994. Phylogeny of hard and soft tick taxa (Acari: Ixodida) based on mitochondri-
al 16S rDNA sequences. Proceedings of the National Academy of Sciences of USA 91: 10034-10038.
Black W.C., Roehrdanz R.L. 1999. Mitochondrial gene order is not conserved in arthropods: Prostriate and Meta-
striate tick mitochondrial genomes. Molecular Biology and Evolution 15 (12): 1772-1785. DOI:10.1093/
oxfordjournals.molbev.a025903
Bouman E.A. P., Zemek R., Dusbábek F., Socha R. 1999. Sexual behavior of the sheep tick, Ixodes ricinus (L.)
(Acari, Ixodidae). Proceedings of the 3rd International Conference on Urban Pests (Prague, 1999) (Hronov,
Czech Republic, 1999): 255-260.
Emmanouel N., Pelekassis, C., Santas, L. 1983. Harmful mesostigmatic mites ectoparasitic to honey bees. Ento-
Hermann C., Gern L. 2015. Search for blood or water is influenced by Borrelia burgdorferi in Ixodes ricinus.
Hoogstraal H. 1978. Biology of ticks. In: Tick borne diseases and their vectors. Ed: J.K.H Wilde. Proc. Internat.
Conf., Edimburgh, September-October, University of Edinburgh, Centre for tropical veterinary medicine,
Edinburgh. 3-14.
Hornok S. 2020a. Dermacentor marginatus (Sulzer, 1776) In Ticks of Europe and North Africa. A guide to species
identification A. Estrada-Peña, A. Mihalca, T.N. Petney (Editors). Springer, 281-286. doi.org/10.1007/978-
3-319-63760-0
279
Hornok S. 2020b. Ixodes ariadnae Hornok, 2014, In Ticks of Europe and North Africa. A Guide to
Species Identification A. Estrada-Peña, A. Mihalca, T.N. Petney (Editors). Springer, 109-113.
Jeyaprakash A., Hoy M.J. 2009. First divergence time estimate of spiders, scorpions, mites and ticks (subphy-
lum: Chelicerata) inferred from mitochondrial phylogeny. Experimental and Applied Acarology 17: 1-18.
Klompen H., 2010. Holothyrids and ticks: new insights from larval morphology and DNA sequencing, with the
description of a new species of Diplothyrus (Parasitiformes: Neothyridae). Acarologia 50 (2): 269-285.
DOI: 10.1051/acarologia/20101970
Klompen J.S.H., Black W.C., Keirans J.E., Oliver J.H. 1996 . Evolution of ticks. Annual Review of Entomology
Knülle W., Rudolf D. 1982. Chapter 2. Humidity relationships and water balance of ticks. Physiology of ticks,
Kovalev S.Y. 2016. Natural hybridization between Ixodes ricinus and Ixodes persulcatus ticks evidenced by
molecular genetics methods. Ticks and tick-borne diseases 7 (1). DOI:10.1016/j.ttbdis.2015.09.005
Leonovich S.A., Dusbabek F. 1991.Pheromone receptive subsystem in ticks: correlation between stumulus con-
ducting structures and evolution of behavior. Modern Acarology (Academia (Prague) and SPB Publ. (The
Hague) 1: 53-58.
McCoy K.D., Tirard C. 2002. Reproductive strategies of the seabird tick Ixodes uriae (Acari: Ixodidae). Journal
of Parasitology 88 (4): 813-816. doi: 10.1645/0022-3395(2002)088[0813:RSOTST]2.0.CO; 2
Mihalca A.D., Dumitrache M.O., D’Amico G. 2020a. Rhipicephalus rossicus Yakimov and Kol-Yakimova, 1911.
In Ticks of Europe and North Africa. A Guide to Species Identification A. Estrada-Peña, A. Mihalca, T.N.
Petney (Editors), Springer, 311-316. doi.org/10.1007/978-3-319-63760-0
Mihalca A.D., Pfäffle M.P., Petney T.N. 2020b. Hyalomma dromedarii Koch, 1844. In Ticks of Europe and North
Africa. A Guide to Species Identification A. Estrada-Peña, A. Mihalca, T.N. Petney (Editors), Springer,
365-370. doi.org/10.1007/978-3-319-63760-0
Mysterud A., Hatlegjerde I.L., Sørensen O.J. 2014. Attachment site selection of life stages of Ixodes rici-
nus ticks on a main large host in Europe, the red deer (Cervus elaphus). Parasites and Vectors 7, 510.
Nava S., Guglielmone A.A., Mangold A.J. 2009. An overview of systematics and evolution of ticks. Frontiers in
Otranto D., Dantas-Torres F., Santos-Silva M.M. 2020. Ixodes ricinus (Linnaeus, 1758) In Ticks of Europe
and North Africa. A Guide to Species Identification. A. Estrada-Peña, A. Mihalca, T.N. Petney (Editors),
Peñalver E., Arillo A., Delclòs X., Peris D., Anderson S.R., Nascimbene P.C., Pérez-de la Fuente R. 2017. Ticks
parasitized feathered dinosaurs as revealed by Cretaceous amber assemblages. Nature Communications 8,
Pfäffle M.P., Petney T.N., Santos-Silva M.M. 2020a. Ixodes acuminatus Neumann, 1901 In Ticks of Europe
and North Africa. A Guide to Species Identification. A. Estrada-Peña, A. Mihalca, T.N. Petney (Editors),
Pfäffle M.P., Petney T.N., Jaenson T.G.T. 2020b. Ixodes persulcatus Schulze, 1930. In Ticks of Europe and North
Africa. A Guide to Species Identification A. Estrada-Peña, A. Mihalca, T.N. Petney (Editors), Springer,
197-204. doi.org/10.1007/978-3-319-63760-0
Philips J.S., Sonenshine D.E. 1993. Role of the male claw sensilla in the perception of female mounting sex
pheromone in Dermacentor variabilis, Dermacentor andersoni and Amblyomma americanum. Experimental
and Applied Acarology 17: 631-653.
Sándor A.D. 2020a. Ixodes canisuga Johnston, 1849. In Ticks of Europe and North Africa. A Guide to
Species Identification A. Estrada-Peña, A. Mihalca, T.N. Petney (Editors), Springer, 137-142.
280
Sándor A.D. 2020b. Ixodes hexagonus Leach, 1815 In Ticks of Europe and North Africa. A Guide to
Species Identification A. Estrada-Peña, A. Mihalca, T.N. Petney (Editors), Springer, 147-152.
Sándor A.D. 2020c. Ixodes lividus Koch, 1844. In Ticks of Europe and North Africa. A Guide to Spe-
cies Identification A. Estrada-Peña, A. Mihalca, T.N. Petney (Editors), Springer, 157-162.
Shao R., Barker S.C. 2007. Mitochondrial genomes of parasitic arthropods: implications for studies of population
genetics and evolution. Parasitology 134, 153-167.
Sonenshine D.E. 2006. Tick pheromones and their use in tick control. Annual Review of Entomology 51: 557-80.
doi: 10.1146/annurev.ento.51.110104.151150
MALE APHAGIA IN IXODID TICKS OF THE SUBFAMILY IXODINAE
S. A. Leonovich
Keywords: ixodid ticks, Ixodinae, aphagia, mouthparts, copulation
SUMMARY
The analysis of available data on the structure of mouthparts, salivary glands, and behavior in
two main groups of hard ticks (Prostriata and Metastriata), and also of molecular-genetic data revis-
ing the origin of hard ticks from new point of view, allowed the author to propose a hypothesis of
the secondary character of male aphagia in representatives of the subfamily Ixodinae (genus Ixodes).
Positive aspects of this phenomenon that had stipulated the evolutionary success of this subfamily,
comparable with that in other representatives of othe hard tick genera (group Metastriata).
281